Contents
Sickness-Associated Anorexia: Mother Nature’s Idea of Immunonutrition?
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4942670/
オンライン公開 2016 Jun 29.
概要
感染症に罹患すると、免疫細胞の増殖、抗体の構築、発熱反応の誘導が行われ、宿主に継続的な代謝的負担がかかる。これらのことは、重症患者における栄養支持の理論的根拠にもなっている。しかし、臨床および前臨床研究の結果から、積極的な栄養支持は必ずしも患者のためになるとは限らず、時には有害となる可能性があることが示されている。さらに、脊椎動物および無脊椎動物はともに感染時に食欲の減退を示し、このような疾病に伴う食欲不振(SAA)が進化的に保存されていることが示されている。また、食欲不振は感染時に重要な機能を果たすことが示唆された。
我々は、食欲不振がオートファジーフラックスを全身的に制御するメカニズムである可能性を示す証拠について検討した。感染時に血清アミノ酸が減少すると、免疫細胞だけでなく、非免疫細胞でもオートファジーが促進される。同様に、食後に再吸収された胆汁酸はファルネソイドX受容体に結合して肝のオートファジーを抑制することから、食欲不振はオートファジーを温存するための試みである可能性が示唆される。さらに、オートファジー反応の増強は、病原体の除去(ゼノファジー)、非補完的抗原提示細胞におけるエピトープの提示、損傷したタンパク質やオルガネラの除去において重要な役割を果たす可能性がある。これらの観察結果を総合すると、患者によっては寛容な低栄養が有効である可能性が示唆される。
1. はじめに
感染症や組織外傷は、疾病行動と総称される様々な行動変容を引き起こすことが知られている。これらの行動変化の中でも、疾病に伴う食欲不振(SAA)はパラドックスである。免疫反応の活性化には、代謝的なコストがかかる。抗体や他のシグナルペプチド(サイトカインや初期段階タンパク質など)の産生、免疫細胞集団の拡大、発熱反応の誘発はすべて、代謝基質への要求を劇的に増大させる要因となっている。しかし、免疫反応の活性化にはコストがかかるにもかかわらず、食欲の減退は感染が成立したときの最も重要な症状の一つとして現れている。
このような食欲不振は適応的な反応であることが、3つの観察から示唆されている。まず、リポ多糖(LPS)や特定のサイトカイン(例えば、Il-1βやTNF-α)のような非感染性要素は、食欲減退を誘発する[2]。食欲不振が感染に反応して放出されるのと同じ標準的な炎症メディエーターによって関与しているという事実は、食欲不振が免疫応答の一部を形成していることを示唆している。第二に、脊椎動物[3-6]から無脊椎動物[7-10]に至るまで、多くの動物が食欲不振を発現していることだ。実際、イソギンチャクのような原始的な動物でさえ、病原菌に感染すると触手を引っ込め、摂食を停止することから[11]、食欲不振は実際に進化的に古く、多くの種で保存されている可能性がある。このことは、食欲不振が進化的に古く、多くの種に保存されていることを示している。また、動物の間でこのように広く見られるということは、食欲不振が大きな適性上の利点を与えるに違いないと考えられる。最後に、食欲不振は様々な状況で一貫して観察される。アフリカ馬疫(致死性の媒介性ウマウイルス感染症)だけが、食欲不振を引き起こすことなく発熱することが知られている [12]。同様に、最近のレビューでは、病気行動の側面を弱める可能性のある多くの社会的要因(例えば、若者のための母親のケアや侵入する雄に対する警戒行動)を強調した [13]。しかし、驚くべきことに、食欲不振が減少した例は確認されていない。これらのことから、食欲不振は感染時に宿主の生存を促す専用の宿主反応であると考えられるが、食欲不振がどのようなメカニズムで生存の利点をもたらすかはまだわかっていない。
食欲不振の適応的な価値を説明するために、いくつかの説が提唱されている。感染症にかかると遊離鉄が急速に減少することから [14, 15]、慢性的な低鉄分状態が感染症から宿主を保護することで多面的な利益をもたらすと主張されている [16]。従って、食欲不振は鉄のような重要な資源を病原体に与えない可能性がある [15]。しかし、内因性貯蔵物(例えば、ヘモグロビン)の再利用は、鉄レベルを維持する主要なメカニズムであり、食事による再吸収は非常に効果的でない。実際、食事から吸収される鉄は1%未満であり、栄養状態の変化に対して鉄の状態はゆっくりとしか反応しない [17]。行動的側面と免疫学的特権を一致させることも、病気に関連した食欲不振が追求する生理学的戦略として提案されている。一般的な疲労感とともに、食欲不振は動物の採食行動への動機づけを低下させる可能性がある [12]。また、採食する動物はより大きな表面から熱を放射するため、発熱反応の有効性が制限される [12]。さらに、感染した動物は周囲への注意力が低下し [12]、目立つため [18] 捕食の危険性が高くなる可能性がある。したがって、採食活動を減らせば、捕食者への曝露を減らすことができるかもしれない。さらに、多くの病原体は経口から侵入するため、食欲不振は致命的な病原体への曝露を防ぐ可能性がある [12]。しかし、LPSを投与するとラットの摂餌量は劇的に減少するが、摂餌制限(30分/日)された場合、溜め込み行動はわずかに減少するようである [19]。実際、LPSを投与したシベリアハムスター(ハツカネズミやラットとは異なり、専ら溜め込み行動をする)は摂餌量が劇的に減少するが、溜め込み行動はほとんどそのままである [20]。そのため,エネルギー節約や捕食回避のために低食欲を示す動物が,なぜ採食を積極的に続けるのかが説明されていない.
我々は最近,感染時の食欲減退は,進化的に保存された別のプロセスであるオートファジーを系統的にアップレギュレートするための戦略である可能性を論じた [21].重症患者における栄養補給の有益性を調査した研究のあいまいな結果について簡単に概観した後、感染時の免疫細胞の栄養的状況について概観する。次に、オートファジー活性の増加が臨床転帰に影響を及ぼす可能性のある様々なメカニズムについて要約する。続いて、オートファジーの誘導剤としての食欲不振の主な限界について、栄養補給の臨床的意義に言及した議論を行う。最後に、オートファジーの役割に関する未解決の問題、およびこれらの考察に対する洞察が、より洗練された栄養支持プロトコルにどのようにつながるかを論じる。
2. 栄養支持は有益か?
重症患者における栄養支持の主な目標は、死亡率および病的状態の臨床マーカーである筋肉量の減少を回避することだ。しかし、さまざまな証拠から、栄養支持は利益をもたらさない可能性があり、実際、特定の状況では有害である可能性があることが示唆されている。敗血症性ショックのラットモデルでは、多価不飽和脂肪酸またはアルギニンによる「免疫栄養」が疾患の進行を増悪させた [22] 。同様に、栄養介入は重篤な患者において有効であることが一貫して実証されていない。実際、ある研究では、早期(集中治療室での3日目)に非経口栄養を受けた患者は、わずかではあるが有意に感染症の発生率が高いことが明らかにされ [23] 、別の研究では、許容的な低栄養(目標カロリーの60~70%)に関連して死亡率が低下することが明らかにされた [24] 。最近のCochraneメタアナリシスでは、栄養療法に関連する唯一の有益性は、非選択的再入院の減少であると報告されている [25] 。実際、専門家のコンソーシアムは、敗血症または敗血症性ショックを患っている重症患者には、完全カロリー給餌ではなく、容認性低栄養を適用すべきであると提唱している [26] 。しかしながら、栄養摂取量の減少が有益となる機序は、まだ十分に解明されていない。
同様に不可解な現象は、短期間の絶食で観察される逆説的な利益である。リステリア菌に感染する3日前までの絶食では、死亡率がわずか5%に低下した(死亡率が95%だった給餌群と比較して) [27] 。さらに、飢餓は、Listeria monocytogenesのような細菌に対するマクロファージ活性を促進し(in vivoおよびin vitro)、これはLPS投与によりさらに強化することができた[28]。M. J. MurrayとA. B. Murray [29] は、飢餓状態にあるハリネズミが口蹄疫に対して免疫があるように見えることに気付いたEdward [30] が提供した興味深い逸話も語っている。これに対応して、感染時に強制給餌を行うと、マウスの死亡率が高くなることが判明した[29]。このように、栄養支持はすべての患者に有益ではないことを示す臨床および前臨床の証拠が存在する。
3. 飢餓 計算された反応
飢餓が免疫機能を強力に抑制することは広く認められており [31]、食欲不振が有効な免疫反応の動員を阻害している可能性が示唆される。しかし、動物は栄養ストレスに対処するために様々な適応策を進化させてきた [32]。特に免疫細胞は、エネルギー密度の高い基質の供給に関して特権的な地位を占めている。実際、感染症にかかると、免疫エフェクターの増殖は、末梢の異化作用によって促進される。この点で、多くの生理学的適応が、摂食量の減少にもかかわらず、免疫系が栄養不足に陥らないことを保証している。
3.1. エネルギーに富む代謝産物とパラクリンシグナル
活性化した免疫細胞は、グルコースに強く依存している。実際、解糖の主要な誘導因子である低酸素誘導因子(HIF)は、マクロファージの成熟に必要である [33] 。逆に、酸化的代謝への転換は、抗炎症プログラムの活性化を伴う [34]。低酸素状態では通常解糖が活発に行われるが、活性化された免疫細胞は、癌細胞や増殖中の線維芽細胞など他の急速に分裂する細胞と同様に、酸化的解糖を行うことに注意しなければならない:これらの細胞は酸素濃度に関係なく解糖を介してATPを生産する。このような好気性解糖(Warburg効果)は、酸化的リン酸化よりも効率が悪く、2つの要因から説明できると考えられる [35]。第一に、解糖の効率の悪さは、解糖によって細胞がATPを生成する速度の速さによって補われることだ。第二に、解糖の代謝中間体は、急速に分裂する細胞でアップレギュレートされる生合成経路に容易にフラックスされることだ。例えば、脂肪酸の合成に必要なアセチルCoAは解糖系経路から得られる。この点、脂肪酸の合成は免疫細胞の機能にとって重要である。実際、単球の脂肪酸合成能力が損なわれると、成熟マクロファージへの分化が妨げられる[36]。脂肪酸合成の依存性は、今度はリン脂質合成の需要によって説明される。小胞体(ER)、ミトコンドリアネットワーク、リソソーム、および糸状体の発達などの細胞成分の拡張はすべて、脂質を膜構造に取り込むことを必要とする [36]。このように、活性化された免疫細胞は、細胞成分の生合成だけでなく、エネルギー産生にもグルコースを必要とするのである。したがって、解糖がエネルギー生産と生合成の両方に交差しているという事実によって、Warburg効果を説明できる可能性がある。
免疫細胞にもグルコースが十分に供給されるように、多くの重要な制御因子が存在する。炎症性サイトカインであるTNF [37] とIL-1β [38] は、インスリン抵抗性を誘発し、血糖値を上昇させる。その結果、高いグルコースレベルは、GLUT-1トランスポーターを介して免疫細胞へのグルコースの流入を促進する。GLUT-1トランスポーターは促進性トランスポーターであるため、細胞内グルコースは細胞外グルコース濃度に依存する。したがって、感染時にグルコース濃度が上昇するのは、活性化した免疫細胞において十分なグルコース含有量を確保するための適応的な戦略であると考えられる。同様に、重症感染症はしばしば高トリグリセリド血症を伴う。ラットでは、低用量のLPSでも急速に高トリグリセリド血症が引き起こされる[39]。高いトリグリセリドレベルは肝臓でのde novo合成 [39] と脂肪細胞からの放出 [40] によって維持される。同様に、LPSがTLR4に結合することによるインスリン抵抗性の発現[41]は、インスリン抵抗性状態を誘導する炎症性サイトカインの分泌をもたらす[42]。このように、感染によって、免疫細胞の代謝を促進するエネルギーに富んだ分子が循環中に遊離される。
脂肪組織もまた、免疫系と機能的に統合されているようで、特に脂肪細胞は解剖学的にリンパ組織と関連している [43-46]。例えば、レプチンはエネルギー状態を知らせることで「免疫栄養」因子として働き、その結果、代謝的予備能の範囲内で免疫への投資を最適化することができる [47]。実際、短期間の絶食でもレプチンレベルを減少させることができる [48]。この点で、細かく枝分かれしたリンパ管は表面積を増やし [44, 45] 、脂肪細胞由来のパラクライン因子と同様にエネルギーに富む分子の局所的な供給を容易にする [43-45, 49]。このような局所的なパラクラインシグナルは、絶食時に重要な役割を果たす可能性がある。局所的な脂肪沈着物を透過する細かく分岐したリンパ管は、脂肪細胞と免疫細胞の間のパラクラインシグナル因子を促進する可能性もある解剖学的適応を示す [43-45, 49]。この見解を裏付けるように、リンパ組織に関連する脂肪細胞は、通常の空腹時の合図には反応せず、代わりに免疫シグナルに対してより敏感に反応することから、これらの細胞は免疫細胞を補助することに特化していることが示唆される [43-46, 49]。同様に、骨髄脂肪(BMF)は、その機能はほとんど不明であるが、「パラクリン工場」として機能し、栄養の利用可能性が低い場合でも、局所の免疫細胞を維持する可能性がある。実際、BMFは絶食にほとんど反応せず、食欲不振の患者では逆説的に増加する [50]。食欲不振(および高齢者 [51])におけるBMFの増加は、免疫拮抗シグナルの状況に対抗する試みである可能性を推測するのは魅力的である。BMF細胞は正常な脂肪細胞とは異なり、凝集しておらず、点在しているという事実は、貯蔵機能よりもむしろパラクライン機能の可能性を示しており、この見解を支持している [52]。最後に、大網(リンパ管が張り巡らされた脂肪組織の「帆」)に転移した卵巣癌細胞は、脂肪細胞によって「燃料」を与えられ、癌細胞に直接脂質を移動させることが判明した[53]。これらの著者らは、脂肪酸のエンドポイントとしてベータ酸化を挙げているが、これらの細胞に由来する脂肪酸が細胞成分の合成に関与している可能性もある。これらのリンパ系関連脂肪細胞は、通常、活性化された免疫細胞によって提示されるシグナルキューに反応し、それが癌細胞によって利用されている可能性がある。
これらの観察から、脂肪細胞は、生合成とエネルギー生産の両方に必要なエネルギーに富んだ基質と、絶食状態でも免疫反応を持続させるためのパラクライン因子を提供することによって、重要な免疫支持の役割を担っている可能性があることが示唆される。さらに、最近の知見では、免疫系と脂肪細胞の密接な協力関係は、エネルギーに富む分子や副次的因子を供給するという単純な任務だけにとどまらない可能性があることが示されている。例えば、脂肪細胞は抗菌ペプチドを生成し [54]、食作用を示すことが知られており [55]、脂肪細胞はMHC IIを発現することができるので [56]、エピトープの発現に関与している可能性もある。このように、脂肪細胞は免疫系と機能的に統合されていることが明らかである。実際、脊椎動物に特有の組織である脂肪細胞の出現が適応免疫系の進化を可能にしたのではないかと以前から議論されている[57]。このような適応により、健康で栄養状態の良い個体であれば、感染時の絶食が免疫機能を阻害することはない。
3.2. アミノ酸プロファイルの変化によるオートファジーのアップレギュレーション
グルコースや脂質とは対照的に、ほとんどのアミノ酸(AA)の血漿レベルは、さまざまな感染症や無菌組織の損傷時に著しく低下することが長い間認識されてきた [59-64]。注目すべきは、AAレベルは動的な状態にあり、しばしばリバウンド効果を示し、感染の重症度またはそのシミュレーション、および血清AAレベルをサンプリングした時点に最も影響されることであろう。このようなAAの減少は、急速な筋肉の異化という状況下で起こり、解放されたアミノ酸の主な受け皿は、アミノ酸が糖新生に使われる肝臓と、急速な細胞分裂や同化のための免疫細胞である可能性が示唆される。分岐鎖アミノ酸(BCAA)の血清レベルが感染中にしばしば低下するという観察 [60, 65-67] と、ロイシンが筋肉の分解を抑制する能力を実証するex vivo研究 [68] とが相まって、敗血症患者のサプリメントの可能性として最初に大きな興奮を引き起こした。重症患者は、蛋白質代謝回転の増加を示すので [69] 、これらの観察は、AAの補給が重症患者にとって有益であることを示唆している。しかしながら、これらのアミノ酸または他のアミノ酸の補給を適用した研究の結果は期待外れであり、現在のところ、重症患者における最適なタンパク質供給を実証する決定的な研究は存在しない [70]。
したがって、感染時にAAプロファイルが低いと、2つの疑問が生じる。第一に、感染中のある時点で様々なAAの血漿濃度が低下するにもかかわらず、なぜAAの補給が一貫して臨床的利益を示せなかったのかが説明されなければならない。第二に、免疫細胞にエネルギー生産と生合成のための豊富な基質を供給するために、他の様々な洗練された適応が存在することを考えると、感染症のある時点で様々なAAが減少する理由は特殊である。
4. オートファジーを誘導する食欲不振
4.1. 食欲不振はオートファジーのアップレギュレーションを促進する
すべての真核細胞は、栄養不足に陥ると、オートファジーと呼ばれる古くから知られている異化プロセスを活性化する。オートファジー(ギリシャ語で「自己」を意味するautoと「食べる」を意味するphagyに由来)は、真核細胞が大きな細胞成分を基質に分解し、その後、燃料源として使用したり、重要な細胞成分の合成に利用する、進化的に保存されたプロセスである。プロテアソームがタンパク質を分解するのに対し、オートファジーはミトコンドリアなどのオルガネラや長寿命タンパク質を含む細胞質成分の大量分解に用いられる(正式にはマクロオートファジーと呼ばれるプロセス)。オートファジーは、植物[71]、酵母[72]、無脊椎動物[73]、哺乳類[74]など様々な真核生物由来の飢餓状態の細胞で急速に発現が上昇する。オートファジー過程は、栄養ストレス時の細胞の生存に重要である。オートファジー過程の欠損したトランスジェニックマウスは、正常に発育するが、出生後まもなく死亡する[75]。驚くべきことに、オートファジーの欠陥は、これらのマウスが胎盤栄養から哺乳に伴う摂食断食サイクルへの移行中に栄養恒常性を維持できなくなることを立証し、断食中に栄養を供給するオートファジーの極めて重要な役割を明確に示している。このように、進化的に保存されたオートファジーのプロセスは、絶食状態における細胞の栄養状態の調節に重要な役割を果たしており、絶食期間中は一貫して強固に発現が上昇する。
栄養ストレスがオートファジーを誘導するメカニズムについては、最近になって見直されている[76, 77]。簡単に説明すると、オートファジーはmTORによって抑制され、AMPKによってアップレギュレートされる。ATP : ADPの比率が低いと、AMPKが活性化される。次に、活性化されたAMPKは、オートファジーの主要な阻害剤であるmTORを阻害する。このように、低エネルギー状態は、オートファジーがアップレギュレートされる1つのメカニズムである。この点で、サイトカインを介したインスリン抵抗性は、細胞内に低レベルのエネルギーストレスを誘発し、オートファジーのアップレギュレーションを促す戦略であると考えられる。あるいは、細胞内のAAプールが増加すると、mTORが活性化され、それに続いてオートファジーの抑制が生じる。例えば、ロイシンなどのBCAAを補給すると、タンパク質不足の食事によって誘発される筋肉の消耗から保護される [78]。注目すべきは、これらの著者らは、ロイシンがAA飢餓時に筋肉量を保護するメカニズムとして、合成よりもむしろタンパク質分解の減少に関与していることだ。この研究は、AAなどの栄養素がオートファジーを強力に阻害する能力を持つことを再度強調するものである。さらに、AAが枯渇すると、未変化のtRNAが蓄積され、これもまたオートファジーを誘発する[79]。最後に、栄養不足の状態では、細胞はアミノ酸をエネルギー源として利用し、アンモニアのような代謝廃棄物が蓄積する。この点に関しても、アンモニアはオートファジーを誘導することが示されているが、mTOR非依存的なメカニズムによるものである[80]。
オートファジーの引き金は、飢餓だけではない(図1)。例えば、小胞体ストレスもオートファジーの活性化を誘導する[81]。オートファジーは、プロテアソームが収容できないミスフォールドしたタンパク質凝集体を分解するための機構を提供するものである。実際、フリーラジカル[82]、重金属[83]、あるいは細胞毒性化学療法剤[84]を含む様々な細胞障害は、一般的なストレス応答としてオートファジーを誘発する。また、オートファジーは成長因子によって制御される[85]。成長因子によって活性化される特異的経路は、オートファジーを直接的に抑制することができる(例えば、Rasの活性化[86])。逆に、成長因子の離脱は、細胞表面上の主要な栄養トランスポーターの発現を低下させ、細胞内栄養分の減少をもたらすため、栄養ストレスによるオートファジーの活性化につながる。最後に、オートファジーは選択的なプロセスであり、分解する基質を選択することが可能である。例えば、オートファジーは損傷を受けたミトコンドリア(すなわち、膜電位の低いミトコンドリア)を選択的に分解することが示されており、ミトコンドリアの「品質管理」において重要な役割を果たす(マイトファジーと呼ばれる過程)[87]。オートファジーの異化プロセスが基質を選択的に分解対象とすることができるという事実は、オートファジーを細胞内病原体に対する宿主防御という別の重要な細胞プロセスにも位置づけている。実際、オートファジーは病原体の分解にも関与している(正式にはゼノファジーとして知られている)[88]。
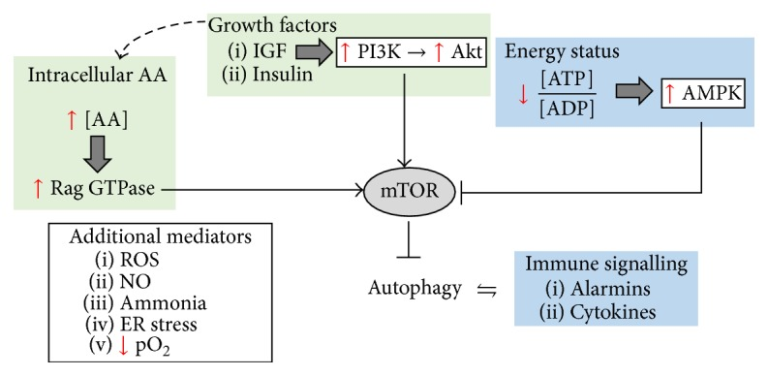
図1 オートファジーは、エネルギー恒常性、免疫調節、および様々な攻撃に対する一般的なストレス応答において重要な役割を担っている
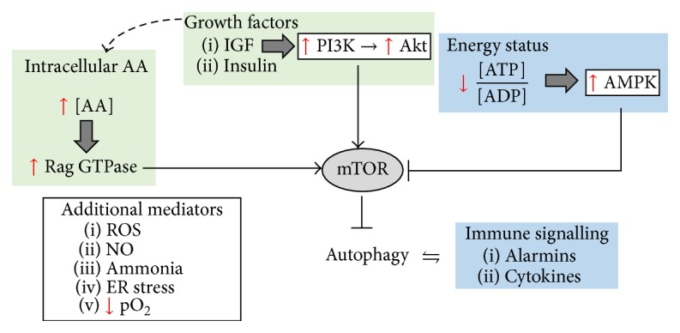
成長因子シグナルは、オートファジーを直接的に阻害することが知られているが、AAsの細胞内輸入系を制御することによって、間接的にオートファジーに影響を与えることもある。高濃度のAAs(特に、BCAA、ロイシンのような必須AAs)は、mTORの活性化を通じてオートファジーを抑制することも知られている。一方、低エネルギー状態はAMPKをアップレギュレートし、それがmTORを抑制するため、オートファジーが増加する。オートファジーは、TLR-4活性化、アラミンなどの免疫エフェクターや、Il1-b、IFN-γなどのサイトカインを介して活性化されることもある。また、オートファジーは、例えば、インフラマソームを分解することによって、これらの炎症性メディエーターを調節している。最後に、一般的なストレス応答としてのオートファジーは、低酸素条件下や酸化ストレスに応答しても発現が上昇する。
したがって、オートファジーをアップレギュレートするメカニズムとしての食欲不振と、オートファジーの抗菌機能との間には、もっともらしい関係が存在する。実際、患者に見られるAAプロファイルの変化は、AAの離脱がmTORを阻害し、その結果オートファジーが増加するというメカニズムである可能性がある。興味深いことに、マクロファージから成長因子とAAを4時間奪うと、オートファジーが上昇し、結核菌に対する保護機能が追加された[89]。このことは、絶食によってマクロオートファジーをアップレギュレートすることで、免疫機能を増強できることを示唆している。
4.2. 感染症および組織外傷におけるオートファジーの役割
以前の研究において、我々は、オートファジーが感染時に多くの重要な機能を持つことを主張した[21](図2)。例えば、オートファジーの流速が高ければ、細胞内病原体は宿主の細胞内防御を操作するための時間枠を短くすることができる。同様に、病原体は、ウイルスがゲノム複製機構を破壊するのに応じて、アポトーシスを阻害するメカニズムを進化させてきた [90]。この点で、オートファジーを介した細胞死(オートシス)[91]は、「バックアップ」の細胞死プログラムを提供する可能性がある。加えて、一連の顕著なオートファジックメディエーター(例えば、BECN1、ATG5、ATG7、およびATG12)はアポトーシス経路にも関与しており[92]、オートファジーのアップレギュレーションが細胞を細胞死に向けて「準備」する可能性があることが示唆される。このことは、食欲不振が免疫細胞の抗病原菌活性を高めるだけでなく、細胞の自律的防御のためのプロトコルであり、その結果、感染性物質の拡散を妨害する可能性があることを示唆している。最後に、オートファジーは、筋肉 [93]、内皮 [94]、脂肪細胞 [54] などの非専門的抗原提示細胞におけるエピトープの発現に関与しており、食欲不振によるオートファジーは、適応免疫応答を動員する際に非免疫細胞を動員して免疫活動を増強する可能性を示唆している。この見解を裏付けるように、オートファジーの強力なイニシエーターであるmTORの阻害は、マウスにおけるインフルエンザワクチンの効力を増強する[95]。同様に、細胞がMHC I上のウイルスエピトープを処理して発現するのを防ぐ戦略であるプロテアソーム経路のウイルスによる阻害は、内因性タンパク質のオートファジー処理によって補われることがある[96]。
図2 オートファジーは病原体のクリアランスと宿主の生存に重要な役割を担っている
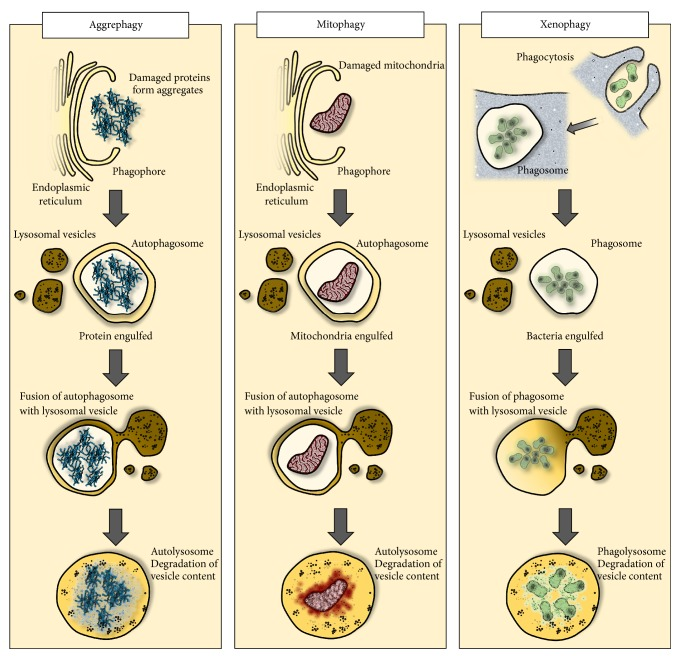
組織の虚血や免疫活性化によって生じる酸化ストレスと同様に線維反応もタンパク質を傷つけ、それが毒性凝集体を形成し、オートファジーによって除去される(「アグレファジー」)。同様に、損傷し機能不全に陥ったミトコンドリアは、細胞の消化の対象となり(マイトファジー)、エネルギー生成を最適化すると同時に、活性酸素の生成を減少させる。オートファジーはまた、免疫細胞と非免疫細胞の両方において、細胞内病原体の除去(ゼノファジー)にも関与している。実証されていないが、オートファジー過程はエピトープの発現にも関与しており、ウイルス感染細胞における細胞死の代替形態を提供する可能性がある。また、オートファジーは、膜受容体やインフラマソームのような単一化プラットフォームを持つことで、炎症トーンを調節している可能性がある。
さらに、オートファジーは、非免疫機構を介して、宿主の生存を高める可能性もある。重度の炎症が起こると、細胞は多くの傷害に直面し、それに対処しなければならない。実際、敗血症の重症例における臨床的低体温の開発は、細胞の生存システムの過剰を避けるための戦略であるかもしれない。この考えを裏付けるように、ラットの重症エンドトキシン血症モデルでは、低体温にさせたラット(重症全身性炎症の場合によく見られる観察)は、生存率が著しく向上した [97]。一般的な細胞生存反応としてのオートファジーは、全身的な炎症状況によってもたらされるストレス要因に対処する上で、重要な役割を担っているのかもしれない。実際、重度の火傷を負ったウサギのオートファジーが不十分であることは、ミトコンドリア機能障害と臓器不全に関与している [98]。さらに、オートファジーは、貪食されたアポトーシス体を除去する役割を果たし [99]、二次的な壊死とその後の炎症を回避することができるかもしれない。さらに、オートファジーは、インフラマソーム複合体の分解にも関与しており [100]、したがって、炎症のトーンを制御し、細胞を病気の軌道に対応しやすくしているのである。最後に、発熱域内の体温上昇は熱ショックタンパク質の発現を誘導することから[101]、新たに合成されたタンパク質が時折ミスフォールドする可能性があることが示唆される。この点で、オートファジーは、ミスフォールドしたタンパク質の凝集体を分解する重要な役割を担っているのかもしれない[102]。以上のことから、オートファジーは、感染時の病原体の除去と宿主の生存の両方に関与していることが明らかとなった。
5.空腹時のオートファジー:諸刃の剣?
宿主-病原体の共進化は、宿主による新しい免疫戦略の絶え間ない開発をもたらし、その結果、病原体に効果的な対抗策を開発するよう進化的な圧力をかけている[103]。この点に関して、オートファジーがLPSやTNFなどの免疫シグナルによってもアップレギュレートされるという事実 [104] は、免疫学的状況におけるオートファジーの役割を強調するだけでなく、病原体が宿主防御機構としてオートファジー過程と共進化したことを示唆している。実際、病原体はオートファジープロセスを覆すための戦略を数多く進化させてきた[105]。このことは、絶食が宿主と病原体の間の「軍拡競争」がエスカレートした結果、オートファジーをアップレギュレートする戦略である可能性を示唆している:絶食状態を呼び起こすことによって、オートファジーは2つの独立した経路(免疫活性化および絶食誘導オートファジー)により相乗的に活性化されるのである。このような二重の活性化(絶食の合図と免疫シグナルカスケードによる)は、オートファジーを破壊または阻害しようとする病原体による「特異的攻撃」に対して、オートファジー過程をより耐性あるものにする可能性がある。
しかし、一部の病原体は、宿主のオートファジー機構を破壊するための成功した手段を進化させただけでなく、宿主のオートファジーを阻害するための手段を進化させた。このことは、Trypanosoma cruziがよく例示している。この病原体のマウス胚性線維芽細胞への侵入は、主要なオートファジータンパク質であるAtg5とBeclin 1の欠失によって妨げられ、同様にオートファジーを促進する条件(ラパマイシンおよびAA飢餓の両方によるmTORの阻害)でも促進される [106].このことは、オートファジーのアップレギュレーションが、Trypanosoma cruziの増殖を促進する可能性を示している。実際、これらの著者らは、T. cruzi 感染の疾病経過は、感染者の栄養状態に悪影響を受ける可能性があると指摘している:肝オートファジーの割合が高い栄養不足の患者では、Trypanosoma cruzi の増殖が促進される可能性がある。したがって、栄養サポートが自食作用プロセスの治療的抑制を仲介する上で実施される可能性のある臨床的状況は類似していると考えられる。
さらに、すでに栄養不足の患者には積極的な栄養補給が必要であろう。先に述べたように、レプチンは免疫機能の維持に重要な役割を担っている。実際、レプチンの発現は、免疫チャレンジに反応して顕著に増加する [107] 。逆に、レプチンまたはレプチン受容体を欠くマウスは、その免疫機能に欠陥を示す[108]。この点で、レプチンレベルは体脂肪量と並行しており、長期的な栄養状態を示している [109]。栄養不良の個体では、慢性的に低いレプチンレベルが、これらの個体で観察される免疫不全に関与していることが示唆されている。このように、絶食と飢餓の生理学的な違いは、調査すべき重要なポイントである。傷害を受ける前の栄養状態は、栄養サポートから最も恩恵を受ける患者や、より良好な結果をもたらす寛容な低栄養に耐えられる患者をターゲットにする上で、重要な役割を果たす可能性がある。
これはまた、栄養支持のもうひとつの重要な側面、すなわち、栄養介入のタイミングを示唆している。ここで論じたように、高レベルのオートファジーを維持することは、感染または損傷の初期段階において有利であると考えられる。しかし、治癒期には、同化的な修復過程を維持するために栄養支持が重要になる場合がある。この見解を裏付けるように、重症小児を対象とした最近の研究 [110] では、遅発性(1週間延期)非経口栄養の優れた転帰が実証されており、成人 [23, 111] でも観察されていることが再確認されている。一因は、損傷/感染の初期段階において非経口栄養を差し控えることで、最も有益なときにオートファジーのレベルが高くなる可能性があることだ。対照的に、栄養補給は、効果的な組織修復に多量栄養素が必要とされる治癒期に、より有利になる可能性がある。
臨床試験のあいまいな結果は、栄養支持から利益を得る患者もいれば、栄養介入によって実際にマイナスの影響を受ける患者もいることを示唆している。臨床試験は、病気の性質と原因を区別することなく「重症」患者に対して実施されることが多い。異なる疾患設定の文脈で臨床上の有益性を再評価することは、代謝基質の供給よりも自己貪食過程の維持がより重要であるという文脈を指摘することができる。また、疾患の軌跡を明らかにするための優れたマーカーを開発し、栄養が最も必要とされるときに栄養を投与する最適な栄養プロトコルを可能にすることも必要である。
6. 今後の方向性
感染時、そしておそらくは組織外傷時のオートファジーの役割は、重症患者における栄養療法の役割に関する多くの問題を浮き彫りにしている。栄養補給は、オートファジーを抑制する循環血中AA濃度を増加させる。同様に、食事に応じた胆汁酸塩の分泌も肝のオートファジーを抑制する。このことから、オートファジーのプロセスを阻害することなく患者に栄養を供給できるような食事処方を設計することができないかという疑問が生じる。前述したように、食後に再吸収される胆汁酸は肝のオートファジーを抑制する。このことは、広範な胆汁の流れを避ける経腸栄養処方は、オートファジーのダウンレギュレーションを回避できる可能性があることを示唆している。胆汁酸の放出は、胃管内の脂肪酸に反応して分泌される胃ペプチドホルモンであるコレシストキニンによって開始される。しかし、C12より短い脂肪酸はコレシストキニンの分泌を刺激しないことが分かっており[112]、脂肪酸の長さが重要な役割を担っている。このことは、短鎖脂肪酸がオートファジーを阻害することなくエネルギー源となる可能性を示唆している。したがって、オートファジー過程への影響を最小限に抑えながら代謝基質を供給することができる食事組成の役割について、今後の研究で調査する必要がある。
さらに、集中的なインスリン療法もオートファジーを阻害する役割を担っている可能性がある。高血糖は、集中治療患者における感染症発生率および臨床転帰の増加の独立したマーカーであり [113] 、インスリン療法が血糖を低下させ生存率を高めるという考え方を支持している。しかし、高血糖がより悪化した状態を示すのか、あるいは高血糖がさまざまな病態の発生につながるのかは、明らかではない。積極的なインスリン療法(IT)によってグルコースレベルをコントロールすることが、集中治療患者において臨床的な利益をもたらすことが、以前の研究で明らかにされている[24]。しかし、この試験の妥当性については多くの懸念が指摘されている[114]。実際、その後の試験は、IT療法を受けた患者における副作用の増加、特に低血糖による合併症の増加のために予定より早く中止された [115] 。この点で、許容的な低栄養は、インスリンの併用を必要とせずに、すでに上昇しているグルコース値をさらに悪化させることを回避することもできるかもしれない。さらに、これらの時々の有害作用は、インスリンがmTORシグナル経路を介してオートファジーを阻害する能力から生じるのではないかと推測される[116]。したがって、寛容な低栄養は、オートファジーをアップレギュレートし、栄養支持による血糖指数のさらなる上昇を回避することにより、優れた栄養支持の形態を示す可能性がある。
また、疾患の経過に伴い、様々な細胞でオートファジーが果たす数多くの役割を解明する必要がある。以前の研究 [117, 118] では、増殖中のT細胞におけるオートファジーの早期のアップレギュレーションが確認されている。実際、mTORを阻害すると、T細胞を介した免疫応答が増強され、免疫細胞の記憶も強化されることから [119]、T細胞の機能におけるmTORの役割は明らかに示唆されている。しかし、コンディショナルノックアウトシステムを用いた最近の研究 [120] では、これまでの知見とは異なり、CD8細胞では感染初期にオートファジーがアップレギュレートされないことが実証された。しかし、この時点(8日目)では、ウイルスはすでに除去されていた。このように、オートファジーがアップレギュレートされた時点で食欲不振の刺激が取り除かれていることから、オートファジーは発症中の病態において継続的に役割を果たしており、細胞がオートファジーを誘導するメカニズムは食欲不振だけではないことが示された。さらに、この文脈におけるオートファジーの機能は、脂肪酸代謝への代謝シフトによって、主にT細胞の生存に関与しているようである。したがって、オートファジーは(メモリーT細胞の細胞生存を促進することによって)ウイルス制御に重要な役割を果たしているが、このプロセスは食欲不振とは無関係でなければならず、したがって食欲不振を “オートファジーの引き金 “とする解釈は支持されない。さらに、T細胞は顕著な代謝可塑性を示すことが実証されており [121]、このことは、移動する細胞として遭遇する様々な環境を生き抜くために、これらの細胞を助けているのかもしれない。これらの観察結果を総合すると、オートファジーは様々な免疫学的状況において重要な機能を有しているが、これらのオートファジー過程は食欲不振とは無関係に活発であることが示唆される。
オートファジー回路の解明は、病原体の破壊を理解する上でも、栄養補給を最適化する上でも、興味深いものであると思われる。ATP:AMP比が低いとAMPKがアップレギュレートされ、オートファジーがアップレギュレートされるが、AAが低いとオートファジーの強力な阻害剤であるmTORが阻害される [122].したがって、オートファジーは、AA飢餓、または軽度のエネルギーストレスのいずれかの結果として、mTORの阻害によってアップレギュレートされる可能性がある。このように、オートファジーは異なる栄養的誘因によって優先的に誘導される可能性があるが、これらのプロセスは相互に排他的ではないことに留意すべきである。また、動物が様々な病気を取り除くために、特定の性質を持つ食物を選択する「自己治療」が可能であることはよく知られている [123]。実際,無脊椎動物でも食物の嗜好性が変化することが報告されている.2つのグループがそれぞれ、細菌感染[7]やウイルス感染[8]の際に、タンパク質とブドウ糖の比率が高い餌を与えると、アフリカンアーミーウォームが好み、生存率が上がることを観察している。このことは、無脊椎動物ではAMPKによるオートファジーがより重要である可能性を示唆している(一方、脊椎動物ではAAがオートファジーの「トリガー」とされる可能性がある)。あるいは,無脊椎動物は感染時にAAを燃料として代謝し,アンモニア濃度を上昇させ,それに伴ってオートファジーが増加する可能性もある [80].実際、同様のメカニズムが臨床の場でも観察されている。LPSが尿素生成によるアンモニアの肝臓での除去を阻害することが示されており、これは敗血症の患者で観察されるアンモニアの増加を説明するかもしれない[124]。このような「代謝機能障害」は、実際にはアンモニアレベルをわずかに上昇させ、オートファジーを全身的にアップレギュレートするための刺激を増加させる戦略であると推測するのは魅力的である。今後の研究により、オートファジー過程の制御における基質利用、代謝廃棄物や中間体の蓄積の機能的価値が明らかにされるかもしれない。
最後に、病原体はオートファジーのプロセスを破壊する戦略を進化させてきたため、オートファジーのフラックスを測定する慎重な研究設計が必要である[125]。しかし、小胞のようなオートファジー要素の増加は、オートファジー活性の増加を示している可能性がある。また、リソソームがファゴソームと融合できないなど、オートファジー過程の欠陥を意味する場合もあり、病原体がオートファジー過程を破壊した直接の結果である可能性もある。さらに、オートファジーに関与する様々なタンパク質は、オートファジー過程自体によっても分解される[126]。したがって、主要なタンパク質のイムノブロッティングは、誤解を招く結果をもたらす可能性がある。
7. 結論
様々な種で食欲不振が広く見られることから、感染時に摂食を避けることは進化的に保存された反応であり、その結果、適応的な反応である必要があることが示唆された。しかし、免疫反応を動員するための代謝要求が、積極的な栄養支持の実施につながる。臨床試験および動物実験の結果では、栄養補給の利点が一貫して証明されていない。同様に、冒頭で述べたように、食欲不振が有益なプロセスであるというメカニズム上の正当性は、まだ確定的になっていない。
オートファジーをアップレギュレートする戦略としての食欲不振の役割は、寛容な低栄養の臨床的価値を説明する合理的な根拠を提供するだけでなく、研究間の対照的な結果も説明できる。すなわち、オートファジーを介した細胞生存とこのプロセスの抗病原性効果から利益を受ける患者もいれば、そうでない患者もいるのである。
実際、病原体によっては、オートファジーをアップレギュレートすることがかえって有害な場合もある。関与する外傷または感染因子に応じて患者群を層別化することにより、積極的な栄養支持が正当化される状況と、寛容な過少栄養が優れた戦略を提供する状況について洞察することができる。
最後に、栄養支持を導入する際のスケジュールを最適化する必要がある。異化代謝から同化代謝への移行が認められる治癒期に栄養支持を実施すると、患者は最も恩恵を受けると思われる。