Sharing CD4+ T Cell Loss: When COVID-19 and HIV Collide on Immune System
オンラインで公開2020年12月15日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7770166/
要旨
COVID-19は、ヒト間感染の増加を特徴とする特徴的な感染症であり、症状がない状態から重篤なサイトカインストームを呈し、予後不良に陥る可能性がある。HIVと同様に、COVID-19患者のリンパ球減少とCD4+ T細胞数の大幅な減少は、臨床的には予後不良と関連している。
CD4+ T細胞はウイルス感染に対する反応を調整する上で重要な役割を果たしていることから,COVID-19とHIV感染におけるT細胞反応を比較し,SARS-CoV-2に感染したHIV感染者を研究することで,重要な教訓を得ることができる。
本研究では、SARS-CoV-2感染者の臨床転帰に大きな違いがあることをより深く理解するために、これら、2つのウイルス感染症における宿主の特徴や炎症反応を批判的に検討した。
T細胞の機能障害のメカニズムをよりよく理解することは、重症COVID-19に対する標的治療法の開発に貢献するとともに、ウイルス感染を長期的にコントロールするためのT細胞応答を関与させたワクチンを合理的に設計することにも役立つであろう。
キーワード
COVID-19,HIV、CD4枯渇、サイトカインストーム、リーキーガット
序論
2019年12月に中国・武漢で未知の感染性肺炎が発生した(1)。本疾患の病原体は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と名付けられた新型コロナウイルスであることが迅速に特定され、WHOによりコロナウイルス病19(COVID-19)と命名された(2-4)。その後、このウイルスは2020年11月までに世界で4,800万人以上の確定症例と120万人以上の死亡者を出している(5)。COVID-19患者の大多数は、乾いた咳、発熱、鼻水、倦怠感、筋肉痛、下痢などのインフルエンザ様症状を伴うか否かを問わず、軽度の臨床症状を呈している。症例によっては、急性呼吸窮迫症候群、敗血症性ショック、凝固機能障害、および多臓器不全に進展することがある(1,6,7)。重症度は、高齢、肥満、メタボリックシンドロームなどの要因に影響される(8,9)。SARS-CoV-2の急性感染は、約80%の患者でリンパ球減少症を伴う(6,10-21)。さらに、B、ヘルパー(CD4+)および細胞障害性(CD8+)T細胞機能の抑制を伴うリンパ球減少症は、臨床転帰不良の指標となる(10-15,17-19,21-27)。リンパ減少はウイルスクリアランスを遅延させ、マクロファージ刺激とそれに伴うサイトカインストームを助長し、臓器機能障害につながると考えられる(7, 15, 18, 19, 21, 23, 24, 26, 28, 29)。
SARS-CoV-2以外にも、SARSコロナウイルス、麻疹ウイルス、鳥インフルエンザウイルスH5N1,豚口蹄疫ウイルス、呼吸器同期ウイルス、ヒト免疫不全ウイルス(HIV)などの他のウイルスがリンパ球減少症と関連している(30)。その中でもHIVは、リンパ球減少症に関連したよく知られた疾患である後天性免疫不全症候群(AIDS)を引き起こす可能性がある(31)。HIV感染の急性期は末梢性CD4+T細胞数の大幅な減少が特徴であるが、慢性期になると、これらのCD4+T細胞の減少は緩やかで持続的なものとなり、AIDSの発症と関連している。抗レトロウイルス療法(ART)によりHIVの複製が急速に抑制され、CD4+T細胞数が回復してAIDSを予防する。しかし、このような人たちでは、何年もARTを受けた後も全身性免疫活性化が持続し(32)、枯渇した老齢化したT細胞と相まって、プロ炎症性メディエーターの増加とCD4/CD8比の低下(33)が特徴である。全身の免疫活性化は、心血管疾患、神経認知障害、がんなどの非感染性合併症にも関連している。
CD4+ T細胞は、免疫系を調整することにより、急性および慢性のウイルス感染に対する反応を調整する。これらの細胞は、B細胞、細胞傷害性CD8+T細胞、および非免疫細胞と同様に、自然免疫系の複数の細胞を活性化する。CD4+ T細胞はまた、長期的な細胞性および体液性抗原特異的免疫の確立に重要な役割を果たしており、これは多くのウイルス感染症やワクチンの生涯保護の基礎となっている(34, 35)。
HIV-1とSARS-CoV-2は、CD4+ T細胞リンパ球減少症を共有する一方で、異なるウイルス学的特徴を有している。このレビューでは、急性および慢性ウイルス感染症におけるCD4+ T細胞リンパ減少症の可能性のあるメカニズムと潜在的な影響を批判的に評価した。また、これら、2つの劇的なウイルス感染における宿主の特徴と高炎症反応、およびHIVとともに生きる人々(PLWH)におけるCOVID-19感染の影響についても論じている。
PLWHとCOVID-19におけるT細胞の調節障害
HIV感染の急性期は末梢性CD4+ T細胞数の大幅な減少が特徴であるが、慢性期ではCD4+ T細胞の継続的な減少がAIDSの発症と関連している(図1)。対照的に、CD8+ T細胞の増加が観察されるが、これは主にHIVに対する細胞毒性反応が枯渇したことによって引き起こされ、CD4/CD8の比率が逆転することにつながる。ARTにもかかわらず、PLWHは依然として持続的な免疫活性化と炎症を呈している。CD38とHLA-DR、およびプログラムされた死-1(PD-1)の発現は、活性化されたT細胞のバイオマーカーであり、T細胞の枯渇に寄与している(36)。枯渇したウイルス特異的CD4+ T細胞はPD-1を高レベルで発現し、疾患の進行、ウイルス負荷、CD4+ T細胞数の減少と相関している(37)。
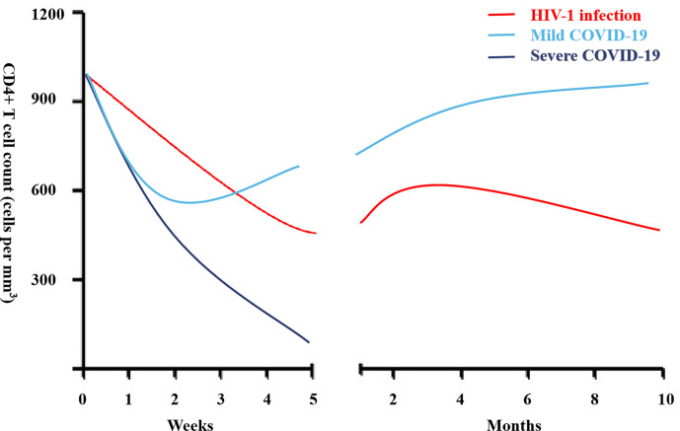
図1 HIVとともに生きる人々(PLWH)およびコロナウイルス病19(COVID-19)の急性感染時のCD4+リンパ球数
健康な対照者と比較すると、急性および慢性のPLWHでは、循環血液中の調節性T細胞(Tregs)の絶対数は減少しているが、慢性感染時のTregsの割合は増加しており(38,39)T細胞の機能不全をさらに助長している。粘膜保護機能を持つTh17機能を持つ腸CD4+ T細胞は急速に枯渇し(40)、粘膜バリア機能不全に寄与し、微生物の転座の増加と全身性免疫活性化につながる(41)。CD4+ T細胞のサブグループが減少しているにもかかわらず、HIV感染の慢性期には、循環するT濾胞ヘルパー(Tfh)細胞の細胞数と相対的な割合の両方が血中で増加している(42,43)。Tfh細胞は、二次リンパ系器官の胚細胞中心部のB細胞に助けを提供し、HIV感染における効率的な中和抗体および非中和抗体応答の生成に中心的な役割を果たしており、効果的なワクチンの生成に不可欠であると考えられている(44)。HIV特異的および非HIV特異的な循環Tfh細胞の拡大および変化した特徴はART期間中には改善されず、持続的なHIV抗原発現によって駆動される可能性がある(45)。ARTによるウイルス抑制では、Tfh細胞に関連する遺伝子の発現がウイルス感染期と比較して低下し、それに伴いTh17細胞に関連する遺伝子の発現もウイルス感染を自然にコントロールしている人と比較して持続的に低下している(46)。
リンパ球減少は重症COVID-19患者の特徴であり(6,10-15,17-19,21)不良な臨床転帰と関連している。軽度および重度のCOVID-19の間のCD4+リンパ球数の動態を図1に示す。ヘルパーCD4+ T細胞は、B細胞を刺激してウイルス特異的抗体を産生することにより、防御的体液性免疫を媒介する上で重要である。一方、CD8+ T細胞は、主にペルフォリンおよびグランザイムの産生を介して感染細胞の排除に関与し、サイトカインの分泌を介して異なるタイプのウイルスを制御するためのキープレイヤーである。CD4+およびCD8+ T細胞数の両方が、重症COVID-19では減少する(10-15,17-19,21-27)。同様に、B細胞数の減少も重症COVID-19で観察される(14, 23)。さらに、CD4+ T細胞サブセット内では、エフェクターメモリーT細胞(CD45RO+)およびTregs(CD25+CD127low)の減少が認められ、一方でナイーブT細胞(CD45RA+)の割合は増加した(16)。活性化や抗炎症機能を抑制して免疫恒常性の維持に関与するTregsの頻度は、重症例では非常に低かった。また、重症COVID-19では、活性化CXCR5+PD-1high CD4+ Tfh細胞の相対的に増加した再循環が観察された。
COVID-19におけるCD4+ T細胞は、HLA-DR、CD25,CD38およびKi-67のような細胞マーカーの発現によって特徴づけられるように活性化されている(47)。末梢T細胞上のPD-1およびTIM-3受容体のような阻害性マーカーの増加に基づくT細胞の枯渇も報告されている(47-49)。多機能性(複数のサイトカイン分泌)やT細胞の細胞毒性の低下は、疾患の進行と相関があることが研究で示されている(21,49)。HIVとは逆に、ある研究では、COVID-19患者の末梢血中のTh17細胞数の増加が示された(50)。入院患者では、非入院患者と比較して、Mathewらは、SARS-CoV-2に反応する細胞傷害性濾胞ヘルパー細胞および細胞傷害性Tヘルパー細胞の割合が増加し、SARS-CoV-2反応性Treg細胞の割合が減少していることを発見した(47)。SARS-CoV-2特異的CD4+およびCD8+ T細胞の増加は、それぞれ軽度の疾患と関連しており、COVID-19における防御免疫におけるCD4+およびCD8+ T細胞の重要な役割が示唆された(51)。さらに、これらのウイルス特異的細胞の不在は、低ナイーブCD4+ T細胞を有する高齢者において、主に低ナイーブCD4+ T細胞を有する高齢者において、協調性のない抗原特異的免疫応答およびCOVID-19の制御の失敗をもたらす。同様に、PLWHは効果的なHIV特異的CD4+およびCD8+ T細胞応答をマウントすることができないが、HIVコントローラは例外として、ARTを使用していないにもかかわらず検出不能または低レベルのウイルス血症を維持することができる(46, 52, 53)。PLWHおよび重症COVID-19における異なる末梢血細胞型の特徴を図2に示す。
図2 HIVと重症コロナウイルス感染症19(COVID-19)における末梢血細胞型の違いの変化
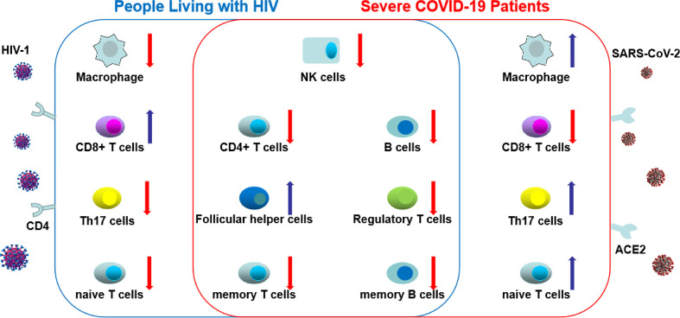
COVID-19とHIV感染では、ナチュラルキラー細胞、B細胞、CD4+ T細胞、調節性T細胞、メモリーT細胞、B細胞の合計数が減少するのに対し、濾胞性ヘルパー細胞の数は増加する。これらのHIVとCOVID-19の間の共通の変化を中央の円で示した。しかし、HIVと共に生きる人(PLWH)と重度のCOVID-19の間では、マクロファージ、CD8+ T細胞、Th17細胞、ナイーブT細胞の総カウントに明確な変化が示された。赤矢印は細胞数の減少、青矢印は細胞数の増加を示す)。
リーキーガット
腸CD4+ T細胞の枯渇は、タイトジャンクションの破壊、および腸上皮の細胞死が続く。上皮の腸の損傷は、慢性的な免疫活性化と炎症に参加して、腸内細菌叢の組成(dysbiosis)と循環(微生物の転座)における細菌産物の放出の両方の不均衡につながる(54,55)。
宿主の恒常性維持のための関連代謝機能とは別に、腸内細菌叢は、細菌やウイルスの病原性コロニー化に対する保護作用を発揮するが、これは少なくとも部分的には、免疫システムの教育と強化における役割に起因していると考えられる(56)。腸内細菌叢異常-免疫過剰反応-炎症の三位一体は、HIVとCOVID-19の両方の発症に関与している(57)。
HIV感染の数週間以内に、ウイルスはTh17機能を持つCD4+ T細胞の大幅な枯渇を経て、腸への大規模な攻撃を開始する(58)。PLWHは、有益な細菌の減少だけでなく、プロ炎症性および潜在的な病原性細菌の増加と微生物相の組成が変化している(59,60)。腸の損傷は微生物の転座を可能にする。これは慢性HIVにおける全身免疫活性化の原因となり、通常、リポ多糖(LPS)や(1→3)-β-D-グルカン(BDG)などの微生物転座のマーカーの血漿レベルを測定することによって決定されるが、これらはすべてPLWH(ART中であっても)で上昇している(61,62)。これまでの研究では、LPSとBDGは疾患の進行、CD4+ T細胞数の低下、免疫活性化の誘導と関連していることが示されている(61-63)。
COVID-19患者の60%以上が下痢、吐き気、嘔吐などの消化器症状の証拠を報告している(64)。SARS-CoV-2が腸内細胞で複製することができるという直接的な証拠がある(65)。さらに、インフルエンザを含む多くのウイルス感染症は、腸および肺のマイクロバイオータの変化を促進し、腸内でのウイルス介在性の変化には、腸内のジスビオーシスおよび透過性の亢進が含まれる(66)。実際、最近の研究では、SARS-CoV-2感染における腸内微生物の特徴と関連代謝物に違いがあることが明らかになっている(67)。重度のCOVID-19への寄与における腸内環境異常と微生物転座には、より多くの注意が払われるべきである。
HIV感染症における高炎症とCOVID-19
急性HIV感染の血漿中サイトカインを調べたところ、ウイルス感染が検出されてから数日以内に増加した最初のサイトカインはインターフェロン(IFN)αであり、次いで腫瘍壊死因子α(TNF-α)IFN-γ、およびインターロイキン(IL)-12であることが明らかになった(68)。Fiebig期I-IIの間にARTを開始すると、HIV誘発性サイトカインストームを和らげることができる(69)。IFN-α、IFN-γ、単球化学吸引性タンパク質(MCP)-1,可溶性IL-2受容体(sCD25)IL-6およびIL-8の上昇が、慢性的に感染している未治療者において認められた(63,70,71)。ARTの開始は、炎症性サイトカイン、炎症のマーカー、および単球活性化の血漿レベルを、HIV感染者と比較して正常化することなく有意に低下させる(72)。
同様に、COVID-19患者でも炎症性サイトカインの上昇が観察された。重症例では、TNF-α、IFN-γ、IL-2R、IL-6,IL-8,およびIL-10の上昇が検出された(7,15,18,19,21,23,24,26,28,29)。しかしながら、高度に障害されたインターフェロン(IFN)タイプI応答が観察され、IFN-βが存在せず、IFN-αの産生および活性が低いことを特徴としていた(73)。さらに、研究では、集中治療室(ICU)患者において、非ICU患者と比較して、プロ炎症性サイトカインおよびケモカイン、IL-2,IL-7,IL-10,顆粒球コロニー刺激因子(G-脳脊髄液)CXCL-10/IP-10,TNF-αおよびマクロファージ炎症性タンパク質(MIP)-1αの産生が増加していることが明らかにされている(7)。さらに、IL-6レベルは疾患の重症度および死亡率のバイオマーカーと考えられており(28,29)現在進行中の臨床試験では、COVID-19患者の転帰を改善するためにIL-6遮断を評価している(74)。
2型糖尿病(2型糖尿病)における既往の低レベルの炎症とリーキーガットは、COVID-19の死亡率の上昇と関連している可能性がある(75,76)。レトロスペクティブ研究では、COVID-19で入院した2型糖尿病患者において、メトホルミン使用者は非使用者と比較して死亡率が減少したことが示されている(77)。COVID-19におけるメトホルミンの潜在的な効果は、mTOR経路の阻害と免疫亢進の防止であると考えられる(78)。TNF-αおよびIL-6などのサイトカイン産生の減少が、メトホルミン投与患者で認められた(79)。さらに、メトホルミンは腸内細菌叢の組成を変化させることで炎症を減少させる可能性もある(80,81)。糖尿病のPLWHを対象としたレトロスペクティブコホート研究では、メトホルミンの使用はCD4回復の改善と関連していることが示された(82)。メトホルミンがCOVID-19のCD4+T細胞リンパ減少症の治療戦略になりうるかどうかは、さらなる調査が必要である。
PLWHおよびCOVID-19における併存疾患
ARTはAIDS発症リスクを低下させたが(83)心血管疾患や代謝性疾患、神経認知機能障害などの非AIDS併存疾患のリスクと関連する炎症を正常化させることはできない(84-86)。
COVID-19では、直接のウイルス攻撃と全身性の高炎症は、いくつかの臓器の機能障害を引き起こす可能性がある。死後の分析では、主な損傷は肺で発生し、肺胞上皮細胞、ヒアリン膜形成、II型肺炎球の過形成、これらはすべてびまん性肺胞損傷の構成要素であることが示された(87,88)。中国武漢でCOVID-19で入院した患者の20%近くが心臓損傷の証拠を示した(89,90)。COVID-19で入院した患者の半数以上は、肝臓の損傷を示す酵素レベルが上昇していた(91)。COVID-19患者214人の症例シリーズでは、神経学的症状が36.4%の患者に認められ、急性脳血管イベント、意識障害、筋損傷が含まれてた(92)。
CD4+ T細胞リンパ球減少症のメカニズム
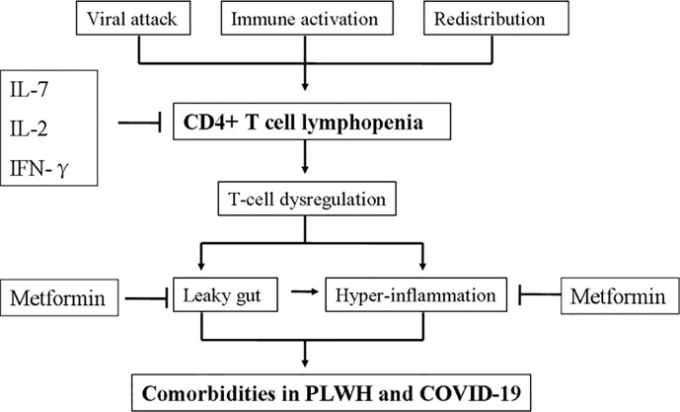
胸腺は、骨髄の造血幹細胞から分化するT前駆細胞からのT細胞分化をサポートし、成熟CD3+ CD4+およびCD3+ CD8+胸腺細胞を選択する(41)。定量的な推定では、健康な若年者(30歳未満)の成人が約2.2×1011の成熟CD4+ T細胞を保有していることが示されている(93)。ほとんどのCD3+CD4+およびCD3+CD8+ T細胞は末梢リンパ系器官に存在し、T細胞およびB細胞の応答は抗原提示細胞(APC)によって調整されている。CD4+ T細胞数は、IL-7を含む恒常性メカニズムにより、ヒトの体内で一定に保たれている(41)。総CD4+ T細胞は、細胞死、半減期の短縮、または産生障害により枯渇することがある。さらに、循環CD4+細胞の割合は、炎症部位でのリンパ組織の再分配により減少することがある。HIVが媒介するCD4+ T細胞の枯渇を説明するために、多くの動的モデルが提唱されている(94,95)。しかし、COVID-19では、CD4+リンパ球減少は十分に理解されていない。PLWHとCOVID-19におけるCD4+リンパ球減少症の潜在的なメカニズムと結果を図3に示す。
図3 HIV(PLWH)とコロナウイルス感染症19(COVID-19)の生活者におけるCD4+リンパ球減少症の潜在的なメカニズムと結果
CD4+ T細胞への直接的な攻撃
実験室で適応したHIV単離株を組織培養して行った初期の実験では、CD4+ T細胞に対する高いトロピズムを持つ細胞病原性ウイルスが明らかになった(96)。HIV感染によるCD4+ T細胞の喪失はT細胞の産生によって打ち消される恒常性応答があるが、恒常性応答によるT細胞の産生が枯渇すると、最終的にはこのバランスが崩れてしまう。このことは、PLWHにおけるCD4+ T細胞数の減少と細胞増殖およびアポトーシスのレベルの増加の定量的画像解析によって立証されている(97, 98)。しかしながら、未感染CD4+ T細胞がIL-7シグナル化に影響を与える細胞ウイルス接触により半減期が短くなることから、HIVの病因は直接的なウイルス殺しの仮説だけでは説明できないことが証拠として示された(99)。もう一つの説明は、ホスホリパーゼA2グループIB(PLA2G1B)がHIV gp41エンベロープタンパク質と相乗効果を発揮し、CD4+ T細胞表面を標的とし、CD4+ T細胞の無反応性(アレルギー)を引き起こすことである(100)。
SARS-CoV-2はHIVと同様にCD4+ T細胞数を直接減少させることができるのかという疑問が生じる。ACE2(アンジオテンシン変換酵素2)は、宿主のTMPRSS2(膜貫通型プロテアーゼセリン2)膜プロテアーゼと協働して、コロナウイルススパイクSタンパク質の細胞侵入を促進するプライミングを行うSARS-CoV-2内在化受容体である(101)。ACE2とTMPRSS2は、肺、心臓、肝臓、腎臓、ニューロン、および免疫細胞で共発現している(103)。免疫細胞は、SARS-CoV-2に感染する可能性があり、SARS-CoVの場合のように(104)、両方のウイルスが同じ受容体ACE2を共有している(102)。研究では、SARS-CoVは循環中のリンパ球の50%に感染し(105)アポトーシス、壊死、またはパイロプトーシスによる細胞死をもたらすことが示されている(106,107)。さらに、SARS-CoVの影響下では胚中心が退行し、Tリンパ球とBリンパ球の両方が枯渇する(108)。COVID-19患者6人の脾臓および肝門リンパ節の剖検研究では、リンパ球の広範な細胞死が観察された。しかし、SARS-CoV-2がT細胞に感染するかどうかの直接的な証拠はまだ不足している。
免疫活性化とT細胞死
これまでの研究では、活性化されたCD4+ T細胞は、活性化に誘導された細胞死やアポトーシスにより、寿命が非常に短いことが提案されている(109)。HIV感染では、CD4+ T細胞の活性化は、HIVタンパク質による抗原刺激によって駆動され(110)、一部は炎症性サイトカインの産生を介した抗原に依存しないメカニズムによって駆動される。T細胞の継続的な過剰活性化は、アポトーシスまたは記憶表現型への分化を介したナイーブT細胞の消費の促進につながる可能性がある。
炎症性サイトカインおよびサイトカインストームの上昇は、COVID-19患者において観察された。これまでの研究は、多数の抑制性サイトカインが感染した肺マクロファージまたは上皮細胞によって放出されることを示した。これらのサイトカインには、T細胞のアポトーシスを引き起こすTNF-α(111)T細胞の増殖を防ぐことが知られているIL-10(112)およびリンパ球の再循環を調節するI型IFN(113)が含まれる。これらの炎症性サイトカインがCD4+ T細胞の消失に寄与しているかどうかについては、さらなる調査が必要である。
CD4+ T細胞の再分布
循環CD4+ T細胞数は、そのアクセスのしやすさから最も研究されている。しかし、血液区画内のCD4+ T細胞は、必ずしもリンパ系臓器の組成やCD4+ T細胞がリクルートされる感染部位を反映しているとは限らない。したがって、CD4+T細胞リンパ減少症は、体全体のCD4+T細胞の再分配を反映している可能性がある。
シミアン免疫不全ウイルス(SIV)サルモデルからのいくつかの証拠は、末梢血からリンパ節および腸へのCD4+ T細胞の再分布を示している(114)。CD4+リンパ球の血中濃度が著しく低下し始めると、これらの細胞はしばしばリンパ節で数が増加する(115)。このことは、血液中のCD4+ T細胞の減少は、リンパ節へのCD4+リンパ球のホーミングの亢進によって一部説明できることを示唆している。さらに、リンパ節ホーミングの受容体であるCD62Lは、HIVに感染すると制御されなくなる可能性がある(116)。効果的な抗レトロウイルス治療の開始後、リンパ球のリンパ組織への隔離を媒介するVCAM-1やICAM-1のような接着分子のレベルが低下すると、CD4 T細胞の急速な増加とLNサイズの減少とが関連していた(117)。
SARS-CoV-2は肺胞上皮細胞に感染して破壊され、その結果、炎症性サイトカインやケモカイン(インターロイキン-6(IL-6)IL-8,CXCL10/IP-10,CCL3/MIP1α、CCL4/MIP1βを含む)の産生やマクロファージによる過剰産生を誘発する可能性がある(118)。このようなサイトカインおよびケモカインの分泌は、免疫細胞、特に単球およびTリンパ球を血液中から感染部位に引き寄せ、これが循環リンパ減少症を説明する可能性がある。さらに、COVID-19患者の最初の剖検では、肺に単核細胞(単球およびT細胞)が蓄積しており、末梢血中の活性化したT細胞のレベルが低いことが明らかになった(88)。さらに、抗IL-6薬は、IL-6のレベルが高いことを特徴とするマルチセントリックキャッスルマン病患者のリンパ球減少を直ちに逆転させ、組織の再分配を促進した(119)。動物モデルと将来の臨床試験は、SARS-CoV-2に関連したリンパ球減少症の原因となるメカニズムの解明に役立つであろう。
HIVとCOVID-19が出会うとき
PLWHにおけるCOVID-19の影響を評価した症例報告がいくつかある(120-123)。COVID-19を投与された33人のPLWH患者の症例シリーズでは、転帰が記録された32人のうち3人が死亡した(9%)。しかし、患者の91%が回復し、76%が軽症例に分類されており、症候性COVID-19を有するPLWHではCOVID-19 HIV陰性患者と比較して過剰な罹患率や死亡率はないことが示されている(123)。武漢での研究では、調査したHIV/AIDS患者1174人のうちCOVID-19は8人であった。著者らは、COVID-19の発生と関連する性、CD4+T細胞数、HIVウイルス負荷、ARTレジメンの影響はなく、COVID-19感染と関連するのは年齢が高い場合のみであると報告している(124)。
COVID-19病におけるHIV感染の非影響に関する仮説
HIV感染におけるCD4+ T細胞数の低下とインターフェロンレベルの上昇を伴う免疫系の低下は、COVID-19の臨床症状を低下させる可能性がある。活動的な免疫状態が低下すると、SARSやMERSなどのウイルス誘発性サイトカインストームから人体を保護する可能性があるという仮説がある(125)。
いくつかのART薬(ロピナビル/リトナビル、リトナビル、ダルナビル、およびドルーテグラビル)は、抗SARS-CoV-2複製活性についてスクリーニングされ、当初はCOVID-19の治療に使用されていた(126)。しかし、試験管内試験でSARS-CoV-2複製を抑制できるプロテアーゼ阻害剤であるロピナビル/リトナビルを用いた臨床試験では、COVID-19の転帰に影響はなかった(127)。もう一つの薬剤は、レムデシビルのヌクレオシド類似体であるテノフォビル(TDF)であり、これはSARS-CoV-2 RNA依存性RNAポリメラーゼ(RdRp)活性を試験管内試験で阻害し、COVID-19で入院した成人で下気道感染の証拠がある場合に回復までの時間を短縮することができる(128)。
ARTを受けているHIV陽性者77,590人を対象としたコホート研究では、TDF/エムトリシタビン(FTC)を投与されているHIV陽性者は、他の治療を受けている者と比較してCOVID-19および関連入院のリスクが低いことが示された(129)。これらの知見は、健康な人を対象としたHIV曝露前予防研究や、HIVの有無にかかわらず、これら、2剤を服用している人を対象とした無作為化試験について、さらなる調査を行うことを保証するものである。
CD4+ T細胞のリンパ球減少症の可能性のある治療法
IL-7
IL-7 レベルは、HIV/AIDS 患者の CD4+ T 細胞数と逆相関していることが知られており、ホメオスタシス反応と関連している可能性が高い(130)。IL-7は骨髄におけるB細胞およびT細胞のリンパ増殖に不可欠である。臨床研究では、組換えIL-7の投与により、T細胞の機能を維持しつつ、ナイーブCD4+およびメモリーCD8+ T細胞の数が増加することが示された(131, 132)。COVID-19を有するリンパ性患者における臨床転帰を改善するためのIL-7の有効性を評価するためのいくつかの臨床試験が現在進行中である(NCT04407689,NCT04379076,NCT04442178およびNCT04442178)。
IL-2およびIFN-γ
IL-2は、抗原刺激されたCD4+ T細胞における強力なマイトジェンおよび成長因子である(133)。IL-2はHIVで研究され、CD4+ T細胞数を増加させることが示されている(134,135)。末梢血中のIL-2レベルは、軽度の症例と比較して重度のCOVID-19症例で増加した(7, 15, 18, 19, 21, 23, 24, 26, 28, 29)。COVID-19患者のCD4+ T細胞リンパ減少症を改善するためにIL-2を使用できるかどうかは、慎重に検討されるべきである。SARS-CoV2関連急性呼吸窮迫症候群患者を対象とした無作為化比較試験(NCT04357444)において、低用量IL-2投与の有効性が評価されている。
制限事項
PLWHとCOVID-19におけるCD4+ T細胞の消失については、まだいくつかの知識のギャップがある。第一に、CD4+ T細胞の変化の動態は、特にHIVは急性疾患状態と慢性疾患状態の両方を誘発するため、比較することが困難である。第二に、COVID-19のデータは限られている。この新しい疾患についてより詳しく知るためには新しい研究を行う必要があり、HIV感染とPLWHのケアに関する研究から得られた教訓は、新しい治療法の設計に役立つことは間違いない。
おわりに
HIV-1とSARS-CoV-2感染は、両方ともCD4+ T細胞の損失と疾患転帰および免疫不全との関連で共通している。CD4+T細胞への直接的な攻撃、免疫活性化、CD4+T細胞の再分配が、両疾患におけるCD4+T細胞リンパ減少の原因となるメカニズムは、非常に異なる割合で存在する。免疫不全の期間中は、全身の炎症がリーキーガットによって煽られ、重篤な合併症につながる可能性がある。しかし、HIVがCOVID-19を満たす場合、COVID-19の発生の増加はなく、症候性COVID-19を有するPLWHの間では過剰な罹患率および死亡率は報告されていない。以前、IL-7とIL-2はHIV-1感染症でCD4+T細胞数を増加させるために使用されていたが、それらの機能の改善は報告されていない。にもかかわらず、COVID-19に対する短期的な効果は調査中である。CD4+ T細胞は免疫応答を調整するため、ワクチンの効果的な反応には適切なCD4+ T細胞の機能が必要である。したがって、長期的に効率的なワクチン製剤を開発するためには、抗SARS-CoV-2抗体とCD4応答を研究する必要がある。全体として、HIVの臨床管理における経験と過去の臨床試験は、CD4+ T細胞機能の増加とCOVID-19の罹患率の低減を目的とした革新的な研究のための特別な使用例を表している。
著者寄稿
XPは原稿の第一稿を執筆した。JO, SI, JL, BF, BZは原稿の修正を行った。J-PRは原稿の構想とデザインを担当した。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金調達
本研究は、中国奨学金委員会(No.201906325018)カナダ保健研究所(CIHR、助成金MOP 103230およびPTJ 166049)CIHRカナダHIV試験ネットワークのワクチン&免疫療法コア(CTN、助成金CTN 257)CIHRが出資するカナダHIV治療企業(CanCURE)チーム助成金HB2-164064,本研究はまた、Fonds de la Recherche Québec-Santé(FRQ-S)によっても支援された。SIDA/Maladies infectieuses and Thérapie cellulaire. JOは、第13次5カ年計画(第2018ZX10302104号)の中国国家科学技術大プロジェクトの支援を受けている。SIは、Fond de Recherche Québec SantéフェローシップとCIHR/CTNポスドク研究員賞の支援を受けている。JP-Rは、McGill大学血液・腫瘍学分野のLouis Lowenstein Chair、McGill大学保健センターのWilliam Turner awardホルダーである。
利益相反
著者らは、利益相反の可能性があると解釈されるような商業的または経済的な関係がない状態で研究が行われたことを宣言している。
