Contents
Sex hormones, autoimmunity and gender disparity in COVID-19
pubmed.ncbi.nlm.nih.gov/33903964/
公開:2021年4月26日
Hussain Ahmed Raza, Parikshit Sen, Omaima Anis Bhatti & Latika Gupta
Rheumatology International (2021)Cite this article
概要
新型コロナウイルス019(COVID-19)パンデミックは、大量かつ広範な死亡率に大きく寄与した。疫学データによると、COVID-19の臨床転帰には性差があり、女性の方が感染率や入院率が低く、予後も良く、死亡率も低いことが強く示唆されている。この格差は、自然免疫反応と適応免疫反応の違い、遺伝的要因、性ホルモンと免疫エフェクターの相互作用、さらには性別による行動の違いなど、いくつかのメカニズムによって説明できる。これらの経路、特にウイルス感染に対する免疫学的分岐は、COVID-19の病因や疾患経過だけでなく、抗ウイルス剤やワクチンへの反応にも影響を及ぼす可能性がある。さらに、COVID-19に対する防御的優位性をもたらす要因を利用して、COVID-19の臨床結果を改善するための治療戦略を開発できるかもしれない。
はじめに
新型コロナウイルス019(COVID-19)パンデミックは、発生から 2年目を迎えた現在も、世界中で罹患率や死亡率の高い原因となっている。中国の武漢で発生した初期の人口統計では、女性に比べて男性の死亡率が高いことが示されていたが、COVID-19の重症度と臨床転帰に性差があることを報告した多くの疫学研究によって、さらに裏付けられた[1]。
中国疾病予防管理センターは、中国の72,314人の患者から算出したCOVID-19感染者の男女比は2.7:1,症例死亡率(CFR)は女性の1.7%に対して男性は2.8%であることを報告している[2, 3]。これは、COVID-19による女性の死亡者数10人に対して男性の死亡者数が14人であるというGlobal Healthの50/50性差データからも裏付けられている。38カ国で行われた疫学調査では、男性の平均CFRは女性の平均CFRの1.7倍であり、年齢の上昇は男女ともに死亡のリスク要因であると報告されている[4, 5]。ヨーロッパの研究では,20歳以上の男性で症例死亡率が高いことが報告されており,イングランドの1700万人の成人を対象としたコホート研究では,男性の性別とCOVID-19関連の死亡リスクに有意な相関関係があることが示され,ハザード比は1.59であった[4].結論として、現在の疫学的証拠は、SARS-CoV-2感染とCOVID-19による重篤な臨床転帰の両方において、男性に偏りがあることを示唆している。これは気になることではあるが、以前に重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)のパンデミックでも同様の性差が観察されていることから、当然のことである[6, 7]。リウマチ患者のCOVID-19に関するデータを収集した欧州リウマチ連盟(EULAR)のCOVID-19登録では、COVID-19患者6155人のうち4018人(65%)が女性であったという例外的な結果が出ている。しかし、女性ではリウマチの発症率が高いことがよく知られているため、このことがサンプル集団の偏りにつながり、一般集団からのサンプルとは対照的に、女性のリウマチ患者でより多くのCOVID-19が観察されることになる可能性がある[8]。さらに、本研究のデータによると、65歳以上の男性は、炎症性リウマチおよび筋骨格系疾患(RMD)患者におけるCOVID-19入院の単一の最も重要な危険因子であることが確認されている[9]。
女性のCOVID-19疾患の重症化に対する固有の予防効果の生理学的根拠は、COVID-19のより良い管理のための治療的介入を開発するために利用できる可能性がある。この総説では、遺伝、行動、ホルモン、および免疫反応における性差を調査し、COVID-19の臨床結果および死亡率に見られる性差のもっともらしい説明を提案する[10]。
検索方法
文献調査は、Gasparyanらによるレビューの推奨事項に従って実施された[11]。PubMed,MEDLINE,EMBASE,ClinicalTrials.gov,SCOPUSの各データベースを用いて,”sex differences OR sex disparity OR gender differences OR gender bias “と “COVID-19 OR SARS-CoV2 OR SARSCOV-2 OR novel coronavirus OR nCOV “のキーワードで検索を行った。約1500件の論文が確認され、2021年3月26日までに発表された症例報告、ケースシリーズ、編集者への手紙、観察研究からナラティブレビュー、システマティックレビュー、臨床試験まで多岐にわたった。関連する論文を独自にレビューし、以下の異なるカテゴリーに該当する情報を抽出した。;免疫反応の性差、免疫反応における性ホルモンの役割、COVID-19の感染症と転帰の性差、COVID-19と血栓症、COVID-19と妊娠、COVID-19と自己免疫、ワクチン反応の性差。
免疫反応の性差
女性は本来、ウイルス感染に対してより強い自然免疫反応と適応免疫反応を起こすことが知られている。また、女性の方がウイルスの排出が早く、ウイルス量が少ないことも報告されている。しかし、このような免疫反応の増強により、女性は炎症性疾患や自己免疫疾患にかかりやすくなる[12]。
自然免疫
貪食反応
女性の好中球とマクロファージは、一般的に活性化と貪食活性が高くなる。また、女性の樹状細胞は、TLR-7とタイプ1-IFNの反応が高い [13]。この結果、感染の初期段階では、女性は速やかにウイルスを感知し、抗ウイルス反応を起こすと考えられる。
サイトカイン
注目すべきは、女性の方がより強固な免疫反応を示しているにもかかわらず、COVID-19を発症した男性では、ベースラインでは特にIL-8とIL-18,疾患経過ではCCL5のレベルが上昇していることである。このような炎症性サイトカインのプロファイルは、COVID-19の重篤な転帰と強く相関しており、炎症の緩和が逆効果になる可能性が示唆された[14]。興味深いことに、これらのサイトカインレベルは、CD14,CD16+非classical単球のレベルも高かった。同様に、女性では、ウイルス感染における炎症性のIL-6の産生が男性よりも低く、炎症が抑えられているためか、COVID-19の良好な転帰と相関している[15]。
適応免疫
T細胞
女性のCD4+およびCD8+ T細胞は、ウイルス感染に対してより強固な反応を示する[16]。Yale大学の研究では、疾患が悪化した男性では、女性に比べてT細胞レベルが低いことが報告されている。さらに、活性化されたCD8 T細胞の数は、女性の方が有意に多かったのである[14]。T細胞の活性化が高まれば、女性の抗ウイルス適応免疫反応が向上し、ウイルスのクリアランスが大きくなる可能性がある。
B細胞と体液性免疫
また、女性の方が高い抗体価を産生する傾向があり、この抗体は循環体内に長く留まるため、COVID-19感染に対する防御効果が長続きする [14]。
刺激的な出来事に対する両性の反応方法におけるこのような原始的な違いは、両性の遺伝子構造そのものの違いや、性ホルモンをはじめとする他の潜在的な要因との相互作用に根ざしているのかもしれない。
SARS-CoV-2に対する免疫反応の違いを決定づける要因
性染色体の遺伝子
免疫関連遺伝子
女性のX染色体上の免疫調節遺伝子が二重に過剰発現している可能性があることから、ウイルス感染やワクチン接種に対する女性の反応がより強固であることが説明でき、COVID-19に対する追加的な防御効果をもたらす可能性もある[17]。
エンドソームのToll様受容体7(TLR7)は、ウイルス抗原の認識と効果的な抗ウイルス免疫反応の形成に関与する重要な因子である[18, 19]。X染色体上に位置するTLR-7遺伝子の発現が女性で増加することが報告されているが,これはTLR-7遺伝子がX染色体の不活性化から逃れることができるためである。急性HIV-1感染に反応する形質細胞様樹状細胞(pDC)によるTLR-7駆動のIFN-α産生量は、男性に比べて女性の方が多いことが報告されている[18,19,20]。COVID-19による重篤な呼吸器合併症を発症した若年男性患者4名のケースシリーズでは、TLR7遺伝子のまれな機能不全変異体が発見され、I型およびII型IFN応答の両方に悪影響を及ぼしていた[21]。TLR-7の発現が増加すると、女性ではサイトカインの産生が増加し、ウイルスのクリアランスが早くなる可能性がある。今回のパンデミックでは、男性にいくつかの多型が確認されたが、これまでは一般的な無害な潜在的一次免疫不全と考えられてたが、現在では、生命を脅かすCOVID-19の素因におけるジェンダーバイアスの基盤となっている可能性がある[4, 5]。
SARS-CoV-2に対する免疫反応の性差には、他の遺伝子も関与している可能性がある。これらの遺伝子には、インターロイキン、FOXP3,XIST、TLR-8などをコードするX連鎖遺伝子が含まれ、これらの遺伝子はバイアル発現により女性で同様に発現が増加する可能性がある。また、Y連鎖遺伝子(SRYとSOX9)は男性で発現が増加するため、男性に比べて女性の方がウイルス量が少なく、炎症が少ないことにも貢献している可能性がある[22,23,24,25,26,27,28,29]。表1は、免疫反応の性差に関与すると考えられる遺伝子とその機能をまとめたものである。
表1 SARS-CoV-2に対する免疫反応の性差に影響を与える可能性のある遺伝子
| 遺伝子 | 関数 |
|---|---|
| X連鎖遺伝子 | |
| ACE-2 | SARS-CoV-2スパイク(S1)タンパク質の受容体、抗酸化剤、抗炎症剤 |
| インターロイキンの遺伝子、例えばIL-2RG遺伝子(インターロイキン受容体共通ガンマ鎖タンパク質をコードする) | 免疫応答の調節に関与するサイトカイン |
| FOXP3,XIST | 制御性T細胞(Treg細胞)の機能に関与する転写因子 |
| TLR-8 | 自然免疫の活性化に関与するエンドソームパターン認識受容体(TLR-8はSARS-CoV-2 ssRNAに結合し、MyD88を動員し、NF-κBを活性化する) |
| Y染色体連鎖遺伝子 | |
| TMPRSS2 | SARS-CoV-2の侵入を促進する |
| SRY、SOX9 | ウイルス感染に対する免疫応答に関与するタンパク質をエンコードする |
ACE-2
アンジオテンシン変換酵素2(ACE-2)受容体は、SARS-CoV-2が標的細胞(主に肺胞2型肺細胞)にウイルス侵入する際の受容体として機能し、COVID-19の疾患発症に大きな役割を果たしている[30]。しかし、ACE-2受容体は、活性型のアンジオテンシンIとIIをそれぞれアンジオテンシン1-9と1-7に変換して不活性化し、COVID-19の際に肺水腫が発生する可能性を減少させるため、臓器保護にも重要な役割を果たしている[31, 32]。このことから、ACE-2の発現が増加すると、COVID-19の病原体の血管として機能しているにもかかわらず、女性のCOVID-19の重篤な臨床結果に対して明らかな逆説的な保護効果がもたらされることが説明できるかもしれない。
ACE-2受容体遺伝子のX染色体(Xp22.2)上の位置は、女性ではX不活性化を免れるようになっている[33]。このため、女性の2型肺細胞ではACE-2受容体の発現が増加し、SARS-COV-2受容体結合ドメインに結合されていないACE-2受容体がアンジオテンシンIIを触媒的に切断し、肺水腫に対する保護機能を発揮すると考えられている。男性ではこの二重発現がないため、アンジオテンシンIIを切断するのに十分な遊離のACE-2受容体が得られず、その結果、保護効果が低下すると考えられる。
性ホルモン
ジェンダーバイアスのもう一つのもっともらしいメカニズムは、男女間の明らかな性ホルモンの違いと、その自然免疫と適応免疫への影響である。テストステロンのようなアンドロゲンは免疫抑制作用があることが知られているが、エストロゲンはその性質がより多彩で、その濃度、分布、受容体の発現に基づいて、免疫反応を亢進させたり低下させたりする傾向がある[34]。
エストロゲンの役割
エストロゲン受容体ERαとERβは、異なるリンパ系細胞に存在し、その成熟と制御に関与している。エストロゲンは、単球/マクロファージの動員、サイトカインおよび抗原提示の調節に役割を果たすことが知られている。また、エストロゲンは、その受容体シグナルを介して、パターン認識TLRを介した形質細胞性樹状細胞による抗ウイルスIFN-αなどのサイトカインの産生を促進することが示されている[34,35,36]。
SARS-CoVパンデミックの際、男性の死亡率が高かったという同様の傾向に基づき、雄のモデルマウスでは、ウイルス量の増加が報告されており、これはSARS-CoVの重篤な感染症に対する感受性の高さと相関していた。さらに、卵巣摘出やエストロゲン受容体拮抗薬の投与を受けた雌マウスでは死亡率の上昇が見られ、SARS-CoV感染におけるエストロゲンシグナルの保護的役割が示唆された[37]。したがって、COVID-19感染症においても、エストロゲンの同様の保護的役割が存在する可能性があると思われる。
中国の武漢で行われたCOVID-19患者を対象とした断面多元研究では、閉経前の女性は同年齢の男性と比較してCOVID-19の重症度が軽く、予後も良好であることが示された。さらに、非重症の患者では、E2と抗ミュラーリアンホルモンが高いことが判明した。また、E2の高値は、IL-2,IL-6,IL-8,TNF-αの低値と相関しており、ホルモン軸と免疫軸の相互作用が示唆された[35]。また、エストロゲンは、CD16を直接変化させることにより、活性化マクロファージからの炎症性サイトカインIL-12やIL-6の産生を抑制することが示されている[35]。このことは、COVID-19に関連したサイトカインストーム症候群の予防にエストロゲンが関与している可能性を示している。
さらに、エストロゲンは、ACE-2受容体をダウンレギュレートすることが報告されている。最近の試験管内試験実験では、17β-エストラジオール(E2)を投与した正常ヒト気管支上皮(NHBE)細胞では、コントロールと比較してACE-2 mRNAの発現が減少したが、TMPRSS2には影響がなかったことから、女性では、SARS-CoV-2ウイルスが作用できるACE-2のレベルが低い可能性が示唆された。しかし、この研究は、1人の女性ドナーから採取したNHBE細胞を用いて、わずか4回の実験を繰り返しただけであり、使用したエストロゲンの濃度は、妊娠中の血漿中のエストロゲン濃度と同程度であった。現在の文献では、妊娠とCOVID-19による重篤な転帰のリスク低下との間に有意な関連性は報告されておらず、また、SARS-CoVパンデミック後に実施された過去の研究では、ACE-2受容体の発現に男女差はないと報告されていることから、エストロゲンがACE-2の発現に及ぼす影響と、COVID-19に対する免疫反応に見られる相関性のある男女差を明らかにするためには、さらなる研究が必要である。[38,39,40].
テストステロンの役割
テストステロンには一般的な免疫抑制作用があり、これがSARS-CoV-2感染症の病状が男性の方が重症化しやすいことの説明になるかもしれない。アンドロゲンが免疫系を抑制する正確なメカニズムはまだ不明だが、テストステロンがTH2細胞やTh17細胞の機能を抑制し、適応免疫反応に影響を与えているのではないかと推測されている[41, 42]。いくつかの研究では、テストステロンがIFNγやTNF-αなどのサイトカインの産生を抑制し、IL-10などの抗炎症性サイトカインを増加させる可能性が示されている[43]。また、テストステロンは、SARS-CoV-2のウイルス侵入を促進するTMPRSS2の発現を積極的に調節する役割も果たしている可能性があり[44]、女性に比べて男性のCOVID-19の発症率や死亡率が高い要因となっている可能性が示唆されている。一方、イタリアで行われたCOVID-19患者31人のコホートを対象とした研究では、ベースライン時の総テストステロン値および遊離テストステロン算出値の低下は、臨床症状の悪化と相関し、好中球の増加およびリンパ球の減少とも有意に関連していた[45]。このことは、男性において、テストステロンのレベルが低いと、重度の感染症のリスクが高まる可能性があることを示唆している。
科学的証拠はまだ決定的ではなく、COVID-19における性ホルモンの影響に関する情報はまだ進化しているが、COVID-19に罹患した男性の免疫力を向上させるためのエストロゲン試験には大きな可能性があると思われる。表2は、COVID-19の管理に関する進行中の試験の一覧である。
表2 エストロゲン、プロゲステロン、アンドロゲン、アンドロゲンブロッカーを用いたCOVID-19の管理に関する進行中の試験
| シリアルナンバー | 題名 | 設計 | 介入と投薬 | 状態 | 国 | Clinicaltrial.gov識別子 |
|---|---|---|---|---|---|---|
| 1 | 非重症COVID-19患者におけるエストロゲン療法:三次病院で提案された治療計画 | 介入的、ランダム化/非盲検対照試験 | ノルレゲセトロミン6mg /エチニルエストラジオール0.60mgを含むEVRA皮膚パッチ(21日間毎週1パッチが配置される) 対照群は従来のCOVID-19治療を受ける |
まだ募集していない | メキシコ | NCT04539626 |
| 2 | 初期のCOVID-19における選択的エストロゲン調節とメラトニン | 介入的ランダム化二重盲検プラセボ対照試験フェーズ2 | アクティブコンパレーター(トレミフェン+メラトニン)は、1日目と2日目に100mgの経口メラトニン(朝に40mgと夕方に60mg)3〜14日目に60mg(朝に20mgと夕方に40mg)および毎日60 mgの経口トレミフェン1〜14 アクティブコンパレーター(メラトニン+プラセボ)は、 1日目と2日目に100 mgの経口メラトニンを服用するように指示される(朝に40 mg、夕方に60 mg )および3〜14日目に60 mg(朝に20 mg、夕方に40 mg) プラセボコンパレーター(プラセボ):経口プラセボは、介入と同じ数と外観でピルに使用される |
まだ募集していない | 米国 | NCT04531748 |
| 3 | COVID19 +および推定COVID19 +患者におけるCOVID19感染の重症度を軽減するためのエストラジオールの第II相臨床試験 | 介入的、ランダム化オープンラベル対照試験フェーズ2 | 実験群は皮膚に適用された経皮パッチを通して7日間エストラジオール100μg/日を 受け取る対照群は介入を受けない |
採用 | 米国 | NCT04359329 |
| 4 | イソトレチノインとタモキシフェンの併用療法は、重症急性呼吸器症候群コロナウイルスに対する完全な保護を提供すると期待されている | 介入的ランダム化オープンラベル対照試験フェーズ2 | アクティブコンパレーター:13シス-レチノイン酸の経口投与とタモキシフェンの経口投与 80人の感染患者はタモキシフェン20 mgを1日2回14日間経口投与され、タモキシフェンを3日間服用した後、感染患者は13シス-レチノイン酸(0.5 mg / kg /日、2回に分けて14日間経口投与 アクティブコンパレーター:エアロゾル化された13シス-レチノイン酸投与量とタモキシフェン経口投与 80人の感染患者はタモキシフェン20mgを1日2回14日間経口投与され、タモキシフェン療法の3日後に感染患者はエアロゾル化された13シスを受け取る-レチノイン酸を2回に分けて段階的に0.2mg / kg /日から4mg / kg /日に増加、13シス-レチノイン酸の吸入療法を14日間 対照群はイソトレチノインまたはタモキソフィエン治療を受けない |
まだ募集していない | エジプト | NCT04389580 |
| 5 | 2019年コロナウイルス病患者の罹患率を低下させるためのエンザルタミド治療の前向き多施設ランダム化第II相臨床試験(COVID-19) | 前向き、ランダム化(2:1)非盲検、多施設、臨床対照試験 | 実験群は4×40mgのエンザルタミド錠を1日1回最大5日間経口投与し、入院中のみ投与し、侵襲的人工呼吸を開始した場合または退院時に中止する 対照群はエンザルタミドを投与しない |
採用 | スウェーデン(多中心) | NCT04475601 |
| 6 | 入院中の男性におけるCOVID-19の治療のためのプロゲステロンの安全性と有効性に関する単一施設のランダム化比較試験 | 介入的、ランダム化オープンラベル対照試験フェーズ1 | 実験群:プロゲステロン100 mgは、施設の標準治療に加えて、1日2回5日間皮下投与される。 対照群は、施設の標準治療のみを受ける。 |
アクティブ、募集していない | 米国 | NCT04365127 |
| 7 | テストステロンとジヒドロテストステロンの臨床的役割と、COVID-19患者(両刃の剣)でどちらを抑制すべきか? | 介入的ランダム化オープンラベル比較第4相試験 | 実験群はエアロゾル化された13シス-レチノイン酸と吸入テストステロン を受け取る対照群は標準治療を受ける |
まだ募集していない | エジプト | NCT04623385 |
| 8 | 膜貫通プロテアーゼであるセリン2(TMPRSS2)の間接阻害を介してCOVID-19患者を治療するため の13シス-レチノイン酸とカプトプリル のエアロゾル併用療法の有効性 | 介入的ランダム化(1:1:1)プラセボ対照、概念実証第2相試験 | 実験群:感染患者がエアロゾル化13の受信するシス緩やか一つに-レチノイン酸が0.2ミリグラム/ kg /日吸入13のとして/ kg /日から4日ごとに増加する用量シス噴霧によって14日間-レチノイン酸療法プラス吸入投与カプトプリル25mgを14日間 偽の比較器:感染した患者はCOVID-19の標準治療を14日間受ける |
まだ募集していない | エジプト | NCT04578236 |
| 9 | COVID-19の抗アンドロゲン治療 | 前向き、介入、プラセボ対照、二重盲検、ランダム化並行割り当て試験 | 実験:プロキサルトアミド+標準治療 プロキサルトアミド(200 mg qd)+標準治療 アクティブコンパレータ:標準治療 |
採用 | ブラジル | NCT04446429 |
COVID-19の症状における性別による違い
男性では死亡率の上昇が認められるだけでなく、罹患率も不相応に高く、罹患率が上昇する年齢が高くなるにつれて、男女間の臨床転帰の差は狭まっていく。
COVID-19における血栓症
COVID-19で観察された死亡率は、凝固障害や血栓イベントに起因する可能性がある。ある剖検シリーズでは、肺血管の微小血管血栓症が観察され、12人の患者のうち7人が深部静脈血栓症を患っていたが、別の研究では重症患者の69%に静脈血栓塞栓症が見られた[46]。イタリアの単一施設での研究では、入院患者の8%に血栓塞栓症が発生したと報告されている[47]。同様に、TangらはCOVID-19を使用した非生存者の71.4%にovert-DICを報告しており、非生存者群の76%は男性でした[48]。男性と女性の間の生理学的な違いは、女性におけるCOVID-19関連の凝固障害のリスク低下をもたらす血栓塞栓症に対する本質的な保護メカニズムへの洞察を提供し、結果として女性の死亡率を低下させる可能性がある。
COVID-19関連の凝固障害は、疾患経過中の炎症性サイトカインの上昇、アンジオテンシンIIレベルの上昇、凝固性の亢進、血小板機能障害によって説明される可能性があり、年齢や高血圧などの既存の併存疾患が主要なリスク因子となる[49]。
女性では、エストロゲン依存性、NOおよびプロスタサイクリン非依存性の好中球の動員および内皮細胞への血小板の接着の抑制が、白血球の動員を促進する接着分子であるP-セレクチンのエストロゲンを介した発現低下を介して顕著に見られることが報告されている[50]。さらに、血小板受容体のシグナル伝達、膜の組成、栄養素(特に多価不飽和脂肪酸とフラボノイド)に対する反応、凝集性、血小板数などの血小板生物学における性差や、女性の動脈硬化性プラーク形成に対する保護効果をもたらすトロンボキサンA2,プロスタサイクリン、セロトニンの放出などから、女性の凝固病関連死亡率の低下を説明できるかもしれない。
COVID-19と自己免疫
COVID-19の重篤な症例に見られる血栓促進状態とびまん性凝固障害は、自己抗体が引き金となって炎症や血栓の経路が活性化されることによる抗リン脂質症候群(APS)の致死的な多臓器不全と類似している。多くの研究が、COVID-19による凝固障害と、COVID-19患者の血清から検出された抗リン脂質(aPL)抗体との相関関係を推測している[51]。以前、SARS-CoV感染症に関するいくつかの研究でも自己免疫反応が認められており、一般的にウイルス感染症は一過性のaPL抗体の産生を引き起こすことが知られている[52]。Zhangらは、COVID-19の重症患者66名のうち47%にaPLが認められ、そのうち最も多かったのがIgA抗β2GPI抗体であったと報告している[53]。先行研究では、Zhang らは 3 人の重症 COVID-19 患者に多発性梗塞と凝固障害を報告しており、これらの患者は抗β2 グリコプロテイン I IgG および IgA 抗体と抗カルジオリピン IgA 抗体にも陽性であった[54]。COVID-19患者172人のコホートにおいて、Zuoらは8種類のaPL抗体の変異体を分離し、サンプルの52%に少なくとも1種類の抗体を確認したが、aCL IgM、aPS/PT IgG、aPS/PT IgMが最もよく検出された。臨床的には、これらの自己抗体の濃度が高くなると、血小板数の増加や腎機能障害、呼吸器合併症とともに、NETosisと呼ばれるプロセスでの好中球細胞外トラップ(NET)形成を含む著しい好中球の活性化が認められた。最近、SARS-CoV-2によるヒトのリンパ球におけるNETosisの活性化が、好中球における活性酸素種(ROS)の増加と関連しているプロセスであることが初めて明らかになった。このNET-ROS経路は、COVID-19の最も厄介で深刻な合併症の一つである広範囲の微小血栓形成に関与している可能性がある。さらに、Zuoらは、マウスモデル研究において、これらの患者からのIgGが静脈血栓症を促進することを報告している[51, 55]。
これらの知見は、自己抗体がCOVID-19関連の凝固障害の病因に関与している可能性を示唆している。自己抗体は、すでに存在する全身の炎症や血栓促進状態を増強し、結果的に本疾患の重症化につながる。また、自己免疫疾患は女性に多いことが知られている[56]。COVID-19における自己免疫の正確な基盤と、COVID-19感染の性差への影響を明らかにするには、さらなる調査が必要である。
COVID-19と妊娠
COVID-19に関する最新のデータによると、妊娠中の女性は非妊娠中の女性や一般の人々と同様に重篤な疾患に罹患するリスクに直面していることが示唆されている[57, 58]。それとは逆に、過去に発生したSARSやMERSでは、妊娠中の女性は、産科的転帰の悪さや早産のリスクなど、重大な罹患率や死亡率を受けることが判明している[59, 60]。一般的に妊婦は、妊娠中に起こる生理的な心肺機能や免疫力の変化のため、感染症にかかりやすいと言われている。妊娠中の細胞介在性免疫反応にはTh2システムが存在するため、ウイルス感染症に対する脆弱性が高くなる。COVID-19の場合、すでに肺機能が変化しているため、肺の圧迫や呼吸不全を起こすリスクが高くなる[61]。さらに、妊娠中の血栓促進状態は、COVID-19に関連した凝固障害による重大な罹患につながる可能性がある[62]。COVID-19を発症した妊娠中の女性の致死率は、生殖年齢の女性の致死率と平行しているようであるが、重篤なCOVID-19の後遺症を報告した症例もある[39]。米国疾病管理センターによると、妊婦は非妊婦に比べてより多くの集中治療室への入室を必要とし、多くの場合、人工呼吸を必要としている[63]。胎児の合併症では、早産が最も多く見られるが、長期的な胎児の合併症はまだ見られていない[59]。
感染症の性差パターンとワクチンの反応
感染症の罹患率や転帰、ワクチンの有効性について、性差による格差が広く研究・報告されている[15, 64]。2003年に発生したSARSでは,男性の方が女性よりも致死率が高く,MERSでも同じような傾向が見られた[6].HIV感染症では,女性の方がCD4+数が多く,CD8+T細胞の活性化が強いにもかかわらず,ウイルス量が低いことが示されているが,これは生得的なウイルス感知能力の向上とIFNαの産生が関係していると考えられている[20].同様に、B型肝炎では、男性の方がHBV DNA量が多く、肝細胞がんになりやすいことが報告されているが、このことは、テストステロン濃度や特定のアンドロゲン受容体遺伝子と正の相関があるとされている[65, 66]。さらに、成人と小児の両方において、女性は男性に比べて抗HBV抗体価が高いことがわかった[16]。一方、A型インフルエンザウイルスへの曝露率は男性の方が高いが、致死率は若い女性の方が高いことが報告されている[67]。しかし、女性はA型インフルエンザワクチンに対してより強い抗体反応を示する。これは、TLR7の発現量が多いことと、エストラジオールによるB細胞の誘導によって調節されている可能性がある[64]。したがって、いくつかの研究では、女性はワクチンに対してより効果的な反応を示す傾向があると結論づけられているが、COVID-19に関するこの疑問に答えるのはこれからである。
行動的リスク因子と社会的構成要素
男女間の死亡率に明らかな差があるのは、行動上の危険因子の性差も一因となっている可能性がある。COVID-19では、喫煙は重症度の高さと関連しており、ACE-2の発現量の高さとも関連している。喫煙は男性に多く見られるため、男性の臨床的予後を悪くする可能性がある[68]。また、女性は男性よりも多くの医療サービスを利用し、より良い衛生習慣を採用する傾向があるという研究結果もある[69]。パンデミック発生時に米国で行われた調査では、成人男性は、社会的距離を置く、マスクを着用するなどの行動変化を観察する決意が弱く、COVID-19による心配や懸念も少なかったと報告されている[70]。このことが、男性におけるCOVID-19の感染しやすさの一因となっている可能性がある。
私たちの国を含む世界の多くの地域では、女性に比べて男性は外で働き、公共交通機関を利用して移動し、集会型の宗教儀式などの大規模な集まりに参加する傾向が強く、必然的に曝露のリスクが高くなるため、感染のリスクが高くなると考えられる。しかし、特に社会経済的に恵まれていない環境では、女性は病院の受診が遅れたり、不十分な治療を受けなければならなかったりと、男女間で医療を受ける権利や医療サービスへのアクセスに関する自律性に格差が生じているため、社会的な構造や規範を調査する必要がある。
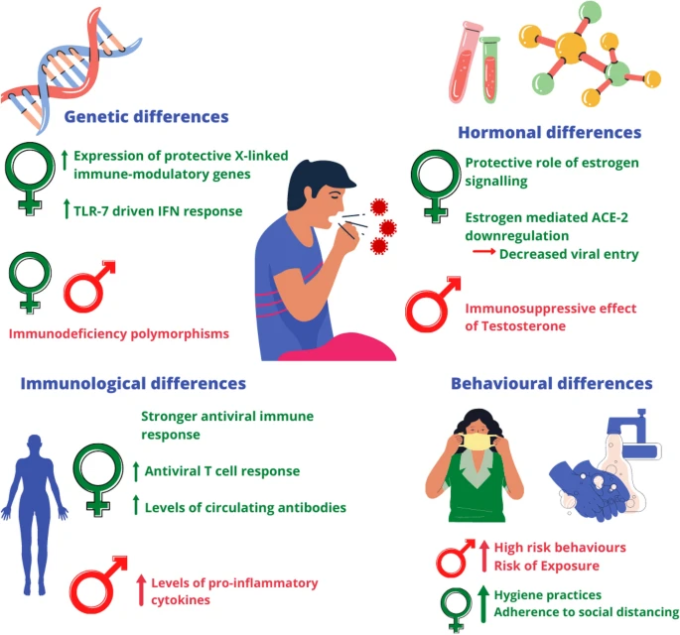
性別に特有の行動の違いは、COVID-19のセックスバイアスにはあまり貢献していないようである。生理学的には、性ホルモンと免疫エフェクターの相互作用が、主に感染症に関する男女間の差異をもたらしている。Guerra-Silveiraらは、病気の曝露-有病率の違いにつながる性に関連した行動の違いは、SchistosomiasisとLeptospirosisでのみ有意であると報告しているが、大多数の病気では、病気の発生率と重症度の格差は、男女間の生理学的な違いと密接に関連しているとしている。本研究では、主に結核やデング熱などの細菌・寄生虫感染症の疫学を調査したが、これらの高罹患率疾患の疾患疫学モデルを外挿することで、同じく高罹患率疾患であるCOVID-19の発症率や臨床転帰における性差を説明することができる[71]。図1は、COVID-19で観察された性差に影響を与える要因をまとめたものである。
図1男性におけるCOVID-19の転帰および死亡率の重症化に寄与する因子
結論と将来への示唆
世界的なデータによると、COVID-19の臨床転帰には性別による格差が存在し、男性の方がSARS-CoV-2の初感染、入院、臨床転帰の悪さの影響を受けやすいことが強く示唆されている。この性差は、感染症や炎症性疾患に対する免疫反応にも同様に存在する。
その要因としては、自然免疫と適応免疫の本質的な違い、男女間の免疫制御遺伝子の発現に関する遺伝的な違い、性ホルモン間のクロストークの役割、性別特有の行動の違いなどが考えられる。これらの違いは、COVID-19に対する女性の防御的優位性をもたらし、男性に比べて女性はウイルス量が少なく、炎症が少なく、臨床結果が良好で、死亡率が低いことが一貫して報告されている。
これらの違い、特にウイルス感染に対する免疫学的な差異は、COVID-19の病気の経過や、抗ウイルス剤やワクチンに影響を与える可能性がある。さらに、COVID-19に対する防御をもたらすこれらの免疫学的要因を利用して、臨床転帰を改善するための治療戦略を開発できるかもしれない。
