Contents
Severe Acute Respiratory Syndrome Coronavirus 2 and Male Reproduction: Relationship, Explanations, and Clinical Remedies
www.ncbi.nlm.nih.gov/pmc/articles/PMC8079781/
オンラインで2021年4月14日に公開
Jia Xu, Liting He, Yuan Zhang, Zhiyong Hu, Yufang Su, Yiwei Fang, Meilin Peng, Zunpan Fan, Chunyan Liu, Kai Zhao,* and Huiping Zhang*.
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とするコロナウイルス感染症2019(COVID-2019)は,現在進行中のパンデミックであり,世界的な公衆衛生上の緊急事態であるため,世界中で注目されている。COVID-19の病態は、男性の生殖に深く関わる精巣特異的な細胞であるライディッヒ細胞、セルトリ細胞、精子形成細胞などのアンジオテンシン変換酵素2(ACE2)発現細胞に感染することが特徴である。これにより、免疫系が異常に亢進し、感染した臓器にダメージを与えることになる。このように、免疫反応がコントロールされずに精巣機能が低下すると、男性不妊症が注目される。一方、最近の臨床データによると、SARS-CoV-2がヒト精巣に感染すると、男性の生殖細胞の発達が損なわれ、生殖細胞の損失や免疫細胞の浸潤が生じる可能性がある。この総説では,SARS-CoV-2感染に伴う男性生殖機能障害の証拠を調べ,その免疫学的説明と臨床的治療法の可能性を検討した。
キーワード
SARS-CoV-2, COVID-19, 男性生殖, 免疫学, ウイルス性睾丸炎
はじめに
人獣共通感染症であるコロナウイルスは 2003年の重症急性呼吸器症候群(SARS)(Cinatl et al 2003)や2012年の中東呼吸器症候群(MERS)(Zumla et al 2015)の発生後、再び世界的なニュースの最前線に登場している。今回、新たに発見されたコロナウイルスの仲間であるSARS新型コロナウイルス(SARS-CoV-2)(Wu er al 2020)が、アメリカ、カナダ、日本、シンガポール、オーストラリア、フランス、スペイン、ドイツ、イギリス、インド、イラン、イタリア、アフリカなど多くの国や地域で急速に患者数を増やし、パンデミックを起こしていることが明らかになった。このような状況は、世界保健機関(WHO)を驚かせ、深刻な公衆衛生上の問題となった。そのため、WHOは「コロナウイルス感染症2019」(COVID-2019)をパンデミックに分類した。しかし、この致命的な疾患に対する宿主の免疫反応についての理解が限られているため、効果的な治療法を特定する努力が妨げられている。現在(2021年1月8日)までに、全世界で3,700万人の確定症例と100万人の死亡者が報告されている(世界保健機関 2020a)。中国などの臨床データによると、COVID-19の一般的な症状は、発熱、乾いた咳、疲労であり(Wang D. et al 2020)80%の患者は軽度から中程度の症状を示すか、無症状に見えるが、15~20%の患者は重度の症状を示すことが示されている(Huang et al 2020a; Xu et al 2020; Young et al 2020)。そのため、症状の軽い未検出者の実数は公式データよりも多くなる傾向があり、感染がコントロールできなくなる可能性があるのである。
簡単に説明すると、SARS-CoV-2は、コロナウイルス科に属し、ベータコロナウイルス属属に属し、典型的には哺乳類のみに感染する(Zumla et al 2015)。SARSコロナウイルス(SARS-CoVs)やMERSコロナウイルス(MERS-CoVs)など、他のヒト病原性コロナウイルスもベータコロナウイルス属である。最近発表されたSARS-CoV-2の塩基配列によると、SARS-CoV-2はSARS-CoVとの相同性が高く、ゲノムの約79%を共有していることがわかった(Wan er al)。 SARS-CoVとSARS-CoV-2に共通する点は、ほとんどがコロナウイルスの免疫原性成分であり、同じアンジオテンシン変換酵素2(ACE2)受容体への結合に関与していることが明らかになった。これらの受容体は、SARS-CoVのエントリー受容体としてよく知られており、SARS-CoVがACE2を発現している細胞に感染する可能性を示唆している(Hoffmann et al 2020; Zhou et al 2020)。興味深いことに、これまでの研究では、ACE2がラット精巣のライディッヒ細胞、ヒト精巣のライディッヒ細胞およびセルトリ細胞(SC)に発現していることが報告されている(Douglas et al 2004;Xu et al 2006)。同様に、最近のバイオインフォマティクス解析により、ACE2は肺胞上皮細胞だけでなく(Zhao et al 2020)ラット精巣のライディグ細胞や、ヒト精巣のライディグ細胞およびSCにも高発現していることが明らかになった(Douglas et al 2004;Watermeyer et al 2006;Anguiano et al 2017)。注目すべきは、成人ヒト精巣のシングルセルRNAシーケンスデータから、ACE2のmRNA発現が生殖細胞と体細胞の両方に発現していたこと、不妊男性の精巣におけるACE2の陽性率が通常よりも高かったことから、SARS-CoV-2がACE2によって活性化される経路を介して生殖障害を引き起こす可能性があり、生殖障害のある男性がSARS-CoV-2に感染しやすい可能性があることを警告している(Shen er al)。 一方、精巣のライディッヒ細胞やSCは、精巣の機能や男性の生殖に密接に関係していることが知られている。中でも、SARS-CoV、ムンプスウイルス(MuV)ジカウイルス(ZIKV)などのウイルスは、ライディッヒ細胞に影響を与え、血液-精巣バリア(BTB)を破壊し、ウイルス性睾丸炎を形成して精巣上皮を破壊することが報告されている(Xu et al 2006;Govero et al 2016;Ma et al 2016;Wu et al 2016)。したがって、SARS-CoV-2の感染は精巣機能に影響を与え、男性生殖系の機能障害をもたらすのではないかと考えられた。
精巣における免疫特権
成体哺乳類の精巣は、構造的に異なる2つの領域、すなわち精管とその間の間質から構成されており(図1)それぞれ造精機能とステロイド産生機能を担っている。生理的条件下では、哺乳類の精巣はユニークな免疫環境、すなわち免疫特権を呈しており、生殖細胞は、アロ抗原だけでなく自己抗原からの免疫反応を含む内因性の免疫攻撃から保護されている(Hedger, 2015; Monika et al 2017)。精巣の免疫特権は、全身の免疫寛容、積極的な局所免疫抑制、および精巣の局所解剖学的構造の調整と相関している。もちろん、精巣の防御機構は、精巣の免疫特権を克服しなければならないときに、循環血液や泌尿器系から上昇してきた外因性の微生物病原体の侵入に対抗することも含まれることが示されている。しかし、HIVやMuVがヒトの精巣に感染して精巣障害を起こして男性不妊につながるように(Philip et al 2006,Garolla et al 2013年)全身の免疫細胞の蓄積や、精巣免疫寛容と精巣免疫反応の効果の間で局所的な免疫恒常性を乱すことによる過剰な免疫反応は、炎症性の男性不妊につながる可能性がある。ここでは、精巣の免疫特権の確立、維持、崩壊に相関するメカニズムのいくつかを紹介する。
図1 精巣の免疫微小環境における免疫特権の模式図
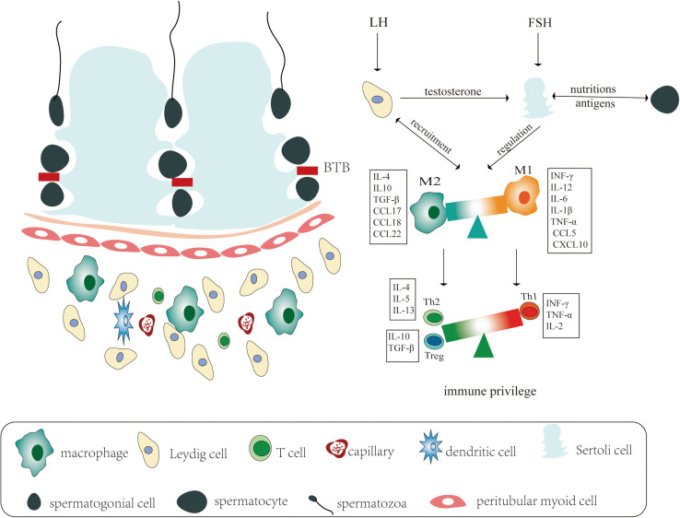
左:成体哺乳類の精巣は、構造的に異なる2つの領域、すなわち、精管と、精管間の間質空間から構成されており、それぞれ精子形成とステロイド形成の機能に対応している。精巣管は、セルトリ細胞に囲まれた様々な発生中の生殖細胞からなり、精巣間質は、ほとんどの種類の免疫細胞と精巣特異的なライディッヒ細胞からなる。右。生理的条件下では、哺乳類の精巣の免疫特権は、血液-精巣関門(BTB)間質性空間の免疫細胞、および精巣機能の内分泌調節と相関している。精巣の免疫環境は、ライディッヒ細胞に作用する黄体形成ホルモン(LH)とセルトリ細胞に作用する卵胞刺激ホルモン(FSH)によって調節されている。LHによる刺激に反応して、ライディッヒ細胞はテストステロンを産生し、成熟したセルトリ細胞の機能をサポートするのに必要である。ライディッヒ細胞は、マクロファージを間質組織にリクルートする役割を担っている。マクロファージは、機能的には、炎症促進作用(M1)と抗炎症作用(M2)の2つの異質な集団に分けられる。M2集団は、IL-4,IL-10,TGF-β、CCL17,CCL18,CCL22などのサイトカインやケモカインを産生することで、免疫特権を維持する免疫調節的な役割を担っているが、炎症時には、IFN-γ、IL-6,TNF-α、IL-1β、CCL5,CXCL10などのサイトカインやケモカインを放出することで、M1が炎症性免疫細胞を急激にリクルートすることが知られている。セルトリ細胞とマクロファージは、精巣を循環するリンパ球の発生を制御し、制御性T細胞(例えば、Th2細胞やT-reg細胞)の活性を促進し、Th1細胞の活性を抑制する。
セルトリ細胞と血液-精巣バリアー
セルトリ細胞は、精管の構造基盤を構成し、その内部には精子形成の全段階が存在する。また、全身および局所の精巣の炎症に見られる免疫抑制分子(Fallarino et al 2009,Zhao et al 2014)やトランスフォーミング成長因子β(TGF-β)腫瘍壊死因子α(TNF-α)アクチビン(De et al 1993年、Avallet et al 1994年、Meehan et al 2000)などの免疫抑制性サイトカインを産生することで、免疫応答を偏らせ、精巣の免疫特権を維持することができる。BTBは、隣接するSCをつなぐタイトジャンクションやギャップジャンクションなどの様々な接合部によって形成されており、生殖細胞を間質空間に存在する免疫細胞から分離し、免疫細胞がこれらの生殖細胞を認識するのを防いでいる。
精巣の間質細胞と免疫特権
ヒトの精巣は、精巣マクロファージ(TMφ)樹状細胞(DC)リンパ球などのほとんどの種類の免疫細胞と、精巣に特異的なライディッヒ細胞を含む様々な種類の細胞で構成されている。精巣マクロファージは、精巣の間質に存在する主要な細胞集団であり、正常な精巣では精巣の間質細胞全体の約20%を占める(Hedger, 2002)。生理的条件下では、TMφは炎症刺激に反応して低レベルの炎症性サイトカイン[TNF-αおよびインターロイキン12(IL-12)]を構成的に分泌することが報告されているが、免疫特権の維持にはIL-10などの抗炎症性サイトカインを多量に分泌することが必要であることがこれまでの研究で示されている(Gerdprasert et al 2002;Bhushan et al 2015)。特殊な条件では、TMφは動的な特性を持ち、炎症促進作用(M1)と抗炎症作用(M2)のいずれかに発展することができる。ウイルス感染時には、サイトカインシグナルや病原体の認識などの外因性シグナルにより、マクロファージの極性がM2からM1表現型へと推進されることが示されている。常駐するM2集団は、IL-4,IL-10,TGF-β、C-Cモチーフケモカインリガンド17(CCL17)CCL18,CCL22などのサイトカインやケモカインを産生することで、特にライディッヒ細胞の免疫特権や栄養機能を維持する免疫制御的な役割を担っていることが知られている。一方、急性および慢性炎症時には、M1炎症サブセットは、免疫細胞を感染部位に急激にリクルートし、サイトカインバランスを歪め、インターフェロンγ(IFN-γ)IL-6,TNF-α、IL-1β、CCL5,C-X-Cモチーフケモカインリガンド10(CXCL10)などのサイトカインやケモカインを放出して炎症反応を刺激することが報告されている(Gerdprasert et al, 2002; Mantovani et al 2004; Biswas and Mantovani, 2010; Geissmann et al 2010; Locati et al 2013; Murray et al 2014; Li et al 2019)。)
DCは、マクロファージの10分の1の量であり、通常、特に抗原提示に関与し、適応免疫を引き起こす食細胞として知られている。さらに、DCは、抗原に抵抗するT細胞を支援し、自己免疫反応を最小限に抑えるだけでなく、抗原特異的T細胞を活性化し、その結果、精巣において一連の自己免疫反応を開始し、免疫学的不妊症を引き起こす可能性がある(Rival et al 2006;Jacobo et al 2009)。
リンパ球は、全白血球細胞の10〜20%を占め、精巣リンパ球の大部分は、主にCD8+、CD4+、および制御性T(T-reg)細胞からなるT細胞である(Hedger and Meinhardt, 2000; De Rose er al)。 T細胞の大幅な増加は、精巣の炎症時に免疫バランスが乱れていることの特徴である。自己免疫関連の睾丸炎では、精巣のT細胞サブセットがT-reg細胞に偏っていることから(Jacobo et al 2009,2011年)精巣のT-reg細胞は強力な免疫抑制細胞であり、末梢の寛容性を促進し、精子抗原に対する寛容性と自己免疫性の反応を調整していることがわかる。その上、精巣の間質性空間内のリンパ球の数は、サイトカインを放出するマクロファージの集団の数と活性に密接に関係している(Hedger and Meinhardt, 2000)。
ライディッヒ細胞は、間質性細胞のもう一つの大きな割合を占めており、一般的に免疫細胞と密接に隣接している。ライディッヒ細胞の主な機能は、精子形成と精巣外アンドロゲン標的器官の両方のためにテストステロンを合成することである。さらに、ライディッヒ細胞は刺激を受けて免疫調節サイトカインを産生し、その結果、免疫細胞(最も可能性の高いマクロファージ)がリクルートされ、精巣における免疫のホメオスタシスが崩壊し、精子形成細胞の発達に影響を与える(Fijak et al 2011,Loveland et al 2017)。
内分泌による精巣機能と免疫恒常性の制御
ライディッヒ細胞で合成されるテストステロンは、自己抗原に対する全身および精巣の免疫反応を抑制することが報告されている(Cutolo, 2009; Fijak et al 2011; Avellar er al)。 さらに、テストステロンは、これらの細胞に発現するアンドロゲン受容体(AR)を介してSCに作用する可能性がある。SCにおける細胞特異的なARノックアウトのマウスモデルは、精巣の免疫特権の障害につながり、精子形成の停止につながることが実証された(Page et al 2006)。一方、睾丸に炎症性因子が存在すると、ライディッヒ細胞の機能にも影響を与え、睾丸炎が起こるとテストステロンの分泌にも影響を与える。また、別のホルモンである下垂体から産生される卵胞刺激ホルモン(FSH)も、SCの増殖を調節することが報告されており(Barakat et al 2008,Cannarella et al 2019,Meroni et al 2019年)SCは、一連のサイトカインを分泌することにより、マクロファージの精管への侵入を誘導し、精母細胞のアポトーシスを引き起こす(Wang et al 2013)。
重症急性呼吸器症候群新型コロナウイルスの精巣における免疫反応について
最近発表された研究では、COVID-19に感染した患者の免疫反応やサイトカインに関連した臨床症状を調べたものがいくつかある。一般に、SARS-CoV-2に感染すると、免疫反応が始まり、多くの種類の免疫サイトカインが放出される。制御不能な免疫反応、さらにはサイトカインストームや免疫脱落が観察された場合、患者はより重篤な症状を呈し、有害な組織障害が発生する可能性がある(Cao, 2020)。
ご存知の通り、精巣は精巣間質の免疫細胞に依存することで維持されている特殊な免疫器官である。そのため、SARS-CoV-2感染によるリンパ球減少や免疫脱落は、全身から精巣組織にリクルートされる免疫細胞の数を低下させ、精巣に存在する免疫特権と免疫抑制のバランスを崩す可能性がある。さらに、全身組織からのサイトカイン・ストーム、炎症性サイトカイン、ケモカインが精巣での免疫反応を引き起こし、精巣組織を破壊し、病原体に対する感受性を高める可能性もある。以上のことから、一つの残念な結論として、SARS-CoV-2の感染によって引き起こされる精巣機能の障害は、免疫学的な観点から無視できないということになる。
重症急性呼吸器症候群新型コロナウイルスに感染した患者の男性生殖機能障害の可能性を示す臨床的証拠
精巣は、局所的な免疫抑制と全身的な免疫反応の両方によって維持される免疫寛容メカニズムを持つ特殊な免疫器官であり、その精密なシステムにダメージを与える可能性のある多くの微生物感染症の影響を受けやすく、免疫介在性の損傷を引き起こす(Rival et al 2006,Liu et al 2018,Stassen et al 2018)。MuV、HIV、ZIKVなどの様々なウイルスは、男性の生殖器系、特に精巣に対してトロピズムを持つことが知られており、したがって、これらのいずれかに感染すると、精巣の損傷を誘発し、男性不妊を引き起こす可能性がある(Liu er al 2018)。現在までに、SARS-CoV-2とヒトの精巣の関係を示す臨床データがいくつかあるが(表1)報告された結果は逆説的なものであった。
表1 SARS-CoV-2と男性不妊の可能性との関係を示すウイルス学的、生物学的、および臨床的証拠
| 研究内容 | 結果 | 参考文献 |
| SARS-CoV-2シーケンス | SARS-CoVとの相同性が高い。ACE2と類似点がある | Hoffmann et al。、2020 ; Ma et al。、2020 ; Wan et al。、2020 ; Zhou et al。、2020 |
| 精巣におけるACE2発現 | ライディッヒ細胞、セルトリ細胞、生殖細胞で陽性 | Douglas et al。、2004 ; Watermeyer et al。、2006 ; Anguiano et al。、2017 ; Ma et al。、2020 ; Shen et al。、2020 ; |
| ヒト精巣のscRNA-seqプロファイリング | ACE2は精原細胞、ライディッヒ細胞、セルトリ細胞に富んでいます | Shen et al。、2020 ; 王と徐、2020年 |
| 性ホルモンの変化 | LHの増加; T / LHの低下 | Ma et al。、2021 |
| 血清中のSARS-CoV-2RNA | ポジティブ(1 / 5、1 / 12、39 / 95) | Lescure et al。、2020 ; Young et al。、2020 ; Zheng et al。、2020 |
| 尿中のSARS-CoV-2RNA | ポジティブ(4 / 58、3 / 48、1 / 67) | Cao、2020 ; Ling et al。、2020 ; Wang L. et al。、2020 ; Zheng et al。、2020 |
| 精液中のSARS-CoV-2RNA | ポジティブ(6/38) | Li D. et al。、2020 |
| 精巣におけるSARS-CoV-2RNA | ポジティブ(2 / 5、0 / 12) | Ma et al。、2020 ; Song et al。、2020 |
| 精子形成障害 | 精巣セクションの生殖細胞の喪失; RNA-seqデータは、精子形成細胞と生殖に富むダウンレギュレートされた遺伝子を示しています | Ma et al。、2020 |
| 精巣の免疫学的症状 | 精巣の高次T細胞とマクロファージ; 精液中のIL-6、IL-8、TNF-α、およびMCP-1のレベルの上昇 | Li D. et al。、2020 ; Ma et al。、2020 ; Gacci et al。、2021 |
SARS-CoV-2,重症急性呼吸器症候群新型コロナウイルス,ACE2,アンジオテンシン変換酵素2,LH、黄体形成ホルモン、T、テストステロン。
そこで、精巣に感染してウイルス性睾丸炎や男性不妊症を引き起こす可能性のある他のウイルス性疾患から得られた教訓を紹介する。MuVがBTBを破壊し、SC、ライディッヒ細胞、TMφ、男性生殖細胞などの主要な精巣細胞に感染する可能性があることはよく知られている。これはムンプス睾丸炎の原因となり、通常、精管のうっ血とリンパ球の浸潤を特徴とし、精巣の機能障害と男性不妊の障害につながる(Wu et al 2016;Westphal et al 2019)。かつてパンデミックを引き起こした別のウイルスであるZIKV(Epelboin et al 2017)は、感染した男性の精液中に長期間にわたって検出され、ライディッヒ細胞やSCにおける自然免疫応答の誘導を通じて睾丸炎や精巣上体炎を開始する可能性が高く、最終的には男性不妊症につながる(Govero et al 2016,Ma et al 2016,Stassen et al 2018)。さらに重要なのは、最近広く懸念されているSARS-CoVが睾丸炎を引き起こす可能性があることが示されたことである。これは、広範な生殖細胞の破壊、精管内の精子の数が少ないか全くないこと、白血球の浸潤、間質組織のT細胞とマクロファージのレベルが有意に増加していることを示した6人の死亡した患者から得られた所見に基づいて判断された(Douglas et al 2004,Xu et al 2006,Ma et al 2020)。
しかし、多くの懸念を引き起こしている主な問題は、SARS-CoV-2が前述のウイルスと同様に精巣感染症を引き起こすかどうかだろう。まず、前述のようにSARS-CoVとSARS-CoV-2の間には、ウイルスの最も免疫原性の高い部分に類似性が認められることから、ヒトの精巣がSARS-CoV-2の感染の潜在的な標的である可能性が示唆され、結果的にウイルス生物学の観点から、精巣の機能や男性の生殖能力に重要な役割を果たしていると考えられる。
SARS-CoV-2に感染した81人の生殖年齢の男性と、年齢をマッチさせた100人の健康な男性の性ホルモンを比較した単一施設での研究では、SARS-CoV-2への感染が男性の生殖腺機能に影響を与える可能性が示された。さらに、重度のCOVID-19に感染した男性では、血清黄体形成ホルモン(LH)が有意に増加したものの、テストステロン(T)とLHの比(T:LH)が劇的に低下していた(Ma er al 2021)。この研究は、COVID-19が男性ホルモンに及ぼす影響に関する初めての直接的な証拠となり、SARS-CoV-2の感染から回復した患者、特に若い男性の性腺機能の評価にさらなる注意を喚起した。さらに、いくつかのケースシリーズ研究では、血清(Lescure et al 2020,Young et al 2020,Zheng et al 2020)および尿サンプルにSARS-CoV-2のRNAが検出されたことが示されている(Cao 2020,Ling et al 2020,Wang L. et al 2020,Zheng et al 2020)。興味深いことに、SARS-CoV-2のRNAは、喉のスワブが陰性であることが示された後、3人の患者の尿検体から検出されることが実証された(Ling et al 2020)。このように、血漿や尿の間接的な証拠からも、SARS-CoV-2が精巣に影響を与える可能性は無視できないと考えられる。特に注目すべきは、精液中のSARS-CoV-2に関する臨床調査で、精液検体を提供した計38人の患者のうち、23人(60.5%)が臨床的に回復し、15人(39.5%)がまだ感染の急性期にあり、6人(15.8%)の患者がSARS-CoV-2陽性であることが判明し、そのうち4人が感染の急性期にあり、2人が回復期にあったことが示された(Li D. er al)。 別の最近の研究では、重度のCOVID-19を発症した2人のヒト精巣サンプルがSARS-CoV-2核酸に陽性であり、精巣切片はSARS-CoVスパイクS1に陽性であり、精巣の組織形態は、5例中4例で、変性した生殖細胞が多数認められた(Ma er al)。 これらの臨床結果は、SARS-CoV-2がCOVID-19の過程で男性生殖器管や精巣に直接感染する可能性を示唆しており、SARS-CoV-2発生時またはその後の男性不妊症の基礎的な病因仮説となりうるものである。しかし、回復期にあるCOVID-19患者に関するこれまでの多くの報告では、精液サンプルや精巣生検標本からSARS-CoV-2の陽性RNAは検出されなかった(Li H. et al 2020; Song et al 2020)。これらの知見は、精液中のSARS-CoV-2 RNA陽性は稀な事象であり、死亡した患者であっても重度のCOVID-19に関連しているが、軽度または中程度のCOVID-19の患者では陰性である可能性を示唆している。興味深いことに、Gacci et al 2021)は、SARS-CoV-2感染症で治癒が確認された患者の5人に1人は、精液中にウイルスRNAが存在しないにもかかわらず、乏しいクリプトアゾ精子症であることを発見した。精子のパラメータに異常がある男性の大半は、他の不妊要因を除けば、生物学的な子供がいる。確かに、抗生物質、抗ウイルス剤、免疫調整剤などの薬剤による治療や発熱は、男性の生殖能力に影響を与えるかもしれない(Carlsen et al 2003,Semet et al 2017)。
結論として、SARS-CoV-2が精巣に感染している可能性が高いという問題は、特に重症のCOVID-19患者では、上記のウイルス、生物学的、臨床的データに基づいて無視できず、COVID-19患者の生殖細胞の消失は、患者、特に生殖年齢の男性の生殖機能に障害を与える可能性があることに警鐘を鳴らすべきである。
新型コロナウイルス感染症の男性患者の可能性に対する臨床的救済策
現在の臨床データでは、COVID-19の男性患者が主に(56~73%)感染者を構成していることが示されているが(Chen et al 2020;Huang et al 2020a;Xu et al 2020)男性の生殖系に対する潜在的な影響は不明である。その結果、SARS-CoV-2発生時にCOVID-19の有無にかかわらず男性患者の診断と治療を行う過程では、WHOが発行したガイドライン(World Health Organization, 2020b)に従ってCOVID-19の一般的な臨床症状を適時考慮するだけでなく、男性生殖器の健康にもより注意を払う必要がある。
COVID-19の男性患者については、WHOが発行したガイドライン(世界保健機関 2020b)に従って、一般的な臨床症状に適時介入し、個別の治療を行うことができた。重篤な症状を呈する患者に対しては、これまであまり検討されてこなかった免疫介在性障害の緩和策を検討することができる。例えば、IL-6受容体を標的とした抗体であるtocilizumab(Liu et al 2020)は、炎症性サイトカインストームの影響を弱めるために使用される可能性がある。また、間葉系幹細胞(MSC)は、抗アポトーシス作用、抗炎症作用、免疫調節作用、再生作用、抗線維化作用を発揮し、肺に生じた損傷を治療するための新しいアプローチを提供する可能性がある。
その先には、男性の生殖器系の健康状態も考慮する必要がある。SARS-CoV-2がライディッヒ細胞やSCに感染し、ウイルス性睾丸炎を引き起こす可能性を示唆する既存研究のデータが完全には排除されていないにもかかわらず、精巣が損傷したと報告された患者はほとんどいません。SARS-CoV-2の発生時に、発熱、精巣痛、その他の臨床症状のために男性患者、特に生殖年齢の男性患者が男性外来で治療を受ける場合、SARS-CoV-2への感染の可能性を考慮し、精液、尿、血液、咽頭拭い液などを用いて適時スクリーニングを行う必要がある。その上、医師は人と人との間でのウイルスの感染を防ぐために、必要なすべての保護手段を適用する必要がある。特別な場合には、患者の精液を使ってSARS-CoV-2のRNAを検出することも可能である。
この特殊な段階では、男性の生殖管にSARS-CoV-2が感染する可能性が存在し、この感染の期間が特定できないため、精子の提供と凍結保存は、SARS-CoV-2のリスクを除外してから実施することを推奨する(Huang et al 2020b; Paoli et al 2020)。しかし、無精子症、クリプトゾ精子症、全身性自己免疫男性など、医学的治療後に「妊孕性の窓」が一過性のものとなる可能性がある特定のシナリオを持つ患者に対する不妊治療サービスは、配慮された安全な方法で継続することが推奨される(Esteves et al 2020)。
結論
いくつかの先行研究や最近のバイオインフォマティクス解析により、SARS-CoV-2がライディッヒ細胞、SC、生殖細胞などのACE2陽性細胞に感染し、精巣の機能に影響を与える可能性が示された。さらに、精巣の特徴的な免疫機能と、COVID-19によるサイトカインストーム、リンパ球減少、免疫脱落による潜在的な免疫介在性障害のために、男性患者、特に重度のCOVID-19患者は、生殖能力に障害が生じる可能性がある。直接的、間接的な既存の疫学的証拠により、SARS-CoV-2のRNAが精巣で検出されることが示されており、精子形成に障害を与え、男性の生殖能力に影響を与える可能性が予測されており、これを深刻に受け止める必要がある。COVID-19が世界的にパンデミックしている今、男性の生殖能力を守ることの重要性を高めていくべきだ。
