Contents
Selective Vagus Nerve Stimulation as a Therapeutic Approach for the Treatment of ARDS: A Rationale for Neuro-Immunomodulation in COVID-19 Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC8076564/
オンラインで公開2021年4月13日
Svetlana Mastitskaya, * Nicole Thompson, and David Holder
概要
急性呼吸窮迫症候群(ARDS)は,急性肺障害の中でも最も重篤なものである。敗血症,誤嚥,SARSコロナウイルスやヒトインフルエンザウイルスなどによる肺炎が原因で発症する。ARDSの主な病態生理学的メカニズムは、全身の炎症反応である。
迷走神経刺激(VNS)は、脾臓でのサイトカインの産生を制限することで、全身の炎症や、肺やその他の臓器での炎症による組織損傷を抑制することができる。しかし、非選択的なVNSを適用した場合、肺への副交感神経の流出が増加することで、気管支収縮、粘液分泌の増加、局所的な肺の炎症活動の亢進が起こる可能性があり、これはVNSの有益な全身性抗炎症作用を上回る可能性がある。
迷走神経内の局所的な筋群の活動を画像化し、特定された器官特異的な筋群を選択的に刺激することで、器官・機能特異的な治療が可能となる。これにより、迷走神経内の異なる経路を選択的に神経調節することができ、ARDSの転帰を改善するための新しい手段を提供することができるかもしれない。
今回の総説では,VNSの抗炎症作用のメカニズム,選択的VNS技術の進歩,ARDSへの応用の可能性について論じた。
キーワード
迷走神経、神経調節、炎症、サイトカイン・ストーム、ARDS、COVID-19
はじめに
急性呼吸窮迫症候群(ARDS)は、40%以上の死亡率を引き起こす可能性のある劇症型の疾患である(Diamond er al 2020)。その原因は、細菌性やウイルス性の肺炎、煙や有毒化学物質の吸入、胃内容物の吸引などによる直接的な肺の損傷や、敗血症性ショック、急性膵炎、熱傷、大きな外傷などによる間接的な損傷によるものである(Wong er al 2019)。肺または肺外の傷害によって誘発されるかどうかにかかわらず、ARDSは、間質および肺胞浮腫、重度の低酸素血症、内皮傷害、および呼吸器および多臓器不全に急速に進行する可能性のある急性全身性炎症反応として現れる肺傷害によって引き起こされる(Matthay et al 2019,Diamond et al 2020)。ウイルス性肺炎に続発するARDSは、SARS-CoV-2感染症による死亡の主な原因である(Mehta et al 2020,Zhang et al 2020)。
重症COVID患者における全身の炎症反応
COVID-19感染症では、細胞表面のアンジオテンシン変換酵素2(ACE2)がSARS-CoV-2ウイルスの侵入口として機能している(Hoffmann er al 2020)。肺の上皮細胞をはじめ、心臓、消化管(GIT)腎臓などにも豊富に発現している(Samavati and Uhal, 2020)。重症のCOVID-19患者におけるアンジオテンシンIIの血漿レベルの上昇(ウイルス侵入時にACE2が内在化された結果)は、脾臓からの単球の動員を刺激する可能性がある(Ni er al 2020)。単球は24時間以内に感染組織に移動し、初期の炎症性損傷に寄与し(Swirski et al 2009年)好中球の活性化と間質・肺胞腔への移動を促進する。自然免疫系が病原体の除去や肺の修復に失敗すると、全身の免疫反応が過剰に活性化され、炎症性サイトカインであるインターロイキン-1α(IL-1α)IL-6,IL-1β、腫瘍壊死因子α(TNF-α)インターフェロンγ(IFN-γ)が放出されるようになる。これは一般的に「サイトカイン・ストーム」と呼ばれている(Mehta et al 2020)。重症および中等症のCOVID-19患者の気管支肺胞洗浄液を用いて肺の免疫微小環境を分析すると、ARDS患者からの肺の過剰な炎症反応では、炎症性の高い単球由来の脾臓マクロファージが優勢であることが示された(Liao et al 2020)。脾臓由来のマクロファージは、ケモカインやサイトカインを積極的に産生し、肺胞腔への好中球の移動や活性化を促進する。活性化した好中球はプロテアーゼや活性酸素を放出し、内膜や上皮の統合性の崩壊、肺胞内に浮遊するタンパク質を多く含む滲出液による血管伝染性のさらなる増大、およびヒアルロン膜の形成に寄与する(Matthay et al 2019)。全身の炎症の影響に対抗する恒常的なメカニズムとしては、内因性のグルココルチコイドの分泌やIL-10などの抗炎症性サイトカインの放出があるが(Johnston and Webster, 2009)この劇症型の炎症カスケードを抑えるには不十分である可能性がある。
COVID-Diseaseにおけるサイトカイン・ストームとARDSの抗炎症療法
COVID-19患者のサイトカイン・ストームと全身性炎症を抑えることを目的とした抗炎症薬には、非ステロイド系抗炎症薬、グルココルチコイド、免疫抑制剤、炎症性サイトカインの拮抗薬(IL-6R抗体、TNF阻害剤、IL-1R拮抗薬など)がある。デキサメタゾンは、COVID-19感染症の重症・重度の症例(ARDSによる人工呼吸が必要な症例を含む)の生存率向上に有効であることが示された(Horby et al 2021)。COVID-19パンデミックまでは、他の原因に伴うARDSの予防や治療にステロイド使用の利点を示す決定的な証拠はなく、長期にわたる低用量コルチコステロイドの利点が、回復の遅れなどの短期および長期のリスクを上回るかどうかは、まだ確立されていない(Mokra er al)。 また、炎症性サイトカインIL-6の受容体に対するモノクローナル抗体であるTocilizumabを用いた別の有望な治療法が、急性全身性炎症反応のリスクがあり、人工呼吸が必要なCOVID-19患者の代替治療として登場した(Guaraldi et al 2020)。しかし、コルチコステロイドなどの抗炎症薬は、ウイルスの排除を遅らせ、免疫不全患者の二次感染のリスクを高める可能性がある(Zhang er al 2020)。特定のサイトカインを標的とする薬剤は、特定の炎症性因子を阻害することしかできないため、重要な他のサイトカインの影響を抑えるのに十分な効果が得られない可能性がある。そのため、抗炎症療法の適切なタイムウィンドウを選択し、免疫抑制の効果が最も期待できる患者を特定することは、依然として重要な課題である。重度のCOVID-19感染症の患者は、免疫抑制によって生存率が向上する可能性のある患者のサブグループを特定するために、実験室の傾向(例えば、フェリチンの増加、血小板数の減少、または赤血球沈降速度)を用いて高炎症のスクリーニングを行うことができる(Mehta et al 2020)。しかし、ARDSはサイトカインストームの進行した症状であり、その時点ですでに不可逆的な損傷を引き起こしている可能性があるため、そのような患者を特定し、抗炎症療法を開始するには、病状が重度に進行するよりもかなり前に行う必要があることは明らかである。
迷走神経の刺激
迷走神経は、副交感神経系の主要な構成要素である。迷走神経は、咽頭、喉頭、気管気管支樹と肺、心臓、食道、胃、肝臓、胆嚢、膵臓、小腸、近位結腸など、内臓器官の大部分を支配している(Thompson er al 2019)。重要なのは、迷走神経が神経系と免疫系の接続に不可欠な役割を果たしていることである(図1;Borovikova et al 2000;Kressel et al 2020)。そのため、炎症の神経調節において特に注目されている。迷走神経刺激(VNS)は、ヒトにおいて脾臓の直接的なコリン作動性(迷走神経)の神経支配の証拠がないにもかかわらず、脾臓のサイトカイン産生に対して間接的な抑制効果を有する(Verlinden er al)。 ヒトの患者における頸部VNSの既存の方法は、円周状のワイヤーループを用いて神経全体を電気的に刺激することを採用している。適用された電流は、迷走神経全体および求心性および送心性の両方のそのすべての繊維を活性化するが、その結果、感覚(求心性)繊維は活性化閾値が低いため、優先的に活性化される。これにより、吐き気、咳、頭痛などの複数の望ましくない副作用が発生し、VNSの忍容性と効率が制限される可能性がある(Howland, 2014)。
図1 迷走神経の抗炎症経路
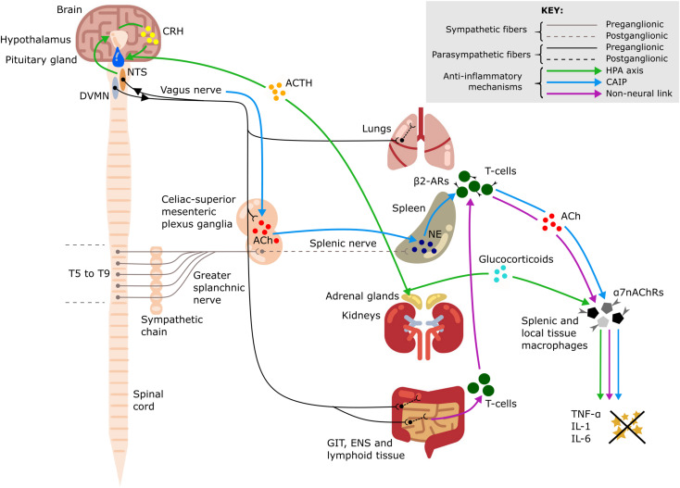
迷走神経の抗炎症経路を模式的に表したもので、視床下部-下垂体-副腎(HPA)軸(緑の矢印)コリン性抗炎症経路(CAIP)(青の矢印)迷走神経と脾臓の間の非神経的リンク(紫の矢印)を含む。この3つの経路はいずれも、腫瘍壊死因子-α(TNF-α)インターロイキン-1(IL-1)インターロイキン-6(IL-6)などの炎症性サイトカインの産生を減衰させる結果となっている。迷走神経背側運動核(DVMN)孤路核(NTS)消化管(GIT)腸管神経系(ENS)胸椎(T5-T9)アセチルコリン(ACh)。NE(ノルエピネフーリン)CRH(コルチコトロピン放出ホルモン)ACTH(副腎皮質刺激ホルモン)β2アドレナリン受容体(β2-ARs)α7ニコチンACh受容体(α7nAChRs)などがある。
頸部迷走神経を選択的に刺激することは魅力的な可能性である。しかし、残念ながら、最近まで迷走神経の筋群の機能解剖がほとんどわかっていなかったため、この方法には限界があった。ユニバーシティ・カレッジ・ロンドンの私たちのグループでは、14個の円周電極を備えたシリコーンゴム製のカフを用いて、電気インピーダンス・トモグラフィー(EIT)で局所的な筋膜複合活動電位を画像化する方法を開発した(図2A;Ravagli er al 2019, 2020)。そして、特定されたファシクルは、3mm間隔で配置された2つの電極リングを用いて選択的に刺激することができる(図2B;Aristovich er al)。 今回の研究では、大型哺乳類(ヒツジとブタ)における頸部迷走神経の筋群が、器官的に構成されていることが示唆された。これまでは、心臓、肺、反回喉頭の3つの領域が迷走神経の頸部に局在しており、選択的に調節することができた(図2B,C)。現在、迷走神経から供給されている他の器官についても、同様のイメージングと選択的な調節を実現するための研究が進められている。この知見は、マイクロコンピュータ断層撮影法(microCT)で終末器官から筋節を追跡することで独自に検証されている(Thompson et al 2020)。
図2 ARDS治療におけるVNSの提案されたアプローチ
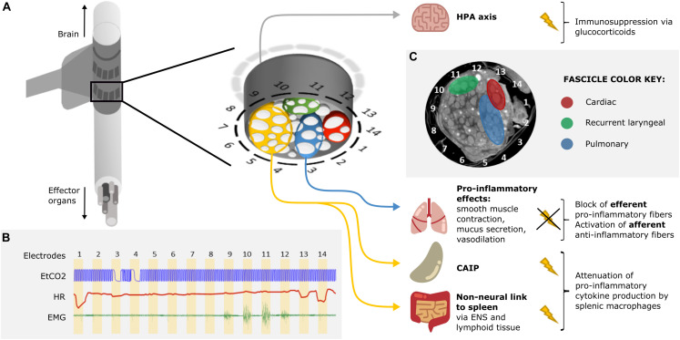
(A) 迷走神経に巻き付けられた14個の円周方向の電極を持つケイ素ゴム製カフの概略図である。挿入図:電極で囲まれた迷走神経の断面のより詳細な模式図。迷走神経の神経節(白)は、選択的な刺激とその後のマイクロコンピュータ断層撮影(microCT)によって、反回喉頭(緑)心臓(赤)肺(青)そして腹部の内臓を支配していると思われる神経節を持つ神経の残りの部分(オレンジ)の4つの領域に分類される。迷走神経のオレンジ部分を刺激すると、コリン作動性抗炎症経路(CAIP)が活性化され、迷走神経発散を介して腸管神経系(ENS)と消化管のリンパ組織を経由して迷走神経と脾臓の間の非神経リンクが活性化され、炎症性サイトカインの産生が抑制される。迷走神経を刺激すると、視床下部-下垂体-副腎(HPA)軸が活性化され、グルココルチコイドによる免疫抑制効果が得られる。肺筋群を選択的に遮断すると、肺末梢神経線維が活性化されず、肺の平滑筋収縮、粘液分泌増加、血管拡張などの炎症促進効果が得られない。全体として、免疫反応の抑制が達成されるだろう。B)選択的VNSの迅速なラウンドによる臓器特異的ファシクルの識別。肺、心臓、および反回喉頭筋群は、電極対1-14を介して神経の橈骨部分を順次刺激し(各対で30秒間刺激した後、30秒間の回復期間を設ける)それに応じて呼吸(潮解性CO2,EtCO2)心拍数(HR)および首の筋肉の収縮(筋電図、EMG)の変化という生理学的パラメータを読み取ることによって、特定される。肺筋群は電極ペア3と4の隣に位置し(徐呼吸),心筋群は電極ペア1,13,14の隣に位置し(徐脈),反回喉頭筋群は電極ペア10と11の隣に位置する(筋電図信号の最大値)。C)頸部迷走神経のmicroCT断面図。反回喉頭筋(緑)心筋(赤)肺筋(青)の領域が確認できる(未発表データ、豚の左迷走神経の研究)
VNSの全身性抗炎症効果
VNSの強力な全身性抗炎症効果は、VNSがARDS患者に対する有望な代替免疫調節治療法となりうることを示唆している(Van Westerloo et al 2006,Krzyzaniak et al 2011,補足表1)。VNSは、敗血症とエンドトキシン血症の動物モデルにおいて、炎症性サイトカインの放出を減少させ、凝固を調節し、循環不全を防ぎ、その結果、臓器機能障害を減少させ、生存率を向上させることが示された(Borovikova et al 2000;Van Westerloo et al 2006)。また、臨床研究では、関節リウマチ(Koopman et al 2016年)難治性てんかん(Majoie et al 2011年)心房細動(Stavrakis et al 2015年)クローン病(Bonaz et al 2016)において、VNSによる炎症の抑制と臨床症状の改善という免疫調節作用が実証された。これらの効果は、以下のようなメカニズムで発揮される(図1)。
視床下部-下垂体-副腎軸
迷走神経求心性神経は傍神経節レベルでIL-1β受容体を発現しているため、局所的および全身的な炎症を感知することができる(Bonaz er al)。 これらの求心性神経が活性化されると、孤路核(NTS)でグルタミン酸が放出される。NTSは、コルチコトロピン放出ホルモン(CRH)ニューロンの集団を含む視床下部の室傍核にアドレナリン性の投射を送る(Hosoi er al)。 CRHは次に下垂体前葉に作用し、副腎皮質刺激ホルモンの全身循環への放出を刺激し(Hosoi er al 2000)最終的には副腎皮質に作用し、免疫系の抑制に非常に有効なグルココルチコイドの分泌を増加させる(Fleshner er al)1995; Bonaz er al 2016)。
コリン性抗炎症経路(CAIP)
迷走神経の efferent fiber の刺激によって間接的に活性化される脾臓の強力な抗炎症経路である。脾臓の遠心性神経支配は、脾臓神経内のノルアドレナリン性交感神経線維からなる(Verlinden er al 2019)。迷走神経前枝ニューロンの一部は腹腔-上腸間膜神経節で終止するが、ここでは脾臓への交感神経後枝供給の多くが派生する(Kressel et al 2020)。迷走神経前節ニューロンの軸索は、個々の脾臓神経細胞体を取り囲むように瘤状の構造を形成し、それによって脾臓神経の活動を調節する(Kressel et al 2020)。腹腔神経節の迷走神経発散路から放出されたアセチルコリン(ACh)は、脾臓神経のシナプス後のα7ニコチンACh受容体(α7nAChR)を活性化する(Vida er al)。 その結果、脾臓でノルエピネフーリンが放出され、脾臓のCD4+T細胞のβ2アドレナリン受容体に作用してAChが放出される。T細胞由来のAChは脾臓マクロファージのα7nAChRに作用し、転写因子NF-kB p65の阻害を介して炎症性サイトカインの産生を減少させる(Rosas-Ballina et al 2008)。脾臓は、敗血症のような全身性の炎症状態において、サイトカインの主な産生源である。したがって、コリン性抗炎症経路(CAIP)は、VNSが炎症性疾患の治療に利用できる強力なメカニズムである。遠心性迷走神経を直接刺激すると、肝臓、脾臓、胃腸での炎症性サイトカインの合成が抑制され、エンドトキシン血症、虚血、敗血症などの全身の炎症反応でもそのレベルが低下する(Rosas-Ballina et al 2008,Dos Santos et al 2011)。炎症性サイトカインの産生はVNSによって減衰されるが、炎症に対抗する作用を持つIL-10の放出は影響を受けないことが示されている(Borovikova et al 2000)。
迷走神経から脾臓への非神経的リンク
CAIP経路の重要なレビューは、(Martelli et al 2014)の研究に記載されている。彼らはまた、迷走神経の活動が、α7nAChRs受容体の活性化を介して脾臓マクロファージによる炎症性サイトカインの産生を減少させることにつながる非神経的なメカニズムを示唆している。迷走神経は、胃腸の二次リンパ組織を広く支配しており、これらのリンパ組織への副交感神経の刺激が増加すると、AChを合成するT細胞が動員される。循環するT細胞は脾臓に隔離され、そこで脾臓マクロファージが発現するα7nAChRに作用してAChを放出する(Martelli er al 2014)。
組織のマクロファージ活性の抑制
VNSの抗炎症作用には、迷走神経発散線維が関与している。この迷走神経発散線維は、胃腸の腸管神経系の内在性ニューロンにシナプス結合し(Matteoli et al 2014年)肝臓(Borovikova et al 2000)や肺などの他の内臓器官で終末を迎える。組織マクロファージは、全身の炎症反応時に放出される炎症性サイトカインの産生に寄与し、過剰な反応時にはサイトカインストームを助長し、複数の臓器に損傷を与える(Johnston and Webster, 2009)。迷走神経から放出されるAChは、腸内の局所組織マクロファージのα7nAChRに作用し、主要な炎症性サイトカインであるTNF-αの産生を減少させる(Matteoli er al)。 同様に、肺の常在免疫細胞(肺胞マクロファージ、上皮細胞、活性化した浸潤好中球など)は、AChがそのα7nAChRに作用することで影響を受け、局所的な炎症反応を遅らせ、肺損傷を緩和することができる(Su er al)。
VNSの肺への影響
非選択的VNSは肺の副交感神経線維を刺激するが、この不用意な活性化は有益ではない。炎症促進効果のある肺のコリン作動性送出路を活性化することになる。副交感神経の遠心性刺激は、気道平滑筋、腺、血管系のムスカリン性ACh(mACh)受容体の活性化につながり、気道平滑筋の収縮、粘液分泌の増加、血管拡張を引き起こす(Gosens er al 2006)。粘液の分泌は気道における自然防御の重要なメカニズムであるが、炎症過程において粘液が過剰に産生され肺胞に蓄積されると、血液-ガスバリアーが損なわれ、低酸素症や炎症性傷害が増強される(Fahy and Dickey, 2010)。肺胞に存在する主な免疫細胞は肺胞マクロファージである。AChはこれらの細胞を刺激して、好中球、単球、好酸球などの炎症細胞の走化性を放出することがわかった(Sato er al)。 マウスのmACh受容体をブロックすることで、肺の炎症性浸潤や組織損傷に寄与するサイトカインの産生が抑制された(Gori er al)。
一方、肺求心性A線維(肺ストレッチ受容体)を刺激すると、呼吸困難や反射的に副交感神経の緊張が低下するため、肺放出性の刺激とは逆の作用-肺気管支拡張や粘液分泌の低下-が生じる(Kubin er al)。 肺迷走神経叢への刺激が、肺の求心性線維と送出性線維のどちらに優位に作用するかは不明である。ARDSにおけるサイトカインストームを改善し、他の副交感神経の制御変数を変更することで転帰を改善するためには、肺の繊維を刺激すべきか遮断すべきかを明らかにするために、選択的なVNSが必要である。
ARDSの実験モデルにおけるVNS
毒物誘発ARDSのラットモデルでは、迷走神経発散刺激はMesobuthus tamulus(MBT)に対して保護的であったが、オレイン酸(OA)誘発ARDSに対しては保護的ではなかった(Akella and Deshpande, 2015)。この保護効果は、サーファクタント分泌の増加と抗炎症経路の活性化によって説明された。興味深いことに、VNSはMBTモデルでのみ有効であった。このモデルは、肺の損傷だけでなく、全身の心血管の変化も特徴的である。おそらく、このモデルでの動物の生存期間の延長から明らかになったVNSの有益な役割は、肺に対する抗炎症作用ではなく、副交感神経緊張の増加による心血管効果に起因するものであろう。
迷走神経発散刺激の有益な効果は、人工呼吸器誘発性ARDS(Brégeon et al 2011,Dos Santos et al 2011)および腹膜炎誘発性肺損傷(Boland et al 2011)で報告されているが、他のARDSモデル(敗血症および換気、Kox et al 2012)では報告されていない。ラットのエンドトキシン血症誘発性肺炎モデルでは、機械的過換気によって増強されたが(Kox et al 2012年)VNSの効果は観察されなかった。このことは、機械的換気が開始されるICUに収容された全身性炎症患者におけるCAIPの刺激の臨床的適用性に疑問を投げかけるものである。本研究では、迷走神経を切断していないため、求心性繊維と送出性繊維の両方が刺激され、刺激は神経全体に適用されており、肺送出性繊維の刺激による潜在的な有害作用がVNSの抗炎症作用を上回っていると考えられる。さらに、VNSを適用するタイミングが非常に重要である可能性がある。この研究では、敗血症性ショックが完全に進行してからVNSを適用した。この研究では、敗血症性ショックが完全に進行した時点でVNSが適用されたが、全身性反応の大きさがVNSの影響を受けないほどすでに大きかったのかもしれない。
ARDS治療におけるVNSのアプローチの提案
VNSは、その抗炎症作用を通じて、免疫調節不全の転帰と死亡率の改善を支援することが明らかになっている(Dos Santos et al 2011,Bonaz et al 2016,Koopman et al 2016,Liu et al 2017)。既存の技術では、神経全体を刺激するため、望ましくない副作用が生じたり、強度が不十分で治療効果が得られなかったりすることが多い。私たちは、選択的VNSによってARDSの予後を改善できるのではないかと考えている。これにより、標的外の副作用に制限されることなく、より最適な刺激パラダイムを採用できる可能性があり、肺迷走神経の緊張を微調整することで、さらなる効果が得られるかもしれない。選択的VNSの様々な手法が提案されており、アノードブロック(Tosato et al 2007年)脱分極プレパルス(Vuckovic et al 2008年)キロヘルツ電気刺激ブロック(Patel et al 2017年)繊維選択的刺激(McAllen et al 2018年)空間選択的刺激(Aristovich et al 2021)などがある。アノーダルブロック、脱分極プレパルスおよび繊維特異的刺激は、喉頭の副作用を効率的に緩和することができるが(Vuckovic et al 2008年)標的器官またはエフェクターに関しては十分な選択性がない。繊維特異的な刺激とは異なり,空間選択的なVNSは,頸部迷走神経内の繊維の器官的配置を考慮している(図2)。これにより、繊維特異的VNSよりも正確なターゲティングが可能となり、副作用が軽減され、器官特異的な反応の誘発に成功したことが実証されている(Ordelman et al 2013,Plachta et al 2014,Aristovich et al 2021)。
侵襲的VNSと非侵襲的VNS
非侵襲性VNSは外科的介入を必要としないため、VNSの安全性と忍容性を向上させることができる。現在、非侵襲的VNSには、経皮的VNSと耳介的VNSの2種類がある。経皮的VNS(tVNS)では,首の胸鎖乳突筋の上の皮膚表面に刺激電極を貼る(Yap er al)。 耳介VNS(aVNS)は,耳にある迷走神経の感覚器官である耳介枝を標的とする。この方法は、耳介、迷走神経、NTS、迷走神経背側運動核が関与する耳介迷走神経反射を利用する(Yap er al)。 tVNSおよびaVNSのいずれも、VNSと同様の治療効果を引き出すことが示されている(Hein et al 2013,Koopman et al 2016,Subramanian et al 2020,Yap et al 2020)。
しかし、tVNSもaVNSも、迷走神経の器官や機能の活動を調節することはできない-具体的には、侵襲的VNSと比較して不利である。侵襲的VNSでは、頸部迷走神経に外科的に埋め込まれたデバイスを使用し、特別に設計された電極カフを用いて選択的VNSを行うことができる。迷走神経の特定の繊維、例えば、特定の所望の経路または機能(例えば、CAIP)を選択的に活性化し、他の繊維(例えば、肺繊維)を選択的に活性化しないことは、すべての繊維の無差別な刺激を可能にするだけのtVNSまたはaVNSでは実現できそうにない(Yuan and Silberstein, 2016)。
考えられるリスクと課題
迷走神経刺激には、多くのオフターゲット効果(声の変化、咳、呼吸困難、嚥下障害など)があることが知られており、そのほとんどが刺激に関連している(Howland, 2014)。提案されている選択的刺激の使用により、これらの副作用は回避できる可能性がある。肺出口線維への刺激に伴う気管支収縮や粘液分泌の増加のリスクをモニタリングし、ARDSの病因にこれ以上貢献しないように回避する必要がある。さらに、挿管された患者の喉頭や食道の筋収縮は、神経への機械的損傷や上気道閉塞のリスクとなるため、防止する必要がある(Zalvan et al 2003)。ICUの重症患者にVNSデバイスを埋め込むことは困難である。理想的には、VNS装置の植え込みに関する決定は、全身性炎症の早期の実験的徴候から情報を得て、ARDSに進行する可能性の高い患者は、サイトカインストームとARDSが完全に発症する前にVNS装置の植え込みを受けるべきである。
結論
VNSは、感染体に対する特異的な免疫を損なうことなく、免疫活性化を初期の重要な段階で抑制することができるため、ARDSやその他の免疫異常疾患の治療に非常に有利である。免疫抑制療法とは対照的に、腹腔-上腸間膜神経節複合体にシナプスを形成する迷走神経の腹側流出神経を介してCAIPを活性化することは、ARDSの病態生理上の特徴である炎症性サイトカインの過剰産生を抑制するために望ましい。しかし、肺線維への刺激は、気管支収縮と粘液分泌の活性化により炎症を増強し、CAIP活性化による有益な抗炎症作用を否定する可能性があるため、その影響を考慮する必要がある。迷走神経を選択的に調節することで、必要に応じて脾臓や肺の免疫経路を独立して活性化したり遮断したりすることができ、ARDSの転帰を改善する可能性が最も高いと考えられる。
