Contents
Seeding Brain Protein Aggregation by SARS-CoV‑2 as a Possible Long-Term Complication of COVID-19 Infection
概要
コロナウイルス感染症2019(COVID-19)の感染後の合併症は未だ不明であり、感染者の長期的な懸念事項の一つに脳病理がある。重症急性呼吸器症候群コロナウイルス2(SARS-CoV2)感染は、感染者の散発性神経変性を加速させる環境因子ではないかという疑問がある。
このような観点から、SARS-CoV2のインタクト構造やスパイク蛋白質サブユニット由来のペプチドによる脳内蛋白質凝集誘導を将来的に検討する必要があると考えられている。本論文では、他のウイルスからのエビデンスを用いて、これらの可能性について議論する。
キーワード
脳、COVID-19,機能性アミロイド、神経変性、タンパク質凝集、SARS-CoV-2
はじめに
SARS-CoV-2ウイルスの最近の世界的な発生は、この感染症のヒトへの合併症についての懸念を提起している。現在、ほとんどの科学的努力は、インフルエンザに似た症状をコントロールするための短期的な合併症と、この危険なウイルスの広がりを止めるためのワクチンの生成に焦点を当てている。
しかし、このウイルスの作用機序はまだ不明であり、世界中の多くの集団がこのウイルスに感染している。したがって、COVID-19の長期的な感染後の合併症の可能性を考慮することが重要である。
この新しいコロナウイルスによる感染後の主な懸念事項の一つは,血液脳関門(BBB)を通過することによる中枢神経系(中枢神経系)へのウイルスの侵入である.ヒト免疫不全ウイルス(HIV)西ナイルウイルス、単純ヘルペスウイルス1型(HSV-1)インフルエンザA型(H1N1)呼吸器同期ウイルスなど、脳炎、蛋白質凝集、神経変性、パーキンソン病やアルツハイマー病などの神経障害を引き起こすウイルスの感染後の脳合併症は、これまでにも報告されている1。
これらのウイルスの中には、神経変性の発症に関与する脳凝集性タンパク質の凝集を促進する種となり得るものがあることが示されている。
これらのウイルスの凝集促進作用には、以下の2つのメカニズムが報告されている。本論文では,COVID19の感染後のアウトカムとして,これら2つの作用機序の関与の可能性について考察する.
SARS-COV-2スパイクが触媒となる可能性
コロナウイルスのユニークな特徴は、コロナウイルスの名前の由来となっているウイルス表面の王冠状のスパイクである。このスパイクは、細胞の内部化と感染に関与している。その構造により、組織内および細胞外のタンパク質と結合し、ウイルス表面にタンパク質コロナを形成することができる。最近、スパイクS1タンパク質内に位置するSARS-CoV-2ウイルスの受容体結合ドメインがヘパリンとヘパリン結合タンパク質を結合することが明らかになった4。
自己播種(均質なタンパク質の自己集合)と交差播種(不均質なタンパク質の集合)は、有毒なアミロイド線維の生成につながる凝集過程であり、これらは細胞内または細胞外の介在物として沈着する。凝集過程に関与する蛋白質-蛋白質相互作用は、これらの蛋白質の集合体を誘導するユニークな認識結合部位または共通の化学的特徴を必要とする。
ここでは、凝集を起こしやすいタンパク質のヘパリン結合部位が認識結合部位として機能し、これらのタンパク質の初期結合に関与している可能性があり、最終的に組み立て、凝集、フィブリル化のプロセスを誘導することを提案している。
興味深いことに、これらのヘパリン結合性ウイルスの一つであるHSV-1は、試験管内試験と生体内試験の両方の研究において、その表面スパイク上のアミロイドβ(Aβ42)ペプチドの凝集を促進することが示されている2。このことは、ウイルス表面のヘパリン結合部位が、Aβ42ペプチドをウイルス表面に結合させるためのドッキング部位として機能する可能性があることを示唆しており、また、表面支援不均一播種を介してAβ42の凝集を触媒する可能性があることを示唆している。
SARS-CoV-2もまた、スパイクS1サブユニット内にヘパリン結合部位をいくつか有していることから4 、同様のメカニズムは、Aβ、α-シヌクレイン、タウ、プリオンなどの凝集を起こしやすいタンパク質が高レベルで存在する脳内COVID-19病理(図1B)でも活性化されている可能性がある。
したがって、この新規なクロスシードプロセスを標的とすることにより、将来の転帰を防ぐためには、これらの相互作用および凝集過程を調査することが不可欠である。この点から、回復後もCOVID-19患者の病理学的特徴として、BBBを通過して脳内に侵入したウイルスがアミロイド蛋白質の凝集を加速させ、若年発症の神経変性を引き起こす可能性が考えられる。
スパイク由来のペプタイドは機能性アミロイドのように作用するかもしれない
SARS-CoV-2ウイルスのスパイクは、2つのプロテアーゼ、すなわち、furinおよび膜貫通型プロテアーゼ、セリン2(TMPRSS2)によって活性化されることが示されている(図1A)。この活性化は、S1/S2部位(残基669-688)でのfurinによるスパイクタンパク質の前開裂と、TMPRSS2によるS2′部位(残基808-820)での後続の開裂を伴う5 。
もし、このペプチドがウイルスから解離して細胞内または細胞外環境に放出されると、免疫反応を引き起こし、機能性アミロイドとして作用する可能性がある。
したがって、SARSCoV-2の活性化と感染の病理学的メカニズムとして考えられるのは、このペプチドの放出とそれに続く凝集(図1C)が機能性アミロイドとして作用し、ウイルスや細菌由来の機能性アミロイドであるM45,3a NSs,3bやcurli,3cに類似した脳タンパク質のシード凝集が考えられる。
この点、提案されたSARS-CoV-2機能性アミロイドペプチド(S-CoV-ペプチド)の自己凝集特性を測定し、AGGRESCAN凝集予測サーバーを用いてα-シヌクレイン、Aβ40,M45との比較を行ったところ、これらのタンパク質の良好な自己凝集性は以下の通りであることが示唆された。
S-CoV-ペプチド>Aβ40>M45>α-シヌクレイン
陽性対照(Aβ40およびαシヌクレイン)に対するこの凝集予測は、Aβ40がαシヌクレインよりも速く凝集体を形成する実験研究におけるこれらのペプチドの凝集速度論を確認する。
このように、提案されたS-CoVペプチドは、既知の凝集性タンパク質よりも多くの凝集性を有していることが明らかになった。このことから、SARS-CoV-2スパイク蛋白質由来のこのペプチドは、機能性アミロイドとして作用し、
(1)ウイルスの感染性を補助する毒性のある凝集体を形成しやすく、
(2)誤って折り畳まれた脳内蛋白質の種子凝集体を形成しやすいことが示唆された。
考察と結論
新型COVID-19パンデミックは、世界中で高い関心と経済危機を引き起こしている。現在およびパンデミックの短期的な段階では、感染者の数を減らし、感染者のインフルエンザ様症状を改善するためのワクチンまたは治療法の開発に焦点が当てられている。
これらの取り組みが進んでいる一方で、感染者の長期的な病態を考慮する必要がある。他のウイルスと同様に、COVID-19の可能性のある結果の一つは、脳のタンパク質凝集の増加による神経変性を加速させる環境因子として機能する脳内病理の発達であるかもしれない。
本論文では、このウイルスが脳タンパク質の凝集を増加させる2つの可能性のあるメカニズムを取り上げた。
(1)スパイク蛋白質による無傷のウイルス粒子への蛋白質凝集の播種、
(2)スパイク蛋白質由来のペプチドが機能性アミロイドとして作用して脳蛋白質の凝集をクロスシードする、
という2つのメカニズムである。これらのメカニズムの両方において、SARS-CoV-2の役割は、脳凝集タンパク質の凝集を触媒し、促進するための種として機能することである。したがって、ウイルスまたはウイルス粒子と脳タンパク質との相互作用を標的とすることは、これらのクロスシードおよび凝集プロセスを減少させるのに適した方法であるかもしれない。
図1. SARS-CoV-2が脳のフィブリル形成に関与する可能性のあるメカニズムを示す模式図。
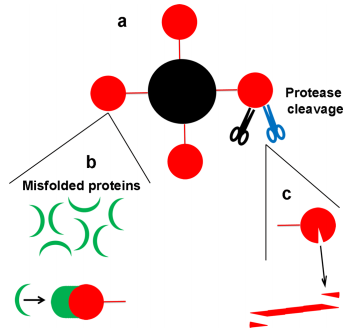
A)ウイルススパイクを含むSARS-CoV-2の構造。
B)ウイルススパイクの表面に形成されたミスフォールドされたタンパク質の集合体。C)プロテアーゼによるウイルススパイクタンパク質の切断は、高い凝集性を有するウイルスペプチドの放出をもたらす。このペプチドは、脳内で有毒なフィブリルを形成する。
ACS Chemical Neuroscience pubs.acs.org/chemneuro Viewpoint htt
