Contents
- SARS-CoV-2 spike protein: pathogenesis, vaccines, and potential therapies
SARS-CoV-2 spike protein: pathogenesis, vaccines, and potential therapies
www.ncbi.nlm.nih.gov/pmc/articles/PMC8326314/
2021 Aug 2 : 1-22.
Ahmed M. Almehdi,1 Ghalia Khoder,2,3 Aminah S. Alchakee,2 Azizeh T. Alsayyid,2 Nadin H. Sarg,2 and Sameh S. M. Solimanconsresponding author2,3
要旨
目的
致死性の病原体である重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)に感染した結果、COVID-19パンデミックが発生し、人類に甚大な脅威をもたらしている。コロナウイルスは、ウイルスの病原性、進化、感染に重要な役割を果たしているクローヴ様スパイク(S)タンパク質によって区別される。本研究の目的は、SARS-CoV-2のSタンパク質の特徴的な構造を調べ、その病原性における重要な役割を明らかにし、治療法やワクチンの開発に役立てることである。
研究方法
SARS-CoV-2 Sタンパク質の特徴、ワクチン開発、潜在的な治療法に関して、利用可能な科学的データを要約、分析、解釈するために、文献調査を行った。
結果
Sタンパク質のサブユニットとその多様なコンフォメーション状態が、ウイルスの病原性、感染性、進化的変異に大きく影響していることを示すデータが得られた。また、Sタンパク質を利用した天然および合成の治療法が数多く提案されている。また、最近、中和抗体が緊急用に承認された。さらに、Sタンパク質を利用したいくつかのワクチンも開発された。
結論
Sタンパク質の特徴、構造、変異をより深く理解することで、ウイルス感染におけるSARS-CoV-2のSタンパク質の重要性が認識され、治療法やワクチンの開発が促進される。これらの治療薬やワクチンの有効性や安全性については,まだ議論の余地がある。しかし、SARS-CoV-2の感染を抑制・予防することで、このパンデミックによる世界的な健康被害を大幅に軽減することができる可能性がある。
キーワード
SARS-CoV-2,スパイクタンパク、病態、変異、治療法、ワクチン
はじめに
SARS-CoV-2と呼ばれる重症急性呼吸器症候群コロナウイルス[76]は,長さ約30Kbのポジティブセンスの一本鎖RNAを持つエンベロープ型ウイルスである[30, 76]。このウイルスは中国で出現し,特に武漢では2019年12月に複数の重症肺炎患者が検出された[71]。最初はコウモリから中間宿主を介してヒトに感染した[31]。ウイルスは、それぞれがウイルスの感染性と伝播における特定のステップを担当するいくつかの構造および非構造タンパク質から構成されている[31, 71]。スパイク(S)エンベロープ(E)膜(M)ヌクレオカプシド(N)がウイルスの構造タンパク質を構成している[31, 71]。SARS-CoV-2に感染した人は、発熱、咳、下痢、息切れなどの軽度から中等度のインフルエンザ様症状が最も一般的な症状として現れる[31]。リスクの高い人で報告されている重症例には、呼吸不全や全身性の炎症が含まれており、これがさらに多臓器障害などの悲劇的な結果につながる可能性がある[31]。残念なことに、無症状の患者もウイルス感染の一因となる[31]。SARS-CoV-2の感染者が急増したため,WHOはSARS-CoV-2を世界的なパンデミックと宣言した。本稿執筆時点で、世界的な統計によると、188,332,972Mが現在確認されている症例であり、COVID-19の重篤な状態は0.6%で、残りの99.4%は比較的軽度である。全治率は98%、死亡率は2%と推定されている[105]。
Sタンパク質の特徴
SARS-CoV-2のSタンパク質は,S1サブユニットとS2サブユニットで構成されるクラスI融合膜貫通構造糖タンパク質である[71]。サイズは180-200kDa[43]、全長は1273から1300アミノ酸の間のホモ三量体である[113]。アミノ酸残基(1-13)はシグナルペプチドを構成している[43]。クローブ型の構造で[71]、ウイルスの表面から突出しており(図1)ウイルスの宿主細胞への結合や融合を担えるようになっている[30]。Sタンパク質は,宿主細胞の受容体であるACE-2を認識して結合するウイルスの基本単位であり[43],中和抗体の主要な標的となっている。
図1 SARS-COV-2のSタンパク質のドメイン構成を示す図
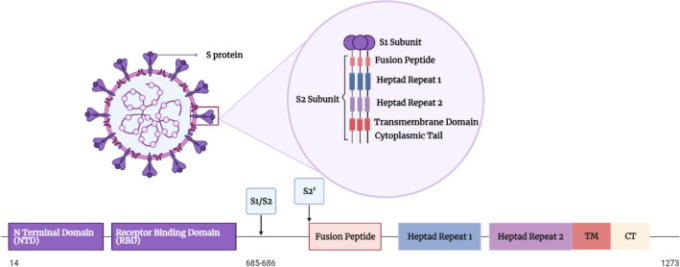
NTD N末端ドメイン、RBD受容体結合ドメイン、FP融合ペプチド、HR1ヘプタッドリピート1,HR2ヘプタッドリピート2,TM膜貫通ドメイン、CT細胞質尾部。S1/S2およびS2’。Sタンパク質の開裂部位
S1サブユニット
S1は672アミノ酸(14-685)残基からなる遠位のサブユニットである[30]。これらのアミノ酸は4つのドメインに編成されている。これらのアミノ酸は,N末端ドメイン(NTD),C末端ドメイン(CTD),あるいは受容体結合ドメイン(RBD),および2つのサブドメイン(SD1およびSD2)の4つのドメインに編成されている(図1)[30]。S1はV字型のエクト三量体サブユニットで,モノマーごとに1つのACE-2認識モチーフを収容して結合する[93]。各S1モノマーの頂点には,1つのRBDが存在する[93]。SARS-CoV-2のRBDは,β1,β2,β3,β4,β7の5本鎖の反平行βシートがねじれたコアから構成されていることが明らかになっている[93]。β4とβ7の間には,短いβ5とβ6鎖,α4とα5のヘリックスとループを含む拡張ループが存在する[93]。この拡張ループは,受容体結合モチーフ(RBM)として知られており,ACE-2受容体との相互作用を形成するRBDのアミノ酸のほとんどを含んでいる[30]。ACE-2のアミノペプチダーゼN領域は,RBDの結合に関与している[43]。RBDには9つのシステイン残基があり,そのうち8つは4対のジスルフィド結合を形成し,そのうち3対はβシート構造の安定化に役立つコアにあり,残りの1対はRBM遠位端のループを連結している[63]。
RBDとACE-2の界面を分析すると、RBDの17個のアミノ酸とACE-2の20個のアミノ酸が接触していることがわかった[63]。RBDとACE-2の界面における重要な特徴は、13個の水素結合と2個の塩橋が存在する親水性相互作用ネットワークである[63]。また、RBDのTyr449,Tyr489,Tyr505などの複数のチロシン系アミノ酸残基が水素結合を形成していることも特徴である[63]。さらに,RBMの外側では,RBDのLys417残基がACE-2のAsp30と塩橋相互作用を形成しているというユニークな相互作用がある[63]。RBDとACE-2の間の相互作用を阻害することで,SARS-CoV-2感染症の治療に有用であると提案されている[63]。しかし,RBDは変異性の高い領域であるため,広域抗ウイルス剤の開発には理想的な標的部位とはいえない[43]。
S2サブユニット
S2は,588アミノ酸(686-1273)残基からなる膜結合型のサブユニットである(図1)[30]。S2は,N末端の疎水性融合ペプチド(FP),2つのヘプタッドリピート領域(HR1およびHR2),膜貫通ドメイン(TM),細胞質尾部(CT)から構成される[30].FPは,グリシン(G)やアラニン(A)など,主に疎水性の15~20アミノ酸からなる短いセグメントである[43]。先行研究では、FPが宿主細胞膜の脂質二重層の破壊と接続を引き起こすことから、膜融合におけるFPの重要な役割が指摘されている[43]。HR1の位置はFPのC末端に、HR2の位置はTMドメインのN末端にある[43]。これらは反復するヘプタペプチドHPPHCPCで構成されており,Hは疎水性またはバルキーな残基,Pは親水性の残基,Cは荷電アミノ酸を示す[43]。これらの領域は,6つのらせん状の束(6-HB)を形成することで,ウイルスの融合と侵入に重要な役割を果たしている[43]。TMドメインは、Sタンパク質をウイルスの膜に付着させる[43]。
Sタンパク質の糖鎖シールド
Sタンパク質は多糖類でコーティングされている[43]。Sタンパク質の遺伝子は、モノマーあたり22個のN-結合型糖鎖シークインをコードしており、1つのS糖タンパク質には66個のN-結合型糖鎖が含まれることになる[93]。S2のモノマーと比較して、S1のモノマーはより多くのN-結合型糖鎖で覆われている[93]。この糖鎖シールドは、Sタンパク質の折り畳み、宿主細胞のプロテアーゼによる処理、免疫回避、体液性免疫反応の誘発などにいくつかの影響を及ぼす[93]。Sタンパク質の広範な糖鎖シールドがタンパク質表面をブロックすることで、特定のエピトープが抗体による中和から隠され、その結果、エピトープがマスキングされ、免疫逃避が促進される可能性がある[93]。さらに、グリコシル化されたS外ドメインと非グリコシル化されたS外ドメインは、どちらもACE-2とほぼ同じ親和性(1.7 nM vs 1.5 nM)で結合することが確認されており、Sタンパク質のグリコシル化は、ACE-2に対するSタンパク質の結合親和性を変化させないことが提唱されている[30]。しかし、SARS-CoV-2のSタンパク質の糖鎖シールドは、HIV-1などの他のウイルスの糖タンパク質と比較して、密度が低く、効果が低いことが示唆されており、このことは、体液性免疫の誘導やワクチン開発に有益であると考えられている[30]。そのため,ワクチン候補としての糖鎖部分の潜在的な免疫原性を調べることに大きな関心が寄せられている[30, 118]。
開裂部位
Sタンパク質が宿主のプロテアーゼによってS1およびS2サブユニットに切断されることは,融合プロセスを仲介する基本的なステップである(図1)[43]。Sタンパク質は通常、膜貫通型プロテアーゼセリン2(TMPRSS2)カテプシンL、フーリンなどの宿主プロテアーゼによって切断され[41]、その結果、ウイルスの活性化が促進され、SARS-CoV-2の病原性を表すことになる[72]。実際、ウイルススパイクの活性化は、TMPRSS4,TMPRSS11A、TMPRSS11D、TMPRSS11E1など、宿主細胞に存在する他のプロテアーゼによっても媒介される可能性がある[72]。SARS-CoV-2のSタンパク質の特徴は,S1サブユニットとS2サブユニットの境界に位置するユニークな多塩基性のfurin-like cleavage site(FCS)の存在であり,これによりSARS-CoV-2の感染時に宿主のフーリンプロテアーゼによるタンパク質分解処理速度が向上する[110].このことが,SARS-CoV-2の感染力を高め,感染しやすくしている[43].
コンフォーメーション
Sタンパク質の構造には,主に融合前と融合後のコンフォーメーションを含む,異なる状態に関連するものがある(図2)[15]。準安定な融合前コンフォメーションでは,RBDは開いた形と閉じた形のいずれかで存在している可能性がある[30, 31].閉鎖型では,3つのRBDがすべて下向きになっており,受容体結合領域が隠されている(受容体にアクセスできない)状態を表している[71]。RBDはその柔軟性のため,ヒンジのような動きをして,受容体結合領域を露出させる部分的に開いた状態(受容体アクセス可能)になる[71]。この状態では,1つまたは複数のRBDが「上」の位置にあるかもしれない[40]。これらの形態は,様々な割合で共存している可能性がある[101].しかし、閉じた状態が優勢である[101]。ACE-2に結合すると、この開いた動的な状態が安定化し、それによってさまざまな中間体を経てコンフォメーションが変化し、最終的には融合前のコンフォメーションから融合後のコンフォメーションへと変化する[101]。免疫原として使用する場合、これらの異なるコンフォメーションは、異なる免疫介在性抗体を誘発する可能性があり、最適な免疫化のための課題となっている[101, 111]。そのため、いくつかの研究では、Sタンパク質のコンフォメーションを安定化させようとしている[101, 111]。これは、ワクチン開発を成功させ、診断法を改善し、さらに、長期間の保存条件に対する耐性を高めることで基礎研究をサポートするなど、いくつかの利点がある[111]。
図2 SARS-COV-2 Sタンパク質がACE-2受容体と結合する際のコンフォメーション変化を示す図
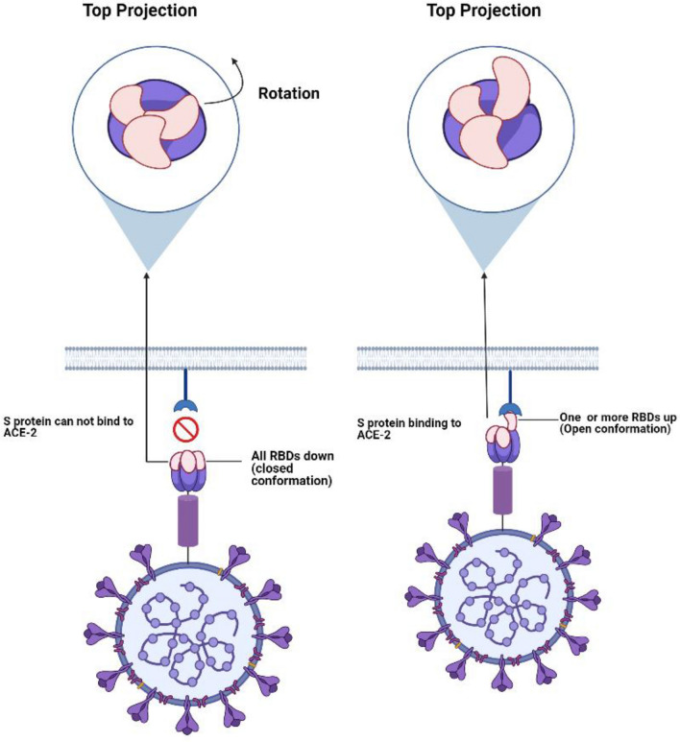
ウイルスの融合と宿主の侵入におけるSARS-CoV-2 Sタンパク質の役割
融合ペプチドに近接して、Sタンパク質の構造変化に大きな役割を果たす融合ペプチド近位領域(FPPR)の構造が発見された[15]。このFPPRは、S1/S2およびS2’の切断部位にも近接している[15]。上昇位置にあるFPPRとRBDの間のクロストークにより、後者はクランプダウンする[15]。しかし、RBDの力学的エネルギーが高いため、RBDは反転して「上」のコンフォメーションに戻ることができる[15]。この部分的に開いた構造により、RBDは宿主細胞上のACE-2と結合することができる[15]。その結果、S1/S2部位での切断が誘発され、S1-ACE-2の解離を引き起こし[51, 101]、柔軟なFPPRが形成されてS2’切断部位が露出し、融合ペプチドが放出されて宿主膜に挿入されることになる[15, 43]。続いて、HR2とHR1の間の相互作用が起こり、HR1ドメインのプレヘアピンコイルドコイルが露出し、6-HB(six-helical bundle)が形成される[101]。最終的には、ウイルスの融合と侵入のために、ウイルスエンベロープを細胞膜に近づける[101]。
Sタンパク質の進化パターンがウイルスの感染力と感染率を支える
SARS-CoV-2は人獣共通感染症に由来しており[62]、最近のパンデミックでは、種間の壁を越えて、いつでも動物から人間に感染し、予測できない結果をもたらす能力があることが明らかになっている[61, 113]。実際、ウイルスの進化能力とその変異率を知ることは、ウイルスの伝搬、病原性、感染性の脅威をよりよく理解するのに役立つ[31, 71]。さらに、免疫系の回避メカニズムや薬剤耐性の発達を理解し、正確で効果的な治療法を開発するのにも役立つ[31, 71]。
SARS-CoV-2の進化をより深く理解するために,現在のパンデミック中に分離されたいくつかの株について,ゲノム配列の解析が行われた[47]。いくつかの遺伝的進化の特徴が確認され、報告されており、SARS-CoV-2は、全ゲノム配列の79.6%をSARS-CoV-1と共有していることが示された[109]。興味深いことに、SARS-CoV-2のSタンパク質は、SARS-CoV-1のSタンパク質と79%程度のアミノ酸配列の同一性を有している[31, 48]。したがって、残りの非保存のヌクレオチド配列が、新株の異なる抗原性を説明していると考えられる[71]。この進化上の特徴は,免疫系と対峙するウイルスの侵入に大きな役割を果たしていることと一致している[89]。RBDとS1-NTDが示す結合パターンの大きなばらつきから、両部位は強い進化圧力を受けていると結論づけることができる[89]。
研究によると,ほとんどの進化的変異は,アミノ酸残基のユニークなパターンで表される両部位に生じていることがわかっている[89]。このような分子進化の早い残基は、タンパク質の柔軟性を高め、ACE-2のインターフェースや重要な結合部位に近いコンフォメーションをとり、宿主の細胞表面タンパク質との類似性が高いという特徴があり、その結果、免疫回避の可能性を高めることになる[89]。さらに、SARS-CoV-2のSタンパク質は、SARS-CoV-1のそれよりもACE-2に対して10-22倍高い結合親和性を示した[101]。これは、界面での接触が増えたことと、Sタンパク質の3つの変異ホットスポットによって、より特異的でコンパクトなコンフォメーションが形成され、SARS-CoV-2の宿主への感染範囲に貢献していることに起因する[62]。結局、RNAウイルスであることから、SARS-CoV-2は時間をかけて進化し続けることが予想される[101]。
SARS-CoV-2のSタンパク質の注目すべき進化の特徴は、以下のようにまとめられる
ACE-2結合を担うRBD領域の進化的変異
一般に、ACE-2の20残基は、SARS-CoV-1とSARS-CoV-2の両方のRBDの16と17のアミノ酸残基との結合相互作用を担っている[63]。SARS-CoV-2のRBDのLys417残基は、静電ポテンシャルを発生させる正電荷のパッチを持ち、これがSAS-CoV-1と比較して高いSARS-CoV-2 RBD-ACE-2結合親和性の原因となっている[63]。2つのRBDには、側鎖が異なる他の5つの残基が存在するが、生化学的特性は同じである[63]。しかし、SARS-CoV-1のLeu472は、ACE-2のLeu79とMet82と相互作用を形成し、SARS-CoV-2のPhe486は、ACE-2の異なるアミノ酸残基と追加の相互作用を形成している[63]。さらに、SARS-CoV-1のAsn479残基はACE-2のHis34とのみ相互作用するが、SARS-CoV-2のGln493はLys31,His34と結合を形成し、特にACE-2のGlu35と水素結合を形成している[63]。さらに、SARS-CoV-1のValをSARS-CoV-2のリジン残基で置換したことにより、ACE-2のLys417とAsp30との相互作用時に特殊な塩橋を形成するという利点がある[63]。これはSARS-CoV-1のバリン残基では許されない特徴であり、SARS-CoV-2とACE-2受容体の間のより強い相互作用を説明し、SARS-CoV-2のより高い感染力の原因となっている[76, 90]。SARS-CoV-1の受容体結合モチーフ(RBM)には3残基のモチーフが含まれているが、SARS-CoV-2には4残基のモチーフが含まれている[76, 90]。この4残基のモチーフは、SARS-CoV-2のRBMに追加の水素結合形成をもたらし、そのループをACE-2に近づけ、よりコンパクトな形態を確立する[76, 90]。これにより、ACE-2のN-terminal helixとの接触が増え、より大きな結合界面が形成される[76, 90]。
ACE-2のウイルス結合ホットスポットは、2つのリジン残基が関与しており、ウイルスの結合に重要な役割を果たしている[90]。完全な結合のための重要な要因は、これらのリジン残基の電荷を中和することである[90]。これは、これらのホットスポットを安定化させる特定のアミノ酸によって達成される[90]。SARS-CoV-2のこの排他的な安定性パターンは、その高い感染力と感染率を説明するものと思われる[116]。
多塩基性FURIN切断部位
SARS-CoV-2は,S1/S2接合部にユニークな多塩基性の切断部位があることが特徴であり,この部位はウイルスの感染性,発病性,伝達性の決定に重要な役割を果たしていると考えられている[116]。ウイルスの高い病原性の原因になっていると予想されている[76]。Sタンパク質は、ウイルス細胞内のfurinおよびfurin-like proprotein convertaseによってあらかじめ活性化されている[48]。これは、このfurin切断部位を持たないSARS-CoV-1とは対照的である[107]。
O-linked glycans
SARS-CoV-2のS1/S2接合部にはプロリン残基が同定されており[49]、この残基がS673,T678,S686にO-結合型糖鎖を付加する原因であると予測されている[9]。その正確な機能は不明であるが,ウイルスが糖鎖のシールドとして利用する「ムチン様ドメイン」の形成に寄与している可能性がある[9]。しかし、SARS-CoV-2におけるその意義を証明するには、さらなる研究が必要である[9]。この糖鎖シールドは、エピトープを隠すことでウイルスの病原性に寄与している可能性が示唆されているが、活性化プロテアーゼによる処理を妨げる切断部位を挟んでいる可能性もある[49]。
SARS-CoV-2のSタンパク質のユニークな突然変異
SARS-CoV-2のゲノムには、753個のミスセンス、452個のサイレント、12個のナンセンス、4個の遺伝子間置換など、いくつかのヌクレオチド多型が検出されている[31]。Sタンパク質は、遺伝子変異の割合が高く、変異率は約1.21であった[31]。これらの変異は、地理的な分布、配列決定の時間、遺伝子間の組み換えによって大きく変化する[57]。このことは、世界的に急速に広まっていることにも起因している[61]。それにもかかわらず、他の変異が共存していることが報告されており[101]、ウイルスの感染、病原性、病気の重症度への影響を完全に理解することは困難である。
Sタンパク質のD614G変異
G614は、Sタンパク質をコードする遺伝子のミスセンス変異である[47]。Dは、614位のアスパラギン酸残基がグリシン(G)アミノ酸に置換されていることを示している(D614G)[71]。これは,RBDの外側にあるS1サブユニットのサブドメイン2(SD2)に位置している[109]。D614Gの変異は,異なる地域での感染性や伝達性を高めることが報告されている[61]。この変異は、呼吸器分泌物中のウイルス量を増加させているが、病気の重症度には影響していないようである[104]。さらに,ユニークな多塩基性のfurin切断部位がSタンパク質の安定性を低下させ,この不安定性を補うためにウイルスがこの変異を起こすきっかけとなっている[48]。
いくつかの研究では,感染力の向上は,スパイクの変異体D614Gがオープンなコンフォメーション状態を好むことと相関していることが示されている[38]。アスパラギン酸残基をより小さなグリシンアミノ酸に変異させることで柔軟性が増し,閉じた「ダウン」状態から開いた「アップ」状態へと容易に移行できるようになるのかもしれない[61].さらに,D614Gは,Sタンパク質のモノマー間に形成される重要な塩橋の崩壊を引き起こすが,これは,この塩橋相互作用を形成するアミノ酸間の距離が長くなるためである[109]。そのため、RBDへのアクセス性が高まり、ウイルスの細胞への結合と融合が促進される[109]。注目すべきは,G614ビリオンでは,S1の排出量が限られており,Sタンパク質の密度が高いことが報告されていることである[31, 116]。このことから、D614G変異がウイルスの感染力を高め、ACE-2を発現する細胞への侵入効率を高め、それに伴って機能的なSタンパク質のビリオンへの組み込みを増加させるという新たな仮説が生まれた。このメカニズムは、「密度仮説」と呼ばれている[31, 116]。別の仮説「安定性仮説」では,G614グリシン残基がNTDとCTD1の間に挿入されたループを介してS1とS2の間の相互作用を安定化させることで結合部位の数を増やし,その結果,S1の脱落が減少すると考えられている[48, 116, 117]。しかし,この変異がウイルスの感染力と伝播力を高めるために採用された正確なメカニズムを理解するには,さらなる調査が必要である[48]。もともと、多くのSARS-CoV-2ワクチンはスパイクのD614変異体を利用して設計されていたが、G614変異がワクチンの効果に影響を与えるのではないかという懸念が生じている[37]。さらに、G614変異体は、RBD特異的モノクローナル抗体や過去に感染したことのある人の血清サンプルによる中和に対して、より脆弱であるというデータが大半を占めている[104]。これは、RBDのアップコンフォメーションの割合が高いため、この変異体では中和エピトープの露出度が高いことで説明できる[104]。
治療およびワクチン開発の潜在的な標的としてのSARS-CoV-2のSタンパク質
前述のデータは、SARS-CoV-2 Sタンパク質の免疫原性特性[45]に加えて、Sタンパク質がウイルスの侵入、発病、感染を開始するための主要な反応因子であることを示している[79, 87]。そのため、Sタンパク質に対する複数の治療薬が提案されている。一方で、S(RBD、S1-NTD、S2サブユニットを含む)N、M、Eタンパク質といういくつかの標的が、ワクチン開発の可能性を求めて研究されている[87]。一方、Nタンパク質は、豊富な量と高い免疫原性を持ち、マウスモデルでCoVに対する防御作用を示したものの、SARS-CoV-2感染に対する防御作用はなく、代わりに感染誘発性肺炎を増強した。したがって、これらのタンパク質はいずれも、SARS-CoV-2ワクチンの開発には賢明な選択ではない[25]。したがって、SARS-CoV-2に特異的な強力な中和抗体を引き出すための最適な標的は、Sタンパク質である。現在、防護対策の大半はSタンパク質をベースとしたワクチンであり、それゆえに防護効果と許容できる安全性プロファイルを示している[112]。一般に,S1-NTDおよびS2サブユニットを標的にすると,中和活性を持つ抗体が誘導されるが,現在のSARS-CoV-2株に対してより高い選択性を持ちながら,非常に強力な中和抗体を引き出すためには,RBDが主要な標的であると考えられている[112]。
SARS-CoV-2のSタンパク質を用いた治療法の可能性
SARS-CoV-2 Sタンパク質の重要な特徴は、治療薬開発のための優れたターゲットとなっている(表(表1;1;図3)[9, 97])。
表1 SARS-CoV-2 Sタンパク質を標的としたさまざまな潜在的治療法の概要
| 処理 | ソース | 作用機序 | 臨床段階(87) |
|---|---|---|---|
| ナチュラル/再利用製品 | |||
| リノール酸 | 植物油から得られるN-6多価不飽和脂肪酸(PUFA) | Sタンパク質のRBDのLA結合ポケットに結合します | NA、潜在的な薬 |
| エモジン | 天然アントラキノン | Sタンパク質とACE-2受容体の相互作用を阻害する可能性があり、COVID-19に関連する炎症を抑制します | NA、潜在的な薬 |
| ビソキサチン | 合成薬 | Sタンパク質のRBDに有意に結合する | NA、計算研究、潜在的なリード化合物 |
| 天然レクチン | |||
| GRFT(グリフィスシン) | 紅藻Griffithsiasp。から分離された藻類由来レクチン | S1サブユニットのグリコシル化部位に結合し、ウイルス侵入に不可欠な後続のステップを防ぎます | インビトロ研究、フェーズ:NA |
| フリル | Lablabpurpureus 植物から単離されたグルコース/マンノースレクチン | 高マンノース型糖鎖および複合型N型糖鎖に結合します | インビトロ研究 |
| 抗ウイルスペプチド | |||
| EK1C4 | 合成リポペプチド | Sタンパク質のHR1ドメインをターゲットにします。したがって、ネイティブ構造と同様の6-HB構造を形成すると、ウイルス融合が阻害されます。 | 前臨床(invivo研究) |
| SBP1 | 合成ペプチド | ACE-2PDα1ヘリックス配列の残基21〜43を模倣し、RBDに結合して、ACE-2とSタンパク質の相互作用を妨害します | 潜在的な阻害剤は、動物およびヒトの細胞でさらに試験する必要があります |
| 組換えベースの治療 | |||
| 組換え可溶性ACE-2 | ヒト組換え | Sタンパク質に競合的に結合し、膜結合型ACE-2受容体からウイルスをそらします | ランダム化介入(臨床試験)、フェーズ:NA |
| カシリビマブ、イムデビマブ、バムラニビマブ、エテセビマブ | 中和モノクローナル抗体(mAbs) | SARS-CoV-2 Sタンパク質RBDに結合し、ACE2への付着を阻害します | 緊急緊急使用を認可されたFDA(フェーズII–III臨床試験) |
図3 SARS-CoV-2のSタンパク質が融合して侵入する際に介在する肺の病因と、その治療法の可能性と現行のワクチン
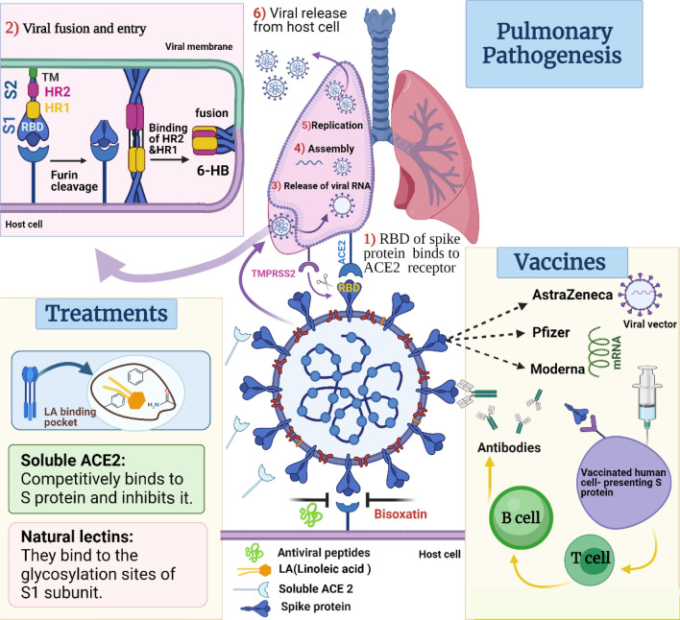
天然物由来の治療法
リノール酸
最近、研究チームは、SARS-CoV-2 Sタンパク質の中に、「薬になる」可能性のある重要な結合ポケットを予想外に発見した[51]。市場で入手可能ないくつかの医薬品や脂肪酸サプリメントは、Sタンパク質の三量体のポケット部位に親和性を示す可能性があり、それによってSタンパク質のACE-2受容体へのアクセス性が阻害されると考えられている[9]。S三量体のRBD間の界面に埋もれた油性チューブのような密度が観察され,3つの遊離脂肪酸結合ポケットと解釈された[97]。このポケットは,フェニルアラニンを中心とした疎水性アミノ酸で構成されており,リノール酸(LA)の炭化水素テールを収容することができる[97]。さらに,三量体の隣接するRBDのアルギニン残基とグルタミン残基が親水性の正電荷を与え,負電荷を持つLAのカルボキシル基を固定することで,LAが結合部位に適切に収まるようになっている[97]。
さらに調べてみると,リノール酸結合ポケットには,2つのチロシン残基を含む疎水性ポケットの入り口にゲーティングヘリックスがあり,隣接するRBDの間にはアルギニン残基とグルタミン残基をリノール酸のカルボキシル基の位置から離して(~10Å)配置するギャップがあることがわかった[97, 98]。そのため,リノール酸はゲーティングヘリックスを(~6Å)再配置し,2つのチロシン残基をリノール酸との衝突を避けるために振り切らせる。その後、ポケットが開き、隣接するRBDが隣のRBDに向かって移動し、リノール酸の親水性アンカーをロックダウンすることになる[97, 98]。このようにして,RBD三量体に硬い圧縮構造が形成され,Sタンパク質がホスト受容体からアクセスできないような閉じた構造になる。したがって,LAはACE-2の付着を減少させ,その結果,侵入と感染力を減少させることが期待される[9]。実験的には,ヒト上皮細胞の培養にLAを補充すると,レムデシビルとの相乗効果が得られ,ウイルスの複製が顕著に抑制された[11]。
遊離脂肪酸結合ポケットは、過去の病原性ヒトコロナウイルス(HCOVS)でも報告されている[9]。SARS-CoV-2のLA結合ポケットをSARS-CoV-1のそれと構造比較すると,すべての疎水性および親水性残基が保存されていることが明らかになった[97, 98]。対照的に、他の流通しているHCOVでは構造的な違いが観察され、LA結合の失敗の原因となっていた[97]。
LA結合ポケットの発見は、新しい遊離脂肪酸を用いた治療法の開発への道を開くものとして注目されている[97]。パルミチン酸,オレイン酸,ステアリン酸,リノール酸などの藻類油の脂肪酸は,SARS-CoV-2エンベロープの脂質膜に取り込まれることで,その二重層を不安定にしたり,ウイルスの宿主細胞への付着を妨げたりするなど,COVID-19の感染を予防するいくつかのメカニズムを持っている[94]。さらに、ゴマ油はリノール酸濃度が高い(41%)ため、SARS-CoV-2感染に対する保護効果が期待できると提案されている[53]。最近の研究では、SARS-CoV-2感染の拡大を抑える保護方法として、主にリノール酸を含む油性の鼻腔スプレーの使用が提案されている。しかし、この提案はさらなる臨床的・実験的研究が必要である[94]。
ビスオキサチン
Sタンパク質の強力な阻害剤を同定するために,RBDに対する薬剤ライブラリを用いて計算機上の研究が行われた[98]。選択された化合物はLipinskiの5つのルールを満たし、それらはSタンパク質とACE-2受容体の間の相互作用を崩壊させる可能性のある重要な相互作用を調査した[98]。これらの研究により、下剤であるビスオキサチン(DB09219)は、アミノ酸残基とπ-πおよび親水性の相互作用を形成することにより、Sタンパク質のRBDに有意に結合し、Sタンパク質-ACE-2相互作用を阻害することが示された[98]。したがって、ビスオキサチンは、SARS-CoV-2のSタンパク質阻害剤を開発するためのリード化合物として利用することができる[98]。
エモジン
エモジンは,天然のアントラキノンであり,試験管内試験の解析でSタンパク質とACE-2受容体の相互作用を阻害する能力を示した[26, 55]。また,活性化マクロファージの分極を阻害することにより,喘息性気道炎症を緩和することから,COVID-19に関連する炎症を抑制する可能性があると考えられている[108]。しかし、毒性があり、作用機序が十分に解明されていないため、合理的な使用が制限されている[26]。
抗ウイルスペプチドを用いた治療法
ACE-2とSタンパク質の間のタンパク質-タンパク質相互作用は,治療介入のための潜在的な標的を表している[67, 92, 114]。RBDの大きな界面を小分子の薬剤で阻害することは、通常、効果的ではなく困難である[92, 114]。代わりに,ペプチドを利用することができる。ペプチドは表面積が大きく,より多くの官能基が結合部位と相互作用できるため,これらのネイティブなタンパク質-タンパク質相互作用を模倣して阻害することができる[92]。さらに,ペプチドは,Sタンパク質の6-ヘリカルバンドル(6-HB)の形成を阻害するために利用することができる[69]。興味深いことに、抗ウイルスペプチドは、肺の局所投与のために吸入剤として製剤化することができ[92]、その結果、起こりうる全身性の副作用を軽減することができる[51]。可能性のある抗SARS-CoV-2ペプチドには以下のものがある。
EK1C4
EK1は、36個のアミノ酸からなるコロナウイルス融合阻害剤であり[69]、ヒトコロナウイルスのSタンパク質のヘプタッドリピート-1ドメインを標的として設計されている[51]。そのため,ネイティブなものと類似した6-HB構造を形成し[102],ウイルスの融合を阻害する[51]。このペプチドは,試験したすべてのヒトコロナウイルスに対して強力な阻害活性を示した[51]。最近では,EK1がSARS-CoV-2に対して有効なペプチドであることが報告されている[51]。しかし,EK1は6-HB構造の安定性が高いため,SARS-CoV-2では抗ウイルス効果が低いことがわかった[51]。EK1の活性を向上させるために、そのC末端をコレステロール(EK1C)またはパルミチン酸(EK1P)にグリシン/セリンリンカーとポリエチレングリコール(PEG)スペーサーで共有結合させた。リンカー/スペーサーの存在と長さは,形成されるリポペプチドの活性に影響を与える[33]。
EK1C4は,SARS-CoV-2のSタンパク質を介した膜融合に対して強力な活性を持つリポペプチド[33]である[51, 102]。EK1C4のEK1部位は,HR1三量体の3つの疎水性溝のうちの1つに結合し,コレステロール部位を利用して隣接する疎水性溝に固定することが示唆されている[51]。In vivoの研究では,EK1C4がコロナウイルス感染に対して,毒性がないか最小限であることが確認されている[51]。したがって,SARS-CoV-2感染症や将来出現するかもしれない他のヒトコロナウイルスの予防や治療のための有望な汎CoV融合阻害剤と考えることができる[51]。
23-Merペプチド(SBP1
ACE-2のペプチダーゼドメイン(PD)のα1ヘリックスがRBDとの結合に重要であることが示されている[99]。したがって,SBP1は,ACE-2のPDα1ヘリックス配列の21-43残基を模倣するように設計・合成された[92]。このSBP1は,ウイルスのRBDに結合し,ACE-2とSタンパク質の相互作用を阻害することができる[33, 114]。SBP1は,ヒトのタンパク質に由来するため,免疫原性の影響は期待できない[114]。SBP1の結合親和性は,マイナーチェンジによってさらに改善され[92],新たに設計された25merのペプチドであるSPB25につながった。それに伴い,5つのペプチドが設計されたが,最も有望だったのはSPB25F8Nであった[92]。その主な理由は,予測された水素結合の数が多く,π相互作用が関与していたからである[92]。
以前は,ペプチドは,高価な合成,限られた安定性,バイオアベイラビリティなど,多くの課題を抱えていた。しかし,技術的な進歩と化学的な改良により,これらの課題を克服することができた[99, 114]。さらに、これらのペプチドをナノ粒子に結合させることで、結合親和性を高め、複数のウイルスに対する抑制効果を得ることができるが[99]、SARS-CoV-2への使用にはさらなる検討が必要である。
天然レクチンを用いた治療法
Sタンパク質は高度に糖化されたタンパク質であるため、レクチンのような糖鎖結合剤の潜在的な標的となりうる[107]。
グリフィスチン(GRFT)
GRFTは,紅藻類Griffithsia sp.から単離された藻類由来のレクチンであり,広範囲の抗ウイルス活性を示す[14]。実験的に,GRFTは試験管内試験でSARS-CoV-2感染に対して大きな抑制効果を示した[14]。GRFTは,3つの独立した糖鎖結合部位を有しており[52],S1サブユニットの糖鎖結合部位に選択的に結合することができ,その結果,ACE-2との結合能力を保持した複合体が形成されることが報告されている[52]。しかし,ウイルスの侵入に不可欠な後続のステップを阻止することができる[52]。さらに,GRFTには免疫調節作用があり,特に感染した肺細胞のサイトカイン反応を変化させることが分かっている[52]。重要なことに、以前の研究では、GFRTとEK1の結合部位が異なることから、GFRTとEK1を併用することで相乗的な抗ウイルス活性が得られることが報告されており、SARS-CoV-2感染症の予防と治療のためのカクテル療法の可能性を示唆している[14]。研究では、GFRTの抗ウイルス活性濃度はいかなる毒性も示さず、効果的に高い効力を示し、潜在的な成果が期待できることが明らかにされている[64, 88]。
FRIL
FRILは、Lablab purpureus植物から単離されたグルコース/マンノースレクチンであり[77]、Flt3 Receptor Interacting Lectinと呼ばれている[107]。FRILは,SARS-CoV-2を効果的に中和する能力を示し,その結果,ウイルスの細胞毒性作用を完全に抑制した[77, 107]。FRILは,Sタンパク質のN-グリコシル化部位の中で優勢な糖鎖である複合型N-グリコシルに結合する。これは、その高い結合親和性を説明するものである[107]。
組換え体ベースの治療法
可溶性ACE-2
ACE-2は、SARS-CoV-2の重要な機能的受容体として、ウイルスの宿主細胞への侵入を可能にし、心臓、肝臓、腎臓、肺などの複数の臓器の保護経路としての役割を果たすという二重の機能を持っている[119]。これは、レニン-アンジオテンシン-アルドステロン系(RAAS)のホメオスタシスを調節する酵素および触媒機能に起因する[46]。実際に、Sタンパク質の結合後にACE-2がダウンレギュレートされ、それが重度の疾患の進行と肺機能の悪化に寄与するという研究報告がある[115]。
可溶性ACE-2を過剰に投与すると、SARS-CoV-2のSタンパク質と競合的に結合し、膜に結合したACE-2受容体からウイルスの気をそらすことができるため、ウイルスを中和し、宿主細胞への侵入を抑制することができることが実証されている[73, 115]。ヒト組換え可溶性ACE-2(rhACE2;APN01,GSK2586881)が開発され[115]、SARS-CoV-2のSタンパク質に対する結合親和性が約1.2nMであることが研究で示された[119]。APN01は,すでに第1相と第2相の臨床試験に合格しており,急性呼吸窮迫症候群(ARDS),急性肺損傷(ALI),肺動脈性肺高血圧症(PAH)の肺損傷を軽減することができた。加えて、忍容性と安全性も高い[54]。注目すべきは、同等のマウスrsACE-2も、マウス組換え可溶性ACE-2(mrsACE2)も、SARS-CoV-2ウイルスの侵入を阻止することができず、APN01の独自性が明らかになったことである[73]。さらに、APN01がSARS-CoV-2感染の初期段階でウイルス量を1,000〜5,000減少させることを阻止する能力が高いことを示すデータもある。しかし、病気の後期におけるその効果はまだ決定されていない[73, 119]。この阻害は、おそらく他のコ・レセプターの存在により不完全なものであったが[73]、用量依存関係が観察された[119]。
重要なのは、APN01を投与することで、SARS-CoV-2に対するIgAおよびIgG抗体ができることが実験的に示されたことである[8, 119]。これらのデータを総合すると、APN01の有益な効果には、ウイルスの侵入、拡散、そして最終的にはウイルスの中和を遅らせることが含まれることが示唆された。また、APN01は細胞のACE-2を維持し、重要な身体器官に対する保護作用を維持することができる[8, 56, 115, 119]。
モノクローナル中和抗体
最近、米国FDAは、SARS-CoV-2のSタンパク質に対する合成中和モノクローナル抗体を緊急に使用することを許可した[7, 34]。これらのモノクローナル抗体、すなわちカシリビマブ、イムデビマブ、バムラニビマブ、エテセビマブは、12歳以上の成人および小児における軽度から中等度のCOVID-19の治療、または重度の疾患進行の可能性がある高リスク者の治療に適応されている[6, 7]。バムラニビマブは、SARS-CoV-2のSタンパク質のRBDを標的としている。カシリビマブとイムデビマブは,SARS-CoV-2のSタンパク質RBDの重ならないエピトープに結合する組換えヒトモノクローナル抗体である。エテセビマブは、SARS-CoV-2のSタンパク質のRBDの異なるが重複するエピトープに結合する[96]。
なお、これらの薬剤は、重症例、入院患者、人工呼吸を必要とする患者の状態を悪化させる可能性があるため、使用すべきではない[6,7]。重要なのは、これらの治療法を組み合わせて静脈注射で使用することである。これらの組み合わせには、カシリビマブとイムデビマブの併用などがある[2]。バムラニビマブは単剤での使用が許可されていたが、ごく最近、SARS-CoV-2耐性の増加に伴う有効性の欠如を理由に、この許可は取り消された[2, 3]。現在、バムラニビマブは、エテセビマブとの併用が認められている[2, 3]。この緊急承認は、これらの抗体がウイルス量や入院を減少させる能力を示しているため、リスクを上回る潜在的なメリットがあるとFDAが確信しているためである。したがって、このパンデミックによる健康被害を軽減することができる。これらの薬剤の副作用は、発熱、悪寒、かゆみ、輸液関連反応、アナフィラキシーショックなどさまざまである。しかし、これらのmAbの安全性と有効性はまだ評価中である[6, 7]。
最近のSARS-CoV-2のVOC(variant of concern)特にSタンパク質が大きく変異したVOCの出現により、回復期の患者では抗体の中和活性が低下していることが報告されている[23, 42]。最近の研究では、抗Sタンパク質カシリビマブとイムデビマブのモノクローナル抗体の組み合わせが、SARS-CoV-2の変種B.1.1.7,B.1.351,ミンククラスター5,COH.20G/677Hを中和する能力を検証した。この抗体の併用療法の効果は、B.1.351では9.1倍、ミンク・クラスター5では16.2倍に低下した。これらの結果は、このモノクローナル抗体を用いたアプローチを新しい亜種の治療に用いることの有効性に対する懸念を引き起こし、世界のSARS-Cov-2亜種をカバーする新しいモノクローナル抗体を開発する必要性を促した[95]。一方、メモリーB細胞に由来する41種類のヒトモノクローナル抗体(mAbs)が同定され、SARS-CoV-2のS N-末端ドメイン(NTD)特にスーパーサイトIに対して強力な中和活性を示し、防御免疫やワクチン設計における重要性が示唆されている[70]。
治療としての回復期血漿
COVID-19の感染を予防・管理するための治療法として回復期血漿を利用すると、免疫・非免疫の二重の作用機序が得られるが、最も重要なのは、Sタンパク質に対するものを含む中和抗体によるものである[85]。ほとんどのウイルス性疾患では、感染後1週間以内にウイルス血症のピークが観察され、主な宿主の免疫反応は通常、感染後10日目から14日目の間に起こるため、感染の初期段階が回復期血漿を効果的に投与する最適な時期であると考えられる[80]。COVID-19の管理における治療としての血漿の有効性はまだ議論の余地があるが、軽度の感染者に72時間以内に高力価の回復期血漿を早期に投与すると、SARS-CoV-2の感染リスクの進行が48%と大幅に減少した。逆に、入院中の患者が感染後に血漿を投与されても、その効果は認められなかった[66, 85]。
免疫系防腐剤
人体で産生される内因性の抗炎症物質や広域抗病原性物質は、SARS-CoV-2を含む呼吸器感染症の抗ウイルス剤の開発に応用できる安全な治療法である[59]。N-クロロタウリン(NCT)や次亜塩素酸(HOCl)は,ヒトの免疫系が産生する内因性物質の一例である[12, 59]。N-クロロタウリン(NCT)は,ヒトの免疫系細胞である好中球,好酸球,単球で産生される長時間作用型の酸化剤である。NCTは化学合成され、下気道感染症の防腐剤として吸入により局所投与される。動物実験では,繰り返し吸入した場合の忍容性が確認されている[59]。ある研究では,NCTが1%の治療濃度でSARS-CoV-2およびA型インフルエンザウイルスに対して殺ウイルス活性を示した。この広範囲な活性は,侵入した病原体にかかわらず瞬時に適用できるため,診断にかかる時間をなくすことができる。また、細菌や真菌にも効果があるので、COVID-19患者の二次感染や超感染の予防にも大いに役立つだろう。また、本剤は局所適用であるため、全身性の副作用がなく、他の薬剤との相互作用もない。しかし、その臨床効果については、さらなる調査が必要である[59]。
HOCLは、すべての哺乳動物の好中球、好酸球、単核食細胞、Bリンパ球によって産生されるもう一つの内因性物質である。この物質は強力な酸化剤であり、微生物に対して広い範囲で活性を持つ。ウイルスのDNAを破壊するクロラミンとラジカルを形成することで、ウイルスを破壊する[12]。また、複数の感染症や炎症状態の管理に局所的に広く使用されている(Lori Robins 2021)。ある研究では、サイトカインであるIL-6がHOCLとNCTにさらされた後、試験管内試験でIL-6受容体に結合できなかったことが示され、IL-6の化学修飾を誘発することが示された。注目すべきは、IL-6がSARS-CoV-2感染に伴う急性炎症状態の発症に関与していることである。また、COVID-19患者では、全身および肺組織においてIL-6レベルが上昇していることから、生体内でのIL-6受容体との結合を低下させることができれば、病気の重症度や進行を緩和することが期待できる。サイトカイン・ストームを緩和するためにHOCLやNCTを用いることは、モノクローナル抗体に代わるアプローチとなり得る。さらに強調すると、モノクローナル抗体の投与は高価で入院が必要であるのに対し、HOCLとNCTは吸入製剤で開発された場合、入院の必要がなく、患者が容易に投与することができる(Lori Robins 2021)。
TMPRSS2を標的とした治療法
COVID-19が原因で、女性よりも男性の方が死亡率や入院率が有意に高いことがいくつかの研究で示されている。多因子性の理由が示唆されているが、アンドロゲンがTMPRSS2の発現を調節するため、男女間のアンドロゲンレベルの違いが大きな理由となっている[82]。高レベルのエストロゲンはTMPRSS2の発現を増加させる。したがって、アンドロゲン受容体の活性を阻害したり、エストロゲン経路を活性化したりすることで、SARS-CoV-2の侵入を防ぐことができる(Wang, 2020)。FDAで承認された抗前立腺癌薬であるダロールタミド、アパルタミド、エンザルタミドなどのアンドロゲンアンタゴニストは、TMPRSS2の発現を転写的にダウンレギュレートするため、SARS-CoV-2の感染を弱めることができる[82]。
SARS-CoV-2 Sタンパク質ベースのワクチン開発
COVID-19パンデミックの拡大を抑制する上で重要な役割を果たすことから、Sタンパク質に対するワクチンの開発が提案されている(表(表2;2;図3))。ワクチンは、病気の発生率を低下させ、集団全体の免疫力を高めることができるため、その安全性、有効性、価格を確保する必要がある。実際、数多くのワクチン候補が提案されたり、臨床試験が行われたりしている[100]。これらには以下が含まれる。
表2 Sタンパク質を利用したSARS-CoV-2に対する現在のFDA承認済みワクチンの概要
| ワクチン(ブランド名/一般名) | メーカー | ワクチンプラットフォーム | 抗原 | 投与量と投与計画 | 全体的な有効性 | 臨床相[ 50、108 ] |
|---|---|---|---|---|---|---|
| モデルナ/ mRNA-1273 | モデルナ(米国) | mRNA | プロリン置換により融合前の状態で安定化された全長Sタンパク質 |
100 µg 28日(約4週間)間隔で筋肉内注射による2回投与 |
94.1% |
フェーズI〜III 緊急使用のためにFDAによって認可された |
| アストラゼネカ/ ChAdOx1nCoV-19 | オックスフォード-アストラゼネカ(英国) | ウイルスベクター | 完全長SARS-CoV-2Sタンパク質遺伝子を利用した組換え複製欠損チンパンジーアデノウイルスベクター |
標準用量:0.5 mLの5×10含有10個の ウイルス粒子を 8〜12週間の間隔で区切られた筋肉内注射による2回の投与 |
70・4% |
フェーズI〜III 最近、緊急使用のためにWHOによって承認されました。FDAはまだ承認していません |
| ファイザー/ BNT162b2 | ファイザー-BioNTech(米国) | mRNA | プロリン置換により融合前の状態で安定化された全長Sタンパク質 |
30μg 21日間隔の2回投与レジメン |
95% |
フェーズI〜III 緊急使用を許可 |
| (ヤンセン/ジョンソン・エンド・ジョンソン)/Ad26.COV2。NS | ヤンセン/ジョンソン・エンド・ジョンソン(米国) | 組換え型、複製能のないヒトAd26ベクター | プロリン置換により融合前の状態で安定化された全長Sタンパク質 |
1回分(0.5 ml)には、5×1010個の ウイルス粒子が含まれています 1回の投与 |
66.3% |
フェーズI〜III 緊急使用のためにFDAとWHOによって認可されています |
| Novavax / NVX-CoV2373 | Novavax(米国) | Sタンパク質サブユニット | 融合前に安定化された完全長組換えSタンパク質 |
1回の投与量には5µgのタンパク質と50 µgのアジュバントが含まれています 21日間隔で2回投与 |
90.4% | フェーズI〜III |
| CureVac / CVnCoV | キュアバックAG。(ドイツ) | mRNA | 融合前に安定化された完全長Sタンパク質 |
12μg 28日間隔で2回投与 |
48% | フェーズI〜III |
mRNA-1273(Moderna社製ワクチン)
mRNA-1273ワクチンは、Moderna社のCOVID-19ワクチンとして広く知られており、SARS-CoV-2のSタンパク質を融合前に安定化させた形でコード化した脂質ナノ粒子(LNP)内包のmRNAベースのワクチンである[10]。このワクチンは,米国国立アレルギー感染症研究所(NIAID)によって開発された[20, 50]。mRNAベースのワクチンは,従来のワクチンに比べて,迅速な開発,スケールアップ,迅速な対応が可能であるという特徴がある.さらに、COVID-19ワクチンの初期の臨床試験以来、許容できる安全性プロファイルで、強力な免疫原性反応の誘発を示している[20, 50]。
歴史的に、MERS-CoV、SARS-CoV-1,HCOV-HKU1のSタンパク質の安定化した融合前構造には、2つのプロリン(2P)が置換されていることがわかっている。これにより、MERSのSタンパク質の免疫原性が野生型のSタンパク質よりも低用量で向上することが示された。実際、同じコンセプトがmRNA-1273ワクチンにも適用されている[22]。この2つのプロリン部位は、融合前安定化SARS-CoV-2 Sタンパク質を作り出すことができ、これを構造評価や血清学的アッセイの開発に用いた。注目すべきは、これが2020年3月16日の第1相臨床試験 2020年5月29日の第2相臨床試験につながり、そして、このワクチンは第3相臨床試験に入っていることである[22]。驚くべきことに、第3相試験の予備的な結果では、COVID-19感染の予防に94.1%の有効性が認められた[10]。
また、mRNA-1273がCD8 T細胞と中和抗体の放出を強力に誘導することで、免疫病理を引き起こすことなくCOVID-19感染を予防できることが報告されている[22]。同様に、50および100µgの投与量では、用量依存的に強固な中和抗体反応が得られた[20]。なお,mRNA-1273ワクチンは,28日の間隔を空けて2回に分けて筋肉内に注射される[50].興味深いことに、mRNAを発現させたSARS-CoV-2 S-2Pの単回投与でも、免疫原性と中和活性が証明されている[22]。
mRNAワクチンの安全性については、局所的および全身的な副作用を含めて検討され、中程度から重度の全身性副作用が報告されている[20]。特に、初回投与後に最もよく見られた全身性の副作用は、関節痛、筋肉痛、悪寒、吐き気、嘔吐に加えて、頭痛であった[20]。全体として、Modernaワクチンの免疫原性と安全性をさらに評価するためには、縦断的な臨床データが決定的に必要である[106]。
オックスフォード-アストラゼネカ社のワクチン
COVID-19ワクチン アストラゼネカ社のワクチン(AZD1222)は、英国のオックスフォード大学、アストラゼネカ社によって開発された組換え複製欠損チンパンジーアデノウイルスベクターで、ChAdOx1 nCoV-19ワクチンとしても知られている[35, 100]。この技術は,組織プラスミノーゲン活性化因子(tPA)と融合した完全長のSARS-CoV-2免疫原性S糖タンパク質遺伝子をリーダー配列として利用するものである[35]。Sタンパク質は、発現した三量体の融合前構造で安定化されている[4]。オックスフォード・ワクチンは,アデノウイルスが運ぶDNAの中に抗原をコードする配列を組み込んだものである。このカプセル化にはいくつかの利点がある。DNAはRNAよりも壊れにくく、アデノウイルスの丈夫なタンパク質コートがさらに保護してくれるので、遺伝物質を守ることができる[17]。さらに,同じ大きさのスケールであることから,細胞内への侵入が可能となり,送達された核酸からの抗原の発現が可能となる[21]。さらに,ヒトが既存の免疫抗体を持たないチンパンジーのアデノウイルスをバックボーンとすることで,免疫系への強力な働きかけが可能となり,アジュバントを使用せずにSタンパク質に対する強力な細胞性および体液性の免疫反応を誘導する能力が高まった[50, 75].もう1つの利点は,このワクチンが呼吸器粘膜に対して自然なトロピズムを持つことで,呼吸器粘膜へのワクチン接種が可能になることである[50, 74]。
臨床試験では、ChAdOx1 nCoV-19ワクチンは、COVID-19の予防に非常に有効であることがわかり、症状のあるCOVID-19に対しても有効性を示している[100]。2種類の投与法が行われ、5×1010個のウイルス粒子を含む標準用量のワクチンを2回接種した参加者(標準用量;SD/SDコホート)では、有効性は62.1%であった[100]。一方、1回目に低用量(2.2×1010個のウイルス粒子)を接種し、1カ月以上の間隔を空けて2回目に標準用量を接種した者(LD/SDコホート)では、意外にも90.0%と有効性が向上した[100]。両投与レジメンを組み合わせた解析では、全体のワクチン有効性は70.4%であった[100]。この違いの理由はまだ解明されていないが、LD/SDレジメンで有効性が向上したのは、中和抗体がより多く作られたことに起因すると提案されている[4, 100]。安全性プロファイルを見ると、大きな安全性の懸念はなく、良好な忍容性が示されている[4]。一般的に、副作用のほとんどは接種後数日以内に解消される軽度から中等度のもので、2回目以降はより軽度で頻度も低いことが報告されている[4]。最も頻度の高い副作用として、注射部位の圧痛や痛み、頭痛、発熱、疲労、関節痛が指摘されている[4]。
BNT162b2(ファイザー社製ワクチン)
BNT162b2は、Pfizer社とBioNTech社によって開発されたmRNAワクチンである[65]。このワクチンは、完全長のS遺伝子のプレフュージョンコンフォメーションをコードするmRNAで構成されており、脂質可溶性のナノ粒子製剤に製剤化されている[65]。このワクチンは、Sタンパク質のRBDをコードするmRNAを持つ別のワクチン候補BNT162b1と比較された[65]。その結果、BNT162b1とBNT162b2の両方が、用量依存的に同程度の血清中和抗体価を産生することがわかった。しかし、BNT162b2はBNT162b1に比べて副作用が軽度であった[65]。また、高齢者にも有効であった[65]。さらに、ある研究では、BNT162b2ワクチンがSARS-CoV-2 S特異的中和抗体、CD4 + 、CD8 + T細胞、およびインターフェロンγ(IFNγ)などのサイトカインの産生を誘導することが報告されている[86]。
16歳以上の人のCOVID-19を予防するために、30μgのBNT162b2を2回投与するレジメンの有効性、安全性、免疫原性を評価するために、2/3フェーズの臨床試験が行われた[78]。その結果、BNT162b2はCOVID-19感染の予防に95%の効果があることが示された[78]。安全性については、注射部位の軽度から中等度の痛み、頭痛、疲労感を伴い、重篤な有害事象の発生率は低かったとされている[78]。これに伴い、ファイザー社はFDAに緊急使用許可(EUA)を提出した。2020年12月11日、Pfizer-BioNTech COVID-19ワクチンは、COVID-19感染症の予防のためにFDAから緊急使用を認可された最初のワクチンとなった[1]。
JNJ-78436735/Ad26.COV2.S(ジョンソン社製ワクチン)
JNJ-78436735/Ad26.COV2.Sワクチンは、アデノウイルス・ベクターを用いたSARS-CoV-2ワクチンで、既にEUAを取得している。このワクチンは,SARS-CoV-2のSタンパク質を融合前の安定した構造で発現する,組換えで複製不能な自然発生の低頻度ヒトアデノウイルス26型(Ad26)ベクターで構成されている[83]。この希少なAd26血清型を利用することで,他のウイルスベクターワクチンに見られるような既存の免疫の障害を克服することができ,したがって,誘発される免疫反応の大きさを損なうことは大きな懸念ではないと予想される[24, 58].このワクチンは,米国ジョンソン・アンド・ジョンソンのJanssen Pharmaceutical Companyによって,18歳以上の人を対象に開発された[32]。このワクチンは,1回の接種で強い免疫原性を示し,特にパンデミック時には,手頃なコストと限られた時間で世界的な需要を満たすために,2回接種のワクチンよりも明らかに有利である[58],Laffoley er al)。) Ad26.COV2.Sワクチンは、安全性、反応原性、免疫原性のプロファイルが許容できるものである[83]。さらに、最近発表されたデータでは、急速に広がっているSARS-CoV-2のDelta変異体やその他のパンデミックしているウイルス変異体に対して、強力で持続的な免疫反応を誘発する効率性が実証されている(2021年7月1日)。ファイザー社やモデルナ社のワクチンと比較して、ジョンソン・エンド・ジョンソン社のワクチンは冷蔵庫温度での保管条件が容易であるため、世界中での流通や投与が容易になる[29]。
NVX-CoV2373(ノババックス社製ワクチン)
NVX-CoV2373,ノババックスのCOVID-19は、SARS-CoV-2に由来する安定したプレフュージョンSタンパク質抗原からなるタンパク質サブユニットワクチンである。NVX-CoV2373は、ノババックスの組換えナノ粒子技術を用いて作られており、ノババックスが特許を持つサポニンベースのMatrix-M™アジュバントを配合することで、免疫反応を高め、中和抗体の産生を促進する[58, 84]。このワクチンは、第3相臨床試験において、全体で90.4%の有効性を示し、新たに流通するウイルス亜種においても一貫して高い有効性を維持している。また、安心できる忍容性と安全性のプロファイルを示し、抗体反応を誘発する強固な能力を備えている[27, 84]。
CVnCoV(CureVac社製ワクチン)
CureVacのCVnCoVワクチンは、ドイツのバイオテクノロジー企業が開発したCOVID-19ワクチン候補で、mRNAベースの新しい技術を利用している。Pfizer-BioNTech社やModerna社と同様に、このワクチンはSARS-CoV-2のSタンパク質遺伝子をコード化し、それを脂溶性のナノ粒子でカプセル化している[19]。しかし、CureVacのワクチンは、他のワクチンのようにウリジンをプソイドウリジンで置換するのではなく、化学的に改変されていない天然のmRNAヌクレオチド配列を維持している[13, 19]。このワクチンは、標準的な冷蔵庫での保存が可能で、投与量も12μgと少ないため、より早く安価に大量生産が可能であることから、競合するmRNAワクチンに比べていくつかの利点があると期待されている。したがって、ヨーロッパでのワクチン不足の問題を解決するだけでなく、低所得国や温暖な国でもmRNAベースのワクチンの流通を拡大することができる[19],Dolgin)。しかし、このワクチンは、第3相試験の最終解析では有効性が48%と、WHOが設定した受け入れ基準を下回っており、十分な結果が得られていない。しかし、この低い有効性は、新しい種類が主流である臨床試験の時期、RNAの使用、最適ではないと考えられる投与量などが原因であるとする議論もある(Dolgin)。現在、CureVacはグラクソ・スミスクライン(GSK)と共同で、中和抗体を誘発する能力を高めるために調整された第二世代のワクチンを製造している[19],Dolgin)。
SARS-CoV-2のSタンパク質の変異と予測手段の今後の展望
SARS-CoV-2の進化と現在進行中の突然変異生成を深く理解することで、潜在的な新種を特定し、その拡散を制限するための将来計画が容易になる[36, 81]。SARS-CoV-2のSタンパク質の変異パターンを追跡・分析することで、感染やワクチン接種、中和抗体によるウイルスに対する集団免疫の継続的な増加が、ウイルスに対する強い選択圧の源になっていることがわかる(図4A)[14, 81]。その結果、新たに出現した変異体の一般的な傾向は、ウイルスの適合性を高め、ACE-2受容体との結合自由エネルギーを増加させることで、ACE-2受容体との結合親和性を高めることにある[14, 81]。これらは、免疫回避やより効率的な宿主感染を可能にするエスケープメカニズムとして機能する可能性がある[14, 81]。
図4 SARS-CoV-2のSタンパク質変異の今後の展望と、潜在的な新亜種の特定と拡散制限の計画
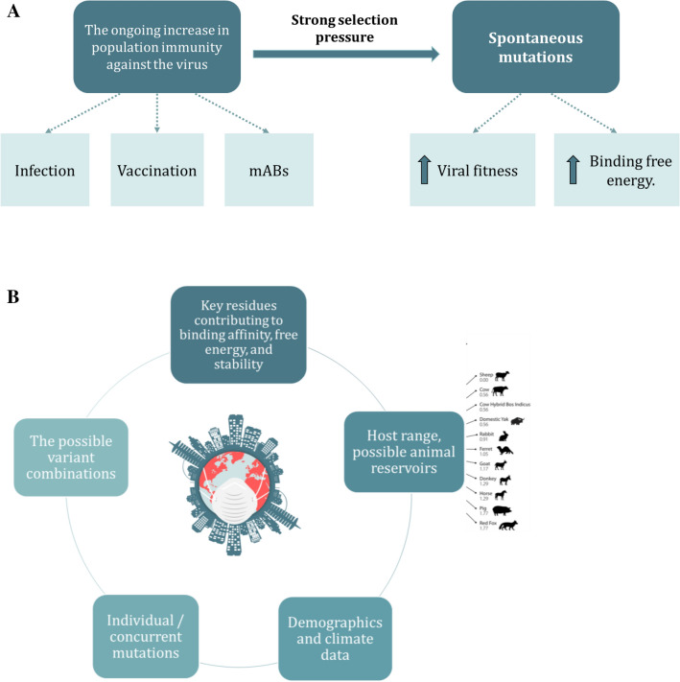
A SARS-CoV-2のSタンパク質が採用する変異原性パターンの追跡と分析。B 感染範囲と防御に大きく寄与する要因
一般的に、Sタンパク質の将来の変異を予測するには、ウイルスの動態、進化的適応、遺伝子配列の経時変化を大規模に追跡・分析する必要がある(図4B)[36, 62, 81]。考慮すべきその他の要因としては、可能な変異の組み合わせ、集団免疫の影響、結合親和性、自由エネルギー、安定性に寄与する重要な残基を認識するための構造的相互作用の分析、個別変異と同時変異の両方を考慮することなどが挙げられる(図4B)[36, 62, 81]。進化の原動力となりうる人口統計や気候データを組み込んだ構造モデルを構築することで、予測結果を改善することができる [36, 62, 81]。さらに,Sタンパク質を介した受容体結合がウイルスの宿主範囲に大きく寄与していることから,多くの動物リザーバーが存在する多宿主病原体であることが,ゲノムサーベイランスや将来の変異予測に大きな影響を与え,指針となることが期待される[39, 62, 91]。特に、その系統的パターンの分析から、複数の宿主種や地理的地域にまたがる共感染や遺伝子組み換え現象が可能であることが示されている[39, 62, 91]。
これらの広範な研究は,計算機および実験的なin silico変異誘発法と分子動力学シミュレーションプログラムを組み合わせたマルチアプローチを利用して行うことができる[18, 44, 77].バイオインフォマティクス・ツールを使用することで、研究プロセスを迅速化・簡略化することができる[18, 44, 77]。このプロセスは、突然変異を追跡してマッピングし、その伝搬を追跡することができる国際的なウェブサイトやデータベースによって促進され、より効率的な予測を助けることができる[18, 44, 77]。このような観点から、シンプルで自由にアクセスできる計算モデルが何人かの研究者によって開発されたことは言及する価値がある。これは「SpikePro」と呼ばれており、将来の進化における新しいSタンパク質の変異体の影響を、ウイルスのフィットネス、伝達性、感染性、宿主の免疫システムの回避能力に関して予測、記述、解釈する有用なツールである[81]。実際には、RBDのアミノ酸残基のコドン解析とホットスポットの特定により、Sタンパク質に起こりうる合計3686個の変異を予測できた研究もある[14]。これらの変異は、最も可能性の高い変異、可能性の高い変異、可能性の低い変異に分類された[14]。これらの変異の影響も分析された[14]。一般的に,起こりやすい変異は自由エネルギーが高く,感染力を強化するものであると予測された[14]。
結論
要約すると、SARS-CoV-2のSタンパク質は、ウイルスの発病や感染に重要な役割を果たしており、治療薬やワクチン開発の重要なターゲットとなっていることが明らかになった。このような関心は、Sタンパク質の構造的特徴、結合相互作用、変異を含むSタンパク質の深い理解によってさらに高まった。これにより、診断や免疫療法への新たな応用の可能性を見出すことができる。しかし、ほとんどの医薬品候補はまだ前臨床段階にある。そのため、安全性と有効性を確保するためには、さらなる研究が必要である。現在、緊急に使用されているワクチンについては、ワクチン接種後の免疫反応を継続的に総合的に評価することが重要であると考えられている。このレビューで得られた知見は、現在進行中のパンデミックの罹患率や死亡率を軽減するために有効な、合理的な薬剤やワクチンの設計の指針となるものである。
