Contents
SARS-CoV-2 Spike Protein Elicits Cell Signaling in Human Host Cells: Implications for Possible Consequences of COVID-19 Vaccines
2021年1月11日
pubmed.ncbi.nlm.nih.gov/33440640/
鈴木雄一郎1,*OrcIDとSergiy G. Gychka 2による
1ジョージタウン大学医療センター薬理学・生理学教室(ワシントンDC 20007,米国
2ウクライナ,01601キエフ、ボゴモレツ国立医科大学病理解剖学第2部
要旨
世界では、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス感染症2019(COVID-19)のパンデミックが発生している。SARS-CoV-2は、そのスパイクタンパクを利用して宿主細胞に侵入する。現在、このスパイク蛋白質を体内に導入してウイルス中和抗体を誘導するワクチンが開発されている。この記事では、ヒト宿主細胞がスパイク蛋白質に敏感に反応して細胞のシグナル伝達を引き出すことに注目している。そのことから、新しいCOVID-19ワクチンによって産生されたスパイクタンパク質が宿主細胞にも影響を与える可能性があることに注意することが重要である。我々は、これらのワクチンの長期的な影響を注意深くモニタリングすべきであり、特に、そうでなければ健康な人に投与される場合には、その影響を注意深くモニタリングすべきである。SARS-CoV-2スパイク蛋白質のヒト細胞への影響については、さらなる研究が必要であり、適切な実験動物モデルが必要である。
キーワード:細胞シグナル伝達; コロナウイルス; COVID-19; SARS-CoV-2; スパイクタンパク質; ワクチン
1. 序論
ポジティブセンス一本鎖RNAウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス疾患2019(COVID-19)パンデミックが世界で発生している[1,2]。2020年12月末現在、8,000万人以上がSARS-CoV-2に感染し、世界で180万人の死者を出している。SARS-CoV-2は、スパイクタンパク質として知られるウイルス膜融合タンパク質を用いて、ヒト宿主細胞に侵入するために「受容体」としてアンジオテンシン変換酵素2(ACE2)と結合し[3,4]、重度の肺炎や急性呼吸窮迫症候群(ARDS)を引き起こす[5]。心血管疾患を持つ高齢者は特にCOVID-19の重篤な症状を発症しやすく、場合によっては死に至ることもあるが、若くて健康な人は重篤な症状を発症することはほとんどない [1,6,7]。COVID-19が深刻な健康、経済、社会問題を引き起こし続けているため、世界はこのパンデミックを終わらせる可能性のある有効なワクチンの普及を待っている。
クラスIのウイルス融合タンパク質であるSARS-CoV-2スパイクタンパク質は、ウイルスと宿主細胞表面受容体の間の相互作用を開始するために重要であり、ウイルス膜と宿主細胞膜の融合を支援することにより、ウイルスの宿主細胞への侵入を促進する。このタンパク質は2つのサブユニットで構成されている。ACE2受容体結合ドメイン(RBD)を含むサブユニット1(S1)と、融合プロセスで役割を果たすサブユニット2(S2)である[3,4](図1)。SARS-CoV-2スパイクタンパク質は、COVID-19ワクチン開発の主要なターゲットである。
図1 SARS-CoV-2スパイクタンパク質の構造
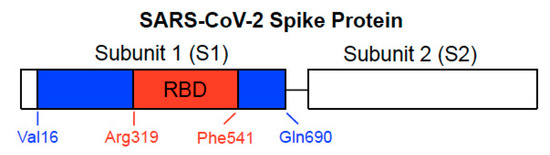
スパイクタンパク質は、サブユニット1(S1)とサブユニット2(S2)から構成されている。S1サブユニットは、宿主細胞膜のACE2に結合する受容体結合ドメイン(RBD)を含む。S2サブユニットは融合を担う。セクション3およびセクション5に記載された我々の先行研究において、青および赤の領域で描かれた完全長S1(Val16-Gln690)および赤で示されたSARS-CoV-2スパイクタンパク質(GenBankアクセッション番号:QHD43416.
2. スパイクタンパク質を用いたCOVID-19ワクチンの開発
2020年のCOVID-19に対するワクチンおよび治療薬の開発が驚くほど急速に進んだのは、政府と民間企業の効果的な協力関係によるものである。2020年11月9日、ファイザーとバイオンテックは、自社のmRNAベースのワクチン候補であるBNT162b2がCOVID-19に対して90%以上の有効性を持つことを発表した[8]。これは、有効なワクチンが間もなく利用可能になる可能性があることを明らかにしたという点で、歓迎すべきニュースであった。BNT162b2は、ウイルス中和抗体を誘発するSARS-CoV-2スパイクタンパク質をコードしている[9,10]。より具体的には、SARS-CoV-2の完全長スパイクタンパク質をコードしており、S2サブユニットの2つのアミノ酸をプロリンに変異させてプレフュージョン構造を維持しているが、姉妹ワクチンであるBNT162b1(同じくファイザー/BioNTech社製)は、T4フィブリチンフォールドンドメインの付加によって三量化されたSARS-CoV-2スパイクタンパク質のRBDのみをコードしている[9,10,11]。臨床試験では、BNT162b1[11]およびBNT162b12[9,10]のいずれも重篤な短期的な副作用を示さないことが実証されている。2020年12月10日、BNT162bに関する大規模な臨床試験の結果が発表され、このワクチンは16歳以上の人に95%の保護を与えることが示された[12]。しかし、これらのワクチンの長期的な影響は不明である。
もう一つの有望なワクチンであるModerna社のmRNA-1273もまた、完全長SARS-CoV-2スパイクタンパク質をコードするRNAワクチンである[13]。非複製チンパンジーアデノウイルスベクターを使用するアストラゼネカ社のAZD1222[14]、非複製アデノウイルス26ベースのジョンソン・エンド・ジョンソン社のAd26.COV2.S[15]、およびガマレヤ疫学・微生物学研究所のGam-COVID-Vac(スプートニクV)[16]などのウイルスベクターベースのワクチンは、すべてSARS-CoV-2スパイクタンパク質を発現している。組換えタンパク質ベースのワクチンであるNVX-CoV2373(Novavax)[17]もまた、完全長SARS-CoV-2スパイクタンパク質を発現している。これらのワクチンだけでなく、開発中の他の多くのワクチン[18,19,20]も、SARS-CoV-2スパイクタンパク質を体内に導入することで、SARS-CoV-2に対する抗体の産生および免疫が刺激される。
3. SARS-CoV-2スパイク蛋白質はヒト細胞の細胞シグナルを誘導する
培養初代ヒト肺動脈平滑筋細胞(SMC)またはヒト肺動脈内皮細胞を、組換えSARS-CoV-2スパイクタンパク質S1サブユニットで処理すると、残りのウイルス成分なしで細胞シグナル伝達を促進するのに十分であることが明らかになった[21]。さらに、COVID-19で死亡した患者の死後の肺組織を解析したところ、これらの患者は肺動脈性肺高血圧症(PAH)の特徴である肺血管壁の肥厚を示していることが判明した[21]。これらの結果に基づいて、我々は、SARS-CoV-2スパイクタンパク質(残りのウイルス成分を含まない)が、肺血管リモデリングとPAH、および他の心血管系合併症を促進する可能性のある細胞シグナル伝達イベントを誘発することを提案した[21,22]。
我々の細胞培養実験では、RBDを含む2つの組換えSARS-CoV-2スパイクタンパク質を研究した[21]。完全長S1サブユニットタンパク質は、図1に示すように、S1サブユニットの大部分(Val16-Gln690)を含んでいるのに対し、RBD S1サブユニットタンパク質はRBD領域(Arg319-Phe541)のみを含んでいる。培養ヒト初代肺動脈SMCおよびヒト肺動脈内皮細胞を、これらのタンパク質で10分間処理した。我々は、ホスホ特異的MEK抗体を用いて、SARS-CoV-2の組換え完全長S1サブユニット単独で、130 pMという低濃度で、細胞外シグナル調節キナーゼ(ERK)の活性化因子であり、細胞増殖のためのよく知られたシグナル伝達機構であるMEKを活性化することを発見した[23]。対照的に、スパイクタンパク質による細胞シグナル伝達のこのような活性化はラット肺動脈SMCでは起こらなかった[21]。
ACE2は、SARS-CoV-2スパイク蛋白質がヒト宿主細胞上で膜融合を促進し、ウイルスの侵入を得るために結合する「受容体」としてよく知られているが、ACE2の通常の生理的機能は、細胞内シグナルを伝達する膜受容体としての機能ではない。ACE2は、カルボキシペプチダーゼとして機能し、アンジオテンシンIIをアンジオテンシン(1-7)に切断し、血圧を調節するタイプのI型インテグラル膜タンパク質である[24,25](図2)。しかし、10年前、Chenら[26]は、ヒト肺胞上皮細胞株A549において、SARS-CoV(2002-2004年のSARSパンデミックの原因ウイルスであるSARS-CoV-1としても知られている)のスパイク蛋白質に応答して、ACE2が細胞シグナル伝達のための膜受容体として作用することを示す興味深い知見を報告した。SARS-CoV-1のスパイク蛋白質は、SARS-CoV-2のスパイク蛋白質と76~78%同一である[27]。彼らの研究では、完全長スパイクタンパク質がACE2に結合することで、カゼインキナーゼII依存性のアクチベータープロテイン-1(AP-1)転写因子が活性化され、その後の遺伝子転写イベントが誘発されることが示されている[26]。SARS-CoV-1での彼らの発見[26]とSARS-CoV-2での我々の発見[21]は、スパイク蛋白質がACE2(通常はペプチダーゼ酵素である)を、スパイク蛋白質を活性化のためのリガンドとして使用する細胞シグナル伝達のための膜受容体に変換する機能が著しく優れていることを示している(図2)。
図2 ACE2 の生物学的機能。
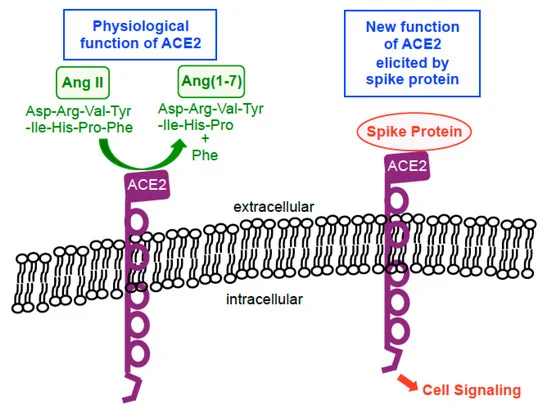
生理的状況では、ACE2は、フェニルアラニン(Phe)を切断することによってアンジオテンシンII(Ang II)のAng(1-7)への加水分解を触媒するカルボキシペプチダーゼ酵素として機能する。スパイクタンパク質の存在下では、この酵素は、スパイクタンパク質を活性化のためのリガンドとして使用する細胞シグナル伝達のための膜受容体となる。
Kubaら[28]は、組換えSARS-CoV-1スパイク蛋白質をマウスに注射すると、ACE2の発現が低下し、酸誘発性肺障害が悪化することを示した。また、酸誘発性肺障害を呈したマウスでは、組換えSARS-CoV-1スパイク蛋白質がアンジオテンシンIIを劇的に増加させ、アンジオテンシン受容体阻害剤ロサルタンがスパイク蛋白質による肺障害の増強を減衰させた[28]。このように、これらの生体内試験研究により、SARS-CoV-1のスパイク蛋白質(ウイルスの残りの部分を除いたもの)がACE2の発現を低下させ、アンジオテンシンIIのレベルを上昇させ、肺損傷を悪化させることが示された。
残りのウイルス成分を含まないSARS-CoV-2スパイクタンパク質もまた、Patraら[29]によって細胞シグナル伝達を活性化することが示されている。著者らは、ヒト肺胞上皮細胞株A549またはヒト肝上皮細胞株Huh7.5のいずれかで一過性のトランスフェクションにより発現した全長SARS-CoV-2スパイクタンパク質が、NF-κBおよびAP-1転写因子、ならびにp38およびERKマイトジェン活性化プロテインキナーゼを活性化し、インターロイキン-6を放出することを報告している。この細胞シグナル伝達カスケードは、SARS-CoV-2 スパイクタンパク質が ACE2 タンパク質の発現をダウンレギュレーションし、その後アンジオテンシン II タイプ 1 受容体を活性化することによって引き起こされることが判明した [29]。一過性のトランスフェクションを用いたこれらの実験は、RNAおよびウイルスベクターベースのワクチンによって誘発されるスパイクタンパク質の細胞内効果を反映している可能性がある。
これらの結果は、ヒト細胞が細胞内シグナル伝達の活性化を介して、細胞外および/または細胞内スパイクタンパク質の影響を敏感に受けているという考えを補強するものである。
4. 肺高血圧症
PAHは治療法のない重篤な疾患であり、子供を含む年齢に関係なく男女問わず発症する可能性がある。PAHにおける肺血管抵抗の増加は、右心不全を引き起こし、その後死に至る。PAHと診断された患者は、未治療の場合、診断時から平均して2~3年しか生きられない[30,31]。現在利用可能な治療法を用いても、PAH患者の60~70%しか3年間生存しない[32,33,34,35]。PAHは、その症状(息切れ、疲労、めまいなど)が他の一般的な非生命を脅かす疾患と類似しているため発見が困難であり、PAHの正式な診断は侵襲的右心カテーテル検査で行わなければならない[36]。内皮機能障害は、PAHおよびCOVID-19患者の共通の特徴である[37,38]。
PAHの「アウトブレイク」は、特定の薬物または毒素への暴露に関連して発生している[39]。PAHの大規模なアウトブレイクは1965年に発生し、体重減少刺激薬であるアミノレックスと関連していた [39,40]。この薬を服用した人の約0.2%がPAHを発症した [40]。アミノレックスの導入から 2年後にパンデミックが見られ,パンデミックから 10年後には半数の患者が死亡した[39].
COVID-19患者の肺血管とARDSで死亡したH1N1インフルエンザ感染者の肺血管を調べた[21]。死亡後のCOVID-19患者の肺の肺動脈は、主に中膜の肥大による血管壁の肥厚の組織学的特徴を一貫して示した。詳細な病理学的分析により、血管と周囲の肺実質との境界が明瞭でなくなっていること、動脈の中層裏のSMCが肥大していること、SMCの核が膨潤していること、SMCの細胞質に空胞が発生していることが明らかになった[21]。形態素解析の結果、肺血管壁厚中央値はCOVID-19患者で15.4μm、インフルエンザ患者で6.7μmであり、これらの値は互いに有意に異なっていた[21]。COVID-19患者では胸部CTスキャンでも肺血管壁の肥厚が認められた[41,42]。このように、これらの結果から、COVID-19は肺血管壁肥厚と関連していることが示唆された。この肺血管壁肥厚が臨床的に重要なPAHと関連しているかどうか、またPAHの病態におけるスパイク蛋白質の役割についての研究が必要である。
5. RBDのみを含むSARS-CoV-2スパイク蛋白質はヒト細胞ではシグナル伝達を起こさない
完全長スパイクタンパク質[26,29]または完全長SARS-CoV-2スパイクタンパク質S1サブユニット[21]とは対照的に、RBDのみを含むタンパク質(図1)は細胞シグナル伝達を促進しないことがわかった。MEK活性化をモニタリングした我々のウエスタンブロットの結果は、MEKタンパク質に対するリン酸化MEKの平均±SEMリン酸化MEK/MEKタンパク質比の値が0.05±0.003(未処理)1.9±0.07(完全長S1タンパク質で処理)および0.05±0. 003(RBDのみを含むタンパク質で処理);ヒト肺動脈SMCについては0.09±0.006(未処理),0.90±0.06(全長S1タンパク質で処理)および0.10±0.003(RBDのみを含むタンパク質で処理)であった[21]。
完全長S1およびRBDのみを含むタンパク質の異なる効果は、BNT162b2および他の多くのCOVID-19ワクチンが完全長スパイクタンパク質を発現しているのに対し、BNT162b1ワクチンはRBD領域のみをコードしていることを考慮すると重要であるかもしれない[9,10,11,12,13,14,15,16,17,18,19,20]。他にもいくつかのRBDベースのCOVID-19ワクチンが開発されている[43]。RBDベースのワクチンは免疫原性は低いが、宿主細胞には影響を与えない可能性がある。したがって、潜在的な長期的な副作用を考慮するとリスクは低いかもしれない。しかし、上述のSARS-CoV-1スパイクタンパク質の生体内試験研究[28]では、RBDのみを含む欠失変異体もまた、完全長スパイクタンパク質と同様に酸誘発性肺不全を悪化させた。このように、完全長スパイク蛋白質とRBDのみを含む蛋白質の様々な生物学的プロセスへの影響を理解するためには、さらなる研究が必要である。
6. 考察
一般に、ウイルス膜融合タンパク質の唯一の機能は、ウイルスが宿主細胞に結合して細胞内に侵入することで、遺伝子物質を放出し、ウイルスの複製・増幅を行うことができるようにすることだと考えられている。しかしながら、最近の観察では、SARS-CoV-2スパイクタンパク質は、それ自体が、様々な生物学的プロセスを導くことができる細胞シグナリングを誘発することができることが示唆されている。このような事象が、場合によっては、特定の疾患の発症につながると考えるのが妥当である。
我々の研究室では、SARS-CoV-2スパイク蛋白質の影響を肺血管細胞とPAHの発生に関与する細胞でのみ試験を行ったが、SARS-CoV-2スパイク蛋白質は肺血管細胞にも影響を及ぼす可能性がある。しかし、このタンパク質は全身血管や冠動脈の細胞にも影響を与え、冠動脈疾患、全身性高血圧症、脳卒中などの他の心血管疾患を誘発する可能性がある。心血管系細胞以外にも、ACE2を発現する他の細胞もSARS-CoV-2スパイク蛋白質の影響を受ける可能性があり、有害な病理学的イベントを引き起こす可能性がある。したがって、新しいCOVID-19ワクチンによって産生されるSARS-CoV-2スパイクタンパク質が、特定の個体においてPAH、他の心血管系合併症、および/または他の組織/器官における合併症を促進する細胞シグナル伝達イベントを誘発する可能性を考慮することが重要である(図3)。我々は、スパイクタンパク質をヒトの体内に導入するCOVID-19ワクチンの長期的な影響を注意深くモニタリングする必要があるだろう。さらに、スパイク蛋白質ベースのCOVID-19ワクチンの考えられる長期的な影響に関するヒトデータはすぐには得られないだろうが、SARS-CoV-2スパイク蛋白質がPAHまたは他の慢性病理学的状態の病因の兆候を誘発しないことを確実にするために、適切な実験動物モデルをできるだけ早く採用することが不可欠である。
図3 SARS-CoV-2スパイクタンパク質の考えられる作用
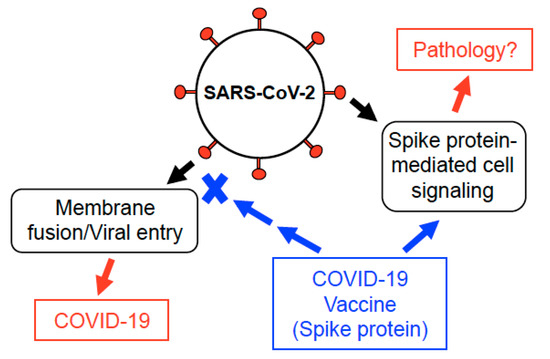
インタクトウイルスの SARS-CoV-2 スパイクタンパク質は宿主細胞の ACE2 を標的とし、膜融合とウイルスの侵入を促進する。SARS-CoV-2スパイク蛋白質はまた、ヒト細胞において細胞シグナル伝達を誘発する[21,29]。COVID-19ワクチンは、スパイクタンパク質をヒトの体内に導入する。ウイルスの侵入を抑制する免疫反応を誘発することに加えて、COVID-19ワクチンによって産生されるスパイクタンパク質は宿主細胞に影響を与え、有害事象を誘発する可能性がある。この可能性については、さらなる調査が必要とされている。
7. 結論
結論として、SARS-CoV-2スパイクプロテインベースのCOVID-19ワクチン開発の最近の進歩は刺激的であり、現在のパンデミックを終わらせる方法に光を当てている。これらのワクチンは、急性の有害事象を示さなければ、基礎疾患を持つ高齢者に利益をもたらすはずである。
しかし、特にそうでなければ健康な人や若年成人や子供に投与する場合には、長期的な影響を慎重に考慮する必要がある。今後、SARS-CoV-2感染者やスパイク蛋白質ベースのワクチンを接種した人のデータを評価することに加えて、ヒト細胞や適切な動物モデルにおけるSARS-CoV-2スパイク蛋白質の影響をさらに調査する必要がある。
