Contents
オンラインで公開2020年12月11日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7759632/
アブド A. エルフィキー
要旨
ヒトコロナウイルス(HCoV)であるSARS-CoV-2は、現在までに3,400万人以上の感染が確認され、100万人以上の死亡が報告されている(WHO状況報告書-154)。現在のパンデミックは深刻な社会経済的負担をもたらしている。認識とウイルスの侵入モードの理解が重要なため、スパイクタンパク質は 2020年2月26日に最初にリリースされた解決済みの構造を持つ最初のルックタンパク質ターゲットとして薬剤設計者を流した(PDB ID: 6VSB)。GRP78の認識部位はSARS-CoV-2やヒトコロナウイルスの浸潤に見られることが提案されているが、実験的な検証が必要である。
キーワード
GRP78,HSPA5,SARS-CoV-2,ウイルス付着、スパイク、宿主細胞認識、COVID-19,クロスワクチン接種
ヒトコロナウイルス(HCoV)であるSARS-CoV-2は、現在までに3,400万人以上の感染が確認され、100万人以上の死亡が報告されている(WHO状況報告書-154)。現在のパンデミックは、深刻な社会経済的負担を引き起こしている(Nicola er al)。 認識モードの理解とウイルスの侵入の重要性のために、スパイクタンパク質は、ファーストルックタンパク質のターゲットとして、薬物設計者を投げかけている。スパイクタンパク質の最初に解かれた構造が2020年2月26日に公開された(PDB ID: 6VSB)(Wrapp et al 2020)。
ヒートショックプロテインA5(HSPA5)すなわちグルコース調節プロテイン78(GRP78)は、SARS-CoV-2の付着および侵入のための可能性のある経路であることが報告された(Elfiky, 2020; Ibrahim et al 2020; Ha et al 2020; Saghazadeh and Rezaei, 2020)。SARS-CoV-2
スパイクにおける結合部位は、図1に示すように、S1 C末端ドメインに見られる9つの残基CNGVEGFNC(C480-C488領域)であると予測される(拡大パネルを参照)(Ibrahim er al)。 この予測は、スパイクのこの領域と、以前に生体内試験でGRP78を選択的に標的化することが報告された環状Pep42ペプチド(CTVALPGGYVRVC)との間の構造的保存性に基づいていた(Kim et al 2006; Quinones et al 2008; Braun et al 2020)。最近、SARS-CoV-2スパイクが、以前のヒトコロナウイルス株(HKU1, 229E, NL63, OC43)と比較して保存されたモチーフを持つことがNature journalで報告された(Braun et al 2020)。
図1 コロナウイルスのスパイクタンパク質とGRP78認識部位
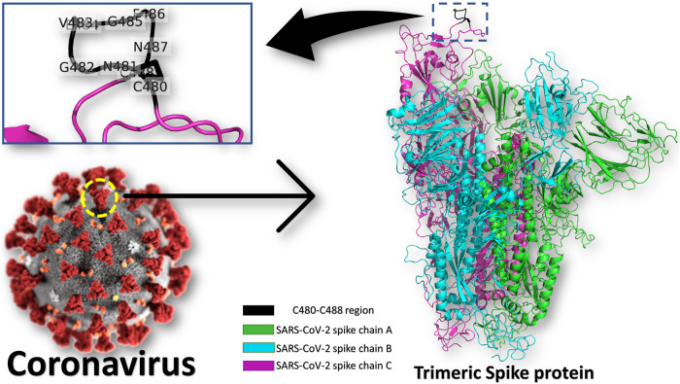
三量体スパイク蛋白質(緑、シアン、マゼンタのカートゥーン)は色付きのカートゥーンで、GRP78認識部位(SARS-CoV-2ではC480-C488)は黒いカートゥーンで描かれている(拡大パネル参照)。SARS-CoV-2のGRP78認識残基は、拡大パネルでラベル付けされている。
アルファコロナウイルス(NL63,229E)とベータコロナウイルス(OC43,HKU1,MERS-CoV、SARS-CoV、およびSARS-CoV-2)を含む既知のヒトコロナウイルス株間の配列比較は、スパイクタンパク質のC480-C488領域に関して刺激的な結果を明らかにした。
図2Aは、GRP78認識部位(SARS-CoV-2におけるC480-C488)における異なるヒトコロナウイルス株について、clustal omegaウェブサーバによって作成され、ESpript3によって閲覧された多重配列アラインメントの一部を示している。ペプチドPep42によるGRP78の認識は、ペプチドの環状形態(最初と最後のCYS残基がジスルフィド結合を形成する)に制限されることが以前に報告されている(Kim et al 2006; Quinones et al 2008)。
驚くべきことに、残基C480およびC488は、SARS-CoV-2および浸漬ヒトコロナウイルス株(NL63,229E、OC43およびHKU1)に見られるが、SARS-CoVおよびMERS-CoVには欠落している。さらに、浸漬したヒトコロナウイルス株では、SARS-CoV-2株と比較して、少なくとも3つの同一(4つの類似)残基が検出された(図2B参照)。このことから、SARS-CoV-2とヒトコロナウイルス浸漬株(NL63, 229E, OC43, HKU1)との交差免疫の可能性が示唆された。
図2
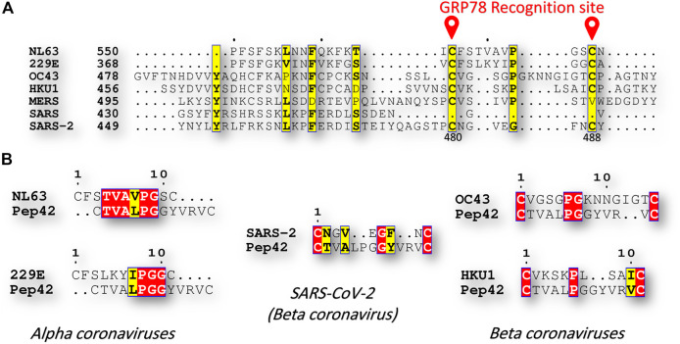
配列比較(A)現在報告されているすべてのヒトコロナウイルス株(NL63,229E、OC43,HKU1,MERS-CoV、SARS-CoV、およびSARS-CoV-2)のスパイクタンパク質の多重配列アラインメントの一部。アライメントは、Clustal Omegaウェブサーバーを使用して行われ、ESpript 3ソフトウェアで表示される。黄色くハイライトされた残基は、7つのHCoV間で保存されている。GRP78認識部位(SARS-CoV-2ではC480-C488)は赤色でマークされている
(B)一方の側から見たPep42と他方の側から見たNL63,229E、OC43,HKU1,およびSARS-CoV-2との間のペアワイズ配列アライメント。赤色の残基と黄色の残基はそれぞれ同一の残基と類似の残基。
ヒトコロナウイルスNL63,229E、OC43,およびHKU1は、ヒトへの影響が少ない(Zumla et al 2016; van den Brand et al 2015)。以前にこれらのヒトコロナウイルス株に感染した人は、SARS-CoV-2に対する免疫を発現する可能性がある。残念ながら、軽度のインフルエンザ様症状およびウイルス分布に関する情報を特徴とする浸潤ヒトコロナウイルス株は稀である(Huynh et al 2012;HilgenfeldおよびPeiris 2013;Zumla et al 2016)。
SARS-CoV-2スパイクの分子動力学研究(NAMDソフトウェアを使用)と分子ドッキング(AutoDock Vinaソフトウェアを使用)を組み合わせて、SARS-CoV-2スパイクのGRP78とC480-C488との間に少なくとも4つの相互作用(H-結合または疎水性接触)が存在することを明らかにした。疎水性接触(2つから6つ)は、すべてのドッキング実験(100 ns MDS後のSARS-CoV-2スパイクの異なるダイナミクス状態で行われた7つのレプリカ)で発見された。これは、アンフォールドされたタンパク質中の疎水性パッチのGRP78認識についての以前の報告(Tsai and Lee, 2018; Li and Lee, 2006)を支持するものである。この仮説を証明するためには、さらなる実験的検証が必要である。
結論として、SARS-CoV-2スパイク-宿主細胞認識は、治療ルートおよび予防ルートの両方でCOVID-19との戦いにおいて極めて重要である。C480-C488領域は、SARS-CoV-2の宿主細胞認識を阻害したり、弱めたりするために、薬剤、天然化合物、抗体によって標的とされる必要不可欠なウイルススパイクエピトープである。これは、実験室での検証が必要なホットなトピックである。
