Contents
SARS CoV-2 Organotropism Associated Pathogenic Relationship of Gut-Brain Axis and Illness
オンラインで公開2020年12月22日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7783391/
Pottathil Shinu,1 Mohamed A. Morsy,2,3 Pran Kishore Deb,4,* Anroop B. Nair,2 Manoj Goyal,5 Jigar Shah,6 and Sabna Kotta7
要旨
COVID-19は 2019年12月上旬に中国の肺炎患者に初登場した後、パンデミックをもたらした。WHOによると、この新型COVID-19の世界的大パンデミックは 2020年9月12日時点で210カ国から報告されている28,329,790人の実験室確認症例と911,877人の死亡をもたらしている。
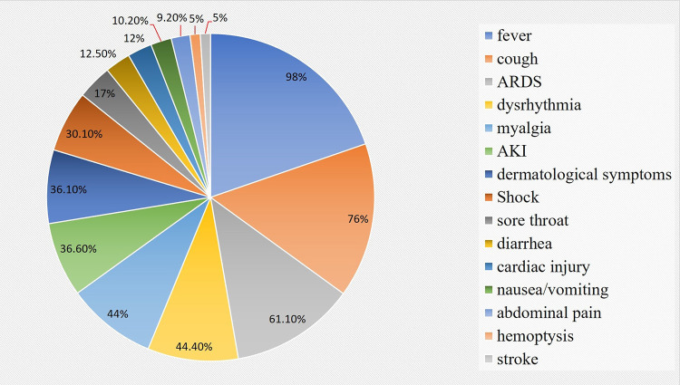
COVID-19の発症当初の主な症状は、発熱(98%)タスキ(76%)咽頭痛(17%)鼻漏(2%)胸痛(2%)筋肉痛や倦怠感(44%)である。さらに、急性呼吸窮迫症候群(61.1%)心不全性不整脈(44.4%)ショック(30.6%)喀血(5%)脳卒中(5%)急性心不全(12%)急性腎不全(36.6%)黄斑部外皮を伴う皮膚症状(36.1%)重症化すると死亡することもある。
ヒトコロナウイルス(CoV)は主に呼吸器系の感染を主な原因としているが、重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)の場合には、消化管(消化管)だけでなく神経系を含む肺外臓器にも感染する可能性があることが報告されている。また,COVID-19に感染した患者では,嗅覚・味覚障害,食欲不振,吐き気,嘔吐,下痢,腹痛などの神経症状や腸管感染症に伴う症状がみられた。
本総説では、COVID-19の臨床症状に関わる基礎的なメカニズムを、COVID-19と腸-脳軸との相互作用を中心に解明することを目的としている。本総説では、COVID-19ウイルスの生物学的特徴と臨床症状の両面から、COVID-19ウイルス感染の基本的なメカニズムを理解し、予防・治療戦略の進展に資することを目的としている。
キーワード
SARS-CoV-2,COVID-19感染症、腸-脳軸、ACE2受容体、マイクロバイオータ、腸内環境異常、サイトカインストーム
序論
21世紀のヒト病原性コロナウイルス(CoV)の3つのアウトブレイク、すなわち 2003年の重症急性呼吸器症候群CoV(SARS-CoV)2012年の中東呼吸器症候群CoV(MERS-CoV)および2019年の新CoV疾患(COVID-19)(2019年に中国で初めて報告された)があり、世界的な感染を引き起こし、世界的な公衆衛生問題および経済発展に関連した課題を引き起こしている(Stadler er al 2003; Cui et al 2019; Lu et al 2020; Memish et al 2020; Wu et al 2020a; Zhou et al 2020a)。) COVID-19パンデミックは、世界保健機関(WHO)による2020年9月12日の時点で、210カ国で28,329,790人の実験室確認症例および911,877人の死亡をもたらした(Organization and Organization, 2020)。電子顕微鏡の助けを借りて、ウイルスはスパイクと呼ばれる円形または楕円形の粒子(直径60~140nm)を持つエンベロープを持っていることが明らかにされている(Ahn er al)。 新規CoV-2019のゲノム配列は、β-CoVファミリーに属するSARS-CoVに関連しており、SARS-CoVおよびMERS-CoVとそれぞれ〜79%および〜50%の類似性を示した(Lu et al 2020)。SARS-CoV-2は、基礎再生産数(R0)が3.77(SARS、R0=3~5)の感染力を持つことが知られているが(Li et al 2020b; Yang et al 2020b)SARS-CoV-2の感染力は、SARS-CoV-2とMERS-CoV-2との間にはほとんどない。2020b)高齢者(≧60歳)および高血圧、糖尿病、心血管疾患などの既往症を有する患者を除き、ほとんどの症例は軽症であり、死亡率は低い(Baghizadeh Fini, 2020; Chen et al 2020; Contini et al 2020)。SARS CoV-2感染症に罹患している患者の多くが、胃腸症状および神経学的症状にも関連していることが観察されている。SARS CoV感染症では、腸内炎症は主にACE2受容体媒介機構(主に腸内細菌叢を調節する)によって調節されており、同様の機構はSARS CoV-2感染症においても関係している可能性がある(Yang et al 2020a)。腸内細菌叢の乱れは、混乱やせん妄などの中枢神経症状の一因となっている可能性がある。本レビューは、COVID-19,ACE2と中枢神経系および消化管症状との間の相互作用の可能性を裏付ける試みである。
レビュー対象文献の選定
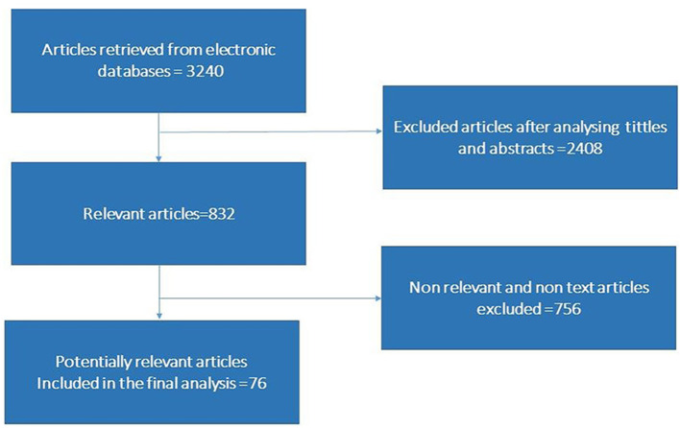
関連研究は、Science Direct、Medline、Public Library of Science、Mendeley、PubMed、Springer Link、Google Scholarから検索した。「マイクロバイオータ」、「マイクロバイオーム」、「微生物群集」、「腸内細菌叢」、「SARS-CoV-2感染」、「COVID-19感染」、「COVID-19感染の病態」、「SARS-CoV-2感染症」、「SARS-CoV-2媒介性消化管感染」、「COVID-19感染に関連する精神病的問題」、「COVID-19感染に関連する脳血管変化」などの複数のキーワードで検索した。 ” “腸内細菌叢と脳との関係 “または “COVID-19媒介炎症反応 “を、”サイトカインストーム”、”免疫原性プロファイル”、”SARS-CoV-2媒介のジスビオーシスとジスビオーシス改変mRNAプロファイル”、”免疫調節反応は脳生理学を変化させる “と個別に組み合わせて文献検索を行った。論文の全体的なスクリーニング方法と選択基準を図 1 に示す。英語の論文を用いて情報をまとめた。また、初期の検索戦略では特定できなかったままの論文を見つけるために、検索された論文のリファレンスリストのスクリーニングを行った。
図1 記事検索と選択基準を示すフローチャート
COVID-19 感染症に関連する臨床上の特徴と疾患
WHOによると、COVID-19は、過去20年間で動物性CoVのヒトへの感染が大パンデミックを引き起こした3番目のエピソードである(Yang et al 2020b)。SARS-CoV-2の主な感染経路は、(他のCoVと同様に)エアロゾル化された飛沫を介した感染であり、さらに、感染は直接の身体的接触、母子間の接触によっても感染することがある(García, 2020; Harapan er al)。 SARS-CoV-2の核酸は、確立された事実とみなすためにはさらなる研究が必要であるが、感染における消化管(消化管)の可能性を示唆する糞便検体からも発見されている(Holshue et al 2020)。SARS-CoV-2の潜伏期間は、レトロスペクティブ研究(Lu et al 2020)では5〜14日であり続けているが、より最近の研究では、潜伏期間は24日であることが示唆されている(Izzetti et al 2020)。COVID-19パンデミック開始時の主な症状は、発熱(98%)タスキ(76%)咽頭痛(17%)鼻出血(2%)胸痛(2%)筋肉痛または疲労(44%)であった。さらに、急性呼吸窮迫症候群(61.1%)心臓不整脈(44.4%)ショック(30.6%)喀血(5%)脳卒中(5%)急性心不全(12%)急性腎不全(36.6%)黄斑部外皮を伴う皮膚症状(36.1%)重症化すると死亡することもある(図2)(Jiang et al 2020;Kandeel and Al-Nazawi 2020)。
図2 COVID-19感染症の臨床症状を示す円グラフデータ。
ヒトCOVは呼吸器系の感染をもたらすが、いくつかの研究では、SARSやMERSの症例で観察されるように、神経系や腸管を含む肺外臓器への拡散の可能性も示されている(Kannan et al 2020)。最近の報告によると、COVID-19患者はまた、におい/味覚に関連する障害、食欲不振、吐き気、嘔吐、腹部の痛み、および下痢などの神経学的および腸管感染に関連する症状を呈している(KotwaniおよびGandra 2020;Lake 2020)。
SARS-CoV-2の器質性と感染メカニズム
薬理学的には、エアロゾル化された飛沫を介したSARS-CoV-2の肺への伝播には、いくつかの重要な病理学的分子機構が関与していることを証明するのに十分な証拠が収集されている。SARS-CoV-2のゲノム配列は、29kb塩基および12のタンパク質コード領域(1ab、1a、S、3a、4,M、6,7a、7b、8,N、10)からなる(Walls et al 2020)。スパイク(S)タンパク質は、SARS-CoV-2の宿主細胞への侵入を媒介する。このタンパク質は、2つの機能的サブユニット-S1(宿主細胞との接着のため)とS2(細胞膜との融合を助ける)から構成されている(Li er al)。 多くのCoVのタンパク質Sは、S1サブユニットとS2サブユニットの境界で分離されており、それらはプレフュージョンコンフォメーションで非共有結合のままである(Walls et al2020)。S1サブユニット(遠位)は、受容体結合ドメインを運び、膜に固定されたS2サブユニットのプレフュージョン状態を安定化するのに役立ち、融合のための受容体としても機能する(Liu et al 2020a,b)。すべてのCoVのタンパク質Sは、融合ペプチドの上流に位置するS2′の位置で、宿主のプロテアーゼによってさらに切断される。したがって、感受性のある細胞へのCoVの侵入は、調和のとれた複雑なプロセスであり、これは、受容体の結合およびウイルス-細胞融合の促進を助けるタンパク質Sのタンパク質分解的分配の集中的なメカニズムを必要とする(Liu et al 2020c)。宿主細胞へのウイルスの最も一般的な侵入機構は、エンドサイトーシスを介したものであり、これは受容体が介在するプロセスである。受容体であるアンジオテンシン変換酵素2(ACE2;細胞表面に見られるタンパク質)およびTMPRSS2(膜貫通型プロテアーゼ酵素をコードする遺伝子であり、セリンプロテアーゼファミリーに属する)が肺組織および上皮細胞に発現しており、これがCoVによって肺に感染を確立するために採用されると考えられている(Ozma et al 2020;PorfidiaおよびPola 2020)。また、ACE2受容体が心臓、食道、回腸、腎組織上で肺胞細胞よりも高いレベルで発現していることも知られている。このことは、重症SARS-CoV-2感染における多臓器系の関与を示唆している(Rico-Mesa et al 2020)。ウイルスは、特に気道および上部食道に位置する宿主細胞のACE2受容体(上皮細胞の漿膜上に存在する)と結合する(Shanmugaraj et al 2020)。SARS-CoV-2はまた、結腸および回腸の成層上皮細胞および腸球のような細胞型に感染することができる。さらに、ウイルスは、胆管細胞、腎の近位尿細管細胞、膀胱の尿道細胞、心臓の心筋細胞にも感染する(Shen er al)。 SARS-CoV-2の試験管内試験での単離には、Vero-E6やHuh-7のような細胞株では通常6日を要することが知られているが、ウイルスは96時間以内に上皮細胞株に感染する。 しかし、SARS-CoV-2はT細胞、CD4細胞、ACE2細胞に影響を与えず(Sifuentes-Rodríguez and Palacios-Reyes, 2020)免疫系にダメージを与えない。さらに、ヌクレオチド配列解析により、SARS CoV-2に7つの主要な遺伝的変異が発生したことが明らかになり、現在進行中のヒト感染は最近の出来事である可能性があることが示された。これらの遺伝的変異は、呼吸器感染以外にも消化器系、循環器系、泌尿器系、中枢神経系に感染するようにウイルスをより病原性の高いものに変化させて再燃させる可能性がある(Hussain et al 2020)。
SARS-CoV-2攻撃時の消化器系の病因と臨床的影響
COVID-19患者の消化管関連疾患の臨床的特徴および疫学的特徴は、様々な研究者によって分析されてきた。様々な研究では、COVID-19患者の様々な割合で嘔吐、吐き気、下痢などの消化管関連疾患に罹患していることが報告されている。ある研究では、抗ウイルス剤または抗生物質による治療を受ける前に登録された合計651人のCOVID-19患者が、11.4%の患者が消化管に関連する少なくとも1つの共通の症状、すなわち下痢に苦しんでいることが観察された(Jin et al 2020)。本研究では、腸に関連する障害は中央値で4日間持続し、呼吸器系に関連する症状に先行していた。腸管に関連した症状は、重症COVID-19患者(23%)では軽症COVID-19患者(8%)よりも比較的高かった(Sohrabi et al 2020)。COVID-19患者の数を変化させたいくつかの研究(n = 254,59,204,58,138,および1099)は、COVID-19患者の26,25.4,18.6,11,13.7,および8.7%において、それぞれ消化管に関連する障害の発症を示唆している(Borah et al 2020;Cheung et al 2020;Lin et al 2020;Pan et al 2020;Wang et al 2020a;Zhou et al 2020b)。米国および欧州で実施された他の研究では、患者数の異なる患者(n = 278,318,および40)が登録されており、それぞれ35,61,および55%の患者で消化管に関連する徴候および症状が認められた。食欲不振(26.8%)下痢(12.5%)吐き気・嘔吐(10.2%)腹部の痛み・不快感を含む消化管症状の有病率のプールデータは、6カ国のCOVID-19患者4243人を対象としたメタ解析研究で見られた(Tian et al 2020)。SARS-CoVとSARS-CoV-2は80%近く類似しており、主にACE2受容体を介して媒介される消化管の感染が予想された。ACE2受容体は小腸の腸球に発現しており、その結合親和性の割合がウイルスの感染率に影響する。また、これまでのSARS-CoVパンデミックと比較して、SARS-CoV-2 RNAは呼吸器では検出されなかったが、便サンプルでは検出可能であった(Velavan and Meyer, 2020)。
SARS-CoV感染症では、腸内炎症は主にACE2受容体媒介機構によって調節されており、したがって、SARS-CoV-2によるその障害は、下痢および他の消化管関連の合併症をもたらす可能性がある。骨髄からの炎症性細胞のリクルート、インターロイキン(IL)-6,腫瘍壊死因子α(TNF-α)IL-1β、2,7,8,9,10,17,単球ケモタクチックタンパク質1(MCP1)マクロファージ炎症性タンパク質1A(MIP1A)のような炎症性サイトカインの全身的または局所的な産生。マクロファージ炎症性タンパク質1B(MIP1B)マクロファージ炎症性タンパク質3A(MIP3A)プロカルシトニンの上昇、フェリチンdダイマー、C反応性タンパク質(CRP)の上昇、およびJAK-STATタンパク質の活性化は、消化管合併症の病因にも寄与しているかもしれない(Wang er al)。 , 2020b; Wu er al)。) さらに、腸管壁に沿ったサイトカインの過剰な分泌(サイトカインストーム)は、組織損傷をもたらす可能性がある。この細胞損傷はまた、ウイルスの複製によって誘導され、これは腸管上皮の損傷および炎症の発生に関与する可能性がある。これらの炎症性サイトカインは、迷走神経を刺激して、COVID-19感染症の複雑な症例で通常起こる吐き気、嘔吐および下痢を促進する(Wu et al 2020c)。COVID-19の合併症例を対象に行われた最近の研究では、SARS-CoV-2への感染が腸内細菌叢を変化させる可能性があることが明らかになった。この研究では、COVID-19患者において、主にStreptococcus、Rothia、Veillonella、Erysipelothrix、Clostridium、およびActinomyces種によって引き起こされる消化管の日和見感染の症例が相対的に増加していることが明らかになった(Xiao et al 2020c)。
腸内のACE2受容体は、食物からのアミノ酸(AA)を含む栄養素の摂取のための共受容体として作用することが知られている。食事によるアミノ酸の恒常性の制御とは別に、ACE2は腸内細菌叢の発達や自然免疫機構の制御にも関与している(Yang er al)。 これまでの報告では、ACE2変異マウスの小腸では、AAトランスポータータンパク質B0AT1の発現が見られなかった。腸内でのB0AT1タンパク質の発現不足により、ACE2/yマウスでは、非必須AAのバリン(Val)、スレオニン(Thr)、チロシン(Tyr)と必須AAのトリプトファン(Trp)の血清中濃度が有意に低下した(Ye et al 2020a)。さらに、これらのAA(特にTrp)は、脳内のモノアミン神経伝達物質セロトニン[5-ヒドロキシtyphtophan(5-HT)]およびカテコールアミンの合成の前駆体として作用する。さらに、5-HTおよびカテコールアミンの産生速度は、脳内でのそれらの局所基質の利用可能性と直接関連していた(Yu et al 2020)。これは、5-HTおよびカテコールアミンの産生の減少をさらにもたらす可能性がある。したがって、消化管関連の合併症を有する重度のCOVID-19患者は、うつ病、せん妄、および錯乱のような病態生理的状態を発症する可能性がある。
重症COVID-19感染症における腸活量の変化が精神病的変化を媒介する
腸-脳軸は、脳の認知中枢と消化管の末梢の働きをつなぐ双方向のシステムである(図3)。腸内細菌叢の変化が、うつ病やせん妄・錯乱などの行動変化の発現に影響を及ぼす可能性があることは明らかである。このことは、消化管からのTrpの吸収率や脳組織での5-HTの産生と関連している可能性が高い。(Yu et al 2020)。腸内微生物またはその代謝最終産物は、また、一次消化管感覚中継局として機能する孤核にインパルスを送信するために迷走神経を刺激し、その後、視床、視床下部、小室座、扁桃体、および四肢周囲灰色(Al OmranおよびAziz 2014)などの最も重要なセンターにインパルスを送信するために。迷走神経で産生されるこれらの電気的インパルス(腸内細菌叢の刺激の結果として)は、げっ歯類とヒトの両方の脳組織における5-HT濃度に影響を及ぼす(Ressler and Mayberg, 2007)。腸内微生物は、代謝物の合成を介して中枢神経系と腸を刺激することで、様々な神経伝達物質の濃度に影響を与える(Galland, 2014; Evrensel and Ceylan, 2015)。これらの代謝物は、短鎖脂肪酸(SCFA)胆汁酸、コリン代謝物、乳酸、およびビタミンを含む、正常な腸管フローラの最終生成物である。これらの代謝産物は、神経伝達物質の産生を直接または間接的に調節することができる(Galland, 2014)。免疫細胞や炎症性メディエーターは、睡眠や記憶における生理学的な役割から、神経精神疾患における病態生理学的な役割に至るまで、腸-脳軸のコミュニケーションにおいて様々な機能を果たしている(Caspani er al)。 文献によれば、うつ病患者は通常、健常者と比較して高濃度のプロ炎症性サイトカイン(例えば;IL-6,およびTNF-α)を保有している(Dantzer et al 2008;Dowlati et al 2009)。消化管におけるこれらの炎症性サイトカインは、中枢性ストレス回路を調節し、視床下部-下垂体-副腎軸を活性化するために迷走神経を刺激する可能性がある(Sternberg, 2006)。さらに、うつ病を患っている患者の腸内細菌叢には、ストレプトコッカス属、ロチア属、ヴェイロネラ属、エリシペロトリックス属、クロストリジウム属、アクチノミセス属が豊富に存在することが知られており(Amirkhanzadeh Barandouzi et al 2020)ストレプトコッカス属の増殖がヒトにおいてIL-6およびTNF-αのレベルを上昇させることが確立されている(Jiang et al 2015)。この事実は、うつ病に耐えている患者において、プロ炎症性サイトカイン(IL-1βおよびIL-6など)の高濃度および抗炎症性サイトカイン(IL-4およびIL-10など)の低濃度が検出された様々な研究によって、さらに支持されている(Berk et al 2013;Wong et al 2016)。さらに、5-HTの腸内濃度は、トリプトファンヒドロキシラーゼを有する腸内アロマフィン細胞によって保持され、SCFAおよび胆汁酸のような腸内代謝物によって刺激される(Annweiler et al 2020; BobkerおよびRobbins 2020)。さらに、Trpのレベルの低下は5-HTの低下をもたらし、せん妄発症につながる可能性があると推測されている(Gunther et al 2008)。ドーパミンの増加とせん妄発症は相互に関連している。また、ドーパミンは様々な代謝経路やCa2+チャネルと関連しており、酸化的に障害された状態ではドーパミンが著しく上昇する。細胞内のCa2+の流入は、主に脳実質細胞のミトコンドリアで発生する酸化的リン酸化のアンカップリングをもたらすドーパミン産生の上昇をもたらす(Calcagno et al 2020)。その結果、前頭前野におけるドーパミン合成および分解を助ける重要な酵素であるカテコール-O-メチルトランスフェラーゼ(COMT)活性を阻害するATP産生の減少とともに毒性のあるドーパミンの代謝物の産生が増加する(Gunther et al 2008; Maldonado 2008; Kamholz 2010)。
図3 SARS CoV-2のオルガノトロピズムと腸-脳軸の病因関係と精神病の関係
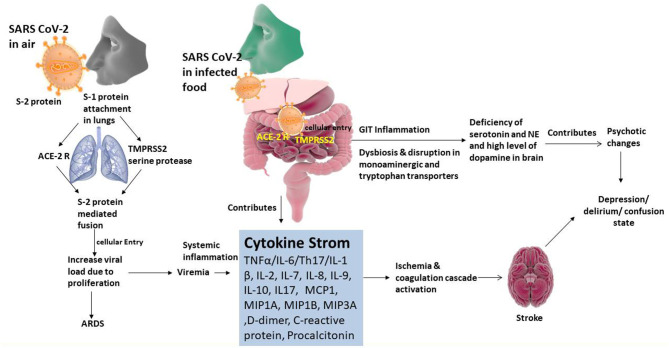
一方、最近の研究では、ノルエピネフーリン(NE)トランスポーター(NET)ノックアウトマウスでは、正常マウスに見られる脳内ニューロトロフィンの発現と同様に、ストレスによって誘発されるうつ病様の行動変化に対して抵抗性があることが示されている。したがって、うつ病およびせん妄は、NETのレベルの低下およびドーパミンの濃度の上昇に起因して引き起こされ得る(Coleman et al 2020;Das et al 2020)。その上、CRPは、血液脳関門の障害をもたらす活性酸素種(ROS)の形成の刺激につながる可能性があり、それによってせん妄を引き起こす。研究によると、股関節手術後の患者におけるせん妄の発生率が高いことは、CRPとIL-6の濃度が高いことと関連している(Beloosesky et al 2004; Macdonald et al 2007)。機械的に人工呼吸を行った患者の炎症性バイオマーカーであるプロカルシトニンとCRPを測定した前向き研究が行われた(McGrane et al 2011)。その結果、せん妄、無昏睡日数の減少、CRPとプロカルシトニンの上昇との間に関連性が認められ、せん妄の病態生理において炎症が重要なメカニズムであることが示唆された。
結論
一言で言えば、SARS-CoV-2の診断・管理においては、消化器系に関連する初期症状、特に下痢を呈している患者に注意を払う必要がある。また、治療中に下痢やその他の関連症状が出現した場合には、速やかに統合的な精神症状のサーベイランスを受けるべきである。したがって、治療レジメンは、中枢神経系の精神病的な結果を減少させるのに役立つプロバイオティクス(有益な腸内微生物叢の再活性化に必要な)とともに抗下痢療法を含むべきである。抗ウイルス剤の介入に加えて、治療レジメンには十分な水分摂取とともに電解質の若返りを含めるべきである。さらに、SARS-CoV-2と腸-脳軸との関連についての知見を得るためには、今後の研究が必要である。
