SARS-CoV-2 infects human neural progenitor cells and brain organoids
www.nature.com/articles/s41422-020-0390-x
新型重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)1によるコロナウイルス疾患2019(COVID-19)は、2020年7月16日現在、218の国と地域で1,300万人以上の確定症例と580,045人以上の死亡が確認されている。この新型コロナウイルスは、主に呼吸器疾患を引き起こし、臨床症状はSARSとほぼ類似している。しかし、頭痛、無呼吸、老衰、錯乱、発作、脳症などの神経症状もCOVID-19患者で頻繁に報告されている2,3。中国の武漢で行われた入院中の COVID-19 患者 214 例を対象とした研究では、神経学的所見が 36.4%の患者で報告されており、重症の感染症患者(45.5%)でより一般的にみられた。重要なことに、ドイツの最近の研究では、COVID-19の致死的症例の36.4%(8/22)でSARS-CoV-2 RNAが脳生検で検出されたことが示されている4。これまでのところ、ヒト中枢神経系(中枢神経系)における SARS-CoV-2 感染の直接的な実験的証拠はなかった。我々は最近、SARS-CoV-2が神経細胞由来の細胞に感染して複製することを明らかにした5 。この知見に沿って、SARS-CoV-2がハムスターの嗅覚ニューロンに感染して損傷を与えることを示した6 。また、SARS-CoV-2 の侵入受容体であるアンジオテンシン変換酵素 2(ACE2)は脳内で広く検出され、黒質、中側頭回、後帯状皮質など多くの場所に高濃度に存在することが明らかになった7 。
中枢神経系における SARS-CoV-2 の直接的な関与を生理学的に関連するモデルで調べるために、我々は誘導多能性幹細胞(iPSCs)由来のヒト神経前駆細胞(hNPCs)、神経球、および脳内オルガノイドにおける SARS-CoV-2 感染を評価した8 。その結果、ACE2、TMPRSS2、カテプシンLおよびfurinがhNPCで容易に検出されることが示唆された(補足情報、図S1)。次に、iPSC由来のhNPCを、SARS-CoV-2を10倍数感染(MOI)で、SARS-CoVを対照としてチャレンジした。ウイルス複製の評価のために、感染後0、24、48時間(hpi)に上清を採取した。興味深いことに、我々のデータは、SARS-CoV-2は、SARS-CoVではなく、hNPCにおいて複製可能であることを示唆した(図1a;補足情報、図S2)。さらに、SARS-CoV-2に感染したhNPCの細胞生存率を定量した。重要なことに、SARS-CoV-2感染は、72および120 hpiにおいて、hNPCの生存率を、模擬感染hNPCと比較して、それぞれ4.7%(P<0.0001)および2.5%(P<0.0001)に有意に低下させた(図1a)。感染したhNPCにおいてSARS-CoV-2によって誘導される実質的な細胞毒性とは対照的に、SARS-CoV-2の感染は、感染したhNPCにおいてインターフェロン(補足情報、図S3)およびプロ炎症反応(補足情報、図S4)を有意にアップレギュレートしなかった。次に、3D神経球にSARS-CoV-2で挑戦し、ウイルス複製評価のために、0、24、48、72hpiで感染した神経球から上清試料を採取した。その結果、SARS-CoV-2のRNA依存性RNAポリメラーゼ(RdRp)コピー数が時間依存的に有意に増加していることがわかった(図1b、左)。さらに、プラークアッセイによって決定されるように、感染した神経球からかなりの量の感染性ウイルス粒子が放出された(図1
b、右)。並行して、SARS-CoV-2に感染した神経球を凍結切除し、ウイルス抗原評価のために免疫染色した。重要なことは、SARS-CoV-2ヌクレオカプシド(N)タンパク質は、感染した神経球全体で容易に検出されたが、模擬感染した神経球では陽性シグナルは検出されないであった(図1
c)。さらに、電子顕微鏡観察では、二重膜構造内の液胞内に広範囲のウイルス粒子が検出され、これはウイルス粒子形成部位と考えられた(図1d)。これらの知見は、神経球がSARS-CoV-2感染に寛容であり、生産的なウイルス複製をサポートしていることを示している。
図1
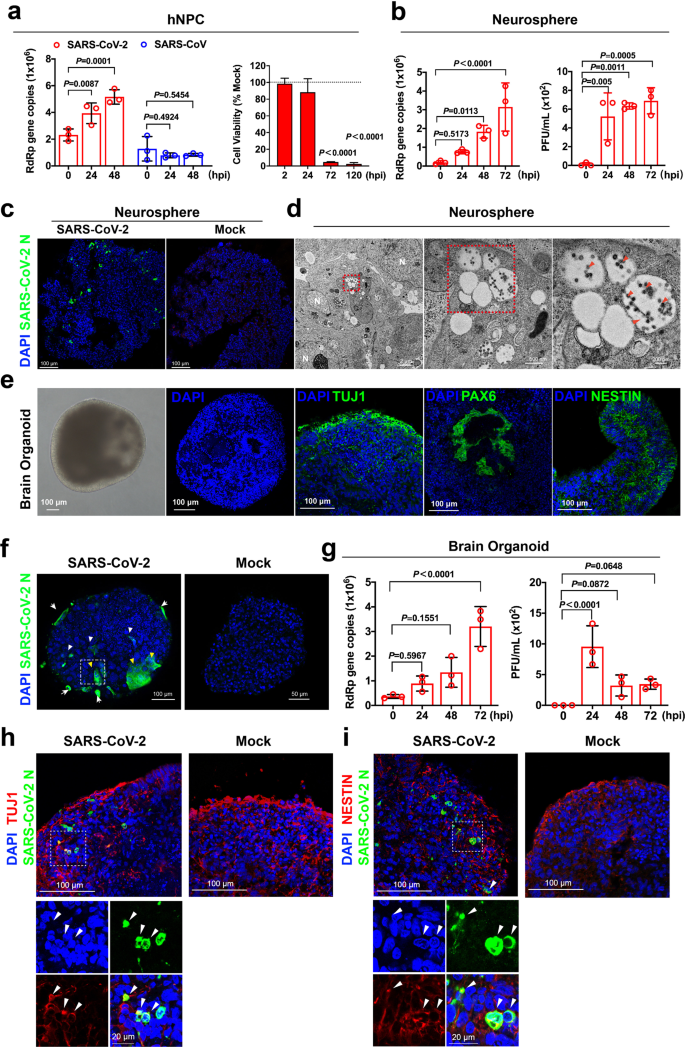
図1
a hNPC を 10 MOI SARS-CoV-2 または SARS-CoV でチャレンジした。ウイルス上清サンプルを0、24、および48 hpiで採取し、ウイルス負荷をqRT-PCRによって決定した。SARS-CoV-2および模擬感染hNPCの細胞生存率をCellTiterGloアッセイを用いて定量した。b SARS-CoV-2を接種した神経球からの上清サンプルをqRT-PCRでウイルスRNAを分析した。棒グラフは平均±SDを示す。SARS-CoV-2を接種した神経球からの上清サンプルの感染性ウイルス力価をプラークアッセイによって決定した。データは、3つの実験における神経球の3つ(n = 3)独立したバッチから得られた。 c 72 hpiで収穫されたSARS-CoV-2-または模擬接種された神経球の代表的な共焦点画像。SARS-CoV-2は、SARS-CoV-2ヌクレオカプシド(N)タンパク質免疫血清(緑)で同定した。スケールバー、100μm。 d 72 hpiでSARS-CoV-2を接種した神経球の代表的な透過型電子顕微鏡像。完全なSARS-CoV-2粒子(赤矢印)、および核(白N)。スケールバー、2μm、500 nm、または200 nm。 e 35日齢の脳オルガノイドの特性評価。脳オルガノイドを4%パラホルムアルデヒドで固定し、30%ショ糖溶液に移し、凍結切除のために埋め込んだ。脳オルガノイドの代表的な明視野画像を示した。複雑な内部形態を示す35日前の脳オルガノイドをDAPIで染色した。神経細胞マーカーTUJ1、放射状グリア細胞マーカーPAX6、および増殖神経前駆細胞マーカーNESTINの免疫染色した35日齢のヒト脳オルガノイドの代表的な画像。スケールバー、100μm。 f SARS-CoV-2感染脳オルガノイドの代表的な画像。SARS-CoV-2は、SARS-CoV-2-N免疫血清(緑色)を用いて検出された。SARS-CoV-2感染細胞は、オルガノイドの末梢領域(矢印)および深部領域(白矢印)で同定された。実質的な細胞-細胞融合が検出された(黄色の矢印)。模擬感染した脳オルガノイドでは陽性のNシグナルは検出されなかった。g ウイルス上清サンプルは、0、24、48、72 hpiで採取した。ウイルス複製をqRT-PCRで検出した。感染性ウイルス力価は、ベロE6細胞のプラークアッセイによって決定した。統計的有意性は、一方向ANOVAによって決定された。h SARS-CoV-2-NおよびTUJ1を免疫染色したSARS-CoV-2感染ヒト脳オルガノイドの代表的な画像。i SARS-CoV-2-NおよびNESTINで免疫染色したSARS-CoV-2感染ヒト脳オルガノイドの代表的な画像。スケールバー、100μmまたは20μm。共焦点画像は、Zeiss LSM880共焦点イメージングシステムで得た。画像は、3つの実験からの神経球またはオルガノイドの3つ(n=3)の独立したバッチの代表であった。統計的有意性は、双方向ANOVAによって決定した。MOI感染の多重度、接種後のhpi時間。
次に、SARS-CoV-2 がヒトの 3 次元脳器官に感染するかどうかを調べた。35 日齢の脳オルガノイドは、内部に自己組織化した形態を示し、発育途上の大脳皮質に類似した流体充填型の脳室様構造を有していた(図 1e)。凍結切除と免疫染色を行い、35日齢の脳内器官の神経マーカーの発現と分布を調べた。汎ニューロン、初期前脳、およびhNPCsマーカーは、それぞれTUJ1、PAX6、およびNESTIN染色によって同定された。TUJ1染色では初期ニューロンを含む原始皮質プレートが同定され(図1e)、PAX6染色では大脳皮質の放射状グリアが同定された(図1e)。また、NESTIN染色では、脳内オルガノイドで活発に増殖しているNPCが確認された(図1e)。これらの結果から、我々のオルガノイドシステムは、脳脊髄の発達と大脳神経新生をモデル化できることが示唆された。
脳オルガノイドがSARS-CoV-2感染に寛容であるかどうかを調べるために、ヒトiPSC由来の35日齢の脳オルガノイドにSARS-CoV-2を投与した。重要なことは、72 hpiの時点で感染したサンプルから広範なSARS-CoV-2抗原が検出されたことであり(図1f)、SARS-CoV-2が脳オルガノイドに直接感染したことを示している。免疫蛍光染色と共焦点顕微鏡検査により、SARS-CoV-2-Nシグナルは末梢領域(図1f、矢印)と脳小器官の深部領域(図1f、白矢印)で確認された。また、SARS-CoV-2感染が強固な領域では、細胞融合が容易に検出された(図1f、黄色矢印)。模擬感染した脳オルガノイドでは、SARS-CoV-2-Nシグナルは検出されなかった(図1f)。次に、感染した脳オルガノイドの上清サンプルを分析し、SARS-CoV-2ウイルス粒子の放出を評価した。その結果、SARS-CoV-2 RdRp遺伝子のコピー数は時間依存的に増加しており、感染した脳オルガノイドからの子孫ウイルス粒子の放出が活発に行われていることが示唆された(図1g、左)。具体的には、SARS-CoV-2 RdRp遺伝子の約3.2×106コピーが72 hpiで検出され、これは0 hpiで検出された場合に比べて9倍に増加した(P < 0.0001)(図1g、左)。SARS-CoV-2に感染した脳内オルガノイドの上清を用いたプラークアッセイでは、感染性ウイルス力価は24 hpiでピークを迎え、48 hpiと72 hpiで継続的に検出された。これらの結果は、SARS-CoV-2がウイルス粒子を放出しながら脳内オルガノイドに生産的に感染することを明確に示している(図1g、右)。さらに、二重免疫染色により、SARS-CoV-2-Nが神経細胞マーカーTUJ1やNPCマーカーNESTINとコロケーションしていることが明らかになり、SARS-CoV-2が脳内小器官の皮質神経細胞やNPCに直接感染することが示唆された(図1h、i)。
以上の結果から、iPSC由来のhNPCはSARS-CoV-2には寛容であるが、SARS-CoV感染には寛容ではないことが明らかになった。また、SARS-CoV-2に感染した神経球や脳内オルガノイドでは、広範なウイルスタンパク質の発現と感染性ウイルス粒子が検出され、SARS-CoV-2がヒトの脳に生産的に感染することが示唆された。重要なことは、SARS-CoV-2がヒトの脳内オルガノイドに感染した場合、TUJ1陽性細胞とNESTIN陽性細胞に局在していたことであり、SARS-CoV-2は皮質ニューロンとNPC(神経前駆細胞)を直接標的としている可能性が示唆された。SARS-CoV-2がヒトの脳オルガノイドに生産的に感染する可能性があるという知見は、COVID-19患者の神経症状にウイルスが直接関与している可能性を浮き彫りにした。これらの結果は、無嗅覚(嗅覚の喪失)や老年期障害(味覚の喪失)などの認知症状や、発作、脳症、脳炎、ギラン・バレー症候群、ミラー・フィッシャー症候群などのCOVID-19の他の神経学的症状についての知見を与えてくれた。10,11 しかし、これらの研究では、SARS-CoV-2に対する神経前駆細胞の感受性は評価されていなかった10,11。この点で、嗅覚機能やその他の神経学的症状の回復は、これらの神経前駆細胞がSARS-CoV-2に感染している可能性があるため、不完全かつ遅れる可能性がある。重要なことに、2015年に再登場したジカウイルスもまた、ヒトの脳の神経前駆細胞を標的とし、胎児の小頭症や重度の発達障害、成人の他の神経学的異常につながることが十分に認識されている12。中枢神経系におけるSARS-CoV-2感染の慢性的または長期的な影響は、注意深く監視されるべきである。