SARS-CoV-2 Infectivity and Neurological Targets in the Brain
www.ncbi.nlm.nih.gov/pmc/articles/PMC7445393/
要旨
新規な重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるヒト宿主細胞への侵入のゲートウェイは、複数の免疫細胞型および非免疫細胞型で発現しているアンジオテンシン変換酵素2(ACE2)膜貫通型受容体を介している。
コロナウイルス病2019(COVID-19;CoV-19)を引き起こすSARS-CoV-2は、新規なクラスリンおよびカベオラエに依存しない内分泌経路を介して、多くの異なるタイプのヒト宿主細胞を同時に攻撃し、多様な細胞、組織および器官系に傷害性となり、宿主のあらゆる免疫の弱点を悪用するという異常な能力を有する。
この多面的な攻撃の誘発は、CoV-19患者で観察される重症度と広範囲にわたる様々な徴候や症状の一部を説明している。本研究では、SARS-CoV-2感染のメカニズムと経路、および特定の細胞・組織型・器官系のSARS-CoV-2攻撃に対する感受性についての理解を深めるために、21の異なる脳領域、7つの胎児組織、および8つの対照を含む85のヒト組織におけるACE2の発現を解析した。
ACE2は呼吸器、消化器、腎、泌尿生殖器、生殖細胞で強く発現していたが、扁桃体、大脳皮質、脳幹でも高い発現が認められた。ACE2の発現量が最も高かったのは、脳の髄質呼吸中枢を含む脳幹の扁桃体と延髄であり、多くのCoV-19患者が重度の呼吸困難に陥りやすいことの一因となっていると考えられた。
キーワード
アルツハイマー病、アンジオテンシン変換酵素2(ACE2)受容体、コロナウイルス、COVID-19、CoV-19、ハートヌプ病、microRNA、miRNA-5197、SARS-CoV-2、一本鎖RNA (ssRNA)
序論
コロナウイルス病2019(COVID-19; CoV-19)は、2019年12月中旬頃~中国東部中央部の武漢市のオープンな魚介類、家禽類、野生動物の湿った市場で初出現した。
状況証拠は、SARS-CoV-2の人獣共通感染の初期出現の可能性と、SARS-CoV-2の種間伝播における「人獣共通感染のスピルオーバー」を介した、フルーツバット(Pteropus scapulatus)、パンゴリン(Manis javanica)、野生鶏(Gallus gallus)および他の野生動物などの中間宿主の役割を示唆していた(Rodriguez-Morales er al)。 これまでヒトでは観察されなかったSARS-CoV-2は、「重症急性呼吸器症候群コロナウイルス2」(SARS-CoV-2; Bourgonje et al 2020; Guan et al 2020; Wackett 2020)として知られる一本鎖リボ核酸(ssRNA)βコロナウイルスによって引き起こされることが知られている。
SARS-CoV-2による高度に伝達性のある広範囲な感染は、2020年3月中旬までに世界保健機関(WHO)によって世界的なパンデミックと宣言された(https://genome.ucsc.edu/covid19.html)。
この新規ヒトウイルス性病原体は、主に発熱、咳、息切れ、重度の呼吸機能障害および苦痛を伴う危険な急性肺障害を誘発し、しばしば人工呼吸を必要とする。CoV-19の臨床症状は、「重症急性呼吸器症候群コロナウイルス」(SARS-CoV)および中東呼吸器症候群コロナウイルス(MERS-CoV;Du et al 2017;Evans et al 2020;Ivashchenko et al 2020)について報告されたものと類似している。
劇症型SARS-CoV-2感染が成立し、重症化すると、全症例の約3%で致死的になる、炎症亢進、サイトカインストームおよび全身炎症性バイオマーカーの急激な増加、心血管機能不全の上昇、および重度の呼吸不全を特徴とする全身疾患へと急速に進展し得る。
複数の神経学的症状には、嗅覚の喪失(無感覚)、味覚の変化(ageusia)、運動の協調性の喪失(運動失調)、頭痛や吐き気、めまい、意識の断続的な喪失または障害、既往の認知障害の加速または悪化、免疫反応の亢進の直接的な負の効果が含まれる。異常な高炎症性反応、血管炎症の増加、脳および脊髄の炎症およびアテローム形成、炎症性神経変性の増悪またはde novo誘導、呼吸制御の喪失、および認知の進行性障害(Baig and Sanders 2020. Zhang er al)。 2020)、脳炎(Efe et al 2020)、脳卒中、発作、脳症(Zubair et al 2019)および急性播種性脳脊髄炎(ADEM;PanupattanapongおよびBrooks 2020;Parsons et al 2020)を含む。
小児における多系統炎症性症候群」(MIS-C)と呼ばれるCoV-19感染の1つの憂慮すべき補助的な後遺症として、CoV-19感染から回復した小児が、その後、持続的な発熱を含む川崎病様の特徴を有する重度の炎症性症候群を発症することが観察されている。
結膜炎、炎症反応の亢進、炎症性マーカーの上昇および免疫不全、および低血圧、心臓、胃腸(GI)、腎臓、血液学的、皮膚学的および神経学的関与を含む一連の症状(PanupattanapongおよびBrooks 2020. ロンコーニら(Ronconi er al)。 2020). WHOの報告によると、2020年7月下旬の時点で、世界的には現在、約〜約1700万人のCoV-19の症例が、約〜約70万人の総死亡者とともに存在している(https://www.worldometers.info/coronavirus/;最終アクセスは2020年7月29日)。
SARS-CoV-2 は、29、811 ヌクレオチド(nt)の包埋型正鎖 ssRNA ゲノムを有し、SARS-CoV や MERS-CoV と非常に相同性の高い RNA 配列を共有している(SARS-CoV や MERS-CoV と同様に、重篤で急性の呼吸窮迫や致死性の高い肺炎を引き起こす)。SARS-CoV-2は、少なくとも6つの膜タンパク質:エンベロープ(E)、膜(M)、スパイク(S1)およびヌクレオカプシド(N)タンパク質N3〜N5をコードしている(Fehr and Perlman 2015; Sah et al 2020; Shang et al 2020)。
病原性に関して、スパイク(S)タンパク質は、宿主細胞へのウイルスの侵入に不可欠である(Du et al 2017; Guan et al 2020; Li et al 2020a、b; Zubair et al 2019)。SARS-CoV-2は、アンジオテンシン変換酵素(ACE2)タンパク質に排他的に結合するように見えるが、これは、その酵素的に活性なドメインが呼吸器系のII型肺胞細胞などの複数の細胞型の表面に露出しているシングルパスの1型膜貫通型受容体である。
腸球および腸管上皮細胞、内皮細胞、結膜上皮細胞、腎臓細胞(腎尿細管)、および特定の免疫細胞、例えば肺胞単球/マクロファージ、および大脳皮質および脳幹の細胞を含む中枢神経系の特定の細胞(Guan er al)。
2020; Kabbani et al 2020; Li et al 2020a、b; Zhou et al 2020; Zubair et al 2019)。) より具体的には、SARS-CoVおよびSARS-CoV-2の両方のスパイクS1タンパク質の細胞表面上のACE2の酵素ドメインへの結合は、SARS-CoV-2およびACE2酵素の両方のエンドサイトーシスおよび感染細胞のエンドソームへのトランスロケーションをもたらす(Wang et al 2008;MilletおよびWhitttaker 2018;Leish 2020)。
細胞表面に関連する膜貫通型セリンプロテアーゼ2 TMPRSS2(エピテアシン;EC 3.4.21.109)もまた、ウイルススパイクタンパク質S1とACE2との結合に続く細胞内へのCoV-19の侵入を促進する(https://www.genecards.org/cgi-bin/carddisp.pl?gene=TMPRSS2; Zhou er al)。 2020)。
SARS-CoV-2およびACE2の認識、TMPRSS2シグナル伝達、および宿主細胞へのSARS-CoV-2トランスロケーションの阻害は、現在、前向きで効果的な抗SARS-CoV-2治療戦略を実施するための礎石として、極めて激しい研究調査が行われている(AkhmerovおよびMarbán 2020; Bourgonje et al 2020; Datta et al 2020; Saavedra 2020; Shang et al 2020)。
SARS-CoV-2の認識、付着および細胞への侵入におけるACE2メタロプロテインの特異的な重要性のために、今回の通信では、複数の組織発現(MTE)アレイを用いて、ヒトの脳の21の解剖学的領域を含む85のヒト組織および対照におけるACE2の発現を調査した。興味深いことに、ACE2の発現は複数の脳領域で容易に検出された。脳内で最も高いレベルの ACE2 発現が認められたのは、脳の呼吸中枢である扁桃腺と延髄であった。
方法
ヒト MTE アレイ(Invitrogen-Clontech、 Palo Alto、 CA; cat no. 7775-1)を、ACE2 mRNA の組織特異的または脳特異的な発現を解析するために、最低でも 3 箇所で使用した;この MTE アレイには、77 のヒト組織から濃縮された polyA + mRNA サンプル(各セクタは ~ 2.0 µg の polyA+ RNA を含む)と 8 つの独立した DNA および RNA コントロールが含まれている(図 1)。
ユニークなヒト特異的26 nt ACE2特異的DNAプローブ5′-CTTGCAGCTACACCAGTTCCCAGGCA-3′(US NIH/NLM Sequence ID: AY217547.1; blast.ncbi.nlm.nih.gov/Blast.cgi#27978647; accession AB046569.1.1 www.ncbi.nlm.nih.gov/nuccore/AB046569.1も参照)およびヒト特異的35 nt ACE2 DNAプローブ(5′-GGGCTCGAGTTTTTCTAAAAGGAGGTCTGAACATC-3′;〜3.4 knt ACE2 mRNAのエクソン18に由来する。
4 kntのACE2 mRNA; Genbank Accession AF291820; NM_021804.2; www.genscript.com/gene/homo-sapiens/59272/ace2.html; www.ncbi.nlm.nih.gov/gene/59272; 最終アクセスは2020年7月29日)であり、ACE1との相同性を示さない; (Tipnis er al)。 2005; Hofmann er al)。 2004)のエクソン18に由来する。2004)は、博士からの寛大な贈り物であった。26 ntおよび35 ntのACE2 DNAプローブはどちらも同様のハイブリダイゼーションシグナルを示した;26 ntのACE2 DNAプローブのデータをここに示す;これらのDNAプローブはどちらも2つのエクソンに交差するように特別に設計されており、それによってACE2のmRNAのみを検出し、ACE2のゲノムDNAは検出しなかった。
同様のハイブリダイゼーションシグナルを与える他のいくつかのACE2特異的放射性標識cDNAプローブが使用された;DNAプローブが使用されたのは、RNA-DNAハイブリッドの方が、ACE2 DNAプローブと膜結合したpolyA + mRNAターゲットとの間の結合エネルギー(EA)が高く、より正確で安定したハイブリダイゼーションが得られるからである(Lukiw er al)。 1992; Goulter er al)。 2004; www.ncbi.nlm.nih.gov/gene? Db=gene&Cmd=DetailsSearch&Term=59、272);ACE2 DNAプローブは、(i)ランダムプライマー標識および[α-32P]dCTP(3000 Ci/mmol、 Amersham、 Chicago、 IL)の直接取り込みを使用して放射性標識されたか、または(ii) [γ-32P]dATP(3000 Ci/mmol、 Amersham redivue)を使用して末端標識された。グリセルアルデヒド3-リン酸デヒドロゲナーゼ(G3PDH)を、対照の正規化のために使用した(htttps. //参照);グリセルアルデヒド3-リン酸脱水素酵素(G3PDH)を用いた。
takara.co.kr/file/manual/pdf/PT3307-1.pdf; Lukiw er al)。 1990、1992; Goulter et al 2004);最大のシグナル定量精度を得るために、ハイブリダイズされた膜および洗浄された膜をMTEテンプレート上に重ね合わせ(図1)、切除し、液体シンチレーションカウンター(LS600016 LSC、 Beckman、 Fullerton、 CA)中の10ml液体シンチレーション液(Ultima Gold、 PerkinElmer、 Waltham、 MA)中で各セクタを別々に計数した;相対的なシグナル強度(図2、 、3)3)を、液体シンチレーションカウンター(LS600016 LSC、 Beckman、 Fullerton、 CA)中で計数した。2、 、3)3)は、ACE2ハイブリダイゼーションシグナルを、MTEアレイ上の各polyA + mRNAについてのG3PDHシグナルと比較することにより発現させた(Lukiw et al 1990、 1992; Zhao et al 2001; Jaber et al 2017; Piras et al 2020を参照)。統計的有意性を、二元配置分散分析(p、ANOVA;SAS Institute、Cary、NC)を用いて分析した。p<0.01(ANOVA)は、高い統計的有意性とみなされた;実験値は、平均値±SDとして表された。
図1
ノーザンブロット分析のためのヒトMTEブロットの構成;ACE2シグナルを同じサンプル中のG3PDHシグナルと比較し、「相対シグナル強度」として表現;これらは、図2および3;3に棒グラフ形式で示されている;各タイプの組織決定において、最低N = 6個のMTEアレイ(ACE2用に3個、G3PDH用に3個)を使用した。
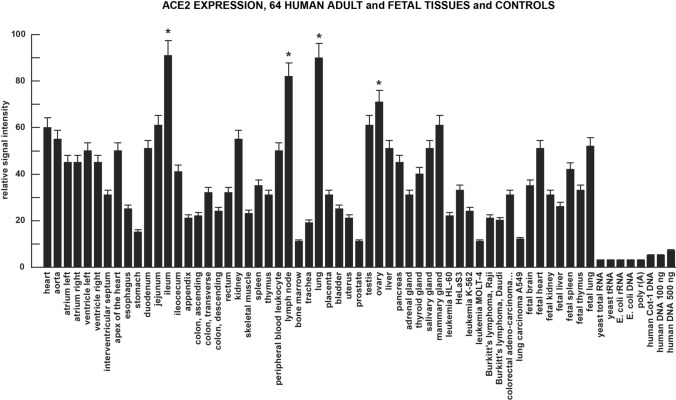
図2
組織特異的な ACE2 発現パターンは、遺伝子機能と SARS-CoV-2 浸潤および CoV-19 発現に対する感受性を示す強力な指標である。血管、消化管(GI)、呼吸器、排泄物、生殖組織、およびいくつかの関連する癌と対照でACE2の発現が高く、心臓(成人および胎児)、回腸、腎臓、肺(成人および胎児)、精巣、卵巣、乳腺で発現が最も高い値を示した。
ACE2は、ジペプチジルカルボキシジペプチダーゼのアンジオテンシン変換酵素ファミリーのメンバーであり、ヒトアンジオテンシン1変換酵素(ACE1)とかなりの相同性を持っているが、ここでのACE2のDNAプローブは、ACE1との相同性を示さないユニークなものであった。
ACE2は、分泌タンパク質としても膜貫通型としても発現し、アンジオテンシンI(ANG)の開裂を ANG1-9に、ANG IIを血管拡張剤である ANG1-7に触媒する。https://www。 youtube.com/watch?v=W1k1sUoLPlA; www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=DetailsSearch&Term=59、272; 最後のアクセスは2020年7月29日); 少なくともN = 6個のMTEアレイ(ACE2については最低3個、G3PDHについては最低3個)を各組織決定において使用した; *p < 0.01(ANOVA); エラーバーは平均の1標準偏差を表す
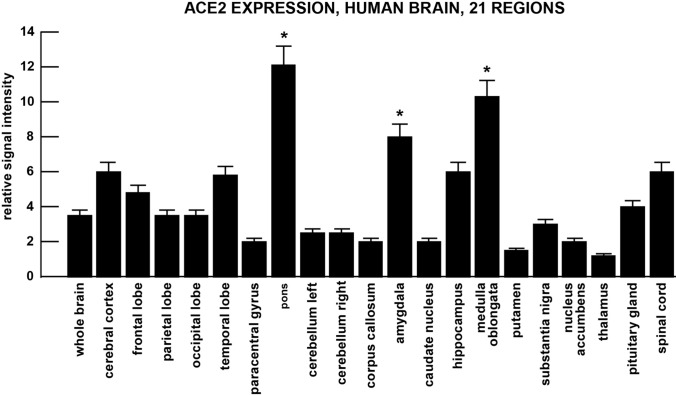
図3
ヒトの脳の 21 の解剖学的領域における ACE2 の発現。SARS-CoV-2受容体ACE-2の発現が最も高かったのは扁桃体、海綿体、延髄であり、後の2つの領域には脳の呼吸制御中枢が含まれていた;脳、側頭葉、海馬でACE2がかなり発現していることは、SARS-CoV-2感染に伴う神経学的障害や認知機能障害の一部を説明している可能性がある
図2と比較してY軸(縦軸)のスケールの違いに注意してほしい。最大のシグナル定量を得るために、ハイブリダイズされ、洗浄された膜をMTEテンプレート(図1)の上に重ね合わせた。1)に重ね合わせ、切除し、そして以前に記載したように液体シンチレーション流体中で計数した;相対的なシグナル強度(図2、3)を、同じMTEアレイセクタ上の各ポリA+mRNAについてのG3PDHシグナルとACE2ハイブリダイゼーションシグナルを比較することによって表現した(Lukiw et al 1990年、1992年;Zhao et al 1990年、1990年、1990年、1992年を参照のこと)。
1990、 1992; Zhao er al)。 2001; Jaber er al)。 2017);少なくともN = 6個のMTEアレイ(ACE2のための3個およびG3PDHのための3個)を各脳組織の決定に使用した;*p < 0.01(ANOVA);エラーバーは平均の1標準偏差を表す
結果
mRNA レベルでは、ACE2 は複数のヒトの細胞や組織の種類、臓器系で非常に広く発現している。最も一貫した発現が見られたのは、採取した心臓のすべての部位であり、成体の肺、回腸、リンパ節、精巣、卵巣で最も高発現であった。
ACE2の発現が高いというこのパターンは、成体、胎児の心臓と肺の両方で同じように見られた(図2)。
脳では、大脳皮質全体で一貫したACE2発現が見られ、最も高いACE2発現はポンズと延髄で見られた(図3)。
ACE2の細胞、組織、臓器別の発現パターンは、この一般的なジペプチジルカルボキシジペプチダーゼ(E.C.3.4.17.23)が、呼吸器系、心血管系、消化管系、腎泌尿器系の機能の調節に重要な役割を果たしていることを示唆している。
一般的に、これらのデータは、ACE2が非常に一般的で広範な受容体タイプであることを示しており、SARS-CoV-2ウイルスは、この広範な潜在的な細胞侵入ポイントと、複数のヒト細胞型での生存と増殖を確実にするための非常に効率的なウイルス侵入戦略を利用していることを示している(以下を参照のこと)。
考察
805アミノ酸、92.5 kDa、亜鉛含有ACE2膜一体型メタロタンパク質(E.C.3.4.17.23)の主要な確立された生物学的機能は、血管収縮ペプチドであるアンジオテンシンII(ANG II)の血管拡張剤であるANG1-7への加水分解を触媒することである。ANG1-7を増加させながらANG IIの量を減少させることは、血管平滑筋の弛緩、局所および全身の血流に対する血管抵抗の低下をもたらし、したがって血圧の低下を誘発する(Wang er al)。 2016; Datta er al)。 2020; Li er al)。 2020a、 b)。
したがって、ACE2は、レニン・アンジオテンシン系(RAS)の古典的な軸、すなわち、全身の血流に対する血管抵抗および血圧だけでなく、体液および電解質バランスも調節するホルモン系において重要な調節的役割を果たす(Kehoe er al)。 2016; Wang er al)。 2016; Datta er al)。 2020)。ACE2はまた、補助的な生理学的役割を有することが報告されている。
(i)ハートナップ病(アミノ酸の恒常性と移動の障害;Gheblawi et al 2020)に関与しているナトリウム依存性中性アミノ酸トランスポーターSLC6A19の膜トラフィッキングの調節における;(ii) 2020);(ii)血圧および心筋収縮力を調節するアペリンなどの他の血管活性ペプチドとの相互作用における(Kuba et al 2013);および(iii)GI-tract炎症およびGI-tractマイクロバイオームの複雑性およびスペシエーションの調節における(Kuba et al 2013;Gheblawi et al 2020;Lukiw 2020;Zuo et al 2020;未発表の観察)。
変動するACE2受容体発現(およびそれゆえにSARS-CoV-2感染およびCoV-19重症化の可能性)に関連する他の重要な寄与因子には、年齢、性別、民族、投薬、および心血管疾患、メタボリックシンドロームおよび肥満などのいくつかの併存疾患、ならびに認知症および認知機能の低下が含まれる(BaigおよびSanders 2020; Gheblawi er al)。 予想されるように、ACE2の遮断またはダウンレギュレーションは、血管収縮、アルドステロン分泌、内皮機能不全、およびRASの活性の増加を介してすべてCoV-19感染の進行に影響を与える可能性のある変化した炎症性シグナル伝達を含むプリーオトロピックな効果をもたらし、その結果、「無負荷の」ANG IIの蓄積を導く(Du er al)。 2017; Datta er al)。 2020; Saavedra 2020)。
確かに、ACE2またはコロナウイルスのスパイク(S1)タンパク質に対する増強された親和性を有するアンジオテンシン受容体ブロッカー(ARB)の分子ベースの合理的デザインは、中和抗体、デコイリガンド、およびおそらくSARS-CoV-2感染の抑制のためのより効果的な薬理学的戦略の開発をさらに進めるかもしれないが、これらの治療的アプローチは、現在、CoV-19研究調査のごく初期の段階にあり、それらの臨床的有効性は、もしあるとすれば、まだ確立されていない(Du er al)。、 2017; de Vries 2020; Saavedra 2020)。2017; de Vries 2020; Evans et al 2020; Lewis 2020)。)
呼吸器系、心血管系、消化管系、腎・泌尿器系、生殖器系の細胞および組織における相当なACE2発現に加えて(Harmer er al)。 2002; Datta er al)。 2020)、脳および中枢神経系の異なる解剖学的領域における相当なACE2発現がある(図3)。これは、頭痛、無感覚、老衰、嗜眠、錯乱、認知障害および自律神経呼吸器制御の喪失を含むCoV-19感染に関連する複数の神経学的異常と一致する(Baig and Sanders 2020; Bourgonje er al)。 2020; Datta er al)。 2020; Efe er al)。 2020; Heneka er al)。 2020; Kabbani and Olds 2020)。
SARS-CoVが関与する有意な神経浸潤は、患者および実験動物の両方から報告されており、ここでは、シナプスに接続された経路を介して髄質心葉中枢に明らかに広がることから、脳幹が激しく感染していた(Zubair et al 2019;Chigr et al 2020)。実際に、SARS-CoV-2媒介の神経侵入は、高度に血管化された脳組織への血液媒介輸送、感染したニューロンを横断するシナプス伝達、嗅神経を介した侵入、眼球上皮または血管内皮を介した感染、または血液脳関門を横断する白血球の移動を含む、いくつかの経路によって達成され得る(Kabbani and Olds 2020; Zhou er al)。
興味深いことに、ACE2受容体の発現もまた、眼および視覚系の網膜細胞で容易に検出された(準備中の原稿)。これは、眼および/または視覚系がSARS-CoV-2侵入のための追加の侵入ポイントを提供する可能性を示唆している(そして、眼鏡またはフェイスシールドが、SARS-CoV-2侵入を減少させるためにフェイスマスクと同様に重要である可能性を示唆している)。
共局在化研究により、SARS-CoV-2ウイルスの侵入は、クラスリンおよびカベオラエに依存しないメカニズムによって媒介される可能性があり、コレステロールおよびスフィンゴ脂質に富む脂質ラフトミクロドメインが、ユビキタスACE2受容体を介したSARS-CoV-2-ACE2-相互作用およびそれに続くSARS-CoV-2の感受性細胞への侵入を助けることが示唆されている(Simmons er al)。 2004; Wang er al)。 2008; Gheblawi er al)。 2020)。
興味深いことに(i) ACE2発現は、アルツハイマー病(AD)の影響を受けた脳組織およびADのアミロイド過剰発現トランスジェニックマウスモデルにおいて有意に減少している(Kehoe er al)。 2016; Rocha er al)。 2018; RoyeaおよびHamel 2020)、(ii) この欠損は、増加したアミロイドβ(Aβ)ペプチド負荷およびタウ病理、ADの2つの病態生理学的特徴と関連している(Kehoe er al)。 2016; Rocha er al)。 2018; Evans er al)。 2020)、および(iii)ANG IIタイプ1受容体(AT1R)のANG II活性化によって媒介されるレニン-アンジオテンシン系(RAS)の古典軸の過活動性は、ADに関連する神経血管および神経免疫病理における生体流体の不均衡にさらに暗示されている(Kehoe er al)。 2016; Evans er al)。 2020)。
最後に、平均的な細胞メッセンジャーRNA(mRNA)のサイズよりもかなり大きいssRNA SARS-CoV-2ウイルス(約〜約30,0000ntで)は、マイクロRNA(miRNA)および成熟miRNAへのプレmiRNA処理およびトランスロケーションに関連するRNA結合タンパク質を含む他のssRNAとの相補的な塩基対相互作用に本質的に影響を受けやすいかもしれない。
例えば、23ntのヒトmiRNAhsa-miRNA-5197は、SARS-CoV-2RNA配列の3′ダウンストリーム領域と90%以上の相同性を有する(Ivashenko et al 2020年;未発表の観察)。既存のまたは人工的に合成され、安定化されたmiRNA(例えば、hsa-miRNA-5197)によるSARS-CoV-2の標的化および不活性化。(i) SARS-CoV-2の侵入に対する自然な保護機構を提供する可能性がある;(ii) hsa-miRNA-5197、またはSARS-CoV、SARS-CoV-2またはMERS-CoVなどの病理学的ウイルスを標的とする他のmiRNAまたはssRNAを自然に発現する一部の人のSARS-CoV-2感染に対する個々の自然免疫を説明するのに役立つ可能性がある;
および(iii) 治療上有用である可能性がある。および(iii)は、侵入したSARS-CoV-2ウイルス配列自体の脱重合および破壊を促進し、その結果、SARS-CoV-2を分解し、SARS-CoV-2の致死効果を迅速に停止および終了させる治療的価値があるかもしれない。
結論
ヒトの複数の細胞型および組織型におけるACE2発現の遍在性は注目に値する。SARS-CoV-2は、非常に共通で豊富で感受性の高い膜貫通型ACE2受容体の存在を利用して、その複製、生存、拡散を確実にするために、驚くべき進化戦略を展開してきた。
多くの研究ギャップが残されており、CoV-19病の病因、疫学、病理学的メカニズム、神経生物学をより完全に理解するためには、さらなる基礎研究が急務となっている。SARS-CoV-2感染症の真の危険性は、その高い感染性と致死性だけではない。
(i) SARS-CoV-2の同時多発的かつ多面的な攻撃は、多くのヒトの細胞や組織型を攻撃し、重要かつ重要な呼吸器系、免疫系、血管系、腎泌尿器系、神経系を巻き込みます。
