Contents
SARS-CoV-2 and nervous system: From pathogenesis to clinical manifestation
www.sciencedirect.com/science/article/pii/S0165572820306974
ハイライト
- コロナウイルス疾患2019(COVID-19)の患者は、神経学的症状を様々に発現する可能性がある。
- 神経炎症と自己免疫はCOVID-19神経学的合併症の根底になっている可能性がある。
- COVID-19 神経免疫学的合併症には、ギラン・バレ症候群、ミオパチー、脳脊髄炎が含まれる。
- 免疫療法は、COVID-19関連の神経免疫学的合併症の転帰をさまざまに改善する可能性があります。
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス疾患2019(COVID-19)のパンデミック以来、増加する証拠の体は、COVID-19の一般的な症状の他に、患者が骨格筋だけでなく中枢神経系および末梢神経系の両方に影響を及ぼす様々な神経学的症状を発症する可能性があることを示している。これらの症状は、COVID-19の一般的な症状の発症前、発症中、さらには発症後にも起こりうる。本総説では、神経系および骨格筋の関与の根底にある可能性のある神経免疫学的機序、およびSARS-CoV-2に関連したウイルス誘発神経免疫学的状態、ならびにこれらの特異的な合併症に対して世界的に検討されてきた治療的アプローチについて論じる。
略語
アンジオテンシン変換酵素2(ACE-2)急性播種性脳脊髄炎(ADEM)抗てんかん薬(AED)急性炎症性脱髄性多発神経症 AIDP)急性運動性軸索神経障害(AMAN)急性運動・感覚性軸索神経障害(AMSAN)急性壊死性脳症(ANE)活性化部分トロンボプラスチン時間(aPTT)アクアポリン-4(AQ4)急性呼吸窮迫症候群(ARDS)血液脳関門 BBB)クレアチニンキナーゼ(CK)中枢神経系(中枢神経系)コロナウイルス疾患2019(COVID-19)C反応性蛋白(CRP)サイトカイン放出症候群(CRS)脳脊髄液(脳脊髄液)。ジペプチジルペプチダーゼ4(DPP4)拡散強調イメージング(DWI)脳波(EEG)筋電図/神経伝導試験(EMG/NCS)赤血球沈降速度(ESR)。体液減衰逆転回復(FLAIR)ギラン・バレ症候群(GBS)顆粒球-マクロファージコロニー刺激因子(GM脳脊髄液)血球凝集性脳脊髄炎ウイルス(HEV)集中治療室(ICU)。インターロイキン(IL)静脈内免疫グロブリン(IVIG)嗅覚受容体ニューロン(ORN)嗅覚内皮(OE)マクロファージ活性化症候群(MAL)中東呼吸器症候群(MERS)。ミラーフィッシャー症候群(MFS)ミエリンオリゴデンドロサイト糖タンパク質(MOG)マウス肝炎ウイルス(MHV)活性化B細胞の核因子κ-光鎖エンハンサー(NF-κB)末梢神経系(末梢神経系)個人用保護具(PPE)プロトロンビン時間(PT)リアルタイム逆転写ポリメラーゼ連鎖反応(rRT-PCR)重症急性呼吸器症候群(SARS)。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)二次性血球貪食性リンパ組織球症(sHLH)一本鎖RNA(ss-RNA)トール様受容体(TLRs)膜貫通型プロテアーゼ。セリン2(TMPRSS2)腫瘍壊死因子α(TNF-α)TNF受容体関連因子6(TRAF6)TIRドメイン含有アダプター誘導インターフェロン-β(TRIF)白血球(WBC)世界保健機関(WHO
1. 序論
2019年12月に中国・武漢から非定型肺炎のパンデミックが最初に報告され 2020年1月上旬には世界保健機関(WHO)が報告を開始した(世界保健機関(WHO)2020)。症例は 2020年1月7日に4例の下気道サンプルから回収されたコロナウイルスの新規株と関連しており、重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)と関連するウイルスと同じファミリーに属するウイルスであった(Zhu et al 2020)。その後、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と命名され(Gorbalenya et al 2020年)無症候性から重症化までの臨床症状を示し、症例死亡率は2.3%(新型コロナウイルス肺炎緊急対応疫学チーム 2020)となり、コロナウイルス疾患2019(COVID-19)に分類された。
1.1 一般的なウイルス学
コロナウイルス科は動物と鳥の両方に感染するコロナウイルスで構成されており、α-コロナウイルス亜科とβ-コロナウイルス亜科は哺乳類にのみ感染する(Cui er al)。 他の亜科は、一般的に鳥類に感染するγ-コロナウイルスとδ-コロナウイルスであるが、一部の亜科は哺乳類にも感染する可能性がある。α-コロナウイルス、β-コロナウイルスともに、通常、ヒトでは呼吸器感染症を、他の動物では胃腸炎を引き起こす。これまでのところ、ヒトのコロナウイルスはすべて動物由来である。その中でもSARS-CoV、SARS-CoV-2,MERS-CoVはコウモリ由来である可能性が高い。一般に、コウモリは、αおよびβコロナウイルスの最大のリザーバーである(Cui et al 2019; Woo et al 2012)。最も一般的な古い既知のコロナウイルスは、風邪の原因となっていた。2002年にSARS-CoVが重症呼吸器疾患の原因菌として初めて出現し、その後2013年にMERS-CoV、そして2019年にはSARS-COV-2が出現した。これらは徐々に進化し、受容体との親和性が強くなり、より高い病原性を持つようになった。SARS-CoV-2は、29,903 bpのポジティブセンス一本鎖RNA(ss-RNA)であり、SARS-CoVと79.5%の同一性を有し、コウモリコロナウイルスと96%の同一性を有する(Baig et al 2020;Lu et al 2020;Wu et al 2020a;Wu et al 2020b)。SARS-CoV、MERS-CoVとともにβ-コロナサブグループに属し、ゲノム幅26〜32kbpのRNAウイルスの中で最大のゲノムを持つ。
COVID-19の一般的な症状として、乾いた咳、発熱、倦怠感、息切れなどが報告されている(疾病対策予防センター(CDC)2020)。後に、アノスミア(嗅覚脱失)(疾病対策予防センター(CDC)2020,Moein et al 2020)やageusia(疾病対策予防センター(CDC)2020)も鑑別症状として追加された。COVID-19の症例の大部分は軽度の症状を有するが、一部の症例は、サイトカインストームに続いて急性呼吸窮迫症候群(ARDS)(Ye et al 2020b)血栓、敗血症性ショック、多臓器不全、および最終的に患者の終末期に至る(Bikdeli et al 2020;Cascella et al 2020;Murthy et al 2020)。ウイルス曝露から症状の発症までは平均5日遅れ、2日から14日の範囲になることもある(疾病対策予防センター(CDC)2020)。
1.2 疫学と感染モード
2020年3月11日、WHOはCOVID-19をパンデミックと宣言した。2020年10月21日の最終レビューの時点で、188の国と地域から4,107万人を超える症例が報告されており、これにより128万8,000人以上が死亡し、約2,800万人が回復している(Dong et al 2020)と同時に、世界中のあらゆる大陸で社会的・経済的な影響が広範囲に及ぶ数十億人の生活に影響を与えている。
パンデミックの初期には、SARS-CoV-2は飛沫や汚染された表面を介して拡散すると考えられてたが、エアロゾル化した拡散の証拠は限られてた(Pyankov et al 2018)。その後、病原体はエアロゾルを介しても拡散する可能性があることを示唆する証拠が浮上した(van Doremalen et al 2020)。SARS-CoV-2の主な感染様式は、密接な接触中の人から人への感染である。感染は、咳、くしゃみ、または会話中に生じる微小液滴を介して行われることが最も多い(疾病対策予防センター(CDC)2020)。現在では、汚染された表面の接触に続いて顔に触れることによる感染は、あまり一般的ではないことが知られている(疾病対策予防センター(CDC)2020)。微小液滴のほとんどは地面や表面に落下し、長距離にわたって空気感染することはない(Centers for Disease Control and Prevention (CDC), 2020)。症状が出てから最初の3日間がSARS-CoV-2が最も感染しやすい期間であるが、症状が出る前に感染することもあり、症状が出ていない人が感染することもある(疾病対策予防センター(CDC)2020)。COVID-19の最も一般的な診断は、鼻咽頭スワブ検体を介して採取したリアルタイム逆転写ポリメラーゼ連鎖反応(rRT-PCR)によるSARS-CoV-2リボ核酸(RNA)の検出を介して行われる(世界保健機関(WHO)2020)。胸部コンピュータ断層撮影(CT)画像もまた、特に症状および危険因子に基づいて感染が強く疑われる場合には、診断のための信頼できる情報源となっている(Salehi et al 2020)。
SARS-CoV-2の主な攻撃様式は呼吸器経路を介したものであると報告されているが、パンデミックの初期には、中国の武漢からの報告では、COVID-19を有する一部の患者が頭痛、めまい、および筋肉痛などの神経症状も示していた(Li et al 2020)。それ以来、世界中の疫学的臨床研究、症例シリーズおよび報告の増加は、COVID-19患者のかなりの数が、骨格筋だけでなく、中枢神経系および末梢神経系(それぞれ中枢神経系および末梢神経系)の両方に影響を及ぼす神経学的症状および合併症を発症する可能性があることを実証してきた。このレビューでは、COVID-19患者における神経系と骨格筋の関与の根底にある可能性のあるメカニズムと、COVID-19の一般的な症状の発症前、発症中、発症後にも起こりうる神経学的症状について議論する。また、これらの神経学的合併症の管理のために検討されてきた治療的アプローチと、そのような患者の機能的転帰を強調する。
2. 神経系へのルート
他のコロナウイルスに関するこれまでの研究では、SARS-CoV-2が中枢神経系(CNS)に侵入する経路として、神経細胞の逆行性、転写性、および血行性播種が考えられることが示唆されている。微小管に沿って移動するモータータンパク質(ダイニンやキネシンなど)は、感覚神経終末または運動神経終末を介したウイルス(アデノウイルスやα-ヘルペスウイルスなど)の逆行性または前向性輸送に関与していることが示されている(Dodding and Way, 2011)。
2.1 嗅覚経路
嗅覚神経経路は、このような神経経路の一例であり、様々なウイルスファミリー(例えば、ヘルペスウイルス科、コロナウイルス科、フラビウイルス科、トガウイルス科、ボルナウイルス科、ブニャウイルス科、オルソミクソウイルス科、パラミクソウイルス科、およびラブドウイルス科のファミリー)に対して、周辺部から中枢神経系へのユニークで直接アクセス可能な入口を提供している(Koyuncu et al 2013)。嗅覚神経は、鼻上皮と大脳皮質、基底核、中脳などの中枢神経系領域をつなぐ二極性の神経細胞構造を有しており、これらの領域はウイルスの影響を受ける可能性がある(Netland et al 2008)。注目すべきことに、軽度から中等度のCOVID-19を有する欧州の患者417人を対象とした最近の多施設研究では、患者の85.6%に嗅覚機能障害が認められ、そのうち11.8%が他の症状よりも先に出現した(Lechien et al 2020)。COVID-19患者における低オスミアおよび他の神経症状の発症は、SARS-CoV-2の嗅覚系への影響を示唆している。最近の死後早期の研究でも、SARS-CoV-2に関連した嗅覚障害は嗅球に限定されているようであることが明らかになった(Coolen et al 2020)。コロナウイルスファミリーの他のウイルスもまた、感染の初期段階で嗅覚管を介して中枢神経系に関与することが示されている(Desforges et al 2019; Mori 2015)。嗅覚受容体ニューロンへのSARS-CoV-2の付着はまた、嗅覚系の付属細胞からのサイトカインストームを誘発し、免疫学的応答を誇張する可能性がある。サイトカイン放出は、嗅覚ニューロンの損傷に寄与している可能性がある(Jakhmola et al 2020; Netland et al 2008)。
対照的な証拠は、SARS-CoV-2が嗅覚ニューロンに直接侵入するのではなく、その代わりに、ヒト嗅覚上皮のustentacular、粘膜細胞、Bowman’s細胞、および嗅覚幹細胞を標的とする可能性があることを示唆している(Brann et al 2020年)。単細胞転写解析により、グリア細胞および嗅覚ニューロンを含む複数の嗅覚細胞上にアンジオテンシン変換酵素2(ACE-2)受容体が存在しないことが示された。嗅覚受容体ニューロン(ORN)および嗅覚内皮(OE)は、前向性小胞性軸索経路によるウイルスの侵入点と考えられる(Jakhmola et al 2020;Murthy et al 2020)。これらの非神経細胞型の感染は、COVID-19患者における嗅覚機能障害の原因となる可能性がある(Brann et al 2020)。
2.2 他の頭蓋神経を介した経路
他の頭蓋神経の中では、三叉神経や迷走神経がより適切な伝達経路であると考えられる。SARS-CoV-2は肺や消化管を侵すことが非常に多いが、迷走神経求心性神経内での逆行性神経細胞輸送を介した神経浸潤(Li et al 2020; Toljan, 2020)も想定されている。腸管神経系に位置する局所末梢神経もまた、消化管内の他の細胞に感染する可能性がある(Bostancıklıolu, 2020; Lima et al 2020; Wong et al 2020b)。実験研究は、インフルエンザウイルス(Matsuda et al 2004)および血球凝集性脳脊髄炎ウイルス(HEV)(Andries and Pensaert、1980b)について、この逆行経路を実証している。また、通常は鼻腔の侵害受容細胞や結膜の感覚線維を供給している三叉神経が中枢神経系に関与している可能性がある。したがって、結膜炎患者においてSARS-CoV-2 RNAが検出されている(Lima et al 2020;Sun and Guan 2020)。
2.3 血行経路
血液脳関門(BBB)の破壊を介した血行性の広がりは、インフルエンザおよび他のコロナウイルスで見られるように、脳へのウイルスの侵入のまだ別の経路として提案されている(Desforges et al 2019; Koyuncu et al 2013; Wang et al 2010)。これは、SARS-CoV-2による中枢神経系への直接的な侵入、または感染した白血球が中枢神経系に侵入することによって起こり得る(Bostancıklıoğlu, 2020)。さらに、SARS-CoV-2は、脳の血管内皮細胞に存在するアンジオテンシン変換酵素2(ACE-2)受容体を攻撃し、BBBを破壊し、BBB透過性を増加させることができ(Hamming et al 2004年)これは最終的に中枢神経系への侵入を促す。BBBBを横断し、マウス、さらには霊長類中枢神経系に感染するコロナウイルスの能力は、マウス肝炎ウイルス(MHV)モデルにおいて以前に記載されている(Bleau et al 2015;Cabirac et al 1994年;CowleyおよびWeiss 2010)。MHVの研究は、コロナウイルスが脳微小血管内皮細胞のタイトジャンクションを破壊し、透過性の増加につながる可能性があることを示した。MHVは骨髄炎、脳炎、中枢神経系の脱髄性疾患を引き起こす可能性がある。興味深いことに、MHV感染マウスは、多発性硬化症を模倣した実験マウスモデルとして使用することができ(Mecha et al 2013年)脳と脊髄の両方で脱髄を引き起こす。また、SARS-COV-2のウイルス様粒子は、死後の脳内皮毛細血管ペリサイトでも検出され、COVID-19患者の血行性中枢神経系感染を支持した。さらに、SARS-CoVの存在は、SARS患者の大脳で確認されている(Ding et al 2004)。
3. 中枢神経系の関与機序
3.1 直接感染
ウイルス感染性の第一の重要な指標は、受容体の認識と、ウイルス-宿主受容体の最強の結合のためのアミノ酸の組み合わせを提示することである。新しいウイルスが先行するウイルスよりも強い結合を行う場合、それは自然淘汰によって選択されるであろう。RNAウイルスは一般に、高い突然変異率のために、より迅速に宿主に適応する。その高い適応能力は、動物からヒトへの感染に有利である(Wu et al 2012)。コロナウイルスファミリーは、すべて球形または楕円形であり、そのエンベロープ全体にスパイク(S)糖タンパク質を持っており、電子顕微鏡下でそれらに王冠の形を与える。それゆえ、それらはコロナ(冠)ウイルス科と命名される(Schoeman and Fielding, 2019; Wu er al)。 三量体Sタンパク質およびその受容体バイディングドメインは、SARS-CoVおよびSARS-CoV-2の両方において、類似の立体構造および相同性を有する。それらは共にヒトACE-2受容体に強い親和性を有する(Chen et al 2020b; Li et al 2005; Ziegler et al 2020)。一連の突然変異は、ヒトACE-2受容体に対するSARS-CoV受容体ドメインの異なる親和性をもたらした。例えば、ヒトACE-2ホットスポット31において疎水性環境下でLys31とGlu35の間に塩橋が存在する(Yin et al 2020)。最初に、ハクビSARS-CoV受容体結合ドメインにおいて、ACE-2のホットスポット31とカウンター反応する479残基もリジンであった(Yin et al 2020)。両側のリジンは、シベット-SARS-CoVとACE-2の塩架橋カウンターパートとの立体的および静電的干渉を引き起こす。その後、リジン残基の点突然変異(K479N)の結果として、アスパラギンで置換され、これはSARS-CoVとACE-2との間のより強い相互作用を保証し、SARS-CoVのヒトへの伝達を容易にした。このような変異はコロナウイルスの進化の過程で起こったものであり、その中にはヒト-SARS-CoV-2宿主相互作用に有利なものもあれば、ヒト-SARS-CoVに有利なものもあった。しかしながら、一般的に言えば、ヒト-CoVにおける選択されたすべての突然変異は、シベット-CoVと比較してヒトACE-2との相互作用を増強する(Yin et al 2020)。
ACE-2受容体は、中枢神経系や骨格筋を含むヒトの体内の複数の組織に発現している(Hamming et al 2004)。主にグリア細胞およびニューロン上で検出される(Baig et al 2020; Palasca et al 2018)。したがって、ウイルスが中枢神経系または末梢神経系に到達する場合、ニューロンおよびグリア細胞が潜在的な標的となるであろう。脳内では、ACE-2受容体は、心血管系の調節に関与する網目状活性化系機能の一部として、特に脳幹および髄質に存在する(Xia and Lazartigues, 2008)。しかし、興味深いことに、SARS-CoVではACE、MERS-CoVではジペプチジルペプチダーゼ4(DPP4)のようなウイルス受容体の発現が、コロナウイルスファミリーの宿主細胞感染の唯一のメカニズムではないようである。最初は、細胞内の受容体の発現レベルが感染性を決定する要因であると考えられていたが、ACE受容体の発現レベルが非常に低く、検出不可能なレベルにもかかわらず、コロナウイルスによる肝臓の感染が顕著であったことから、ACE理論以外のメカニズムが示唆された(Prabakaran et al 2004; To and Lo, 2004)。別の提案された経路は、神経細胞のシナプス経路を介したものである。β-Coronaviridaeの仲間でもあるHEVは、末梢感覚神経を介して中枢神経系に逆行的に感染するようである(Andries and Pensaert, 1980a; Hara et al 2009)。HEV粒子は神経細胞に感染した後、小胞体-ゴルジ体中間コンパートメントから芽生える。その後、ゴルジ体を介してウイルス小胞を形成し、最終的に周囲のマトリックスに分泌される。ウイルスはその後、隣接する神経細胞に取り込まれる(図1)(原 et al 2009; Li et al 2012; Steardo et al 2020)。嗅神経を介したウイルスの輸送は、内皮から嗅神経、嗅球にウイルスを導入し、最終的には脳に至るための可能なチャネルであると考えられている。嗅覚上皮細胞もACE-2を発現している。この経路は、SARS-CoV-2感染によるアノスミア(嗅覚脱失)を説明するものでもある。しかし、ACE-2受容体との相互作用が、SARS-CoV感染で一般的に見られるアノスマの主要なメカニズムであるのか、あるいはHCoV-229Eと同様の毛様体鼻上皮の破壊であるのかが鍵であり、まだ決定されていない(Koyuncu et al 2013; Lechien et al 2020; Troyer et al 2020; Wu et al 2020b)。特筆すべきことに、ヒトACE-2を発現するトランスジェニックマウスをSARS-CoVによって経鼻的に感染させた場合、ウイルスは、主に嗅球を介して感染後4日目までに脳内に侵入し、その結果、脳の接続領域への急速な神経細胞間の拡散をもたらすことが判明した(Netland et al 2008)。別のコロナウイルス、HCoV-OC43は、同様の挙動を示している(Dube et al 2018)。この場合、ウイルスは、感染後4日目までに毛様体皮質、脳幹、および脊髄に拡散する。興味深いことに、嗅覚ニューロンの変性を引き起こす硫酸亜鉛の投与は、中枢神経系への侵入を得るためにウイルスをほぼ完全に停止させた(Dube, Le Coupanec, 2018)。さらに、ヒトDPP4を発現するトランスジェニックマウスをMERS-CoVに非経口的に感染させたところ、脳疾患が観察され、視床および脳幹に最大の関与が認められた(Li et al 2016)。脳組織感染の時間的経過は、嗅覚ニューロンからの逆行性ウイルス拡散を示唆していた。これらのデータは、嗅覚経路とACE-2が神経侵入プロセスにおいて重要な役割を果たしていることを裏付けている。
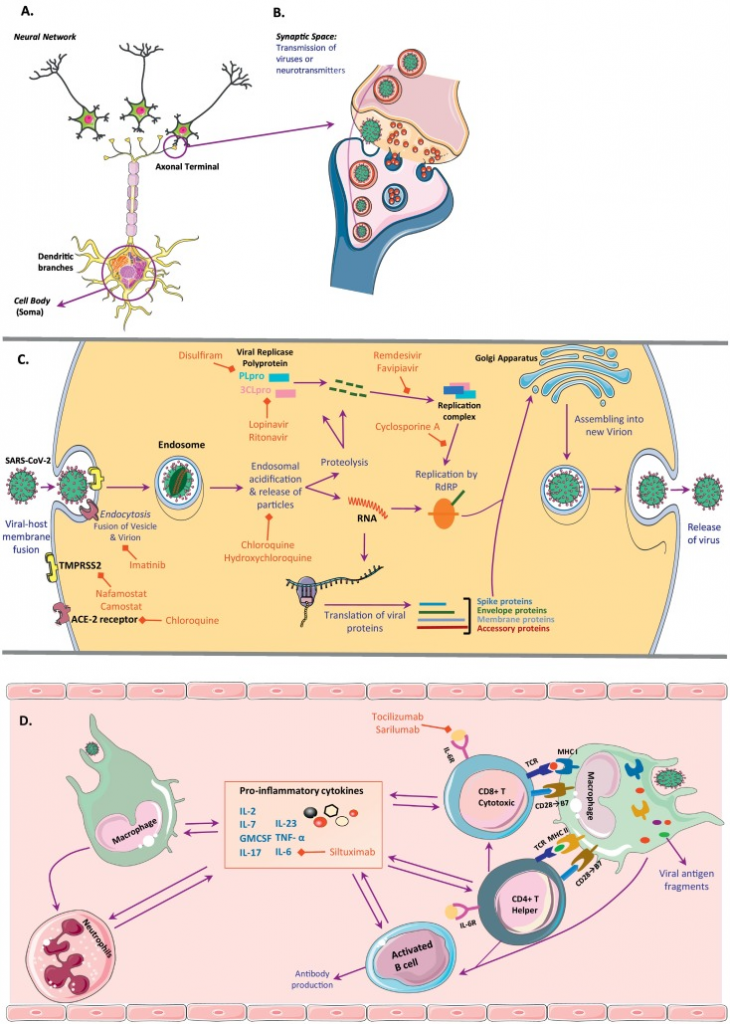
図1A細胞内SARS-CoV-2サイクルの神経ネットワークとシナプス空間、およびその経路と自然免疫応答と先行免疫応答の両方への影響を模式的に示す。
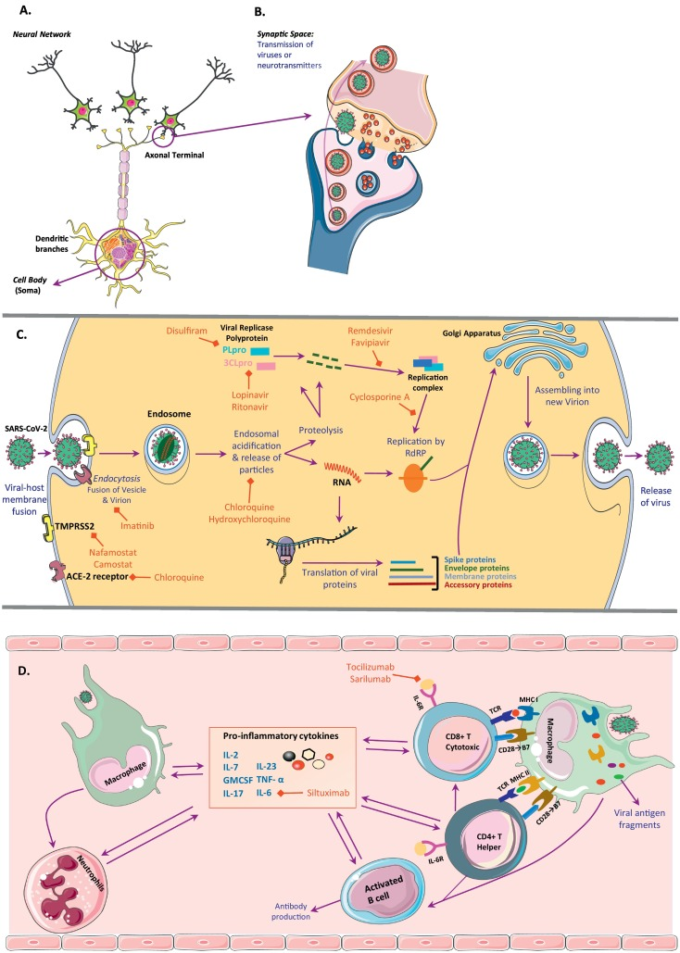
A)神経ネットワークとニューロンの主要な3つの部分(細胞体、樹状枝、軸索)(B)シナプス空間と神経伝達物質とSARS-CoV-2ウイルスの同様の伝達経路、(C)ニューロンを含む任意の細胞型におけるウイルス融合、ウイルスRNAの複製と組み立て、最終的に排泄のための経路。ウイルスはエンドサイトーシスを介して細胞内に入り、その後、エンドソーム酸性化を介してタンパク質粒子と核酸に溶解される。ウイルスゲノムは、ウイルスの再集合と排泄に必要なすべての部品を持っているように複製され、翻訳されている。RNAはRNA依存性RNAポリメラーゼ(RdRP)の助けを借りて複製され、ウイルスタンパク質粒子とウイルスレプリカーゼポリプロテインから構成されている複製複合体によって複製される。カスケードの各ステップを阻害する薬剤がある。(D) 自然免疫応答と先行免疫応答の両方に対するウイルスの影響のメカニズムの描写。プロ炎症性サイトカインの放出とサイトカインストームの急速な増加につながるすべての免疫細胞のタイプの間に相互作用がある。初期の免疫応答として、好中球数が増加し、抗原提示細胞としてのマクロファージは、それぞれMHCクラスIIとIを介してTヘルパー細胞とT細胞傷害性細胞を活性化する。Tヘルパー細胞はまた、B細胞とT細胞障害細胞の活性化にも役立つ。これらの活性化された細胞からは、IL-6やTNF-αなどの炎症性サイトカインが分泌される。GM脳脊髄液、顆粒球-マクロファージコロニー刺激因子、TMPRSS2,膜貫通型プロテアーゼ、セリン2。 (この図の凡例における色の参照の解釈については、読者はこの記事のウェブ版を参照してほしい)。
現在までのところ、神経細胞やグリア細胞への感染経路の全容については、説得力のある説明がなされていない。しかしながら、これまでの症例報告および剖検では、SARS-CoVおよびMERS-CoV粒子が神経細胞およびグリア細胞、ならびに脳脊髄液(脳脊髄液)内で発見されており、神経系の細胞が感染する可能性があることが証明されている(He et al 2003; Lau et al 2004; Li et al 2016; Xu et al 2005)。コロナウイルスに細胞が感染した後、細胞の究極の終着点は、オートファジー、アポトーシス、ピロプトーシス、自然免疫細胞を介した消去、または他の経路を介して起こるかどうかにかかわらず、死である(Varga et al 2020;Yang and Shen 2020)。ウイルス抗原は、孤道核や曖昧核のような呼吸器脳幹センターで検出された。これらの中枢への損傷は、心臓または呼吸停止の一因となる可能性がある(Li et al 2020; Steardo et al 2020; XiaおよびLazartigues 2010)。
3.2 神経炎症
SARS-CoV-2の中枢神経系への追加的な影響は、サイトカインのストーム化と免疫細胞の再活性化を引き起こす全身的および局所的な炎症反応によるものである(Shi et al 2020; Steardo et al 2020)。これまでの疫学研究では、約15%の症例が重症化する可能性があり、65歳以上の高齢者ではその割合が高いことが示されている(Sun and Guan, 2020)。その後、イタリアなどのヨーロッパ諸国では、中国や他の多くの国と比較して、より高い症例死亡率が示された(Onder et al 2020)。重症化の決定要因は完全には解明されていないが、最も顕著な問題である。
ウイルスと宿主免疫応答の間には常に綱引きが存在する。宿主の免疫系は何年にもわたって病原体を除去することに成功するか、あるいは慢性的なウイルス感染を引き起こす方法で適応するかのいずれかである。何年もの共進化の後にウイルスが種を超えた場合、新しい宿主は、宿主組織を損傷することさえある、より深刻な免疫反応でそれに反応するであろう。したがって、SARS-CoV-2に対する可能性のある重度の免疫反応が予想される(Fung et al 2020;Rahman et al 2011;Wagstaff et al 2013)。SARS-CoV-2に対するヒト免疫応答にはいくつかの経路が提案されているが、いずれも自然免疫応答と適応免疫応答の2つの一般的なフェーズを含んでいる(図1)。自然免疫応答は、好中球、マクロファージおよびナチュラルキラー細胞の活性化を含み、適応応答は、細胞傷害性CD8+細胞、CD4+ Tヘルパー細胞およびB細胞を含む(Steardo er al)。 重症で致死的なCOVID-19感染でこれまでに観察されてきたのは、単球、好酸球、好塩基球と同様にT細胞の絶対数の減少である。同時に好中球反応が亢進し、好中球-リンパ球比が増加する。CD4+およびCD8+細胞の両方を含むT細胞の総数の絶対的な減少にもかかわらず、主な減少はメモリーTヘルパーおよび調節性細胞の間であり、一方でナイーブT細胞およびプロ炎症性Tヘルパー17細胞は数でさえブーストされた(KarakikeおよびGiamarellos-Bourboulis, 2019; Lagunas-Rangel, 2020; Qin et al 2020; Xu et al 2020e)。この親炎症性細胞シフトのために、免疫細胞は、過剰レベルの炎症性サイトカインを産生することによってハイパーリアクションを起こす。サイトカインストームが「サイトカイン放出症候群(CRS)」の一部であるか、または「マクロファージ活性化様症候群(MAL)」とも呼ばれる「二次性血球貪食細胞性リンパ組織球症(sHLH)」の一部であるかどうか。その結果、インターロイキン(IL)-6,IL-2,IL-7,顆粒球コロニー刺激因子(GM脳脊髄液)および腫瘍壊死因子-α(TNF-α)などの高度な炎症性サイトカインの頑健な増加が認められる(Mehta er al)。 , 2020; Zhang et al 2020a)。)
CRSは、car T細胞療法後や臓器移植後の敗血症の後によく見られ、ウイルス感染症の後にも報告されている。CRSの臨床的特徴は、頭痛、発熱、脳症、低血圧、凝固障害、細胞減少および多臓器不全を含む(Le et al 2018; Zhang et al 2020a)。これらの特徴のほとんどはMALと共通しており、感染症および血液学的悪性腫瘍に二次的に起こる可能性もある(KarakikeおよびGiamarellos-Bourboulis, 2019)。CRSおよびMALの両方に共通して見られる主な転帰の1つは、IL-6の上昇であり、これはSARS-CoV-2感染の中等度から重度の症例においても増強されることが報告されている(Wan et al 2020)。IL-6およびTNF-αの増加につながる炎症性疾患は、BBBの破壊を促進する可能性がある(Ichiyama et al 2002; Linker et al 2008)。SARS-CoV-2感染によるこのような合併症のいくつかの症例報告があり、で議論する(Alberti et al 2020; Mcアミロイドβee et al 2020; Moriguchi et al 2020; Poyiadji et al 2020; Zanin et al 2020; Zhang et al 2020c)。興味深いことに、T細胞誘発性CRSの治療のためのFDA承認薬であるトシリズマブ(IL-6受容体に対する組換えヒト化モノクローナル抗体)もまた、COVID-19感染症の重症例に対して何らかの有益性を示した(Le et al 2018;Xu et al 2020a)。しかし、まだのところ、SARS-CoV-2感染の一般的な合併症である、ウイルスの直接感染または低酸素症による全身性炎症対局所性炎症の正確な役割を明らかにするのに十分な証拠はない。
3.3 その他のメカニズム
脳と肺は密接な相互関係にある。一方の疾患プロセスは、他方の疾患の合併症を引き起こす可能性がある(アミロイドβdennour et al 2012)。呼吸器系および心血管系の脳幹センターはSARS-CoV-2の潜在的な標的であり、これらのセンターにおける神経細胞死は、呼吸器/心血管停止の中心的な原因を引き起こす可能性がある(Li et al 2020;Steardo et al 2020;XiaおよびLazartigues 2010)。SARS-CoV-2肺感染は非定型のARDSを引き起こすことが報告されているが、患者は通常、低酸素血症の重症度とは一致しない比較的よく保存された肺の力学を示す。これは、肺灌流の調節障害および低酸素性血管収縮が原因であると考えられるが、これにも中心的な原因があると考えられる(Gattinoni et al 2020)。一方、通常、毒性代謝障害や急性感染症で見られる「感染性中毒性脳症」と呼ばれるプロセスを経て、肺胞ガス交換の問題が脳細胞の嫌気性代謝を引き起こし、中枢神経系の低酸素血症を引き起こす可能性がある。脳内の低酸素血症と酸性度の上昇は、細胞の腫脹、間質性浮腫、閉塞性水頭症、頭蓋内高血圧の上昇を引き起こし、精神状態の変化、さらには昏睡状態に至る(アミロイドβdennour et al 2012; Wu et al 2020b)。脳への低酸素傷害はまた、脳卒中や発作のような脳血管事故を引き起こす可能性があり、再び局所的なミクログリアの活性化と全身性炎症の両方のループを活性化させることになる(Liu and Mccullough, 2013; Wu et al 2020b)。
SARS-CoV-2感染のもう一つの臨床的および科学的意義は、Dダイマーレベルの上昇、プロトロンビン時間(PT)の延長、活性化された部分トロンボプラスチン時間(aPTT)および血小板減少によって示される高凝固状態が広く観察されていることである(Violi er al)。 凝固障害は、SARSおよびMERSを含む他のCoronoviridaeウイルスへの感染において以前に観察された(Giannis et al 2020; MeradおよびMartin 2020)。現在、血栓性イベントの発生率を調べているいくつかの前向き研究があるが、初期の研究では、肺塞栓症、心筋梗塞、虚血性脳卒中、さらには脳静脈洞血栓症につながる血管内血栓症の頻度の増加がすでに確認されている。血栓性イベントは、COVID-19感染の最初の提示として報告されることがあった(Hughes et al 2020;Klok et al 2020)。COVID-19患者214人を対象としたレトロスペクティブ研究では、約6%が急性脳血管イベント(主に虚血性脳卒中)を呈した(Cantador et al 2020)。COVID-19に感染した脳卒中患者のうち、ごく少数が脳出血を呈した(Cantador et al 2020)。また、最近の調査では、COVID-19患者は、活性酸素種の過剰産生を介した血管機能障害の重要な引き金となる血清Nox2過剰活性化が増加していることが明らかにされている(Violi et al 2020a)。興味深いことに、より重症のCOVID-19症例や、血栓性合併症を有する症例では、よりアップレギュレーションされていた(Violi et al 2020a)。基礎となるメカニズムの一つとして考えられるのは、SARS-CoV-2感染細胞におけるACE-2の発現および機能の低下である。ACE-2は脳血流を調節し、その変化したシグナル伝達は、その後の高血圧および動脈壁の破裂から出血性脳卒中を発症する素因につながり得る(Sharifi-Razavi et al 2020a)。別の可能性のあるメカニズムは、血小板減少症を伴う感染によって誘導される基礎的な凝固障害である(Wang et al 2020b)。
4. 神経学的症状
世界的なパンデミックの初期段階から、多くの研究でCOVID-19の臨床症状および徴候が実証されており、主に発熱、咳、咽頭痛、呼吸困難、下痢、吐き気、嘔吐、食欲不振、および疲労を含む(表1)。蓄積された証拠はまた、COVID-19患者が神経学的症状および合併症を多様に発現する可能性があることを示している(表1)。中国の武漢で214人の患者を対象とした初期の研究では、COVID-19患者の約36%にめまい(16.8%)頭痛(13.1%)骨格筋損傷(筋痛+クレアチニンキナーゼ[CK]上昇、10.7%)意識障害(7%)などの神経学的症状が認められた。 7%)意識障害(7.5%)老衰(5.6%)無呼吸(5.1%)脳卒中(2.8%)神経痛(2.3%)視覚障害(1.4%)発作(0.5%)および運動失調(0.5%)を含む(Mao er al 2020). 重要な所見は、重度のCOVID-19感染患者では、重度でない感染患者に比べて、神経学的症状(一般的に)および意識障害、脳卒中および骨格筋損傷(特に)の割合が有意に高いことであった(Mao et al 2020)。別の研究では、神経学的合併症に関連する主な因子は60歳以上の年齢であり、これも死亡率の強い危険因子であることが示された(Xiong et al 2020)。COVID-19感染患者を同程度の重症度で比較したところ、神経学的重要事象(意識障害や脳卒中など)の新規発症は、後に死亡リスクを6倍に高めることが明らかになった(Xiong et al 2020)。全体的に、COVID-19患者に記載された最も一般的な神経学的症状は、疲労/倦怠感、筋肉痛、頭痛、意識障害、めまい、老年期障害、および無感覚であり;あまり一般的に報告されていない症状は、視覚障害、神経痛、後頭神経痛、運動失調、振戦、およびチックである。また、SARS-CoV-2感染に関連して、以下に述べるような様々な神経症状やウイルス感染後の自己免疫性合併症が発生することが報告されている。
表1 臨床試験におけるCOVID-19の神経学的症状と徴候
原文参照
ADC、見かけの拡散係数;AKI、急性腎障害、ALT、アラニンアミノトランスフェラーゼ;ARDS、急性呼吸窮迫症候群;AST、アスパラギン酸アミノトランスフェラーゼ;BNP、B型ナトリウム利尿ペプチド;BUN、血中尿素窒素;CK、クレアチンキナーゼ;中枢神経系、中枢神経系。CRP、C反応性蛋白質;DIC、播種性血管内凝固;EEG、電気脳波;ESR、赤血球沈降速度;F、女性;FGF、線維芽細胞増殖因子;G脳脊髄液、顆粒球コロニー刺激因子;GM脳脊髄液、顆粒球-マクロファージコロニー刺激因子。ICU、集中治療室;IFN-γ、インターフェロン-γ;IL、インターロイキン;IP、誘導タンパク質;IQR、四分位間範囲;LDH、乳酸脱水素酵素;MCP、単球化学吸引性タンパク質;MIP、マクロファージ炎症性タンパク質;PDGF、血小板由来成長因子。pro-BNP、pro-brain natriuretic peptide;PT、プロトロンビン時間;RANTES、regulated on activation and normal T-cell expressed;SD、標準偏差;TNF-α、tumor necrosis factor-α;TSH、甲状腺刺激ホルモン;VEGF、vascular endothelial growth factor;WBC、白血球。
低アスタリスク 神経症状を呈したICU患者235人中50人(21%)のうちの1人である。
表2 COVID-19に関連したギラン・バレー症候群(GBS)変異体と骨格筋損傷の症例報告
原文参照
AIDP、急性炎症性脱髄性多発神経障害;AKI、急性腎障害;ALT、アラニンアミノトランスフェラーゼ;AMAN、急性運動性軸索神経障害;AMSAN、急性運動性・感覚性軸索神経障害;ARDS、急性呼吸窮迫症候群;AST、アスパラギン酸アミノトランスフェラーゼ。CBCdif、差動を伴う完全血球数;CK、クレアチンキナーゼ;CMAP、複合運動活動電位;CRP、C反応性蛋白質;COVID-19,コロナウイルス病2019;脳脊髄液、脳脊髄液;EMG/NCS、筋電図/神経伝導試験。ESR、赤血球沈降速度;F、女性;IL、インターロイキン;INO、眼球内視鏡;INR、国際正規化比;IVIG、静脈内免疫グロブリン;LDH、乳酸脱水素酵素;LFT、肝機能検査;M、男性;NR、報告されていない;PT、プロトロンビン時間。RFT、腎機能検査;rRT-PCR、リアルタイム逆転写ポリメラーゼ連鎖反応;SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2;SIADH、不適切な抗利尿ホルモン分泌症候群;SNAP、感覚神経活動電位;WBC、白血球。
表3 COVID-19に関連した発作、脳炎、髄膜脳炎、中枢神経脱髄の症例報告
原文参照
ACE、アンジオテンシン変換酵素; ADC、見かけの拡散係数; ADEM、急性播種性脳脊髄炎; ALT、アラニンアミノトランスフェラーゼ; aPTT、活性化部分トロンボプラスチン時間; AQ4,抗アクアポリン-4; BCx、血液培養; ARDS、急性呼吸窮迫症候群; AST、アスパラギン酸トランスアミナーゼ。CBCdiff、差動を伴う完全血球数;CK、クレアチンキナーゼ;COVID-19,コロナウイルス疾患2019;CRP、C反応性蛋白質;DWI、拡散強調イメージング;EEG、脳波造影;ESR、赤血球沈降速度;F、女性;FLAIR、体液減衰性逆転回復。HSV、単純ヘルペスウイルス、ICU、集中治療室、IL、インターロイキン、INR、国際標準化比、IVIG、静脈内免疫グロブリン、LDH、乳酸脱水素酵素、LFT、肝機能検査、LP、腰椎穿刺、M、男性、RAPD、相対求心性瞳孔欠損。MOG、ミエリンオリゴデンドロサイト糖タンパク質;NR、報告されていない;RFT、腎機能検査;rRT-PCR、リアルタイム逆転写ポリメラーゼ連鎖反応;SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2;TNF-α、腫瘍壊死因子-α;UCx、尿培養;VZV、水痘帯状疱疹ウイルス。
4.1 ギランバレー症候群
GBSの特徴は、急性(4週間未満)の上行筋力低下であり、深部腱反射の低下・消失、軽度・中等度の感覚低下、時として頭蓋神経の病変、橈骨神経痛や筋肉痛を伴うことである。GBSは一般的に脱髄性(急性炎症性脱髄性多発神経障害[AIDP])であるが、急性運動・感覚性軸索神経障害(AMAN)または急性運動性軸索神経障害(AMAN)として知られる原発性軸索損傷が生じることがある。ミラー・フィッシャー症候群(MFS)は、眼瞼下垂、歩行失調、およびアレフレックスの三項対立によって特徴づけられる別のGBS変異体である(Rocha Cabrero and Morrison, 2020)。GBSは、様々なウイルスが引き金となる自己免疫性神経疾患と考えられている。症例の約70%は神経症状の1~3週間前にウイルス性疾患を発症している可能性がある(Wakerley and Yuki, 2013)。GBSのアウトブレイクは、コロナウイルス(MERS-CoVやSARS-CoVなど)を含むウイルス性のパンデミックが見られている(Kim er al)。 SARS-CoV-2関連のGBSの最初の症例は、主要なCOVID-19ホットスポットである中国・武漢から報告された(Zhao er al)。 患者は61歳の女性で、武漢からの旅行から1週間後に、3日間で急速に進行した上肢脱力症を発症し、それに伴って、関節拘縮と後に遠位感覚の変化がみられた。4日目の脳脊髄液検査ではアルブミン細胞学的解離を、5日目の筋電図/神経伝導検査(EMG/NCS)では早期に脱髄性神経障害を認めた。入院時の検査結果はリンパ球減少症と血小板減少症が目立った。入院時には免疫グロブリン(IVIG)の静脈内投与が行われた。特筆すべきは,神経症状発症から8日後に発熱,咳嗽,肺炎を発症したことであった。その時点で口腔咽頭スワブでSARS-CoV-2 rRT-PCRが陽性であった。この患者は3週間後に全快し、COVID-19のリピート検査は陰性であった(Zhao, Shen, 2020a)。
パンデミック以降、COVID-19が確認された患者では全体で30例のGBS亜種が世界的に報告されており(表2)そのほとんどが急速に進行した弛緩性四肢の脱力と無表情、顔面筋の脱力の有無、遠位感覚やしびれなどの典型的な症状を呈している。頭蓋神経の非侵襲は5例(17%)に認められている(Bigaut et al 2020;Gutiérrez-Ortiz et al 2020;Reyes-Bueno et al 2020;Sancho-Saldaña et al 2020)。片側性または両顔面脱力のいずれかが12例(40%)に認められた。28例の患者において、COVID-19の症状は、咳(70%)発熱(57%)消化器症状(例:下痢、吐き気および嘔吐、33%)呼吸困難(17%)筋肉痛(17%)老年期症状(20%)無呼吸(20%)疲労/倦怠感(13%)を含む、GBS症状の発症の26日前から2日前までの間に変動していた。入院時に老年期障害が17%、無気力症が10%であった。3例(いずれもスペイン)はMFSを有していた(Gutiérrez-Ortiz, Méndez, 2020, Reyes-Bueno, García-Trujillo, 2020)。脳脊髄液検査を受けた26人の患者のうち、正常な白血球数(すなわちアルブミン細胞学的解離)を伴う蛋白質レベルの上昇(44~313mg/dL)が22人(85%)に認められた。血清抗GD1b IgG抗体陽性は、MFS患者1名で報告されている(Gutiérrez-Ortiz, Méndez, 2020)。しかし、10例、2例で確認された血清および脳脊髄液抗ガングリオシド抗体(抗GM1抗体、GQ1b抗体、GD1b抗体を含む)は、それぞれ陰性であった(表2)。また、これら30例のうち、白血球減少症(主にリンパ球減少症;40%)および急性期反応物(赤血球沈降速度(ESR)C反応性蛋白質(CRP)フェリチン、フィブリノーゲンなど)の上昇も報告されていた(40%)。EMG/NCSを受けなかった5例(MFS患者2例)を除き、20例(MFS患者1例を含む)(80%)に脱髄症状(AIDP)4例(16%)にAMAN、1例(4%)にAMANが認められた。このことは、SARS-CoV-2に関連して異なるGBSの亜種が発生する可能性があることを示唆している。4例(血漿交換療法を受けたMFS1例とAIDP1例を含む)を除き、他の患者はすべてIVIGの5日間コース(0.4mg/kg/日、1例は1回のみの投与)を受け、2例は追加サイクルを受けた。全体的には、18例(60%)で部分的から完全に回復し、良好な転帰を示した。2人の患者は、IVIG開始後24時間以内に重度の進行性呼吸不全により死亡した(Alberti, Beretta, 2020, Marta-Enguita er al)。
これらの報告例における重要な所見は、COVID-19 rRT-PCRが、チェックされた23例の脳脊髄液サンプルのすべてにおいて陰性であり、活発な髄腔内SARS-CoV-2複製または根感染がないことを示していることである。この所見は、IVIG療法後に比較的良好な転帰を示し、1例では抗GD1b抗体が陽性であったことと相まって、これらの症例ではSARS-CoV-2ウイルス感染後に引き金となる自己免疫過程が存在することを示唆していると考えられる。SARS-CoV-2 Sタンパク質が細胞表面のシアル酸含有糖タンパク質およびガングリオシドに結合し、そのウイルス透過性を増加させることができるという証拠がある(Fantini et al 2020)。したがって、SARS-CoV-2 Sタンパク質含有ガングリオシドと表面末梢神経糖脂質内のエピトープ間の交差反応性が起こり、SARS-CoV-2誘発自己免疫性GBSの基礎的なメカニズムとして機能する可能性がある。したがって、ほとんどの GBS 変異型(AIDP、AMAN、AMSAN、および MFS)が SARS-CoV-2 患者で報告されている(表2
)。今後の症例で抗ガングリオシド抗体をチェックすることで、この仮説に関するより詳細な情報が得られる可能性がある。また、報告されたGBS症例の中には、IVIGまたは血漿交換療法に加えてヒドロキシクロロキンを投与された症例があることも注目すべき点である。クロロキンはシアル酸やGM1ガングリオシドに結合してSARS-CoV-2 Sタンパク質との結合を阻害し、ウイルスの細胞内への侵入を抑制することが示されている。したがって、SARS-CoV-2に関連したGBSに対するクロロキンの併用療法は、今後の研究で検討すべき点であると考えられる。
4.2 骨格筋損傷
武漢からの初期臨床研究(Mao, Jin, 2020)では、筋痛+高CK血症と定義される骨格筋損傷がCOVID-19患者の約11%に認められたと報告されている。COVID-19患者では、11,000 U/Lを超える高CK値を伴う横紋筋融解症の症例報告があるが(表2)(Gefen et al 2020; Jin and Tong 2020; Suwanwongse and Shabarek 2020)SARS-CoV-2とウイルス性または壊死性自己免疫性筋炎のいずれかとの関連性はいまだに不明である。報告された2例は、SARS-CoV-2が引き金となった壊死性自己免疫性筋炎を間接的に示唆している可能性がある(Jin and Tong, 2020, Suwanwongse and Shabarek, 2020)。1例目はニューヨーク出身の88歳の男性で、急性の疼痛を伴う両側近位下肢脱力症と高CK血症(13,581 U/L)を呈した(Swanwongse and Shabarek, 2020)が、COVID陽性と診断され、ヒドロキシクロロキンの投与を開始し、1週間後に脱力感とCK値が改善した。2例目は武漢出身の60歳の男性で、6日後にCOVID陽性の肺炎と発熱を呈したが、7日後に臨床症状が改善したにもかかわらず、高CK血症(11,842 U/L)とCRP上昇を伴う疼痛性近位筋力低下を発症し、IVIG療法の恩恵を受けた(Jin and Tong, 2020)。さらに最近の研究では、急性弛緩性四肢麻痺を有するCOVID-19を有する6例の集中治療室(ICU)入院症例(年齢51~72歳)が報告されている(Madia et al 2020)。EMG/NCSはこれらの患者のすべてでミオパシーの特徴を示し、CK値は正常から軽度の上昇(最高値1274 U/L)であり、重症ミオパシーの存在を示唆していた(Madia, Merico, 2020)。全体として、これらの観察は、IVIGによる治療がこれらの患者における機能的転帰を改善する可能性があるので、骨格筋損傷の徴候を有するいくつかのCOVID-19患者における筋生検および抗体スクリーニングのようなより多くの調査を追求することを必要とするかもしれない。特筆すべきことに、ACE-2は骨格筋で発現していることが示されている(Cabello-Verugio et al 2015);したがって、骨格筋線維のSARS-CoV-2直接感染の評価は、今後の研究のための非常に興味深いテーマとなるであろう。
4.3 脳症
ヒトコロナウイルス感染症は、過去に脳症と関連しており、主に嗅球または血球経路を介して、炎症および脱髄を引き起こし、ヒト神経刺激性および神経侵襲性の電位を有することが知られている(Desforges, Le Coupanec, 2019)。基礎となる病態生理はまだ十分に理解されておらず、自己免疫を伴う異常な宿主免疫応答および/またはウイルスの複製および浸潤による直接的な中枢神経系損傷を含む(Desforges, Le Coupanec, 2019)。より詳細には、ACE-2および膜貫通型プロテアーゼ、セリン2(TMPRSS2)は、SARS-CoV-2侵入のための文書化された共同受容体であり、それらはオリゴデンドロサイトで発現し、COVID-19感染に関連する脳炎の場合には、白質の直接的な関与を示唆している(Needham et al 2020;Sellner et al 2020)。トルコからのレトロスペクティブ研究(Kandemirli et al 2020)では、ICUに入院している235人の患者が含まれており、そのうち50人(21%)が神経症状を発症した。著者らは、COVID-19に関連する神経トロピズムを示すために、27/50人の患者からMRIデータを収集した。その所見には、非特異的なパターンでの皮質拡散制限、下垂体強化、または皮質ブルーミングアーチファクトを伴う皮質FLAIR(体液減衰反転回復)異常(37%)が含まれていた。皮質下および深部白質FLAIR病変の報告は少なかった。残念ながら、これらの所見は患者の症状とは相関していなかった。皮質性FLAIR異常を有する患者の半数で脳脊髄液データも得られ、タンパク質の上昇、正常細胞数、グルコースレベル、IgG指数、オリゴクローナルバンド、アルブミンを示し、SARS-CoV-2に対する陰性のrRT-PCRを示した(Kandemirli et al 2020)。英国からの別の報告では、発熱と呼吸器症状を呈し、進行性の非定常歩行、複視、四肢運動失調、右腕の感覚変化、しゃっくり、食事時のドリブルを呈し、MRIで右下小脳前頭骨に病変を伴う菱形脳炎を認めた患者を報告している(表3)。髄液は正常なタンパク質、正常な白血球(WBC)数を示し、細菌培養は陰性であった(Wong et al 2020a)。残念ながら、SARS-CoV-2 PCR検査は実施されず、ワークアップの一環として送られたミエリンオリゴデンドロサイト糖タンパク質およびアクアポリン4抗体の結果もなかった。
COVID-19に関連した脳の炎症性変化の存在は、18人の脳症患者の脳標本における血管周囲リンパ球の病巣、局所性下肢炎の神経病理学的所見によっても確認されたが、これらの所見は稀であり、脳炎の基礎的診断を支持するものではなかったと報告されている。組織内で実施されたrRT-PCRによるSARS-CoV-2を検出するための免疫組織化学的解析は陰性であり、ウイルスが低レベルで検出されたのは5人の患者のみであり、これはおそらく脳内へのウイルスの直接浸潤または血液からのウイルスRNAの結果であると考えられる(Solomon et al 2020)。
増加する証拠は、脳症がCOVID-19のいくつかの提示症状または合併症の一つであることを示している。脳炎は、脳および周囲の組織の炎症過程を表し、その症状は、局所的な神経学的徴候(例えば、麻痺、脱力感など)と関連して、変化した精神状態、頭痛、行動変化、精神障害を含むことができる。一方、髄膜炎は髄膜および脊髄の炎症過程であり、発熱、頭痛、羞明、電話恐怖症および首のこわばりなどの典型的な症状を呈する。発作もまた、脳炎および髄膜炎の症状の一部である可能性がある(Asadi-Pooya, 2020; Sohal and Mossammat, 2020)。上記の症状の重症度は様々であり、特に症状が軽度の患者では適切な診断を下すことが困難な場合がある。脳症の診断および管理をさらに複雑にするために、症状だけに基づいて基礎となるプロセス(感染性または毒性代謝性)を区別することができないことがある。実際,重度のCOVID-19感染症患者の多くは,必ずしも中枢神経系の病変を呈することなく,低酸素,電解質異常,代謝障害,多臓器不全などの毒性代謝過程による精神状態の変化を呈することがある.さらに、鼻咽頭および口腔スワブからCOVID-19陽性であるが、脳脊髄液 PCRでSARS-CoV-2データを取得していない患者における急性壊死性脳症(ANE)の2例が文献で報告されている(Poyiadji, Shahin, 2020, Radmanesh et al 2020)。ANEは、ウイルスによる直接的な損傷を伴わない灰白質・白質の多焦点対称性病変を伴うサイトカインストームに続発する神経炎症を特徴とする。また,COVID-19感染による呼吸困難で入院した54歳女性で,治療中に軽度の血圧上昇のみの既往歴があり,白質および淡蒼球部に脱髄性病変を認めたとの報告がある.彼女のGlasgow Coma Scaleスコアは14で、感覚が変化していたが、入院時の神経学的検査では焦点が合わず、その後急速に悪化して気管挿管が必要となり、アジスロマイシンとアモキシシリン/クラヴラン酸に加えてヒドロキシクロロキンを投与された。鎮静は2日後に中止されたが,その後も長時間の鈍痛が続いたため,神経画像検査と更なる検査が行われた。脳MRIでは、視床、線条体、後遺症を伴わず、脳室周囲白質と淡蒼球に出血や増強を伴わない両側非対称性の制限拡散病変が認められた。2日後のMRIでは病変の均一なコントラスト増強が認められたが、脳血管像は陰性であった。入院時と9日後に2回実施された脳脊髄液検査はSARS-CoV-2のrRT-PCR検査を含めて異常なしと報告された。鼻咽頭PCRが陰性であったため,入院後12日後に脱髄が疑われ,ステロイド治療を受けた。患者は右側片麻痺の残存を報告し、ステロイドに対する彼女の反応についてのデータはなく、脱髄の診断を支持する可能性がある(Brun et al 2020)。にもかかわらず、画像からはコロナウイルスと関連して記述されている脱髄が疑われたが、これはマウス動物モデル(Wu et al 2000)および急性播種性脳脊髄炎(ADEM)を有する小児患者(Yeh et al 2004)の両方で報告されている。しかし、上記の症例では、他の診断を完全に除外することはできなかった。
実験室で確定診断を受けた214人の患者からデータを収集した武漢のレトロスペクティブな観察的症例シリーズ(Mao, Jin, 2020)では、36.4%が神経学的症状を呈していた。より詳細には、24.8%の患者に中枢神経系症状が認められ、特に7.5%の患者に脳症が認められた。その結果,重症感染者では非重症感染者に比べて中枢神経系症状が有意に多く,脳症が14.8%,2.4%であった(P < 0.001).重症感染症患者は高齢で血圧が高く,入院時に発熱や咳などの典型的な症状をあまり認めなかった。さらに,これらの患者では,入院後数日で神経症状を発症しやすく,死亡率も高かった。また、重症化していない患者に比べて、WBC数、好中球数、血中尿素窒素、Dダイマー、CRPが高く、リンパ球数、血小板数が減少しており、炎症反応が顕著であったことから、多臓器の関与と免疫抑制が神経症状の発症機序の根底にあることが示唆された。本研究では、脳症の病因については、毒性代謝性または感染性のいずれの場合も、さらに調査を行っていない。他の症例報告では、COVID-19感染症を背景とした髄膜脳炎の症状として、新たな発作の発症を伴って初めて病院に来院した脳症患者について記載されている(Asadi-Pooya, 2020, Moriguchi, Harii, 2020, Sohal and Mossammat, 2020)。
現在のところ、中枢神経系に病変を有するCOVID-19の症例の診断に役立つ脳脊髄液または血清学的バイオマーカーは世界的に存在しない(Baig, 2020, Kandemirli, Dogan, 2020);したがって、脳症性COVID-19患者の適切な神経学的評価は、早期診断、より適切な治療の調整、およびおそらく転帰の改善に役立つであろう。脳症患者のワークアップは、神経学的症状の詳細な文書化だけでなく、電気生理学的検査(すなわち、脳波または脳波)脳脊髄液分析、およびおそらく脳画像検査を含むべきである(Asadi-PooyaおよびSimani, 2020; Liu et al 2020b; Oxley et al 2020)。さらに、COVID-19患者の精神状態が変化した場合には、ウイルスによる脳損傷の直接的な結果として、または二次的な毒性代謝異常として、臨床的または不顕性の発作または状態てんかんを伴う症例が報告されているので、発作を疑うべきである(Asadi-Pooya 2020)。抗てんかん薬(AED)は、初期症状として発作を呈している患者には、それ以降のエピソードを予防するために、6週間の期間、投与し、その後、1~2週間でAEDを漸減・中止する必要がある(Asadi-Pooya, 2020)。これらのCOVID-19患者は通常重症患者であるため、レベチラセタムやブリバラセタムなど、呼吸器や心臓の状態への副作用が少ない静注製剤やAEDが推奨されている。また、患者によっては高蛋白結合型AEDの薬物動態に影響を及ぼす体外膜酸素化を必要とする場合があるため、フェニトインやバルプロ酸は避けるべきである(Asadi-Pooya, 2020)。
4.3.1 ウイルス性対自己免疫性髄膜脳炎
COVID-19髄膜脳炎の診断は、脳脊髄液の特徴や脳脊髄液中のウイルスの検出などの臨床検査や臨床検査に基づいて行われる。COVID-19とそれに伴う臨床検査でウイルス性脳炎が確認された最初の症例は、北京で、精神状態の変化、痙攣、持続的なしゃっくり、反射亢進、髄膜刺激、遅発性の瞳孔反応を有する患者で報告されている(表3)。特筆すべきは、脳脊髄液検査では正常範囲のWBC、グルコース、タンパク質は正常であったが、開腹圧力の上昇とSARS-CoV-2の陽性PCRを示したことである(Oxley, Mocco, 2020, Sun and Guan, 2020)。この症例報告は中国語で発表されたもので、診断を裏付けるための更なる臨床データや検査データが不足しているようである。最近の論文では、鼻咽頭スワブと脳脊髄液の両方でSARS-CoV-2陽性を示し、呼吸器症状を伴わない脳炎の女性について論じている(Huang et al 2020a)。日本のCOVID-19からの髄膜脳炎の別の症例(Moriguchi, Harii, 2020)は、頭痛、倦怠感、発熱を呈し、数日後に病院に搬送中に全身性強直発作のエピソードを伴う意識不明の若年患者が発見されたことを報告した。この患者は明快な髄膜徴候、血液中の多血球症、頭部のCTスキャンが陰性で、SARS-CoV-2は脳脊髄液からのみ検出されたが、鼻咽頭スワブからは検出されなかった。興味深いことに脳脊髄液では開腹圧上昇と12個のWBCが主に単核であった;MRIでは右脳室下角壁に沿ったDWI(拡散強調画像)陽性、右中側頭葉と海馬ではFLAIR異常が認められた。これらは、我々の知る限りでは、脳脊髄液ウイルス検出に関連した脳炎の3例のみである。この診断法では、流出した空気中のウイルスからサンプルが汚染されるリスクがあることから、PCRの偽陽性が報告されていることは注目に値する(Needham, Chou, 2020)。
逆に、肺のCT上で発熱、咳、および典型的な複数の地被膜の不透明性を呈し、後に髄膜脳炎を示唆する病巣性神経症状および精神状態の変化を呈した患者の症例報告もある(Yin et al 2020)。特筆すべきことに、咽頭スワブはCOVID-19に陽性であったが、脳脊髄液 PCRは陰性であった(Yin et al 2020)。ウイルス感染を示唆する他の脳脊髄液の結果は、開口圧の上昇とタンパク質であった(Yin et al 2020)。患者は経過観察、抗ウイルス剤治療、支持療法を受けた。時間の経過とともに肺の感染症は改善し、酸素補給を必要としないようになり、同時に神経学的検査も一貫して改善した。この時、さらに2回の咽頭スワブ検査が行われたが、結果は陰性であった。ウイルス性髄膜脳炎が疑われる患者で、鼻咽頭スワブは陽性であったが、脳脊髄液 PCRでSARS-CoV-2が陰性であった症例は他にも報告されている。大多数の報告では、脳脊髄液ではリンパ球を中心とした細胞の増加とタンパク質レベルの上昇が認められた(Bernard-Valnet et al 2020;Dogan et al 2020)。より詳細には、ICU患者53人の症例シリーズでは、重症ARDSのために挿管された29人の被験者が、その後の神経学的検査で挿管後の精神状態や興奮性せん妄の改善が認められなかったことが報告されている(Dogan et al 2020)。挿管された29人の患者のうち6人(20.6%)で神経学的病変が診断された。これらの患者では、フェリチン、CRP、IL-6,フィブリノーゲンなどの急性期反応物質のレベルが上昇していた。MRI所見では、3/6人の患者で白質および皮質の異常と髄膜脳炎に適合する造影増強が認められた。髄液データでは、全例でプレオサイトーシスを伴わない蛋白質の上昇が認められ、SARS-CoV-2を含むウイルスのPCRは陰性であった。MRI陽性・陰性患者ともに自己免疫が疑われたため,プラスマフェレーシスによる治療を行った。臨床状態の改善は5/6例で観察され、MRI所見はMRI陽性の3例すべてで可逆的であった。イタリアからの別の症例(Pilotto et al 2020)は、軽度の呼吸器症状を有する60歳の男性で、アキネティックミューティズムと鼻腔硬直を発症したと報告している。MRIと脳波は陰性で異常は認められなかった。脳脊髄液では、タンパク質レベルの上昇とリンパ球増多、IL-6,IL-8,TNF-αの上昇が認められたが、SARS-CoV-2や他の神経向性ウイルスには陰性であった。COVID-19感染は鼻咽頭スワブにより確立された。この患者には、抗生物質と抗ウイルス剤のカバレッジ、およびヒドロキシクロロキンの投与が初期に開始された。ステロイドの大量投与を開始した後に改善がみられた。退院後はステロイド静注とプレドニゾンの経口投与を5日後に行ったが,神経学的には正常であった。
COVID-19を設定した自己免疫性脳炎の正確な病因機序は不明であるが、BBBへの直接的な損傷と脳への白血球遊走の増加を伴うサイトカインストームに関連している可能性がある(Sohal and Mossammat, 2020)分子模倣によって媒介されるウイルス免疫の調節障害に関連している可能性がある(Pilotto er al)。 自己免疫性脳炎の診断には、免疫調節療法を用いた試験が極めて重要であり得る。ウイルス性または自己免疫性髄膜脳炎が疑われる患者のさらなる症例報告と、その病態とワークアップの詳細な記述も必要である。上記で報告された症例では、脳内でのSARS-CoV-2の播種は一過性である可能性があり、その脳脊髄液力価は極めて低い可能性があるため、脳脊髄液 PCRは診断の信頼性に欠ける可能性があることが示された(Ye et al 2020a)。さらに、この検査は広く利用できるものではない。適切な神経学的検査、脳波、脳脊髄液検査、脳画像検査がCOVID-19関連髄膜脳炎の診断を導く唯一の手段であり、適切な治療を速やかに開始すべきである。
4.3.2 毒性代謝性脳症
COVID-19患者799人を対象としたレトロスペクティブ研究(Chen, Wu, 2020b)では、入院時の精神状態が変化したのは、失神した患者の22%、回復した患者の1%であったと報告されている。このことは、初期症状としての脳症に関連した負の予後因子の可能性を示唆している。神経学的症状や徴候を伴わない頭痛は、死亡した患者の10%で報告されたのに対し、回復した患者では12%であった。代謝異常は回復した患者よりも死亡した患者の方が多く、死亡した患者の20%は肺炎に関連した低酸素性脳症と分類される症状を呈していた。本研究では、頭痛以外の神経学的症状、神経学的徴候、痙攣は報告されておらず、本疾患の可能性があるとは考えられなかった。さらに、ウイルス性脳炎・髄膜炎、基礎となる発作、非痙攣性状態てんかんを除外するための臨床検査は行われなかった。中毒性脳症を呈したと報告されている症例の中には、実際にウイルス性脳炎に罹患していた可能性がある。
パンデミックの開始時に発表された最初の症例報告の一つ(Filatov et al 2020)は、慢性閉塞性疾患(COPD)心房細動、左後大脳動脈の心筋梗塞の既往を有する74歳の男性の症例を報告している。発熱と咳嗽を訴えて救急部に来院し,肺炎の初期検査では陰性であったが,COパーキンソン病の増悪の可能性があるとの診断を受けて退院した。24時間後に重度の精神状態の変化と頭痛を訴えて救急部に再来院した。その際に神経内科を受診し,頭部CTスキャン,脳波,脳脊髄液検査を含む精密検査を行った。頭部CT検査では,脳梗塞の既往,関連する脳軟化症,脳脊髄液検査ではSARS-CoV-2のPCRは行われなかったが,感染症を示唆するものではなかった。脳波では左側頭部にびまん性の徐波と焦点性の鋭い輪郭波が認められ、不顕性発作の疑いが浮上した。最終的にCOVID-19陽性であった。彼はAED、ヒドロキシクロロキン、ロピナビル、リトナビルで治療を受けた。残念ながら、治療に対する反応についての追跡調査報告はない。この症例報告は、COVID-19に関連した毒性代謝性脳症および重度の基礎代謝過程の二次的な発作閾値の低下によるてんかん活動の例である(Delanty et al 1998)。
フランスからの別の研究(Helms et al 2020)では、ARDSおよびCOVID-19を有する患者の84%が、激越(69%)皮質脊髄路徴候(67%)および不注意、見当識障害、または命令に反応した動きの整理不良(36%)などの神経学的徴候を呈していたことが示された。本研究で報告された54人の患者のうち13人に脳のMRIが実施された。これらの患者には脳卒中を示唆する病巣徴候は認められなかったが、23%に虚血性脳卒中が認められ、62%には下垂体強化が認められ、灌流画像診断を受けた患者(11人、100%)にはすべて両側性前頭側頭側頭低灌流が認められた。少数の患者(54人中8人)では脳波が非特異的な変化または両側性前頭側頭部の鈍化を示し、さらに少数の患者(7人)では脳脊髄液検査で細胞やその他の感染の徴候が認められず、すべての検体でSARS-CoV-2のRT-PCRアッセイが陰性であった。どの患者が脳脊髄液分析を受けたかは不明である。残念ながら、この報告書には患者とそのワークアップの詳細な説明が欠けており、その中のいくつかの患者、特にMRI上で局所的な神経学的症状とレプトメニンジアの増強を認めた患者は、中枢神経系のウイルス性の病変を経験していた可能性がある。
4.4 急性骨髄炎
急性骨髄炎はウイルス感染症の合併症として知られており、主に自己免疫反応が原因となっているが、多発性硬化症や視神経脊髄炎スペクトラム障害などの他の神経免疫学的疾患の初期症状である可能性もある。SARS-CoV-2と急性骨髄炎との関連についてはほとんど知られていない。これまでに、単独(4例)または脳病変との複合(3例)の急性骨髄炎の7例が、COVID-19に関連して報告されている(AlKetbi et al 2020,Munz et al 2020,Novi et al 2020,SarmaおよびBilello 2020,Valiudin et al 2020,Wong、Craik 2020a、Zannin、Saraceno 2020)。6人の患者(28~64歳の年齢層、57.1%女性)は、骨髄炎の神経症状発症の25~2日前にCOVID-19の症状(発熱、呼吸困難、倦怠感、悪寒、鼻出血)が変動的に認められた(表3)。5人の患者の脳脊髄液でSARS-CoV-2 rRT-PCRを検査したところ、すべて陰性であった。全体的には、ステロイドまたはプラスマフェレーシスによる治療後、6例(85.7%)で機能的転帰が良好であった。さらに、スペインからの最近の症例報告(Sotoca and Rodríguez-Álvarez, 2020)では、7日間の根尖性頸部痛、右顔面しびれ、左手のしびれと脱力感、歩行不安定性、全身反射亢進を発症した68歳女性が紹介されている。彼女はこれらの症状の8日前に発熱と咳をしていた。頚椎にはT-2の過緊張が延髄からC7まで伸びており、急性横隔膜炎を示唆していた。血液検査では抗アクアポリン-4(AQ4),-ミエリンオリゴデンドロサイト糖タンパク質(MOG),抗リン脂質抗体は陰性であったが,脳脊髄液検査では蛋白質レベルの上昇とプリーコートーシスが認められ,オリゴクローナルバンドは認められず,IgG指数は正常,抗神経表面抗体は認められず,SARS-CoV-2 PCRは陰性であった。しかし,SARS-CoV-2 rRT-PCR の鼻咽頭スワブは陽性であった。メチルプレドニゾロン(1g/日)を5日間投与された。数日後に症状が悪化し,膀胱・腸失禁,両手の脱力感・麻痺,麻痺を呈した。再発した脊髄MRIでは、T1レベルの中心壊死と末梢の増強が認められた。この症例はCOVID-19に関連した急性壊死性骨髄炎の最初の症例であった。この症例では、プラスマフェレーシスと5日間のメチルプレドニゾロン(1g/日)の投与に加え、プレドニゾンの緩徐減圧経口投与が4週間後に行われ、良好な結果が得られた。急性壊死性骨髄炎の正確な発症機序はまだ解明されていないが、ウイルス後の自己免疫性サイトカインストームが示唆されている(Kansagra and Gallentine, 2011)。このことは、SARS-CoV-2の場合、特にステロイドやプラスマフェレーシス治療後の臨床的改善が観察されていることを示唆している可能性がある。
5. 精神症状
SARS-CoV-2感染の潜在的な合併症として、精神症状に関するエビデンスが増えている。したがって、パンデミックの間に世界的に精神衛生障害が悪化したことが報告されており、せん妄、認知障害、気分変調、精神病および自殺を含むがこれらに限定されない(Orsini et al 2020)。より詳細には、せん妄は、ICUレベルのケアを必要とするCOVID-19患者の90%において発生しており、過去に報告された70~75%の割合よりも多く見られている(Kotfis et al 2020)。認知機能障害は、おそらく中枢神経系へのCOVID-19感染の直接的な結果であると報告されており、特に、コロナウイルス感染に対して脆弱であると思われる海馬に対して、アルツハイマー病で起こるような海馬変性の加速を伴う可能性があると報告されている(Ritchie et al 2020)。認知機能障害はまた、脳萎縮および心室肥大と関連している急性呼吸器症候群および相対的低酸素症(Hopkins et al 2006年)および注意力、実行機能および言語記憶の悪化(Hopkins et al 2005)の結果であり得る。不安、うつ病、心的外傷後ストレス障害、不眠症、および強迫性症状は、COVID-19の生存者、特に女性に非常に多く見られ、以前に精神医学的併存疾患を有する者では精神病理学的尺度のスコアが悪化している(Mazza et al 2020)。最近の研究(Brown et al 2020)では、以前に報告された10万人当たり15.2(7.7-43.0)の中央値に対して、感染患者における精神病の発生率は0.9%~4%であったと報告されている(McGrath et al 2004)。自殺率の増加も報告されており、社会的孤立・離散、経済不況、社会的差別などの要因が考えられる(Thakur and Jain, 2020)。
上記の精神症状が、中枢神経系のウイルス感染(すなわちウイルス性髄膜脳炎)脳血管事故、低酸素、大うつ病性障害に重要な役割を果たす可能性のある免疫学的・炎症反応の直接的な結果であるかどうかは不明である(Ghasemi et al 2019; Wohleb er al 2019; Wohleb et al 2016)および精神病(Ferrando et al 2020)と関連しているのか、あるいは、この重篤で潜在的に致命的な疾患の心理社会的ストレスの増加およびパンデミック感染に関連したヘルスケアへのアクセスの困難さと関連しているのか(Zhou and Yao 2020)。このことは、感染患者、特にICU内の患者の治療における課題を増大させており、全体的な罹患率および死亡率を減少させるために、正確な集学的アプローチおよび早期の介入を必要としている(Ojeahere et al 2020)。
6. 治療戦略
上記の節で述べたように、いくつかの治療法がSARS-CoV-2-関連の神経系損傷の症状または結果の治療に使用されてきた。例えば、GBSおよび骨格筋損傷に対するIVIG、自己免疫性脳炎および急性骨髄炎に対する静注/経口ステロイドおよびプラスマフェレーシス、および発作に対するAEDなどである。ウイルス感染に対する免疫反応を調節し、ウイルスクリアランスを誘導することを目的とする薬剤に関しては、抗マラリア薬(例えば、ヒドロキシクロロキン)デキサメタゾン、RNA依存性RNAポリメラーゼ阻害剤(例えば、レムデシビル)HIV-1プロテアーゼ阻害剤(ロピナビル/リトナビル)およびトシリズマブ、インターフェロンおよび回復期血漿のような生物学的薬剤が、いくつかの有益な効果を示している(Chibber et al 2020)。この中で、FDAは、SARS-CoV-2感染が証明または疑われる重症の入院中の成人および小児患者に対する緊急治療薬として、レムデシビルの緊急使用承認を取得した(Lamb, 2020)。いくつかのRNAウイルスに対して幅広い抗ウイルス活性を有する本剤は、SARS-CoV-2の複製を阻害し、症状を緩和し、回復速度を速め、死亡率を低下させることができる(Frediansyah et al 2020)。より詳細には、下気道感染の証拠を有する罹患成人を対象としたレムデシビルの静脈内投与による二重盲検無作為化プラセボ対照試験であるAdaptive COVID-19 Treatment Trial(ACTT-1)の最終報告では、プラセボ群では回復期間中央値が10日(95%信頼区間[CI]、9~11)であったのに対し、15日(95%CI、13~18)であったことが示されている。15日目までの死亡推定率は、レムデシビル群で6.7%対プラセボ群で11.9%、29日目までの死亡推定率は、レムデシビル群で11.4%対プラセボ群で15.2%であった(Paladugu and Donato, 2020)。頭対頭比較が行われていないことを考えると、広く入手可能で安価なデキサメタゾンよりもレムデシビルの方が優れたベネフィットを提供しているかどうかは不明である(McCreary and Angus, 2020)。COVID-19療法の無作為化評価(RECOVERY)試験では、無作為化時に侵襲的機械換気または酸素単独投与を受けたCOVID-19患者ではデキサメタゾンの方が28日死亡率が低い結果となったが、呼吸サポートを受けていない患者ではそうではなかったことが示されている(Horby et al 2020)。ACTT-1試験の著者らはまた、グルココルチコイド使用のためにデータを調整したが、デキサメタゾンの有益性はレムデシビルの有益性に相加的である可能性を示唆している(Beigel et al 2020)。しかしながら、レムデシビルまたはデキサメタゾンがCOVID-19の神経学的症状に対して有益な効果を有するかどうかはまだ不明である。
COVID-19によって媒介される神経細胞の損傷を改善することを目的とした可能性のある治療戦略に関しては、高用量のメラトニンは、免疫調節および神経炎症の軽減において有望であるように思われる。しかし、ウイルスの複製または転写には直接的な効果はない。メラトニンは、抗炎症性、抗酸化性、免疫増強機構を介して作用し、BBB止血を回復させる能力を有するようである(Romero et al 2020)。
COVID-19を予防するワクチンの開発のための世界的な臨床試験が進行中であるが、これは現在利用可能ではなく、特に高齢者集団における再感染のさらなるリスクを伴わない安全性、有効性、および長期的な効果のためにいくつかの課題を提起している(Jamwal et al 2020)。肺や神経だけでなく、様々な症状を示すCOVID-19パンデミックは国際的な公衆衛生上の緊急事態であり、効果的な薬剤やワクチンを早期に開発するために各国の努力が必要である。
7. おわりに
進化したデータは、COVID-19の患者が、COVID-19の一般的な症状の発現前、発現中、さらには発現後に、神経学的症状を変化に富んで発現する可能性があることを示している。一般的に報告されている神経学的症状および徴候には、めまい、頭痛、筋肉痛、疲労、意識障害および錯乱、老年期障害、無感覚、神経障害性または放射性疼痛、後頭神経痛、視覚障害、痙攣および運動失調が含まれる。増え続ける症例報告およびシリーズに基づいて、中枢神経系、末梢神経系および骨格筋の両方が、GBS、筋症および横紋筋融解症、脳症、髄膜脳炎、脳脊髄炎および急性骨髄炎を含む様々な神経免疫学的状態を呈するCOVID-19に関与し得ることが示されている。
これらの合併症の正確な病因はまだ完全には解明されていない。しかし、示唆されているメカニズムは、神経系へのSARS-CoV-2の直接感染、神経炎症、ウイルス後の自己免疫反応、高凝固性、および代謝性または低酸素性傷害である。一般に、COVID-19の治療戦略は、以下の3つの主要な方向性に基づいている。
(i)抗ウイルス剤、中和抗体または回復期血漿療法を用いたSARS-CoV-2の標的化、
(ii)免疫調節薬およびサイトカイン阻害剤を用いた炎症性ストームの標的化、および
(iii)疾患発現を予防するためのワクチンの開発である(包括的なレビューについては、(Vabret et al 2020)を参照のこと)。
しかしながら、活性感染症の治療が成功したとしても、COVID-19のウイルス誘発後の自己免疫性神経学的合併症(例えば、GBS、筋炎、中枢神経系脱髄、骨髄炎)の頻度および/または重症度が低下するかどうかを見極めるには、まだ時期尚早である。この問題に対処するためには、明らかに追加の研究が必要である。