Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7385538/
要旨
公衆衛生の観点から、21世紀はコロナウイルスのパンデミックによって特徴づけられている:2002-03年にはウイルスSARS-CoVがSARSを引き起こし、2012年にはMERS-CoVが出現し、2019年にはSARS-CoV-2と呼ばれる新しいヒトベータコロナウイルス属株が前代未聞のCOVID-19アウトブレイクを引き起こした。現在のパンデミックの過程で、命を救うための医学的課題と、新しい病原体の遺伝的進化とバイタルサイクルの生化学を明らかにすることを目的とした科学的研究は、SARS-CoV-2に対する新たな予防・治療戦略につながる可能性がある。
今のところ、COVID-19の治療法はなく、有効なワクチンを待っているため、「古い 」抗炎症剤と抗ウイルス剤に基づく 「野蛮な 」プロトコルの開発は、代替的な治療アプローチとして有効性を表している。
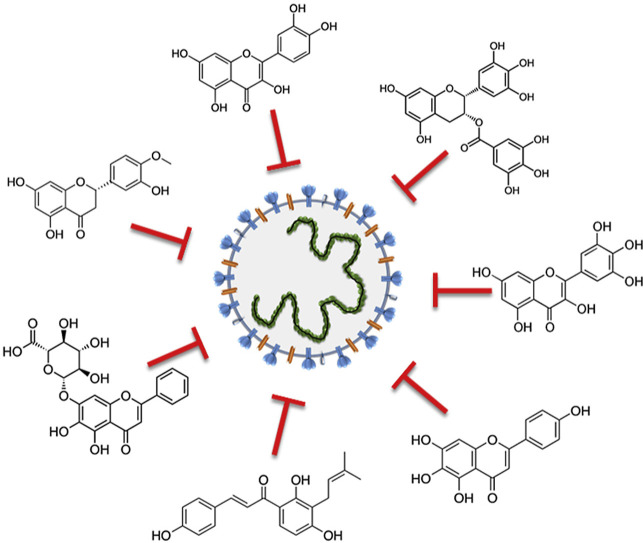
代替的または追加的な治療/予防の選択肢として、ポリフェノールファミリーに属する小さな天然分子が、コロナウイルスの侵入および複製サイクルの様々な段階を妨害することができることが、in silicoおよび試験管内試験(in vitro)での様々な研究で実証されている。
ここでは、有名なポリフェノール(例:ケルセチン、バイカリン、ルテオリン、ヘスペレチン、ガロカテキンガレート、エピガロカテキンガレート)と一般的ではないポリフェノール(例:スクテラレイン、アメント)の能力を検討した。
フラボノイドは、植物組織に広く存在する二次代謝物で、抗酸化作用と抗微生物作用を持ち、コロナウイルス感染サイクルに関与する主要なタンパク質、例えばPLpro、3CLpro、NTPase/helicaseを阻害する。これらのフラボノイドおよびその誘導体は、プリーオトロピックな活性を有し、全身毒性がないことから、コロナウイルス感染症の治療薬を充実させるために、将来の臨床試験のターゲットとなる化合物であると考えられる。
グラフィカルな抽象
1. はじめに
21世紀の2nd 10年は、人類史上前例のないパンデミックで始まった:2020年初頭に中国で初めて単離され、配列決定された新しいヒトベータコロナウイルス属株の出現[1]と、コロナウイルス病19(COVID-19)の病因菌としてSARS-CoV-2(Severe Acute Respiratory Syndrome CoronaVirus-2)と呼ばれている[2]。世界的には、執筆時点(2020年7月11日)で、南極大陸を除く全世界で556,335人の死亡例を含む12,322,395人のCOVID-19の確定症例が登録されており、WHOが報告している(https://covid19.who.int/COVID-19)。
一部の微生物学者によって待ち望まれていたが、このパンデミックは、多くの欧米諸国(イタリア、スペイン、フランス、英国、米国)の医療システムが大部分の準備ができていなかったことを示している。しかし、同時に、過去5ヶ月間にPubMed上で6000以上の査読付き科学論文の生産で科学界を動員した。
ワクチンを待っている間に、COVID-19に対する特異的な治療法は現在のところ存在しない。SARS-CoV-2のバイタルサイクルと感染性を維持している遺伝学と生化学についての深い知識があれば、新しい治療法の開発につながることは間違いない。
最近の研究では、2003年に分離された近縁種のSARS-CoVと比較して、SARS-CoV-2が「戦略的適応」の配列を獲得したことから、SARS-CoV-2が効率的なキラーであることが証明されている[3]。自然界での進化の間に、メタ遺伝学的解析としておそらく数十年は、コロナウイルスの新しい株がコウモリから未知の哺乳類に、そして人間に 「ジャンプ 」したことを明らかにしている。
ここでは、SARS-CoV-2は、鼻やのどの細胞から肺に至るまで、複数のレベルでさまざまな組織を標的とすることができ、おそらく、血管内皮、腎臓、神経系を通って侵入し、重篤な病気や死を引き起こす可能性がある[4,5]。
しかし、SARS-CoV-2についてはまだ多くのことを学ぶ必要があり、その生物学的な知識を深め、メタゲノミクス解析や以前のコロナウイルス(SARS-CoVおよびMERS-CoV)の生化学的特徴を比較することは、効率的な治療戦略および/または予防戦略を決定するために非常に重要であると考えられる。
「古い」薬剤(ファビピラビルやリバビリンのような本質的に抗ウイルス剤。最近のCOVID-19発生の重症例に対して臨床医が現在使用している古い薬剤(抗HIVプロテアーゼ阻害剤(リトナビルやロピナビルなど)、抗炎症剤(トシクリズマブやデキサメタゾンなど)のほかに、植物界から分離された天然化合物で、フラボノイドの複数の不均一なクラスに属する化合物(図1)も、興味深い選択肢となり得るだろう。1 )は興味深い選択肢の一つであると考えられる。
実際、フラボノイドは全身毒性がなく、従来の薬剤との相乗効果が大きく実証されており、最終的には、機能性基が異なる細胞標的と相互作用し、複数の経路を遮断することができる「多元的」化合物であることが示されている[9,10]。これらの特徴から、フラボノイドはコロナウイルスのライフサイクルを阻害する可能性を秘めている。
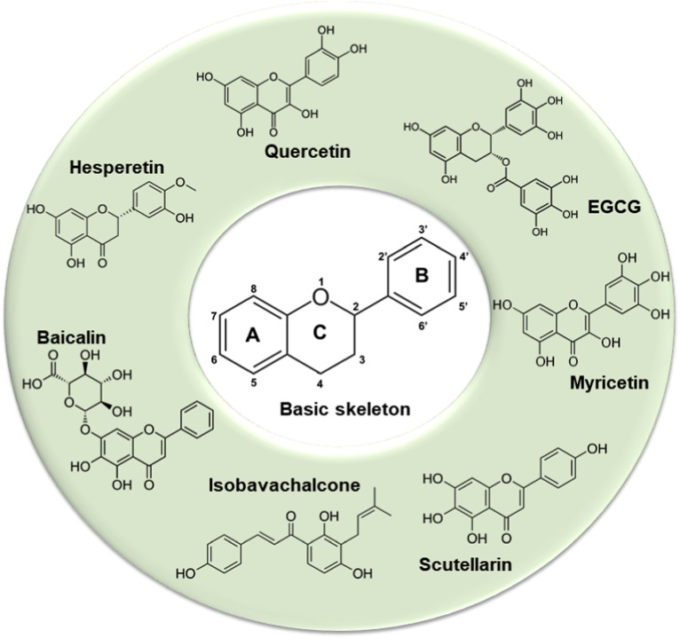
図1
図1
フラボノイドの基本骨格(C6-C3-C6)とコロナウイルスに対抗できる主要な化合物の一部。
フラボノイドには多くの二次代謝物が含まれており、野菜、種子、果実、赤ワインやお茶などの飲料に含まれている[11]。構造的に同定されているフラボノイド分子は6000以上ある。これらの化合物はストレス条件に反応して植物内で合成され、病原体や昆虫から植物細胞を守るために重要な役割を果たしている[[12], [13], [14]]。
化学的には、フラボノイドはフェニルプロパノイド経路で合成された水酸化フェノール分子であり、その構造分類、水酸化の程度、重合度によって区別される。フラボノイドの水酸基は、その抗酸化作用に関与しており、2つのベンゼン環(A環とB環)が複素環ピレン環(C環)を介して連結されて形成されている(図1)。
フラボノイドは、アントシアニン、カルコン、ジヒドロカルコン、ジヒドロフラボノール、フラバノール、フラバノン、フラボン、フラボノール、イソフラボノイドなどの異なるクラスに分類される(Phenol-Explorerデータベース phenol-explorer.eu を参照)。
フラボノイドの薬理学的性質としては、抗菌作用、抗酸化作用、抗炎症作用、抗ウイルス作用などがある。フラボノイドは、広範囲のDNAおよびRNAウイルスに対して研究されている[15]。例えば、アピゲニンはピコルナウイルス(RNAウイルス)に対して活性があり、IRESウイルス活性を抑制してタンパク質合成を阻害する[16]。
緑茶(Camellia sinensis (L.), Kuntze)の葉に含まれるカテキンの約59%を占める活性ポリフェノールカテキンであるエピガロカテキン-3-ガレート(EGCG)は、B型肝炎ウイルス、単純ヘルペスウイルス、アデノウイルスなどのDNAウイルスの複製周期を阻害する[17]。
このレビュー論文を作成するために、特にError! ハイパーリンク参照が有効ではない。「」コロナウイルス」と「フラボノイド」を含む論文を検索した。我々は、ヒトコロナウイルスに対する定義されたフラボノイドの抗ウイルス活性に確信を持って焦点を当てた論文を選択し、我々の見解では科学的な質が十分ではないと思われる、ピアレビューで認定されていないSARS-CoV-2に関するごく最近のプレプリント論文を除外した。スペースの制限により引用が省略されている可能性があることを事前にお詫びする。
2. コロナウイルスの生物学
2.1. 形態と生化学
コロナウイルスは、ニドウイルス目(Nidovirales)の一本鎖(+)RNAエンベロープウイルスの一族である。彼らはもともと、科学者が人間の一般的な風邪の原因となる2つのウイルスを分離した英国と米国で60年代に同定された[18]。コロナウイルスは球形または多形で、直径は80~120 nmである。1968年の電子顕微鏡画像では、ウイルスの王冠のような構造が「太陽コロナ」に似ていることが明らかになり、これがラテン語の「コロナウイルス」に由来するこのファミリーの名前の由来となっている[19]。
それ以来、昨年までに、2つの高病原性ヒト株が出現した。2003年に発生したSARS-CoVと2012年に発生したMERS-CoV(中東呼吸器症候群コロナウイルス)であり、WHOによると深刻なパンデミックを引き起こした[20,21]。これらのコロナウイルスは、それぞれ市場のコベッツとドロメダリーからヒトに感染し、どちらも数百の未知のコロナウイルスの自然保護区であるコウモリに由来している[22]。
コロナウイルスのRNAゲノムは他のRNAウイルスよりも大きく、6~11個のオープンリーディングフレーム(ORF)を含む26,000~32,000塩基のサイズがある。最初のORF(ゲノムの67%)は非構造タンパク質(NSP)をコードし、残りのORFは付属タンパク質と構造タンパク質を産生する [22]。特に、第1のORF(ORF1a/b)は、ORF1aとORF1bの間のフレームシフトの存在に対して、2つのポリタンパク質:pp1aおよびpp1abを翻訳する。
これらのポリプロテインは、3C-like-protease(3CLpro)としても知られるメインプロテアーゼ(Mpro)と1つまたは2つのパパイン様プロテアーゼ(PLpro)によって16のNSPに処理され、4つのメイン構造タンパク質をコードするウイルスRNAを産生する[23](図2)。
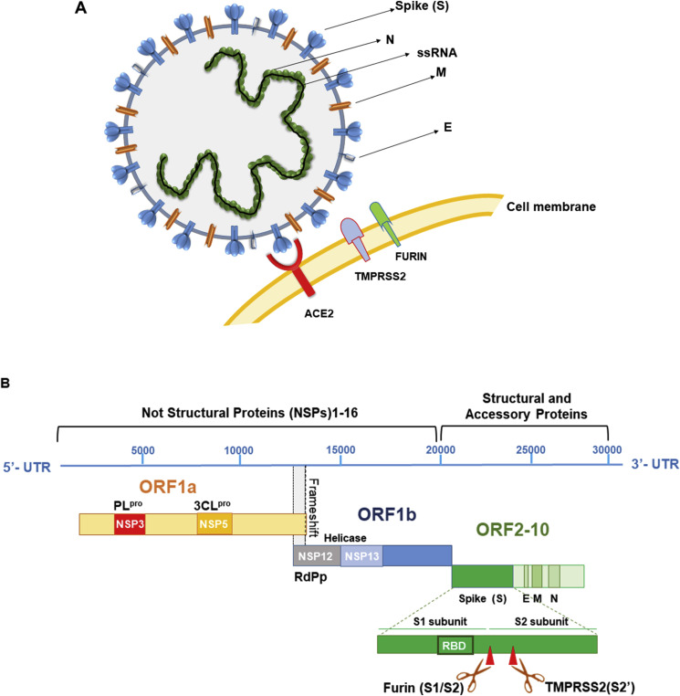
図2
図2
A. コロナウイルスは、直径100~160nmの球状粒子を形成している。コロナウイルスは、ポジティブセンス一本鎖RNA(ssRNA)ゲノムと、RNAゲノムに結合してヌクレオカプサイドを形成するヌクレオカプサイドタンパク質(N)を含んでいる。三量体スパイク糖タンパク質(S)は、ウイルスエンベロープの表面に局在し、ウイルスの宿主細胞への侵入に不可欠である。
このタンパク質は、2つの宿主セリンプロテアーゼによって切断・活性化された後、細胞膜上で宿主受容体タンパク質ACE2を認識する。TMPRSS2およびFURIN。膜タンパク質またはマトリックスタンパク質(M)および小エンベロープタンパク質(E)は、いずれもウイルスの組み立ておよび放出に不可欠である。B. SARS-CoV-2ゲノム、遺伝子およびタンパク質。10個のオープンリーディングフレーム(ORF)がある。
最初のORF(ゲノムの67%)は非構造タンパク質(NSP)をコードし、残りのORFは付属タンパク質と構造タンパク質を産生する。ORF1a/bは、ORF1aとORF1bの間のフレームシフトの存在に対してpp1aとpp1bの2つのポリタンパク質を翻訳する。これらのポリプロテインは、3C-ライクプロテアーゼ(3CLpro)として知られるメインプロテアーゼ(3CLpro)および1つまたは2つのパパインライクプロテアーゼ(PLpro)によって16個のNSPに処理される。
NSPは、ウイルスの複製に不可欠なレプリカーゼ複合体を産生する。NSP12はRNA依存性RNAポリメラーゼ(RdPd)を、NSP13はヘリカーゼをコードしている。ORF2〜10は、Spike (S)、Envelope (E)、Membrane (M)、Nucleocapside (N)およびその他の補助タンパク質をコードしている。特に、Spikeタンパク質は2つの領域から構成されている。
宿主受容体の認識に必須の受容体結合ドメイン(RBD)を持つS1と、膜の融合と侵入に必須のS2である。S1サブユニットとS2サブユニットの間には、宿主のエンドプロテアーゼであるフーリンが認識する多塩基配列がある。Sタンパク質の活性化部位は、S2ドメインのS2′領域にあるセリンプロテアーゼTMPRSS2によって認識されている。
ウイルスサイクルにおける3CLproの重要性およびそのヒト同族体の不在により、この酵素は、コロナウイルス感染症に向けられた新薬の開発のための魅力的なターゲットとなる。3CLproは、すべてのコロナウイルスの間で高度に保存された活性部位を持つ3つのドメインのシステインプロテアーゼである。
ドメインIおよびIIは、キモトリプシンおよびピコルナウイルス3Cプロテアーゼのアーキテクチャに非常に類似した6本鎖の反平行βバレルである。基質結合部位は、これらの2つのドメインの間の裂け目に位置している。長いループ(残基184〜199)が、ドメインIIとC末端ドメイン(ドメインIII、残基200〜300)を連結している。
この後者のドメインは、5つのらせんの球状クラスターであり、3CLproのタンパク質分解活性に関与している。Anandら[24]およびDaiら[23]は、SARS-CoVおよびSARS-CoV-2の基質結合ポケットをそれぞれ解析し、このプロテアーゼの新規阻害剤を設計するために、S1′部位のシステイン残基のチオール基が、分子を共有結合で固定し、有効な抗ウイルス活性を得るために重要であることを発見した。S1′部位は、ヒトコロナウイルスの3CLproの触媒ドメインに高度に保存されている4つの部位(S1’、S1、S2、S4)のうちの1つを表している。
コロナウイルスの4つの主要な構造タンパク質は以下の通りである。1.ウイルスエンベロープの表面に局在し、宿主細胞へのウイルスの侵入に不可欠な三量体スパイク糖タンパク質(S)、2.膜またはマトリックスタンパク質(M)、3.ウイルスの組み立てと放出に不可欠な小エンベロープタンパク質(E)、4.ヘリカル対称ヌクレオカプサイドを形成するRNAゲノムに結合するヌクレオカプサイドタンパク質(N)である[19]。
また、コロナウイルスゲノムの中には、ヘマグルチニンエステラーゼ(HE)と呼ばれる約60~65 kDaの糖タンパク質をコードしているものがある。このタンパク質の役割はまだ明らかにされていないが、アセチルエステラーゼ酵素活性を有しており、宿主細胞表面のシアル酸受容体を破壊し、ウイルスの侵入と付着を助ける[22]。
異なる既知のコロナウイルスの遺伝子解析および比較解析は、現在のパンデミックに対する潜在的な薬剤標的を同定するための強力な戦略であり、3CLproプロテアーゼはその好例である。武漢(中国)で気管支肺炎液から分離され、配列決定された最初の3つのSARS-Cov-2ゲノムは、典型的なβコロナウイルス組織(サルベコウイルス亜属)を示した:5′非翻訳領域(UTR)、レプリカーゼ複合体(ORF1a/b)、S、E、MおよびN遺伝子、3′UTRおよびいくつかの未確認の非構造ORF [1]。
COVID-19に感染した9人の中国人患者のRNA配列を他のコロナウイルスの配列と比較して、Luら(2020)は系統解析を行い、ウイルスの起源の可能性が高いところまで遡ってウイルスの進化史を決定した[25]。この研究の著者らは、SARS-CoV-2 RNA配列が雲南(中国)の洞窟に生息するコウモリウイルスと96%の遺伝物質を共有していたが、SARS-CoV(79%の同一性)やMERS-CoV(50%の同一性)とは距離があったことを発見した。
しかし,ホモロジーモデリングの結果,この新しいウイルスは,いくつかの重要な残基のアミノ酸の違いにもかかわらず,スパイクタンパク質の受容体結合ドメイン構造(RBD)がSARS-CoVと類似していることが明らかになった.このことから、SARS-CoVとSARS-CoV-2は、肺、心臓、腎臓、精巣、消化管などに広く発現しているアンジオテンシン受容体酵素2(ACE2)というタンパク質がヒト細胞内に侵入するための細胞受容体を共有しているのではないかと推測された[25]。
2.2. 付着と進入
コロナウイルスの感染サイクルの開始と完了には、いくつかのステップが必要である
1.細胞内受容体(1つまたは2つ)への認識と結合
2.Sタンパク質のコンフォメーションの変化とタンパク質分解
3.細胞膜への融合
4.エンドサイトーシスによる宿主細胞へのウイルスの侵入[26]。
宿主細胞では、ウイルスは内因性の細胞機械を用いてレプリカーゼを翻訳し、ウイルスRNAを転写・複製する。次のステップは、ゲノム転写/複製中に生成されたサブゲノムRNA(sgRNA)による構造タンパク質の翻訳、そして最後に、ウイルスの組み立てと放出からなる[19]。
ウイルスリン脂質膜の表面に位置するスパイク糖タンパク質Sは、コロナウイルスの感染および病原性に重要であることがよく知られている。Sタンパク質は、2つの機能ドメインまたはサブユニット、S1、N末端にRBDを含む球状頭部、ウイルス-細胞膜融合に関与するC末端のS2サブユニット、続いて2つのヘプタド領域(HR1およびHR2)および膜貫通ドメイン(TM)を含む。Sタンパク質はいくつかの翻訳後修飾を受ける。
:そのエクトドメインは重度のグリコシル化されており、おそらくオリゴ糖は宿主プロテアーゼによるプライミングに影響を与え、抗体認識を決定する可能性がある[26]。特に、膜融合は、Sタンパク質の活性化に責任のあるS1/S2およびS2’サイトでの宿主細胞プロテアーゼによるSタンパク質の切断に依存する(図2)。
Hoffmanら(2020)は最近、SARS-CoV-2のライフサイクルは、宿主細胞上のACE2受容体と接触するSタンパク質のRBDから始まることを実証した[27,28]。このイベントには、2つの宿主セリンプロテアーゼが関与している:膜貫通型TMPRSS2とエンドプロテアーゼフーリンである。SARS-CoV-2のS1/S2部位には、SARS-CoVには存在しないが、MERS-CoVのような他のヒトコロナウイルスに共通するアルギニン残基が複数存在し、これらはフーリンプロテアーゼによって認識される(図2)。
著者らは、S1/S2部位間のこの多塩基切断の存在が、ヒト組織、特に肺にはフーリン様プロテアーゼがユビキタスに存在することから、SARS-CoV-2のトロピズムを拡大し、SARS-CoVと比較して透過性を高めているのではないかと推測している[27]。TMPRSS2およびフーリンプロテアーゼ活性の阻害は、最近報告されたように、コロナウイルス感染症、特にCOVID-19に対する興味深い治療法の選択肢として考えられ、SARS-CoV-2感染症のブロックおよび/または予防を可能にする[28]。
代替的な治療/予防戦略は、Sタンパク質とACE2との相互作用を破壊することが可能な分子または抗体を参照してもよい。この相互作用は、自然淘汰(突然変異とおそらく組み換えイベント)によるもので、SARS-CoV-2はSARS-CoVと比較して10~20倍強く、前者の感染率が高いことを説明できるかもしれない[28]。
ACE2はI型膜貫通型タンパク質であり、その生理的役割は血管収縮と血圧の制御に不可欠なペプチドホルモンであるアンジオテンシンの成熟にある。生化学的な観点から見ると、ACE2はジペプチジルカルボキシペプチダーゼであり、N末端ペプチダーゼドメイン(PD)とC末端コレクトリン(CLD)ドメインは単一の膜貫通らせんと約40残基の細胞内セグメントで終了している[29]。
ACE2のペプチダーゼ活性はコロナウイルス感染には必須ではない。なぜなら、呼吸器組織に感染するウイルスはこのタンパク質を本質的に受容体として使用し、呼吸器管の細胞上で発現するからである。肺では、ACE2は肺胞上皮II型細胞と気管支上皮に存在し、SARS-CoV、MERS-CoV、そして現在ではSARS-CoV-2の受容体として最初に認識された。MERS-CoVはまた、ジペプチジルペプチダーゼ4(DPP4)またはCD26をエントリーレセプターとして認識している[30]。
Sタンパク質のRBDは、ACE2受容体のカルボキシルペプチダーゼドメインと一次接触する受容体結合モチーフ(RBM)を有する。RBMのアミノ酸配列はSARS-CoVとSARS-CoV-2の間で50%保存されており、Yanらによる構造研究により、ACE-2の細胞外PDが極性残基を介してRBDに認識されることが示された[31]。
特に、最も顕著な変化は、SARS-CoV-2-RBDのLys417とSARS-CoV-2-RBDのVal404の置換であることを発見した。共結晶化したタンパク質の構造データから、ACE2の表面には、コロナウイルスによって中和される必要がある正電荷を作り出すSARS-CoV結合ACE2に不可欠な2つのLys残基、「ウイルス結合ホットスポット」が含まれていることが明らかになった[32]。
SARS-CoV-2のRBMにおける2つの重要な残基、Gln493およびLeu455は、これらのホットスポットに結合し、結合の大幅な安定化と、SARS-CoVよりも高いACE2への親和性をもたらした。さらに、SARS-CoV-2 RBDは、それらの間の相互作用を安定化する特異的な置換体(残基482〜485:Gly-Val-Glu-Gly)により、有意に高いACE-2結合親和性を示す。最後に、SARS-CoV-2のRBMに存在するPhe486はACE2のN末端α1ヘリックスの疎水性ポケットに挿入されているが、SARS-CoVのRBMに存在するロイシン残基は鎖が小さいために弱い接触を形成していると考えられる[32]。
2.3. ゲノムの複製・転写とウイルスの集合・放出
ウイルスの複製は細胞質膜のレベルで行われ、異なるウイルスNSPによって形成されたマルチサブユニット複製/転写複合体(RTC)によって媒介される。侵入後、ゲノムRNA(gRNA)は、宿主リボソームによってポリプロテインのpp1aおよびpp1bに翻訳され、これらは自動切断されてNSPを形成する。
これらのNSPは細胞膜の再配列を誘導して二重膜小胞を形成し、そこにウイルス複製複合体が固定されている[33]。RTC複合体のコアコンポーネントは、RNA依存性RNAポリメラーゼ(RdRp)の触媒サブユニットであるNSP12である。最適な機能のために、この酵素は付属因子を必要とする。NSP7とNSP8は、RdRpのテンプレート結合とプロセス性を増加させる。
NSP3およびNSP5は、パパインライクプロテアーゼ、PLpro、および3CLproをコードしており、上述したように、ポリタンパク質pp1aおよびpp1bの切断に不可欠である[19]。gRNAを鋳型として使用して、コロナウイルスレプリカーゼは完全長のネガティブセンス(-)RNAを合成し、これを鋳型として新しいゲノム(+)gRNAと、不連続転写によって合成された一連の異なるsgRNAを合成する。これらのsgRNAは、ウイルスの構造タンパク質および付属タンパク質をコードしている。
RNA 結合および RdRp の触媒活性部位に関与するアミノ酸残基は、異なる RNA ウイルスで高度に保存されており、レムデシビルのような広範な抗ウイルス阻害剤の使用を正当化している。最近、COVID-19患者を対象としたプラセボ対照試験[34]でその有効性が示されたこの薬剤は、親化合物のモノリン酸から三リン酸への変換を必要とする機構である非オブリゲートRNA鎖終結を介したウイルスRdRpの阻害剤として提案されているアデノシンアナログのプロドラッグである。
特に、Yinら(2020)は、これらの薬剤カテゴリーがSARS-CoV-2レプリカーゼ活性を阻害する方法を理解するためのモデルとして、RdRpと複合体のヌクレオチドテンプレートの構造を研究した。新規化合物EIDD-2801は、レプリカーゼの触媒ドメイン内の鍵となる残基K545とシチジン環から外れたN4水酸基との間で2つの余分な水素結合を形成する能力と、テンプレート鎖内のグアニン塩基を形成する能力について、レムデシビルよりも強力なウイルス複製阻害効果を示した[35]。
ゲノムの複製/転写は主にウイルスレプリカーゼによって媒介されるが、他の宿主因子が関与しており、例えば、テンプレートの切り替えを促進するRNAシャペロンとして作用することが知られているコロナウイルスNタンパク質、および酵素グリコーゲンシンターゼキナーゼ3(GSK3)[19]などが挙げられる。
最後に、RNAヘリカーゼ(NSP13)は、(+)RNAコロナウイルスにおけるRNA合成機械の2番目に保存されているサブユニットを表し、そのライフサイクルの多様なステップに関与している。これらのサブユニットは、二本鎖RNAをほどくためにヌクレオシド三リン酸の加水分解に由来するエネルギーを利用している[33]。
ウイルス粒子の組み立ては、ホモタイプ相互作用を介してMタンパク質の制御の下、ER-ゴルジ中間体複合体で行われる。この段階では、Sタンパク質とMタンパク質、Mタンパク質とNタンパク質の間の相互作用により、構造タンパク質の組み立て部位へのリクルートが可能になるため、Mタンパク質はウイルスの組み立てのための足場として機能する。
Eタンパク質はこの段階でMと相互作用し、膜の湾曲を誘導することで貢献している[19]。最後に、成熟したウイルスは、分泌経路を介して平滑壁小胞中に放出され、エキソサイトーシスによって放出される。
まとめると、コロナウイルスの複製は、ウイルスのRNA合成に必要なタンパク質機能を含む(そして隔離された)膜保護されたヌクレアーゼ耐性の微小環境で行われる。この戦略は、複製/転写の忠実度を向上させ、同時に、二本鎖RNAの存在によって引き起こされる宿主防御を抑制すると考えられている[33]。
3. コロナウイルスに対するフラボノイド
3.1. 初期の作品とフラボノイドの獣医師コロナウイルスへの効果
抗ウイルス剤の候補としてのフラボノイドのPubMedでの最初の出現は1951年にさかのぼり[36]、1966年にはケルセチンがこれらの化合物の中に含まれていることが示されている[37]。1977年には、他のフラボノイド(アピゲニン、ペラルゴニジン、プロシアニジン)とともにケルセチンの殺ウイルス効果がパラインフルエンザウイルス3型と単純ヘルペスウイルスには示されたが、ポリオウイルス1型とアデノウイルス3型には示されなかった。
著者らは、フラボノイドは強力な殺ウイルス活性を有する可能性があるが、ウイルスの増殖を抑制する効果は中程度であると結論づけている[38]。しかし、その後の研究では、ケルセチンは単純ヘルペスウイルス1型(HSV-I)、ポリオウイルス1型、パラインフルエンザウイルス3型(Pf-3)、および呼吸器合胞体ウイルス(RSV)の感染性および細胞内複製を減少させるのに有効であることが示された[39]。
ヘスペレチンは感染性には影響を及ぼさなかったが、細胞内複製を減少させ、カテキンとナリンジンはウイルス感染性と複製のいずれにも影響を及ぼさなかったか、あるいは限定的であった[39]。80年代後半になると、HIV緊急事態以降の抗ウイルス研究の活発化により、フラボノイドの抗ウイルス活性に関する研究が盛んに行われるようになった。
1991年に発表された3-メトキシフラボンがポリオやライノウイルスの感染を抑制する能力に焦点を当てたレビュー論文では、天然物が「ウイルスの宿主細胞への吸着から放出まで」のいくつかの抗ウイルスメカニズムを阻害することができると結論づけている[40]。
コロナウイルスに対するフラボノイドの抗ウイルス効果を探求した最初の論文の一つは、1990年に登場した[41]。この論文では、ケルセチンが60μg/mlの濃度でヒトおよびウシのコロナウイルス、OC43およびNCDCVの感染性をそれぞれ50%減少させたことが示されている。カエンフェロールなどの他のフラボノイドは効果がなかったが、後者は10μg/mlの濃度でNCDCVでは65%、OC43では50%のウイルス複製を減少させた[41]。
ウシコロナウイルスBCVもまた、紅茶由来のテアフラビンの混合物(テアフラビン、テアフラビン-3-モノガレート、テアフラビン-3′モノガレート、およびテアフラビン-3,3′ジガレート)に感受性があり、HRT-18細胞株での感染性アッセイでは平均EC50が34.7μg/mlであった[42]。獣医師が関心を持つ別のCoronaviridaeである豚伝染性下痢ウイルス(PEDV)では、ケルセチン7-ラムノシドがVero細胞におけるPEDVの複製を0.014μg/mlのIC50および100μg/mlのCC50(細胞毒性濃度50%)で阻害した[43]。
ケルセチン、アピゲニン、ルテオリン、カテキンを含む他のフラボノイドもまた、有意な抗PEDV活性を示したが、IC50値はケルセチン7-ラムノシドよりも10倍(アピゲニン)から800倍(カテキン)高い値を示し、C-3′とC-4′のo-ジヒドロキシ官能基と7位のラムノシドの重要性を示している[43](表1)。
表1 天然フラボノイドのヒトおよび非ヒトコロナウイルスに対する抗ウイルス活性を報告している研究。
- コロナウイルス化合物 効果 方法 参考文献
- SARS-CoV Baicalin EC50 = 12.5-25 μg/ml fRhK4細胞株 [44]
- ポルシン伝染性下痢ウイルス(PEDV) ケルセチン 7-ラムノシド IC50 = 0.014 μg/ml ベロ細胞 [43
- ウシコロナウイルス(BCV)テアフラビンEC50 = 34.7 μg/ml HRT-18細胞 [42
- HIV/SARS偽型ウイルス クエルセチンEC50 = 83.4 μM Vero E6細胞 [45]
- HIV/SARS疑似型ウイルス シナモミ皮質抽出物 IC50 = 37.3 μg/ml Hep-G2細胞 [46]
- SARS-CoVルテオリンEC50 = 10.6 μM Vero E6細胞 [45]
- SARS-CoVシナモミ皮質抽出物IC50=7.8μg/ml ベロE6細胞 [46]
- SARS-CoVプロシアニジンA2 IC50 = 30~40 μM Vero E6細胞 [46]
- プロシアニジンB1
- シナモンタンニンB1
3.2. SARS-CoVおよびMERS-CoVに対するフラボノイド
SARS-CoVの予防と治療のための漢方薬(TMC)の処方において、成分の一つはScutellaria baicalensis Georgi由来のフラボン配糖体であるバイカリンであった。この化合物は、10人の患者から分離されたSARS-CoVコロナウイルスを用いた中和アッセイにより、fRhK4細胞株を用いて試験を行った。
バイカリンは、有意な細胞毒性を伴わずに48時間で12.5〜25μg/mlのEC50を示した。この値は、ヒトでは標準的な経口投与量が約1500mgに相当することを考慮すると、60ng/ml(半減期約3時間)のCmaxに対して200~400倍高かった。
このため、バイカリンを抗ウイルス予防や治療に使用することはほとんど不可能であるが、ヒトに360mgを静脈内投与したところ、分子は74μg/mlのピーク血清濃度に達した[44]。他の2つのフラボノイド、ルテインとケルセチンは、宿主細胞へのSARS-CoVの侵入をブロックする能力を示した[45]。
ルテインは、EC50値が10.6μM(CC50=155μM)のVero E6細胞のSARS-CoV感染を用量依存的に阻害し、一方、ケルセチンは、EC50値が83.4μMのHIV-luc/SARS偽型ウイルスの侵入を拮抗した。ケルセチンの細胞毒性は非常に低かった(CC50 = 3.32 mM)[45](表1)。
医療用ハーブであるCinnamomum cassia (L.) J. Preslの乾燥樹皮から得られるCinnamomi Cortexは、生理活性ポリフェノールを濃縮したいくつかの有機画分を調製するために使用されてきた。これらの中で、n-ブタノール画分は、HIV/SARS-CoV偽ウイルス感染を用量依存的に阻害し、IC50が37.3μg/mlと最も活性が高かった。
この結果は野生型SARS-CoV感染症に対しても確認されており,同一画分のIC50は7.8 μg/mlであった[46].著者らは,プロシアニジンA2,プロシアニジンB1およびシンナタンニンB1の存在を抗ウイルス活性の原因と考えており,SARS-CoVのプラーク減少試験では30~40μMの範囲のIC50を示した。
しかし,いずれのプロシアニジンもTfR(トランスフェリン受容体,クラスリン介在性エンドサイトーシスのマーカー)の内包化を阻害するものではなく,SARS-CoVの受容体であるACE2の発現には影響を与えなかった[46](表1)。
3.2.1. フラボノイドとSARS-CoVおよびMERS-CoVプロテアーゼとの相互作用
上で報告したように、SARS-CoV RNAゲノムは、複製および転写に必要なプロテアーゼをコードしている。NSP3およびNSP5は、それぞれPLproおよび3CLpro(Mproとも呼ばれる、セクション2参照)をコードする2つの非構造領域である[47]。
前者はNSP1-NSP3レプリカーゼポリプロテインを切断し[48]、後者はNSP4-NSP16レプリカーゼ産物の個々のポリペプチドへの処理を担当している[24]。したがって、SARS-CoV 3CLproおよびSARS-CoV PLproの両方が、すぐに抗ウイルス薬の設計および開発のための潜在的なターゲットと考えられている[47]。SARS-CoV 3CLproの開裂活性を測定する2つの独立したアッセイを用いて、無細胞法と細胞ベースの方法、およびIsatis indigotica Fortune ex Lindl. (Isatis tinctoria L.の同義語)の根の水抽出物は、無細胞法および細胞ベースのアッセイにおいて、それぞれIC50が53.8 μg/mlおよび191.6 μg/mlであり、SARS-CoV 3CLproのタンパク質分解切断活性を用量依存的に阻害する能力を示した[49]。
同じ実験モデルで、抗ウイルス効果が認められているいくつかのハーブ由来のフラボノイド(ヘスペレチン、ケルセチン、およびナリンゲニン)を試験した。これらの中で、ヘスペレチンのみが無細胞および細胞ベースのアッセイにおいて3CLproの開裂活性を用量依存的に阻害した(IC50 60 μMおよび8.3 μM、それぞれ)[49]。興味深いことに、ケルセチンはSARS-CoVの宿主細胞への侵入を阻害することが報告されているが、SARS-CoVの3CLproに対しては阻害効果を示さなかった[45]。
後者の結論を支持するために、分子ドッキング法を用いて、ケルセチン-3-β-ガラクトシドがSARS-CoV 3CLproと結合し、残基Gln189が結合の安定化に重要な役割を果たしていることを明らかにした[50]。His-tag組換えSARS-CoV 3CLproを用いた試験管内試験(in vitro)アッセイでは、ケルセチン-3-β-ガラクトシドは42.79μMのIC50でプロテアーゼ活性を競合的に阻害した。
また、Gln189 をアラニンに変異させても SARS-CoV 3CLpro の酵素活性は低下しなかったが、ケルセチン-3-β-ガラクトシドの阻害力は結合親和性の低下により約 2 倍に低下した[50](第 4 節参照)。Torreya nucifera (L.) Siebold & Zucc の葉から単離されたいくつかの代謝物を、FRET 法に基づく 試験管内試験(in vitro) アッセイを用いて、市販の SARS-CoV 3CLpro のタンパク質分解活性を阻害する能力について試験した別の研究では、ケルセチンも参照化合物として使用された[51]。
最も強力な阻害効果は、8.3μMのIC50と非競合的阻害(K i = 13.8μM)を有するビフラボン・アメントフラボンに起因していた。一方、クエルセチンとルテオリンは約3倍のIC50を示し、アピゲニンはアメントフラボンと比較して約34倍のIC50を示し、最も効率が悪かった。in silicoドッキングシミュレーションにより、ビフラボンがSARS-CoV 3CLproの結合ポケットにうまくフィットすることが実証された[51](以下のセクション4を参照)。4つの主要なグループ、例えばフラボノール、フラバノン、イソフラボン、フラバン-3-オールなどに属するフラボノイドの異なるシリーズが、別の研究で試験された[52]。
ここでは、ケルセチン、ガロカテキンガレート(GCG)、EGCGは、メチル栄養酵母であるPichia pastorisで発現した組換えSARS-CoV 3CLproの活性を阻害するのに最も効果的であり、IC50は47-73μMの範囲であった。その他、アンペロプシン、プエラリン、ダイゼインなどは350μM以上のIC50を示した。GCGの阻害能をより詳細に解析したところ、競合的な阻害機構(Ki = 25 μM)が示唆された。また、疎水性と水素結合の相互作用を解析した結果、SARS-CoV 3CLproの活性部位へのGCGの結合エネルギーは-14 kcal/molであり、3-OH位置のガロイル部位が阻害活性に重要であることが明らかになった[52](第4節参照)。
Psoralea corylifolia L. (Cullen corylifolium (L. Medik)の同義語)種子のエタノール抽出物は、SARS-CoV 3CLproの活性部位であるガロイル部位の重要性を明らかにした[52](4節参照)。 ) Medik)種子のエタノール抽出物は、6つのフラボノイド、すなわち、ババキニン、ネオババイソフラボン、イソババカルコン、4′-O-メチルババカルコン、プソラリジンおよびコリーリフォールAの単離につながり、これらはすべて、フッ素原性ペプチド(Z-Arg-Leu-Arg-Gly-7-アミド-4-メチルクマリン;Z-RLRGG-AMC)を用いた試験管内試験(in vitro) SARS-CoV PLproのプロテアーゼ活性を阻害することができた。それらのすべては、イソババカルコンとプソラリジンが最も活性である4.2-38.4μMのIC50の範囲で用量依存的な方法でプロテアーゼを阻害した[53]。
阻害のモードが混在しており、阻害定数はタイプIと呼ばれ、阻害剤は遊離酵素に結合しているか、タイプIIと呼ばれ、酵素-基質複合体が阻害剤の標的となっていることが興味深い。同様の方法で,新規かつ希少なゲラニル化フラボノイドであるtomentin A,tomentin B,tomentin C,tomentin D,tomentin Eの5種のSARS-CoV PLproをIC50が5.0~14.4 μMの範囲で阻害した[54].L’Hér. ex Ventに由来する10種類の新規ポリフェノールのうち、SARS-CoVおよびMERS-CoVウイルス由来の2つのウイルスプロテアーゼ3CLproおよびPLproのタンパク質分解活性を阻害する能力を測定したところ、プレニル化ケルセチン誘導体であるpapyriflavonol Aのみが3.7μMのIC50値でSARS-CoV PLproに対して強力で非競合的な阻害効果を示した。
他のすべての化合物は、阻害は用量依存性であったが、すべての4つのプロテアーゼに対して数十および/または数百マイクロモルの範囲のIC50値を示した[55]。表面プラズモン共鳴(SPR)は、パピリフラボノールAとSARS-CoV PLproとの間の相互作用は212μMのK Dと特異的な結合イベントによるものであることを示した、より効果的なコロナウイルス阻害剤の設計を刺激する[55]。フラボノイドによるMERS-CoV 3CLproの阻害に関するより具体的な研究が後に発表された [56]。
ここで著者らは,20μMの濃度で試験した40種類のフラボノイドのうち,ヘルバセチン,イソバカルコン,ケルセチン3-β-D-グルコシド,ヘリクリセチンの4種類のフラボノイドが,それぞれ40.59,35.85,37.03および67.04μMのIC50を示し,最も効果的であったことを示している。
ドッキング解析により、プロテアーゼのS1およびS2部位がフラボノイドとの相互作用において重要な役割を果たしていることが示された。実際、ヘリクリセチンの4-水酸基はプロテアーゼMERS-CoV 3CLproのTyr54の水酸基と水素結合を形成しており、Tyr54は疎水性のS2サイトの奥深くに位置しているため、ヘリクリセチンの親和性が高いことを示しているようである[56]。
最近、同じ研究グループは、SARS-CoV 3CLproの潜在的な阻害剤を求めて、64-フラボノイドライブラリーの試験を行った[57]。その結果、ヘルバセチン、ロイホリン、ペクトリナリンが、IC50値がそれぞれ33.17、27.45、37.78μMと最も顕著な阻害剤として同定された。また、この場合も、ドッキング研究は、ロホイホリンのより良い親和性は、強い傾向はなく、極性S1サイト、疎水性S2およびS3′サイトを介して調整された結合に起因する可能性があることを示した[57](表2)。
表2 天然フラボノイドのヒトコロナウイルス蛋白質に対する阻害活性を報告している研究
原文参照
また、カルコンは、2つの主要なコロナウイルスプロテアーゼに対して有意な阻害活性を有する興味深いフラボノイド群の代表でもある。日本の植物であるAngelica keiskei (Miq.) Koidz(明日葉)から単離された9種類のアルキル化カルコンを用いた研究では,SARS-CoV 3CLproとSARS-CoV PLproの両方のプロテアーゼ活性を細胞ベースおよび無細胞アッセイで有意に阻害することが示された。
前者のプロテアーゼについては、無細胞アッセイでは、9つのカルコンのうち7つのカルコンについて11.4〜39.4μMの範囲のIC50を示した。同じ化合物は、1.2〜26.0μMのIC50でSARS-CoV PLproを阻害した。最も活性の高い結果となった5)のペルヒドロキシル基含有キサントアンゲロールEは、SARS-CoV 3CLproおよびSARS-CoV PLproに対してそれぞれ11.4および1.2μMのIC50を示した。また,細胞を用いた開裂では,IC50が7.1 μM,CC50が65.6 μMで,SARS-CoV 3CLproを阻害する結果となった(58)(表2)。
3.2.2. フラボノイドとSARS-CoV Nタンパク質との相互作用
前の段落で述べたように、SARS-CoVのゲノムは、核局在化シグナルを示唆するリジンが豊富な領域を持つアルカリ性タンパク質であるNタンパク質を含む構造タンパク質をコードしている。N因子は、ウイルスゲノムやMタンパク質との相互作用により、ウイルスの組み立てに重要な役割を果たしている。
また、ウイルスRNA合成にも関与している[59]。ガラスチップ上のウイルスRNAとNタンパク質の直接結合を模倣して、SARS-CoVのNタンパク質の潜在的な阻害剤をスクリーニングするための興味深いアプローチが確立された。
スクリーニングは、試験した23種のポリフェノール化合物の中で、(-)-カテキンガレートおよび(-)-ガロカテキンガレートのみが、RNAオリゴヌクレオチドへのNタンパク質の結合を置換することができることを示した。0.005 μg/ml から、両化合物は濃度依存的に結合親和性を減衰させ、0.05 μg/ml の濃度では最大 40%の阻害活性を示した(60)(表 2)。
3.2.3. フラボノイドと SARS-CoV NTPase/helicase との相互作用
SARS-CoV NTPase/helicase(NSP13とも呼ばれる)は、ウイルスのライフサイクルにおいて重要な役割を果たしているため、抗SARS治療の魅力的なターゲットとなっている[61]。ヘリカーゼの阻害剤として、ケルセチンおよびその誘導体が提案されている。まず、組換えタンパク質と FRET 法を用いて、SARS-CoV NTPase/helicase の Duplex DNA アンワインド活性に対するケルセチンの IC50 は 8.1 μM であることが報告されており、ジケト酸コアと遊離カテコールユニットの存在が重要であることが強調されている[62]。
同じグループはその後、いくつかの7-O-アリルメチルケルセチン誘導体の合成を発表した。本研究で試験した3つのアリールメチル基に3″-Cl、3″-CN、および4″-Cl置換基を有するそれらの誘導体は、親化合物と同じオーダーの2.7~5.2μMの範囲のSARS-CoV NTPase/helicaseに対する阻害活性を示した[63]。NSP13ヘリカーゼは、2本鎖DNAの巻き戻し活性と、ATPを加水分解して核酸と一緒に移動するATPアーゼ活性を有していた。いくつかのフラボノイド(不思議なことにケルセチンはこの研究に含まれなかった)を含む約64の天然化合物のスクリーニングは、すべて10μMの濃度で試験したが、有意にFRETベースのアッセイでNSP13ヘリカーゼのdsDNAアンワインド活性を阻害することができる化合物の証拠はなかった[64]。
しかし、同じ化合物をヘリカーゼのATPase活性を阻害する能力について試験したところ、それらのうちの2つの化合物、ミリセチンとスクテラレインは、それぞれ2.71と0.86μMのIC50値を持つNSP13 ATPaseの強力な阻害剤として浮上した。また,これらの化合物はC型肝炎ウイルスヘリカーゼのATP加水分解活性を同程度には阻害しなかったことから,SARS-CoV酵素に対する特異性が示唆された(64)(表2)。
3.3. SARS-CoV-2に対するフラボノイド類
COVID-19パンデミックの後、コロナウイルス感染に対するフラボノイドの潜在的な治療的使用の関心は、SARS-CoV-2ウイルスに焦点を当てた。これまでに発表された論文はわずかであるが、今後数ヶ月から数週間で指数関数的に増加することは容易に予測できる。
中国でのCOVID-19アウトブレイクの影響を考えると、SARS-CoV-2感染症の治療、あるいは少なくともその症状の緩和において、TCMが主要な役割を果たすことが期待されていた。実際、2020年2月の時点で、中国におけるCOVID-19に対する中医学治療の割合は約90%で、臨床症状が悪化した患者はわずか5%であった[65]。
21の成分(生薬と鉱物薬)からなる処方の清風圧剤(QFPD)は、治癒して退院した被験者、臨床症状が消失した症例、悪化せずに安定したままの症例、または著しく改善した症例を含むすべての段階の患者で92%の効果を示した[66]。QFPDの効果は、投与6日後の胸部CT結果では改善し、気管気管支影は正常となり、肺のCOVID-19に対するQFPDの主要標的を特定するTMCの理論に沿って炎症も吸収されていることが明らかになった[65]。
Yangら[66]は、QFPDの主要成分を同定し、COVID-19感染症に対する薬理学的メカニズムを調べるために、統合的な学際的アプローチ(薬理学的ネットワークとLC-MSデータの分子ネットワークを含むin silico技術)を適用した。彼らは、14のグループにクラスター化された129の化合物を同定し、フラボノイドが全体の45%を占めていた。
最後に、最近の論文では、いくつかの野生植物に存在するイソラムネチン-3-O-ルチノシドフラボノイド(グリコシルオキシフラボン)であるナルシソシドが、SARS-CoV-2 3CLproプロテアーゼの実験的構造を示す用語である6W63の強力な阻害剤であることを計算アプローチを用いて実証した(https://COVID-19.uniprot.org/uniprotkb/P0DTD1)。
ナルシソシドは、標準的な阻害剤X77よりも高い親和性を示した。2つの阻害剤は同じ複合体を共有していたが、ナルシソシドはX77と相互作用するものとは異なる3つのアミノ酸(Leu167、Pro52およびPro168)(His172、Leu27およびThr26)と相互作用した。最後に、6W63の活性部位へのグリコシロキシフラボンのより良い適合性は、X77によって確立された4つの水素結合と比較して、13個の水素結合によっても強化された[67]。
4. SARS-CoVタンパク質の潜在的な阻害剤としてのフラボノイド:in silico研究
前節では、ウイルスの付着と複製に関与する複雑な分子間相互作用を介して、SARS-CoV ウイルスタンパク質の結合部位を特異的に標的とすることができるアンタゴニスト化合物を同定するために、バイオインフォマティクスのアプローチが不可欠なツールであることを学んだ。
この目標は、構造的に重要な結合部位、NSP12 RdRp、NSP13 ヘリカーゼ、およびプロテアーゼ3CLproとPLproを含む非構造タンパク質の高度に保存された領域を標的とすることによって達成される[68]。3CLpro はすべてのコロナウイルスにおいて高度に保存されており、ポリタンパク質の切断に不可欠であり、上記で報告されているように、新しい阻害剤の開発のための重要なターゲットとなっている[24]。
SARS-CoV-2 3CLproの結晶構造解析により、酵素は306個のアミノ酸からなるホモ二量体(A鎖とB鎖)であり、各モノマーは3つの異なるドメインから構成されていることが示された[69,70]。2つの触媒ドメイン、I(残基8-101)およびII(残基102-184)は、互いに垂直に配置された反平行なβバレル構造を有している。活性部位は、長いループ領域によってらせん状ドメインIIIに接続された触媒ダイアド(His41およびCys145)を持つドメインIとドメインIIの間の裂け目に位置している[71]。
5つのαらせんからなる球状クラスターであるドメインIII(残基201〜303)は、触媒活性に不可欠な3CLproの二量体化に関与している。1つのサブユニットのN-フィンガーは、各プロトマーのGlu290とArg4との塩橋相互作用を介した基質結合ポケットの配置に関与している。また、S1、S2、S4サブサイトが基質認識に関与していることも示されている。S1サブサイトは、タンパク質分解部位のP1位置に小さな脂肪族残基(Ser、Gly、Ala)を含む3CLproの極性部位である。疎水性のS2サブサイトは、P2位置に大きな疎水性残基を含み、ValとAlaの側鎖はそれぞれP3とP4側にあり、小さな疎水性ポケットを形成している[69]。
COVID-19のパンデミックにより、SARS-CoV-2プロテアーゼを標的とした新規阻害化合物の同定と設計に力が注がれており、その中でもフラボノイドはSARS-CoV感染症に対する有望な薬剤として科学者の関心を集めている(上述のセクションおよびこれらのレビュー[57,72]を参照のこと)。蓄積されたエビデンスは、この方向に向かっている。低マイクロモル範囲のSARS-CoVシステインプロテアーゼに対するフラボノイドの阻害活性は、ペプチド由来の阻害剤の効果と比較すると高かった[55]。
フラボノイドの構造的特徴がその選択性に関与しており、カエンフェロール、ケルセチン、およびケルセチン-β-ガラクトシドに関する上記の研究で引用されたIC50値が示すように、2つのフェニル基が阻害力と関連していることが示唆された[55]。
フラボノイドの結合親和性を予測するためにドッキング刺激スクリーニングを行い、アピゲニン、ルテオリン、ケルセチン、ダイゼイン、エピガロカテキン、カエンフェロールがSARS-CoV 3CLproのタンパク質分解活性を阻害できることを示した[57](図3)。特に、分子動力学シミュレーションにより、His41、Gly143、Glu166がフラボノイドの共通官能基と相互作用を形成し、阻害活性を示すことが予測された[73]。
例えば、図4 Aは、SARS-CoV 3CLproの触媒部位とカエンフェロールのフェニル基との間の予測された相互作用を示しており、Glu166との水素結合を介してSARS-CoVの親水性タスクに位置している。他の水素結合は、水酸基とIle188、Asp142の間に形成され、クロメン-4-1足場は疎水性S2サイトにあった[57]。SARS-CoV 3CLproに対するケルセチン-3-β-ガラクトシドの阻害効果とドッキング解析により確立された分子間相互作用との間には同様の関連性があることが報告されている[50]。
構造と活性の関係を解析した結果、ケルセチン-3-β-ガラクトシドとプロテアーゼの活性部位との間の特異的な相互作用は、触媒結合ポケットの残基との6つの水素結合によって生じることが示され、重要なファーマコフォアの特徴が強調された。実際、His41、Gly143、Ser144、Cys145、Glu166、およびGln189残基は、ファーマコフォア球の近くに位置していた。
詳細には、ケルセチン-3-β-ガラクトシドの阻害効果は、Gln189との結合に強く関連しており、Gln189側鎖のO原子およびN原子との間に4つの水素結合が形成されていることが示唆された(図4B)。さらに、Glu166の主鎖のN原子は、フラボノイドとの他の2つの水素結合の形成に関与していた。さらに、ケルセチン-3-β-ガラクトシドは、SARS-CoV 3CLproの残基Leu141、Asn142、Met165、Glu166と疎水性相互作用を形成していた(図4B)。
この構造によれば、ケルセチンの4つの水酸基がその抑制的役割に強く関与していると推測でき、糖鎖と7-ヒドロキシ部位に基づく空間コンフォメーションは、水素結合相互作用による構造変化を可能にしている[50]。
図3

図3
フラボノイドとSARS-CoV 3CLproの結合ポケットのコンピュータドッキングスクリーニングのグラフィカルな表現。
図4

図4
A. カエンフェロールとSARS-CoV 3CLproの触媒部位との水素結合形成による予測相互作用。B. ケルセチン-3-β-ガラクトシドとSARS-CoV 3CLproの活性部位との間の水素結合および疎水性相互作用。
他の2つの例として、上記第3節でコメントしたNguyenら[52]とRyuら[51]の研究を挙げることができる。前者では、GCGと3CLproの基質結合ポケットとの相互作用は、触媒結合ポケット内の残基との7つの水素結合と、3CLproのHis41, Cys145, Met165, Glu166, Asp187, Arg188, Gln189との炭素原子の疎水性相互作用に関与していた[52]。
興味深いことに、C-7 の水酸基のメチル化により阻害活性が低下し、ビフラボンであるアメントフラボンが最も高い阻害活性を示し、IC50 値が 8.3 μM であった(表 2)。この分子の効果的な阻害作用を裏付けるために、コンピュータドッキング解析を行ったところ、3CLproのS1部位との相互作用により、C5水酸基とHis163のイミダゾール基の窒素原子、Leu141の-OHとの間に2つの水素結合が形成されていることが明らかになった。また、B環の水酸基とGln189との間には、3CLproのS2部位を含む追加の水素結合が発生した[51]。
フラボン類であるアピゲニン、ルテオリン、ケルセチンの構造活性相関解析から、ルテオリンのようなC-30水酸基の置換とケルセチンのC-30位の水酸基がSARS-CoV 3CLpro阻害に重要な役割を果たしている可能性があることが明らかになった[51]。
この観察は、最近の研究でも支持されており、ルテオリンはGln189、Leu4、Asn142、Thr26と5つの水素結合を形成し、Met49とVal3と疎水性相互作用を形成しており、その低い結合エネルギーと一致していることを分子ドッキング研究で説明している[68]。
これらの観察に基づいて、図3にまとめられた分子ドッキングアプローチは、触媒部位のHis41およびCys145と他の活性部位残基(例えば、Met49、Gly143、His163、His164、Glu166、Pro168、およびGln89)を結合することにより、SARS-CoV 3CLproの阻害におけるフラボノイドの役割を支持し、試験管内試験(in vitro)および生体内試験(in vivo)研究によるそれらの検証を刺激することは驚くに値しない。最近の論文では、ルテオリンがSARS-CoV 3CLproにも結合し、阻害することが確認されている[68]。
もう一つの興味深い研究分野は、RNA ウイルス複製の阻害であり、RdRp を標的とした医薬品開発の候補として提案している。この目的のために、分子スクリーニングの結果、テアフラビンがSARS-CoV-2 RdRpの触媒ポケットに干渉し、その結合エネルギーは-8.8 kcal/molであることが明らかになった。また、RdRpの残基Asp452、Arg553、Arg624との間に水素結合が形成されていることも明らかにした[74]。
5. 結論と今後の方向性
前節で報告したデータから、ポリフェノールのプリーオトロピックな性質と、その中でもフラボノイド類は、潜在的な抗ウイルス能力を持つ天然化合物の有望で強力なトウモロコシのような存在として浮上している。我々は、主にドッキングシミュレーションに基づいていくつかの研究の結果を報告し、特定のフラボノイドは、相互作用し、ウイルスのライフサイクルに責任のある主要な要因を阻害することができる可能性を示唆してコメントしている。
異なる生物学的分野において、フラボノイドの治療応用は、通常、他の生理活性植物化学物質に共通する長所と短所を伴っている。例えば、フラボノイドは私たちの食事に含まれており、このクラスの化合物を豊富に含む食品や食事のパターンを摂取することで、それらの有益な効果を関連付けることは容易である。
我々の分析では、抗ウイルス特性に焦点を当てているが、最近のレビューでは、この見解を支持している。実際、Messinaら(2020)は、食事の介入がCOVID-19の転帰を改善する可能性があり、ポリフェノール/フラボノイドは、炎症を減少させ、核内NF-κB転座をブロックすることで、これらの効果に寄与し得ることを示唆している[75]。
他の研究者は、「栄養補助食品および機能性食品は、ウイルス感染のメカニズムを予防し、免疫応答を調節するための幅広い可能性を持っている」[76]ことを示唆し、いくつかのフラボノイド(例:ケルセチン)の解熱活性と、高齢者のSARS-CoV-2を含むウイルス感染症への感受性の高さとの間の関連性を仮定している。
同様に、COVID-19に感染した患者をセノリティクスおよび他の抗老化薬で治療することが、ウイルス感染を予防するための重要なアプローチであるという仮説が立てられており、ケルセチンは臨床試験で試験される可能性のあるこれらの薬剤の中に含まれている[77]。
我々は、これらの解釈や、コロナウイルスのウイルス感染は食事によって改善されたり予防されたりすることができると示唆する楽観的すぎる見解には注意を払うべきである。しかし、実験や臨床の観点から評価することは難しいが、パンデミック時に免疫系を強化し、炎症や酸化ストレスを軽減することは、食物群や主要栄養素の消費量を増やすことで達成できるという概念は、依然として魅力的な仮説である[78,79]。
この仮説に対する障害は、食品中および/または栄養補助食品製剤中のフラボノイドを含む天然化合物の、よく知られており、広く受け入れられている限界によって表される。バイオアベイラビリティが極めて低く、腸管吸着による高い生体変換性と腸内微生物叢の複雑さから、フラボノイドとその代謝物がマイクロモル範囲の血中濃度に到達する可能性は低いと考えられる。
これらの限界は、ヒトでは栄養補給が効果的でないだけでなく、前のセクションで引用したコロナウイルスやウイルス性タンパク質に対して試験したフラボノイドの有効濃度と明らかに矛盾している(表1、表2)。
我々や他の研究者[72]は、抗ウイルス薬としてのフラボノイドの真の適用性は、予防よりも治療にあると考えがちである。実際、上でコメントした研究の大部分は、IC50が数十マイクロモルであるにもかかわらず、特定のフラボノイドをウイルス標的に直接結合させることに言及している。このことは、試験管内試験(in vitro)アッセイやドッキングモデルに基づいて、主要な活性残基が保存されているフラボノイドの構造に基づいて、より効率的な化合物を設計し、化学的に合成することが可能であることを示唆しているが、他のものはSAR分析に応じて修飾されている。
もちろん、天然化合物と合成化合物のいずれも、組換えタンパク質を用いた試験管内試験(in vitro)アッセイに限定されない機能的な検証が必要である(表2)。この目的のために、最近のCOVID-19パンデミックは、SARS-CoV-2阻害剤を同定するための新しい試薬やキットの商業化を大幅に加速させているが、これらの試薬やキットは、コロナウイルスが細胞にどのように感染するかを評価し、感染を阻止するための革新的な方法の開発を加速させるであろう。
抗ウイルス剤としてのフラボノイドまたはその誘導体の治療的応用は、純粋な化合物として、または標準的な抗ウイルス剤との組み合わせとして、それらの希少なバイオアベイラビリティーという重大な問題を緩和する利点を提示する。
実際、限られた時間のために与えられる薬理学的(栄養学的ではない)用量は、分子を腸内代謝および吸着から保存し、それらの薬物動態および薬力学パラメータを改善する、経口とは異なる経路(例えば、吸入、静脈内)によって、もっともらしく投与することができる。セクション3で上で引用したバイカリンは、静脈内投与で74μg/mlの血清濃度に達することができる化合物の例を示す[44]。
もちろん、フラボノイドの抗ウイルス剤としての栄養学的・薬理学的応用を考えるならば、感染者を対象とした臨床研究は「大きな欠落者」である。私たちの知る限りでは、ClinicalTrial.govのデータベースには1件の臨床試験しかない[81]。それは、COVID-19の予防と治療に対するケルセチンの効果についての募集中の試験である。
この試験は、強力なスカベンジャーであり、抗炎症剤であるケルセチンがCOVID-19症例に有効であることを前提としている。予定されているケルセチンの投与量は、予防用と治療用にそれぞれ500-1000mgである[81]。タンニン[82]とCaesalpinia spinosa (Molina) Kuntze [83]から得られた抽出物に基づく他の2つの研究は、まだ募集していない。
結論として、ヒトコロナウイルス感染症に対するフラボノイドの抗ウイルス能力に対する科学者の関心は、政府、保健機関、民間企業がSARS-CoV-2に対する治療法を求めて、この分野に注ぎ込んでいる莫大な量の資源の恩恵を受けることができる。
この状況は、エイズ大パンデミック後の80年代から90年代にかけて、HIV感染への反応を制御する免疫学的メカニズムの基礎知識が、驚くほど予測不可能な進歩を遂げた時の状況とほとんど似ていない。COVID-19に対する貴重なワクチンを待って、薬理学的アプローチが優先され、フラボノイドがそれに貢献する可能性がある。
このシナリオでは、冒頭で述べたフラボノイドの 「」多元的 「」な特性は、ウイルスと宿主細胞の両方に効果があり、感染を抑制することができるので、コロナウイルスに対抗するための有効な手段になるリスクがある。実際、最近の研究では、フラボノイドがSARS-CoV-2感染を促進するSARS-CoV-2スパイクタンパク質を切断するTMPRSS2とフーリンの両方を阻害することができるという仮説が立てられている。
分子ドッキングに基づくスクリーニングと組換えタンパク質を用いた試験管内試験(in vitro)アッセイの結果、TMPRSS2の(-)-エピカテキン3-O-(3′-O-メチル)ガレート[84]とフーリンの(-)-エピカテキン3-O-(3′-O-メチル)ガレート[85]がそれぞれのプロテアーゼに結合し、ウイルスの伝播を阻害することが明らかになった。
ここに提示された仮説と議論が、天然に存在するフラボノイドまたはその誘導体が抗コロナウイルス予防および治療を改善することを証明するための適切な実験を設計するための科学者を刺激することを期待している。