Contents
link.springer.com/article/10.1007%2Fs00253-020-10832-4
要旨
動物とヒトとの間でのウイルスの種間伝播は、予測不可能な病原性の可能性と新たな感染性疾患をもたらす可能性がある。このメカニズムは、最近、新規な重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)パンデミック、サウジアラビアでの中東呼吸器症候群コロナウイルスパンデミック、西アフリカでの致命的なエボラの発生など、新たな病原性ウイルスの発見によって例証されている。
SARS-CoV-2は、コロナウイルス病19(COVID-19)を引き起こし、経済的混乱、そして何よりも人の健康という点で世界的に大きな影響を与えている。この病気の特徴は、乾いた咳、発熱、倦怠感、筋肉痛、呼吸困難などである。その他の症状としては、頭痛、咽頭痛、鼻漏、胃腸障害などがある。
肺炎は、感染症の中で最も一般的で重篤な症状を示すようである。現在、COVID-19に対するワクチンや特異的な薬剤はない。さらに、新規抗ウイルス剤の開発には、薬剤設計およびバリデーションのためにかなりの時間と労力を必要とする。したがって、天然化合物の使用を再利用することは、代替案を提供し、COVID-19に対する治療をサポートすることができる。
本レビューでは、COVID-19の管理におけるプロバイオティクスの予防的および支持的な治療的役割について包括的に論じている。さらに、腸内微生物を変調させ、腸内恒常性を主張し、抗ウイルス機序としてインターフェロンの産生を促すプロバイオティクスのユニークな役割についても述べている。さらに、プロバイオティクスが腸肺軸や粘膜免疫系に及ぼす影響についても検討した。
キーポイント
・抗ウイルス疾患における腸内細菌叢の役割
・抗ウイルス機構に影響を与える要因
・プロバイオティクスとCOVID-19
序論
過去4ヶ月間で、コロナウイルス感染症19(COVID-19)は、経済的混乱、地域や世界の公衆衛生資源への負担、そして何よりも人間の健康という点で、世界的に大きな影響を与えていた。このレビューを執筆している時点で、世界での陽性症例数は21、600、000件、死亡者数は774、000人であった。インドでは、陽性例が260万件、死亡例が50、921件報告されている。COVID-19は、中東呼吸器症候群コロナウイルス(MERS-CoV)やSARS-CoV-1も含むSARS-CoVファミリーに属する高病原性の新規人獣共通感染性重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)によって引き起こされる。
これらのウイルスは、鳥類や哺乳類に感染するコロナウイルス科およびカロナウイルス亜科の大家族に属するエンベロープ型のポジティブセンス一本鎖RNAウイルスである。これらのウイルスのゲノムサイズは26〜32kbである(Anon 2020a)。SARS-CoV-2は、そのスパイク(S)糖タンパク質を介して細胞上のアンジオテンシン変換酵素2(ACE2)受容体に結合する。Sタンパク質は、2つのドメインS1とS2を有する。S1は、ACE2のペプチダーゼドメインに結合し、したがって、受容体結合ドメイン(RBD)と呼ばれ、一方、S2は、膜融合を触媒し、それによって遺伝子物質を細胞内に放出する(Hoffman et al 2020)。細胞内では、RNAは、レプリカーゼ(R1a/ab)、エンベロープ(E)、スパイク(S)、膜(M)、核タンパク質(N)、およびいくつかの非構造タンパク質(NS1-16)、未同定タンパク質14、タンパク質9b(Anon 2020b)などの構造タンパク質の鋳型を提供する。
これらのうち、非構造タンパク質は、宿主-タンパク質間の相互作用に関与し、宿主細胞のシグナル伝達経路を調節することが予測される。培養期間は2日から14日の間で変化すると推定される。感染様式についての現在の理解は不完全である。しかし、世界各地で最近発生した感染症に基づくと、一般的な感染様式には、感染者が咳やくしゃみをしたときの飛沫感染と、ウイルスを含む飛沫が鼻、目、口に触れた後の表面接触が含まれている。また、新生児への垂直感染も、糞便感染によるものと考えられている。
SARS-CoV-2感染の典型的な臨床症状は、乾いた咳(67%)、発熱(88%)、倦怠感(38%)、筋肉痛(14.9%)、呼吸困難(18.7%)などである。その他の症状としては、頭痛、咽頭痛、鼻漏、胃腸症状などがある。肺炎は、感染症の最も一般的で重篤な症状であるようである(Guan er al)。 2020)。現在、COVID-19に対するワクチンまたは特異的薬剤は存在しない。
さらに、新規抗ウイルス剤の開発は、いくつかの課題を提示し、薬剤設計およびバリデーションのためにかなりの長さの時間および労力を必要とする。したがって、再利用を探求し、天然化合物の使用は、代替品を提供することができ、COVID-19に対する治療をサポートすることができる。現在のところ、COVID-19被験者の管理のためのアジュバント療法としての任意のサプリメントの使用を支持する研究はない。SARS-CoV2に加えて、鳥インフルエンザ、エボラ、デング熱、およびジカウイルス感染症は、世界的に管理が不十分なままである(Liu er al)。
適切な量を適切に投与した場合に宿主に健康上の利点を有する生きた微生物は、プロバイオティクスと呼ばれ、それは細菌および酵母のいくつかの属を含んでいる。プロバイオティクスには、乳酸菌、ビフィズス菌、ロイコノストック、ペディオコッカス、エンテロコッカスなどがある。ヒトの正常な消化管微生物叢には、ラクトバチルス属、ビフィズス菌属に属する微生物叢が生息している。
これらは安全であり、ヨーグルトやその他の乳製品に広く利用されている(López-Moreno and Aguilera 2020)。プロバイオティクスは、宿主の防御免疫応答のバランスを整える役割を果たし、それによって粘膜バリア機能を刺激し、免疫システムを調節する(El Hage et al 2017)。興味深いことに、腸内細菌はビタミンD軸の変調を通じて有益な効果を発揮することが示されている。
ビタミンD軸を介して、プロバイオティクスは、粘膜バリアの完全性を保護し、腸粘膜の炎症を抑制することができる(Li et al 2015)。さらに、ビタミンD軸を介して、プロバイオティクスは、自然免疫系と適応免疫系の両方を調節することができる。その効果は、Th1/Th17 T細胞およびIL-1、IL-6、IL-8、IFNγ、およびTNF-αなどのプロ炎症性サイトカインをTh2応答に有利に減少させ、Tregを増加させ、T細胞主導のIgG産生をダウンレギュレーションし、DC分化を阻害し、自己耐性の維持を助け、一方で防御的な自然免疫応答を増強することを含む(Del pinto er al)。 2017)。
腸-肺軸の相互作用は、呼吸器疾患におけるプロバイオティクスの役割に影響を与え、それによって免疫対話は双方向のプロセスのままである。肺微生物叢は、主にIL-17とNod2刺激を介して顆粒球-マクロファージの生産によって、呼吸器感染症から保護する。肺感染症に対応して、腸内マイクロバイオータは重要な役割を果たしている。
潔癖症のないマウスにおける生体内試験(in vivo)研究では、急性肺感染時の罹患率の増加が示された(Brown et al 2017)。同様に、肺におけるマイコバクテリウム結核感染症の重症度における変調は、腸内細菌叢と相関している(Namasivayam et al 2018)。亜鉛などの微量元素は、宿主の正常な成長と発育に不可欠な役割を果たしている。
亜鉛は、Th1免疫経路をブーストすることにより、腸内細菌集団と免疫システムに大きな影響を与える。体内における亜鉛の恒常性の主要なメカニズムは、摂取した亜鉛の消化管吸収と、内因性亜鉛の腸内への分泌と糞便中の排泄とのバランスである(Cummings and Kovacic 2009)。
ヒトにおける亜鉛のホメオスタシスの摂動は、抗ウイルス免疫に影響を与える重要な因子である。亜鉛の欠乏は、Th1およびTh2免疫機能の不均衡が存在し、Th1経路の欠陥につながるため、ウイルス感染症を獲得するリスクにつながる(GieldaおよびDiRita 2012)。Leonardiら(2013)は、亜鉛メタロプロテインまたはバイオプレックスが人間による吸収のための最良の形態であるため、亜鉛と濃縮されたLABは、食品中のこの要素の貴重なソースである可能性が示された。
プロバイオティクスが宿主生物や免疫系にどのように作用するかのメカニズムは複雑であり、まだ完全には解明されていない。しかし、ウイルス性疾患に対するワクチンの救済と有効性は、ウイルス、特にRNAウイルスの高い突然変異率によって制限されている。
本総説では、プロバイオティクスの効率性とウイルス感染症予防における意義を論じている。さらに、ウイルス感染時の体の様々な部位の微生物の意義を提示する。今後の研究では、プロバイオティクスやパラプロバイオティクスを合理的な補助食品として用いた様々なウイルス性疾患の治療に焦点を当てる可能性がある。
肺微生物叢と呼吸器感染症
下部消化管部分と比較すると、肺にはヒト1000細胞あたり約10~100個の細菌が含まれており、これは比較的少ない細菌バイオマスである(Sze er al)。 2012)。嚢胞性線維症の研究では、出生後に腸と肺の微生物群が同時に発達することが補強されており、これら2つの領域の間には一定のクロストークが存在することが証明されている(Marsland er al)。
肺マイクロバイオームのダイナミックな構成は、栄養、温度、抗炎症細胞の質と量を介した取り込み、咳、粘膜クリアランスを介した排泄、自然免疫と適応免疫、微生物の微小吸気と吸入を介した移民、およびそのコミュニティ内での相対的な増殖によって決定される(O’Dwyer er al)。 2016; Fanos er al)。 2020)。
肺は、生後間もない頃から、吸入または不顕性の微小吸引のいずれかを介して、継続的に微生物相にさらされる器官である。肺および気道マイクロバイオームは、疾患に対する免疫に直接影響を与えるか、または疾患の発症中に局所免疫/炎症を変化させる効果を有し得る。微生物が豊富に存在する上気道や口腔咽頭では、宿主の粘膜防御や粘膜クリアランスを介して排除されず、肺の奥深くまで到達することができる(Wilson and Hamilos 2014)。
口咽頭内容物の不顕性誤嚥は、ヒトでは普遍的に発生する(O’Dwyer et al 2016)。Murineの研究では、肺の細菌負荷が生後2週間で増加することが実証されており、肺で発見された生物の系統は、γ-proteobacteriaおよびFirmicutesからBacteriodetesへとシフトしている(Frank er al)。 肺環境はバクテロイデテスやエンテロバクテリア科などの腸内細菌が豊富になり、「肺の中のより多くの腸」と呼ばれるようになる(Fanos er al)。 2020)。
プロバイオティクスは主に腸内でコロニー化するが、全身の免疫応答に根本的な影響を与える。また、肺を含む遠隔の粘膜部位でもコロニー化し、免疫応答を発揮することができる(Tapiovaara er al)。 この研究では、プロバイオティクスLb. plantarum GGが上気道系、特にリンパ系が利用可能な場所でコロニー化し得ることが報告された。研究者らは、プロバイオティクスLb. plantarum DSM9843を濃縮した発酵オートミール粥を8時間経口摂取した後、6人の個体の扁桃上皮からプロバイオティクスLb. plantarum DSM9843を分離した(Tapiovaara er al)。 2016)。
微生物相のそのような発生変化は、アレルゲンチャレンジに対する耐性を促進し得るT調節細胞集団の蓄積と関連していた(Frank er al)。 肺微生物叢は、肺感染に対する肺免疫または気管支関連リンパ組織の発達を特異的に調節する可能性がある(O’Dwyer et al 2016)。ヒトは、通常の吸入中に、異なる強力な生物、有害粒子、およびガスに直面することができる。カビ、細菌、およびウイルスなどのこれらの有害な生物の堆積は、気道または肺胞表面で起こる。
これらの生物の中には、肺の深部にしか侵入できない3μ以下のものから5μ以下のものまである。繊毛と粘液層が病原体の肺への侵入を防いでる。病原体が肺に侵入すると、肺胞マクロファージの活性化により肺の防御機構が活性化される(Janssen et al 2016)。細胞表面に受容体を持つ肺胞マクロファージは、堆積した粒子と結合し、粒子を摂取・殺傷・消化する。
また、このような重篤な感染性粒子が肺に導入されると、白血球、特に好中球が循環の中で増加し、病原体の摂取・殺傷を助ける。肺微生物叢は、インターロイキン17(IL-17)およびNod2上の刺激を介して顆粒球-マクロファージコロニー刺激因子(GM-脳脊髄液)の肺産生を誘発し、S. pneumoniaeおよびK. pneumoniaeによる呼吸器感染症から保護することができる(Mukherjee and Hanidziar 2018)。
プロ炎症性サイトカインIL-17は、リポ多糖に応答して、間質細胞、内皮細胞、上皮細胞のCD4+およびCD8+ T細胞によって誘導される。IL-17は細胞受容体に結合し、好中球、AP-1、およびNF-κB活性を活性化する(Ryzhakov er al)。 2011)。また、IL-17はイノシトール要求性酵素1を介して小胞体ストレスおよびオートファジーを誘導し、感染性ウイルスの繁殖を阻害する(Kim er al)。 2015)。
ノッド様受容体(NLR)は、NFκBシグナル伝達の刺激を介して宿主防御機構をサポートする細胞質受容体として作用する。NFκBは、プロ炎症性サイトカインTNF-αおよび好中球ケモカインIL-8を有するエフェクター遺伝子の転写を制御する。合理的な状態では、NFκB は停滞したままで、細胞質内でインヒビター分子 IκB と結合している。刺激を受けると、IκBはIKKを介してリン酸化され、ユビキチン化のためのシグナルを送り、IκBから遊離したNFκBを放出し、NFκBのp65/p50ヘテロダイマーが核内に移動するのを助け、標的プロモーター領域で転写因子として作用する核局在化配列(NLRS)を明らかにする(LllewellynおよびFoey 2017)。
NLRは、骨髄における好中球誘導を介して呼吸器病原体の感染から保護し、循環性好中球および炎症性単球の寿命を調節し、造血をサポートし、リンパ球の毛包形成を促進し、アジュバント活性を刺激する(Brown er al)。 2017)。また、腸内マイクロバイオータは、細菌感染に対する肺の反応に重要な役割を果たしている。無菌マウスを用いた研究では、P. aeruginosa、K. pneumoniae、S. pneumoniaeによる急性肺感染時の罹患率と死亡率の増加が示されている(Mukherjee and Hanidziar 2018)。
2020年1月30日現在の世界保健機関は、重度の急性呼吸器症候群を引き起こすSARS-CoV-2とも呼ばれる新規コロナウイルス(CoV)のために国際的な懸念の公衆衛生の緊急事態(PHEIC)を警戒している。コロナウイルスによる肺感染は、ガス交換領域および関連する気道の上皮の破壊を伴う(Fanos er al)。 肺胞の上皮細胞は、ヒト腸球の消化関連酵素であるアンジオテンシン変換酵素2(ACE2)を有するSARS受容体として機能する。
コロナウイルスは、その進行中に結合受容体および結合部位を頻繁に変化させている(Feng er al)。 ウイルス感染は、肺胞マクロファージを誘導して多核巨細胞、単球、樹状細胞を形成し、SARS-CoVに対して作用する。血清中のCXCL10(IP-10)、CCL2(MCP-1)、IL-6、CXCL8(IL-8)を含むプロ炎症性サイトカインの濃度上昇は、肺がSARS-CoV感染に曝露されると明らかになった(Qian et al 2013)。
SARS-CoVの肺感染はまた、インターフェロン-b、インターフェロン-l、CXCL10、CXCL11、およびIL-6のmRNA濃度の著しい上昇をもたらする(Zhaohui er al)。 COVID-19のいくつかの可能性のある治療法、例えば栄養剤、抗ウイルス剤、抗コロナウイルス剤、およびミスセラネア剤のような治療法のうち、プロバイオティクス、特にビフィズス菌および乳酸菌を用いた投薬は、回復のかなりのチャンスを提供する(Fanos er al)。
ビフィズス菌または乳酸菌のようなプロバイオティクスは、気道におけるインフルエンザウイルス感染に対して有益な効果を有する(Zelaya er al)。 プロバイオティクスの摂取は、肺の免疫系におけるI型インターフェロン、抗原提示細胞、NK細胞、およびTおよびB細胞のレベルを改善する。また、プロバイオティクスの投与は、プロおよび抗炎症性サイトカインを改善し、肺の細胞損傷を最小限に抑えてウイルス感染をクリアするのを助けることができる(Baud er al)。 2020)。
この示唆されたメカニズムはまた、COVID-19に関する合併症を予防するために顕在化することができる。最近の研究では、COVID-19における腸の関与は、肺と比較してさらに大きく、より長期化することが示唆されている(Xu er al)。 2020)。
鼻咽頭の微生物
鼻咽頭は、常在菌と病原性微生物の両方の様々なタイプの優勢なニッチとして機能している(Lemon er al)。 微生物は、喫煙者から非喫煙者、健康な人から不健康な人、高齢者と新生児の間でメンバーシップと分布の点で異なる(Charlson er al)。 2010)。数多くの調査により、健康な人の鼻腔内マイクロバイオームは基本的にアクチノバクテリア、バクテロイデテス、ファーミキュートス、プロテオバクテリアの系統で構成されており、ビフィドバクテリウム、プロピオニバクテリウム、コリネバクテリウム、ドロシグラヌラム、およびモラクセラが優占していることが明らかになった(Huffnagle er al 2017; Kumpitsch er al 2019)。
肺炎球菌、ヘモフィルス・インフルエンザ、モラクセラ・カタラリス、黄色ブドウ球菌、およびナイセリア・メニチディスを含む多数の病原性種が、一見健康な人の鼻咽頭に存在する(Allen er al)。 2014)。病原性細菌と同様に、ライノウイルス、エンテロウイルス、コロナウイルス、アデノウイルスを含むいくつかのウイルスは、無症状の感染者から発見されている。
Human Microbiome Projectのメタゲノム研究により、鼻咽頭に存在するP. acnes、 C. accolens、 C. kropenstedtii、 S. aureus、 S. epidermitidisなどの重要な菌を明確に区別することができるようになった(Anon 2012)。細菌の中では、H. influenzaeが最も支配的な細菌であり、S. pneumoniaeおよびM. catarrhalisとともにヒトの鼻咽頭マイクロバイオームを構成している(Bisgaard er al)。 2007)。
S. pneumoniae、M. catarrhalis、およびH. influenzaeの存在下では、単独またはこれらの生物の混合物のいずれかで、血中好酸球を完全にコロニー化し、4歳の若者のIgE数を増加させることができる(Bisgaard er al)。 2007)。上気道のあらゆる感染症は、細菌病原体とウイルスの間に、相乗的にも競争的にも精巧なつながりをもたらする。
上気道の微生物は、細菌の付着、細菌のコロニー化、および宿主の免疫応答を変化させる。重度の気管支炎を持つ小児の鼻咽頭微生物叢の調査では、ウイルス性疾患であるヒトライノウイルス(HRV)(Heinonen er al)。 2016)、呼吸器同期感染(RSV)(Mejias er al)。 2013)、または共汚染に依存した微生物の動きが実証された。
ライノウイルスチャレンジ中の慢性閉塞性肺疾患(COPD)患者および健康な人の肺微生物叢は、感染後に大規模な変化を示した(Huang et al 2017)。鼻咽頭に存在する粘液層は、呼吸した空気を加湿するのを助け、侵入した微生物または任意の異物分子を捕捉する(Kumpitsch et al 2019)。この汚染されたあちこちの粘液は、粘膜クリアランスを経て外に排出される(Bustamante-Marin and Ostrowski 2017)。
不思議なことに、免疫調節特性を有する常在菌は、宿主の免疫反応を開始し、病原体に対して迅速に保護するのに適している(MichaelおよびDavid 2013)。プロバイオティクスのラクトバチルスGG、または他のプロバイオティクスとの組み合わせでは、小児におけるURIの発生またはリスクを減少させることが示された(Kumpu et al 2012)。
ヒトの鼻および上気道は、侵入免疫原性粒子および飛沫を介して効率的に病原体を保持する。消化管(GI)、呼吸器、泌尿器、生殖器の粘膜層で検出された病原体は、体の免疫システムとして機能する(Zhang er al)。2018)。
ヒトの鼻は、消化管と同様に上皮細胞、抗原提示細胞、杯細胞、特殊リンパ器官からなる単層からなる1型粘膜層で覆われている。上気道でも局所粘膜免疫系を活性化する病原性異物は、付着後、特に肺に侵入する。Huaら(2018)は、鼻および上気道のコロナウイルスへの鼻腔内曝露が、同種感染および異種感染に対する自然免疫応答および適応免疫応答のより迅速な開始のために、肺を免疫学的に準備することができることを実証した。
免疫系は、末梢血Tリンパ球サブセットの変化による重症急性呼吸器コロナウイルスの治療において重要な役割を果たし、疾患診断および治療の理解に寄与する(Lin er al)。 また、サイトカインおよびケモカインの過剰産生、Tヘルパー細胞媒介免疫の活性化および宿主炎症反応は、SARS感染の急性期に観察された(Russell er al)。 2020)。
腸内微生物の相互作用と免疫調節
腸は、微生物のほとんどが共生的に宿主にとどまる重要な生息地である。腸内では、マイクロバイオータは腸の恒常性維持に不可欠な役割を果たしている(Kerry er al)。 2018)。腸内マイクロバイオームは、細菌、ウイルス、真菌に限らず、様々な微生物群集を含んでいる(Shi er al)。 ヒトの腸内マイクロバイオームは、約1000種の異なる微生物から構成され、小腸の消化管1ミリあたり104〜105個の細菌、および大腸の腔内内容物1グラムあたり1011個の細菌の密度が異なる(Thomas er al)。2017)。
マイクロバイオームの構成は人によって異なり、環境の変化や遺伝的な遺伝にも左右される(Harmsen and de Goffau 2016)。健常者では、マイクロバイオームは主に4つの微小生物の集まりで構成されている。Firmicutes、Bacteroidetes、Proteobacteria、Actinobacteria(Gu er al)。 2013; Seedorf er al)。 2014)であり、そのうち、FirmicutesとBacteroidetesの2つの系統が腸内細菌叢の90%を占めている。
さらに、ほとんどの場合、腸内の支配的な菌叢はバクテロイデスとファーミキュテスであり、プロテオバクテリアとアクチノバクテリアがそれに続く(Rinninella er al)。 2019)。マイクロバイオームと宿主の共生関係では、両者は相互に有益な関係にある(Parker er al)。 2018)。マイクロバイオームは、ヒトの腸からの空間、栄養、繁殖環境を利用している(Chang and Kao 2019)。その結果、腸内細菌叢は炭水化物発酵を助け、ビタミンを合成し、腸管透過性をダウンレギュレーションする(Kau er al)。 2011)。腸内マイクロバイオータは、防衛障壁として働き、腸管免疫システムを修飾するのに役立つ。
下部管マイクロバイオームは、様々な環境因子の影響を受けている。したがって、腸の恒常性を維持するためには、マイクロバイオームと腸管免疫系の協力が不可欠である。このホメオスタシスが、バランスのとれた腸内微生物群集の変化によって疲弊すると、腸内細菌叢の異常が腸疾患を引き起こす(Na er al)。2017; Chang and Kao 2019)。
研究は、新生児消化管における微生物のコロニー化の加速が、腸の免疫系の成長に重要な役割を果たすことを明らかにした。腸内マイクロバイオームは、病原体の結合、それらのコロニー化、生存、およびそれらの代謝物(例えば、有機酸、抗菌性化合物)による直接的な殺傷との競争を示し、腸関連免疫を増加させる。プロバイオティクスの経口投与は、気管支や泌尿生殖器粘膜のような遠隔の腸粘膜での感染から保護する(Hao er al)。 2011; Barbieri er al)。 2017)。
サルモネラ・エンティカ・セロバー・チフィムリウム汚染のリスクは、マクロファージの貪食作用および微生物殺菌作用を誘導するプロバイオティクスの経口投与によって最小限に抑えることができる(Galdeano et al 2011)。Galdeanoら(2011)によると、プロバイオティクスによって放出されたサイトカインは、消化管からアクセスできない免疫細胞に作用する。
特異的な抗体の産生により、プロバイオティクスは全身の免疫応答を刺激することができる。十分な量のプロバイオティクスは、宿主の自然免疫と適応免疫を刺激することができる。腸内微生物叢は、心臓、肝臓、腎臓、肺の免疫にも長距離の健康に影響を与える(Marsland er al)。2015; Enaud er al)。2020)。腸-肺軸では、呼吸器疾患時の遠位(腸)免疫調節は、腸マイクロバイオータによって媒介される。
健康な腸マイクロバイオームは、その腸-肺軸によって肺免疫だけでなく、腸免疫をも変化させることができる(Fanos et al 2020)。呼吸器の気道感染の間、体の常在菌は、腸-肺軸と考えられる局所(肺)および遠位(腸)部位への免疫応答を刺激し、ここで腸微生物叢は、この感染の間、肺の免疫系を調節する(Budden er al)。 腸-肺軸は双方向性であり、血液やリンパ系を経由して炎症が発生した際にエンドトキシンという微生物代謝物が肺に影響を与え、腸内マイクロバイオームにも影響を与えると考えられている。
このメカニズムにより、腸内細菌叢の変化にも影響を与える可能性のある新規SARS-Cov2の可能性がある(Dhar and Mohanty 2020)。腸内細菌叢は肺の多くの呼吸器疾患の変調に関与していることが示された(Taylor er al)。 プロバイオティクスは、肺胞マクロファージ、好中球、ナチュラルキラー細胞、および肺におけるTNF-αおよびIL-6のようなプロ炎症性サイトカインのレベルの増加を介して有意な微生物殺傷特性を示した(Vieira er al 2016; Belkacem er al 2017)。
抗炎症性サイトカイン(Treg細胞およびIL-10など)もまた、感染マウスの肺におけるプロ炎症性サイトカインの増加に伴って増加する(Khailova et al 2013)。最も重要な方法は、リンパ系が肺と腸の間にあることである。コメンサル、その身体部分(例えば、リポ多糖類)、および代謝物(例えば、短鎖脂肪酸)は、腸から腸間膜リンパ系を介して全身循環を利用して肺に移動し、肺免疫を調節する(Trompette er al 2014; Bingula er al)。 2017)。
最近の研究では、IL-25に伴う炎症性免疫応答に応答して、組織修復を行う自然リンパ系細胞が腸から肺へと移動し得ることが明らかになった(Huang et al 2018)。ある研究では、マウスのビフィドバクテリウム・ロングムの摂取によってK. pneumoniae感染がダウンレギュレートされたことが報告されている。LooftとAllen(2012)は、臨床モデルでのインフルエンザ感染研究中に腸管腔内の乳酸菌と乳酸桿菌のレベルが低下し、腸管腔内のEnterobacteriaceaeのアップレギュレーションが増加したと結論づけている。
粘膜免疫応答
宿主免疫の不調は、体の免疫系、すなわち免疫器官、可溶性サイトカイン、細胞受容体を刺激し、免疫防御の主要なバックボーンとなる。微生物相と環境因子とのコミュニケーションが粘膜免疫に影響を与える(Neish 2014)。消化管、呼吸器管、膣管の表面に存在する粘液層は、免疫グロブリンA抗体が粘膜免疫の第一行目として機能する防御の役割を果たしていた(Corthesy 2013)。
ムチンは粘膜免疫のバリア機能として作用する。異物粒子や病原体は、一度粘膜バリアを通過すると、気道の免疫細胞が産生するリゾチーム、ラクトフェリン、コレクトリン、ディフェンシンなどの粘液中に存在するいくつかの可溶性の抗菌ペプチドとの接触を得ることができる。これらの抗菌ペプチドは、病原体の直接的な殺傷または他の炎症性細胞のオプス化またはリクルートを介した病原体の抑制に関与している(Das and Thakur 2015; Boyton and Openshaw 2002)。
粘膜上皮細胞の病原体感染は、単球、マクロファージ、顆粒球、B細胞、ナチュラルキラー細胞、および樹状細胞を導入する。これらの安全な細胞の導入は、異なるパターン認識受容体(PRR)に依存している。Toll様受容体(TLR)およびヌクレオチド結合オリゴマー化ドメイン含有タンパク質2(NOD-2)、C型レクチン様受容体(CLR)、および活性化された細胞質DNAセンサーを含むPRRは、プロおよび/または抗炎症性、または調節性および/または抗ウイルス性ケモカインの直接的な免疫原性反応を介して、免疫応答を誘導する(Akira er al 2001; Ausubel 2005; Chaudhuri and Sabroe 2008; Hooper and Macpherson 2010)。
マクロファージおよび樹状細胞を介した病原体の破壊もまた、自然呼吸器粘膜免疫系に関与している。肺胞マクロファージはNOと活性酸素を放出して病原体を直ちに排除する。樹状細胞(DC)は、様々な観点から病原体を感知して排除するのを助けている。DCは、リンパ節において抗ウイルスCD8+細胞傷害性T細胞応答を開始することにより、肺からのウイルスクリアランスにおいて重要な役割を果たしている(Ho er al)。 2011)。
樹状細胞は、経上皮樹状突起を介して侵入した病原体を巧みに貪食する(Farache er al)。 樹状細胞はまた、上皮ゴブレット細胞およびM細胞を介して病原体をブロックし、経細胞化するのに役立つ。侵入抗原は、M細胞を介して上皮下のAPCにトランスサイトー化される。APCは、処理された抗原提示のための信号を粘膜関連リンパ組織(MALT)のT細胞領域に送り、B細胞への抗原提示を行う。B細胞は、表面免疫グロブリンIgA陽性(IgA+)B細胞を生成する。
抗原刺激を受けたT細胞および細胞表面免疫グロブリンは、リンパ節を介して全身循環に入る。細胞内免疫グロブリン媒介輸送の間、ウイルスはそれを介して中和されることがある(Das and Thakur 2015)。TGF-β、IL-25およびIL-33のような上皮由来のサイトカインは、Th2またはT調節性粘膜免疫応答の活性化において重要な役割を果たす。
RSVによる重度の肺損傷は、好中球浸潤を増加させ、肺のCD4+細胞を産生するTNF-α、IL-13のアップレギュレーションを増加させた(Stokes er al)。 2013)。RSVへの感染はまた、肺の活性化されたT細胞から分泌されるプロ炎症性サイトカインであるIL-17のレベルの増加により、粘液の産生をアップレギュレートさせる(Chen er al)。
プロバイオティクス生物はまた、有機酸、短鎖脂肪酸(SCFAs)(ToppingおよびClifton 2001;McdermottおよびHuffnagle 2014)、およびバクテリオシン(Bacteriocins)と呼ばれる抗菌性化合物などの分泌代謝物によって媒介される様々なシグナルネットワークによって粘膜免疫系(MIS)の成熟および活性化を助ける(Galdeano et al 2019)。
いくつかのウイルスは、ヒトへの呼吸器感染を引き起こす(Marsland et al 2015)。プロバイオティクス細菌もまた、侵入したウイルスに結合して、宿主細胞受容体へのウイルスの付着を阻害する可能性がある(Salminen et al 2010)。プロバイオティクスの投薬は、粘膜免疫を強化し、呼吸器ウイルス感染に対する制限を提供するのに役立つ(Marsland et al 2015)。
免疫増強剤としてのプロバイオティクス
プロバイオティクスは、局所免疫(腸のウェルビーイングと腸壁の完全性を維持することによって)および全身免疫(特異的および非特異的な免疫システムを強化することによって)を介して、いくつかの潜在的なシステムによって宿主にいくつかの健康上有益な効果を発揮する。プロバイオティクスの応用は、ウイルス感染を含むいくつかの病気に対して効率的かつ有能である(Kanauchi er al)。
100年以上前に、ノーベル賞受賞者エリー・メチニコフは、乳酸産生微生物を摂取すると消化器系や呼吸器系の疾患などの病気が改善されることを示す一連の試験を行った(ゴードン2008)。プロバイオティクスは、貪食活性、白血球(多形核球および単球)、および貪食に関連するいくつかの受容体(CR1、CR3、FccRI、およびFcaR)の発現を増強することによって宿主の自然免疫系を調節し、好中球の微生物機能を増加させる(Hao er al)。
また、ナチュラルキラー(NK)細胞の数や活性も血液中で有意に改善される(Grudzien and Rapak 2018)。常在菌によるToll様受容体(TLR)シグナリングは、腸管バリア機能を強化し、局所免疫応答を改善することで宿主の腸内恒常性を維持するために有意な効果を示す(Belkaid and Hand 2014)。
プロバイオティクスはまた、適応免疫の活性化を介して、異物に対するAPC由来のプロおよび抗炎症性サイトカイン(例えば、IL-10、IL-12、IL-17、TNF-α、インターフェロン-α)の産生を誘導することができる。腸内炎症調節性プロ炎症性サイトカイン、ケモカインおよびそれらの受容体は、異なる免疫活性化細胞によって産生される抗炎症性サイトカインIL-10によって阻害される(Azad et al 2018)。
プロバイオティクスは、IL-12産生を活性化し、NK、Th1、Th2細胞を誘導し、感染症やアレルギーに対して作用する免疫賦活作用と、宿主の適応免疫のためにTh2、DCs、B細胞、単球によるIL-10やTreg細胞の活性化を誘導する免疫調節作用の2種類の異なる免疫調節作用を提供する(Chiba et al 2010)(図1)。
最近の動物およびヒト臨床研究では、乳酸菌株またはビフィズス菌株の免疫機能に応答して、IFN-g、IL-2、腫瘍壊死因子(TNF)-훽、血清IgA、およびIgA分泌細胞のレベルが増加することが示された(Zhang et al 2018)。
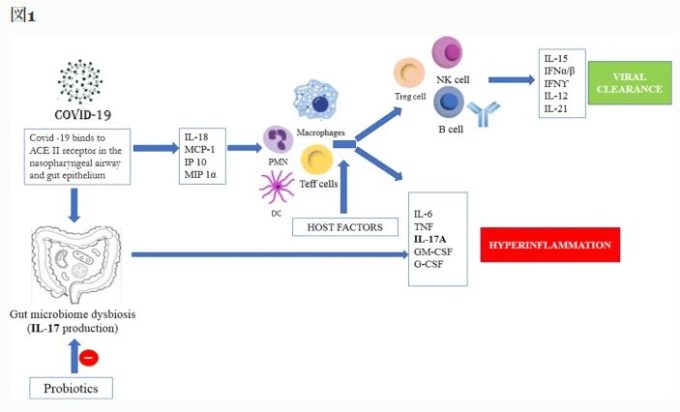
図1
COVID-19に感染した宿主が関与するメカニズム。プロ炎症性サイトカインやインターフェロンが放出され、ウイルス細胞の翻訳が抑制されることで、宿主免疫応答の一部としてウイルスクリアランスが誘導され、隣接する上皮細胞で抗ウイルス状態になる。ウイルスクリアランスは、宿主の免疫状態に応じて肺上皮および腸上皮で起こる。
しかし、プロバイオティクスの摂取は、様々なシグナル伝達経路を介して腸内の免疫応答を調節することで炎症を改善し、SARS-CoV2に起因する腸内環境異常を改善し、患者の回復を早めることができる。ACE II、アンジオテンシン変換酵素II、PMN、多形核顆粒球、DC、樹状細胞、TEFF細胞、Tエフェクター細胞、Treg細胞、調節性T細胞、NK、ナチュラルキラー
腸管免疫の強化に伴い、プロバイオティクスの消費はまた、リスクを減少させたり、呼吸器系の健康感染を修正することができるかもしれない(Wang er al)。 プロバイオティクスは気道のT調節応答を高めることで肺免疫を刺激する。LABは腸から肺へと直接循環に入り、異なる免疫調節作用を発揮する。乳酸菌の経口摂取は、全身的にサイトカインプロファイルを変調させることができる(Mortaz et al 2013)。
別の研究では、Lactobacillus GGおよびLb. casei株、Shirota(LcS)およびDN114001は、インフルエンザを伴う消化管および呼吸器管の微生物感染症を予防および治療することができることが示された(Mortaz et al 2013)。高齢者と子供の両方を対象としたコミュニティ研究では、プロバイオティクスLb. paracasei、Lb. casei 431、Lb. fermentum PCCは、血中のIFN-gと腸内のsIgAのレベルを上昇させることで、インフルエンザや呼吸器感染症の発生、期間、症状を減少させる可能性があることが示されている(Zhang er al)。 2018)。
IFN-gはマクロファージの殺菌機能を誘導し、B細胞のオプソナイジング活性を誘導し、適応介在性免疫につながる補体固定抗体を増加させる(Marshall et al 2018)。ビフィズス菌および乳酸菌の摂取は、子供および若年層の上気道感染症および下気道感染症を改善することが判明した(Rautava er al)。 2009; Smith er al)。 2013)。ビフィドバクテリウム・ブレベ・アグメンテーション抗インフルエンザIgGの摂取は、マウスの呼吸器感染症をインフルエンザから保護することに成功した(Yasui et al 1999)。
免疫不全高齢者は、健康な成人や高齢者に比べて、腸内細菌の多様性が低く、Firmicutes、Bifidobacteria、Clostridium、Faecalibacterium、Prausnitzii、Blautia coccoides-Eubacterium rectalの数が少なく、EnterobacteriaceaeとBacteroidetesの出現率が高い(O’Toole and Claesson. 2010)。FirmicutesとBacteroidetesは、健康な個体における全腸内細菌叢の93%を象徴する(Rondanelli er al)。2015)。
腸内細菌の数とその組成は、年齢の上昇とともに減少し、転化性嫌気性菌およびグラム陰性菌(主にEnterobacter)の数が誘導され、粘膜アーキテクチャが減少する。このような微生物組成の変化は、生活環境、栄養失調、健康状態、抗生物質や非ステロイド性抗炎症薬(NSAIDs)などの薬物投与の違いなどによって起こる(Mäkivuokko er al)。 NSAIDsを服用している18歳の高齢者を対象とした16S rDNAシークエンシングでは、Firmicutesの減少やBacteroidetesの増加など、重要な微生物叢の変化が示された(Mäkivuokko er al)。 2010)。
腸管通過時間はまた、年齢の上昇と健康状態にも依存する。免疫不全の対象者では、健常者に比べて腸管通過時間が長く、便中の細菌細胞量が少ない(Patel er al)。 したがって、腸管内腔内の微生物配列の変化は、高齢者では若年者よりも免疫系機能の低下や消化管感染症の発症率の高さにつながる可能性がある。加齢に伴う主な免疫学的変化は、BおよびT細胞によって媒介される免疫応答の効率の低下を伴う(Rondanelli er al)。 2015)が、これは、CD3+ TおよびCD8+ Tとともに末梢血中のリンパ球の数が年齢の上昇とともに減少するためである(Pu er al)。 2017)。
加齢は、自然免疫応答と適応免疫応答の両方に影響を与える。高齢者の外観は、ファゴサイトーシスの減少、細胞移動の変化、細胞集団と数の変化、および感染に抵抗するための効力を減少させた抗体産生の減少のような免疫学的能力を欠いている(Patel et al 2013)。適切なプロバイオティクスは、高齢者の免疫力を有意に高めることができる(Hamilton-Miller 2004)。
適切な栄養食習慣を持つ改変された食事の投与は、微生物群集を変調させる可能性がある。プロバイオティクスの使用は安全であり、様々な高齢者の障害を予防または治療するための有益な提供である(Blaut er al)。 2006)。Bif. lactis DN173010とLb. casei Shirotaの高齢者の治療の効率は、酪酸、プロピオン酸、乳酸のような短鎖脂肪酸の産生に責任があり、腸管通過時間を減少させることができる大腸の蠕動運動を増加させる大腸pH値を減少させた(Patel et al 2013)。
Lb. paracasei N1115を補充したヨーグルトを12週間経口投与した研究では、T細胞免疫の刺激により中高年の上気道感染症(URTI)のリスクを有意に減少させることができ、対照群と比較して被験者のURTIの頻度を有意に減少させることができた(Pu et al 2017)。プロバイオティクス株Lb. casei DN-114 001を含む発酵乳製品の投与は、対照群と比較して、気道の一般的な感染症(CID)、特に高齢者の鼻咽頭炎の持続時間を減少させる可能性があった(Guillemard et al 2010)。
プロバイオティクス乳酸菌GGは、アトピー性湿疹に関連するアレルギー反応を有意に調節するのに役立つ(Ozdemir and Goksu Erol 2013)。Harataら(2010)は、ラクトバチルスGGの鼻腔内スプレーがH1N1インフルエンザウイルス感染症に対するマウスの呼吸器免疫系を調節することを研究した。プロバイオティクスはまた、人工呼吸器関連肺炎のチャンスのリスクを減らすために責任がある;健康な人と病気の人と40〜60%のウイルス感染慢性閉塞性肺疾患(COPD)の他の呼吸器感染症は、プロバイオティクスの投与によって防止されている(Mortaz et al 2013)。
プロバイオティクスの摂取は、小児の呼吸器感染症リスクを低下させる(Araujo et al 2015)。典型的な上気道感染症および特定のタイプのインフルエンザには、扁桃腺、咽頭、喉頭、および副鼻腔が含まれる(Eccles er al)。 2007; Thomas and Bomar 2020)。重篤な上気道感染症の適応症としては、鼻水、頭痛、咳、鼻づまり、喉の痛み、微熱、くしゃみ、顔面圧迫などが挙げられる(Van Riel er al 2006)。
プロバイオティクスの利用は根本的に基礎的な風邪の危険性を減少させ、呼吸器感染症の症状の持続時間を減少させる(Wang er al)。 2016)。さらに、プロバイオティクスは腸内で競争的にコロニー化して病原体を排除し、腸のバリア機能と透過性を調節する重要な役割を示した。先に説明したように、プロバイオティクスが好中球、白血球、ナチュラルキラー細胞の数と活性を増加させることができることが示されている。
ある研究では、プロバイオティクスはインターロイキン(IL)-10の発現を調節し、腫瘍壊死因子-a、IL-1b、IL-8などの炎症性サイトカインの発現を低下させ(Oliva er al)。2012)、唾液性免疫グロブリンAレベルを上昇させ、バクテリオシンを産生し、最終的には抗菌活性を発揮することが示された(Fooks and Gibson 2002)。
あるメタアナリシスでは、Lb. rhamnosus GGの投与がRTIを予防することが示された(Liu er al)。 別のメタアナリシスでは、ラクトバチルス株とビフィズス菌株を用いて、大人とグループ化して検査に拘束された子供の呼吸器疾患エピソードの期間に対するプロバイオティクスの有効性が評価された(King er al)。
Tabbersら(2011)は、Bifidobacterium animalis subsp. lactis株BB-12を用いた院内感染の治癒を示した。BioGaiaの株L. reuteri DSM 17938は、6ヶ月から3歳までの子供の上気道感染および胃腸障害から保護することが示されている(Gabryszewskiら(2011))。
亜鉛のバイオアベイラビリティと免疫系
細胞の代謝過程の大部分を占める亜鉛は、金属酵素の基本的な補酵素として利用されている。それは、特に免疫細胞(Hojyo and Fukada 2016; Read er al)。 2019)、膜の完全性、DNA合成、および細胞の増殖に不可欠であることがわかっている。亜鉛はさらに、多数の感染症に対する宿主の反応の改善を支援し、宿主の恒常性の維持に重要な役割を想定している(FukadaとKambe 2014)。
亜鉛の投与は、T細胞を介した機能の改善、IL-2 mRNAレベルの増加、プロ炎症性サイトカイン、DNA、TNF-α、脂質酸化の産生を減少させることが示唆されている(Barnett er al)。 亜鉛が利用できないことは、細胞免疫の阻害と相関しており、亜鉛の欠乏は、BおよびTリンパ球、特にCD4+リンパ球の数を減少させ、Th1サイトカインの活性化を減少させることが観察されている。
また、亜鉛は細胞膜を安定化させる作用もあり、その欠乏は腸粘膜を混乱させ、ブラシボーダー酵素を減少させ、サイトカイン産生、細胞内殺傷、貪食による粘膜透過性、マクロファージ機能、腸内水分分泌を増加させる(Shankar and Prasad 1998)。
急性呼吸器感染症の患者を対象とした経口亜鉛補給のメタ分析では、風邪の症状と感染期間の短縮が観察された(Science er al)。 肺炎を持つ子供への亜鉛の補給に関する別の研究では、病状の重大な減少が示された(RerksuppapholとRerksuppaphol 2019)。亜鉛は、ウイルスプロテアーゼを阻害するのに役立ち、ウイルスの付着、感染、コーティングなどの物理的プロセスに干渉する(リード et al 2019)。
呼吸器上皮バリアはタイトジャンクションと接着ジャンクションを含み、ここではE-カデヘリンとβ-カテニンが主要な膜貫通分子として作用する。亜鉛の欠乏は、E-カデヘリンおよびβ-カテニン分子のタンパク質分解を引き起こし、上部および肺胞肺上皮細胞を横切る漏出の増加につながる(GammohおよびRink 2017)。
亜鉛枯渇はまた、ケモカイン産生を誘導し、最終的に肺疾患を引き起こし、破壊されたタイトジャンクションの周りに放棄された好中球の移動を誘導する。亜鉛は、単純ヘルペスウイルス(HSV)や非伝染性ライノウイルスを含むいくつかのウイルス性呼吸器感染症を抑制することができる(SuaraおよびCrowe 2004)。
呼吸器合胞体ウイルス(RSV)は、急性気道感染症(ARI)の最も重要なウイルス因子であり、試験管内試験(in vitro)培養条件下での細胞間の拡散を防止することにより、亜鉛塩によっても防止されている。ビタミンAと一緒に亜鉛を補給することは、下痢と同様に急性呼吸器疾患(ARI)の間引きに有効である(Cuevas and Koyanagi 2005)。
硫酸亜鉛を1日10~20mg補給することで、インドの小児における重症急性下気道感染症の治療失敗リスクが有意に減少することが示された(Basnet er al)。 別の研究では、グルコン酸亜鉛10mgを毎日摂取することで血漿中亜鉛濃度を上昇させると、急性下気道感染症の発症率が低下することが明らかになった(Overbeck et al 2008)。
亜鉛は、コロナウイルス、アルテウイルス、ライノウイルス、C型肝炎ウイルスを含むいくつかのウイルスのRNA依存性RNAポリメラーゼ活性を阻害することが報告されている(Kar et al 2019)。亜鉛を高バイオアベイラビリティな形で送達するために、プロバイオティクス株Lb fermentum SR4およびLb rhamnosus GG(LGG)を、亜鉛を蓄積する能力について研究した。
その結果、市販の無機物(ZnSo4)およびグルコン酸亜鉛の形態と比較して、SR4およびLGGによって、Znの高いバイオアベイラビリティがそれぞれ57%および48%までキレートされたことが示された(Lule et al 2020 te Velthuisら(2010)は、低濃度でのZn2+とピリチオン(PT)の組み合わせが、SARSコロナウイルス(SARS-CoV)の複製を阻害することを明らかにした。
1日あたり最大50mgの亜鉛の摂取は、ウイルス感染に対する宿主の抵抗力を向上させることにより、パンデミックCOVID-19ウイルスの複製を抑制することが示された研究がある(Razzaque 2020)。しかし、亜鉛は、生得的および後天的(体液性)抗ウイルス応答の活性化を介して、直接的な抗ウイルス機能を維持する(Maywald et al 2017;Read et al 2019)。
ウイルス感染症と戦うためのビタミンDの役割
皮膚に優勢に存在するビタミンDは、細胞間カルシウム輸送を活性化することにより、腸および腎臓でのカルシウム再吸収に重要である。ビタミンDの活性型である1、25-ジヒドロキシビタミンD(1、25OHD、VDRとも呼ばれる)ホルモンは、特に免疫機能と炎症において遺伝子発現を調節している(Gunville er al)。
免疫系のビタミンDの働きは、タイトジャンクション、ギャップジャンクション、アドヒアレンスジャンクションの維持を助けます。ウイルス性疾患は接合部の完全性に影響を与え、それによって宿主の感染率を高める(Rossi er al 2020)。ビタミンDの欠乏は、25-ヒドロキシビタミンD(25OHD)レベルを低下させ、それによって宿主に影響を与える可能性がある。プロバイオティクス細菌は、ビタミンを産生し、腸内マイクロバイオータおよび免疫系の組成にポジティブに影響を与えることを特徴としている(Hill er al)。
プロバイオティクス細菌は、主にラクトバチルス属およびビフィドバクテリウム属に属し、ビタミンの送達に対して作用し、欠乏から保護することにより、多くの健康上の利点を与える(Jayawardena er al)。 脂溶性ビタミン、特にビタミンDの高い食事摂取量は、ヒトの病原体を主に構成するα-プロテオバクテリアの微生物多様性の低下と関連している(Steinert et al 2020)。
研究は、ロタウイルス(Zhao er al)。 2019)、デング熱(Martinez-Moreno er al)。 2020)およびインフルエンザ(Urashima er al)。 2010)などのウイルスによって引き起こされる感染症との戦いにおいて、ビタミンDの直接的または間接的な意義を実証している。COVID-19では、高齢者の症例死亡率(CFR)の上昇は、加齢に伴う血清25OHD濃度の低下に起因する可能性がある(Razdan et al 2020)。
ビタミンDの産生量の減少は、太陽の下で過ごす時間が少なくなったために皮膚の7-デヒドロコレステロールのレベルが低下した結果である。ビタミンDの免疫調節作用は、自然免疫系と適応免疫系の両方に作用し、それによって感染症や致死のリスクを減少させる。COVID-19患者では、自然免疫系は、ウイルスや細菌の感染に反応して、プロ炎症性サイトカインと抗炎症性サイトカインを生成する(Huang er al)。 2020)。
ビタミンDは適応免疫のモジュレーターである。1、25OHDは、炎症性サイトカインIL-2およびインターフェロンγ(INFγ)の産生を抑制することにより、Tヘルパー細胞1型(Th1)介在性応答を抑制する(Lemire et al 1985)。さらに、1、25OHDは、Tヘルパー2型(Th2)細胞によるサイトカイン産生を促進し、これは、多数の細胞型によって媒介される作用を補完することにより、Th1細胞の間接的な抑制を増強するのに役立つ。
さらに、1、25OHDはT調節細胞の誘導を促進し、それによって炎症過程を抑制する。COVID-19感染は、炎症を抑制するTh2サイトカイン(例えば、インターロイキン4および10)の分泌増加を開始したが、これはSARS-CoV感染とは異なる(Huang er al)。 SARS-CoVおよびMERS-CoVは、プロ炎症性サイトカインストームを産生することでCoV感染とは異なる。
本項では、CoVおよび肺炎を含む急性呼吸器感染症(ARTI)からの感染および死亡のリスクを低減するための、より高い25OHD濃度の役割を擁護する。ARTIのピークシーズンは一般的に25OHD濃度が最も低い時期である。したがって、25OHD濃度を40~60ng/ml以上に上昇させるために、ビタミン産生プロバイオティクスによるビタミンDの補給を定期的に開始することが考えられる。
しかし、COVID-19に感染した患者の治療のためには、より高い用量が有用であるかもしれない(Jeyaraman et al 2020)。プロバイオティクスによるビタミン補給については、男女同数のボランティアからなる健康な人の大集団を用いて評価する必要がある。これにより、感染症時の免疫反応の違いも明らかになるだろう。2020年3月23日、元疾病対策予防センター長のトム・フリーデン博士は、COVID-19パンデミックに対抗するためにビタミンDを使用することを提案している(https://www.foxnews.com/opinion/former-cdc-chief-tom-frieden-coronavirus-risk-may-be-reduced-with-vitamin-D)。
プロバイオティクスとウイルス感染症のコントロール
免疫力が低下した患者は、腸内細菌叢の異常に遭遇し、それによって腸管内に病原体が蓄積されていく。腸内細菌による感染症は、治療が最も困難で困難なものの一つであり、生命を脅かす可能性を秘めている。ヒトにおけるウイルス感染症の場合、気道上皮は入口ゲートである。
宿主における最初のレベルの保護は、柱状上皮の繊毛の運動を介した粘性粘液によるものであり、気道分泌における分泌性免疫グロブリンAの限界である。樹状細胞(DC)上のウイルス感染の影響は、CD4+およびCD8+細胞の活性化と特定のTおよびB細胞媒介免疫のその後の開発との反応のカスケードにつながる。
プロバイオティクスは、有益な細菌であることに加えて、抗ウイルス活性を持っている。プロバイオティクスは、天然の免疫増強剤として作用するため、代替品として選ばれている(Lakshmi er al)。 プロバイオティクスとその代謝物はまた、細胞の状態を変化させ、自然免疫および/または適応免疫を刺激することで、間接的にウイルスに干渉する可能性がある。
それらは、(1)プロバイオティクスとウイルスとの直接的な相互作用、(2)抗ウイルス阻害性代謝物の産生、および(3)免疫系の刺激によって抗ウイルス活性を発揮する。乳酸菌(LAB)およびそのバクテリオシンは、抗ウイルス剤として機能する(Al Kassaa er al)。 LABは、エキソ多糖類(EPS)を合成することが知られており、これは、免疫調節、抗腫瘍、抗バイオフィルム、および抗酸化活性などの健康上の利益を人に与える可能性がある。
そのような株の一つである Lb. plantarum CRL1506 は、経口投与により、炎症を媒介とする組織損傷を減少させ、抗ウイルス特性を示した(Yang er al)。 Lb. plantarum の代謝物の分析では、主に糖類が存在することが示されており、主要な抗ウイルス活性物質は多糖類である可能性が示唆されている。また、これまでの研究では、乳酸菌による上皮のコロニー化がウイルスの表面への付着を立体的に阻害することが示されている。
Callahanら(1991)は、硫酸化多糖類が標的細胞へのHIVの付着を阻害し、従って宿主へのウイルスの侵入をブロックすることを報告した。同様に、枯草菌OKB105とサーファクチンは、ウイルス粒子を吸着し、競合阻害によりウイルスの付着をブロックすることで、ブタ腸管上皮細胞に侵入したTGEVに対して抗ウイルス活性を有することが確認されている(Wangら(2017))。
肺炎ウイルスに対するLb. plantarumまたはLb. reuteriのプロバイオティクスおよびパラプロバイオティクスは、顆粒球のリクルートおよび複数のプロ炎症性サイトカインの発現を減少させ、ウイルスの回復を減少させた。このことは、作用機序がTLRに依存しないことを示唆している(Gabryszewski er al)。
健康な人を対象としたLb. plantarum HEAL 9とLb. paracasei 8700:2の臨床試験では、一般的な風邪の感染症と咽頭症状のリスクが減少した(Berggren er al)。 小久保ら(2019)の研究では、ラクトコッカス・ラクティスLCの血漿が形質細胞樹状細胞の活性化に影響を与えることが示されている。これは、筋肉の変性遺伝子や疲労制御サイトカインであるトランスフォーミングβ成長因子の濃度を減衰させる。マウスの肺炎治療時のLb.ラムノサスM21は、I型ヘルパーT細胞の代表的なサイトカインであるインターフェロン-γおよびインターロイキン-2のレベルの増加を示した(Song et al 2016)(表1)。
プロバイオティクスの応用は、動物実験で臨床的な可能性を実証している。経口または経鼻投与によるラクトバチルス属の様々な株およびビフィドバクテリウム属の株は、インフルエンザを含むウイルス感染症に対する感染症状の抑制を示している(Kawahara et al 2015; Zolnikova et al 2018)。これらは、ウイルス負荷力価を低下させ、肺実質中のTヘルパー細胞を増加させる。別の研究では、Lb.ラムノサスおよびBif.ラクティスの同時投与は、気管支肺胞液中のIFN-yおよびインターロイキン(IL)-4、IL-10およびIL-6を増加させ、貪食細胞の活性を増加させた(Gill er al)。 2001; Di Cerbo er al)。 2016)。
その結果、プロバイオティクスはウイルス核酸の破壊を引き起こし、ウイルスの複製を制限することができる。しかしながら、SARS、MERS、およびCOVID-19に対する予防または治療の選択のための、プロバイオティクスの特性に関する疑問は、依然として未解決のままである。COVID-19患者の管理のための補助療法としてのプロバイオティクス投与の臨床試験に焦点を当てた研究が必要である。
表1 ウイルス感染症に対する免疫応答の刺激におけるプロバイオティクスのリストとその作用機序
| 微生物 | 感染/ウイルスの種類 | 作用機序 | 参考文献 |
|---|---|---|---|
| ポンド。プランタルム NCIMB 8826 | RSV、ニューモウイルス、 | TLR依存性炎症反応 | Al Kassaa et al。2014年 |
| ポンド。カゼイ DN-114001 | RTI、鼻咽頭炎、インフルエンザ | 強化されたディフェンシン発現と自然免疫 | ギルマード他 2010 |
| Lactobacillus rhamnosus M21 | 肺炎、インフルエンザ | インターフェロン-γとインターロイキン-2を増加させる | ソン他 2016年 |
| ビフィズス菌乳児 BB-12 | URTI | IL-17阻害効果 | スミス他 2013 |
| ビフィズス菌 | URTI | ウイルス、抗インターロイキン17の複製を防ぐ | スミス他 2013 |
| ラクトバチルスプランタラム | 胃腸炎コロナウイルス(TGEV) | 顆粒球を減少させ、ウイルスの回収を減らす | ヤン他 2017年 |
| ラクトコッカスラクティス JCM 5805 | RTI、一般的な感染症 | 形質細胞様樹状突起細胞を活性化する | 小久保ほか 2019年 |
| ラクトバチルスプランタルム CRL1506 | 胃腸炎コロナウイルス(TGEV) | 炎症を介した組織の損傷を軽減 | ヤン他 2017年 |
| 枯草菌 OKB105 | 胃腸炎コロナウイルス(TGEV) | 競合阻害によりウイルスの付着を阻害 | 王ら。2017年 |
結論
乳酸菌やビフィズス菌を含むプロバイオティクスの安全性は、多くの臨床研究によって実証されている。現在の証拠は、プロバイオティクスとプロバイオティクス由来の因子が、免疫の健康を含む宿主のホメオスタシスの健康上の利点と規制を強化するために有望であることを示している。
ウイルス感染からの保護は、プロバイオティクスの作用の利点として示されている。プロバイオティクスは、宿主の免疫応答の変調を介してその有益な効果を発揮し、腸の恒常性を維持し、インターフェロンを産生することにより、ウイルスによって誘発されたサイトカインストームを抑制する。
いくつかの無作為化比較試験では、プロバイオティクスの投与がCOVID-19患者の人工呼吸器関連肺炎を阻止できることが示されたが、死亡率の減少における有効性は不明のままである。乳酸菌とビフィズス菌は有望な有益な効果を示しており、それらの投与はSARS-CoV2感染によって誘発される腸内環境異常を克服することができる。したがって、プロバイオティクスの投与により腸内細菌叢を変化させ、宿主の免疫状態を改善することは合理的である。
しかし、免疫刺激やサイトカインの発現は菌株に依存しており、プロバイオティクス菌群によって異なる可能性がある。COVID-19とその併存菌の治療アプローチの一つとして、腸内マイクロバイオータのモジュレーションに対する新規かつより標的を絞ったアプローチが必要になると思われる。
プロバイオティクスの研究が次のステージに進むにつれ、有効な臨床利用のためには、それぞれのプロバイオティクスの作用機序を解明することが求められている。これは、個別化医療への潜在的な需要につながる。今後の臨床試験では、プロバイオティクスを導入した際のベースラインとなる個々の微生物叢とその遺伝的パターンを明らかにし、ヒトの疾患予防や治療におけるプロバイオティクスの応用の可能性を明らかにすることができるかもしれない。
さらに、トランスレーショナルリサーチと臨床研究の一環として、宿主におけるプロバイオティクスを含む治療法の評価のためにバイオマーカーが同定されることになる。このことは、プロバイオティクスによる免疫刺激が、潜在的にヒトのウイルス感染や病気に対する抵抗力の長期化を促進することを確かなものとしている。