Role of phosphatidylcholine-DHA in preventing APOE4-associated Alzheimer’s disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6338661/
要旨
ω-3脂肪酸ドコサヘキサエン酸(DHA)の食事およびサプリメント摂取は、アルツハイマー病のリスクを低下させ、症状を改善する。アポリポ蛋白E(APOE)4対立遺伝子は、年齢を除く散発性アルツハイマー病の最も強い危険因子である。APOE4キャリアは、魚に存在するDHAによく反応するが、栄養補助食品にはあまり反応しない。この多様な反応の背後にあるメカニズムは不明のままである。
違いは、魚がリン脂質の形でDHAを含んでいるのに対し、魚油のサプリメントは含まれていないことであると仮定している。これは、DHAが非エステル化DHA(遊離DHA)またはリゾホスファチジルコリンDHA(DHA-lysoPC)と呼ばれるリン脂質の形態に代謝されるかどうかに影響を与える。
遊離DHAは受動的拡散を介して血液脳関門(BBB)の外膜リーフレットを介して輸送され、DHA-lysoPCはメジャーファシリテータースーパーファミリードメイン含有タンパク質2Aを介してBBBの内膜リーフレットを介して輸送される。
APOE4キャリアはBBBの外膜リーフレットの故障の結果として、遊離DHAの脳内輸送に障害があるが、DHA-lysoPCの障害はないことを提案し、それらをアルツハイマー病のリスクが高くなる。リン脂質の形でDHAの食事源は、それによってアルツハイマー病のリスクを減少させ、DHA-lysoPCの血漿レベルを増加させるための手段を提供する可能性がある。
キーワード
ω-3脂肪酸、認知症、アミロイドβプラーク、タウのもつれ、リン脂質DHA
アルツハイマー病は、進行性の記憶喪失、空間見当識障害、認知機能障害、行動の変化を特徴とする神経変性疾患である。散発性アルツハイマー病の主な危険因子は加齢であり、有病率は65歳以降5年ごとに約2倍になる。85歳以上の個人の約3分の1はアルツハイマー病を持っている(1)。遅発性アルツハイマー病の主要な遺伝的危険因子は、APOE4と呼ばれるアポリポタンパクE(APOE)遺伝子の変異である。
ヒトAPOE遺伝子は、3つの一般的なAPOEアイソフォームをもたらすいくつかの一塩基多型を含んでいる。APOE2,-3,-4である。アルツハイマー病を発症する全個体の約65~80%が少なくとも1つのAPOE4対立遺伝子を持っており、これは全世界の人口の約25%に見られる特徴です(2)。APOE4対立遺伝子を持たない人と比較して、1つのAPOE4対立遺伝子を持つ人はアルツハイマー病リスクを2-3倍に増加させ、2つのAPOE4対立遺伝子を持つ人はリスクを15倍にも増加させる(3)。しかし、APOE4対立遺伝子を持っているからといって、必ずしもアルツハイマー病を発症するとは限らない。APOE4対立遺伝子を持つ人の中には決してアルツハイマー病を発症しない人もいれば、アルツハイマー病を発症する人の中にはAPOE4対立遺伝子を持たない人もいる(4)。APOE4対立遺伝子の存在はアルツハイマー病と認知障害のリスクを有意に高くするが、早期の認知と知能の改善と関連しており、APOE4対立遺伝子は拮抗的多能性の一例であることを示唆している(5-7)。
APOEは末梢および脳組織の両方に広く分布しており、LDL受容体を介したメカニズムを介して脂質およびコレステロールの輸送に参加している。末梢APOEは主に肝臓で合成され、組織への脂質・コレステロール輸送を調節し、血漿中の逆コレステロール輸送に関与している。末梢組織では、APOEのアイソフォームが脂質代謝に様々な影響を与えている。正常な脂質恒常性の基準とされるAPOE3アイソフォームは、他のアイソフォームを比較する際の基準となる。APOE2アイソフォームは、APOEタンパク質の発現増加、血漿中トリグリセリドの増加、血漿中コレステロールの減少と関連している。APOE4アイソフォームは、APOEタンパク質の発現量の減少と血漿中コレステロールの増加と関連している。脳内APOEは主にアストロサイトによって合成され、神経細胞への脂質およびコレステロールの輸送を制御している。脳内では、APOE2および-3アイソフォームがAPOE4よりも2~4倍高い値でニューロンに蓄積され、APOE4の脳内での機能が低下する(8)。
アルツハイマー病の病理学的ホールマーク
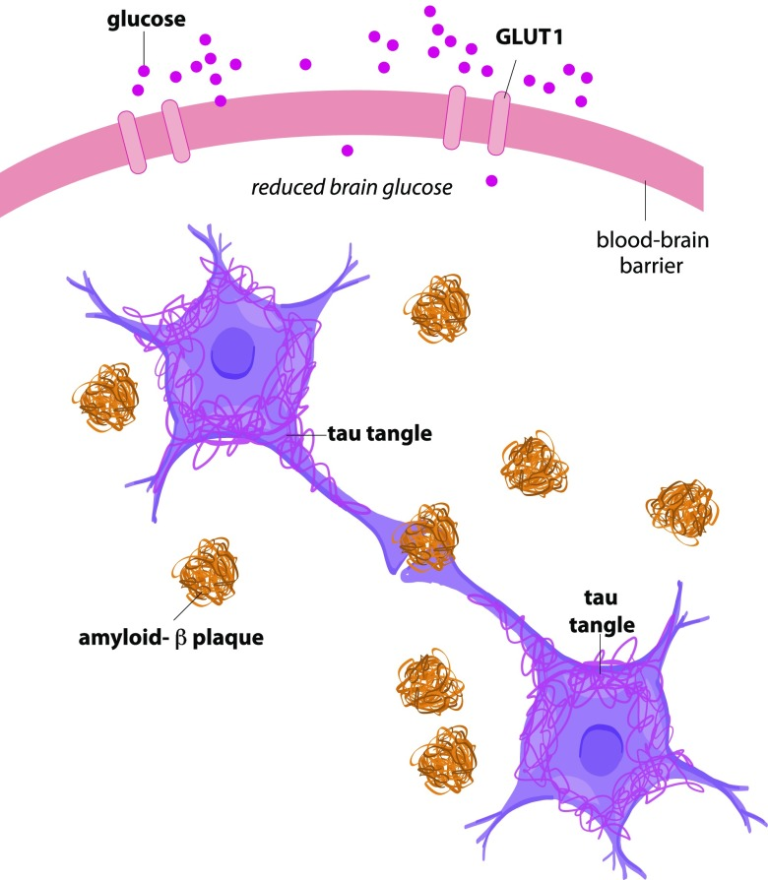
アルツハイマー病の病理学的特徴には、細胞外アミロイドβ斑、細胞内神経原線維(タウ)のもつれ、脳内のグルコース取り込みの低下などがある(図1)。これらの特徴の要約は、アルツハイマー病の進行を促進する疾患プロセスを理解するための枠組みを提供する。
図1 アルツハイマー病の特徴
アルツハイマー病は、GLUT1トランスポーターとグルコース取り込みの低下、ニューロン内部のタウのもつれ、ニューロン間の細胞外空間のアミロイドβプラークと関連している。タウ抗原とアミロイドβプラークの両方がニューロンのシナプス伝達を阻害する。これらの3つの重要な病態がアルツハイマー病の進行を導く。
細胞外アミロイドβプラーク
正常な老化は、脳組織における活性酸素の蓄積と炎症と関連しており、脳の常在免疫細胞であるミクログリア細胞の活性化につながる。ミクログリア細胞は、脳の微小環境の恒常性維持に不可欠な役割を果たしている。急性の損傷を受けた脳におけるその活性化は、炎症や神経毒性を調節する。しかし、アルツハイマー病の設定では、ミクログリア細胞は、アミロイド-β42と呼ばれる42-aaペプチドの存在によって慢性的に活性化され、これは完全長アミロイド-βタンパク質の切断に起因する(9)。慢性的なミクログリアの活性化は、アミロイドβプラークの産生を促進し、持続的なミクログリアの活性化とアミロイドβ42のさらなる産生という悪循環を開始する(10)。ニューロン外でのアミロイドβプラークの凝集は、ニューロン間のシナプスを破壊して破壊し、シナプス伝達を阻害し、アルツハイマー病に伴うニューロン細胞死とニューロン退縮を誘発する(図1)。
アミロイドβプラークは、主にグリンパティック系を介して脳から除去されるが、それよりも少ない程度ではあるが、APOEを介するメカニズムを介して除去される。グリンパティック系は睡眠時に活性化され、その間に脳脊髄液が脳内に拡散し、アミロイドプラークを含む老廃物を運び出す(11)。睡眠の質の低下や睡眠不足は、グリンパティック系の活性化を妨げ、アミロイドプラークの蓄積を促進し、特にAPOE4陽性者では、APOE受容体を介したアミロイドペプチドの取り込みを介してアミロイドペプチドを消去することができない(12)。APOE介在性のクリアランスでは、APOEはアミロイドβ42ペプチドと結合し、APOE受容体を介して神経細胞間の細胞外空間からクリアする。しかし、APOE4型はAPOE3型に比べてアミロイドβ42ペプチドとの親和性が20倍も低いため、アミロイドβプラークを脳外に除去することができない(13)。
細胞内神経原線維のもつれ
アミロイドβが神経細胞外で凝集するのに対し、微小管関連タンパク質であるタウは、アルツハイマー病患者の脳では神経細胞内で凝集して神経原線維(タウ)のもつれを形成する(図1)。タウのもつれが形成されると、軸索内の微小管の安定性が失われ、ミトコンドリア、脂質、細胞内代謝物を輸送する主要なシステムが破壊される(9)。細胞エネルギーはそれによって減少し、新しいシナプスの形成が停止し、アルツハイマー病の初期の特徴である記憶障害をもたらす。最終的には、エネルギーレベルは以前に形成されたシナプスを維持するのに十分ではなく、長期的な記憶障害、神経細胞の死、脳の萎縮につながり、これらはすべてアルツハイマー病に関連している。
脳内グルコース摂取量の減少
アルツハイマー病では脳内グルコースの取り込みと代謝が障害されている(図1)(14)。代謝プロファイリングは、APOE4変異に特異的に関連するアルツハイマー病のサブタイプが脳内グルコース利用の低下と関連していることを示している(15)。1または2のAPOE4対立遺伝子のキャリアは、アルツハイマー病の臨床的特徴を示す数十年前に脳内グルコース取り込みの減少を示し、散発性アルツハイマー病の患者は、アミロイド前駆体タンパク質、プレセニリン-1,またはプレセニリン-2などの常染色体優性アルツハイマー病変異を持つ患者で観察されるのと同等の脳内グルコース取り込みの減少およびアミロイドプラーク沈着の増加を示している(16,17)。
グルコースは、もっぱら血液脳関門(BBB)に常駐するグルコーストランスポーター(GLUTs)を介して脳に入る。脳内グルコース代謝は厳密に制御されており、ニューロンはグルコース合成または貯蔵ができない。脳内の主要なGLUTはGLUT1と-3であり、これらはグルコース取り込みのためにインスリンに依存せず、インスリン感受性ではない(16,18)。GLUT1と-3の両方が顕著にAPOE4対立遺伝子を持つアルツハイマー病患者の脳では、APOE4対立遺伝子を持たない健康な人と比較して減少している(18-20)。マウスでは、GLUT1欠損は脳内グルコース取り込みを低下させ、アミロイドプラークの蓄積を促進し、アミロイドクリアランスを低下させ、アルツハイマー病と一致する広範な神経細胞の損失と機能障害を引き起こす(21)。
脳内グルコースの取り込み障害もまた、タウのもつれの形成に原因となる役割を果たしている。脳内グルコース摂取量の低下は、タウタンパク質の翻訳後修飾であるO-リンクドN-アセチルグルコサミン(O-GlcNAcylation)の付着を障害し、タウの過リン酸化とそれに続くタウのもつれの形成につながる(22-24)。脳のグルコース代謝が低下している状況での高リン酸化タウの増加のための可能性のある説明は、GLUT1と-3トランスポーターの低レベルであるかもしれない。GLUT1と-3の減少は、50%(22,25,26)と同じくらいO-GlcNAcylationを減少させ、タウの過リン酸化とアルツハイマー病脳(18)でのタウのタングルの量を増加させる。さらに、タウのタングルの形成を促進する高リン酸化タウは、アルツハイマー病を持つ個人の脳内の非リン酸化タウよりも4倍少ないO-GlcNAcylationを示している(25)。これらのデータは、脳内への正常なグルコース輸送がGLUT1および-3トランスポーターに依存しており、タウタンパク質の高リン酸化、タウタングルの形成、およびその後のアルツハイマー病の発症を防ぐのに役立つ可能性があることを示唆している。
DHAが3つの主要なAD病理学に影響を与える
ドコサヘキサエン酸(DHA)は、脳内脂質の約30%を占める必須のω-3脂肪酸である。DHAの量が少ないとアルツハイマー病に特徴的な3つの病態を促進するのに対し、正常または高濃度ではそれらを予防または改善する(図2)。DHAは植物由来のω-3脂肪酸から合成することができるが、この代謝経路はヒトでは効率的ではない。このように、ヒトの脳内のほとんどのDHAは、海洋の食事またはサプリメントのソース(27)から供給されている。
DHAのサプリメントは、アミロイド-βプラークの産生、凝集、および毒性を減少させ、中等度の認知症やアルツハイマー病(28-30)を持つ個人でプラーククリアランスを促進する。さらに、DHA補給はタウのもつれを減少させる。6月のための補充DHAの約2グラムを受けたアルツハイマー病患者は、脳脊髄液中のリン酸化タウタンパク質の減少量を示した(31)とDHAの補充を与えられた非ヒト霊長類は、減少したタウ病理学(32)を実証した。
最後に、DHAは細胞膜の重要な構成要素であるため、GLUT1トランスポーターを調節することにより、脳へのグルコースの輸送を促進する(図2)。ラットでは、DHAの欠乏はGLUT1トランスポーターを最大30%減少させるが(33,34)DHAの補給は、げっ歯類や霊長類以外のコントロールと比較して、GLUT1トランスポーターを37%増加させ、内皮細胞がより多くのグルコースを取り込むようになる(35,36)。
図2 DHAは脳内のグルコースの取り込みを調節し、アミロイドβプラークやタウのもつれの形成を防ぐ。
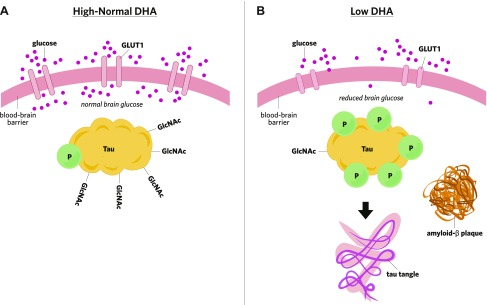
A)脳内のDHAはBBBでGLUT1を増加させ、脳内へのグルコース輸送を促進する。グルコースはタウタンパク質のO-GlcNAcylation(GlcNAc)に必要であり、タウのリン酸化を防ぐ。
B) 脳内のDHA濃度が低いとGLUT1トランスポーターの発現が低下する。その後、より少ないグルコースは、増加したタウリン酸化につながるタウのより少ないGlcNAcで、その結果、BBBを越えて輸送され、続くタウのもつれの形成。脳内グルコースの減少はまた、アミロイドβプラーク形成を促進する。
遺伝子-ダイエット相互作用:APOE4-DHA
十分な微量栄養素の状態、野菜摂取量の増加、十分な睡眠、身体活動などの健康的な食事と生活習慣因子は、APOE4対立遺伝子を持つ個人のアルツハイマー病リスクを減少させる(28-30, 37)。対照的に、過度のアルコール消費、低多価不飽和脂肪摂取、高飽和脂肪摂取、および喫煙などの不健康な食事および生活様式因子は、APOE4保持者のアルツハイマー病リスクを増加させる(38)。食事による魚の摂取もまた、APOE4保因者と非保因者の両方でアルツハイマー病の進行を遅らせる。魚介類を多く摂取しているAPOE4対立遺伝子を持つ患者では、グローバルなアルツハイマー病病理学、神経斑密度、およびアルツハイマー病診断スコアを含むアルツハイマー病に関連する指標において、脳神経病理学が改善されていることが示されている(39)。野生魚を含む複雑な食事とライフスタイルのプロトコルで治療されたアルツハイマー病患者(APOE4キャリアと非キャリアの両方)は、認知機能の低下の逆転を経験した(28, 40)。2件の研究では、魚の食事摂取はAPOE4キャリアには効果がなかったが、これらの研究では週に1食未満の魚が含まれており、ω-3脂肪酸の濃度が十分に高くない可能性がある(41, 42)。
APOE4キャリアの認知機能に対する魚の食事摂取の有益性は、DHA補給では観察されていない。複数の研究では、1日2gのDHAを補給すると、APOE4非キャリアにおけるアルツハイマー病の認知機能低下の進行が遅くなることが示されているが、APOE4キャリアには効果がない(43,44)。さらに、APOE4キャリアにおける魚類の多量の食事摂取で観察される脳神経病理学的に正の効果は、APOE4キャリアにおけるDHA補充では観察されない(39)。さらに、APOE4対立遺伝子を持つ個体では、DHA補給後にアミロイドβプラークがクリアされず、APOE4は脳内へのDHA輸送を損なうことから、遺伝子と食事の相互作用の可能性が示唆されている(45,46)。
DHAは、アルツハイマー病に関連する3つの主要な病態を予防または改善するために重要である。APOE4を持つ個人は、アルツハイマー病を発症するリスクが高く、脳へのDHA輸送の障害を示している。食事DHAは、アルツハイマー病の病理学を改善し、APOE4キャリアと非キャリアの両方でアルツハイマー病リスクを低減する一方で、DHAの補充は、非キャリアでのみアルツハイマー病の病理学を改善する。DHAが脳内に輸送されるメカニズムを解明することは、DHA補給への異質な反応を理解し、なぜAPOE4対立遺伝子が有意にアルツハイマー病リスクを増加させるのかを理解する鍵となるかもしれない。
魚にはリン脂質の形でDHAが含まれているのに対してサプリメントには含まれていないので、APOE4キャリアはサプリメントからのDHAではなく、魚からのDHAに反応することを示唆している。この形態の違いは、DHAが非エステル化DHA(遊離DHA)またはリゾホスファチジルコリンDHA(DHA-lysoPC)と呼ばれる特定のリン脂質形態に代謝されるかどうかに影響を与える。APOE4キャリアは、BBBの欠陥に関連している遊離DHA(しかし、DHA-lysoPCではない)で障害された脳の輸送機構を持っていることを提案し、それが原因でアミロイドβプラーク、タウのタングル、および低脳グルコースレベルの蓄積のアルツハイマー病のリスクが増加したそれらを置く。魚よりもリン脂質の形でDHAの量が多い食事源を列挙し、これらのソースにより、DHA-lysoPCの血漿レベルを増加させるための手段を提供することを示唆している。このような増加は、APOE4キャリアが遊離DHAの彼らの欠陥輸送をバイパスし、効果的に彼らの脳にDHA-lysoPCを提供することができ、それによってアルツハイマー病のリスクを低下させる可能性がある。
脳内へのDHA輸送
DHAは脳内に豊富に存在するにもかかわらず、神経細胞はそれを合成する能力を欠いており、アストロサイトは植物のω-3脂肪酸α-リノレン酸からDHAを合成することができるが、ほとんどのDHAは、食事で取得し、BBBを越えて血漿から脳に輸送されなければならない(47)。
DHAは、血漿中の2つの主要なプールに存在している:1)トリアシルグリセロール、コレステリルエステル、またはリン脂質にエステル化されたリポタンパク質の成分として、および2)アルブミンにバインドされている、いずれかの非エステル化遊離DHAとして、またはエステル化DHA-lysoPC(48)として。残りの55%がアルブミンに結合しているDHA-lysoPCでエステル化されているのに対し、ヒト血漿中のDHAの約45%は、アルブミンに結合した遊離DHAとして存在している(49)。アルブミンに結合した遊離DHAとDHA-lysoPCは、脳内に輸送されるDHAの唯一の形態である;しかしながら、それらは異なる輸送メカニズムを使用している(図3)。遊離DHAは、受動的な拡散を介してBBBの外膜リーフレットを介して輸送され、DHA-lysoPCは、メジャーファシリテータースーパーファミリードメイン含有タンパク質2A(MFSD2A)(図3)を介してBBBの内膜リーフレットを介して輸送される(50-52)(図3)。MFSD2Aは、BBB上の血管に並ぶ内皮細胞に選択的に存在する膜貫通型タンパク質である(50)。
図3 脳内への遊離DHAとDHA-lysoPCの輸送
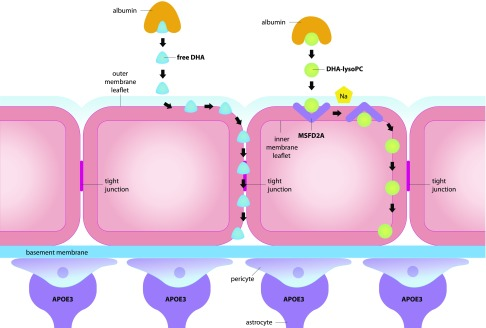
遊離DHAは血漿中のアルブミンから剥離し、受動的な拡散を介してBBBの外膜リーフレットに沿って輸送される。アストロサイトで産生されるAPOE3は、BBBの外膜リーフレットを無傷に保つタイトジャンクションを維持する役割を果たしている。DHA-lysoPCはアルブミンから剥離し、メジャーファシリテータースーパーファミリードメインを含むMFSD2Aを介してBBBの内膜リーフレットに沿って輸送され、ナトリウムの電気化学的電位を利用してDHA-lysoPCを脳に転送する。
DHA-lysoPCは、DHAの脳の好ましいソースであるように見える(50)。研究では、DHA-lysoPCは、遊離脂肪酸の形でDHAと比較して、若いラットや子豚の脳内で10倍高い量で蓄積することを示している(53,54)。DHA-lysoPCまたは遊離DHAの静脈内投与後、より多くのDHA-lysoPCは、遊離DHAよりも脳に輸送される(48,50,55,56)。MFSD2Aトランスポーターを欠くように設計されたマウスは、彼らの脳内の60%未満のDHAを持っている小さな脳を持っており、運動と認知障害(50)の様々なを示している。MFSD2Aトランスポーターの部分的または全体的な欠乏を持つヒトは、脳へのDHA-lysoPCの輸送が老化プロセス中に脳機能を維持するために重要であることを示唆している、年齢とともに徐々に悪化する脳機能の障害を持っている(57,58)。
DHA-lysoPCの前駆体であるホスファチジルコリンDHAの血漿中濃度は認知症の発症を予測する。すべての認知症症例の約70%はアルツハイマー病に関連している(59)。血漿ホスファチジルコリンDHA値が最高四分位の人は、APOE4対立遺伝子とは無関係に、下位3四分位の人よりも認知症リスクが47%低かった(59, 60)。さらに、血漿中リゾホスファチジルコリン濃度が低ければ、APOE4対立遺伝子とは無関係に、2-3年以内に軽度の認知症とアルツハイマー病の診断を90%の精度で予測した(61)。血漿リン脂質中のDHAレベルは、APOE4キャリアと非キャリアでは差がない(45)。これらのデータは、低レベルのホスファチジルコリンDHAとリゾホスファチジルコリンの両方が認知症とアルツハイマー病を予測し、APOE4の存在はこれらのいずれにも影響しないことを示唆している。
APOE4キャリアの脳内遊離DHA輸送の障害
複数の研究により、脳内に存在するAPOE4はタイトジャンクションの破壊と脳血管の減少によって証明されるように、BBBの完全性の破壊を引き起こすことが示されている(62-65)。脳内のアストロサイトによって産生されるAPOEは、LDL受容体関連タンパク質1を介してオクルーディン(タイトジャンクションの主要構成要素の一つ)を活性化することにより、BBBのタイトジャンクションの完全性を維持することに関与している(63)。しかし、アストロサイトにおけるAPOE4はオクルージンを活性化することができず、タイトジャンクションの分解やBBBの外膜リーフレットの破壊を引き起こす(63)。また、アストロサイトにおけるAPOE4は、微小血管の変性、基底膜の劣化、周皮細胞の被覆率の低下によるBBBの破壊を誘導するが、これらはいずれも加齢とともに悪化する(64, 65)。さらに、APOE4キャリアとAPOE3キャリアの死後脳では、基底膜表面積が減少している(66)。
遊離DHAは、BBBを横切って高度に拡散性であり、その小さなサイズ(<500 D)低い水素結合能力、および親油性のために、脳に入るためにトランスポーターを必要としない(図3)。これは、アストロサイトで産生されるAPOE4によって破壊されるタイトジャンクションの完全性と表面透過性の両方に依存している(59, 61-63)。APOE4はまた、ジアゼパムなどのBBBを横切って高度に拡散する他の親油性化合物の通過を阻害する(59)。脳内へのDHA輸送は、APOE4トランスジェニックマウスおよびAPOE4キャリアにおいて障害される(45,46)。しかし、遊離DHAとDHA-lysoPCのどちらの形態でDHA輸送が障害されるのかは不明である。私は、APOE4対立遺伝子を持つ個体では、遊離DHA(DHA-lysoPCではない)の脳内への輸送に障害があると提案している(図4)。
図4
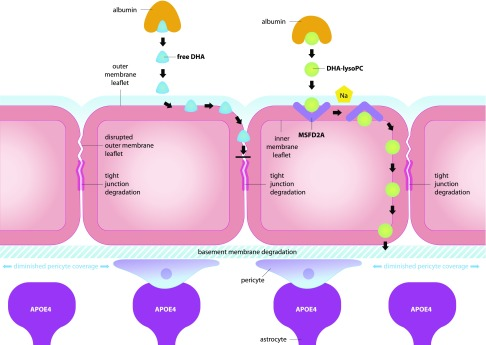
APOE4はタイトジャンクションの分解を促進し、遊離DHAの脳内への輸送を阻害する。アストロサイトで産生されるAPOE4は、タイトジャンクションの分解を促進し、BBBの外側リーフレットの破壊を促進し、遊離DHAの輸送を阻害する。また、APOE4は、微小血管の変性、基底膜の劣化、周皮細胞の被覆率の低下によるBBBの破壊を引き起こす。DHA-lysoPCは、MFSD2Aトランスポーターを介してBBBを越えて運ばれ、BBBを覆う内皮細胞の内膜リーフレット膜に移動し、DHA-lysoPCは内皮細胞間の外膜リーフレットのタイトジャンクション欠陥を迂回して脳内に輸送される。
アストロサイトで産生されるAPOE4のDHAおよび受動的拡散を介して脳内に容易に輸送される他の化合物の輸送障害に対する効果は、加齢とともに徐々に悪化する(46, 64)。これは、老化プロセスがBBBの整合性を破壊し、APOE4対立遺伝子(67)と同様の脳血管化を混乱させることを示す証拠と一致している。DHAの補充は、APOE4を持つ高齢者では認知機能を改善しないが、若いAPOE4キャリア(43,68,69)では、おそらく、若いAPOE4キャリアでは、十分な遊離DHAが認知機能に積極的に影響を与えるために脳に輸送されているため、認知機能を改善する。
DHA-lysoPCは、脳内に輸送されるDHAの別の形態である。遊離DHA輸送とは対照的に、DHA-lysoPCはBBBの内膜リーフレットを介して輸送され、アストロサイトで産生されるAPOE4によって障害されるタイトジャンクションに依存しないため、その輸送は、APOE4キャリアのBBBの欠陥のための潜在的なバイパスを提供する可能性がある(図4)。
DHA-lysoPCは、ナトリウムの電気化学的電位を利用してBBBを横切ってDHA-lysoPCを輸送するMFSD2Aトランスポーターを介して輸送される(図4)。DHA-lysoPCがBBBに到達すると、アルブミンから剥離してMfsd2aと結合し、BBBを覆う内皮細胞の内膜リーフレットにDHA-lysoPCが移動する(図4)。この移行により、DHA-lysoPCは内皮細胞間の外膜リーフレット上のタイトジャンクションを迂回することができる(図4)(50)。アストロサイトで産生されるAPOE4がBBBのタイトジャンクションの分解を導くため、この点は重要であり、APOE4対立遺伝子を持つ個体では、脳内へのDHA-lysoPC輸送が遊離のDHA輸送よりも優れていることを示唆している。MFSD2Aトランスポーターを介した脳内へのDHA-lysoPCの特異的な輸送もまた、BBBの完全性を維持するために重要であるように思われ、BBBのタイトジャンクションの破壊と脳血管化の減少を有するため、DHA-lysoPCはAPOE4キャリアにとってさらに重要であることを示唆している(70,71)。
リン脂質DHA:食生活のバイパス
APOE4対立遺伝子のキャリアは、食事のDHAの摂取量から正の効果を経験するが、DHAのサプリメントからの利点を経験しないことの理由は、十分に理解されていないままである。魚介類のDHAの一部がリン脂質の形で存在し、その代謝処分を通してこの形を維持しているため、応答のこの違いは、ほとんどの場合、発生する。このように、それは効果的にMFSD2Aトランスポーターを介してDHA-lysoPCとしてBBBを横切って輸送することができる(図4)。サプリメントに含まれる魚油がリン脂質形態のDHAを含まないのに対し、魚類は、そのω-3脂肪酸のうち、∼1.0〜1.5%をリン脂質形態で含有している。特に魚卵は、リン脂質形態のDHAの最も濃縮された供給源の一つである。サケ、ニシン、スケソウダラ、およびトビウオからの卵は、主にホスファチジルコリンに存在するリン脂質の形でそれらのω-3脂肪酸の∼38-75%を含んでいる。リン脂質の形でのDHAの別の豊富なソースはオキアミ油で、リン脂質の形でDHAの約35%を含んでいる(72)。対照的に、DHAを含む魚油サプリメントの製剤は、一般的に遊離脂肪酸、エチルエステル、および、より少ない範囲で、再エステル化トリグリセリド(73)として存在している。
DHAは、リン脂質の形態(すなわち、魚、魚卵、およびオキアミ油)トリグリセリドの形態(すなわち、魚およびいくつかのDHAサプリメント)遊離脂肪酸の形態(すなわち、ほとんどのDHAサプリメント)またはエチルエステルの形態(すなわち、ほとんどのDHAサプリメント)のいずれであるかに応じて異なる方法で代謝される(図5)。これらの様々な形態のDHAの代謝を要約すると、魚、魚卵、オキアミ油に含まれるDHAが、DHA-lysoPCをAPOE4キャリアの脳内に送達するために特に重要であることを理解するための有用なフレームワークが得られる。
図5 リン脂質DHA、エチルエステルDHA、トリグリセリドDHAの代謝
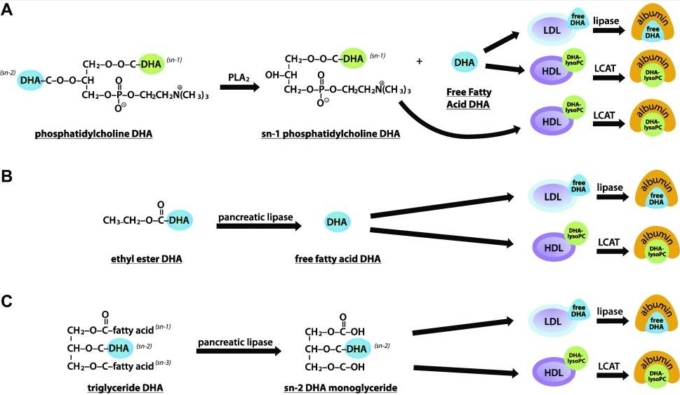
A)DHAは、ホスファチジルコリンのsn1と-2の位置に存在している。腸内に存在するヒトPLA2は、sn2の位置でDHAを切断し、sn1の位置でDHAと遊離脂肪酸DHA(遊離DHA)を持つリゾホスファチジルコリンを生成する。sn1のDHA-lysoPCは、酵素LCATを介してアルブミンに結合したDHA-lysoPCを形成し、HDLに再分泌される。遊離脂肪酸DHAは、LDLとHDLの両方に再還流される。LDLでは、それは酵素リパーゼを介してアルブミンに結合した遊離DHAを形成し、HDLでは、それはLCATを介してアルブミンに結合したDHA-lysoPCを形成する。
B)エチルエステルの形態のDHAは、HDLとLDLの両方に再分泌される遊離脂肪酸DHAに分解される。HDLに存在するDHAは容易にアルブミンに結合した遊離DHAを形成するのに対し、LDLに存在するDHAは容易にアルブミンに結合したDHA-lysoPCを形成する。
C)トリグリセリドの形で存在するDHAは、トリアシルグリセロールのsn2位置に位置している。ヒト膵臓リパーゼは、一般に、脂肪酸をsn1または-3位置から解放し、sn2モノグリセリドをそのまま残す。sn2モノグリセリドは、LDLとHDLの両方に再分泌され、それはそれぞれアルブミンに結合した遊離のDHAとアルブミンに結合したDHA-lysoPCを形成している。
リン脂質形態のDHAの代謝
リン脂質において、脂肪酸は、グリセロール分子の第1および第2の炭素に付着することができ、それぞれ求核的置換(sn)1およびsn2の位置として示される。DHAは、グリセロールバックボーンのsn1または-2位置に付着することができる。魚や魚卵のような脂肪酸のほとんどの海洋供給源は、sn2位にDHAとのホスファチジルコリンを有し、sn1位には少量のDHAとのホスファチジルコリンを有するが、オキアミ油は例外であり、sn1位にはかなりの量のDHAとのホスファチジルコリンを有する(74-76)。リン脂質のsn2位置にあるDHAは、膵臓ホスホリパーゼA2(PLA2)によって腸内で分解され、DHAを遊離脂肪酸として放出することができる。ターンでは、DHA遊離脂肪酸は、HDLとLDLの両方にカイロミクロンで再分泌される(77)。HDLに再放出されるDHAのプールは、酵素レシチン-コレステロール-アシル転移酵素(LCAT)を介して容易にDHA-lysoPCを形成するのに対し、LDLに再放出されるDHAは、容易に酵素リパーゼを介してアルブミンに結合した遊離DHAを形成する(図5A)(47,78,79)。DHA-lysoPCを形成することができる血漿中に存在する別の酵素は、PLA1活性を示し、BBBに特に多く存在する内皮リパーゼである(78)。PLA1は、遊離脂肪酸とリゾリン脂質を生成するために脂肪酸の加水分解を触媒する(80)。
sn2位置のDHAとは対照的に、リン脂質上のsn1位置のDHAは、膵臓PLA2の作用をエスケープし、したがって、DHAのすべてがリン脂質の形で保持され、DHA-lysoPCが生成される確率を高めることができる(図5A)(77,81)。リン脂質のsn1位置のDHAは、吸収後、遊離脂肪酸形態のDHAよりも高い速度∼5倍の速度でリン脂質に組み込まれる。さらに、リン脂質のsn1位置のDHAは、2倍以上のHDL画分に蓄積される(77)。DHA-lysoPCは、LCATの作用を介してHDL粒子内のホスファチジルコリンに存在するDHAから派生し、sn1の位置にあるすべてのDHAがDHA-lysoPCを形成する可能性が高いことを示唆している(78)。
一緒に、これらのデータは、リン脂質のsn2位置のDHAが遊離脂肪酸DHAに代謝され、その後、LDLとHDL粒子の両方に再分泌されることを示唆している。しかし、HDL中のDHAのみがDHA-lysoPCを形成する(図5A)。LDL中のDHAは遊離DHAを形成し、リン脂質のsn2位置にあるDHAの一部のみがDHA-lysoPCを形成する。対照的に、sn1の位置にあるDHAのすべては、そのリン脂質の形態を保持し、HDL粒子に組み込まれているため、さらに多くのDHA-lysoPCを形成する(図5A)。
エチルエステルとトリグリセリド形態のDHAの代謝
魚、魚卵、オキアミ油に存在するDHAとは対照的に、魚油サプリメントからのDHAは、ほとんどがエチルエステルの形、遊離脂肪酸の形、または、より少ない程度に、再エステル化されたトリグリセリドの形で存在し、ほとんどが腸内の膵臓リパーゼによって分解される(73)。トリグリセリドでは、脂肪酸は、グリセロール分子の第1,第2,または第3の炭素に付着することができ、それぞれsn1,-2,または-3の位置として示される。DHAは、グリセロールバックボーン上のこれらの位置のいずれかに付着することができる。エチルエステル形態のDHAは、HDLとLDLの両方にカイロミクロンで再分泌される遊離脂肪酸DHAに分解される(図5B)(77)。LDLに存在するDHAは容易に遊離DHAを形成するのに対し、HDLに存在するDHAは容易にDHA-lysoPCを形成する(図5B)(47,78,79)。トリグリセリドの形で魚や魚油のサプリメントに含まれるDHAは、ほとんどがトリアシルグリセロールのsn2位に位置している(図5C)(82)。しかし、ヒト膵臓リパーゼは、一般的にDHAをsn1または-3位置から遊離させ、sn2モノグリセリドをそのまま残す(83)。sn2モノグリセリドはカイロミクロンでHDLとLDLの両方に再分泌される(図5C)。魚または魚油サプリメントのいずれかからのトリグリセリド形態のDHAは、エチルエステル形態のDHAよりも4倍高い血漿リン脂質に蓄積される(73)。
これらのデータは、DHAは、それがリン脂質、エチルエステル、またはトリグリセリドに由来するかどうかに応じて、異なる代謝運命を持っていることを示唆している(図5)。リン脂質のsn2位置のDHAと同様に、エチルエステル形態のDHAは遊離脂肪酸DHAに代謝され、最終的にはDHA-lysoPCおよびアルブミンに結合した遊離DHAの両方を形成することができる。トリグリセリドの形で存在するDHAは、sn2モノグリセリドに代謝され、HDLとLDLの両方にカイロミクロンで再分泌され、最終的にはDHA-lysoPCとアルブミンに結合した遊離DHAの両方を形成している。しかし、リン脂質はまた、それがそのリン脂質の形態を保持し、DHA-lysoPCのみを形成するsn1位置にDHAを持っているため、リン脂質の形態のDHAは、DHA-lysoPCのより良いソースを作る(図5)。しかし、トリグリセリドとエチルエステルの両方の形態のDHAは、DHA-lysoPCを生成することができるので、それらの形態のDHAのより高い用量のDHAが顕著にDHA-lysoPCプールを増加させる可能性が残っている。
リン脂質対トリグリセリドのDHAからのDHA-lysoPCの血漿レベル
リン脂質形態のDHAの代謝処分は、トリグリセリド形態のそれよりも迅速に発生する。例えば、ヒトがリン脂質形態のDHAを消費する場合、アルブミン結合DHA-lysoPCは、彼らがトリグリセリド形態のDHAを消費する場合よりも速く血漿中に表示される(81,84)。さらに、脳のDHAレベルのバイオマーカーであるDHA-lysoPCの赤血球量が増加する(49)。リン脂質DHAの経口投与を受けた人は、トリグリセリド形態のDHAの経口投与を受けた人と比較して、赤血球へのより高いDHA取り込みを実証した(81,84)。トリグリセリドの形でDHAで構成される魚油を消費するヒトは、アルブミンに結合した遊離DHAの増加を示するが、2時間後にDHA-lysoPCの遅い外観を示している(49,84)。さらに、それがトリグリセリドの形で消費されるときよりもリン脂質の形で消費されるとき、より多くのDHAは、脳に配信される。リン脂質の形で放射性標識されたDHAを供給されたラットは、トリグリセリドの形でDHAを供給されたラットと比較して、6時間後に小脳で78%以上のDHA、海馬で140%以上のDHA、および脳の残りの部分で69%以上のDHAを示した(85)。さらに、マウスに経口DHA-lysoPCを投与すると、脳内DHAレベルが2倍に増加し、空間学習と記憶が改善されたが、遊離DHAは改善されなかった(86)。これらのデータは、リン脂質形態のDHA(すなわち、魚、魚卵、オキアミ油)を消費すると、血漿中のDHA-lysoPCの形成が増加し、トリグリセリド形態のDHA(すなわち、DHAサプリメント、魚)で消費されたDHAと比較して、より多くのDHAが脳に取り込まれることを示唆している。
考察
いくつかの独立した証拠に基づいて、APOE4対立遺伝子を持つ個人が魚の摂取では認知機能を改善したが、DHAサプリメントでは改善しなかった理由は、魚にはリン脂質の形でDHAが含まれているのに対し、サプリメントには含まれていないからであると示唆している。この形態の違いは、DHAが血漿中の遊離DHAに代謝されるか、DHA-lysoPCと呼ばれる特定のリン脂質形態に代謝されるかに影響を与える。私は、APOE4キャリアは、BBBの完全性の故障の結果として、遊離DHAの脳内輸送に障害があるが、DHA-lysoPCではないことを提案する。この輸送障害は、アミロイドβプラークの蓄積、タウのもつれ、脳内グルコースレベルの低下によって引き起こされるアルツハイマー病のリスクを高めることになる。リン脂質形態のDHAを多量に含む食事源は、DHA-lysoPCの血漿レベルを増加させる手段を提供するかもしれない。そのような増加は、APOE4キャリアが遊離DHAの彼らの欠陥輸送をバイパスし、効果的に彼らの脳にDHA-lysoPCを送達することができ、それによってアルツハイマー病のリスクを低下させる可能性がある。
この提案は以下の観察から導き出されたものである。
1)APOE4キャリアは、高い食事性の魚の摂取によって脳神経病理と認知機能を改善したが、DHAの補給では改善しなかった。
2)DHA補給後、APOE4対立遺伝子を持つヒトとマウスは、脳内へのDHA輸送が減少しており、これは加齢とともに徐々に悪化する。
3)アストロサイトのAPOE4は、タイトジャンクションの分解、BBBの外膜リーフレットの破壊、およびBBBの機能不全につながる、減少した脳血管化を含む形態的な障害につながるオクルディン活性化を阻害する。
4)遊離DHAはBBBを横切って高度に拡散性を持ち、BBBの外膜リーフレットに沿って輸送されるが、このプロセスは脳内で産生されるAPOE4によるタイトジャンクション分解によって破壊される。
5)脳内へのDHA-lysoPCの輸送は、BBBのタイトジャンクションに依存しないが、代わりに、ナトリウムの電気化学的電位を使用して脳内にDHA-lysoPCを転送するために、MFSD2Aトランスポーターを介して内膜リーフレットに沿って輸送される。
6)魚、魚卵、オキアミ油は、DHAサプリメントはトリグリセリドまたはエチルエステルの形でDHAを含むのに対し、様々な範囲でリン脂質の形でDHAが含まれている。
7)リン脂質形態のDHAの方がトリグリセリド形態またはエチルエステル形態のDHAと比較して、DHA-lysoPCとして血漿中に現れる。
APOE4対立遺伝子を持つアルツハイマー病患者で認知機能と脳形態学上のDHAの効果を評価しているこれまでのすべての臨床試験は、別々にまたは一緒に、リン脂質の形でDHAが含まれていない魚油のサプリメントを使用している。DHAは、リン脂質の形で消費されている場合(食事の魚や魚介類からのように)より多くのDHAは、より良いAPOE4キャリアのBBBを越えて輸送される可能性があるDHA-lysoPCとして血漿中に表示される。アルツハイマー病を持つAPOE4キャリアの認知機能に魚卵油またはオキアミ油のいずれかから、リン脂質の形でω-3の効果を評価する臨床試験のための緊急の必要性がある。