Contents
Risk and Protective Environmental Factors Associated with Autism Spectrum Disorder: Evidence-Based Principles and Recommendations
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC6406684/
2019年2月8日オンライン公開
Leonardo Emberti Gialloreti,1,* Luigi Mazzone,2 Arianna Benvenuto,2 Alessio Fasano,3 Alicia Garcia Alcon,4 Aletta Kraneveld,5 Romina Moavero,2,6 Raanan Raz,7 Maria Pia Riccio,8 Martina Siracusano,1,9 Ditza A. Zachor,10 Marina Marini,11 and Paolo Curatolo2
要旨
自閉症スペクトラム(ASD)は、幼児期に発症する複雑な疾患であり、一連の共通した行動的特徴によって特徴づけられる。ASDの病因はまだ完全には解明されていないが、遺伝と環境の相互作用を反映している。遺伝は現在、確立された危険因子であるが、いくつかのデータは、環境の寄与も支持している。本論文は、環境因子の潜在的な病因的役割と、遺伝との相互作用に焦点を当てたコンセンサス会議の結論をまとめたものである。ASDのリスクに関しては、いくつかの環境因子が議論されてきた。すなわち、高度な親の年齢、生殖補助技術、栄養因子、母親の感染症や病気、環境化学物質や毒物、薬、その他の条件である。この分析では、生物学的に脳の発達に関連する3つの時期(受胎前後、出生前、出生後早期)に与える影響に焦点を当てた。また、ASDの発症を防ぐ、あるいは修正する可能性のある保護因子についても検討した。また、ASDのリスクや重症度を軽減するための臨床家への推奨事項も提案されている。分子生物学的手法やビッグデータを用いたアプローチの発展により、ASDの発症につながる遺伝子と環境の相互作用を解明する新たな機会が生まれている。
キーワード 自閉症スペクトラム、危険因子、保護因子、環境、遺伝、薬物、毒物、提言
1. はじめに
自閉症スペクトラム(ASD)は,複雑な生物学的疾患であり,様々な遺伝的・環境的危険因子の相互作用を反映した,幼児期に発症する共通の行動的特徴を特徴とする[1]。
現在のところ、ASDの中核的な症状に対する究極の治療法はない。しかしながら、自閉症の症状は、早期の行動的介入によって軽減することが可能であり[2,3]、精神医学的併存疾患の治療のためにいくつかの薬理学的治療法が利用可能である[4]。
ASDの有病率は増加しているようである。最近の推定では、米国の8歳児の有病率は59人に1人とされている(https://www.cdc.gov/ncbddd/autism/data.html)[5]。また、別の研究では 2001年から 2011年の間に、2歳から17歳の子どもたちの有病率が3.5倍に増加したと推定されている[6]。このような有病率の増加の原因は、ASDの診断基準の拡大や症例の確認の改善以外には、まだはっきりしていない。しかし、ASDは、妊娠中から生後間もない時期までの脳の発達に影響を及ぼす一連の出来事の最終的な結果であるため[7]、本当の意味での増加は、これらの複雑な出来事に関連している可能性がある。
ASDの病因は完全には解明されていないが、遺伝は確立された危険因子である[8]。双子の研究では、一卵性双生児における76%の一致が示唆されており、ASDの強い遺伝性が確認されている一方で、環境因子の重要な寄与も支持されている[9]。
ASDの症例の約20%には、100以上の遺伝子や遺伝子座の遺伝的な欠陥、数百のコピー数変異(CNV)や一塩基多型(SNP)が関与していると考えられている[10,11,12,13]。DNAマイクロアレイは、ASDの重要な原因となる希少なCNVや再発性CNVの発見を可能にし、自閉症の遺伝学的理解を深めるとともに、遺伝的に自閉症になりやすい人を特定することにつながる。16p11.2,22q11.2,1q21.1,7q11.23,15q11-q13などの再発性CNVのホットスポットは,ASDと強く関連していることが示されている[14]。次世代シーケンシング(NGS)法はASD遺伝子の発見に革命をもたらし、ASDに頻繁に関連する変異を、脳の発達や初期のシナプス形成時に脳の転写ネットワークの制御に関与する遺伝子と結びつけることで、機能的な遺伝子データにも大きな貢献をしている。しかし、ASDには、Fragile-X(FMR1)結節性硬化症複合体(TSC1-2)PTEN症候群などの単一遺伝子の症候群も関連している[16,17]。
しかし,ASDで観察される臨床的・生物学的表現型が不均一であることは,遺伝的に影響を受けやすい人では,環境的な危険因子も組み合わさったり,相乗効果を発揮したりして,機能障害を決定づける「しきい値」を生み出していることを強く示唆している。遺伝的およびエピジェネティックな要因については理解が進んでいるが,環境的なリスク要因についてはあまり理解されていない[18]。実際、最近の研究では、中枢神経系の発達の重要な時期に、微生物(細菌やウイルス)から薬剤まで、化学物質から物理的な物質まで、さまざまな環境因子に早期にさらされることで、ASDに関連する影響を含む神経生物学的な発達に影響を与えることが明らかになっている[19,20]。
2018年10月、国際的なASD専門家がローマに集まり、脳の発達に生物学的に関連する3つの窓、すなわち受胎前後、出生前、出生後早期に焦点を当てて、環境因子の潜在的な病因的役割、および遺伝的感受性との相互作用について議論した。疫学的な観点からは、各環境因子の作用の正確な時期や、神経発達経路におけるその影響を特定することは、依然として困難である。とはいえ、ASDのリスクが高い集団の発見や個別のフォローアップに役立つ、リスク因子間のいくつかの違いを確立することが可能になっている。
本論文では、このコンセンサス会議の結果を要約し、ASDのリスクや重症度を軽減するための臨床家への提言を行う。
2. 受胎期
親の年齢が高いこと。受胎時の親の年齢が高いことと、子孫の神経精神疾患との関連は、現在ではよく知られている[21,22]。ASDの場合、出生時の母方の年齢と父方の年齢がともに高い(35歳以上)とASDのリスクが高まることがわかっている[23,24,25,26]。また、両親の年齢がともに高い場合に最も高くなり、親の年齢差が大きくなるにつれて高くなる複合的な親の年齢効果が確認されている[27]。ヒトおよび動物モデルを用いた研究では、高齢の父親におけるde novo変異率の上昇とASDのリスク上昇との間に関連性があるという仮説が支持されている[28,29]。また、母体年齢の上昇がASDリスクに及ぼす影響を媒介する母体のメカニズムは、染色体や遺伝子の改変だけでなく、慢性疾患の罹患率の高さや子宮環境の悪さにも関連しており、その結果、産科的合併症が多くなり、最終的には有害な出産結果のリスクが高まる可能性が示唆されている[26]。
ホルモン導入および/または生殖補助技術の使用
生殖補助技術(ART)は、現在、西欧諸国の全出生数の1~3%を占めている(https://www.cdc.gov/reproductivehealth/index.html)[30]。ホルモン刺激、採卵、体外受精(IVF)細胞質内精子注入(ICSI)配偶子のマイクロマニピュレーション、培養液への暴露など、ARTプロセスで使用されるいくつかの手順は、配偶子および初期胚を環境ストレスにさらす可能性があり、先天性欠損症および低出生体重児(LBW)のリスク増加と関連している可能性がある[31]。ARTを用いて妊娠した子供は、中枢神経系の2倍の増加を含む先天性異常や、エピジェネティックおよびインポーチンティング障害のリスクも高く[32,33,34]、ARTがDNAメチル化を介してインポーチンティングに影響を与えている可能性を示す証拠もある[35]。実は、人工妊娠とASDはいくつかの危険因子を共有している。どちらの場合も、ホルモンの乱れ、特にテストステロン/アンドロゲン調節の乱れに加えて、高年齢の親、早産、低体重児の割合が高いことが報告されている[6,24,36,37]。
さらに、最近のメタアナリシスでは、ARTの使用が、子孫におけるASDの高いリスクと関連している可能性が指摘されている[31]。イスラエルの大規模集団を対象に実施された以前のケースコントロール研究[38]では、若い母親(29歳未満)であっても、全体のART率と比較して、ASD児の間でより高いART(IVFおよびICSI)の有病率(10.7%)が報告された。さらに、本研究では、ARTが、このグループに特有の臨床表現型を示す可能性のある固有の自閉症の症状(自閉症の重症度や適応機能、発達退行の履歴など)と関連しているという仮説が除外された。その結果、補助人工妊娠はASDの危険因子である可能性があるものの、このグループは自閉症スペクトラムの中で個別の臨床表現型を表しているようには見えないことがわかった。これらの知見は、ARTとASDの両方の最近の有病率の増加が関連している可能性を示唆している。
環境化学物質および毒物の要因
発達の重要な段階で化学汚染物質にさらされると、神経や行動の発達に影響を及ぼす可能性があるという証拠がいくつかある。環境化学物質因子の発症メカニズムには、神経毒性のほか、免疫調節障害、脂質代謝の変化、ミトコンドリア機能障害などの経路が含まれる。現在までのところ、最も強い関連性の証拠は、交通関連の大気汚染物質と農薬の異なる曝露時期で示されている[39,40]。
母体の栄養状態
妊娠前の母親の栄養状態と肥満度は、微量栄養素や成長因子の過不足を通じて正常な脳の発達に影響を与え、子孫の神経発達結果に影響を与える環境因子と考えられてきた[41,42]。このような観点から、母親の肥満と低体重の両方がASDのリスク増加と関連していると考えられている[42,43]。母親の肥満は、母親の免疫系の活性化と子宮環境の慢性的な炎症を引き起こし、胎児の神経細胞の成長と分化に異常をきたし、その結果、子孫の神経発達に障害をきたす [44]。同じレベルで、母親の栄養不足は、炎症性因子の不均衡な放出を通じて、神経細胞の損傷につながる生理的ストレス反応を誘発する可能性がある[45]。
最近の多くの研究では、妊娠前の葉酸の摂取量と新生児のASD発症リスクとの関連性が示唆されている[46]。葉酸を摂取していない子どもは、葉酸を摂取した母親の子どもに比べて、ASDの発症率が有意に高いことがわかっている。逆に、合成葉酸の栄養補助食品を使用した母親の子供では、ASDや神経認知障害のリスクが増加するという、明らかに矛盾した結果も他の研究で報告されている[47,48,49]。これらの結果の違いを説明するには、サプリメントに使用されているFA(プテロイルモノグルタミン酸)と天然の食物源から得られるFA(オルミルテトラヒドロプテロイルグルタミン酸)の組成の違いが考えられる。肝臓での代謝に依存するプテロイルモノグルタミン酸が多いと、血中に未代謝の非有用なFAが多く含まれることになり、脳のシナプス伝達の変化やASDに関連する多くの遺伝子の発現異常を引き起こす可能性がある[50,51,52]。
ASDの神経発達の変化に関連する可能性のあるもう一つの重要な微量栄養素は、鉄である。鉄を適切に摂取することの重要性は、妊娠前後の時期からすでに明らかになっている[53]。脳では、鉄は神経伝達物質の生成、髄鞘形成、免疫機能に寄与している。このような観点から、この時期に鉄分が不足すると、認知能力、運動能力、言語能力などの一般的な発達に障害が生じるだけでなく、社会的志向性や社会参加の障害が生じ、ASDにつながる可能性がある[53]。
薬物療法
セロトニン経路の変化とASDの神経生物学的異常との間に病因的な関連性があると仮定して、選択的セロトニン再取り込み阻害薬(SSRI)への出生前の曝露がASDの発症と関連する可能性を強調する研究が増えている[54,55,56];妊娠前または第1期の曝露は、他の2期に比べて高いリスクと関連するようである[57]。また、抗うつ薬の成分にかかわらず、ASDリスクの増加と関連している可能性があるとする報告もある[58]。このように、抗うつ薬の種類と投与量の両方に関連して、いくつかの異なる結果が見つかっている[58,59]。さらに、5,057,282人年の追跡調査を行ったデンマークの縦断的研究では、妊娠中の母親のSSRI使用と子孫のASDとの間に有意な関連は検出されなかった[60]。さらに,別の大規模な研究では,いくつかの交絡因子をコントロールした後に,抗うつ薬への出生前の曝露とASDとの間に有意な関連を見いだすことができなかった[61]。最後に、「適応による交絡」を排除することはできず、抗うつ薬そのものではなく、うつ病や不安が子孫のASDの危険因子である可能性を提起している[58]。それにもかかわらず、証拠がまだ矛盾している場合でも、抗うつ剤の使用と未治療の母親のうつ病による実質的な悪影響とのバランスを考慮して、予防原則の適用を進めることが推奨される。
3. 胎児期
環境化学物質および毒物。ここ数年、疫学的調査により、大気汚染、農薬、プラスチック産業で使用される材料や重金属などの化学物質や毒性因子への出生前の暴露がASDのリスクを高める可能性が指摘されている[39,40,62,63,64]。これらの環境リスク因子とASDとの関連の背後にあるメカニズムとして考えられるのは、遺伝的因子との相互作用、および/または異種物質を解毒する能力の低下につながるエピジェネティックなマークだけでなく [65,66] 、神経生物学的および神経伝達物質の変化やシグナル伝達経路の異常につながる神経炎症や酸化ストレスの引き金となる潜在的な役割である [63] 。
大気汚染
大気汚染は、おそらくASDとの関連性が最も強く示唆されている化学的危険因子であり、特に第3期における暴露についてはその傾向が強い[40,67,68]。曝露の測定基準、汚染の種類、曝露の時間などの複数の変数がASDのリスクとその臨床転帰に影響を及ぼす可能性がある[69,70,71]。しかし、米国、カナダ、台湾、イスラエルなど多くの国で正の関連性が認められたにもかかわらず、ヨーロッパの研究では関連性が認められなかったことに留意すべきである[71,72,73]。最近、カナダの人口ベースの出生コホートにおいて、一酸化窒素への曝露とASDとの間に有意な関連が認められた。ASDと直径2.5μm以下の粒子状物質や二酸化窒素との関連は認められなかった[74]。これらの矛盾した結果は、大気汚染に関する研究は、曝露の測定方法が間接的かつ横断的であったり、曝露の測定基準が異なっていたり、結果の評価が異なっていたり、異なる汚染物質に焦点を当てていたりして、制限されていることが多いためであると考えられる。さらなる調査が必要であり、未解決の問題がいくつか残っているにもかかわらず、出生前の大気汚染への曝露はASDの潜在的な修正可能な危険因子として浮上している。
殺虫剤
有機塩素系農薬への曝露(地理的マッピングを用いて測定)は,子孫のASDのリスクを高める[75,76]。さらに、ポリ塩化ビフェニル(PCB)の出生前レベルとASDのリスクとの関連を調べた研究では、特定のPCBとの示唆的な関連が報告されている[20,77,78]。妊娠中の有機リン酸塩への曝露は,2~3歳の子供の自閉症症状のリスクを高める[79]。特に、妊娠中のどこかの時点で有機リン酸塩に近い場所に居住していると、子孫がASDを発症するリスクが60%増加するとされている[80]。逆に、保存された母親の血清で測定された有機汚染物質(様々なPCBコンジェナー、DDT(ジクロロジフェニルトリクロロエタン)DDE(ジクロロ-2,2-ビス(p-クロロフェニル)-エチレン)への曝露と子どものASD診断との関連性を調査したパイロットケースコントロール研究では、ASDのオッズ比に有意な差は認められなかった[77]。現在使用されている農薬のほとんどは神経毒性を有しており、発達中の脳を標的とする可能性があり[81]、酸化ストレスを引き起こしやすい[82]。広く使用されているピレスロイドは、ASDおよび神経発達遅延と関連している[83]。しかし、大気汚染について述べたのと同じ理由で、農薬への曝露とASDとの関連はまだ確認されていない[78]。
フタル酸エステル類
フタル酸エステル類は、可塑剤、溶剤、潤滑剤として、また、医薬品や栄養補助食品の腸溶性コーティングとして使用される化学物質の一種である。ASDとフタル酸エステル類への出生前の暴露(第3期)との関係を扱った研究は少なく、対照的な結果となっている[78]。
重金属への暴露
水銀、銅、カドミウム、セレン、クロムなどの毛髪金属濃度と自閉症症状との関連を示す証拠は、これまでほとんど出ていない[84]。さらに、これらの研究のほとんどはバイオマーカーを測定しただけで、実際の暴露源を確認していないため、関連性の一時性は不明である。母親の歯科用アマルガム充填や、母親や子供の魚介類の摂取との関連で暴露を調べた研究もあるが、その結果は一貫していない[19]。あるメタアナリシスでは、小児期のチメロサール曝露とASDとの間には関連性がないという一貫した証拠があるだけでなく、無機水銀曝露量が多いほどASDのリスクが高まることがわかった[85]。
薬物療法
ASDと出生前の薬物への曝露との関連性がますます研究されているが、特に注目されているのは、抗てんかん薬と抗うつ薬の研究である[54]。
抗てんかん薬(AED)の中でもバルプロ酸塩は,認知障害,発達遅延,ASDなどの神経発達の結果と最も強い関連性を示した[86]。そのため、妊娠中の女性や妊娠を予定している女性には、抗てんかん薬や気分安定薬の第一選択薬として禁忌とされている。さらに、オクスカルバゼピンやラモトリギン(単独またはバルプロ酸との併用)などの他のAEDは、子孫におけるASDの発症と関連することがわかっている[87]。妊娠中の抗うつ薬への曝露とASDとの関連を調べたいくつかのメタアナリシスの結果は、リスクの増加を示すという点でほぼ一致している[88]。さらに、母親の精神疾患はASDの発症に重要な役割を果たす可能性があるため、これらは抗うつ薬への曝露だけでは、潜在的な交絡または習慣性の危険因子としても考慮されている [88,89,90]。
いくつかの研究では、出生前または幼少期の抗生物質の使用とASDとの関連性の可能性も示唆されているが[91]、現在のところ、結論を出すには情報が少なすぎる。しかし,最近,マウスにおいて,妊娠後期から生後早期にかけての低用量の抗生物質への曝露が,腸内細菌叢の変化に関連して,マウスの社会的行動の障害や攻撃性を誘発することが明らかにされた[92]。一方,プロバイオティクスであるLactobacillus Rhamnosus JB-1を補給することで,幼少期の抗生物質による異常行動を防ぐことができるかもしれない。これらの結果を総合すると、ASDの発症における幼少期の抗生物質への曝露の潜在的な役割について、さらなる研究が必要である。
物質乱用
多くの研究が、重度のタバコ煙、アルコール、コカインなどの物質乱用への出生前の曝露とASDの関係を調べている。妊娠中の大量のアルコール摂取と子孫のASD(特に胎児性アルコール症候群)との関連が報告されている[93,94,95]。一方、妊娠中の中程度のアルコール摂取とASDとの関連は考えにくい[94]。
妊娠中の喫煙と小児期の自閉症のリスクとの関連が示唆されているが[96]、この場合、結果は相反しており、合計15件の研究における2つのメタアナリシスでは、オッズ比が重複して関連がないと報告されている[97,98]。したがって、現時点では、関連性を支持するには十分なデータが得られていない。
栄養因子
妊娠中の母親の食事は、行動を制御する神経回路の発達に重要な役割を果たし、その結果、子孫の持続的な行動の影響を決定するという証拠が、疫学研究やヒトで得られたデータから得られている[48]。一般的に、FA、ビタミンD、鉄、脂肪酸など、妊娠中の母親の食事の一部の要素が、子孫のASDや自閉症形質の発生率の高低と関連することが知られている[99]。特に、ビタミンDとFAの低濃度は、特に、これらの欠乏が妊娠中期に存在する場合、ASD診断のリスク増加と関連している[100,101]。さらに、妊娠中にメタノールやアスパルテームを多く含む母親の食事は、ASDのリスク増加と関連している可能性がある[102]。
妊娠中のオメガ3摂取量の少なさや妊娠中の母親の高脂肪食は、ASDやその他の神経発達障害のリスクと関連している[19,103]。実際、妊娠中の高脂肪食摂取は、ASD児の母親の妊娠中に上昇しているのと同じいくつかの炎症性サイトカイン(例えば、インターロイキンIL-4,IL-5)の活性化と強く関連している。さらに、妊婦の高脂肪食摂取は、行動制御に関わる神経経路、特にセロトニン系の変化と関連している。子孫が妊娠中に母親の高カロリー食にさらされている限り、脳内のセロトニン合成が抑制されることが、後に行動障害を発症するリスクの根底にあると考えられる。
出生前の感染症と母体の免疫活性化
最新のデータによると、少なくとも一部の女性では、妊娠中に感染症にかかると、子孫のASDやその他の中枢神経系(CNS)の障害が増加する可能性がある。母体の免疫反応の活性化は、精神疾患の発症リスクをもたらす可能性がある。特に、インフルエンザ、風疹、はしか、単純ヘルペスウイルス、細菌感染などの出生前の感染症にさらされると、子孫が双極性障害や統合失調症を発症するリスクが高まる可能性がある[104]。最近では、いくつかの集団ベースのコホート研究で、妊娠中の曝露時期、感染因子の種類、母親の免疫反応の強さに応じて、自閉症リスクと妊娠中の母親の感染症や炎症との間に潜在的な関連性があることが報告されている。具体的には、ウイルス感染は妊娠第1期、細菌感染は妊娠第2期、インフルエンザや発熱エピソードは妊娠期間中、特に妊娠第3期にASDリスクと関連しているようである[105,106]。感染症との関連ではなく、発熱そのものがASDリスクに与える潜在的な影響を検討した研究はほとんどない[106]。母親の自己報告に基づいたレトロスペクティブなケースコントロール研究では、妊娠中の発熱とASDリスクの上昇との間に関連があることが示された[105];このリスクは、発熱を抑えるために解熱剤を服用した母親でのみ軽減され、服用しなかった母親では軽減されなかったことも示された[105]。ノルウェーで行われた前向き研究でも、出生前に発熱にさらされた後にASDのリスクが上昇し、母親の発熱が複数回に及ぶとリスクも並行して上昇するという用量反応関係の証拠が示された[107]。
母体の免疫活性化(MIA)は、発育中の胎児の炎症分子の発現を変化させる可能性があり、母体-胎児の免疫調節不全は、脳の発達と神経結合を乱し、その結果、子孫の精神機能に長期的な影響を与える可能性があるという考え方が有力である[108]。母親の感染症とASDのリスク増加との関連性を支持する研究の中には、母親の血清や羊水に含まれるサイトカイン、ケモカイン、その他の炎症性メディエーターの定量化を目的として実施されたものがいくつかある[109]。しかし、これらの研究では、相反する結果が得られている[56,105]。最近では、妊娠中の母親のサイトカインやケモカインのレベルの上昇が、その後の知的障害を伴うASDと関連している[110]。
母体の免疫系は、出生前の感染症とは関係なく、ASDリスクの増加に関与する可能性がある。特に、母親の自己抗体は、発達中の胎児の脳内のタンパク質を認識する可能性がある[111]。これらの自己抗体は、自閉症を発症するリスクのある子供の母親の約20%に検出されるのに対し、正常に発達している子供の母親では1%であり、ASDの新たなサブタイプを定義している[112,113]。
個々の母親の要因と疾患
妊娠糖尿病は、胎児の成長に悪影響を及ぼし、妊娠合併症の発生率を高めることから、危険因子と考えられている[114,115,116]。さらに、長期的な微細・粗大運動の発達に影響を与え、学習障害や注意欠陥多動性障害につながる[117]。脳の発達に対する母親の糖尿病のこれらの悪影響は、胎児の酸化ストレスの増加や、いくつかの遺伝子の発現におけるエピジェネティックな変化から生じていると考えられる[114,115,118]。しかし、妊娠糖尿病に関連したASDリスクの増加は、高血糖による二次的な合併症というよりも、妊娠合併症に関連している可能性がある。糖尿病をコントロールすることでASDリスクが低下するかどうかはまだ不明である[114,115]。
さらに、母体のメラトニンレベルがASDの病因における潜在的な原因として調査されている[119]。メラトニンは、神経発達に重要なホルモンであり、酸化ストレスや神経毒性物質から保護する。メラトニンの欠乏は,ASDの子どもたちではすでに人生の非常に早い時期に発見されることが多く,したがって,母親のメラトニンレベルが低いことの潜在的な意味が,自閉症の感受性を高める要因として考えられている[120]。
4. 周産期/出生後早期
現在の研究では、神経質な対照群と比較して、ASD児では産科的危険因子がより頻繁に発生することが示唆されているようだが、この結果には他の著者から異議が唱えられている[121]。この見解では、ASDにおける産科的ネガティブイベントの高い有病率は、上述の母親の遺伝/エピジェネティックなメカニズムだけでなく、ホルモン因子が胎内環境を変化させ、生殖能力の低下を招き、帝王切開(CS)や早産などの緊急事態につながる妊娠および産科的合併症が増加することによっても説明される可能性がある[114]。
いくつかの研究では、CSおよび/または誘発分娩とASDとの関係の可能性が検討されているが、相反する結果となっている[122,123]。ASDの病因には、CS中のオキシトシン(OT)の変動が影響している可能性があるというのが、病因仮説の一つである。オキシトシン系のエピジェネティックな調節不全がASDの行動異常に関与している可能性がある。また,周産期におけるOTの変化は,社会的行動の発達に生涯にわたって影響を及ぼす可能性がある[124]。周産期には,計画的な帝王切開,合成OTによる陣痛の誘発,オキシトシン作動性拮抗薬による陣痛の中断などの様々なプロセスによっても,新生児のOTバランスが変化する可能性があるが,これらの操作の意味合いや中長期的な影響については,まだほとんど分かっていない[123,125]。
その他の周産期要因としては、妊娠36週未満、自然分娩、誘発分娩、または無分娩、逆子、子癇前症、胎児の苦痛などが研究されている[24,26,126]。早産の場合、絨毛膜羊膜炎、急性分娩内出血、および低体重は、早期自閉症スクリーニングにおける異常結果の高いリスクと関連している[127]。ある研究によると、4以上の妊娠はASDリスクを低下させる保護因子である可能性がある[126]。
マイクロバイオーム
ASD患者の腸内細菌叢は,健常者とは異なる組成を示し(例えば,Clostridia属,Bacteroidetes属,Desulfovibrio属,Sutterella属の割合が高い),ASD患者が頻繁に経験する胃腸障害の原因となっている可能性を示唆する科学的証拠が蓄積されつつある。ASD患者を対象とした最近のエビデンスによると、微生物叢移植は、胃腸症状およびASD症状を改善するための有望なアプローチであることが示唆されている[128]。ASD動物モデルでも裏付けられたデータによると、プロバイオティクス治療および糞便微生物叢移植の潜在的な有益性が示されている[129]。しかし、ASDの臨床表現型に対する長期的な改善効果を評価するには、さらなる研究が必要である。マイクロバイオームを標的とするもう一つの方法は、善玉菌の成長と活性を誘導するガラクトオリゴ糖(GOS)などの繊維を含むプレバイオティクスを用いた食事介入である[130]。最近では、排除食とGOSの補給を組み合わせることで、ASDの反社会的行動が大幅に改善する可能性が示唆されている[131]。
胎児環境は当初、完全に無菌状態であると考えられていたが、最近の証拠では、羊水や胎盤にはいくつかの細菌が存在することが示唆されている。これらの新たな発見の意味するところは、発達中の子孫の微生物組成は、出生前の段階でも環境の変化に敏感である可能性があるということである[132]。動物モデルでは、母親の腸内細菌が子孫の神経発達異常を促進することが示唆されており、おそらく、T-ヘルパー-17細胞を介して、その後の免疫系の活性化につながると考えられている[133]。
表1は、ASDに関与していると考えられている主な環境リスク因子の詳細を、最も重要な曝露期間との関連でまとめたものである。
表1 自閉症スペクトラム障害(ASD)に関与すると考えられる環境リスク因子
| 危険因子 | 仮定された行動期間 | 選択された研究 |
|---|---|---|
| 高度な親の年齢 | 概念 | Durkin et al.,2008 [ 23 ]; Ben Itzchak et al.,2011 [ 24 ]; Geier et al.,2016 [ 25 ]; Sandin et al.,2016 [ 27 ]; Modabbernia et al.,2017 [ 26 ] |
| ホルモン誘導の使用; 生殖補助医療(ART) | 概念 | Auyeung et al.,2009 [ 36 ]; Zachor&Ben Itzchak。 2011 [ 38 ]; Liu et al.,2017 [ 31 ] |
| 環境化学物質および毒物: 大気汚染 農薬 フタル酸エステル |
受胎、出生前 | Volk et al.,2011 [ 69 ]; Becerra et al.,2013 [ 70 ]; Rossignol et al.,2014 [ 40 ]; Weisskopf et al.,2015 [ 67 ]; Gong et al.,2017 [ 71 ]; Raz et al.,2018 [ 73 ]; Eskenazi et al.,2007 [ 79 ]; Cheslack-Postava 2013 [ 77 ]; シン et al 2018 [ 134 ]; ブラウン他 2014年[ 78 ] |
| 栄養的要因: 母体の肥満または 栄養失調は、 ビタミンD欠乏症、 鉄欠乏症に続く |
概念; 出生前; 出生後早期 | Georgieff et al.,2007 [ 45 ]; Krakowiak et al.,2012 [ 41 ]; Getz et al.,2016 [ 42 ]; Andersen et al.,2018 [ 43 ]; シュミット et al 2011,2012及び2017 [。46、135、136 ]。Vinkhuyzen et al.,2017 [ 101 ]; Schmidt et al.,2014 [ 53 ] |
| 薬: バルプロ酸 、他の抗てんかん薬 のSSRIの 抗生物質 抗生物質 |
出生前 | Roullet、et al.,2013 [ 86 ]; Veroniki et al.,2017 [ 87 ]; Mezzacappa et al.,2017 [ 57 ]; Atladottir 2012 [ 91 ] |
| 感染症; 熱; 母体の免疫活性化(MIA) |
出生前 | Zerbo et al.,2013 [ 105 ]; Jiang et al.,2016 [ 137 ]; Brucato et al.,2017 [ 106 ]; Zerbo et al.,2013 [ 105 ]; Parker-Athill et al.,2010 [ 109 ]; ジョーンズ他 2017 [ 110 ] |
| 母体の個々の要因と病気: 妊娠糖尿病; 母体のメラトニンレベル; うつ (?) |
出生前 | Gardener et al.,2009 [ 114 ]; Lyall et al.,2012 [ 115 ]; Jin et al.,2018 [ 120 ] |
| 配送方法 | 周産期 | Dodds et al.,2011 [ 122 ]; Emberti Gialloreti et al.,2014 [ 123 ] |
| 胎児の苦痛 | 周産期 | Modabbernia et al.,2017 [ 26 ]; Wang et al.,2017 [ 126 ] |
5. 遺伝子-環境相互作用とエピジェネティクス
ASDの病因における環境リスク因子の病因的役割は、独立した要素として考えるのではなく、遺伝子成分にエピジェネティックに影響を与える複雑なネットワークのように考えなければならない。さらに最近では、ASDの病因に環境因子を結びつける因果関係を確立するために、関連性の観察からより機構的な研究へと移行することが強調されている[26]。
例えば、オゾンへの曝露とASDのリスクとの関連は、CNVの負荷が高い人の間でのみ示されている[61]。さらに,ASDの発症と重症化に対するMIAの影響は,遺伝的感受性に大きく影響されるようである[137,138]。ある種の毒素やビタミンDの欠乏などの環境因子は、遺伝子変異のリスクを高め、それがASDのリスクを高めることになる[139]。同様に、母親の脂肪率と新生児の血中DNAメチル化の変化との関連が確認されていることから、胎児の神経発達に重要ないくつかの重要な遺伝子(アポリポタンパクDなど)の発現が変化する可能性がある[135]。
遺伝子と環境の関係の影響を説明するために、多くの研究者がASDの病因にエピジェネティクスが関与している可能性を調べることに関心を寄せている[140,141]。エピジェネティックなメカニズムは、DNAの配列を変えずに遺伝子発現に影響を与えるDNAの生化学的修飾であり、これらは環境因子への暴露によって影響を受ける[20]。エピジェネティックプログラミングは、発育過程におけるさまざまな環境への曝露に応じて動的に変化し、クロマチンリモデリング、ヒストン修飾、DNAメチル化、マイクロRNA(miRNA)の発現など、相互に関連するいくつかのプロセスを含んでいる。エピジェネティックなメカニズムは、正常な脳の発達に重要な役割を果たしており、遺伝的素因と環境要因の間の架け橋となっている。エピジェネティックなメカニズムは、個人レベルと世代を超えたレベルの両方で、生涯を通じて脳機能に影響を与える。いくつかの研究では,エピジェネティックなプロセスにおける胎児期の感染症などのストレス体験の潜在的な影響についても検討されている。特に,MIAの動物モデルでは,出生前に感染した子孫は,miRNAの発現,ヒストン修飾の変化,DNAメチル化の変化に有意な差を示すことが明らかになった[132]。
6. 保護因子
すでに述べたように、ASDの遺伝的および環境的な危険因子についての知識は向上しつつある。しかし、個々の発達の軌跡や結果は、リスク因子の影響だけではなく、リスク因子と保護因子の相互作用も考慮しなければならない。以前は、保護因子とは、知的指数が高いとか、社会的スキルが高いなど、個人が本来持っている特性だけだと考えられてた。現在では、出産前後の環境要因も考慮する必要があることが理解されつつある。しかし、ASDのリスクを低減するために、環境的なリスク要因を特定し、それを防止することへの関心が高まっているにもかかわらず、今日までASDの保護要因についてはほとんど知られていない。それにもかかわらず、ここ数年、長期的な転帰を改善する可能性のある因子を特定しようとする努力が増えている[142]。
母親の食事の要素の中には、自閉症の中核症状に対抗して保護的役割を果たすものがあるかもしれない。母親の食事でASDに対して保護的な役割を果たしていると思われる主な要素は、脂肪酸、ビタミンD(vit.D)および鉄である[99]。
受胎前期および/または妊娠初期に1日平均600μg以上のFAを摂取することは、母親の脂肪酸が著しく不足している場合に限り、ASDリスクの40%低下と関連する[100,143]。脂肪酸とASDリスク低下との関連は、MTHFR 677 C > T(シトシン > チミン)変異株遺伝子型を持つ母子で最も強く、葉酸代謝の効率が低下することになる[143]。
いくつかの研究によると、妊娠中にビタミンDのサプリメントを摂取することで、子孫のASD発症リスクを低減できる可能性があるとされている[144]。
妊娠末期、特に授乳中の鉄分摂取量が多いと、少ない場合に比べてASDリスクの低下と関連していた[53]。
さらに、いくつかのメタアナリシスでは、母乳育児(専らまたは追加のサプリメントを伴う)がASDを予防する可能性があるという証拠が示されている[145]。母乳育児は、母乳の保護効果を反映している可能性がある[145,146,147]。例えば、母乳にはビフィズス菌、リゾチーム、リポキシン、グルタチオン、抗炎症性サイトカインなどが含まれている。文献によると、ASDの子どもは、対照群に比べて、消化管内のビフィズス菌やリゾチームの量が少なく、血漿中の炎症性サイトカインの量が多いことが示唆されている。したがって、母乳に含まれる多くの成分がASDのリスク低下に関係している可能性がある。
さらに、精神疾患では脂質組成(リピドミクス)が重要であると考えられていることから、母親の食事における多価不飽和脂肪酸(PUFA)への関心が高まっている[148]。出生前の母親の食事におけるPUFA,特にオメガ3脂肪酸の増加は,ASDリスクの低下と関連していた[19]。
保護因子としての役割を果たす可能性のあるもう一つの因子はメラトニンである。メラトニンの合成は、ASD患者とその母親で頻繁に障害されている。したがって、妊娠中にこのホルモンを摂取すると、神経保護因子として作用し、ASDを含む神経発達障害のリスクが低下する可能性がある[120]。
表2は、ASDの主な既知の保護因子を、示唆される暴露期間との関連でまとめたものである。これらの保護因子は、悪い結果を予防したり、より良い結果に修正したりして、より健康的な生活の可能性を高める可能性がある。これらの理由から、保護因子の強化に焦点を当てることは、ASDの臨床的アプローチだけでなく、予防法の重要な要素としてますます考慮されるべきである。
表2 ASDの保護因子の提案
| 栄養保護因子 | ばく露期間 | 勉強 |
|---|---|---|
| 600μg以上の 葉酸葉酸+ MTHFR 677 C> T変異遺伝子型 |
出生 前出生前 |
Schmidt et al.,2012 [ 143 ]; Schmidt et al.,2011 [ 149 ]; Suren et al.,2013 [ 100 ] |
| 脂肪酸 PUFA |
出生前 | Lyall et al.,2013 [ 19 ]; Morgese et al.,2016 [ 148 ] |
| ビタミンD | 出生前 | Stubbs et al.,2016 [ 144 ] |
| アイアン アイアン+母乳 |
出生前; 生後 | Schmidt et al.,2014 [ 53 ] |
| メラトニン | 出生前 | Jin et al.,2018 [ 120 ] |
| 母乳育児 | 生後 | Bar et al.,2016 [ 146 ]; Boucher et al.,2017 [ 147 ]; Tseng et al.,2017 [ 145 ] |
7. 早期介入の戦略
受胎前と出生前の期間は、おそらくリスク因子と保護因子が主要な役割を果たす段階である。しかし、よく知られている出生後の脳の可塑性は、生後1か月および/または1年の間に、ASDが患児の生活の質に与える影響を軽減するための追加の見通しがあることを示唆している。実際、ASDの子どもたちの発達過程は複雑で変化に富むため、潜在的な保護因子を特定し、効果的な治療法を開発することが大きな課題となっている。TSCやPTEN症候群のような神経発達障害の有病率が高い単一遺伝子症候群は、リスクと保護因子を調査するユニークな機会を提供する。実際、表現型の発達は、診断が下された時点で止まるわけではなく、いくつかのリスク因子と保護因子が、人生全体、特に初期の段階で共に作用し続けている。このため、早期発見とそれに続く早期介入戦略は、進化する発達の軌跡を積極的に修正する可能性がある。
実際、包括的な教育環境や肯定的な子育てなど、保護的であることが示されている一般的な環境面に加えて、ここ数年、特発性自閉症の患児には多くの周辺マーカーが確認されている。例えば、酸化還元バランスの変化とミトコンドリア機能障害 [150]、赤血球膜のNa+/K+-ATPase活性の低下を伴うDHAとコレステロールの減少 [151,152]、炎症性サイトカインのアップレギュレーションと微生物叢の機能不全 [153,154]、特徴的なメタボローム・シグネチャー [136,155]などである。これらの変化したパラメータは、早期診断のためのツールとなるだけでなく、自閉症の臨床症状とそのより一般的な併存疾患の発現の基礎となる、相互に関連した機能障害のネットワークのハブとみなされるべきである。このような末梢機能障害を、特に人生の非常に早い時期に改善することは、症状の重症度を軽減し、生活の質を向上させる上で大きな違いをもたらす可能性がある。理想的には、ハイリスクの乳幼児や新たに診断された幼児・児童に対して、栄養不足、酸化ストレス、ミトコンドリア機能障害、炎症マーカー、腸管漏出マーカー、膜の脂質組成など、多くの生物学的パラメータをモニターし、適切な栄養補助食品を提供することである。数ヶ月間の治療の後、臨床結果と生物学的パラメータを評価し、治療の効果を評価する。
8. 臨床上の推奨事項
表3は、脆弱性の期間ごとの主な臨床推奨事項をまとめたものである。しかし、これまでの章で述べてきたように、これらの要因のいくつかがASDリスクに与える影響は部分的にしか明らかにされていない。したがって、これらの臨床的推奨は、いまだに存在する矛盾したデータの解釈に関連する落とし穴の可能性を考慮して行われるべきである。このため、これらの推奨事項は、予防原則の観点から検討されるべきである。一般的な推奨事項の中には、禁煙、禁酒、葉酸やビタミンDの欠乏の予防など、もちろん各妊娠の妊産婦ケアに関連するものもある。しかし、小児科医は、ASDの危険因子として認識されている環境条件にも注意を払う必要がある。例えば、親の年齢が高い、ASDの兄弟がいる、未熟児、ARTの経験、母親の糖尿病、母親の肥満、抗てんかん薬や抗うつ薬の使用などが挙げられるが、これらに限定されるものではない。これらのケースでは、危険因子の影響を最小限に抑え、保護因子の影響を最大限に引き出すことを目的とした綿密なモニタリングが必要である。
表3. 受胎前、出生前、出生後早期の臨床上の推奨事項を示している
| 臨床上の推奨事項 | リスク要因の最小化 | 保護因子の最大化 | 参考文献 |
|---|---|---|---|
| 受胎前後の期間 | 肥満の場合は女性の体重減少を、糖尿病の場合は厳格な血糖コントロールを奨励する。 先入観のある母体の疾患および/または状態(精神状態、ビタミンDまたは葉酸欠乏症)の綿密なモニタリングおよび/または治療; 出生後の頻繁な発達サーベイランスを使用したART使用後に生まれた子供の綿密なフォローアップ |
女性の食事を監視する。 妊娠前に天然資源から毎日の葉酸とビタミンDを摂取することを想定することを奨励する。日光に適度にさらされている。 |
Peretti et al。、2017 [ 99 ]; Schmidt et al。、2012 [ 143 ]; Andersen et al。、2018 [ 43 ]; Oberlander et al。、2017 [ 90 ]; Zachor&Ben Itzchak、2011 [ 38 ] |
| 出生前の期間 | 軽度の感染症や炎症性エピソードのある母親に対しても、綿密なモニタリングと対症療法。 予防接種プログラムによる妊娠中の感染症の予防; 長期の薬を使用している母親の監視。 すでに自閉症の子供がいる、および/またはdenovoまたは遺伝性のASD関連CNVを持っている母親は、その後の妊娠で環境的侮辱を受けやすくなる。したがって、妊娠中の感染症や炎症エピソードの厳密な監視と治療を強くお勧めする。 |
妊娠の最初の月の間、600μg以上の葉酸を毎日摂取することをお勧めする。 ビタミンDと鉄の一定の摂取をお勧めする |
Babenko et al。、2015 [ 156 ]; Schmidt et al。、2014 [ 53 ]; Mezzacappa et al。、2017 [ 57 ]; Veroniki et al。、2017 [ 87 ] |
| 周産期/出生後早期 | 未熟児だけでなく、周産期の合併症が軽度の新生児も綿密に監視する。 早産児の医学的および神経心理学的フォローアップを定義した。M-CHATなどの機器を使用した、AAPが推奨するすべての早産児におけるASDスクリーニング 症候群ASDの場合:ASDを示唆する初期兆候(すなわち、TSCの社会的コミュニケーション行動の欠陥、低適応性)を迅速に特定するための早期かつ頻繁な神経発達評価FXSの社会的領域での行動、アンジェルマン症候群の言語発達の欠如、および早産児の共同注意の困難) てんかんのリスクが高い場合、EEGモニタリングおよび発作の即時治療(長期転帰への影響を最小限に抑えるため) すべての高リスク乳児(遺伝性症候群、早産、家族歴)において、早期紹介と親を介した介入を正当化するための親の教育 |
可能な限り、母乳育児を奨励してほしい。 乳幼児の食事を監視する。 認知能力を強化するための早期の標的行動介入。これは、ASD症状の重症度を軽減する保護因子として機能する可能性がある。 |
Curatolo et al。、2018 [ 157 ]; Peralta-Carcelen et al。、2018 [ 158 ]; McDonald et al。、2017 [ 159 ]; Tseng et al。、2017 [ 145 ]; Peretti et al。、2017 [ 99 ]; Zwaigenbaum et al。、2015 [ 160 ]; Bonati et al。、2007 [ 161 ]; McCary et al。、[ 162 ]; ジョーンズら、2017 [ 163 ] |
| 高リスクの乳児および新たに診断された幼児/子供ではできるだけ早く | 生物学的パラメータの評価に続いて、適切な栄養補助食品を提供する | Li et al。、2017 [ 164 ]; Adams et al。、2018 [ 165 ] |
もちろん、自動車の排気ガスやその他の種類の大気汚染のように、危険因子の影響を軽減することが個人の選択の特権ではなく、政府の政策の問題である状況もある。とはいえ、換気の改善や空気清浄機など、いくつかの簡単な戦略は、少なくとも室内の汚染を減らすのに役立つ。
いずれにしても、これらの要因のいくつかは、例えば注意欠陥多動性障害(ADHD)行動上の問題、あるいは行動スコアの低下など、他の神経発達障害や精神疾患とも関連していることにも言及しておく必要がある[166]。実際のところ、神経発達障害の併発は、例外ではなく規則であることが多いと認識されている。このような観点から、ある環境因子がASDのリスクを高めるかどうかだけでなく、社会的コミュニケーションや反復行動など、ASDのさまざまな特徴のうちの1つだけに影響を与えるかどうかも問うべきである。
つまり、遺伝的要因、エピジェネティックな要因、環境的要因の相乗効果により、妊娠中、特にASDの子どもを持つリスクの高い母親の一部で、ASDに対する感受性が高くなる可能性があるということである。現時点では、これらの要因の大部分の病因的影響を変えることはできないが、いくつかの修正可能な環境因子を調整することで、障害の重症度を抑制し、潜在的には発症を予防することができる。
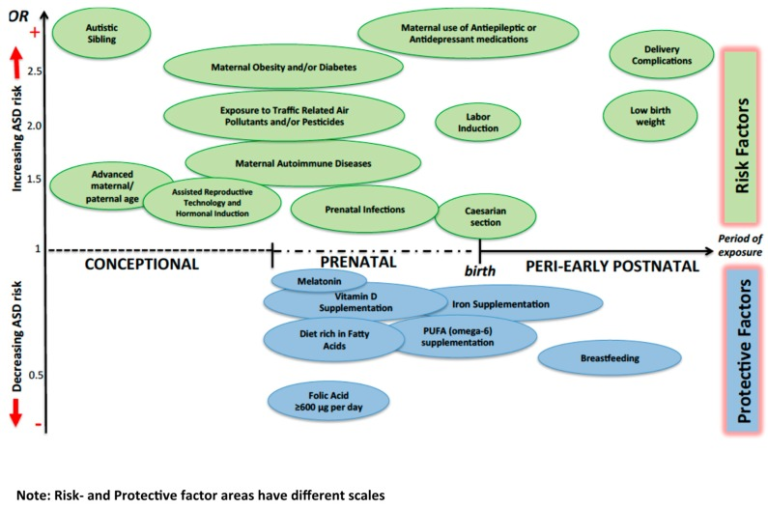
図1は、特定の環境因子がASDのリスクに与える影響をまとめたものである。
図1. さまざまな環境因子がASDリスクに与える影響の可能性
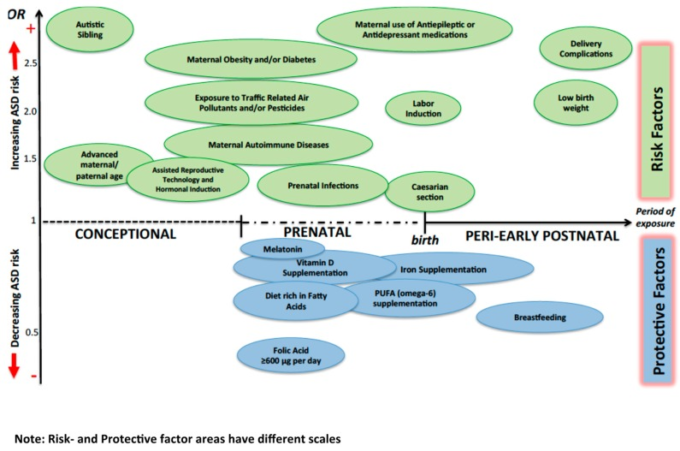
母乳育児以外の保護因子のオッズ比(OR)は、通常、母親が特定の因子の欠如を呈している状態を指す。自閉症の兄弟姉妹」のORは7程度なので、スケールアウトして表示している。
9. 今後の展望
今後の研究では、ASDの複雑性や異質性を考慮し、ASDに関連する多様で複数のリスク因子や保護因子の相互作用を検出することを目指す必要がある。したがって、単一の危険因子の研究から、遺伝と環境のダイナミックな関係を考慮したモデルへと移行する必要がある。新しい遺伝学的・エピジェネティックな証拠や、細胞モデル、計算機モデル、動物モデルから得られるデータを考慮して、多世代を含む大規模で長期的な遺伝学的情報に基づく前向き研究が必要である。また、リスク因子や保護因子が作用する重要な発達期に関連した曝露のタイミングを特定するためには、大規模かつ異種のサンプルサイズが必要である。さらに、環境有害物質に関する研究は、これまで、信頼性の高い曝露量の測定ができないために、大きく制限されてきた。さらに、この分野では前向きな研究が必要である。
結論として、近年の分子生物学の発展とビッグデータを用いたアプローチは、共存する多くの要因を評価することができ、ASDの発症につながる遺伝子と環境の相互作用を解明する新たな機会を提供している。
寄稿
P.C.、L.E.G.、L.M.は、コンセンサス会議の構想を練り、P.C.、L.E.G.は、コンセンサス会議の実施、インフラ、ロジスティックの調整を行い、全著者はコンセンサス会議に積極的に参加し、P.C.、L.E.G.、M.M, P.C.、L.E.G.、M.M.、A.B.、R.M.、M.S.が構想を練り、最初の原稿を作成し、最終的な原稿を検討・修正し、L.M.、A.F.、A.G.A.、R.R.、D.Z.が原稿を批判的に検討・修正し、著者全員が最終的な原稿を承認した。
利害の衝突
著者は利益相反を宣言していない。