Contents
Rhythms of life: circadian disruption and brain disorders across the lifespan
www.ncbi.nlm.nih.gov/pmc/articles/PMC6338075/
要旨
脳機能を含む人体の多くのプロセスは24時間周期で制御されており、乱れた概日リズム(例えば、睡眠-覚醒周期)と中枢神経系の障害との間には強い関連性がある。自閉症、うつ病、パーキンソン病などの脳障害は、典型的には人生の特定の段階で発症し、概日リズムは、これらの障害の発症に影響を与える可能性のあるプロセスの調節のために人生の各段階で重要である。
ここでは、人間の生涯を通じて様々な脳疾患で観察される概日リズムの乱れについて説明し、これらの乱れが脳に影響を与えることを示唆する新たな証拠を強調する。
現在のところ、脳疾患と概日性機能障害を結びつける証拠の多くは相関関係にあるため、どのような因果関係が存在するのか、またどのような因果関係があるのかは不明である。したがって、我々は、概日リズムの乱れと中枢神経系の障害との関連性をよりよく理解するために、将来の研究につながる可能性のある、残された疑問点を明らかにする。
概日リズムは、人間の脳と身体のあらゆる生理的プロセスで見られる24時間近くの振動である1。視床下部にある視床上核(SCN)は、ニューロン活動、体温、ホルモン信号を調節することでリズムのタイミングを設定するペースメーカーの役割を果たしている2(図1)。
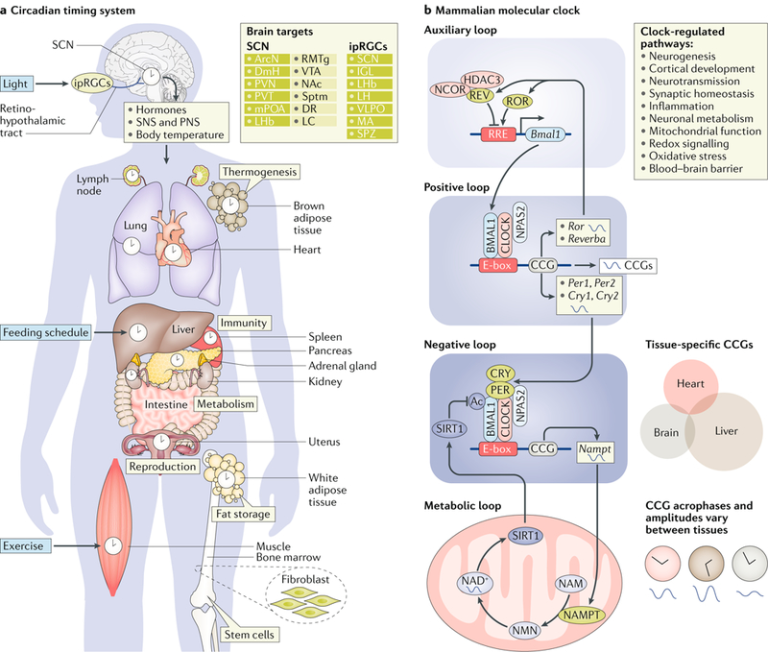
図1 サーカディアン・タイミング・システム
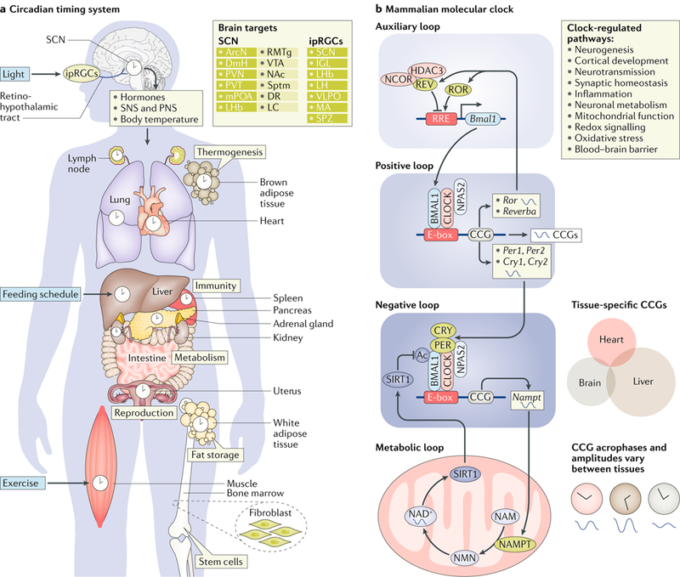
a|サーカディアン・タイミング・システムは、環境の変化に適応して生理機能を最適化するために、全身の時計を同期させている。光は、目の中の特殊なメラノプシン産生網膜神経節細胞(ipRGC)によって受け取られる。これらのipRGCは、網膜視床下部路を通って視交叉上核(SCN)などの脳領域に投射される。SCNは、直接投射(濃い緑色のボックス)と間接投射(薄い緑色のボックス)を介して脳の他の領域にタイミング情報を中継している。体液性信号と末梢神経系(つまり、交感神経系(SNS)と副交感神経系(末梢神経系))は、SCNからの情報を伝達して末梢時計を調整する。摂食スケジュールと運動もまた、中枢時計と末梢時計を巻き込むことができる。哺乳類の分子時計は、ほぼ24時間周期で振動する転写と翻訳のフィードバックループで構成されている。この正のループは、核内の脳と筋肉のARNT様1(BMAL1)と概日運動器出力サイクルタンパク質kaput(CLOCK)またはニューロンPASドメイン含有タンパク質2(NPAS2)のいずれかのヘテロ二量化によって駆動される。得られたヘテロダイマーは、遺伝子プロモーターのエンハンサーボックス(Eボックス)に結合し、周期(PER)タンパク質やクリプトクローム(CRY)タンパク質をコードするものを含む、時計制御遺伝子(CCG)の転写を制御する。PERタンパク質とCRYタンパク質は概日周期の間に細胞質に蓄積され、最終的には二量体化して核に移動して自身の転写を阻害し、ネガティブフィードバックループを閉じる。補助ループは、核内レチノイン酸受容体関連オーファン受容体(RORαおよびRORβ)およびREV-ERB(REV-ERBαおよびREV-ERBβ)を含み、これらはまた、CLOCK-BMAL1ヘテロダイマーによって転写制御される。REV-ERBα(図ではREV)およびRORαは、それぞれRORまたはREV-ERB応答エレメント(RRE)を阻害・活性化することにより、Bmal1の転写を抑制・活性化する。CLOCK-BMAL1複合体はまた、ニコチンアミド(NAM)からのNAD+生合成の律速酵素であるニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)の発現を制御する。NAMはNAMPTによって修飾されてニコチンアミドモノヌクレオチド(NMN)を生成し、このNMNはいくつかのアデニルトランスフェラーゼによってNAD+に変換される。このように、NAMPTの振動はNAD+レベルの概日変動を制御し、サーチュイン1(SIRT1)活性とシグナル伝達を調節する。NAD+レベルが高いと、SIRT1の活性化が促進される。SIRT1はCLOCK-BMAL1と直接相互作用してBMAL1を脱アセチル化し、CLOCK駆動の転写を阻害する。組織や細胞型の間では、CCGや他の分子や細胞のリズムは、異なるアクロフェーズ(発現のピークの位相)振幅、さらには周期性を持って発現している可能性がある。ArcN、弧状核、DmH、背側視床下部、DR、背側辺縁部、IGL、遺伝子間葉状部、LC、脊髄座、LH、側方視床下部、LHb、側方手綱膜、MA、内側扁桃体、mPOA、内側前頭前野、NAc、後頭核。PVN、視床下部傍室核;PVT、視床傍室核;RMTg、吻側中隔核;Sptm、中隔;SPZ、副室下帯;VLPO、ベントロラテラル前頭前核;VTA、腹側中隔領域。
個々の細胞では、分子リズムは、コア転写活性化因子を含む転写翻訳フィードバックループによって生成される ・circadian locomotor output cycles kaput(CLOCK)密接に関連するニューロンPASドメインタンパク質2(NPAS2)および脳および筋肉ARNT様タンパク質1(BMAL1) ・ピリオド(PER)およびクリプトクローム(CRY)1をコードするものを含む多くの遺伝子の発現を調節するものであり、一旦翻訳されると、それら自身の転写を阻害する。様々なキナーゼ、ホスファターゼ、その他の転写因子を含む他の多くのタンパク質が、このコアとなる分子時計を制御している(図1)。
概日リズムは、遺伝的要因と環境的要因の両方によって設定される。ほとんどの人の睡眠覚醒リズムと活動リズムは、環境的な手がかりがない場合、24 時間よりもわずかに長い3,4 が、この期間の長さは概日性遺伝子の変異によって影響を受ける可能性がある5。光への曝露、社会的合図、食事時間、仕事のスケジュールなどの環境要因も、これらのリズムの周期、位相、振幅に影響を与える6,7。
概日リズムは乳児期の初期に出現するが、生涯を通じて、また加齢に伴って様々な変化を受ける(図2)。一般的に、睡眠の開始と起床および他の生物学的リズム(例えば、メラトニンレベルの変動)のタイミングは、幼児期の間に成人に比べて早く8,9と思春期の間に遅くシフトし、タイミングのこのシフトは、げっ歯類および非ヒト霊長類(NHPs)10の間で保存される可能性がある。高齢者では、リズムは多くの場合、実質的に早期であることに戻り、このシフトは概日リズム11,12の弱体化を伴う可能性がある。
図2 生涯にわたるリズム
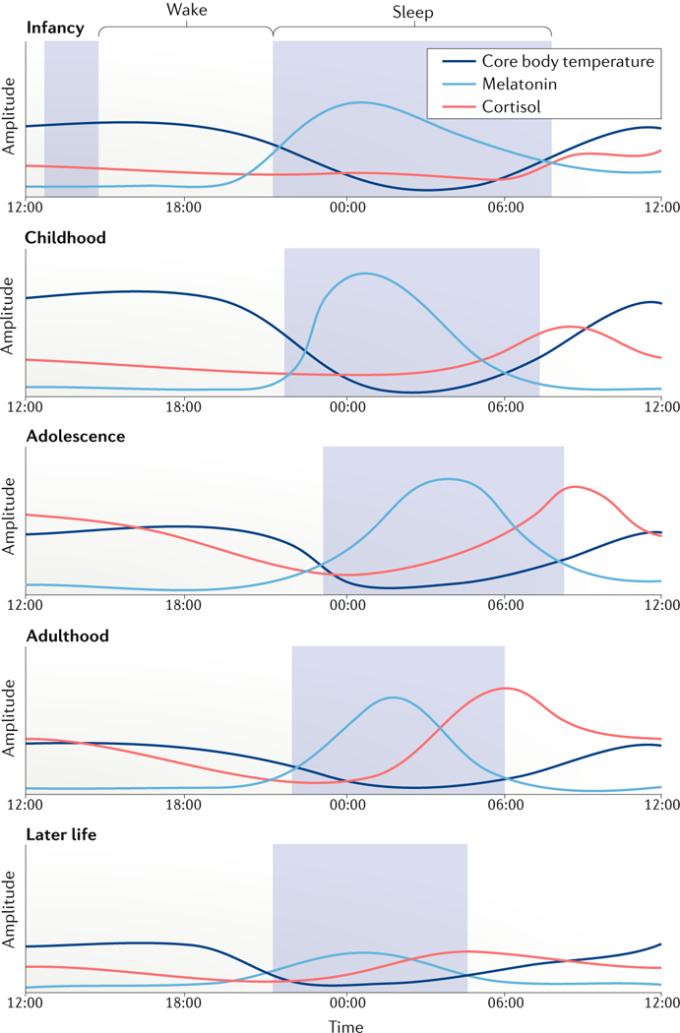
乳児期、思春期、成人期、高齢期のサーカディアンリズムの変化の模式図。乳児期には、睡眠覚醒リズムは超日周リズムとなり、発育の最初の1年間に統合される。小児期から青年期にかけては、早期型から後期型への顕著なシフトが見られ、その後、成人期には早期型になり、成人期までの睡眠持続時間は短くなる。リズムは加齢とともに振幅が徐々に失われていく。
体温リズムは小児期にピークを迎え、その振幅は加齢とともに着実に減少する。メラトニンのリズムは思春期に遅れ、全体的なレベルは小児期にピークを迎え、加齢とともに大幅に減少する。同様に、齧歯類を用いた研究では、視交叉上核(SCN)の活動リズムは加齢とともに徐々に低下することが示されている(図示せず)。
コルチゾールのリズムは小児期の朝方にピークを迎え、加齢とともに徐々に広がり、全体的な振幅は減少する。脳やその他の組織におけるリズミカルな遺伝子発現の振幅は加齢とともに減少し、組織の恒常性と機能に影響を与える(図示せず)。
概日リズムの機能障害は、いくつかの脳障害で観察され、典型的には人生のさまざまな段階で出現する。概日リズムの乱れは、脳障害の高いリスクと関連している。例えば、慢性的なシフト労働者(回転スケジュールや一貫した夜勤を持つ労働者)は、うつ病15-19などの精神疾患を含む様々な疾患13,14に脆弱である。現在利用可能な脳疾患と概日リズム機能障害との関連を示す証拠の多くは相関関係にあり、脳機能にとって概日リズムの重要性を考えると、驚くべきことではないかもしれない20。リズム機能障害と精神疾患との間の因果関係を特定することは、障害の治療に重要な意味を持つかもしれない。
精神医学、神経学、行動医学では、概日リズムに基づく新規の介入は稀であり、見落とされることが多い。概日リズムの乱れが障害の主な原因ではない場合であっても、行動学的、環境学的、または薬理学的手段を用いて睡眠覚醒パターンを安定化させることで、例えば症状が緩和されることがある。概日リズムが正常な機能や病理学的プロセスにどの程度関与しているかを理解するには、システム生物学的アプローチが必要である。このようなアプローチは、リズムと代謝障害21の間の複雑な関係を調査するために貴重であることが証明されており、サーカディアンシステム22を標的とした分子および行動療法を介して代謝性疾患や早老を治療するための強力なトランスレーショナルポテンシャルを提供し続けている。このレビューでは、我々は成人期に人間の開発と老化と一緒に発生する概日リズムの変化を説明し、異なるライフステージでの概日の混乱は、通常、神経発達障害、精神疾患や神経変性疾患など、これらの生活期間中に出現する特定の脳疾患に関連付けられている可能性があることを示唆する証拠を強調している。サーカディアン障害と脳障害を関連付ける研究のほとんどが相関関係にあるため、我々は特にメカニズムと因果関係に焦点を当てて主要な知見を強調する。さらに、治療や介入の意味合いについても議論する。
出生前の期間と幼児期
サーカディアンシステムの発達に関する我々の洞察の多くは、げっ歯類とNHPsの実験室での調査から得られたものである。妊娠中期から後期までに、代謝活動と遺伝子発現のリズムは、げっ歯類とNHPs23-25のSCNで明らかである;しかし、胎児のリズムと生理のためのSCNの初期の出生前開発の機能的重要性はあまり理解されていない。ヒトでは、メラトニンとドーパミン受容体は、メラトニンとドーパミンは、胎児のための概日情報の主要なコミュニケーターとして機能する可能性があることを示唆している、胎児SCN26-28の妊娠週18として早くも表示される29,30。母親からのメラトニンは容易に胎盤と胎児の血液脳関門を通過し、したがって、循環メラトニンの上昇31-34として、特に夕暮れから夜への移行時に、胎児に一日の時間情報の支配的なリレーである可能性がある。コルチコステロイドと一緒にメラトニンの概日リズムは、胎児の循環35,36と一緒に、臍帯動脈と静脈で検出可能である。胎児のリズムはまた、母体のコア体温、摂食とホルモンリリース27(図3)によって巻き込まれている。
図3 母体と胎児のリズム
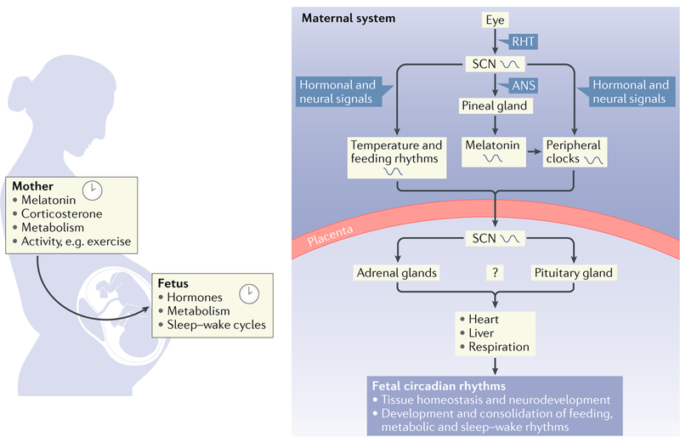
そのような副腎と視交叉上核(SCN)などの胎児の組織は、母体の摂食スケジュール、コア体温とメラトニンのリズムによって巻き込むことがある。メラトニンとグルココルチコイドを含む巻き込み信号は、脳と末梢組織の間で胎児の概日リズムの開発を巻き込み、変調または支援するために胎盤の障壁を横切ることがある。ANS、自律神経系、RHT、網膜下視床路。
出生前および母体のリズム。
疫学研究では、慢性的なシフトワーカー37-40 である妊婦の早産、低出生体重、流産のリスクが増加していることが報告されている。異常な睡眠、給餌と仕事のスケジュールは、そのようなメラトニンの変動などの母体のリズムを、混乱させる可能性があり、したがって、末梢振動子から母体のSCNを非同期化し、胎児にシフトワークの悪影響につながる。模擬シフトワーク(数週間のために3-4日ごとに明暗サイクルの完全な反転であること、)にさらされた妊娠ラットは、妊娠初期の間に大幅に減少した体重増加を示し、脂肪パッドと肝臓の重量を減少させ、また、コルチコステロン、グルコース、インスリン、レプチンレベル41の低振幅のリズムを示した。同じ操作はまた、胎児の肝臓で代謝と概日性遺伝子発現リズムに影響を与えたが、胎盤や胎児の成長には影響を与えなかった41。一定の光に妊娠したNHPを曝露すると、母体のリズムが胎児のサーカディアンシステム45の初期の脳の発達のために重要であることを示唆し、出生後の子孫のメラトニンと体温リズムの出現を抑制42-44。また、サーカディアン遺伝子(具体的には、Bmal1(Arntlとしても知られている)とPer2)とNMDA受容体サブユニット(Grin1b、Grin3aとGrin3bを含む)をコードする遺伝子の発現のリズムは、妊娠中に一定の光にさらされたラットの成体の子孫の海馬で抑制されている46。サーカディアン遺伝子発現のリズムの変化はまた、これらの子孫の空間記憶障害に関連付けられている46,47,およびこれらのメモリの赤字は、母親へのメラトニンの定期的に予定された補充によって防ぐことができる46。妊娠期の概日リズムの乱れはまた、彼らはさらに母親と子孫に妊娠中の概日リズムの安定性の重要性を強調し、彼らは非乱れた母親48によって交配されている場合でも、子犬の社会的回避と多動性行動を促進する。
他の研究では、夜間の薄暗い光であっても、親と子孫に生理的・行動的な影響を与えることが示されている。例えば、マウスを慢性的に夜間に薄暗い光にさらすと、適応免疫機能49 が損なわれ、子孫のうつ病に似た行動50 が増加する。このような影響は、繁殖前に夜間薄暗い光にさらされた両親の子孫でも明らかであり、夜間薄暗い光への曝露を繰り返すことで、世代間で受け継がれるエピジェネティックな変化が生じることが示唆されている。シフトワークや長時間労働の割合は、仕事や社会的要求から夜間の光の長時間への暴露、および電子デバイス51の使用を持っているように、過去10年間で増加しているため、このような研究は特に重要である。
幼児期のリズム
概日リズムは、出生から生後数ヶ月の間に徐々に出現する。体温リズムは、成熟期の乳児では生後ほぼすぐに出現するが、安静時活動、睡眠覚醒、ホルモンサイクルを含むその他のリズムは、通常、生後3~6ヵ月の間に発達する23,52。生後1年目の間、睡眠覚醒リズムは、日没時のメラトニン分泌量の増加と一致して、統合され続ける23。注目すべきことに、夜行性睡眠の開始は、出生後の最初の数ヶ月間は日没と結合され、その後は家族の就寝時間と結合されており、サーカディアンシステムは最初は光に支配されているが、その後は社会的・環境的要因に支配されていることを示唆している。ほとんどの乳児、幼児(2-3歳児)と幼児(4-11歳児)は、子供のクロノタイプ質問票によると、大人よりも早い睡眠覚醒パターンとより強い朝の好みを表示する ・親の報告書アンケートやアクチグラフィー8,9によって測定された睡眠の開始、中間点と起床時間の個人内および個人間の高いばらつきを考慮した場合でも。しかし、予定のない日には、子どもの起床時間が遅くなる傾向があり、睡眠覚醒時間が大幅に遅れることから、学校や親が課す予定などの社会的・環境的要因が、調査に基づく年代型の測定に大きな影響を与えていることが示唆されている9。重要なことは、予定された日に睡眠の開始時刻が常に早い子どもは、睡眠の開始時刻と起床時刻が遅い子どもよりも遅れる傾向があるということである9。
親による社会環境とスケジュール要求は、内因性概日リズムと睡眠リズムと相互作用し、社会的スケジュール、内因性概日生理、睡眠恒常性の間にミスアライメントの状態を作り出する。睡眠不足と一貫して短い睡眠時間は、2~5歳児の不注意、イライラ、多動性と関連している53,54。興味深いことに、3歳以前には、睡眠の質の低下と睡眠時間の短縮は、睡眠覚醒サイクルの不整合と概日リズムの緩慢さの結果である可能性があり、6歳時には多動性、認知障害、衝動性を予測する55,56が、中間期には正常な睡眠を示している子どもでも57。発達初期の睡眠-覚醒サイクルが一貫していないことが、幼児の情緒や行動の問題の発生率が着実に上昇していることに寄与している可能性がある58-61。追加の ・理想的には縦断的な ・乳児期から幼児期までの研究は、より良いサーカディアンシステムと脳の残りの部分の開発における環境と生物学と認知、気分や行動の問題への潜在的な関与の間の相互作用を理解するために必要とされている。これらの知見は、早期の子育ての実践を形作る遺伝的または他の生物学的要因の関与を排除するものではないが、これをサポートするために、大規模な双子の研究では、(むしろ遺伝よりも)共有環境が睡眠異常や行動問題62の主な影響力を持っていることが示唆された。
出生時には、光は概日リズムを巻き込むための最も重要な刺激である。げっ歯類の研究は、メラノプシン光受容体は、出生前に存在し、妊娠後に光応答性であり、人生の最初の数週間の間に機能的な再編成と成熟を受けることを実証している63-69。ラットでは、SCNへの光入力は生後10日目(reF.64)以降に成熟するが、マウスでは、これらの経路は、目が完全に開く生後14日目までに成熟する67,69。いくつかの研究では、早生まれの乳児の目は、妊娠30週目には早くも光に反応することが示されており、このことは、視覚入力経路が発達の第3期に機能している可能性を示唆している70,71。ヒヒの研究では、SCNにおける代謝活性と遺伝子発現は、満期の乳児の光入力に非常に応答し、ヒトの乳児と同様に、低強度の光によって巻き込むことができることが明らかになった72-74。
定期的な明暗スケジュールおよび/または低強度照明だけでなく、概日時計に影響を与える光の特定の波長は、未熟児の全体的な健康のために有益である可能性がある75-77。世界中の新生児集中治療室(NICU)では、ケアや看護スタッフが潜在的な緊急事態に容易に対応し、頻繁に健康状態をモニタリングできるように、一定の照明条件がしばしば使用されている78。しかし、未熟児(妊娠32週齢以上)をNICUで規則的な明暗スケジュールで飼育すると、常に明るい光や薄暗い光の下で飼育するよりも体重増加が早く、入院期間を効果的に短縮することができる76,77。規則的な明暗の環境で飼育された未熟児は、経口摂取も早く、人工呼吸器の介助を受けていた日数も少なかったが、NICU内の連続的な暗闇下(妊娠28~32週)で飼育された乳児と比較して、運動協調性は同等であった79-85。さらに、一定の薄明かりの中にいる乳児と比較して、泣き声が少なく、日中の活動性が高い81。また、定期的な明暗スケジュールは、未熟児の安静活動、睡眠覚醒、メラトニンリズムの早期成熟をサポートしている71,85。より対照的な比較研究が必要であるが、これらの知見は、定期的な明暗と給餌のスケジュールが、未熟児の胎内で母親のリズムと一定の暗闇環境の影響の早期喪失の一部を代用する可能性があることを強く示唆している。異なる明暗スケジュールがNICU内の乳児の長期的な健康状態の転帰を改善する可能性があるかどうかを判断するには、より大きな多施設無作為化試験が必要である。
神経発達障害
睡眠障害および概日リズムの乱れは、注意欠陥多動性障害(ADHD)自閉症スペクトラム障害(自閉症スペクトラム障害)プラダー・ウィリ症候群(PWS)およびスミス・マジェニス症候群(SMS)を含むいくつかの神経発達障害と関連している。小児期の最も一般的な神経発達障害の一つであるADHDは、不注意、衝動性と多動性を特徴とし、共起睡眠問題と概日変化86の高率に関連付けられている。睡眠の質の低下、概日位相の遅延と夜の好みは一貫してADHDを持つ子供と大人で報告されている87とADHDの症状88の重症度と相関している可能性がある。ADHD を持つ成人では、口腔粘膜でのサーカディアン遺伝子発現リズムの損失は、コルチゾール リズムと低振幅メラトニン リズムの遅延を伴う89。明るい光治療を使用してメラトニンリズムを改善すると、成人の多動性および衝動性の ADHD 症状が、睡眠時間、睡眠効率、覚醒時間、または睡眠中の覚醒の変化とは無関係に改善される87,90。
異常なメラトニンリズム(例えば、位相の遅れや振幅の減少など)は、ADHDを持つ小児でも報告されている87。ADHDの子供の睡眠覚醒サイクルの研究は、多くの場合、障害を治療するために使用される覚せい剤の効果によって複雑になることがよくある91。興味深いことに、ナルコレプシーやシフトワーク障害の治療に使用される刺激剤であるモダフィニルは、ADHD92の治療に有効である可能性があり、ドーパミン作動性シグナル伝達を標的とするとともに、中枢性ヒスタミンとオレキシンのシグナル伝達経路を含むアンフェタミンとメチルフェニデートによって標的とされるものとは異なる治療メカニズムを標的とし、睡眠の効率と質を改善する可能性がある93。
また、概日リズムの機能不全と自閉症スペクトラム障害(社会的コミュニケーションの障害、興味の制限、反復的な行動などで特徴づけられる神経発達障害)との関連性は、研究によって弱く示されている。睡眠の問題は自閉症スペクトラム障害の子どもたちに非常によく見られる94-96が、基礎となる概日リズムの異常を明らかにすることは困難であることが証明されている97,98。思春期前の子供、思春期の青年、および自閉症スペクトラム障害を持つ若年成人における最も一貫した関連所見は、夜間のメラトニンレベルの低下である99-102。自閉症スペクトラム障害のメラトニン合成障害の遺伝的な根拠は、自閉症スペクトラム障害を患っていない子供の親は夕方のメラトニンレベルが低く、N-アセチルセロトニンをメラトニンに変換するアセチルセロトニンメチルトランスフェラーゼ(ASMT)酵素102の活性が低いという知見に基づいて提案されている103。ASMT遺伝子のプロモーターに同定されたバリアントは、対照群と比較して自閉症スペクトラム障害患者に特異的であり、ASMT活性とメラトニンレベルの低下と関連していた102。メラトニンは、睡眠と概日リズムにおける役割に加えて、強力な抗酸化物質でもある。発達初期のメラトニンの減少は酸化ストレスの蓄積につながるという仮説が立てられており、これは発育途上の神経系に有害であり、自閉症スペクトラム障害などの神経発達障害のリスクを増加させる104。125人の小児および青年(2歳から17.5歳)を対象とした二重盲検プラセボ対照試験では、自閉症スペクトラム障害105に関連する睡眠障害を治療するためのメラトニン補給の使用が支持されており、サーカディアンリズムおよび睡眠問題、ならびに自閉症スペクトラム障害106の他の症状を標的とした他の治療的アプローチにつながる可能性がある。
PWSやSMSなどの他の神経発達障害は、機能不全の概日リズム経路とより直接的に関連している107,108。PWSは、乳児期および幼児期の低血圧および成長不全が特徴であり、その後、過食症および小児肥満、知的障害、低ゴナディズムおよび強迫性関連行動109が続く。PWSはまた、睡眠時間の短縮と日中の過度の眠気を伴う71,111,112。15q11-13遺伝子座は、マウスやヒトの脳で発現しているSNORD116を含む、小核性RNA(snoRNA)をコードする遺伝子のいくつかのクラスターを含んでいる113-115。マウスでは、Snord116の父性欠失は、ユビキチンリガーゼE3A(UBE3A)116をコードするUBE3aを含む、光期に特異的にいくつかの遺伝子の発現を増加させる。UBE3Aはサーカディアン転写因子BMAL1を標的とし、プロテアソーム分解を行うため、分子時計のタイミングを維持するために重要である117。UBE3Aは15q11-13遺伝子座の中にあるインプリント遺伝子群に属している。具体的には、ゲノムインプリンティングと呼ばれる、遺伝子制御と発生インプリンティングの稀なエピジェネティックなメカニズム118は、15q11-13遺伝子座の欠失による親由来特異的な効果をもたらす。例えば、SNORD116は父方に遺伝した対立遺伝子113から排他的に発現しているのに対し、UBE3Aの母方に遺伝した対立遺伝子はPWS119,120にリンクしている。15q11-13遺伝子座の母方重複は、UBE3Aの発現増加と父方アンチセンス転写産物であるUBE3A-ATS121-124のエピジェネティックサイレンシングにつながる。UBE3Aの母方対立遺伝子は、ニューロンにのみ刷り込まれ、他の細胞型120,125,126で対立遺伝子によって発現されている。UBE3Aの母性欠損マウスでは、脳内の運動リズムや分子リズムの周期延長は、CLOCKとBMAL1(reF.127)を含むコアクロック因子に依存している。興味深いことに、エピジェネティックにサイレンシングされた父方のUbe3a対立遺伝子の活性化は、神経細胞の概日リズム機能を回復させる127。このように、15q11-13遺伝子座の重複とSNORD116とUBE3Aの発生的インプリンティングは、PWS患者によく見られる概日リズムの乱れの分子的説明を与えてくれるかもしれない。
SMSは、頭蓋顔面および骨格の異常、代謝異常、肥満、知的障害およびステレオタイプの行動を特徴とするまれな神経発達障害であり、染色体領域17p11.2のヘテロ接合性欠失の結果である。欠失した領域にはいくつかの遺伝子が含まれており、その中にはレチノイン酸誘導遺伝子(RAI1)をコードする遺伝子が含まれているが、この遺伝子の欠失がこの疾患の特徴の多くに関与していると考えられている。RAI1はメラトニン分泌に関与しており、メラトニンリズムの反転がこれらの睡眠障害の原因となっている可能性がある132。RAI1のヘテロ欠損マウスでは、松果体メラトニンを産生しないC57BL/6を含む混合遺伝背景のマウスであるにもかかわらず、運動器活動期間が短縮されている133,134。内因性メラトニンを産生できる別のマウス背景に変異を導入することで、SMSに関連した睡眠や概日リズムの表現型により顕著な効果が得られる可能性がある。SMS患者のヒト細胞やマウスの脳では、RAI1はCLOCK遺伝子のイントロン1内のエンハンサーエレメントに直接結合することでCLOCKの転写を活性化する135。SMSの動物モデルや患者で観察された分子時計の乱れとメラトニン分泌の逆転を決定的に結びつけるためには、さらなる研究が必要である。概日性障害、睡眠障害、行動障害はSMS患者にとって最も重篤で治療が困難なものである。アセブトロールによるβ1-アドレナリン受容体の薬理学的拮抗作用を介して朝のメラトニンの上昇を減衰させることは(松果体メラトニン産生はβ1-およびα1受容体の交感神経系の活性化によって刺激されるため)4-18歳の患者10人のサンプルにおいて、日中の昼寝の減少、集中力の改善、かんしゃくの頻度の減少に効果的であった136。β1-アドレナリン受容体拮抗作用と外因性メラトニンの時限投与を組み合わせることで、睡眠が大幅に改善され(つまり、睡眠中の覚醒回数が減り、より整然とした睡眠段階が得られるようになる)SMS137を有する小児や青年の日中の乱れた行動が軽減される。したがって、SMS患者のメラトニンリズムの逆転を標的とした治療法は、睡眠だけでなく、行動、注意、学習137-139を改善する可能性がある。
思春期
人間、げっ歯類といくつかのNHPsは、思春期140の間に概日リズムの変化を受ける。性腺ホルモンの存在に依存しているシフト ・思春期の発症時に、睡眠覚醒サイクルとメラトニンのリズムは位相遅延141に開始され、それは性的成熟142,143と一致している。また、仲間からの社会的圧力や、就寝時間のルーチンへの親の関与の減少などの環境要因も、思春期の睡眠のタイミングと持続時間の変化に寄与する可能性がある140。光の位相シフト効果に対する感受性も役割を果たしている可能性があり、これは夜間の電子機器の使用がますます普及していることと、それらが睡眠のタイミング、持続時間、および質に及ぼす影響を考慮する場合には特に重要である144。例えば、夜間(23:00 h~24:00 h)の光曝露は思春期の若者のメラトニンレベルを抑制し、後期の思春期(11~15歳、後期思春期~後期思春期の段階)145よりも初期の思春期(9~14歳の思春期前~中期の思春期の若者)の方がより大きな抑制が起こる145。早朝の光曝露(03:00 hから04:00 hの間)もまたメラトニンを減少させたが、思春期初期と後期の間に差は見られなかった145。このように、光曝露に対する概日系の感受性は発達段階と時間帯に依存しており、思春期初期の若者は夜間の光の位相遅延効果に対して特に脆弱である可能性がある145。一晩に必要な睡眠量は様々であるが、米国小児科学会によると、米国の青年の大多数は一晩の睡眠時間が推奨されている8~10時間未満である146,147。米国の高校(15~18歳)では、小学校(9~10歳)や中学校(11~13歳)に比べて、学校の始業時間が1時間以上早いのが一般的であるため、睡眠時間が短いというこれらの問題の一因となっている可能性がある10,148。週末には、米国の思春期の若者は、自然な睡眠と覚醒のサイクルに戻ると同時に、学校の週 間の累積睡眠損失から回復するために、睡眠時間が遅くなる傾向がある149。平日から週末への移行は、しばしば「社会的時差ぼけ」と呼ばれる内因性時計の位相遅れ150,151を複合的に生じさせている148,152。
薬物使用障害
ヒトおよび動物モデルにおける研究から得られた新たな証拠は、思春期の睡眠および概日リズムの乱れが脳の発達に影響を与え、気分障害および薬物使用障害に対する脆弱性に寄与する可能性があることを示唆している(図4)。物質の実験は、多くの場合、思春期中期から青年期後期(年齢~14~18歳)に始まり、使用頻度は初期から 20代半ばにピークを迎える153。思春期のサーカディアンの乱れ(社会的時差ぼけなど)は薬物使用に対する脆弱性を高め、逆にこれらの物質への慢性的な曝露はサーカディアンと睡眠ネットワークの長期的な変化をもたらす可能性がある154。睡眠のタイミングと時間における平日と週末の違いは、リスクテイク行動、薬物使用、抑うつ的な気分の増加と関連している155,156。さらに、睡眠時間が短い思春期の若者は、カフェイン、ニコチン、アルコール、マリファナなどの物質を使用しやすく157-159,その他のリスクを伴う行動に従事する可能性が高い157,160,161。縦断的な追跡調査では、思春期および青年期の週末の遅延および睡眠タイミングの変動は、2年後のアルコール使用162および3年後および5年後のアルコール使用障害症状の発生率163と正の相関があり、アルコール使用障害の早期発症と関連していることが明らかになっている164。思春期および若年成人におけるより大きな夜間性およびより遅い睡眠時間は、物質乱用の増加と関連しており、単に夜間に薬物使用に従事する機会が増加した結果ではないかもしれない165-167。しかし、生物学的要因と社会的影響の役割については不明な点が多く、社会的背景も重要であり、社会的ネットワークが青年期の睡眠時間と薬物使用に影響を与える可能性がある168。
図4 社会的制約、睡眠、概日リズムの乱れが思春期の脳機能に及ぼす影響
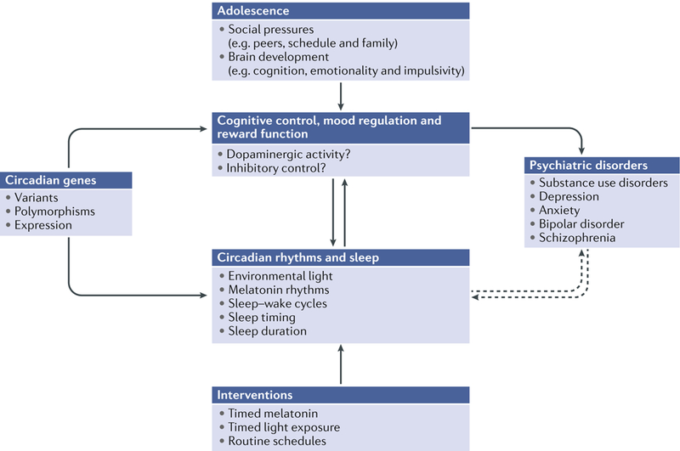
思春期の睡眠、概日リズム、精神疾患との関連について提案されたモデル。認知、気分、報酬を制御する神経回路は思春期に急速に成熟し、睡眠不足や概日リズムの乱れによって悪影響を受け、意思決定の低下、衝動性、危険な行動につながる可能性がある。基礎研究および臨床研究では、概日性遺伝子とその変異体は、認知、気分、報酬に重要なコルチコステリアターナルドーパミンおよびグルタミン酸シグナルに関連している。これらの変化は、精神疾患の発症の脆弱性に寄与している。気分障害、薬物使用障害、統合失調症を含むいくつかの精神疾患は、認知、意欲、衝動性に影響を与えるリズムや睡眠の変化と関連している。睡眠および/または概日リズムの乱れ(例えば、遺伝的および/または環境的な摂動)もまた、精神疾患に対する脆弱性およびその進行と関連している。睡眠および/または概日リズムを標的とする介入は、思春期の脆弱な時期に出現する障害の治療に治療的に有効であり得る。
思春期には、腹側線条体(VS;後天核を含む)背側線条体(DS)および内側前頭前野皮質(mPFC)169,170を含む前頭前野報酬回路で多くの発達的変化が起こる。これらの変化には、大脳辺縁回路におけるドーパミンの利用可能性の増加と同様に、シナプスの剪定と骨髄化107,171の増加が含まれる172,173。報酬関連回路の活動の亢進と認知制御中枢の未発達の組み合わせは、より大きな情緒性、衝動性、報酬を求める行動に寄与している174,175。概日リズムの乱れと睡眠の乱れは、ヒトの青年期における皮質制御をさらに低下させ、報酬回路の活動を増加させることで、これらの反応を増幅させる可能性がある。乱用薬物への慢性的な曝露は、分子時計に影響を与えるエピジェネティックな変化につながる可能性があり、それはその後長期間にわたって報酬回路の機能を変化させ、将来の薬物乱用に対する脆弱性を生み出す可能性がある176。
機能的MRIによる研究では、金銭的報酬課題時の線条体と前頭前野の脳領域の活性化(すなわち、グルコースの取り込み)は、青年期末期と若年成人(19~24歳)では朝よりも午後や夕方の方が大きいことが明らかにされている177。思春期後期の年齢をマッチさせたコホートでは、報酬の結果に対するVS反応が大きく、報酬の予測に対するmPFC反応が減少していることがイブニングネス179と関連しており、アルコール依存を予測している可能性が167ある。実際には、睡眠導入の大きな平日週末の進歩(例えば、早期の学校の開始時刻から週末のスケジュールへの移行に似ている)は、思春期、性別、総睡眠時間149を調整した後であっても、思春期初期の青少年(11-13歳)で金銭的報酬の期待と受信に低いmPFCの反応性と関連している。PFCの反応性が低下すると、衝動性やリスクテイクを含む線条体回路や関連行動の抑制が損なわれる可能性がある。報酬に対する神経反応とアルコール使用との間のこれらの関係が、概日性のずれやその他の要因に起因するかどうか、そのうちのいくつかが年代型に影響を及ぼす可能性があるかどうかは、依然として不明である。例えば、睡眠不足もまた、神経の報酬回路を変化させる可能性がある:一晩の完全な睡眠不足は、若年成人(18~25歳)180において、報酬刺激に反応してmPFCの活動が減少し、VSの活動が増加することにつながる。サーカディアンのずれや乱れが、独立して、あるいは睡眠不足と一緒に、報酬や認知神経系の発達にどのように影響を与えるか、また、これらの系を標的とした介入が臨床的に有益であるかどうかを決定するためには、ヒトと動物を対象としたさらなる調査が必要である。9つの研究で行われた最近のメタアナリシスでは、アルコール使用障害に対する不眠症治療の影響が調査された181。不眠症に対する行動的(薬理学的ではない)介入は睡眠の質を改善し、うつ病の症状を減少させた;しかしながら、これらの介入が断酒率を改善するという証拠はなく、睡眠の質の改善だけでは再発を防ぐのに十分ではないことが示唆された。慢性生物学的介入が薬物使用障害を発症するリスクを減少させることができるかどうか、またはこれらの障害を持つ患者を治療することができるかどうかを判断することは、今後の研究の重要かつ翻訳的に関連性のある道である。
気分障害
思春期は、大うつ病、双極性障害、統合失調症などの重篤な精神疾患が出現しやすい時期である。この発達期に重度の障害および/または苦痛を伴う障害の全有病率は22.2%182であり、気分障害の発症年齢の中央値は13歳182である。多くの気分障害、不安障害および精神病性障害の主な構成要素は、睡眠-覚醒サイクルの乱れである183-188。さらに、概日リズムの乱れは、すでに精神疾患を発症している人に気分障害や精神病エピソードを誘発することがある189-191。気分症状は、季節性情動障害や双極性障害の多くの症例で見られるように、季節的なパターンで起こることもある192,193;症状は、季節によって異なる光の量、持続時間、強度(つまり、短い日と長い日)194に関連している可能性がある。しかし、これらの障害は非常に異質であり、睡眠覚醒サイクルの乱れとの関連は個人によって大きく異なる。したがって、遺伝学的研究と同様に、すべての双極性障害や大うつ病の原因となる共通の概日リズムや睡眠に関連するメカニズムを特定することは考えにくい。
薬物使用障害と同様に、思春期および成人期初期のリズムの遅れは、うつ病および気分症状の重症度と強く関連している195,196。より最近の研究では、精神病のリスクが高い思春期(つまり、精神病の亜閾値症状、社会的障害、より高い疑い-パラノイア)197および気分障害を持つ個人における概日リズムの乱れが、縦断的研究において予後および症状の悪化を予測することが示されている198,199。これらの知見を合わせると、概日リズムと睡眠の乱れが気分障害に対する脆弱性と障害症状の促進に役割を果たしている可能性が示唆される。
これらの関連性の根底にあるメカニズムはまだ解明されていないが、一つの可能性としては、睡眠と概日リズムの乱れが、思春期の間の神経回路のシナプスの剪定と成熟に影響を与えるということである3,4,107,108,200。これらの選択的なシナプス剪定と洗練プロセスの多くは睡眠中に発生し、睡眠はヒトや動物における適切な回路の成熟と長期記憶の形成に不可欠である201-204。また、睡眠中の遅波活動は、劇的に思春期に特に減少し、この減少は、睡眠とシナプスの変化の間の重要なリンクをさらに実証し、シナプスの洗練から直接の結果であることが示唆されている107,108。思春期の間の過度の剪定またはあまりにも少ない剪定は、精神疾患の開発にリンクされている可能性がある205,206;例えば、思春期初期の間にラットの50%の睡眠制限の5日間は、運動野から脳の他の領域への投影のフラクションの変化につながった207。したがって、睡眠と概日リズムの安定性に影響を与える思春期の障害は、これらの疾患の脆弱性と後の人生での進行の基礎となる病態生理に寄与している可能性がある107,108。思春期の若者の推定7%が睡眠相遅延症候群の臨床基準を満たしており、思春期の若者の大多数が睡眠不足であると報告されているように208-210,学校の開始時間を遅らせることは、これらの条件の影響を抑制するための潜在的な介入として普遍的に考慮されるべきである211。
概日リズムを増幅したり、位相を早めたり、遅らせたりする治療法は、成人の精神疾患での使用の可能性を考えて開発されてきた。これらの治療法には、明るい光療法、急性睡眠遮断、対人・社会リズム療法、治療的メラトニンアゴニスト(アゴメラチンなど)189,212-214が含まれる。さらに、リチウム、バルプロ酸、選択的セロトニン再取り込み阻害薬(SSRI)などの抗うつ薬や気分安定薬は、すべて遺伝子発現リズムに劇的な影響を与え、それが少なくとも一部では治療効果の背景にあるかもしれない215-217。さらに、低用量ケタミンの迅速かつ持続的な抗うつ効果は、治療前の運動器活動リズムの測定値と、治療によって低振幅活動リズムがどの程度強化されるかに基づいて予測することができ、治療効果が概日系の強化に直接関係していることを示唆している218。このように、リズムの整列と増幅は、精神疾患の予防や治療を支援するための重要な治療的アプローチである。しかし、このような精神疾患に対する慢性療法はまだ黎明期にあり、エビデンスに基づいたものである必要がある。例えば、うつ病の患者は、夜間の慢性型で、気分の日内変動が正で、最高の気分は夕方に発生している場合、起床療法と睡眠時間の安定化を組み合わせた光治療に反応しやすくなる219。
成人期
ほとんどの人にとって、思春期から成人期にかけて、より早い年代型へと徐々にシフトしていく141。20歳から50歳までの間、男性は女性よりも平均的に夜を好む傾向が続き141,220,221,この性差は50歳を過ぎると消え、女性の閉経と重なる141,220,222。しかし、これらの年代型の指標は、社会的なスケジュールや仕事のスケジュールにも影響を受けており、思春期を過ぎても朝の嗜好性に戻らない人もいる223。CRY1,NFIL3,RORCなどの時計遺伝子の変異は、家族を対象とした遺伝学的研究において、極端な位相遅延(すなわち、遅発性睡眠覚醒相障害)と関連している224,225。うつ病のリスクは、この障害を持つ人、特に生物学的概日リズムのずれ(薄明メラトニン発症(DLMO)相によって測定される)を持つ人で増加している。さらに、双極性障害と診断されたほとんどの人は、思春期以降も持続する夕方のクロノタイプを持っている191,226。
シフトワーク障害と慢性時差ぼけ
私たちの24時間社会は、シフトワークと時差を越えた頻繁な移動の両方に依存している。シフトワークは、がん、肥満、心臓病、胃腸機能障害、睡眠障害、糖尿病、うつ病のリスクの増加に関連付けられている227. 11,450カナダの看護師の大規模な研究では、仕事のスケジュールとうつ病の間の最も強い関係は、急速に回転するスケジュールと未定義の回転スケジュール(ゆっくりと回転するスケジュールとは対照的に)228を働く人にあったことがわかった。この研究は、より深刻な概日リズムの乱れがうつ病を発症する可能性の高さと関連していることを示唆している。韓国の電子機器製造業の労働者14,000人を対象とした別の調査では、日中の労働者と比較して、シフト勤務の労働者は不眠症、うつ病、自殺願望の発生率が高いことが明らかになった(不眠症との関連が最も強い)229。
米国国民健康・栄養調査(NHANES)の一環として行われた客室乗務員約4,000人を対象とした調査では、客室乗務員は一般人口と比較して、睡眠障害、うつ病、不安、および/または疲労を持つ可能性が2~5.7倍高いことが明らかになった230。女性客室乗務員はまた、生殖がん、皮膚がん、慢性気管支炎や心臓病などの他の疾患の有病率も高い230,231。これはおそらく、宇宙放射線や航空機の換気不良などの機内環境における発がん性物質の影響であるが、夜勤勤務、不規則なスケジュール、頻繁な時間帯の移動などによっても悪化する可能性がある232,233。これらを総合すると、睡眠障害、うつ病、不安など、成人期の多くの健康問題は、交替勤務やその他の環境または遺伝的な睡眠覚醒サイクルの乱れによって引き起こされる概日リズムの乱れと関連していることがわかる。
晩年の生活
高齢者(65 歳以上)は一般的に睡眠時間が短く、睡眠効率が低下し、夜間の覚醒が増加し、睡眠潜時が増加し、昼間の眠気のレベルが高くなる234-236。いくつかの研究では、加齢に伴うメラトニンレベルの低下が報告されているが、他の研究では健康な集団の若年者と比較して差がないことが報告されている237,238。他のサーカディアン出力を測定した場合、高齢者では体温リズムの振幅が低く、内因性相の最小値が若年者よりも2時間近く早く発生している239。
重要なことは、高齢者の活動量と生理的リズムの測定は、健康問題、投薬、および中心時計への光入力を減少させる白内障などの眼の問題によって混同される可能性があるということである。ヒトおよびげっ歯類モデルでは、末梢振動リズムの振幅は加齢とともに減衰するが、この影響が内在性のコアクロック機能の喪失によるものか、SCNのシグナル伝達と接続の機能不全によるものか240,241,あるいは環境への同調の欠如によるものかは不明である242。ヒト243,244およびげっ歯類245,246では、SCNのバソプレッシン発現細胞数は加齢とともに減少し、SCNの出力を変化させる可能性がある。さらに、いくつかのSCN細胞は高齢の動物では(試験管内試験で測定されたように)無音になり、SCNニューロンは加齢とともに位相コヒーレンスを失う247,248。これらのSCNネットワークの変化は、非同期化とニューロン活動リズムの振幅の減少をもたらし、248,249,そして最終的には生理学的・行動的リズム241をもたらす。
SCNの変化に加えて、ヒトmPFCにおける遺伝子発現リズムも加齢とともに低下する;しかし、驚くべきことに、高齢者(65歳以上)では、別の遺伝子セットが新たにリズムをとるようになる11。この死後の研究では、生前に精神疾患や神経変性疾患を経験していなかったことから、これらのリズミカルな遺伝子は保護されている可能性がある。また、乱れた睡眠と概日リズムをヒトおよび動物モデルで神経変性疾患に結びつける証拠が蓄積されている235,236。
神経変性疾患
高齢者では、概日リズムの緩慢さや活動パターンの断片化が認知症発症の危険因子となっている250。さらに、CLOCKとBMAL1とPER1の一塩基多型(SNP)の発生率は、それぞれアルツハイマー病とパーキンソン病(PD)のリスク増加と関連している251-253。健康な高齢者と比較して、アルツハイマー病またはパーキンソン病の個人は、かなり低いメラトニンリズム振幅と過度の眠気、および他の睡眠覚醒サイクルの障害、例えば遅い睡眠のオンセット254-258を示している。パーキンソン病を持つ個人では、これらの睡眠覚醒症状は、多くの場合、運動や認知症状の開発に先行し、さらには診断バイオマーカーとして有用であるかもしれない259,260,一方、アルツハイマー病患者では、睡眠障害は診断後に開始する傾向がある261。アルツハイマー病の脳はSCN243,244,262のニューロンの著しい喪失を示し、SCNのニューロン喪失は死の前の同じ個体の運動活動リズムの振幅の減少と相関している240。さらに、アルツハイマー病患者はまだ複数の脳領域で循環時計遺伝子の発現を示すが、彼らは領域内および領域間の典型的な位相コヒーレンスを失う263。
マウスでは、代謝センシングタンパク質であり、CLOCKとBMAL1の機能を媒介するサーチュイン1(SIRT1)のSCNレベル(図1)は加齢とともに低下し、高齢者における概日リズムの乱れの増加を説明する可能性がある241。実際、げっ歯類における Sirt1 の脳特異的ノックアウトは、SCN とサーカディアン行動に対する加齢の影響を表現するのに十分であるが、Sirt1 の過剰発現は保護的である241。最近の研究では、SIRT1 がドーパミン作動性ニューロンのチロシン水酸化酵素(TH)をコードする遺伝子のプロモーターで CLOCK に結合し、TH の発現と最終的にはドーパミン合成のリズムを制御していることが明らかになった264(図 5)。鉄が細胞質に存在する場合(加齢に伴ってより頻繁に発生する可能性がある)265,266,ドーパミンはドーパミンキノン(DAQ)に酸化され、非常に反応性が高く毒性がある267,268。DAQは、PD269に関連する変異を持つヒト誘導多能性幹細胞由来のドーパミン神経ニューロンで発見されている。したがって、SIRT1の欠損は、DAQの毒性レベルと神経変性に寄与している可能性がある。
図5 ドーパミンのサーカディアン制御
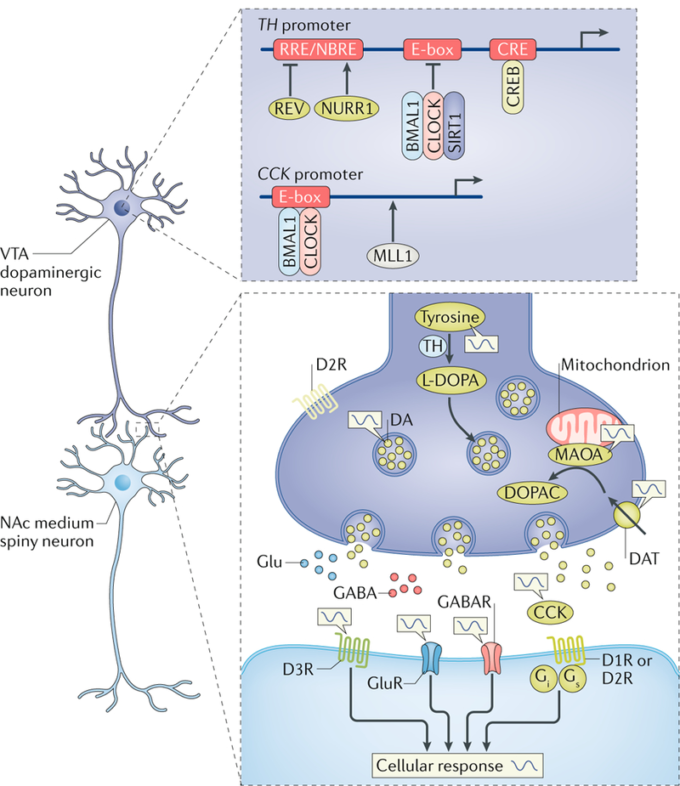
腹側セグメント野(VTA)-核酸受容体(NAc)回路は、局所的な分子時計によって制御されており、これはドーパミン(DA)シグナル伝達経路に関与する遺伝子の転写を制御するもので、エンコードするものを含む。チロシン水酸化酵素(TH)チロシンをDA前駆体であるl-ジヒドロキシフェニルアラニン(l-DOPA)に変換する主要な律速酵素、さらにDA放出を抑制するためにシナプス前のDA端末から放出される神経ペプチドであるコレシストキニン(CCK)DAを含むモノアミン神経伝達物質を代謝するために使用されるミトコンドリア酵素であるモノアミン酸化酵素A(MAOA)をコードする遺伝子などが含まれる。例えば、概日運動器出力サイクルプロテインカプト(CLOCK)および脳および筋肉ARNT様1(BMAL1)の概日転写因子はヘテロダイマーを形成し、代謝センサーおよびヒストンアセチラーゼサーチュイン1(SIRT1)をTHプロモーター内のエンハンサーボックス(Eボックス)にリクルートして、cAMP応答エレメント結合タンパク質(CREB)による転写を抑制する。CREBは、転写開始部位の近位に位置するCRE部位とサーカディアンEボックスを介してTHの転写を活性化する。さらに、CLOCKは、Cckプロモーター内のEボックスに結合して、VTAにおけるCckの転写を促進することができる。混合系統白血病タンパク質1(MLL1)もまた、CLOCK-BMAL1ヘテロダイマーにリクルートされ、ヒストンアセチル化を介して標的遺伝子の転写を促進する。また、REV-ERBα(REV)は、アンチフェーズでREV-ERB応答エレメント(RRE)プロモーター部位と転写因子NURR1の結合モチーフであるNBREに結合することで転写を抑制する。プレシナプスのドーパミン2受容体(D2R)もまた、分子時計によって制御されている可能性がある。ドーパミン、グルタミン酸、GABAレベルの日周リズムだけでなく、それらの受容体の発現と活性の日周リズムは、潜在的に一日の特定の時間帯に時間的にゲーティングとニューロン応答を促進し、NAcに存在している。DAT、DAトランスポーター;DOPAC、3-4-ジヒドロキシフェニル酢酸;GABAR、GABA受容体;Glu、グルタミン酸;GluR、グルタミン酸受容体(イオントロピー性)。
特にパーキンソン病は、急速眼球瞬間(reM)睡眠行動障害(RBD)だけでなく、日中の過度の眠気、不眠症、レストレスレッグス症候群270-273と強く関連している。実際、RBD患者の80%以上が後にパーキンソン病や認知症と診断されている274,275。α-シヌクレインを過剰発現させたトランスジェニックマウス(PDモデル)では、活動期の運動リズムの断片化と振幅の低下が顕著であり、加齢とともにその影響は進行する276。これらのマウスでは成人期の若年期からSCN神経細胞の発火も減少しており、加齢とともに徐々に悪化していることから、概日リズムのペースメーカーが弱まっていること276と、中脳、線条体、SCN回路を介した概日リズムのドーパミン作動性調節が失われている可能性が示唆されている277,278。また、MitoParkトランスジェニックマウスは、一定の条件下で運動リズムが大きく乱れ、明暗サイクルの変化に対してより脆弱である279。
日暮れ症候群は認知症の人に多く見られ、攻撃性、落ち着きのなさ、せん妄、激越感の増加が特徴である。臨床および前臨床データによると、適切な明暗の手がかりの欠如、睡眠障害(特にreM睡眠の減少)SCNペースメーカーとその出力の低下がすべてサンダウニング症候群の一因であることが示唆されている281。体温リズムの位相遅延および振幅の低下は、サンダウニング症状の重症度と相関しており、サーカディアンシステムの破綻が原因である可能性を示唆している282。例えば、攻撃性はサーカディアンシステムによって調節される可能性がある。最近のマウスの研究では、攻撃的行動の傾向のリズムは、SCNのVIPニューロンから副室下帯のGABA作動性ニューロンへの多シナプス回路を介して調節されていることが明らかになった。多くの高齢者とその家族に影響を及ぼすこの症候群の原因となっている生物学的機序を完全に解明するためには、さらなる研究が必要である。
サーカディアンクロックによって制御されるいくつかのプロセスが、酸化ストレス、炎症、ドーパミン合成、細胞代謝の制御など、神経変性に寄与している可能性がある。単純な仮説としては、概日リズムの乱れが睡眠を乱し、その結果、神経変性疾患の原因となる誤って折り畳まれた凝集したタンパク質の脳からのクリアランスが減少するというものがある。最近の研究では、睡眠遮断の一晩でも、ヒトの脳の右海馬と視床でアミロイドβ(アミロイドβ; アルツハイマー病で脳に病理学的に蓄積されているタンパク質の一つ)の蓄積につながったことがわかった284。これらの増加は気分と負の相関を示したが、特定のアルツハイマー病関連遺伝子型(つまりAPOE遺伝子型)とは関連していなかった。クリアランス仮説に沿って、睡眠中、グリンパティック系285 は脳脊髄液を間質液と交換し、アミロイドβ286 をクリアする。睡眠遮断はマウスやハエではアミロイドβの間質液レベルを上昇させ、プラーク形成を増加させる287,288が、ショウジョウバエでは遺伝的に睡眠を増加させることでアミロイドβの沈着を減少させる288。しかし、解剖学的および流体力学的パラメータの推定に基づいて、大動脈周囲の流れとグリンパティック系循環の妥当性については議論の余地がある;したがって、このシステムのさらなる特徴付けが必要である289。
活性酸素種(ROS)の蓄積と放出も概日パターンに従う。日周性種(ヒトを含む)では、活性酸素は日中、覚醒中の神経細胞の活動のために蓄積し、夜間には、抗酸化物質は、覚醒中の神経細胞の活動のために日中に過剰な活性酸素を安全に除去し、夜間には、抗酸化物質は、睡眠中に過剰な活性酸素を安全に除去する236,290。機能的な分子時計を欠くBmal1-/-マウスは、早老、神経変性、寿命の減少を示す291。活性酸素の蓄積はBmal1-/-マウスではかなり高く、アストロサイトーシスや脳内の酸化的損傷マーカーのレベルの増加と相関している。Bmal1-/-マウスに抗酸化物質である N-アセチル-l-システインを投与すると、その寿命が部分的に回復し、加齢に依存した病態を予防することができる292。興味深いことに、脳特異的な Bmal1 欠失マウスは、運動性概日リズムと睡眠・覚醒サイクルはほぼ正常であるにもかかわらず(つまり、SCN の時計機能は比較的正常である)アストロサイトーシスの増加を示した;したがって、これらの神経変性作用は、通常は BMAL1 によって媒介される脳の特定領域の細胞代謝の局所的な制御が、これらの細胞で独立して、あるいは分子時計の一部として失われたことに起因すると考えられる291。
概日リズムと睡眠の乱れが神経変性疾患の主な原因であるかどうかは不明であるが、これらのシステムに対する環境的・生物学的な乱れは、これらの疾患の進行を悪化させるように思われる293-295。したがって、概日リズムと睡眠リズムを安定化させる治療法は、少なくともこれらの疾患の進行を遅らせる可能性がある。実際、いくつかの研究では、朝の光治療は、特に認知症の初期段階で、概日リズムとミニ精神状態検査(MMSE)コーエン-マンスフィールド動揺インベントリ(CMAI)と行動病理学的アルツハイマー病評価尺度(BEHAVEアルツハイマー病)のスコアを改善する可能性があり、認知症の重症例でも、概日リズムと行動症状、特に動揺と全体的な認知機能を改善することが示されている296,297。認知症患者のケアセンターは薄暗いことが多く298-300,189人の参加者を対象とした無作為化対照試験では、日中の時間帯に高齢者ケアセンターの照度を上げると、認知症患者のMMSEスコアの低下が緩やかになり、抑うつスコアが低下し、機能障害が1.5年間で減少することが明らかになった301。さらに、アルツハイマー病患者157名を対象とした二重盲検多施設共同研究では、夜間のメラトニン治療により認知機能が改善され、夜行性活動が低下し、睡眠が増加したことが示されている302。重要なことは、メラトニン治療は、正常な内因性メラトニン合成のタイミングに合わせて慎重に行う必要がある。
結論
生涯を通じて、睡眠と概日リズムの乱れは、特定の精神疾患や神経変性疾患の病態生理に強く関連している。ほとんどの臨床研究はまだ相関関係にあるが、動物モデル研究では、概日リズムの乱れと複数の脳障害との間の潜在的な因果関係が検討され始めており、分子メカニズムの特定が始まっている。SCNの中心的な時計が鍵を握っているように思われるが、この中心的なペースメーカー以外の他の脳領域のサーカディアン遺伝子もまた、神経細胞の代謝、神経伝達物質の合成および活性の制御に局所的に寄与しており、これらの機能の障害は脳障害に寄与している可能性がある264,304-315。私たちは、脳の複数の領域における末梢振動子の役割、それらがどのように巻き込まれているか、また、サーカディアン転写因子が、日常のリズムの制御とは無関係であるかもしれない他のどのような機能を持っているのかについて、理解し始めたばかりである。これらの点が今後の研究の焦点となることは間違いない。
私たちは、概日リズムとストレスや乱用薬物などの環境の摂動との間の双方向の関係をよりよく理解し、概日リズムが神経伝達、代謝、免疫、その他のプロセスとどのように密接に関係しているかを理解する必要がある。概日リズムの乱れは、発達の文脈の中で、特定の障害に対する脆弱性や進行を促進する可能性がある。発達に伴い、光入力に対する脳の感受性、SCNの入出力、および脳内および他の組織の特定の細胞型における分子時計の機能に変化が生じる。晩年になると、特定の障害は、睡眠や概日リズムの問題が他の症状の発生に先行することが多く、一定の軌跡をたどる。これらの知見は、睡眠および/または概日リズムの乱れと神経変性との因果関係について、今後の綿密な調査につながるものである。
最近の研究では、分子性概日時計の要素が、肝臓や他の組織における細胞代謝やミトコンドリア機能を直接制御していることが実証されている316-318。これらのプロセスや状態のそれぞれの機能不全が神経変性に寄与する可能性があるため、今後の研究では、サーカディアン遺伝子が神経細胞やグリアの代謝、ミトコンドリア機能、酸化還元状態、抗酸化反応、活性を制御している可能性のある分子機構を明らかにする必要がある。また、今後の研究では、薬物標的の発現の概日リズムを明らかにする必要がある。例えば、特定の神経伝達物質およびその受容体を標的とする薬剤は、薬剤を投与する時間帯や神経伝達および受容体発現の内因性リズムに依存して、治療効果が高くなったり、副作用が強くなったりする可能性がある。
ヒトにおける概日リズムの乱れと脳障害との関連についての証拠は、ほとんどが疫学的なものであり、相関関係に基づくものである。前臨床モデルでの研究は、これらの知見を支持する一方で、概日リズムの乱れが特定の疾患関連表現型につながる双方向性や、ストレスや乱用薬物への曝露など、リズムを変化させる環境因子が特定の症状の増悪や進行につながることへの洞察を提供してきた。今後の研究では、トランスレーショナルなアプローチを用いた因果関係の実験的調査の継続が必要となる。例えば、研究者たちは、個人の内因性の睡眠覚醒リズムやメラトニンリズムと環境のスケジュールをズラすために、ヒトを実験室で操作して、サーカディアン・アライメントが認知機能、報酬、記憶機能、およびそれらに関連する神経回路に与える影響を評価し始めている。特定の発達期(例えば、思春期)は、これらの混乱に脆弱である可能性があるため、発達の文脈の中でこれらの仮説を考慮する必要がある。新しい生物学的アッセイ319を用いた大規模でより詳細なクロノタイプの評価が、縦断的な追跡調査と組み合わされることで、夕方性や遅発性のクロノタイプとうつ病、双極性障害、依存症などの脳障害との間の予測的な関連をさらに明らかにすることができるだろう。10万人以上の被験者を対象とした最近のゲノムワイドな関連研究では、睡眠時間、クロノタイプ、代謝表現型(例えば、体格指数)320,321と関連する新規の遺伝子座が同定されている。概日リズムと脳障害の基礎となるこれらの環境的・遺伝的要因の役割は、細胞ベースのアッセイや前臨床モデルを用いて、実験的にさらに検証することができる。神経細胞の種類や領域内の特定のサーカディアン遺伝子を操作することで、神経回路や関連する生理学的・行動的終点における分子時計や細胞時計の関与を解剖することができるようになる。光遺伝学的および化学遺伝学的ツールは、最近気分に関連した行動322-324で実証されたように、神経活動を調節する際にSCN接続に依存している、あるいはSCN接続から独立している脳への光入力経路の機能を分離するために使用することができる。神経科学における新しいツールやリソースの出現により、また概日リズム、生理学、行動の関係についての理解が深まったことにより、ヒトや動物における研究は、概日リズムの乱れと様々な脳障害との間の因果関係を調査することができるようになった。これらの知見は、効果的な治療法や臨床転帰の改善を伴う介入につながる可能性がある。
特定の薬剤を特異的に投与するタイミングで投与する慢性治療戦略は、現在、特定の癌の治療に用いられている325 。時間制限付き給餌もまた、現在では、代謝性疾患、心臓疾患、肝臓疾患だけでなく、肥満の治療や予防にも使用されている327,328。双極性障害に対するリチウムや大うつ病性障害に対するSSRIなど、精神疾患に対するいくつかの第一選択薬理学的治療法は、概日時計を調節する216,217,329-331。これらの影響は後になって明らかになったが、薬理学的薬剤を用いてリズムまたは時計の構成要素を標的とすることが治療的に有益である可能性を示唆している215,216,331。脳障害やその他の疾患に対する最も効果的な治療法の多くは、時計の機能を調節している216,326,330,332,333。重要なことに、サーカディアンシステムを標的とした治療や介入は、治療効果があり、臨床症状や個人の日常生活機能を改善する可能性がある。そのようなアプローチが考慮されれば、治療成績をさらに向上させるために、第一選択薬や治療法に補助的な治療法として追加される可能性さえある。安定した環境のスケジュールは、自閉症スペクトラム障害やADHDを持つ個人の日中の眠気や日中の行動問題を改善するように見えるので、発達障害を持つ子供や青年の定期的な社会的、睡眠や活動のスケジュールの実装に多くの関心がある。ウェアラブル活動と睡眠トラッキングデバイスの使用の増加はまた、診断分析と個別化された治療計画334の面で新たな可能性をもたらした。この分野では、脳機能、受容体レベル、内部リズムのトラッキングなど、将来的に精神疾患や神経疾患の治療に価値があると思われる複数のアプローチを調整する準備が整っている。
周辺発振器
脳の他の部分や末梢器官のサーカディアン「時計」は、視交叉上核や他の様々な非病的な合図や刺激によって駆動されている。
アクチグラフィー
典型的には手首の運動計などの非侵襲的な装置を使用して、何日、何週間、何ヶ月にもわたって身体活動パターン(すなわち、休息活動サイクル)をモニタリングすること。
クロノタイプ
24時間周期の中での早起きや遅起きの活動(それぞれ朝型と夜型に変換される)の好み。
睡眠の恒常性
睡眠不足や睡眠不足を補うために、長時間の覚醒状態が続くと、その後の睡眠の強度と持続時間が増加する恒常性の一種。
メラノプシン光受容体
オプシンクラスgタンパク質共役型受容体は、光感受性哺乳類網膜神経節細胞のごく一部(~2%)で発現している。
明るい光治療
気分障害や睡眠障害の治療法で、通常は午前中に明るい光を使用して、内因性の概日リズムをシフトさせて安定させる。
睡眠効率
睡眠構造の完全性と睡眠の質を測る尺度で、ベッドで過ごした時間に対する総睡眠時間の比率で構成される。
ナルコレプシー
日中の過度の眠気を特徴とする慢性神経障害で、多くの人が断続的で制御不能なカタプレキシー(覚醒時に筋肉の緊張が突然失われる)のエピソードを経験している。
アンフェタミン
注意欠陥多動性障害の治療に使用できる強力な覚せい剤である。
メチルフェニデート
主に注意欠陥多動性障害の治療に用いられる覚せい剤。
イブニング
夕方以降の就寝時間に活動を好むことは、内因性の概日位相に関連しており、夕方のクロノタイプに類似している。
前頭葉の報酬回路
前頭領域と大脳基底核を結び、報酬の価値と意欲を媒介する神経経路
遅波活動
遅発性(0.5~4Hz)で、主に非遅発性眼球運動睡眠時に発現する同期振動活動の電気生理学的測定値。
遅延睡眠相症候群
概日リズム障害で、睡眠と覚醒の周期が2時間以上ずれており、体温とホルモンリズムの同様のずれを伴うことが多い。
急性睡眠不足
睡眠制限の部分的な一晩または一晩中の睡眠。このアプローチでは、短期的な抗うつ効果を得ることができる。
対人・社会リズム療法
双極性障害によく用いられる認知行動療法で、睡眠覚醒や社会生活のスケジュールを安定させるように作用する。
薄光メラトニン発現(DLMO)。
内因性概日相のマーカーで、研究や治療の適切なタイミングを決定するために使用される。
疲労
疲労感や元気のなさを感じる。
レム睡眠行動障害
RBD)。急速な眼球運動による睡眠中に通常起こる麻痺が消失し、物理的に夢を「演じる」ことができるようになる障害。
レストレスレッグス症候群
足の違和感が特徴的な状態で、足を動かしたいという衝動を伴う。
ミトパーク遺伝子導入マウス
ミトコンドリア転写因子Aの不活性化によりドーパミン神経細胞のミトコンドリア機能が欠損したパーキンソン病のマウスモデル。
レム睡眠
急速な目の動き、低筋緊張、後に回想する夢を特徴とする睡眠相。
グリンパティック系
睡眠中に活動する脳の機能的な老廃物排出システム。
アストロサイトーシス
近くの神経細胞の死に起因するアストロサイトの異常な増加。
ミニ精神状態検査(MMSe)。
11の質問からなる標準化された質問セットで、最高点が30点(認知機能障害を示す23点以下)で、方位、登録、注意および計算、想起および言語の5つの認知機能領域を評価するために使用される。