Contents
- Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19
Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19
Pierre Kory, MD 1*, G. Umberto Meduri, MD2†, Jose Iglesias, DO3, Joseph Varon, MD4, Keith Berkowitz, MD5, Howard Kornfeld, MD6, Eivind Vinjevoll, MD7, Scott Mitchell, MBChB8, Fred Wagshul, MD9, Paul E. Marik, MD10
• Front-Line Covid-19 Critical Care Alliance.
• Memphis VA Medical Center – Univ. of Tennessee Health Science Center, Memphis, TN.
• Hackensack School of Medicine, Seton Hall, NJ.
• University of Texas Health Science Center, Houston, TX.
• Center for Balanced Health, New York
• Recovery Without Walls
• Volda Hospital, Volda, Norway
• Princess Elizabeth Hospital, Guernsey, UK
• Lung Center of America, Dayton, Ohio
10 Eastern Virginia Medical School
* Correspondence:
Corresponding Author: Pierre Kory, MD, MPA
これらの著者は、この作品に等しく貢献している。
メドゥーリ博士の寄稿は、メンフィスVAメディカルセンターの資源と施設の利用に支えられた仕事の成果である。本解説の内容は、米国退役軍人局または米国政府の見解を表すものではない。
キーワード
イベルメクチン、COVID-19,感染症、肺感染症、呼吸不全
要旨
2020年3月、ポール・E・マリク教授を中心に「Front Line COVID-19 Critical Care Alliance(FLCCC)」が創設され、急速に出現している基礎科学、トランスレーショナル、臨床データを継続的に検討し、COVID-19の治療プロトコルを開発することを目的としている。FLCCCは最近、抗寄生虫薬であるイベルメクチンが、SARS-CoV-2およびCOVID-19に対して非常に強力な抗ウイルス性および抗炎症性を有することを発見した。
この結論は、試験管内試験や動物モデルだけでなく、世界中の多くの臨床試験で有効性が報告されている研究結果の増加に基づいている。イベルメクチンを予防薬として、また疾患のすべての段階で投与した場合、複数の大規模な無作為化および観察対照試験から、臨床転帰における反復的で一貫した大きな改善が報告されている。
さらに、集団全体の健康アウトカムへの影響を示すデータは、南米諸国の様々な地域の保健省庁や政府当局が、イベルメクチンが有効であることを期待して、市民集団への「イベルメクチン配布」キャンペーンを開始した時に起こったと思われる、複数の大規模な「自然実験」から得られている。このようなキャンペーンを実施していない近隣地域と比較して、これらの各地域の患者数と患者の死亡率が時間的に関連して減少していることから、イベルメクチンがパンデミックに対する世界的な解決策となる可能性があることが示唆されている。
私たちの知る限りでは、今回のレビューは、複数の疾患フェーズにおける多数の臨床試験に基づいているため、治療効果の強力なシグナルを示す十分な臨床データをまとめた最も古いものである。一つの限界は、対照試験の半数が査読付き出版物に掲載されたものであり、残りの対照試験の結果はMedicine Preprintサーバにアップロードされた原稿から得られたものであることだ。
現在では、プレプリントサーバーからの臨床試験データがパンデミックの間に直ちに治療法に影響を与えることは標準的な慣行となっているが、この慣行の結果として採用された治療法が物議を醸していることを考えると、FLCCCは、国内および国際的な主要な医療機関が、これらの研究をより迅速に検証し、イベルメクチンがCOVID-19感染症の発生率が高い集団に広く配布されたときに記録された大きな正の疫学的影響を確認するために必要なリソースを割くことが急務であると主張している。
序論
2020年3月には、Paul E. Marik教授が率いるFront Line COVID-19 Critical Care Alliance(FLCCC)と呼ばれる専門家パネルが設立された1。クリティカルケアの専門医や思想的リーダーからなるグループは、COVID-19の急速に出現した基礎科学、トランスレーショナル、臨床データの継続的なレビューを直ちに開始した。
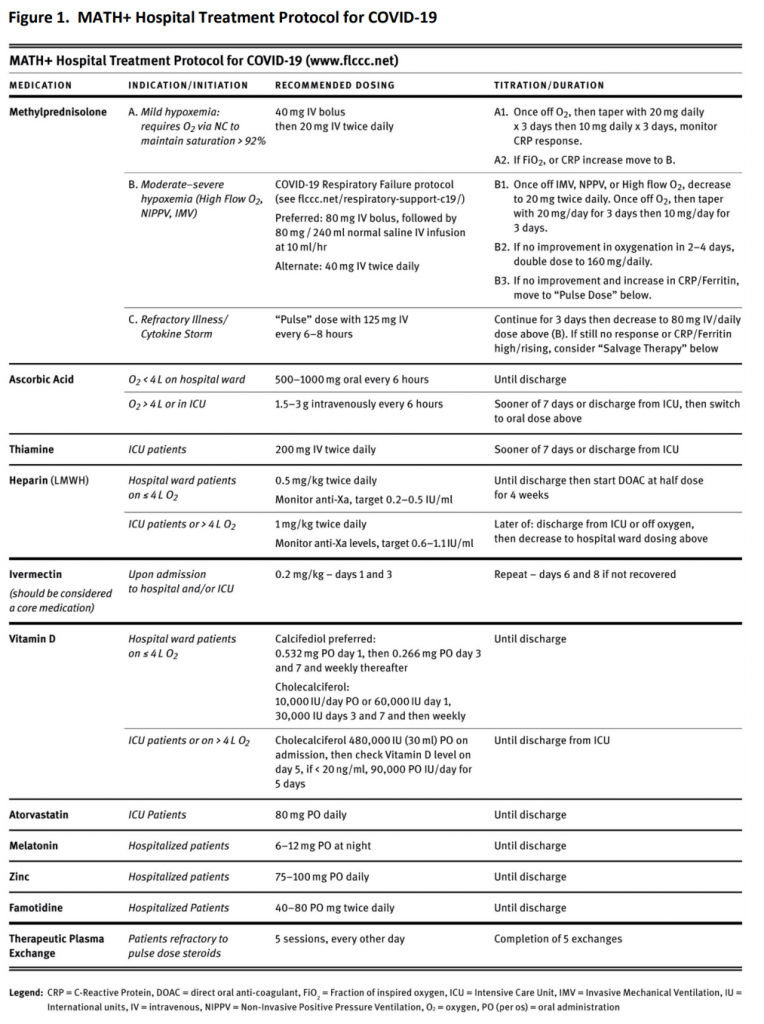
MATH+プロトコルを支持する科学的根拠と発表された発展的な臨床証拠の両方の異なる側面をレビューした2つの原稿が、パンデミックの2つの異なる時期に主要な医学雑誌に掲載された(Kory et al 2020;Marik et al 2020)。最新の論文では、MATH+プロトコルを体系的に採用した米国の2つの病院で測定したCOVID-19患者の病院死亡率は6.1%であったことが報告された(Kory et al 2020)。これは、23万人以上の患者を含む45件の研究のレビューから算出された23.0%の病院死亡率と比較して、著しく低下した死亡率であった(未発表データ;リクエストに応じて入手可能)。現在のMATH+プロトコルを構成する治療介入のレビューについては、以下の図1を参照のこと。

図1 COVID-19に対するMATH+病院治療プロトコル
MATH+の採用はかなりのものであったが、大部分は、プロトコル成分の大部分(コルチコステロイド、アスコルビン酸、ヘパリン、スタチン、ビタミンD、メラトニン)の治療効果が、その後のランダム化比較試験で検証されたか、または大規模な観察データセットでより強く支持された後にのみ発生した(Entrenas Castillo et al 2020;Horby er al 2020;Horby et al 2020;Jehi et al 2020;Nadkarni et al 2020;Rodriguez-Nava et al 2020;Zhang et al 2020a;Zhang et al 2020b)。) 数多くの支持的証拠があるにもかかわらず、入院患者に対するMATH+プロトコルはまだ普及していない。さらに、世界は再び病院やICUを圧倒する可能性を秘めた危機を悪化させている。2020年12月16日の時点で、米国におけるCOVID-19による死亡者数は311,073人に達し、現在までで最も多い680万人以上の有効症例数となっている2。
これらの憂慮すべき事態をさらに悪化させたのは、COVID-19に有効と考えられる医薬品を対象とした治療試験の結果が最近相次いで発表されたことである。2020;Consortium, 2020;Hermine et al 2020;Salvarani et al 2020)4 パンデミックから 1年が経過し、COVID-19で救命治療として「証明されている」と考えられている唯一の治療法は、中等度から重症の患者におけるコルチコステロイドの使用である(Horby et al 2020)。同様に、最も懸念されるのは、入院を防ぐための病気の進行を防ぐ効果がほとんど証明されていないという事実である。
幸いなことに、現在、抗ウイルス性および抗炎症性が知られている広く使用されている抗寄生虫薬であるイベルメクチンが、COVID-19に対する非常に強力で多段階に有効な治療法であることが証明されているようだ。この結論を裏付ける研究の数は増加しているが、残りの試験データの約半分は、医療用プレプリントサーバーにアップロードされた原稿から得られたものであり、これはパンデミック中の新しい治療法の迅速な普及と採用のための標準的な方法となっている。FLCCCの専門家パネルは、新たな医学的根拠に基づくレビューに長期的かつ継続的に取り組み、最近の急増の影響を考慮して、COVID-19の予防および治療の両方のためのイベルメクチンを体系的かつ世界的に採用すべきであることを推奨するというコンセンサスに達した。
FLCCCの勧告は、既存のデータから得られた以下の一連の結論に基づいており、以下に包括的にレビューする。
- 2012年以降、複数の試験管内試験研究により、イベルメクチンがインフルエンザ、ジカ、デングなどを含む多くのウイルスの複製を阻害することが実証されている(Mastrangelo et al 2012;Wagstaff et al 2012;Tay et al 2013;Götz et al 2016;Varghese et al 2016;Atkinson et al 2018;Lv et al 2018;King et al 2020;Yang et al 2020)。
- イベルメクチンは、いくつかの観察されたおよび提案されたメカニズムを介して、SARS-CoV-2の複製および宿主組織への結合を阻害する(Caly et al 2020b)。
- イベルメクチンは、炎症の最も強力なメディエーターであるサイトカイン産生および核内因子κB(NF-κB)の転写の両方の深遠な阻害を実証する試験管内試験データを有する強力な抗炎症特性を有する(Zhang et al 2008;Ci et al 2009;Zhang et al 2009)。
- イベルメクチンは、SARS-CoV-2または類似のコロナウイルスに感染した場合、複数の動物モデルにおいて、ウイルス負荷を有意に減少させ、臓器損傷から保護する(Arevalo et al 2020;de Melo et al 2020)。
- イベルメクチンは、感染した患者に曝露された者におけるCOVID-19病の感染および発症を防止する(Behera et al 2020;Bernigaud et al 2020;Carvallo et al 2020b;Elgazzar et al 2020;HellwigおよびMaia 2020;Shouman 2020)。
- イベルメクチンは、症状後早期に治療された軽症~中等症の患者において、回復を促進し、悪化を防ぐ(Carvallo et al 2020a;Elgazzar et al 2020;Gorial et al 2020;Khan et al 2020;Mahmud 2020;Morgenstern et al 2020;Robin et al 2020)。
- イベルメクチンは回復を早め、入院患者のICU入院および死亡を回避する(Elgazzar et al 2020; Hashim et al 2020; Khan et al 2020; Niaee et al 2020; Portmann-Baracco et al 2020; Rajter et al 2020; Spoorthi V 2020)。
- イベルメクチンは、COVID-19を有する重症患者における死亡率を減少させる(Elgazzar et al 2020;Hashim et al 2020;Rajter et al 2020)。
- )イベルメクチンは、広く使用されている地域では、症例死亡率の顕著な減少をもたらしている(Chamie, 2020)5。
- イベルメクチンの安全性、入手可能性、およびコストは、ほぼ40年間の使用と数十億回の投与で観察された軽度でまれな副作用とともに、薬物相互作用がほとんどないことを考えると、ほぼ他に類を見ないものである(Kircik et al 2016)。
- 世界保健機関(WHO)は長い間、イベルメクチンを「必須医薬品リスト」に掲載していた。
以下は 2020年12月14日時点で入手可能な有効性データの包括的なレビューであり、COVID-19におけるイベルメクチンの上記の影響を示すin-vitro試験、動物試験、臨床試験、および実世界での試験のすべてから得られたものである。
SARS-CoV-2に対するイベルメクチン活性の試験管内試験および動物試験
2012年以降、増加する細胞研究により、イベルメクチンが、インフルエンザ、ジカ、HIV、デング、および最も重要なSARS-CoV-2を含む、増加する数のRNAウイルスに対して抗ウイルス特性を有することが実証された(Mastrangelo er al 2012;Wagstaff et al 2012;Tay et al 2013;Götz et al 2016;Varghese et al 2016;Atkinson et al 2018;Lv et al 2018;King et al 2020;Yang et al 2020)。
イベルメクチンがヒト細胞内でのSARS-CoV-2の侵入および複製の両方を妨害する作用機序に関する洞察は、マウンティングされている。Calyらは、細胞培養モデルにおいて、イベルメクチンがSARS-CoV-2の複製を有意に阻害することを最初に報告し、イベルメクチンに曝露した48時間後にはすべてのウイルス物質がほぼ消失していることを観察した(Caly et al 2020a)。しかしながら、標準的または大量のイベルメクチンを用いた実験モデルで採用された同様の組織濃度を達成することができないことを考えると、この観察が臨床的に一般化可能であるかどうかを疑問視する声もあった(Bray et al 2020;Schmith et al 2020)。細胞培養モデルにおける効果に必要な濃度は、イベルメクチンのような治療薬と相乗的に作用する活性免疫系が存在しないことを考えると、ヒトの生理学にはほとんど似ていないことに留意すべきである。さらに、ある薬剤に長期間曝露する場合には、短期の細胞モデル曝露における投与量の何分の一かを必要とする可能性が高い。また、6つの分子モデリング研究(Dayer, 2020;Hussien and Abdelaziz, 2020;Lehrer and Rheinstein, 2020;Maurya, 2020;Nallusamy et al 2020;Suravajhala et al 2020)で提案されているような、SARS-CoV-2スパイクタンパク質の宿主受容体結合領域とのイベルメクチンの競合結合のような、共存または代替の作用機序が、観察された臨床効果を説明する可能性もある。これらの研究のうち4つにおいて、イベルメクチンは、まとめて調べた数百の分子の中で、SARS-CoV-2のスパイクタンパク質S1結合ドメインに対する結合親和性が最も高いか、または最も高い中にあると同定されたが、イベルメクチンは、これらの研究のうち4つにおいて、特に研究の焦点となっていなかった(Scheim, 2020)。これは、ウイルス抗体、特にファイザーワクチンおよびモデルナワクチンによって生成されたものがSARS-CoV-2ウイルスを含むのと同じメカニズムである。SARS-CoV-2スパイクタンパク質へのイベルメクチンの高い結合活性は、それぞれ、ACE-2受容体またはシアル酸受容体のいずれかへの結合を制限し、ウイルスの細胞内侵入を防ぐか、またはCOVID-19で最近提案された病理学的メカニズムであるヘマグルチン化を防ぐかのいずれかであり得る(Dasgupta J, 2020;Dayer, 2020;LehrerおよびRheinstein, 2020;Maurya, 2020;Scheim, 2020)。イベルメクチンはまた、複製するためにウイルスによって必要とされる複数の必須構造タンパク質および非構造タンパク質に結合し、または干渉することが示されている(Lehrer and Rheinstein, 2020;Sen Gupta et al 2020)。最後に、イベルメクチンはまた、SARS-CoV-2 RNA依存性RNAポリメラーゼ(RdRp)に結合し、それによってウイルスの複製を阻害する(Swargiary, 2020)。
Arevaloらは、SARS-CoV-2に類似した2型ファミリーRNAコロナウイルス(マウス肝炎ウイルス)に感染したマウスモデルにおいて、500mcg/kgのイベルメクチン対プラセボに対する反応を調査した(Arevalo et al 2020)。試験には、40匹の感染マウスが含まれ、20匹がイベルメクチンで処理され、20匹がリン酸緩衝生理食塩水で処理され、その後、16匹の未感染対照マウスもリン酸緩衝生理食塩水で処理された。日目に、すべてのマウスを安楽死させ、検査およびウイルス負荷の評価のための組織を得た。20匹の非感染マウスでは重度の肝細胞壊死が認められたが、イベルメクチン処理マウスでは重度のリンパ芽細胞性炎症性浸潤に囲まれており、高い肝ウイルス負荷(52,158 AU)が認められたのに対し、イベルメクチン処理マウスでははるかに低いウイルス負荷(23,192 AU; p<0.05)が認められた。
Dias De Melo氏らは最近、ゴールデンハムスターにSARS-CoV-2ウイルスを経鼻的に接種し、感染時に0.4mg/kgのイベルメクチンを単回皮下注射した研究結果を掲載した(de Melo et al 2020)。対照動物は生理的溶液のみを投与した。イベルメクチン処理したハムスターでは、以下のことが確認された。アノスミア(嗅覚脱失)の劇的な減少(33.3%対83.3%、p=.03)であり、これは雄のハムスターが臨床スコアの減少を示したのに対し、処理した雌のハムスターはアノスミア(嗅覚脱失)の兆候を示さなかったという点で、性にも依存していた。また、ウイルス力価に明らかな差がないにもかかわらず、治療した動物の鼻甲骨と肺のサイトカイン濃度が有意に低下していることも確認された。
COVID-19の感染を予防するイベルメクチンの能力に関する曝露予防研究
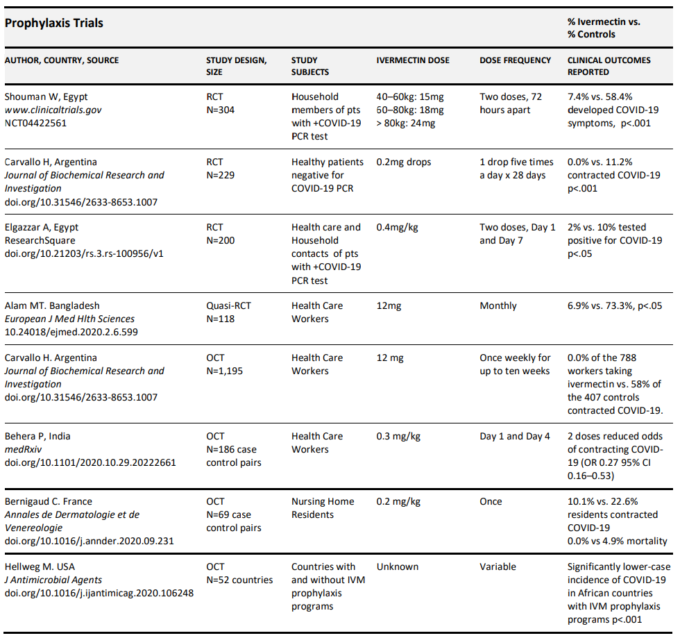
また、4つの無作為化比較試験(RCT)と3つの観察的比較試験(OCT)のデータに基づき、7つのうち4つ(うち2つはRCT)が査読付きジャーナルに発表された(Behera et al 2020;Bernigaud et al 2020;Carvallo et al 2020b;Elgazzar et al 2020;Hellwig and Maia 2020;Shouman 2020)。
エジプトのBenha大学のElgazzar氏らは、COVID-19患者のヘルスケアと家庭の接触者200人を無作為化し、介入群は100人の接触者が個人用保護具(PPE)を着用しているのに対し、100人の接触者の対照群はPPEのみを着用している状態で、1日目に0.4mg/kgの高用量を投与し、7日目に2回目の投与を行った(Elgazzar et al 2020)。彼らは、イベルメクチンを投与したときにRT-PCRで陽性と判定された接触者の数が、対照群と比較して2%対10%と大きく統計的に有意に減少したことを報告した(p<.05)。
Shoumanは、エジプトのザガジグ大学で、PCRでSARS-CoV-2が陽性となった患者の家族340人(治療済み228人、対照112人)を含むRCTを実施した(Shouman 2020)。イベルメクチン(約0.25mg/kg)を陽性検査当日と72時間後の2回投与した。2週間の追跡調査の後、イベルメクチンを投与された世帯員のCOVID-19症状は、7.4%対58.4%、p<.001と大きく統計的に有意な減少が認められた。同様に、アルゼンチンのCarvalloらが229人の健康な市民を対象に実施した別のRCTでは、131人が無作為に割り付けられ、イベルメクチン0.2mgを1日5回経口投与された(Carvallo et al 2020b)。28日後、イベルメクチン予防投与群では、対照群の患者の11.2%に対し、SARS-COV-2で陽性となった患者はいなかった(p<.001)。1,195人の医療従事者を含む同じグループによるはるかに大規模な追跡観察対照試験では、週1回のイベルメクチン予防を受けた788人の労働者では3カ月間、感染は記録されていなかったが、対照群407人の58%がCOVID-19で発病していたことが明らかになった。この研究は、12mgを週1回服用することで、高リスクの医療従事者の間で感染に対する防御が達成できることを示している(Carvallo et al 2020b)。
Carvallo研究における4ヵ月間の週1回投与の必要性は、バングラデシュのダッカからの最近のRCTでは、介入群(n=58)が同様の4ヵ月間、12mgを月1回のみ服用し、対照群と比較して感染症が6.9%対73.3%、p<.05と大きく統計的に有意に減少したことも報告されていることを考えると、必要なかったかもしれない(Alam et al 2020)。その後、インドで行われた大規模なレトロスペクティブ観察的ケースコントロール研究では、Beheraらは、医療従事者の186組(n=372)のケースコントロールペアのうち、何らかの予防措置を講じた169人を特定し、そのうち115人がイベルメクチン予防措置を講じたことを報告した(Behera et al 2020)。マッチドペア分析の結果、2用量のイベルメクチン予防薬を服用していた労働者では、COVID-19に感染するオッズ比が著しく低下した(0.27,95%CI,0.15-0.51)ことが報告された。注目すべきことに、この研究では、1回の投与による予防は防御的ではないことが判明した。この研究で得られた知見とエジプトでの予防研究の両方に基づいて、オールインド医療科学研究所では、医療従事者のために予防プロトコルを制定し、現在ではイベルメクチン0.3mg/kgを72時間間隔で2回服用し、毎月服用を繰り返すようにしている。
COVID-19に対するイベルメクチンの保護的役割をさらに明らかにするデータは、フランスの介護施設の入所者を対象とした研究から得られたものである(Behera er al)。 平均年齢90歳のこのグループでは、酸素サポートを必要とした居住者は1人のみであり、死亡した居住者はいなかった。周辺施設の入居者の対照群では、22.6%の入居者が病気になり、4.9%の入居者が死亡した。
予防薬としてのイベルメクチンの有効性を裏付ける最も決定的な証拠は、最近International Journal of Anti-Microbial agentsに発表されたもので、研究者グループは、WHOが管理する予防化学療法データバンクを用いたデータを、特にジョンズ・ホプキンス大学が使用している公的データ集計サイトであるWorldometersで得られた症例数とともに分析した(Hellwig and Maia, 2020)。彼らは、寄生虫感染症予防のためのイベルメクチン大量投与プログラムが活発に行われている国のデータを比較したところ、最近プログラムが活発に行われている国では、COVID-19の症例数が統計的に有意に低く、p<.001という高い統計的有意差があることを発見した。
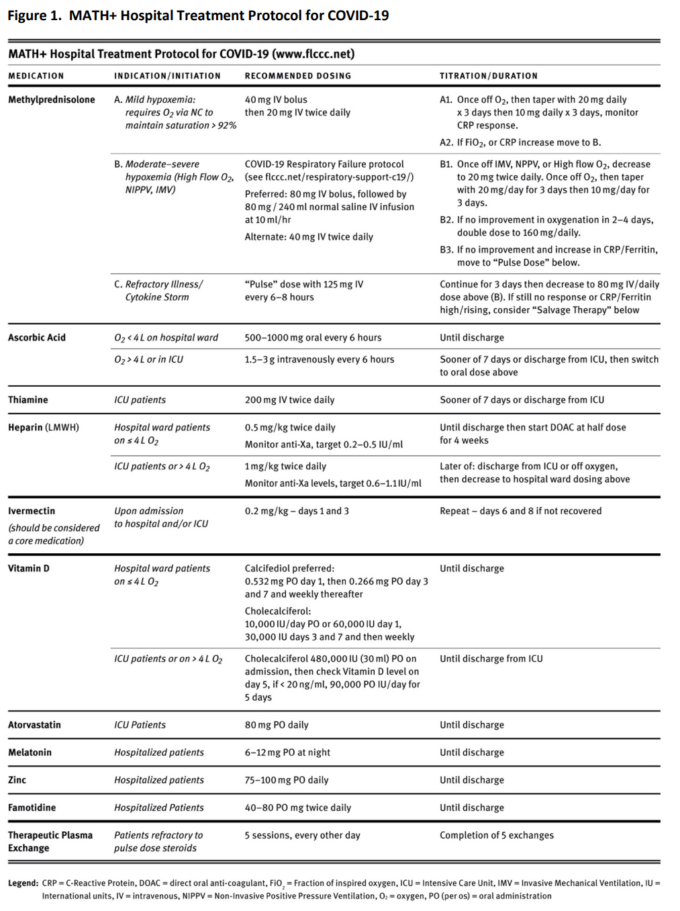
以下の図2は、COVID-19における上記の対照的なイベルメクチン予防試験のすべてのメタ分析を示している。
図2 イベルメクチン予防試験のメタ解析
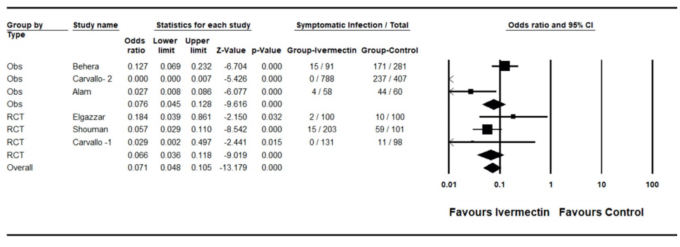
感染率の低下におけるイベルメクチンの役割を裏付ける更なるデータは、南米の国々から得られている。例えば、ペルー、ブラジル、パラグアイの様々な地域の保健省庁や政府当局は、早ければ5月から、市民への「イベルメクチン配布」キャンペーンを開始した(Chamie, 2020)。ブラジルでは、イタジャイ市、マカパ市、ナタール市が大量のイベルメクチンを市民に配布し、ナタール市では100万人分のイベルメクチンが配布された7 。
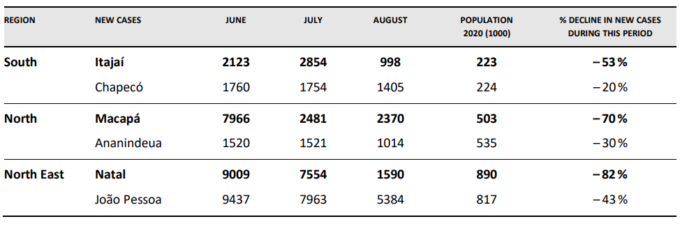
表1 ブラジルのイベルメクチン配布キャンペーンを実施した都市と実施しなかった都市の症例数の比較(太字はイベルメクチン配布を実施した都市、実施しなかった都市の隣の地方都市
イベルメクチンの配布キャンペーンを実施した地域における症例数と死亡率の時間的な減少に関連した同様の例が急速に出現しており、以下でより詳細に議論される(Chamie, 2020)。
これまでにレビューされた臨床エビデンスベースを構成する各試験の詳細な要約は、以下の表2aに示されている。
表2 a. COVID-19におけるイベルメクチン予防の有効性を評価した臨床試験の要約
軽症外来患者に対するイベルメクチンの有効性に関する臨床研究
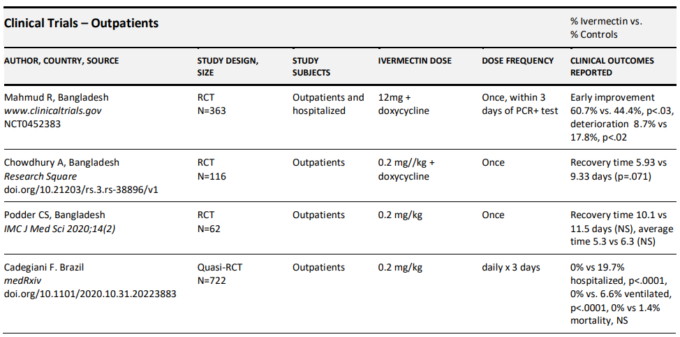
現在、5つのRCTと4つの症例シリーズからなる、合計3,000人以上の軽症外来患者を対象とした6つの研究が終了している(Cadegiani et al 2020;Carvallo et al 2020a;Chaccour et al 2020;Chowdhury et al 2020;Espitia-Hernandez et al 2020;Gorial et al 2020;Hashim et al 2020;Khan et al 2020;Mahmud et al 2020;Podder et al 2020)。
Mahmudらによる最大のRCTは、バングラデシュのダッカで実施され、400人の患者を対象とし、363人の患者が試験を終了した(Mahmud, 2020)。この研究では、レビューする他の多くの臨床研究と同様に、テトラサイクリン(ドキシサイクリン)またはマクロライド系抗生物質(アジスロマイシン)のいずれかが治療の一部として含まれていた。ドキシサイクリンやアジスロマイシンのような抗生物質を含むことの重要性は不明であるが、テトラサイクリンやマクロライド系抗生物質はいずれも抗炎症作用、免疫調節作用、さらには抗ウイルス作用が認められている(58-61)。本研究の掲載データでは、軽症外来患者と入院患者の治療量は特定されていないが、重要な臨床転帰は大きく影響しており、早期改善率の増加(60.7%対44.4%、p<0.03)臨床悪化率の減少(8.7%対17.8%、p<0.013)がみられた。軽症の外来患者が主に研究コホートを構成していたことを考えると、死亡例は2例のみであった(いずれも対照群)。
イラクのバグダッドで行われたHashimらによる別のRCTでは、140人の患者が等分された;対照群は標準治療を受け、治療群は外来患者と入院患者の両方を組み合わせたものが含まれていた(Hashim et al 2020)。軽度から中等度の外来患者96人を対象に、イベルメクチン/ドキサイクリンと標準ケアの組み合わせで48人を治療し、標準ケアのみで治療した48人と転帰を比較した。この試験の標準治療には、デキサメタゾン6mg/日または必要に応じてメチルプレドニゾロン40mg/日2回、ビタミンC 1000mg/日2回、亜鉛75~125mg/日、ビタミンD3 5000IU/日、アジスロマイシン250mg/日5日間、必要に応じてアセトアミノフェン500mgなど、MATH+プロトコルの多くの要素が含まれていた。いずれの群でも進行または死亡した患者はいなかったが、回復までの期間はイベルメクチン投与群の方が有意に短かった(6.3日 vs 13.7日、p<.0001)。
ブラジルのCadegianiは、イベルメクチン、ヒドロキシクロロキン、またはニタゾキサニドのいずれかで治療された患者を比較した前向き試験を実施したが、その際、各薬剤で治療された患者の選択は準ランダム化された方法で行われたと記述している(Cadegiani er al)。 彼らは、イベルメクチン治療を受けた538人の患者において、非イベルメクチン治療群と比較して,0%対19.7%の患者が入院を必要とし(p<.0001),0%対6.6%の患者が機械的換気を必要とし(p<.0001),0%対1.4%の患者が死亡した(NS)ことを明らかにした。
スペインのChaccour氏による小規模RCTが最近掲載され、24人の患者をイベルメクチン対プラセボに無作為に割り付け、7日目のPCR陽性率に差は見られなかったものの、ウイルス負荷、患者の無呼吸日数(76対158,p<.05)咳を伴う患者の日数(68対98,p<.05)に統計学的に有意な減少が見られた(Chaccour et al 2020)。
116人の外来患者を対象としたイベルメクチン治療の別のRCTがバングラデシュのChowdhuryらによって実施され、イベルメクチンとオキシサイクリンの併用療法を受けた60人の患者群と、PCR陰性化までの時間を主要転帰としたヒドロキシクロロキン/オキシサイクリン療法を受けた60人の患者群を比較した(Chowdhury et al 2020)。彼らはこの転帰に差は認めなかったが、治療群では、症状回復までの時間が統計的有意に近づいた(5.9日 vs. 7.0日、p=.07)。Podderらによる62人の患者を対象とした別の小規模RCTでは、症状回復までの期間が統計学的有意に近づき(10.1日 vs 11.5日、p>.05,95%CI,0.86~3.67)より短いことも発見された(Podder et al 2020)。
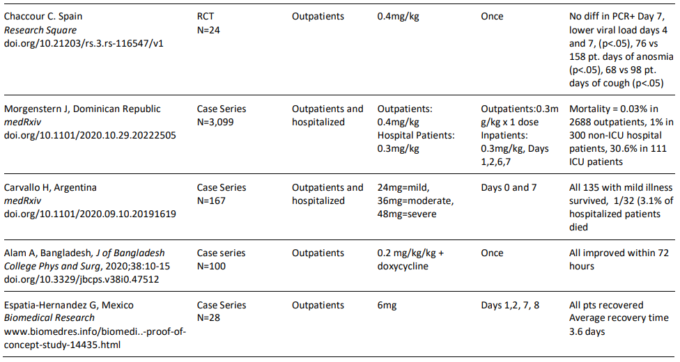
ドミニカ共和国のある医療グループは、救急外来で治療を求めた症状のある連続した外来患者2,688人の症例シリーズを報告しており、その大部分は臨床アルゴリズムを用いて診断されていた。患者には,0.4mg/kg の高用量イベルメクチンを 1 回分投与するとともに、アジスロマイシンを 5 日間投与した。2,688人の患者のうち16人(0.59%)のみがその後の入院を必要とし、1人の死亡が記録された(Morgenstern et al 2020)。
バングラデシュで100人の患者を対象とした別の症例シリーズでは、すべての患者が0.2mg/kgのイベルメクチンとドキシサイクリンの併用療法を受け、入院を必要とした患者や死亡した患者はおらず、すべての患者の症状は72時間以内に改善したことが報告されている(Robin er al)。
アルゼンチンの症例シリーズでは、イベルメクチン、アスピリン、デキサメタゾン、エノキサパリンの併用療法が報告されている。135人の軽症患者のうち、すべての患者が生存した(Carvallo et al 2020a)。同様に、イベルメクチンによる連続治療を受けた28人の患者を対象としたメキシコの症例シリーズでは、全例が回復し、完全回復までの平均時間はわずか3.6日であったと報告されている(Espitia-Hernandez et al 2020)。
イベルメクチンで治療された外来患者の以前にレビューされた臨床エビデンスベースを構成する各試験の詳細な要約は、以下の表2bに記載されている。
表2 b. COVID-19の外来患者におけるイベルメクチンの有効性を評価した臨床試験の要約
イベルメクチンの抗炎症作用が末期疾患への有効性を支える
イベルメクチンの抗ウイルス活性は、試験管内試験試験および動物実験から得られた証拠は、上記の予防試験および早期治療試験で示された有効性と一致しており、それを支持するものである。しかしながら、入院患者およびICU患者集団に対する有益な影響は、COVID-19の後期段階ではウイルスの複製がほとんど起こらず、ウイルスを培養することもできず、ウイルスの細胞病理学的変化が見られるのはごく少数の剖検例のみであることを考えると、イベルメクチンの強力な抗炎症特性が主要な役割を果たす必要があることを示唆している(Perera er al , 2020;Polak et al 2020;Young et al 2020)。疾患経過の後期にウイルスの存在または細胞病理活性が一般的に欠如していることを考えると、最も可能性の高い病態生理学的メカニズムは、SARS-CoV-2の非ウイルス性RNAフラグメントが、圧倒的で有害な炎症反応の誘発を介してCOVID-19の高死亡率および罹患率につながったことを示したLiらによって同定されたものである(Li et al 2013)。これらの洞察および後述する後期疾患におけるイベルメクチンの臨床的有用性に基づいて、炎症抑制剤としてのイベルメクチンの試験管内試験特性は、以前に認識されていたよりもはるかに臨床的に強力であると思われる。イベルメクチンの抗炎症特性を実証する研究の増加傾向にあるリストには、リポ多糖に暴露した後のサイトカイン産生を抑制し、NF-kBの転写を抑制し、一酸化窒素とプロスタグランジンE2の両方の産生を制限する能力が含まれている(Zhang et al 2008;Ci et al 2009;Zhang et al 2009)。
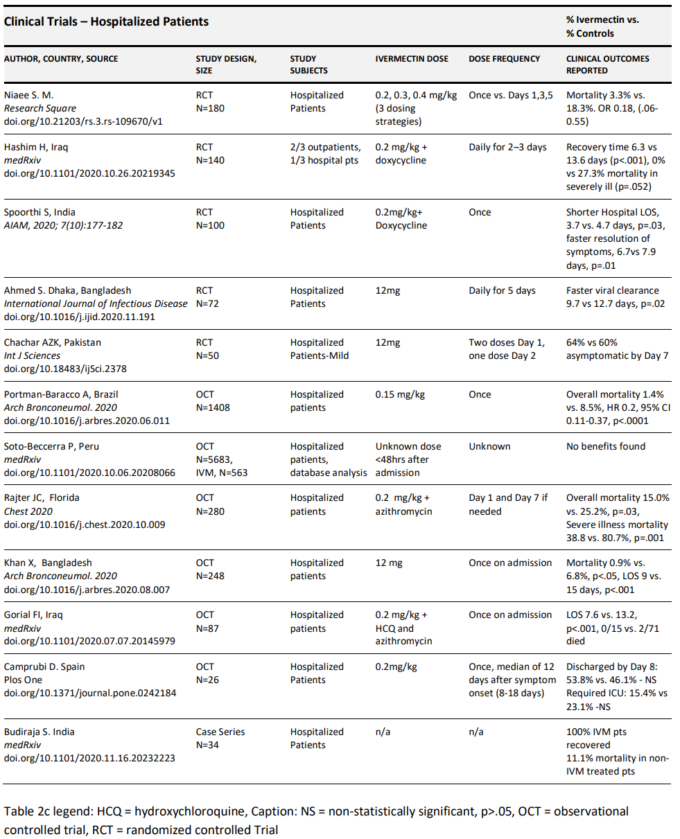
入院患者におけるイベルメクチンの有効性の臨床研究
より重症の入院患者におけるイベルメクチンの研究には、4つのRCT、4つのOCT、およびデータベース解析研究が含まれる(Ahmed et al 2020;Budhiraja et al 2020;Camprubi et al 2020;Chachar et al 2020;Elgazzar et al 2020;Gorial et al 2020;Hashim et al 2020;Khan et al 2020;Niaee et al 2020;Portmann-Baraccoら。2020;Elgazzar et al 2020;Gorial et al 2020;Hashim et al 2020;Khan et al 2020;Niaee et al 2020;Portmann-Baracco et al 2020;Rajter et al 2020;Soto-Becerra et al 2020;Spoorthi V 2020)。)
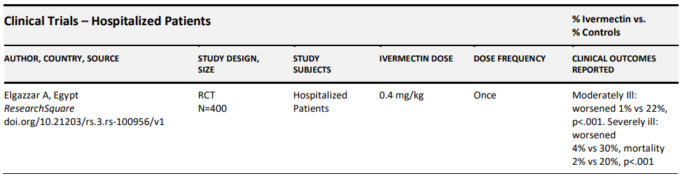
入院患者を対象とした最大のRCTは、Elgazzarら(Elgazzar er al)。 400人の患者がそれぞれ100人ずつの4つの治療群に無作為に割り付けられた。第1群と第2群には軽症/中等症患者のみが含まれ、第1群には1回投与量0.4mg/kgのイベルメクチン+標準治療(SOC)第2群にはヒドロキシクロロキン( ヒドロキシクロロキン)400mgを1日目に2回投与した後、1日2回200mgを5日間投与し、標準治療+標準治療を行った。イベルメクチン投与群では、統計学的に有意に進行率が低かった(1%対22%、p<.001)。3群と4群はいずれも重症患者のみを対象とし、3群は再び0.4mg/kgの単回投与とSOCの投与を受け、4群は ヒドロキシクロロキンとSOCの投与を受けた。この重症サブグループでは、アウトカムの差はさらに大きく、進行率は4%対30%、死亡率は2%対20%と再び低かった(p<.001)。
上述のHashim氏が行った大部分が外来患者のRCTでは、各群に22人の入院患者が含まれてた。イベルメクチン/ドキサイクリン治療群では、重症患者11人と重症患者11人であったが、標準治療群では、重症患者を対照群に含めることへの倫理的な懸念から、重症患者(n=22)のみが含まれていた(45)。この決定により、これらの入院患者群間で重症度が著しく不均衡になった。しかし、グループ間の重症度の不均衡と、含まれる患者数の少なさにもかかわらず、アウトカムには有益な差が見られたが、すべてが統計的に有意な差に達したわけではなかった。例えば、病気の進行率の大幅な減少(9%対31.8%、p=0.15)そして最も重要なことは、重症患者群間の死亡率に大きな差があり、統計的有意差の範囲内であったことである(0%対27.3%、p=0.052)。もう一つの重要な発見は、重症患者の死亡率が18%と驚くほど低く、すべての患者にイベルメクチンが投与されていたことである。
イランからの最近のRCTでは、イベルメクチンの使用により死亡率が劇的に減少したことが報告されている(Niaee et al 2020)。複数のイベルメクチン治療群(介入群では異なるイベルメクチン投与戦略が使用された)の間で、標準ケア群とプラセボ群内の平均死亡率は18.8%であったのに対し、平均死亡率は3.3%と報告され、ORは0.18(95%CI 0.06-055,p<.05)であった。
SpoorthiとSasanakは100人の入院患者を対象としたプロスペクティブRCTを実施し、50人にはイベルメクチンとドキシサイクリンを投与し、50人の対照群にはビタミンB6からなるプラセボを投与した(Spoorthi V, 2020)。いずれの群でも死亡は報告されていないが、イベルメクチン治療群では病院のLOSが3.7日対4.7日、p=0.03と短く、症状が完全に消失するまでの期間が6.7日対7.9日、p=0.01と短かった。
入院患者を対象とした最大のOCTは、フロリダ州のBroward Health HospitalsのRajterらによるもので、最近、主要な医学雑誌「Chest」に発表された(43)。彼らは、280人の連続した治療を受けた患者を対象に、傾向を一致させたデザインでレトロスペクティブOCTを実施し、イベルメクチンを投与された患者と投与されなかった患者を比較した。173人の患者がイベルメクチンで治療されたのに対し(ほとんどが単回投与)107人の患者は治療されなかった(Rajter et al 2020)。非マッチおよび傾向一致コホート比較では、イベルメクチン治療を受けた患者では、同様の、大きな、統計学的に有意に低い死亡率が認められた(15.0% vs. 25.2%、p =.03)。さらに、重度の肺病変を有する患者のサブグループでは、イベルメクチン投与により死亡率が大幅に減少した(38.8%対80.7%、p =.001)。
バングラデシュで行われた別の大規模OCTでは、イベルメクチンで治療された115人の患者を133人の患者からなる標準治療コホートと比較した(Khan et al 2020)。イベルメクチン群の患者の割合が男性の方が有意に多かったにもかかわらず(すなわち、COVIDの生存率が低いことがよく記述されている)両群はそれ以外の点ではよくマッチしていたが、死亡率の低下は統計的に有意であった(0.9%対6.8%、p<.05)(64-66)。最大のOCTは、ほぼ1,500人の患者を対象としたブラジルの研究である(Portmann-Baracco et al 2020)。主要なデータは提供されていないが、彼らは、対照群704例と比較して、イベルメクチン0.15mg/kgの単回投与で治療された入院患者704例では、全死亡率が減少したことを報告した(1.4%対8.5%、HR 0.2,95%CI 0.12-0.37,p<.0001)。同様に、機械換気を行っている患者では、死亡率も減少した(1.3%対7.3%)。イラクのバグダッドで行われた小規模な研究では、イベルメクチン治療を受けた患者16人と対照群71人を比較した(Gorial et al 2020)。この研究では、イベルメクチン投与群で入院期間の有意な短縮(7日 vs 13日、p<.001)も報告された。スペインの小規模研究では、重症患者13人をイベルメクチン治療を受けていない重症患者13人と比較し、8日目までに53.8%対46.1%が退院し、15.4%対23.1%が死亡(p値は報告されていない)という転帰にほとんど差がないことが示されている(Camprubi er al)。 インドの病院で治療を受けた最初の1000人の患者について報告した研究では、イベルメクチンのみで治療を受けた34人の患者では、すべて回復して退院したが、他の薬剤で治療を受けた900人以上の患者では、全体の死亡率は11.1%であった(Budhiraja et al 2020)。
入院患者のデータベースを対象とした1つのレトロスペクティブ分析では、イベルメクチン、アジスロマイシン、ヒドロキシクロロキン、またはこれらの薬剤の組み合わせを投与された患者の反応を比較した。この研究では、イベルメクチンの有効性は認められなかったが、この解析ではすべての治療群には2日目に死亡した患者が含まれていたが、対照群では早期死亡は発生しなかったため、比較は限定的であるように思われる(Soto-Becerra er al)。
以前にレビューされた臨床エビデンスベースを構成する各試験の詳細な要約は、以下の表2cに示されている。
表2c. COVID-19入院患者に対するイベルメクチンの有効性を評価した臨床試験の要約
COVID-19に対するイベルメクチンの臨床エビデンスのまとめ
以下のメタ解析では、OCTとRCTの死亡率データを別々に解析している(図3)。特にいくつかの研究では、治療が疾患経過の後期に開始されたことを考えると、両方の研究デザインの中で全体的に統計学的に有意な死亡率の改善につながる一貫性と再現性のあるシグナルが得られたことは注目に値する。
上記の表2に含まれる24の対照試験から得られた統計学的に有意な結果の分類的要約は以下の通りである。
COVID-19の予防に関する対照試験(n=6)
- 感染率が統計学的に有意に大きく減少した4つのRCT、N=851人の患者(Alam et al 2020;Carvallo et al 2020b;Elgazzar et al 2020;Shouman 2020
- 透過率の統計学的に有意な大きな減少を示す3つのOCT、N=1,688人の患者(Behera et al 2020;Bernigaud et al 2020;Carvallo et al 2020b)
COVID-19(n=5)の早期外来治療における対照試験
- 悪化率または入院率が統計学的に有意に減少した2つのRCT、N=1,085(Cadegiani et al 2020;Mahmud, 2020)
- 回復までの時間がほぼ統計学的に有意に減少した1つのRCT、p=.07,N=130(Chowdhury er al)。
- ウイルス負荷、アノスミア(嗅覚脱失)、咳の日数が統計的に有意に減少した1 RCT(Chaccour et al 2020年
入院患者の後期治療における対照試験(n=12)
- 死亡率の大きな、統計学的に有意な減少を示した2つのRCT(N=580)(Elgazzar et al 2020;Niaee et al 2020
- 死亡率がほぼ統計的に有意に減少した1つのRCT、p=0.052(N=140)(Hashim er al)。
- 死亡率の大きな、統計学的に有意な減少を示す3つのOCT(N=1,688)(Khan et al 2020;Portmann-Baracco et al 2020;Rajter et al 2020)。
イベルメクチンの広範な使用が集団の症例数および症例死亡率に及ぼす影響を示す疫学的データ
イベルメクチンを配布した直後に、そのようなキャンペーンを実施していない近隣都市と比較して、症例数が大幅に減少したブラジルの各都市と同様に、ペルーでも、政府は2020年5月8日に政令でイベルメクチンの使用を承認した。データアナリストでFLCCCアライアンスのメンバーでもあるJuan Chamie氏は最近、2つの重要なデータをまとめて比較した論文を発表した。第一に、彼は、各地域のイベルメクチン介入のタイミングと規模を、公式通信、プレスリリース、およびペルーのシチュエーション・ルーム・データベースのレビューを通じて確認し、効果的な実施日を確認した。第二に、彼は、国立死亡コンピュータ・システム(SINADEF)のレジストリ、および国立統計情報研究所(National Institute of Statistics and Informatics)から、選択された年齢層におけるCOVID-19症例死亡率とともに、その地域の全死因死亡者数に関するデータを経時的に抽出した(Chamie, 2020)。これらのデータを用いて、ペルーの8つの州における過剰死亡率と症例死亡率の両方が大きく減少した時期と、それぞれのイベルメクチン配布キャンペーンの開始日を比較することができた(図4)。過剰死亡率は、COVID-19パンデミック前の3年間の同時期の死亡率と比較して算出した。分析は、健康な若年成人の間で感染が増加していることによる交絡因子を取り除くために、60歳以上の患者のみに限定した。
図4 イベルメクチン大量投与後のペルー8州における60歳以上の人口における総死亡数/人口およびCOVID-19症例数の減少
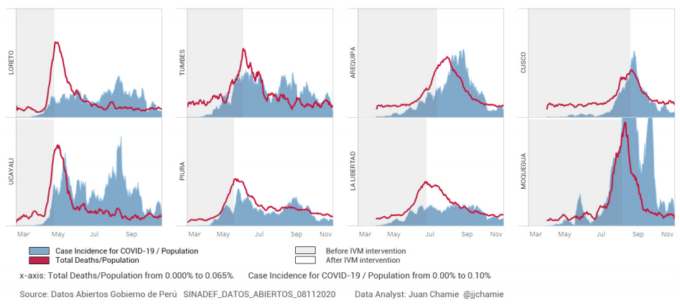
同じ研究の図5は、ペルーの8州における60歳以上の患者の症例死亡率のデータを示している。イベルメクチンが広く普及した後、COVID-19の高齢患者の症例死亡率が劇的に減少していることに注目してほしい。
図5. ペルー8州におけるイベルメクチン大量投与後の60歳以上の症例死亡率の低下
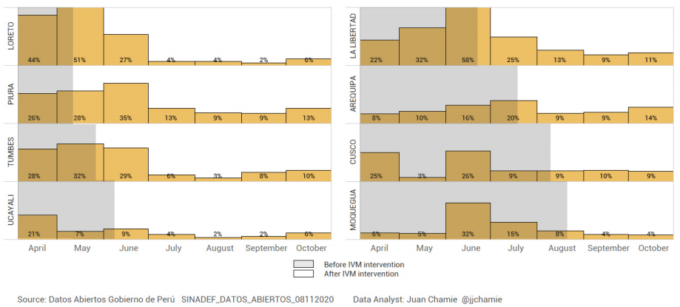
さらに興味深い例として、Chamieは上記の8州の症例数と致死率を、同じ期間にイベルメクチンが配布されておらず、治療にも広く使用されていなかったリマ市と比較している。下の図6は、リマ市では症例数や死亡者数の有意な減少や持続的な減少が見られなかったことと、イベルメクチンが広く分布している8つの州では両方の結果が劇的に減少していたことを比較したものである。
図6 ペルーの異なる州におけるCOVID-19症例の死亡者数と総死亡者数(イベルメクチン大量投与の有無にかかわらず
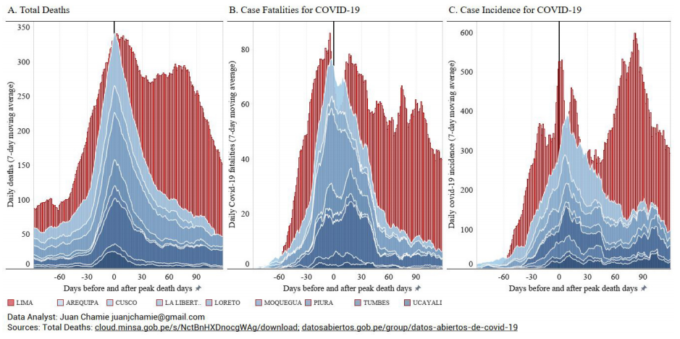
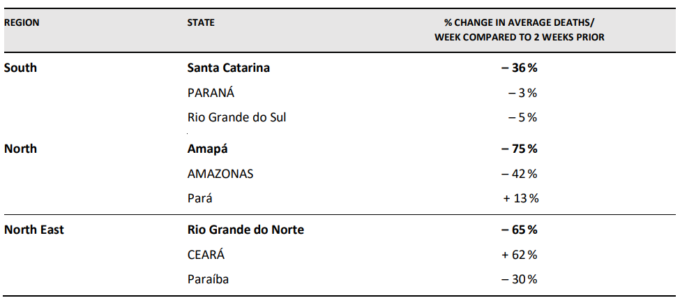
ペルー全体で達成された死亡率の低下は、上記の表2で検討したブラジルの3都市の分析から、ブラジルでも見ることができる。
表3 ブラジルの近隣地域における死亡率の変化(太字の地域にはイベルメクチンを市民に配布している主要都市が含まれ、その他の地域には配布していない。
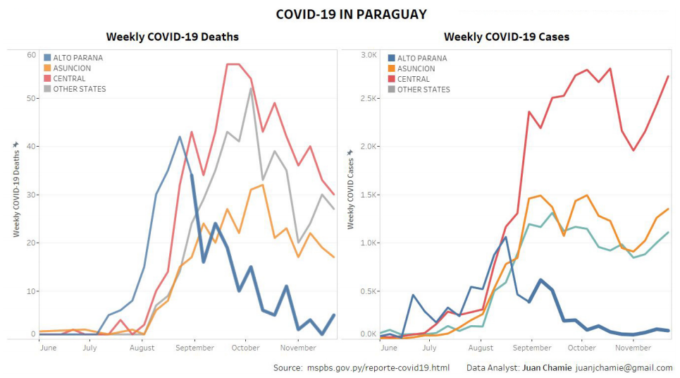
もう一つの説得力のある例は、パラグアイのデータから見ることができる。このキャンペーンは公式には「駆虫」プログラムと表現されていたが、これは州知事が、パラグアイでのCOVID-19の治療にイベルメクチンを使用しないことを勧告している国家保健省との衝突や叱責を避けるための装いと解釈されていた10。
図7 イベルメクチン配布開始後のアルト・パラナ州のCOVID-19症例数と死亡者数(青)(太字は青線)
COVID-19後の症候群におけるイベルメクチン
急性COVID-19からの回復後、持続的で、つらい、さらには障害を起こす症状の報告が増えており、多くの人がこの状態を「ロングコービッド」と呼び、患者を「長期不調組」と呼んでおり、症例の約10%で起こると推定されている(Callard and Perego, 2020;Rubin, 2020;Siegelman, 2020)。一般的には、疲労、息切れ、関節痛、胸痛の順で、慢性的な、時には無力化するような症状からなるポストウイルス症候群と考えられている。多くの患者さんは、記憶力や集中力が低下し、しばしば極度の疲労を伴い、「ブレインフォグ」と表現される最も無効な症状として説明しているが、これは筋痛性脳脊髄炎/慢性疲労症候群を強く示唆している。長期間のCOVIDに対する特異的な治療法は明らかにされていないが、ペルーのサンマルコス国立大学のAguirre-Changらによる最近の原稿では、このような患者におけるイベルメクチンの使用経験が報告されている(Aguirre-Chang, 2020)。彼らは、症状発症から4週間から 12週間の33人の患者を対象に、軽度の場合は0.2mg/kgを2日間、中等度の場合は0.4mg/kgを2日間、症状が持続する場合は投与量を延長するなど、イベルメクチンの用量を段階的に増やして治療を行った。その結果、87.9%の患者で2回の投与ですべての症状が消失し、さらに7%の患者では追加投与で完全に消失したと報告された。彼らの経験は、この厄介な症候群に対する有効性をよりよく検証するための対照試験の必要性を示唆している。

イベルメクチンの歴史と安全性
1975年に発見されたイベルメクチンは、中央アフリカ、ラテンアメリカ、インド、東南アジアの風土病地域におけるオンコセルカ症(河川失明症)リンパ系フィラリア症、疥癬の軽減に世界的な影響を与えたことから 2015年のノーベル医学賞を受賞した(Tamboら)。それ以来、WHOの「必須医薬品リスト」に掲載されている。多くの低・中所得者層で達成された罹患率と死亡率の世界的な大規模な削減を超えて、メジカンの高い安全性と副作用の発生率の低さを確立する知識ベースは、何十億回もの投与経験に基づいているため、他の追随を許さないものである。一例として、1987年に33カ国以上で河川盲目症と闘うために設立されたメジカン(イベルメクチン)提供プログラムでは、最初の20年間だけで5億7,000万回以上の治療が行われた(Tambo er al)。 数多くの研究が有害事象の発生率を低く報告しており、その大部分は軽度で一過性のものであり、大部分は寄生虫の死に対する身体の炎症反応に起因しており、かゆみ、発疹、リンパ節の腫れ、関節痛、発熱、頭痛などが含まれている(Kircik et al 2016)。5万人以上の患者を含む試験の結果を組み合わせた研究では、重篤なイベントは1%未満で発生し、ロアロアの投与に大きく関連していた(Gardon et al 1997)。さらに、医薬品標準規格Lexicompによると、イベルメクチンとの併用が禁忌とされている薬剤は、抗結核ワクチンとコレラワクチンの同時投与のみであり、抗凝固剤のワルファリンは投与量のモニタリングが必要となる。薬物相互作用のより長いリストは、drugs.comのデータベースに掲載されており、ほとんどすべての相互作用がイベルメクチンの血中濃度の上昇または低下の可能性につながっている。イベルメクチンの高用量漸増投与による忍容性と副作用の欠如を示した研究を考えると、毒性の可能性は低いが、血中濃度の低下による有効性の低下が懸念される(Guzzo et al 2002)。
考察
現在(2020年12月14日現在)COVID-19におけるイベルメクチンの安全性と有効性を示すエビデンスの蓄積は、パンデミックの状況下でのリスク/ベネフィット計算上の即時使用を強く支持している。大規模な疫学的解析は、in-vitro、動物試験、予防試験、および臨床試験の結果を検証している。イベルメクチンが広く使用されている世界の地域では、症例数、入院、および致死率が大幅に減少していることが実証されている。このアプローチは、COVID-19パンデミックが深刻化する中で、ワクチン接種への橋渡しとして早急に検討されるべきである。プレプリントとして発表されたオーストラリアの研究者による8つのRCTのシステマティックレビューでは、同様に、イベルメクチン治療は、臨床重症度のすべての段階の患者において、死亡率、臨床的回復までの時間、病気の進行度、入院期間の短縮につながったと結論づけられている(Kalfas et al 2020)。我々の現在のレビューには、24の対照研究[15のRCT(n=3,080)]からの合計7,300人の患者が含まれている;4,054人の患者を含む12の査読付きジャーナルに発表された。
COVID-19のパンデミックの間に、印刷前の出版物は爆発的に増加した。裏付けとなる臨床データが得られる前に広く採用されたヒドロキシクロロキンと回復期血漿を除いて、その後のほとんどすべての治療薬は、印刷前の出版後、ピアレビューの前に採用された。例としては、レムデシビル、コルチコステロイド、およびモノクローナル抗体が挙げられる。さらに積極的な急速な採用の例としては、患者への予防接種を発注する医師が論文前または査読付き試験データのいずれかをレビューする前に、新規mRNAワクチンを使用した予防接種プログラムを開始したことが挙げられる12。
イベルメクチンの長期にわたる安全性の記録、低コスト、幅広い利用可能性に加えて、イベルメクチンが広範囲に分布している地域におけるCOVID-19の感染率、入院の必要性、死亡率、人口全体でのCOVID-19の症例数と死亡率に関する一貫した再現性のある大規模な調査結果の文脈では、広範囲に採用される前にピアレビューに合格するように残りの研究を主張することは不謹慎であり、パンデミック中の新しい治療法の採用に対する現在確立されている標準的なアプローチから逸脱しているように思われる。実際、24の対照試験のうち12試験がすでに査読付きジャーナルに掲載されていることを考えると、採用に対するこのような障壁を主張することは、実際にはこの新しい基準に違反することになるであろう。
観察試験の結果の妥当性に関する懸念については、イベルメクチンの場合、
1)試験の大部分が無作為化比較試験デザインを採用していること(上記の24試験のうち15試験)
2)観察試験と無作為化比較試験デザインは 2014年に行われたこのトピックに関する大規模なコクランレビュー(Anglemyer er al)。 特に、(フロリダのRijter研究のように)傾向マッチング技術を採用したOCTでは、冠症候群、重篤な疾患、手術を含む多くの異なる疾患状態において、後に実施されたRCTとほぼ同じ結論が得られている(Dahabreh et al 2012;Lonjon et al 2014;Kitsios et al 2015)。
同様に、要約試験表(表2a,b,c)および予防試験(図2)と治療試験(図3)のメタアナリシスで証明されているように、OCTとRCTの両方の試験デザインで見つかった利益の全体は、利益の方向と大きさの両方で一致している。世界中の複数の異なる国やセンターで行われた、デザインの異なる多数の試験の間で、このような有益性の一貫性は、エビデンスに基づいた医療の歴史の中でもユニークなものであり、このレビューで得られた結論を強力かつ追加的に支持するものである。すべての人は、1964年に初めて制定された世界医師会の「ヒトを対象とする医学研究の倫理原則に関するヘルシンキ宣言」の37宣言を考慮しなければならない。
個々の患者の治療において、証明された介入が存在しない場合、または他の既知の介入が効果的でない場合、医師は、専門家の助言を求めた後、患者または法的に権限を与えられた代理人のインフォームド・コンセントを得て、医師の判断で、それが生命を救う、健康を回復する、または苦痛を軽減する希望を提供する場合には、証明されていない介入を使用することができる。この介入は、その後、その安全性と有効性を評価するために設計された研究の対象とされるべきである。すべての場合において、新しい情報は記録されなければならず、また、適切な場合には、一般に公開されなければならない。
上記の宣言37は、臨床試験データが入手できなかった時点で、治療の利益がいかなるリスクをも上回るであろうという合理的な推定に基づいて、COVID-19パンデミックの初期に多くのプロバイダーによってヒドロキシクロロキンが熱狂的に広範囲に使用されたことを支持し、また許すものであるが、しかしながら、上記のように、「この介入は、その後、研究の対象とされるべきである」ので、多くのセンターは直ちに、この採用された実践の影響を研究し始めた。残念なことに、熱い議論があったものの、その後のヒドロキシクロロキンの臨床試験のデータを見る限り、ほとんどの治療状況でこの治療法は採用されなかった。有効性が証明されているにもかかわらず、抗ウイルス薬であるイベルメクチンを迅速かつ広く採用しようとする一般的で有害な傾向があったのは、ヒドロキシクロロキンの経験が影響していたと考えられる。もし、医療従事者がパンデミックの初期段階でヒドロキシクロロキンの代わりにイベルメクチンを広く採用していたならば、現在の世界の健康状態は歴史的に見ても著しく改善されていたかもしれない。
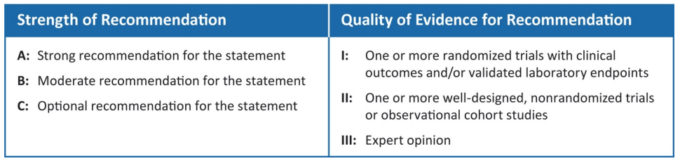
COVID-19患者に対する適切な治療介入を決定する際に医療従事者が直面している継続的な課題は、政府の主要な医療機関から最新かつ決定的なエビデンスに基づいたガイダンスが提供されれば、大幅に緩和されるであろう。現在、米国ではCOVID-19の治療ガイドラインはNIH(National Institutes of Health)によって発行されている。残念ながら、COVID-19患者におけるイベルメクチンの使用に関するNIHの勧告は 2020年8月27日に最終更新された。その時点では、イベルメクチンは使用に対してAIIIの勧告を受けていた。下の図8によると、この勧告は「専門家の意見のみ」に基づく「強い」勧告であり、当時は臨床的証拠がほとんど存在していなかったことを考慮すると、この勧告は「強い」勧告であった。
図8 NIH勧告評価スキーム
本レビューで提示された臨床的および疫学的証拠を総合的に考慮し、イベルメクチンが広く使用されていない世界の一部でパンデミックが悪化しているという状況の中で、著者らは、国の医療提供者を支援し、指導するために、勧告を直ちに更新しなければならないと考えている。NIHの専門家パネルで議論される可能性がある一つの側面は、イベルメクチンに割り当てられるべき勧告のグレードについてである。上記の図8に基づいて、最も強力な勧告はイベルメクチンを支持するAIであり、「臨床結果および/または実験室でのエンドポイントを有する1つ以上の無作為化試験」を必要とする。14 件の無作為化比較試験(RCT)のデータが、感染率、入院率、死亡率などの「臨床結果」に一貫した大きな改善を示していることを考えると、AI レベルの推奨基準をはるかに超えているように思われる。しかし、悩ましいことではあるが、専門家が、利用可能なRCTデータのすべてが米国外で実施されたものであり、米国の学術研究センター以外で実施されたものであることや、外国からのデータは米国の患者には一般化できないことから、無効であり、却下されるべきであると結論付けた場合には、AIレベルの推奨を検討しなければならないだろう。パンデミックの状況が悪化する中で、安全で低コストで広く利用可能な早期治療の選択肢を検討する場合、AIIであっても、COVID-19の治療においてプロバイダーが直ちに広く採用することになるであろう。AIIの基準は、「よく計画された非ランダム化、または観察的コホート研究のうちの1つ以上」からの支持的な知見を必要とする。幸いなことに、COVID-19におけるイベルメクチンに関するこのような研究は数多く存在しており、その中でも最も規模が大きく、デザイン性に優れたものの一つがフロリダ州のDr. このように、この記事を書いている時点では、ほとんど調査されておらず、非常に効果的な治療法がない領域である早期の外来治療に直ちに広く採用されることになるであろうし、またそうなるべきである。さらに、これらのデータは、中程度の強さ(B)弱い強さ(C)グレードIIIの品質など、NIHの他の強さや品質レベルをはるかに超えていることは明らかである。これらの低い等級の勧告を出すことを正当化するためには、このレビューで提示された証拠のほぼ全体を破棄することに加えて、イベルメクチンを広く使用することのリスクが、症例数の増加、死亡者数の増加、ロックダウン、失業、立ち退き、破産という文脈で考えられる利益をはるかに上回るという信念の結果としてのリスク利益の計算が必要となる。確かに、これらのデータに基づいてそのような結論に達することはあり得ないので、これ以上の調査や議論には値しない。
これらのデータを総合して、予防的・早期治療の選択肢としてのイベルメクチンの使用は、国の医療従事者による使用を支持して、NIHによるAIレベルの勧告を受けるべきであるというのが著者の意見である。そのような勧告が出された場合、あるいは出された場合には、Front Line COVID-19 Critical Care Allianceは、「I-MASK+」と呼ばれるCOVID-19の予防および早期治療のアプローチを先取りして作成している。このプロトコルは、COVID-19のハイリスク患者および/または家族のCOVID-19曝露後の患者の早期治療および予防における中核療法としてのイベルメクチンの使用に基づいている(表4および5)。
要約すると、既存および累積的な証拠に基づき、我々は COVID-19 の予防および治療の両方においてイベルメクチンの使用を推奨する。世界的なCOVID-19の急増があった場合、この安全で安価で効果的な介入の広範な使用は、感染率の劇的な減少、および軽症期、中等症期、さらには重症期の罹患率と死亡率の劇的な減少につながるであろう。著者らは、一度採用されれば、公衆衛生および社会的に多くの好ましい影響をもたらすであろうという見通しに勇気づけられ、希望を持っている。
表 4. COVID-19に対するI-MASK+予防および早期外来治療プロトコール
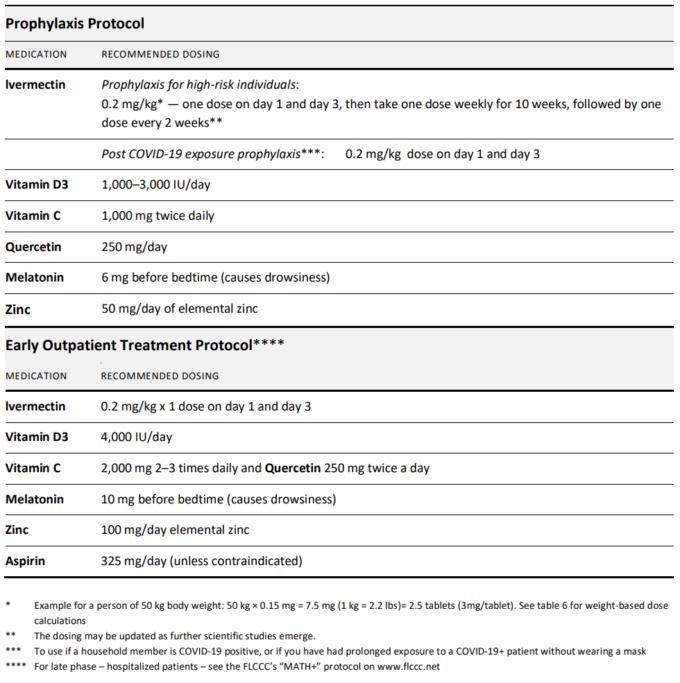
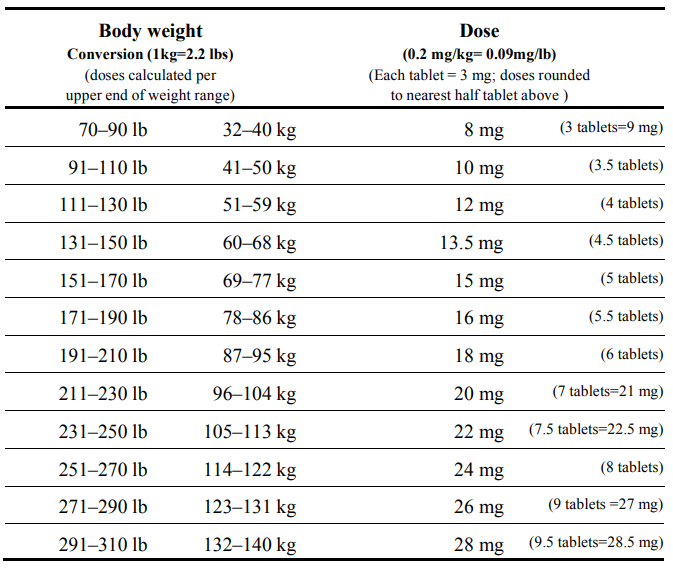
表 5. COVID-19 の予防および治療のための体重別イベルメクチンの推奨投与量
謝辞
なし
フィールドステートメントへの貢献
COVID-19は世界的なパンデミックを引き起こし、150万人以上の世界的な死者を出すとともに、継続的な症例数の増加、ロックダウン、失業、複数の国での景気後退をもたらしました。これを受けて、パンデミックの初期に結成されたFront Line COVID-19 Critical Care Alliance(FLCCC)は、効果的な治療プロトコルを開発するために、急速に出現している基礎科学、トランスレーショナルデータ、臨床データのレビューを開始した。「MATH+」と呼ばれる彼らの非常に効果的な病院内治療プロトコルの裏付けと根拠は、最近、主要な医学雑誌に掲載された。さらに最近では、新規薬剤と再利用薬剤の両方についての研究を継続的にレビューする中で、抗ウイルス性および抗炎症性を有することが知られており、広く使用されている抗寄生虫薬であるイベルメクチンが、COVID-19に対して非常に強力で多段階で効果的な治療法であることが明らかになった。本論文は、イベルメクチンに関する研究から得られた多様で増加しつつあるエビデンスを包括的にレビューし、最後に、COVID-19の予防と治療の両方に使用されるイベルメクチンは、数え切れないほどの命を救い、世界の多くの地域で増加している持続的な感染率を逆転させるという達成可能な目標を達成するために、体系的かつ世界的に採用されるべきであるというFLCCCのコンセンサス勧告で締めくくられている。
利益相反
著者らは、潜在的な利益相反と解釈される可能性のある商業的または経済的関係がない状態で研究が行われたことを宣言する。
著者の貢献
研究の構想とデザイン
ピエール・コーリー、G.ウンベルト・メドゥーリ、ハワード・コーンフェルド、キース・バーコウィッツ。
データ
スコット・ミッチェル、エイヴィンド・ノルイェヴォル、ポール・マリク、フレッド・ワグシュール
分析とデータの解釈
Paul Marik, Pierre Kory
原稿起草
ピエール・コーリー
批判的修正
ウンベルト・メドゥーリ、ジョセフ・ヴァロン
参考文献
Agarwal, A., Mukherjee, A., Kumar, G., Chatterjee, P., Bhatnagar, T., Malhotra, P., and Collaborators, P.T. (2020). Convalescent plasma in the management of moderate covid-19 in adults in India: open label phase II multicentre randomised controlled trial (PLACID Trial). BMJ 371, m3939.
Aguirre-Chang, G. (2020). Post-Acute or prolonged COVID-19: treatment with ivermectin for patietns with persistent, or post-acute symptoms ResearchGate.Available at: www.researchgate.net/publication/344318845
Ahmed, S., Karim, M.M., Ross, A.G., Hossain, M.S., Clemens, J.D., Sumiya, M.K., Phru, C.S., Rahman, M., Zaman, K., and Somani, J. (2020). A five day course of ivermectin for the treatment of COVID-19 may reduce the duration of illness. International Journal of Infectious Diseases.
Alam, M., R, M., Pf, G., Md, M.Z., S, S., and Ma, C. (2020). Ivermectin as Pre-exposure Prophylaxis for COVID 19 among Healthcare Providers in a Selected Tertiary Hospital in Dhaka An Observational Study. European Journal of Medical and Health Sciences.
Anglemyer, A., Horvath, H.T., and Bero, L. (2014). Healthcare outcomes assessed with observational study designs compared with those assessed in randomized trials. Cochrane Database Syst Rev, MR000034.
Arevalo, A.P., Pagotto, R., Porfido, J., Daghero, H., Segovia, M., Yamasaki, K., Varela, B., Hill, M., Verdes, J.M., and Vega, M.D. (2020). Ivermectin reduces coronavirus infection in vivo: a mouse experimental model. bioRxiv.
Atkinson, S.C., Audsley, M.D., Lieu, K.G., Marsh, G.A., Thomas, D.R., Heaton, S.M., Paxman, J.J., Wagstaff, K.M., Buckle, A.M., Moseley, G.W., Jans, D.A., and Borg, N.A. (2018). Recognition by host nuclear transport proteins drives disorder-to-order transition in Hendra virus V. Scientific Reports 8, 358.
Behera, P., Patro, B.K., Singh, A.K., Chandanshive, P.D., Ravikumar, S., Pradhan, S.K., Pentapati, S.S.K., Batmanabane, G., Padhy, B.M., and Bal, S. (2020). Role of ivermectin in the prevention of COVID-19 infection among healthcare workers in India: A matched case-control study. medRxiv.
Bernigaud, C., Guillemot, D., Ahmed-Belkacem, A., Grimaldi-Bensouda, L., Lespine, A., Berry, F., Softic, L., Chenost, C., Do-Pham, G., and Giraudeau, B. (Year). “Bénéfice de l’ivermectine: de la gale à la COVID-19, un exemple de sérendipité”, in: Annales de Dermatologie et de Vénéréologie: Elsevier), A194.
Bray, M., Rayner, C., Noël, F., Jans, D., and Wagstaff, K. (2020). Ivermectin and COVID-19: a report in Antiviral Research, widespread interest, an FDA warning, two letters to the editor and the authors’ responses. Antiviral Research.
Budhiraja, S., Soni, A., Jha, V., Indrayan, A., Dewan, A., Singh, O., Singh, Y., Chugh, I., Arora, V.,and Pandey, R. (2020). Clinical Profile of First 1000 COVID-19 Cases Admitted at Tertiary Care Hospitals and the Correlates of their Mortality: An Indian Experience. medRxiv. doi: doi.org/10.1101/2020.11.16.20232223
Cadegiani, F.A., Goren, A., Wambier, C.G., and Mccoy, J. (2020). Early COVID-19 Therapy with Azithromycin Plus Nitazoxanide, Ivermectin or Hydroxychloroquine in Outpatient Settings Significantly Reduced Symptoms Compared to Known Outcomes in Untreated Patients. medRxiv. doi: doi.org/10.1101/2020.11.16.20232223
Callard, F., and Perego, E. (2020). How and why patients made Long Covid. Social Science & Medicine, 113426.
Caly, L., Druce, J.D., Catton, M.G., Jans, D.A., and Wagstaff, K.M. (2020a). The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Research 178, 104787.
Caly, L., Druce, J.D., Catton, M.G., Jans, D.A., and Wagstaff, K.M. (2020b). The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Res 178, 104787.
Camprubi, D., Almuedo-Riera, A., Marti-Soler, H., Soriano, A., Hurtado, J.C., Subira, C., Grau-Pujol, B., Krolewiecki, A., and Munoz, J. (2020). Lack of efficacy of standard doses of ivermectin in severe COVID-19 patients. PLoS One 15, e0242184.
Carvallo, H.E., Hirsch, R.R., and Farinella, M.E. (2020a) . Safety and Efficacy of the combined use of ivermectin, dexamethasone, enoxaparin and aspirin against COVID-19. medRxiv. doi: doi.org/10.1101/2020.09.10.20191619
Carvallo, H.E., Roberto, H., Psaltis, A., and Veronica, C. (2020b). Study of the Efficacy and Safety of Topical Ivermectin+ Iota-Carrageenan in the Prophylaxis against COVID-19 in Health Personnel. Journal of Biomedical Research and Clinical Investigation 2, 1
Chaccour, C., Casellas, A., Blanco-Di Matteo, A., Pineda, I., Fernandez-Montero, A., Castillo, P.R., Richardson, M.-A., Mateos, M.R., Jordan-Iborra, C., and Brew, J. (2020). The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with mild COVID-19: a pilot, double-blind, placebo-controlled, randomized clinical trial. 10.21203/rs.3.rs-116547/v1
Chachar, A.Z.K., Khan, K.A., Asif, M., Tanveer, K., Khaqan, A., and Basri, R. (2020). Effectiveness of Ivermectin in SARS-CoV-2/COVID-19 Patients. International Journal of Sciences 9, 31-35.
Chamie-Quintero, J., Hibberd, J., Scheim, DE. (2020). COVID-19 case fatalities and total deaths
with and without mass ivermectin treatment in different states of Peru. Open Science Foundation osf.io/ydc2p/
Chowdhury, A.T.M.M., Shahbaz, M., Karim, M.R., Islam, J., Guo, D., and He, S. (2020). A Randomized Trial of Ivermectin-Doxycycline and Hydroxychloroquine-Azithromycin therapy on COVID19 patients. DOI:10.21203/rs.3.rs-38896/v1
Ci, X., Li, H., Yu, Q., Zhang, X., Yu, L., Chen, N., Song, Y., and Deng, X. (2009). Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen-activated protein kinase activation pathway. Fundam Clin Pharmacol 23, 449-455.
Consortium, W.S.T. (2020). Repurposed antiviral drugs for COVID-19—interim WHO SOLIDARITY trial results. medRxiv. DOI: 10.1056/NEJMoa2023184
Dahabreh, I.J., Sheldrick, R.C., Paulus, J.K., Chung, M., Varvarigou, V., Jafri, H., Rassen, J.A., Trikalinos, T.A., and Kitsios, G.D. (2012). Do observational studies using propensity score methods agree with randomized trials? A systematic comparison of studies on acute coronary syndromes. European Heart Journal 33, 1893-1901.
Dasgupta J, S.U., Bakshi a, Dasgupta a, Manna K, Saha, C De, Rk, Mukhopadhyay S, Bhattacharyya Np (2020). Nsp7 and Spike Glycoprotein of SARS-CoV-2 Are Envisaged as Potential Targets of Vitamin D and Ivermectin. Preprints. www.preprints.org/manuscript/202005.0084/v1
Dayer, M.R. (2020). Coronavirus (2019-nCoV) Deactivation via Spike Glycoprotein Shielding by Old Drugs, Bioinformatic Study. Preprints. doi: 10.20944/preprints202005.0020.v1
De Melo, G.D., Lazarini, F., Larrous, F., Feige, L., Kergoat, L., Marchio, A., Pineau, P., Lecuit, M., Lledo, P.-M., Changeux, J.-P., and Bourhy, H. (2020) . Anti-COVID-19 efficacy of ivermectin in the golden hamster. bioRxiv, 2020.2011.2021.392639.
Elgazzar, A., Hany, B., Youssef, S.A., Hafez, M., and Moussa, H. (2020). Efficacy and Safety of Ivermectin for Treatment and prophylaxis of COVID-19 Pandemic.Research Square. DOI:10.21203/rs.3.rs-100956/v1
Entrenas Castillo, M., Entrenas Costa, L.M., Vaquero Barrios, J.M., Alcala Diaz, J.F., Lopez Miranda, J., Bouillon, R., and Quesada Gomez, J.M. (2020). “Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study”. J Steroid Biochem Mol Biol 203, 105751.
Espitia-Hernandez, G., Munguia, L., Diaz-Chiguer, D., Lopez-Elizalde, R., and Jimenez-Ponce, F. (2020). Effects of Ivermectin-azithromycin-cholecalciferol combined therapy on COVID-19 infected patients: a proof of concept study.Biomedial Research.
Gardon, J., Gardon- Wendel, N., Demanga, N., Kamgno, J., Chippaux, J. -P., and Boussinesq, M. (1997). Serious reactions after mass treatment of onchocerciasis with ivermectin in an area endemic for Loa loa infection. The Lancet 350, 18-22.
Gorial, F.I., Mashhadani, S., Sayaly, H.M., Dakhil, B.D., Almashhadani, M.M., Aljabory, A.M., Abbas, Hassan M, Ghanim, M., and Rasheed, J.I. (2020). Effectiveness of Ivermectin as add-on Therapy in COVID-19 Management (Pilot Trial). medRxiv.
Götz, V., Magar, L., Dornfeld, D., Giese, S., Pohlmann, A., Höper, D., Kong, B.-W., Jans, D.A., Beer, M., Haller, O., and Schwemmle, M. (2016) . Influenza A viruses escape from MxA restriction at the expense of efficient nuclear vRNP import. Scientific Reports 6, 23138.
Guzzo, C., Furtek, C., Porras, A., Chen, C., Tipping, R., Clineschmidt, C., Sciberras, D., Hsieh, J., and Lasseter, K. (2002).Safety, Tolerability, and Pharmacokinetics of Escalating High Doses of Ivermectin in Healthy Adult Subjects.Journal of clinical pharmacology 42, 1122-1133.
Hashim, H.A., Maulood, M.F., Rasheed, A.M., Fatak, D.F., Kabah, K.K., and Abdulamir, A.S. (2020). Controlled randomized clinical trial on using Ivermectin with Doxycycline for treating COVID-19 patients in Baghdad, Iraq. medRxiv.
Hellwig, M.D., and Maia, A. (2020). A COVID-19 Prophylaxis? Lower incidence associated with prophylactic administration of Ivermectin. Int J Antimicrob Agents, 106248.
Hermine, O., Mariette, X., Tharaux, P.L., Resche-Rigon, M., Porcher, R., Ravaud, P., and Group, C.-C. (2020). Effect of Tocilizumab vs Usual Care in Adults Hospitalized With COVID-19 and Moderate or Severe Pneumonia: A Randomized Clinical Trial. JAMA Intern Med.
Horby, P., Lim, W.S., Emberson, J.R., Mafham, M., Bell, J.L., Linsell, L., Staplin, N., Brightling, C., Ustianowski, A., and Elmahi, E. (2020). Dexamethasone in hospitalized patients with Covid-19-preliminary report. The New England journal of medicine.
Hussien, M.A., and Abdelaziz, A.E. (2020). Molecular docking suggests repurposing of brincidofovir as a potential drug targeting SARS-CoV-2 ACE2 receptor and main protease. Network Modeling Analysis in Health Informatics and Bioinformatics 9, 1-18.
Jehi, L., Ji, X., Milinovich, A., Erzurum, S., Rubin, B.P., Gordon, S., Young, J.B., and Kattan, M.W. (2020). Individualizing Risk Prediction for Positive Coronavirus Disease 2019 Testing: Results From 11,672 Patients. Chest 158, 1364-1375.
Kalfas, S., Visvanathan, K., Chan, K., and Drago, J. (2020). THE THERAPEUTIC POTENTIAL OF IVERMECTIN FOR COVID-19: A REVIEW OF MECHANISMS AND EVIDENCE. medRxiv.Khan, M.S.I., Khan, M.S.I., Debnath, C.R., Nath, P.N., Mahtab, M.A., Nabeka, H., Matsuda, S., and Akbar, S.M.F. (2020).Ivermectin Treatment May Improve the Prognosis of Patients With COVID-19. Archivos de Bronconeumología.
King, C.R., Tessier, T.M., Dodge, M.J., Weinberg, J.B., and Mymryk, J.S. (2020). Inhibition of Human Adenovirus Replication by the Importin α/β1 Nuclear Import Inhibitor Ivermectin. Journal of Virology 94.
Kircik, L.H., Del Rosso, J.Q., Layton, A.M., and Schauber, J. (2016). Over 25 Years of Clinical Experience With Ivermectin: An Overview of Safety for an Increasing Number of Indications. Journal of drugs in dermatology : JDD 15, 325-332.
Kitsios, G.D., Dahabreh, I.J., Callahan, S., Paulus, J.K., Campagna, A.C., and Dargin, J.M. (2015). Can We Trust Observational Studies Using Propensity Scores in the Critical Care Literature? A Systematic Comparison With Randomized Clinical Trials. Crit Care Med 43, 1870-1879.
Kory, P., Meduri, G.U., Iglesias, J., Varon, J., and Marik, P.E. (2020). Clinical and Scientific Rationale for the “MATH+” Hospital Treatment Protocol for COVID-19. Journal of Intensive Care Medicine.
Lehrer, S., and Rheinstein, P.H. (2020). Ivermectin Docks to the SARS-CoV-2 Spike Receptor-binding Domain Attached to ACE2. In Vivo 34, 3023-3026.
Li, Y., Chen, M., Cao, H., Zhu, Y., Zheng, J., and Zhou, H. (2013). Extraordinary GU-rich single-strand RNA identified from SARS coronavirus contributes an excessive innate immune response. Microbes Infect 15, 88-95.
Lonjon, G., Boutron, I., Trinquart, L., Ahmad, N., Aim, F., Nizard, R., and Ravaud, P. (2014). Comparison of treatment effect estimates from prospective nonrandomized studies with propensity score analysis and randomized controlled trials of surgical procedures. Ann Surg 259, 18-25.
Lv, C., Liu, W., Wang, B., Dang, R., Qiu, L., Ren, J., Yan, C., Yang, Z., and Wang, X. (2018). Ivermectin inhibits DNA polymerase UL42 of pseudorabies virus entrance into the nucleus and proliferation of the virus in vitro and vivo. Antiviral Research 159, 55-62.
Mahmud, R. (2020). A Randomized, Double-Blind Placebo Controlled Clinical Trial of Ivermectin plus Doxycycline for the Treatment of Confirmed Covid-19 Infection.
Marik, P.E., Kory, P., Varon, J., Iglesias, J., and Meduri, G.U. (2020). MATH+ protocol for the treatment of SARS-CoV-2 infection: the scientific rationale. Expert Review of Anti-infective Therapy, 1-7.
Mastrangelo, E., Pezzullo, M., De Burghgraeve, T., Kaptein, S., Pastorino, B., Dallmeier, K., De Lamballerie, X., Neyts, J., Hanson, A.M., Frick, D.N., Bolognesi, M., and Milani, M. (2012). Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug. Journal of Antimicrobial Chemotherapy 67, 1884-1894.
Maurya, D.K. (2020). A combination of ivermectin and doxycycline possibly blocks the viral entry and modulate the innate immune response in COVID-19 patients.
Morgenstern, J., Redondo, J.N., De Leon, A., Canela, J.M., Torres, N., Tavares, J., Minaya, M., Lopez, O., Placido, A.M., and Castillo, A. (2020). The use of compassionate Ivermectin in the management of symptomatic outpatients and hospitalized patients with clinical diagnosis of COVID-19 at the Medical Center Bournigal and the Medical Center Punta Cana, Rescue Group, Dominican Republic, from may 1 to august 10, 2020. medRxiv.
Nadkarni, G.N., Lala, A., Bagiella, E., Chang, H.L., Moreno, P.R., Pujadas, E., Arvind, V., Bose, S., Charney, A.W., Chen, M.D., Cordon-Cardo, C., Dunn, A.S., Farkouh, M.E., Glicksberg, B.S., Kia, A., Kohli-Seth, R., Levin, M.A., Timsina, P., Zhao, S., Fayad, Z.A., and Fuster, V. (2020). Anticoagulation, Bleeding, Mortality, and Pathology in Hospitalized Patients With COVID-19. J Am Coll Cardiol 76, 1815-1826.
Nallusamy, S., Mannu, J., Ravikumar, C., Angamuthu, K., Nathan, B., Nachimuthu, K., Ramasamy, G., Muthurajan, R., Subbarayalu, M., and Neelakandan, K. (2020). Shortlisting Phytochemicals Exhibiting Inhibitory Activity against Major Proteins of SARS-CoV-2 through Virtual Screening.
Niaee, M.S., Gheibi, N., Namdar, P., Allami, A., Zolghadr, L., Javadi, A., Karampour, A., Varnaseri, M., Bizhani, B., and Cheraghi, F. (2020). Ivermectin as an adjunct treatment for hospitalized adult COVID-19 patients: A randomized multi-center clinical trial.
Perera, R.A., Tso, E., Tsang, O.T., Tsang, D.N., Fung, K., Leung, Y.W., Chin, A.W., Chu, D.K., Cheung, S.M., and Poon, L.L. (2020). SARS-CoV- 2 virus culture from the upper respiratory tract: Correlation with viral load, subgenomic viral RNA and duration of illness. MedRXiv.
Podder, C.S., Chowdhury, N., Sina, M.I., and Haque, W. (2020). Outcome of ivermectin treated mild to moderate COVID-19 cases: a single-centre, open-label, randomised controlled study. IMC J. Med. Sci 14.
Polak, S.B., Van Gool, I.C., Cohen, D., Von Der Thusen, J.H., and Van Paassen, J. (2020). A systematic review of pathological findings in COVID-19: a pathophysiological timeline and possible mechanisms of disease progression. Mod Pathol 33, 2128-2138.
Portmann-Baracco, A., Bryce-Alberti, M., and Accinelli, R.A. (2020). Antiviral and Anti-Inflammatory Properties of Ivermectin and Its Potential Use in Covid-19. Arch Bronconeumol.
Rajter, J.C., Sherman, M.S., Fatteh, N., Vogel, F., Sacks, J., and Rajter, J.J. (2020). Use of Ivermectin is Associated with Lower Mortality in Hospitalized Patients with COVID-19 (ICON study). Chest.
Robin, R.C., Alam, R.F., Saber, S., Bhiuyan, E., Murshed, R., and Alam, M.T. (2020). A Case Series of 100 COVID-19 Positive Patients Treated with Combination of Ivermectin and Doxycycline. Journal of Bangladesh College of Physicians and Surgeons, 10-15.
Rodriguez-Nava, G., Trelles-Garcia, D.P., Yanez-Bello, M.A., Chung, C.W., Trelles-Garcia, V.P., and Friedman, H.J. (2020). Atorvastatin associated with decreased hazard for death in COVID-19 patients admitted to an ICU: a retrospective cohort study. Crit Care 24, 429.
Rubin, R. (2020). As Their Numbers Grow, COVID-19 “Long Haulers” Stump Experts. JAMA 324, 1381-1383.
Salvarani, C., Dolci, G., Massari, M., Merlo, D.F., Cavuto, S., Savoldi, L., Bruzzi, P., Boni, F., Braglia, L., Turra, C., Ballerini, P.F., Sciascia, R., Zammarchi, L., Para, O., Scotton, P.G., Inojosa, W.O., Ravagnani, V., Salerno, N.D., Sainaghi, P.P., Brignone, A., Codeluppi, M., Teopompi, E., Milesi, M., Bertomoro, P., Claudio, N., Salio, M., Falcone, M., Cenderello, G., Donghi, L., Del Bono, V., Colombelli, P.L., Angheben, A., Passaro, A., Secondo, G., Pascale, R., Piazza, I., Facciolongo, N., Costantini, M., and Group, R.-T.- C.-S. (2020). Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: A Randomized Clinical Trial. JAMA Intern Med.
Scheim, D. (2020). “From Cold to Killer: How SARS-CoV-2 Evolved without Hemagglutinin Esterase to Agglutinate, Then Clot Blood Cells in Pulmonary and Systemic Microvasculature”. SSRN).
Schmith, V.D., Zhou, J., and Lohmer, L.R. (2020). The Approved Dose of Ivermectin Alone is not the Ideal Dose for the Treatment of COVID-19. Clinical Pharmacology & Therapeutics.
Sen Gupta, P.S., Biswal, S., Panda, S.K., Ray, A.K., and Rana, M.K. (2020). Binding mechanism and structural insights into the identified protein target of COVID-19 and importin-alpha with in-vitro effective drug ivermectin. J Biomol Struct Dyn, 1-10.
Shouman, W. (2020). Use of Ivermectin as a Prophylactic Option in Asymptomatic Family Close Contact for Patient with COVID-19. Clincal Trials.gov.
Soto-Becerra, P., Culquichicón, C., Hurtado-Roca, Y., and Araujo-Castillo, R.V. (2020). Real- world effectiveness of hydroxychloroquine, azithromycin, and ivermectin among hospitalized COVID-19 patients: results of a target trial emulation using observational data from a nationwide healthcare system in Peru. Azithromycin, and Ivermectin Among Hospitalized COVID -19 Patients: Results of a Target Trial Emulation Using Observational Data from a Nationwide Healthcare System in Peru.
Spoorthi V, S.S. (2020). Utility of Ivermectin and Doxycycline combination for the treatment of SARS-CoV2. International Archives of Integrated Medicine 7, 177-182.
Suravajhala, R., Parashar, A., Malik, B., Nagaraj, A.V., Padmanaban, G., Kishor, P.K., Polavarapu, R., and Suravajhala, P.(2020). Comparative Docking Studies on Curcumin with COVID-19 Proteins.
Swargiary, A. (2020). Ivermectin as a promising RNA-dependent RNA polymerase inhibitor and a therapeutic drug against SARS-CoV2: Evidence from in silico studies.
Tambo, E., Khater, E.I., Chen, J.H., Bergquist, R., and Zhou, X.N. Nobel prize for the artemisinin and ivermectin discoveries: a great boost towards elimination of the global infectious diseases of poverty.
Tay, M.Y.F., Fraser, J.E., Chan, W.K.K., Moreland, N.J., Rathore, A.P., Wang, C., Vasudevan, S.G., and Jans, D.A. (2013). Nuclear localization of dengue virus (DENV) 1–4 non-structural protein 5; protection against all 4 DENV serotypes by the inhibitor Ivermectin. Antiviral Research 99, 301-306.
Varghese, F.S., Kaukinen, P., Gläsker, S., Bespalov, M., Hanski, L., Wennerberg, K., Kümmerer, B.M., and Ahola, T. (2016).Discovery of berberine, abamectin and ivermectin as antivirals against chikungunya and other alphaviruses.
Wagstaff, Kylie m., Sivakumaran, H., Heaton, Steven m., Harrich, D., and Jans, David a. (2012). Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus. Biochemical Journal 443, 851-856.
Yang, S.N.Y., Atkinson, S.C., Wang, C., Lee, A., Bogoyevitch, M.A., Borg, N.A., and Jans, D.A. (2020). The broad spectrum antiviral ivermectin targets the host nuclear transport importin α/β1 heterodimer. Antiviral Research 177, 104760.
Young, B.E., Ong, S.W., Ng, L.F., Anderson, D.E., Chia, W.N., Chia, P.Y., Ang, L.W., Mak, T.-M., Kalimuddin, S., and Chai, L.Y.A. (2020). Viral dynamics and immune correlates of COVID-19 disease severity. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America.
Zhang, J., Rao, X., Li, Y., Zhu, Y., Liu, F., Guo, G., Luo, G., Meng, Z., De Backer, D., and Xiang, H. (2020a). High-dose vitamin C infusion for the treatment of critically ill COVID-19.
Zhang, X., Song, Y., Ci, X., An, N., Ju, Y., Li, H., Wang, X., Han, C., Cui, J., and Deng, X. (2008). Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res 57, 524-529.
Zhang, X., Song, Y., Xiong, H., Ci, X., Li, H., Yu, L., Zhang, L., and Deng, X. (2009). Inhibitory effects of ivermectin on nitric oxide and prostaglandin E2 production in LPS-stimulated RAW 264.7 macrophages. Int Immunopharmacol 9, 354-359.
Zhang, X.-J., Qin, J.-J., Cheng, X., Shen, L., Zhao, Y. -C., Yuan, Y., Lei, F., Chen, M.-M., Yang, H., and Bai, L. (2020b). In-hospital use of statins is associated with a reduced risk of mortality among individuals with COVID-19. Cell metabolism 32, 176-187. e174.
参考動画