Contents
Review of safety and minimum pricing of nitazoxanide for potential treatment of COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7332204/
オンライン版2020 Apr 30
Toby Pepperrell,1 Victoria Pilkington,2 Andrew Owen,3,4 Junzheng Wang,1 and Andrew M Hill3,*
概要
背景
コロナウイルス感染症2019(COVID-19)の治療のために、多くの治療薬が再利用されることが検討されている。試験管内試験で有望な結果を示した薬剤の1つがニタゾキサニドである。ニタゾキサニドは,他の薬剤とは異なり,500 mgを1日2回投与したときの最大血漿濃度(Cmax)と,重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の50%複製を阻害するのに必要な濃度(EC50)との比が高い(Cmax:EC50がほぼ14:1)。そのため、今後の試験においては、ニタゾキサニドの安全性を調査することが重要であると考えている。さらに、COVID-19の治療薬は、グローバルアクセスを促進するために安価であるべきであるが、多くの医薬品の価格は製造コストよりもはるかに高くなっている。我々は、ニタゾキサニドの安全性についてのレビューを行い、その最低製造コストを算出することを目的とした。
方法
ニタゾキサニドの臨床研究のレビューは、EMBASEおよびMEDLINEデータベースに加え、ClinicalTrials.govを用いて行った。あらゆる種類の急性感染症を経験した被験者を対象に、ニタゾキサニドとプラセボまたはアクティブコントロールを5~14日間比較した第2相または第3相の無作為化対照試験(RCT)を検索した。抽出したデータは、グレード1~4および重篤な有害事象(AE)。データは、消化管(GI)のAEのほか、肝機能障害や心血管障害についても抽出された。
2016年から 2019年までの原薬コストデータをPanjivaデータベースから抽出し、製造時の5%のロス、賦形剤のコスト、製剤、10%の利益率、税金を調整した。500mgのBDと1100mgの1日3回(TDS)の高用量の2つの投与量を検討した。推定コストは、いくつかの国で公表されているリストプライスと比較した。
結果
ニタゾキサニドに関する9つのRCTを対象とした。これらのRCTは、1514人の参加者と推定95.3人年のフォローアップを行った。評価したいずれのAEエンドポイントにおいても,すべての試験,あるいはアクティブ対照試験またはプラセボ対照試験のサブグループ解析において,有意な差は認められなかった。軽度のGI AEは投与量とともに増加した。肝機能障害や心血管障害の懸念はなかったが,適切な評価指標はほとんど報告されなかった。催奇形性の懸念はなかったが、エビデンスベースは非常に限られていた。
加重平均コスト61米ドル/kgに基づくと、ニタゾキサニド500mgBDを14日間投与した場合のコストは1.41米ドルとなる。1日あたりのコストは0.10ドルとなる。同じ14日間の経過でも、米国の市販薬局では3944ドル、パキスタン、インド、バングラデシュでは1経過あたり3ドルとなる。高用量のTDS 1100mgでは、14日間の投与で4.08ドル、1日あたり0.29ドルとなった。
結論
Nitazoxanideは、承認された用量では良好な安全性プロファイルを示している。しかし、肝機能障害、心血管系への影響、および催奇形性についてはさらなるエビデンスが必要である。ニタゾキサニドのジェネリック医薬品としての製造価格は、14日間の治療でBD500mgで1.41ドル、TDS1100mgで4.08ドルまで可能であると考えている。COVID-19患者を対象とした試験をさらに開始すべきである。SARS-CoV-2に対する有効性が臨床試験で証明されれば、ニタゾキサニドは現在進行中のパンデミックにおいて、安全で安価な治療法となるだろう。
背景
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は、Betacoronaviridae属に属するパンデミックRNAウイルスで、コロナウイルス感染症2019(COVID-19)の原因となっている。有効なワクチンが開発されるまでの間、多くの治療薬がCOVID-19の治療に再利用できるかどうか研究されている。候補となっている薬剤は、このウイルスに対して一定の活性を示しているが、重症例に対する人道的使用を除いて、特定の治療法はまだ認可されていない[1]。治験や人道的治療法として検討されている候補薬には、クロロキン、ヒドロキシクロロキン、ロピナビル、ダルナビル、レムデシビル、ファビピラビル、イベルメクチン、チアゾリド系抗原虫薬、ニタゾキサニドなどがある[2]。
ニタゾキサニドはチゾキサニドのプロドラッグであり、広汎な抗ウイルス作用を持ち、多くのウイルスに適応があり、Coronaviridaeに対して有望な薬理作用を示している[3]。COVID-19の患者を対象とした試験はまだ行われていないが、これまでに中東呼吸器症候群コロナウイルスおよび重症急性呼吸器症候群コロナウイルスに対して低い試験管内試験有効濃度(EC50)を示している[4]。そこで,ニタゾキサニドをSARS-CoV-2を阻害する可能性のある良い候補として選択した。阻害能を評価するために、研究者らは、チゾキサニドの最大血清濃度(Cmax)とニタゾキサニドのSARS-CoV-2に対する試験管内試験 EC50を比較した。
チゾキサニドの単回投与時の血漿中濃度は用量に比例することが報告されているが、1000mg 2000mg、3000mg、4000mgの各用量を食事とともに単回投与した場合、より高い曝露量が認められた(1000mgの場合、Cmaxは空腹時で12,300ng/mLであったのに対し、食事をした場合は15,900ng/mLであった)[5]。tizoxanideの薬物動態は、500mgおよび1000mgのBDを食事と共に7日間経口投与した後に評価された[6]。その結果、500mgBDの再投与による薬物動態への影響は認められなかったが(単回投与時のCmax 10,400ng/mLに対し、7日目は12,200ng/mL)1000mgBDの再投与により大幅に増加した(単回投与時のCmax 16,800ng/mLに対し、7日目は26,400ng/mL)[6]。報告されているチゾキサニドのCmax値はいずれも、SARS-CoV-2に対するニタゾキサニドの試験管内試験 EC50[651ng/mL(2.12μM)]を超えていた[7]。また、ニタゾキサニドの濃度は、肺においてSARS-CoV-2に対するEC50を3.1倍も上回ることが具体的に予測されている[8]。このEC50値は、ニタゾキサニドではなく、そのヒト代謝物であるチゾキサニドについて報告されたものであるが、過去の研究では、さまざまなインフルエンザ株に対して試験を行ったところ、ニタゾキサニドと同様の活性が示されていることに留意すべきである[9]。
試験管内試験での効力の評価とその適用には注意が必要である。一般的に、試験管内試験でのCmaxとEC50の比率が高いほど、生体内試験でのウイルス阻害の可能性が高いことを意味する。しかし、これらの値は標準化されておらず、多くの変数の影響を受ける可能性がある[10]。また、ニタゾキサニドの作用機序を考慮し、SARS-CoV-2の生体内試験阻害を評価する臨床試験を行うことも重要である。
SARS-CoV-2に対する加齢による感受性は、自然免疫反応の低下によって説明できると考えられている[11]。ニタゾキサニドは、宿主のインターフェロン経路をアップレギュレートし、自然免疫系の抗ウイルス反応を増幅させる[12]。したがって、ニタゾキサニドは、より強力なウイルス標的治療薬(ヒドロキシクロロキンのEC50=1.13μM、レムデシビルのEC50=0.77μM)に比べて、病気の初期段階で使用される有用な補助的治療法となりうる[7]。
ニタゾキサニドのこれまでの適応症は多岐にわたる。米国食品医薬品局(FDA)では、ジアルジア症に対して認可されている[13]。しかし、HIV患者のクリプトスポリジウム症の下痢、インフルエンザ、肝炎ウイルス、ロタウイルス、ノロウイルスなど、他の多くの疾患にも試験的に使用されている。このように、ニタゾキサニドの安全性プロファイルは様々に報告されており、COVID-19パンデミックで大規模な試験や治療を行う前に明らかにする必要がある。一般的に、COVID-19の治療経過は7~14日間行われるため、ニタゾキサニドが安全に使用できるかどうかは、この期間中に証明される必要がある[14]。
新規のCOVID-19治療薬は、安全で効果的であるだけでなく、安価で容易に入手できるものでなければならない。現在研究されている潜在的な候補薬の多くは、治療1経過あたり非常に低コストでジェネリック医薬品として製造可能であることが示されており、中には1日あたり1米ドル以下で製造可能なものもある[14]。これらのジェネリック医薬品の推定価格は、妥当な利益率と税金を考慮した上で、医薬品有効成分(API)の推定投与量とコストに基づいて算出することができる。この方法は、C型肝炎治療薬やHIV治療薬などの製造コストを確実に推定するために用いられていた[15-17]。しかし,コロナウイルスの治療薬の価格は,製造コストよりもはるかに高く,アクセスに影響を与える可能性がある[14].
我々は,ニタゾキサニドの安全性に関する既存のエビデンスを検討し,COVID-19の治療に使用する可能性を示すために,その潜在的な最低製造コストを算出することを目的とした。
方法
安全性の検討
ニタゾキサニドの臨床研究のレビューは、システマティックレビューのためのCochraneフレームワークに従い、システマティックレビューおよびメタアナリシスのためのPRISMA声明の報告方法に従って実施した[18]。検索は、Ovid経由でEMBASEおよびMEDLINEデータベースを用いて行い(完全な検索用語はリクエストに応じて入手可能)さらにClinicalTrials.govでニタゾキサニドを介入として記載したすべての研究を検索して補足した。検索は2020年4月6日に終了した。
あらゆる種類の急性感染症を経験している参加者を対象に、ニタゾキサニドとプラセボまたはアクティブコントロールを比較した無作為化対照試験(RCT)を検索した。試験は、成人または小児を対象とした第2相または第3相試験であることが必要であった。参加者は、少なくとも5日間のニタゾキサニド投与を受ける必要があった。治療期間が短い試験は、薬剤への曝露期間が短いと結果にプラスの影響を与える可能性があり、COVID-19で使用される可能性のある治療法と比較することができないため、除外した。また、重度の慢性疾患を持つ患者のニタゾキサニド使用を評価した試験は、有害事象(AE)プロファイルや薬物相互作用が異なる可能性があるため、除外した。研究は2人の審査員が独立してこれらの基準に照らして審査し、矛盾が生じた場合には相互に合意した上で掲載または除外した。
さらに,入手可能なすべての安全性データの解析を行った。抽出したデータは,グレード 1~4 の AE と重篤な AE であった。また,第 1 相試験や薬事承認報告書から特定された注目すべき AE として,消化管(GI) AE,肝腎障害および心血管障害についてもデータを抽出した[19,20].COVID-19がこれらのシステムに悪影響を及ぼすことから,肝,腎,心血管系のエンドポイントを調査した[21,22].対象論文でこれらのシステムについて報告されている適切な評価指標はすべて抽出した。さらに、COVID-19で必要とされる可能性のある高用量での安全性を検討するために、同じ検索対象から用量範囲の研究を抽出した。
公表された論文、補足的な付録、ClinicalTrials.govでデータを検索した。矛盾がある場合は、発表された論文で報告されたデータを優先した。抽出したデータを標準化するために,グレード 1~4 の AE については,AE を経験した被験者数を抽出した。GI AE と重篤な AE については,1 人の被験者が複数の事象や事象タイプを経験する可能性があるため,より一貫して報告され,事象発生率をよりよく表すことができる事象数を優先した。報告バイアスを可能な限り回避するために,試験薬に関連すると考えられるものだけではなく,報告されたすべての AE データを抽出した。また,試験薬の効果を判定するために,比較対照群を用いた。また、事象の割合の統計的比較は、z検定を用いて行った。
コスト分析
我々は、Hillらが現在臨床試験中のCOVID-19の他の潜在的治療法の最低製造コストを推定するために最近使用した方法に従い、APIのコストに基づいてニタゾキサニド治療の潜在的コストを計算した[14]。APIコストのデータは 2016年から 2019年までの世界の出荷記録のPanjivaデータベースから抽出し、製造中の5%の損失、賦形剤(安定剤や増量剤などの完成した薬の中の他の成分)のコスト、処方、10%の利益率と税金で調整した[23]。治療期間はプロトコルによって異なるため、本研究では保守的に14日間とした。COVID-19の用量最適化の可能性を考慮して、BD500mgと高用量のTDS1100mgの2種類の用量を検討した。
推定コストは、一部の国で公表されている価格と比較し 2019年の12カ月間の平均為替レートに基づいて米ドルに換算した。国ごとに1つのデータソースを使用し、複数の価格が掲載されている場合は最も安いものを選択した[24-30]。
結果
安全性の検討
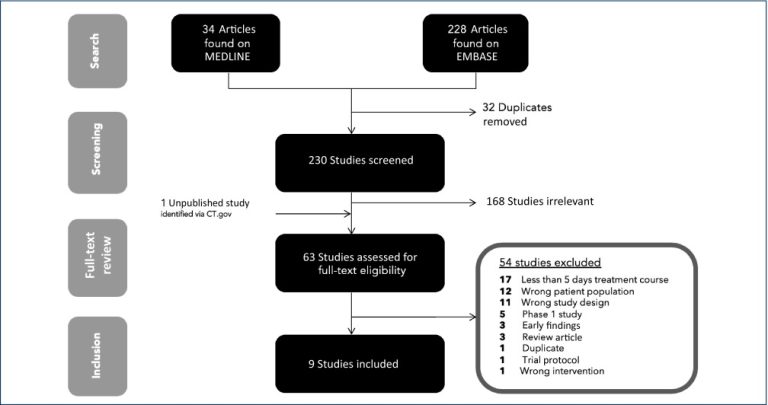
事前に規定した基準に照らし合わせてスクリーニングを行った結果、以前の適応症に対するニタゾキサニドの9つのRCTが組み入れ対象として特定された(図1)。17件の試験は、ニタゾキサニドの治療期間が短期間(通常3日間)であったため除外された。また、後天性免疫不全症候群、がん、末期の肝疾患、C型肝炎ウイルス感染などの重篤な慢性疾患を有する患者を対象とした試験が12件あったため、除外した。
図1検索およびスクリーニング結果を詳細に示すPRISMAフローチャート

対象となった9つの試験では、1514人の参加者が、推定95.3人年のフォローアップを受けた[31-39]。これらの患者のうち、925人がニタゾキサニドを服用していた。1つの試験では、小児と成人を分けて結果を報告している[38]。合計すると、50/1514人(3.3%)の参加者のみが小児であった。研究は世界の様々な国で行われた。米国、エジプト、ペルー、メキシコ、ハイチ。ニタゾキサニドの投与量は500mgBDが最も一般的であったが、1000mgBDを使用した研究もあった。小児の投与量は、体重や年齢によって異なる。入手可能な研究の属性をプールすると、参加者の45.6%が女性で、平均年齢は37歳であった。
5つの研究ではプラセボ比較(n=1077)が行われ、4つの研究ではメトロニダゾール(n=437)バンコマイシン、標準的な結核治療などの抗生物質比較が行われた(表1)。研究対象者は、クロストリジウム・ディフィシル、ヘリコバクター・ピロリ、結核菌、ウイルス性インフルエンザ、アメーバ症など、さまざまな病態を有していた。
表1 有害事象の報告があった6つの第2相および第3相の対照試験から抽出された安全性データの概要

報告された6つの安全性評価項目について、対象となる試験ごとに抽出されたデータを示している。
AE:有害事象、SAE:重篤な有害事象、GI:胃腸。
表2は、3つのAEエンドポイントそれぞれの全体イベント数と割合、およびニタゾキサニド群と比較対照群の差の比較有意性を示している。これらの結果は,さらに比較対象の種類によって,プラセボ対照を用いた試験と積極的な抗菌薬対照レジメンを用いた試験の結果に分類されている。プラセボ対照を用いた試験の結果は、ニタゾキサニドの特異的な効果を分離したものである。
表2 ニタゾキサニドの無作為化試験における有害事象の発生率

AE:有害事象
評価したいずれのエンドポイントにおいても、全試験、あるいは活性化対照試験とプラセボ対照試験のサブグループ解析において、AE の割合に有意な差は認められなかった。イベント比率の最大の差は、プラセボ対照試験で発生したGI AEであり、ニタゾキサニド投与群33/131名(25.2%)対プラセボ投与群10/65名(15.4%)であったが、これも統計学的に有意ではなかった(表2)。図2aは全試験で発生した事象の割合を、図図2b,2bはサブグループ解析上の事象の割合を示している。
図2

(a) 対象となった全9試験(プラセボ対照およびアクティブ対照の両方)において、報告された安全性評価項目に発生したイベントの割合。(b) 報告された安全性評価項目に発生した事象の割合を、プラセボ対照の研究と積極的抗菌薬対照の研究の結果に層別して示したもの。
AE:有害事象;P=n.s: P = n.s: P-value non-significant; SAE: serious adverse events; Gr: grade; GI: gastrointestinal; PYFU: person-years of-follow-up
肝機能および心血管系のエンドポイント
対象となった9つの試験すべてで報告された安全性データによると、特定の肝・腎・心血管系のAEは、(バイオマーカーや症状報告を介して)広く評価されていないか、あまり報告されなかった。いくつかの試験では、有害事象が報告される前に1%~5%の発生率という閾値が設定されており、これらの有害事象が一貫して報告されていない理由が説明された。肝機能への影響を示す指標として、2つの試験でニタゾキサニド投与群と対照群との間で肝機能検査値の上昇が報告された(表3)。潜在的な腎作用の指標として、2つの試験でニタゾキサニド服用者に色尿(黄色の尿)の発生率が高いことが報告されたが、いずれも軽度で臨床的には重要ではなかった(表3)。9件の試験のいずれにおいても、心血管系のAEは記録・報告されなかった(表3)。
表3 対象となった9つの試験で報告された、ニタゾキサニドの肝、腎、心血管系の副作用に関する安全性データ

LFT:肝機能検査、NTZ:ニタゾキサニド、Hepatic: LFTまたはその他の関連する生化学的異常;腎:尿または腎関連の生化学的異常(クレアチニン、尿素、電解質など);心血管:(B型ナトリウム利尿ペプチド、トロポニン、胸痛、QT延長、心イベントなど)
ニタゾキサニドの472件のAEが記録されているWHO VigiAccessでは、肝毒性(n=3)黄疸(n=5)その他の肝胆道系障害(n=10)の報告例は非常に少なかった[40]。腎障害及び泌尿器系障害として報告されたAEが多かったが、その大半は色尿症の症例であった(n=63)。特筆すべきは、排尿障害9例、アゾタミア4例であった[40]。VigiAccess」では血栓性障害は認められなかったが、不整脈が9例、急性冠症候群が3例あった[40]。
用量依存性の有害事象
入手可能な文献を検討した結果、用量依存性の有害事象に関する懸念はなかった。しかし、1,000mgから4,000mgまでの単回投与を行った1つの試験では、軽度のGI症状が投与量に応じて増加した[5]。QT 間隔の調査では、用量の増加に伴う延長は認められなかった[41]。
コスト分析
最小限の製造コストについては、原薬の加重平均コストを1kgあたり61ドル、1日の投与量を1000mg(BD500mg)とした場合、ニタゾキサニドを14日間投与した場合のコストは、損失、賦形剤、製剤、利益、税金を考慮して1.41ドルになると分析した(図3a)。したがって、1日あたりのコストは0.10ドルとなる。一方、同じ14日間の経過でも、図4に示すように、米国の市販薬局では3944ドル、パキスタン、インド、バングラデシュでは1経過あたりわずか3ドルしかかからない。また、TDS 1100mgという高用量では、14日分のコストが4.08ドルとなり(図3b)1日あたり0.29ドルとなった。
図3 ニタゾキサニドジェネリックの14日経過のコスト推定のアルゴリズム

(a)BD500mgを投与した場合の製造コストの試算。(b) TDS 1100mgを投与した場合の製造コストの試算。
API:医薬品有効成分、BD:1日2回、TDS:1日3回。
図4 特定の国におけるニタゾキサニド14日経過の定価

API:Active Pharmaceutical Ingredientの略
考察
本解析では、Nitazoxanideの安全性に関する臨床データをレビューし、関連する9つのRCTから得られた利用可能なデータをまとめた。Nitazoxanideの安全性は全体的に良好であり,総体的なAE,重篤なAE,GI AEの発生については,他の抗菌薬投与群やプラセボ対照群と比較して有意な差はなかった。
最小限の製造コストについては、我々の分析によると、1日の投与量を1000mg(BD500mg)とした場合、Nitazoxanideによる14日間の治療経過のコストは1.41ドルとなった。したがって,COVID-19に対する有効性が臨床研究で証明されれば,現在進行中のパンデミックにおいて,ニタゾキサニドは安全で安価な治療薬となる可能性がある。
制限事項
今回の分析は、公開されている文献に限られている。対象となった9件の研究では、治療期間が5~14日であったため、本レビューの結果は、同様に短期間のニタゾキサニド投与にのみ適用でき、長期的な安全性についてはコメントできない。これはCOVID-19の治療期間と同様であるが、予防のために使用する可能性がある場合は、累積毒性の影響を評価するためにさらなる証拠が必要である。
ニタゾキサニドはCOVID-19に対して有効であることが試験管内試験の結果から示唆されているが、臨床効果を得るためにはどの程度の用量を投与する必要があるのかはまだ明らかになっていない。より高用量の投与が必要であると考えられる。このレビューに含まれる研究では、BD500mgの用量が最も一般的に使用されているが、小児の投与量には年齢や体重の違いがある。投与量の範囲に関する研究は小規模で、期間も短かった。COVID-19 の治療に 1 日 1,000 mg を超える用量が必要な場合は,用量依存性 AE の可能性を考慮する必要があり,さらなる検討が必要である.
これらの知見の一般化は、対象とした試験が実施された環境や集団に限定され、対象とした試験の参加者の多くが若年者(平均年齢 37 歳)であった。つまり、高齢のCOVID-19患者には知見が適用できない可能性がある。
消化器系への影響
ニタゾキサニドの第1相試験では、最も一般的な副作用として胃腸障害が認められた。これらの事象は軽度であり、その他の重篤な事象は認められなかった[6,20]。文献調査によると、小児の下痢症治療のためにニタゾキサニドを3日間投与した多くの小規模試験では、ニタゾキサニド投与により腹痛などの軽度で一過性のGI事象の発生率が上昇したが、重度または持続性のAEはほとんどなかったと報告されている。
これらの研究では、消化器系のAEは、ニタゾキサニドが治療に用いられていた急性感染症に起因するGIイベントとの区別が困難であったため、プラセボとの比較が不可欠である。今回のレビューでは、特にプラセボ対照試験において、ニタゾキサニドによるGI AEの割合が対照と比較して高かった。しかし、その差は統計学的に有意ではなかった。対象となったすべての試験において、GIイベントは一般的に軽度であり、最も一般的なものは腹痛と下痢であった。
心血管系への影響
COVID-19の心血管系への影響を示すエビデンスが増えている。比較的一般的な合併症には心筋炎があり、心電図や心エコー図に変化が見られる。トロポニンとB型ナトリウム利尿ペプチドの増加は予後を左右する可能性がある [42-44]。また、中等度から重度のCOVID-19には血液凝固促進作用があり[45]、血栓性の状態が塞栓症の原因となり[46,47]、D-ダイマーが予後の指標として作用することが示されている[48,49]。
COVID-19の心血管合併症が知られていることを考えると、潜在的な治療法の心血管への影響を評価することは重要である。ニタゾキサニドの第 1 相試験では、健康なボランティアにおいて QT 延長は認められなかった [41]。しかし、その後の臨床試験では、特定の追加試験は行われていない。本レビューで対象とした 9 件の試験では、心血管系の AE は報告されなかったが、試験では関連 するバイオマーカーのモニタリングが行われておらず、心血管系への影響が見過ごされた可能性がある。
肝機能障害
FDAの処方情報では、ニタゾキサニドの安全性について、肝機能障害及び腎機能障害を有する患者では未検討とされている[19]。COVID-19は、肝障害、腎不全、脱水症状を引き起こすことが知られている[21,22]。特にCOVID-19の患者は、肝トランスアミノ炎、蛋白尿、血清クレアチニン及び尿酸の増加が起こりやすい[21,22]。レビューしたニタゾキサニドの研究では、2件の肝機能検査の異常を除き、これらのマーカーは報告されていない。そのため、今後のニタゾキサニドの研究、特にCOVID-19の患者を対象とした研究では、肝機能のエンドポイントを報告することが求められる。
妊娠・授乳
ニタゾキサニドの催奇形性の可能性については、既存のエビデンスは限られている。初期の動物実験では、ニタゾキサニドはラットに高用量を投与しても生殖能力に悪影響を及ぼさなかった。また、ラットやウサギでは、高用量の投与にもかかわらず、胎児への害を示す証拠はなかった。しかし、妊婦におけるニタゾキサニドの影響を評価した適切な研究はなく、ニタゾキサニドがヒトの母乳中に排泄されるかどうかは不明である[20]。そのため、FDAは催奇形性の可能性を「カテゴリーB」と分類している[19]。これは、特に懸念すべき理由はないが、安全性について完全な結論を出すには十分な証拠がないことを示している。妊婦および授乳中の女性には引き続き注意が必要である。
用量依存的な影響
SARS-CoV-2を生体内試験で抑制するためには,本レビューに掲載された研究で使用された用量よりもはるかに高い用量が必要となる可能性がある.ニタゾキサニドの文献には重篤な用量依存性のAEは認められていないが、高用量での使用に関するデータは限られている。高用量では、ニタゾキサニドは軽度のGI AEを引き起こすことが示されているが、QT間隔を延長することはない。
製造コスト
予想通り、14 日間および 1 日あたりの推定製造コストは非常に低く、すでに分析された COVID-19 治療法の可能性と同程度であった[14]。したがって、将来の臨床試験データがCOVID-19に対するニタゾキサニド療法の使用を支持するものであれば、最小限のコストで大量生産し、特に低・中所得国での幅広いアクセスを確保することができる。
ただし、今回のコスト試算では、例えばジェネリック医薬品製造の中心地であるインドでの製造を前提としており、設備投資、間接費、労働力などの関連コストは、先発メーカー(今回のロマーク・ラボラトリーズ)よりも大幅に低いことに注意が必要である。さらに、現在の定価と比較した場合、各国の「実際の」定価は、国内で交渉された割引のために低くなっている可能性がある。
結論
Nitazoxanideは全体的に良好な安全性プロファイルを示し、総体的なAE、重篤なAE、消化器系のAEの発生は、他の抗菌薬レジメンやプラセボ対照と比較して有意な差はなかった。肝機能障害や心血管系への影響、および催奇形性についてはさらなるエビデンスが必要であるが、既存のエビデンスでは特に懸念すべき点はない。しかし、肝機能障害のある患者には注意を払い、慎重なモニタリングを行うことを推奨する。
ニタゾキサニドのジェネリック医薬品としての製造は、14日間の治療経過でBD500mgで1.41ドル、TDS1100mgで4.08ドルまで可能であると推定している。COVID-19を対象としたニタゾキサニドとヒドロキシクロロキンを比較したメキシコでの試験は、現在参加者を募集している(米国臨床試験登録番号NCT04341493)。COVID-19患者を対象とした試験をさらに開始する必要があるが、SARS-CoV-2に対するニタゾキサニドの試験管内試験での高い活性が報告されていることも確認する必要がある。SARS-CoV-2に対する有効性が臨床試験で証明されれば、ニタゾキサニドは現在進行中のパンデミックにおいて、安全で安価な治療法となるだろう。
資金調達
Unitaidが支援するプロジェクト「Affordable Medicines for Developing Countries」の一環として、International Treatment Preparedness Coalitionから資金提供を受けた。
利害の衝突
VPとTPは、申告すべき利益相反はない。AHはメルク社から、本プロジェクトとは関係のない臨床試験レビューのコンサルタント料を受け取っている。AOはメルク社、ヴィーブ・ヘルスケア社、ギリアド社から助成金とコンサルタント料を受けている。AOはTandem Nano Ltdの取締役であるが、このプロジェクトとは無関係である。