Contents
Repeated Exposure to Subinfectious Doses of SARS-CoV-2 May Promote T Cell Immunity and Protection against Severe COVID-19
pubmed.ncbi.nlm.nih.gov/34067349/
2021 年 5 月 22 日
概要
欧州では、感染力の高いSARS-CoV-2の亜種の拡散により、COVID-19の第3の波が発生している。COVID-19の感染率、入院率、死亡率は、さまざまなプラス要因とマイナス要因によって常に変化している。これらの要因の中で、一方では伝達性の高い亜種の増加、他方ではワクチン接種の効果が、第1次パンデミックの波とは大きく異なる状況を作り出している。
ヨーロッパのいくつかの国では、第2次および第3次パンデミックの波の中でCOVID-19の感染者数が増加したが、病気の重症度や死亡率は比例して増加していないという観察から、我々はSARS-CoV-2の動態に影響を与える追加要因の存在を仮定した。
この要因とは、人口の多い環境で低用量のウイルスに自然にさらされることで、SARS-CoV-2特異的T細胞が徐々に発達し、重症化したCOV-19に対する免疫防御機能が働くことである。
最近の研究で示唆されているように、呼吸器や腸管に侵入した低用量のウイルス粒子は、炎症がない状態でT細胞メモリーを誘導することができる可能性があり、その結果、さまざまな程度の免疫が得られる可能性がある。
このシナリオでは、非医薬品による介入は、短期的にはSARS-CoV-2粒子の有害な拡散を抑制し、長期的には(不均質で制御不能ではあるが)広範な免疫防御の発展を可能にするという二重の役割を果たすことになる。
キーワード
COVID-19,SARS-CoV-2,防御免疫、T細胞反応、フェイシャルマスキング、感染媒介物、環境暴露、記憶T細胞
1. はじめに
COVID-19の感染率は 2020年の夏期以降、ヨーロッパのほとんどの国で再燃し、パンデミックの第2波、第3波と密接に関連していることがわかった。過去のSARS-CoV-2ウイルスと比較して重症化することが報告されているB.1.1.7亜種の感染拡大が全体的に懸念されているにもかかわらず[1,2,3]、COVID-19関連の死亡率は、新たな感染の急増と並行して増加していない。さらに、イタリアとスペインで行われたいくつかの研究では、COVID-19の病原性が第1波に比べて第2波では低いことが観察された[4,5]。COVID-19の感染者数と死亡者数の比率が第1波と比較して相対的に減少しているのは、いくつかの要因が考えられる。重症のCOVID-19症例を管理するための臨床プロトコルが最適化されたことと、新しい治療法が利用可能になったことが、死亡率の低下に大きく寄与している。COVID-19による死亡率の低下に影響を及ぼす可能性のあるもう一つの要因は、第2次パンデミックの対象者の平均年齢が若かったことである。しかし、ドイツのデータを分析したところ、COVID-19による死亡率はすべての年齢層で減少しており、全体的な減少を牽引しているのは高年齢層であることがわかった[6]。このことは、「若い患者のパンデミック」が一概に説明できるものではないことを示している。パンデミック傾向の評価を混乱させる可能性のある要因として、第1次パンデミックと第2次/第3次パンデミックの間で検査数が数桁増加し、選択されていない集団にまで広がり、症例検出が増幅されているという事実がある。しかし、ヨーロッパの国々では、スクリーニング率の一定の増加は陽性例の傾向とは連動しておらず[7]、陽性例の数は検査効率だけに依存しているわけではないことを示している。この意見では、人口の多い環境に存在する低用量のSARS-CoV-2が、ウイルス特異的なT細胞反応を誘導し、防御免疫を進行させるのではないかという仮説を検討している。SARS-CoV-2に後から感染した人の病気の重症度を、フェイスマスクから漏れる低量のウイルスが軽減するという仮説は、以前、ユニバーサル・フェイシャル・マスキングを導入した環境で観察された無症候性感染の増加を説明するために提案された[8,9,10]。我々はこの仮説を拡張し、空気中に浮遊するウイルス粒子や無生物に付着したウイルス粒子に繰り返し接触することをT細胞免疫の潜在的な源と考え、非感染者にSARS-CoV-2免疫が存在することを示す最新の免疫学的知見に照らして、この概念を議論する。
2. 欧州各国におけるCOVID-19の感染率と死亡率の非連動傾向、特にイタリアの重症度の推移に着目して
欧州疾病予防管理センター(ECDC)の更新されたサーベイランスレポートによると、2021年には、ヨーロッパ諸国の大部分で、死亡率の比例的な増加を伴わないCOVID-19感染率が高くなってた[7]。原稿投稿時の欧州地理的エリアの国々は、COVID-19の感染者数が増加し、死亡者数が減少/一定しているグループ(ジョージア、リトアニア、ラトビア、デンマーク)と、感染率が減少し、死亡者数が減少している両方のグループ(残りの51カ国)に大別される。イタリアは2番目のグループに属しており、COVID-19の感染率は減少しているものの 2020年3月~4月の最初のアウトブレイクと比較すると、依然として3~4倍になっている[7]。2020年2月から 2021年4月までのイタリアにおけるCOVID-19の重症度分布を報告した最新の分析では、最初のパンデミックサイクルの終わり頃から、無症候性および無症状の症例の割合がきちんと増加していることが明らかになっている(図1)[11]。病気の重症度と死亡率の傾向を詳しく見てみると、COVID-19の第1波では、集中治療室(ICU)への入室者数と死亡者数に関して、明確な共通の傾向が見られた[12]。2020年10月からは、これらの指標の動態は、ICU入室者数に追従しない累積死亡者数から切り離された。以前に示された集中治療の入室数と死亡者数の関係のダイナミクス[12]と一致して、異なる重症度クラスの連動した増加は 2020年夏の初めに終了する。それ以降は、症状の少ない症例や無症状の症例が、重症の症例をきちんと上回っている。異なるエンドポイントに焦点を当てた2つの完全に独立した分析が収束したことは、研究された現象の頑健性を示すものである。図1に示した分析は、確実に確認された症例を対象としており、「死因」の定義の違いによるバイアスの可能性を排除していることは注目に値する。さらに、絶対数ではなくパーセンテージを用いることで、テスト数に起因するバイアスを排除している。無症候性の傾向は、RT-PCR検査法による偽陽性の存在による影響が無症候性の傾向よりも少ないことから、おそらく最も有益な情報となる。全体として、イタリアの現在の疫学的状況(ECDCが報告している欧州の世界的状況を反映している)は、より伝達性の高いSARS-CoV-2の亜種の拡散(感染者数の増加の原因)と、国民の間で自然免疫が徐々に発達していること(その結果、無症候性および無症候性の症例が多く見られる)を反映していると考えられる。次の章で説明するように、最初のパンデミックの際にヨーロッパのいくつかの国で実施された厳しい隔離措置により、循環するウイルスの量が減少し、その後の病気の重症度の傾向に影響を与えた可能性がある。ヨーロッパ諸国の現在の疫学的状況は、COVID-19のパンデミックが繰り返され、死亡率が並行して増加している中南米諸国(ブラジル、メキシコ、ペルー、パラグアイ)とは対照的である[7]。パンデミックのパラメータには複数の複雑な要因が影響しているが、少なくともCOVID-19の最初の波の際に効果的な公衆衛生対策を講じなかった一部の国では、その後、より深刻な病気の症状が現れた可能性があると推測される。最後に、いくつかの考察から、長期的には、SARS-CoV-2はその効力を失い、風邪コロナウイルス(CCCoV)と同様にパンデミックすると考えられる[13,14]。このプロセスは、防御免疫の持続期間、再感染のしやすさ、季節性、他の循環している呼吸器ウイルスとの競合、対策など、複数の要因に依存しており、詳細は別のところで分析されている[13]。このような観点から、環境中に存在する低用量のSARS-CoV-2粒子によって誘発される可能性のある様々な程度の免疫は、COVID-19の重症度の漸進的な低下に寄与することで、SARS-CoV-2のパンデミック状態への移行をよりソフトにするのではないかという仮説を立てることができる。
図1 2020年1月から 2021年4月までのCOVID-19患者の臨床状態を示すイタリア国立衛生研究所(Istituto Superiore di Sanità、ローマ、イタリア)の疫学データ
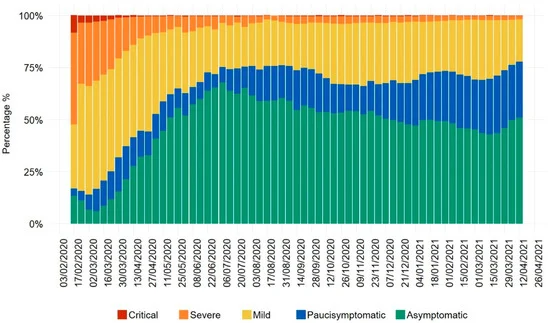
色のついた棒グラフは、それぞれ、重篤な臨床状態(上の棒グラフ、暗赤色、集中治療での入院が必要な気道および/または他の器官系に影響を及ぼす臨床症状)重症(オレンジ色の棒グラフ、集中治療ではなく入院が必要な気道および/または他の器官系に影響を及ぼす臨床症状)軽症(黄色の棒グラフ、通常は入院を必要としない気道および/または他の器官系に影響を及ぼす臨床症状)軽症(青色の棒グラフ、軽度で一般的な症状、例えば。青色の棒グラフ:全身倦怠感、発熱、倦怠感などの軽度で一般的な症状)無症候性疾患(緑色の棒グラフ:疾患の明らかな兆候や症状がない)の3種類がある。xlsx形式の生データは、Istituto Superiore di Sanitàウェブサイト(www.epicentro.iss.it/coronavirus/sars-cov-2-dashboard)で公開されている(アクセス日:2021年4月23日)。
3. SARS-CoV-2に対する防御免疫反応を誘発する低ウイルス量の役割の可能性
ウイルスへの曝露量が少ないと、病気の症状が軽くなり、その後に免疫を獲得できるという概念は、ワクチン接種法の誕生のルーツとなり、寄生虫からさまざまなウイルスまで、さまざまな実験環境で研究されてきた[15,16,17,18,19,20]。低レベルの抗原刺激によって得られるT細胞応答の質の高さを指摘した研究がいくつかあることから、ワクチン開発においても、低抗原量の使用が注目を集めている[21]。ウイルスの投与量が少ないと病気の症状が軽くなるという観察結果は、MERSやSARSのマウス適応モデル[22,23]、SARS-CoV-2感染のハムスターモデル[24]、そして最近ではSARS-CoV-2に感染したフェレットでも確認されている[25]。SARS-CoV-2の低用量チャレンジモデルは、まだ体系的に開発されていない[26]。このアプローチの大きな障害は、低用量の接種では一部の動物しか感染しない可能性があるため、統計的有意性を得るためには多数の動物が必要となることである。とはいえ、いくつかの研究では、ウイルスをネブライザーで噴霧したり、感染動物と非感染動物を同居させたりして、SARS-CoV-2の低用量チャレンジを検討している[27,28,29,30]。
興味深いことに、SARS-CoV-2感染のヒトチャレンジモデルも提案されている[31,32,33]。低用量のSARS-CoV-2が高用量のSARS-CoV-2に比べて重篤な疾患症状を引き起こさないことを裏付けるヒトでのフィールドワークとして、第一線で働く医療従事者を対象とした研究がある。この職種は、COVID-19感染のリスクが高いことが以前に示されている[34]。2884人の医療従事者を対象とした最近の研究では、個人防護具の使用が不十分であることが、COVID-19感染の可能性の増加、疾患の重症度の増加、および罹患期間の延長と関連していることが示され、SARS-CoV-2ウイルスの接種が疾患の重症度と関連しているという仮説が支持された[35]。
サージカルマスクから漏れ出た少量のウイルス粒子が、一種の「変種」プロセスとして作用し、無症状のSARS-CoV-2感染者の割合を増加させ、自然免疫をもたらすという仮説が提唱されている[9,10]。この仮説は、マスク着用時にCOVID-19の感染と病気の重症度が低下することを示したいくつかの研究によって確認されているようである[35,36,37]。ここでは、SARS-CoV-2に対する自然免疫の発達に寄与する可能性のある2つの追加要因を考慮したいと思う。第一の要因は、貨幣、公共交通機関やエレベーターの手すり、現金自動預け払い機、インターホン、ドアノブなどの集合物にウイルスが付着していることである。SARS-CoV-1 に関するこれまでの研究では、感染媒介物(無生物)にコロナウイルスが存在することが報告されている[38]。さらに、SARS-CoV-1による異常なクラスター感染を説明するために、環境表面の汚染が提案されている[39,40]。SARS-CoV-2の付着物は、病院内でも病院外でも発生することが報告されている[41,42,43]。SARS-CoV-2による環境汚染は、人口全体への感染拡大にはほとんど関係しないことが以前に提案されている[44]。
近年、SARS-CoV-2の付着物における存在と安定性に関する理解が深まったことで、米国疾病対策予防センター(CDC)は、SARS-CoV-2の付着物による感染の相対的リスクは、直接接触、飛沫感染、空気感染に比べて低いとし、このテーマに関する継続的な報告書を発表している[45]。実際、付着したウイルスの安定性を系統的に分析した結果、プラスチックやスチールに付着したSARS-CoV-2の感染力は、72時間後に大きく低下することが示されている[46]。さらに、スワブで採取したサンプルの感染力を分析したいくつかの研究では、表面に存在するウイルスはVero E6細胞に感染できないと結論づけているが、これはおそらくウイルス接種量が少なく、ウイルスの生存率が低下しているためであると考えられる[38,47]。
とはいえ、COVID-19に対する防御免疫を誘発するには、抗原接触が反復的かつ多発的であることから、低用量の環境中SARS-CoV-2が依然として重要である可能性があると推測される。呼吸によって肺に入るウイルス粒子に加えて、低用量のウイルスは腸管ルート、つまり汚染された手で頬粘膜や食品に触れることで消化器系に到達する可能性もある。実際、SARS-CoV-2は通常の洗剤では完全には不活性化されないため、手洗い(明らかに滅菌処理ではない)ではウイルス粒子を完全には除去できない[46]。この場合、少量のウイルスの取り込みは、上皮細胞がACE2を発現しており、SARS-CoV-2に効率的に感染できる腸で起こる可能性がある[48]。SARS-CoV-2の消化管での曝露は、呼吸管に比べて病原性が低いことが以前に示されており[49]、COVID-19無症候性感染症の一因であることが提案されている[32]。
低抗原刺激による防御免疫の生成に決定的な影響を与える要因は、ワクチン接種スケジュールで広く利用されている想起の原則に従って、免疫系が病原体と繰り返し接触することであると考えられる。繰り返し行われる抗原刺激には、感染性と非感染性のウイルス粒子の混合物との接触も含まれる。実際、環境表面に存在する感染性のSARS-CoV-2粒子は時間とともに減少するが、非感染性のウイルスに付着しているウイルス抗原は、依然として免疫系に警告を与えるのに有効であると考えられる。この原理を利用して、A型肝炎、狂犬病、インフルエンザ、ポリオなどのワクチンでは、不活性化された病原体の存在が利用されている。不活性化された病原体は、生きている病原体に比べて防御免疫を引き起こす効果が低いことが知られており、そのため、不活性化された病原体を用いたワクチンは、効率的な免疫を獲得するために、時間をかけて何度も接種する必要がある。
興味深いことに、微生物ワクチン(カルメット菌/BCG、経口ポリオワクチン、麻疹)は、自然免疫細胞を再プログラムすることにより、他の感染症に対する異種防御を誘導することができる、訓練された免疫と呼ばれる自然免疫反応を長期的に増強することが知られている。全微生物ワクチンによる訓練された免疫は、SARS-CoV-2の感受性と重症度を低下させることが提案されている[50,51]。BCGのワクチン接種がCOVID-19の予防に役立つかどうかを判断するために、いくつかの試験が行われており、この問題を明らかにするのに役立つであろう。
環境中に存在するSARS-CoV-2は(検出可能な量ではあるが)非常に微量であるため、特異的な免疫反応の発現にはウイルス抗原との繰り返しの接触が不可欠であると考えられる。抗原との接触の多さに加えて、低用量のウイルスによる免疫化は他の多くの要因に影響されると考えられる。これらの要因の中で最も重要なのは、宿主の免疫系の適合性であると思われる。免疫系は、個人の健康状態、年齢、免疫学的能力に応じて、抗原のチャレンジに反応する。さらに、CCCoVに過去にさらされたことが、SARS-CoV-2に対する免疫反応に影響を与える可能性がある重要な要因として浮上している。実際、いくつかの研究では、SARS-CoV-2抗原に反応するT細胞が、未曝露のドナー、つまりパンデミック前の血液サンプルのかなりの割合(20-50%)で確認されている[52,53,54,55,56]。SARS-CoV-2抗原に反応するパンデミック前のサンプルのリンパ球は、HCOV-OC43,HCOV-HKU1,HCOV-NL63,HCOV-229などの風土病のCCCoVに以前さらされた際に生成されたメモリーT細胞である可能性が高い[57]。
現時点では、このような交差反応性T細胞がCOVID-19に対する防御に実際に有効であるかどうかは議論の余地がある。いくつかの研究では、最近記録されたCCCoVs感染が重症度の低いCOVID-19と関連していることが示されており、肺に局在するメモリーT細胞とB細胞が重症度の高い疾患症状からの保護に関与していることが示唆されている[58]。
対照的に、他の研究では、過去のCCCoVs感染とCOVID-19の重症度との関連は検出されておらず[59]、また、CCCoVの体液性免疫を持つCOVID-19患者の臨床転帰が悪いことさえ報告されている[60]。
興味深いことに、健康なドナーから検出されたSARS-CoV-2に対して交差反応性を示すメモリーCD4+およびCD8+ T細胞は、試験管内試験で増殖できず、COVID-19に対する防御免疫反応の一部として機能する可能性が限られていることを示唆している[61]。既存のT細胞免疫に加えて、最近の研究では、パンデミック前の健康なドナーの約20%がSARS-CoV-2と交差反応する血清抗体を持っていることが示されたが、これらの抗体はSARS-CoV-2感染からの保護や病気の重症度とは関連していなかった[62]。
4. SARS-CoV-2の低線量への繰り返しの曝露がT細胞免疫を誘導するか?非感染者におけるSARS-CoV-2特異的T細胞反応を説明する可能性
SARS-CoV-2に対する免疫学的反応に関する最近の研究では、COVID-19患者(重症患者、軽症患者、無症状患者)の免疫シグナルが、回復期の人、COVID-19患者と密接に接触したことのある人、非感染の健康なドナーと比較して、詳細に示されている。このような研究では、SARS-CoV-2に対する免疫の発達にT細胞反応が大きな役割を果たしていることが一貫して報告されている[53,55,63,64,65,66,67,68,69]。
特に、T細胞反応は多機能(CD4+とCD8+の両方のリンパ球が関与)で、安定しており、抗SARS-CoV-2抗体が時間とともに減少しても、感染後少なくとも6カ月間は持続することが示された[63,65,69]。さらに、COVID-19の回復者では、検出可能な循環抗体がなくても、幹様記憶表現型(CCR7+CD127+CD45RA-/+TCF1+)のSARS-CoV-2特異的T細胞が同定され、SARS-CoV-2に対する長期的な免疫を維持する上での記憶T細胞の役割が強調された[67]。
スウェーデンの被験者の異なるコホートにおけるSARS-CoV-2特異的記憶T細胞反応を定量化した重要な研究では、被曝していないドナーにSARS-CoV-2に対する既存の免疫が存在することが確認されたが、この点に関するこれまでにない詳細が明らかにされた。具体的には、パンデミック前に献血した健常者の28%、パンデミック中に献血した健常者の46%、曝露した家族(発病時にCOVID-19患者と同居していた)の67%、軽度のCOVID-19の既往歴がある回復者の87%、重度のCOVID-19から回復した回復者の100%に、SARS-CoV-2のスパイクや膜タンパク質に対するT細胞反応が認められた[67]。パンデミック前の献血者の血液中にSARS-CoV-2に反応するT細胞が存在することは、CCCoVへの過去の感染によって説明できるが、パンデミック開始後に献血した被験者のSARS-CoV-2反応T細胞の割合が約2倍になったことは、環境中に存在するウイルス粒子との接触によって特異的なT細胞反応が誘発されたことを強く示唆している。
さらに、SARS-CoV-2に感染した家族(その3分の1は抗体陰性)の中でSARS-CoV-2反応性T細胞が著しく増加したことは、低用量のウイルス接種が時間をかけて繰り返し行われた結果、特異的なT細胞反応が生じたという仮説を裏付けるものである。この仮説は、COVID-19陽性者と密接に接触していた人は、感染していなくてもT細胞メモリーを獲得していたという最近の研究から、さらに支持されている[61]。近接者は核酸検査でも抗体でも陰性になることが多く、これはSARS-CoV-2が成功裏に感染を確立できなかったことを示している[61]。
同様の観察結果がMERSのパンデミック時にも報告されており、核酸検査陰性かつ抗体陰性のハイリスク者(ラクダ労働者)が、有意なレベルのMERS-CoV特異的メモリーT細胞を発現していた[70]。感染していない状態で生じたT細胞応答が、その後のSARS-CoV-2へのチャレンジから保護できるかどうかは、まだ明らかになっていない。しかし、インフルエンザ特異的T細胞に関する以前の研究では、既存のメモリーCD4+およびCD8+リンパ球が、その後の感染に対して保護することができることが示されている[71,72,73]。コロナウイルスの場合も、特異的な記憶T細胞が重症感染症に対する防御免疫を提供することが示されている[74,75,76]。したがって、自然暴露時に発達したSARS-CoV-2特異的T細胞が重症COVID-19の再発を防ぐ可能性があるという仮説を支持するものである。
以上のように、過去のCCCoVs感染に由来するSARS-CoV-2エピトープに対するT細胞と抗体の存在が、非被爆者において一貫して検出されているが、このような既存の免疫がCOVID-19からの保護に果たす役割については明らかではない。CCCoVsとの交差反応性に由来する既存の免疫は、亜感染性のウイルス量との接触によってSARS-CoV-2特異的T細胞が発達する可能性を排除しない。後者の免疫反応は、COVID-19感染者の免疫反応に比べて効率は低いが、抗CCoVs交差反応性免疫に比べて特異性が高いと考えられ、SARS-CoV-2感染の感受性と重症度を調節する役割を果たしている可能性がある。
最後に、最近、SARS-CoV-2の亜種が出現したが、既存の免疫反応が変異したウイルス粒子に対して少なくとも部分的に防御できるかどうかを検討することが重要な問題である。このテーマに関する具体的な研究はこれからだが、ウイルスタンパク質の複数の異なる領域に対して免疫反応が生じるという観察結果は、SARS-CoV-2との過去の接触が、再感染に対する集団免疫に有利に働く可能性を示唆している[14]。このシナリオでは、非医薬品的な介入とワクチンの拡大によってSARS-CoV-2の流通を制限することで、ウイルスの複製が抑制され、その結果、集団免疫が達成されるまで新しい亜種の生成が制限されることになる。
5. SARS-CoV-2の高用量と低用量に対する免疫反応の違いの可能性
低用量のSARS-CoV-2で抗原刺激を繰り返すと防御免疫が生じるという仮説の説明は、高用量と低用量のウイルスに遭遇した際に活性化される免疫メカニズムの違いによると思われる(図2)。肺胞に到達するSARS-CoV-2の量が多いと、ウイルスの複製速度が速くなる可能性が高い。大量のウイルス粒子は、気道上皮細胞の死を誘発し、その結果、損傷関連分子パターン(DAMPs)を放出する。DAMPsは、単球、好中球、T細胞を肺に呼び寄せる炎症性サイトカインやケモカインの産生を引き起こす。
SARS-CoV-2に対する免疫反応の結果を左右する重要な役割を果たしているのは、気管支肺胞の微小環境に存在する単核食細胞(MNP)である。実際、重症または軽症のCOVID-19患者から採取した気管支肺胞液の単一細胞RNA配列を調べたところ、重症の場合、MNP集団は、組織に常駐する肺胞マクロファージ(FABP4+)が減少し、炎症性単球由来のマクロファージ(FCN1+SPP1+)が豊富に存在するという特徴があった[77]。炎症性マクロファージは、SARS-CoV-2感染組織において、化学走性、炎症の伝播、免疫抑制環境の生成に関与している[78]。COVID-19が重症化すると、肺の炎症により肺胞の損傷が拡大し、急性呼吸困難症候群に陥る。また、全身性の炎症、広範な凝固障害、多臓器不全を伴うこともある。このシナリオでは、単球や好中球の活性化が阻害され、ナチュラルキラー細胞や末梢血T細胞が減少するなど、免疫系が大きく変化する[78]。
対照的に、低用量のSARS-CoV-2が肺胞に到達しても、宿主のT細胞免疫が低下していなければ、大量のウイルス複製を引き起こす可能性は低い。炎症がない状態では、少量のウイルス抗原が気道上皮細胞や肺胞マクロファージと接触して処理され、それぞれ主要組織適合性複合体(MHC)クラスIIを介してCD4+ T細胞に、またはMHCクラスIを介してCD8+ T細胞に提示される。この過程で、SARS-CoV-2に対する様々な強さの適応免疫反応が発生する可能性がある。この点、低用量のSARS-CoV-2にさらされて殺菌免疫が生じるとは考えにくいが、肺にメモリーT細胞が存在することで、COVID-19の病気の重症度を「風邪」や無症状の病気のように最小限に抑えることができる。
実際、SARS-CoV-2特異的CD4+ T細胞とCD8+ T細胞は、進行中のSARS-CoV-2感染時のCOVID-19疾患重症度の低下と関連している[65,79]。興味深いことに、SARS-CoV-2に対するCD4+T細胞の反応は、ウイルスに暴露されたが感染していない人に見られたが、ウイルスの複製がない場合にも起こると提唱されている[61]。実際、強固なCD8+応答は、通常ウイルスの複製によって生成される豊富なウイルス抗原の存在下で起こるが、CD4+応答とそれに続く免疫学的記憶は、内因性ウイルスの複製に依存せず、ほとんどが非複製ウイルス粒子や可溶性ウイルスタンパク質に由来する外因性ウイルス抗原のエンドサイトーシス/ファゴサイトーシスを伴う[61,80]。したがって、CD4+T細胞メモリーの形成は、感染していない被曝者の方が容易に達成できる可能性がある[61]。亜感染性のウイルス量に繰り返しさらされることで、T細胞の反応が強化され、効率的な長期免疫に必要なメモリーT細胞が形成される可能性がある。
最も可能性が高いのは、低用量のウイルスにさらされて防御免疫が生成されるのは、十分な免疫反応を起こすことができる個体であることである。過去に低用量のウイルスにさらされて防御免疫が得られなかったことが、高齢者や合併症を持つ人がより重篤なCOVID-19を経験する理由の一因となっている可能性がある[81]。特に、高齢者では、免疫機能が低下し、慢性疾患の有病率が高く、背景にある炎症レベルが上昇することが報告されている。これらの要因に加えて、環境中のSARS-CoV-2に自然にさらされても、効率的な免疫学的記憶が形成されないことから、高齢者のCOVID-19の症状が重くなることが考えられる[82]。
図2 SARS-CoV-2を高用量(左)または低用量(右)で曝露した際に肺の微小環境に生じる変化
大量(左)または低量(右)のSARS-CoV-2粒子が肺胞に入り、気道上皮細胞に感染する。左図では、大量に感染した気道上皮細胞が細胞死を起こし、損傷関連分子パターン(DAMPs)を放出する。DAMPsは近隣の細胞を活性化して炎症性サイトカインを産生し、活性化した単球、マクロファージ、好中球を呼び寄せる。炎症を起こした肺微小環境では、Tリンパ球は最初に活性化された後、機能的に疲弊し、炎症性単球由来マクロファージ(炎症性MAC)が肺胞マクロファージを代替する。右図では、低用量のウイルスが気道上皮細胞や肺胞マクロファージと接触している。ウイルス粒子は、肺上皮細胞と肺胞マクロファージ(肺胞MAC)によって処理され、T細胞に提示されることで、制御された免疫反応が生成される。防御免疫は、繰り返し抗原刺激を受けることで、効率的な長期免疫記憶へと進化する可能性がある。
6. 結論
この意見は、自然発生的に低用量のSARS-CoV-2にさらされることで、免疫記憶の発達が促進され、その後の重篤なCOVID-19症状から身を守ることができるのではないか、という仮説を検討したものである。この仮説は、各国のロックダウンによってウイルスの拡散が一時的に抑制されたことと密接に関連している。この効果により、より多くの低線量曝露が可能となり、非感染者の免疫力が様々に変化し、その後のウイルスとの遭遇時に、より効果的な免疫反応を起こすことができるようになったのかもしれない。
ここで強調しておきたいのは、仮にこの仮説がさらなる研究によって確認されたとしても、SARS-CoV-2への曝露が有益であることを裏付けるものではないということである。
実際、低用量のウイルス粒子にさらされて防御免疫ができるかどうかは、有効なウイルス量、宿主の免疫系の適合性、合併症や炎症状態の有無、個人の遺伝的要因(リスク関連のゲノム領域を含む)の影響など、複数の制御不可能な要因に左右される。
さらに、SARS-CoV-2の新種が脆弱な集団に広まることで、病気の重症度や死亡率が高まる可能性もある。したがって予防策の継続的な実施や、リスクのある人への迅速なワクチン接種が必要である。最後に、もしSARS-CoV-2への繰り返しの低用量曝露が実際にT細胞を介した免疫記憶を誘発することができるならば、ワクチン接種後の長期的な抗SARS-CoV-2免疫の維持に有用であろう。
実際、SARS-CoV-2抗原が(低用量ではあるが)長期にわたって持続すると、T細胞反応の継続的な引き金となり、抗原レパートリーが新たに循環するCOVID-19亜種に拡大する可能性がある。
このように、パンデミック後の免疫力の維持には、医薬品以外の介入、予防接種、感染後の免疫、そしておそらく環境中の低濃度SARS-CoV-2による保護が総合的に寄与していると考えられる。
