Contents
Relationship of Wine Consumption with Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7019227/
Marcella Reale、1、* Erica Costantini、1 Srinivas Jagarlapoodi、1 Haroon Khan、2 Tarun Belwal、3 and Angelo Cichelli1
要旨
背景。最も脅威的な神経変性疾患であるアルツハイマー病は、記憶や言語機能の喪失、空間の不均衡な知覚、その他の認知的・身体的症状を特徴としている。アルツハイマー病の病理学的特徴は、神経細胞の喪失と老人斑や神経原線維性抗原(NFT)の広範な分布である。アルツハイマー病における環境や食生活の役割についての研究が盛んに行われており、神経変性疾患の予防には栄養が重要な役割を果たしている。
このような背景から、認知症とワインの使用・乱用との関係については、研究の関心が高まっているが、結果は様々で、しばしば矛盾することがある。範囲とアプローチ。本レビューでは、ワインの飲用と認知症との関係を明らかにするために、関連する主な研究を批判的に要約し、飲酒の頻度や量がどのように影響するかを明らかにすることを目的とした。
主要な知見と結論。全体的に、様々な研究の解釈に基づいて、軽度から中等度の飲酒が認知や認知症に有害であるかどうか、あるいはアルコール摂取がアルツハイマー病発症のリスクを低下させるかどうかを明らかにする決定的な結果は得られていない。
キーワード:アルコール消費、アルツハイマー病、軽度から中等度のワイン消費、神経変性
1. はじめに
歴史の中で、ワインはしばしば健康管理の道具として使用され、症状を治療したり、最も一般的な病気を予防することで健康を促進するための薬として処方されていた。
メソポタミアでは、ワインは様々な治療法や治療法に使用され、咳の治療のための一般的な治療法として蜂蜜と混合されていた。
エジプトでは、ワインは溶剤として、弱った状態や怪我の治療薬として、あるいは前菜として使用されていた。古代ギリシャの医師ヒポクラテスは、ワインを健康的な食事の重要な栄養素と考え、鎮静剤や防腐剤としての使用を処方した[1]。
アルコールが健康に及ぼす多くの有益な効果と否定的な効果が強調されているが、ワインの成分の特性とその細胞および分子効果については論争が残っている。ワインの健康への影響は用量に依存しており、問題を引き起こす量と健康に有益な量の境界は低い。
お酒を飲むことは、特に若者の間で人気が高まっている行動である。多くの人は意識的にアルコールを摂取していて、健康に影響はないが、有害な飲酒をする人が増えている。アルコール飲料には、アルコール度数の異なる多くの種類が存在している。アルコールは合法で広く入手可能であるが、アルコール濃度の高い飲み物は、より早く、より少ない量で健康問題を引き起こす危険性がある。
ワインは、酵母によって発酵された種Vitis viniferaの果実のマストやジュースの製品が含まれている。発酵後、ワインには品質に影響を与える様々な化合物の複雑な混合物が含まれている。アルコールワインには、フェノール化合物、多糖類、酸、揮発性化合物、水が様々な濃度で含まれている。
主なポリフェノールはフラバノール、フラボノール、アントシアニン、レスベラトロールであり、フラボノイドはカテキン、エピカテキン、プロアントシアニジン、フラボン、アントシアニン[2]であり、全フェノール化合物の最大60%がカテキンとエピカテキンで占められ、核内因子κB(NF-κB)や炎症性サイトカインの阻害に関連した抗酸化活性を発揮する。
ミリセチン、カエンフェロール、ルチン、ケルセチンはフラボノールであり、ケルセチンはヘムオキシゲナーゼ、グルタチオンSトランスフェラーゼ、チオレドキシン還元酵素などの抗酸化酵素の活性を誘導してNF-κBの核内への移動を抑制し、トール様受容体(TLR2、TLR4)の発現を低下させることで抗炎症活性を発揮する[3]。
デルフィニジン-3-グルコシド、シアニジン-3-グルコシド、およびマルビジン-3-グルコシドはワインに最もよく見られるアントシアニンであり、レスベラトロールとともに抗酸化活性および抗炎症活性を有し、炎症性サイトカインを誘導または抑制することができる。腫瘍壊死因子(TNF)-α、インターロイキン(IL)-1β、IL-6 などの炎症反応を調節し、NF-κB や一酸化窒素合成酵素(iNOS)やシクロオキシゲナーゼ-1(COX-1)の誘導性アイソフォームなどの炎症性酵素を阻害する [4]。
タンニンはブドウの皮や種子に含まれており、これはワインの品質に関与するフェノール類の別のサブグループであり、ワインの色、苦味、渋み、構造に寄与する。ワインのポリフェノールは、抗酸化作用や抗炎症作用を活性化することで、前臨床試験や試験管内試験(in vitro)試験で示されているように、神経変性、癌、代謝障害、老化を予防するための有益な治療的特性を持っている。
また、ポリフェノールは病原体感染症、高血圧症、心血管疾患の治療にも重要な役割を果たしている[5、6、7、8]。
ブドウに存在する最も豊富な糖はグルコースとフルクトースであるが、ショ糖は微量にしか存在しない。エタノールと二酸化炭素は、発酵の過程で酵母による糖の分解によって生成される。芳香族化合物の揮発性は糖の濃度に関係している。
エタノール、酸、タンニンの影響を受ける甘味は、糖類全体の1%(w/v)よりも高いレベルで検出される。酒石酸、リンゴ酸、クエン酸などの有機酸は、ワイン中に最も多く存在する固体であり、味、ワインの安定性、色、pHに関与している。Sunらは、2-O-フェルロイル酒石酸をホスホジエステラーゼ4D阻害剤(パーキンソン病E4D)として同定した。パーキンソン病E4Dは中枢神経系のカルシウムチャネルの機能を変化させ、アルツハイマー病の原因の一つと考えられている[9]。
ワイン中のタンパク質の低濃度は、ポリフェノール、pH、多糖類などの非タンパク質由来の要因と関連して、ワインの透明度と安定性に影響を与えている。窒素化合物にはアンモニウムカチオンやアミノ酸、ペプチドなどがあり、タンパク質は酵母や乳酸菌の栄養素である。
ワインに含まれる最も重要なミネラル化合物は、カリウム、硫酸塩、リン酸塩、ナトリウム、鉄、塩化物である[10、11、12]。ワインの組成は図1に要約されており、どのような天然の生物学的物質でも、成分は大きく異なる場合がある。
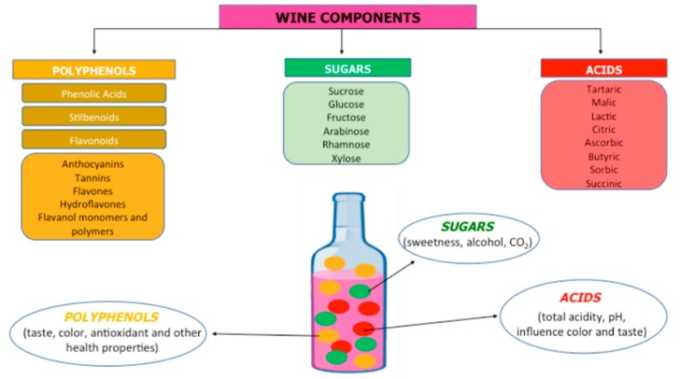
図1 ワインのいくつかのコンポーネント
ワインの消費は、地中海式食生活の一つの構成要素であり、人間の健康増進と、主に精神と心臓の健康に関連する病気の予防との関連性が高まっている。しかし、可能性のある健康上の利点は、米国の食事療法ガイドライン(2015)[13]で報告されているように、「女性は1日1杯まで、男性は1日2杯まで、合法的な飲酒年齢の成人のみ」という、適度な飲酒でのみ存在する可能性がある。
米国アルコール乱用・アルコール依存症研究所(NIAAA)は、中等度の飲酒を、1日に男性は4杯まで、女性は3杯まで、男性は1週間に14杯まで、女性は7杯までと定義している。適度なワインの飲酒は、心臓病を予防し、ブドウ糖を代謝し、心代謝リスクを低下させるオメガ3脂肪酸の血中濃度の上昇と関連している
ヘムオキシゲナーゼの血中濃度の上昇と血液凝固の防止は、脳卒中の損傷から脳を保護する可能性がある [14、15、16、17]。認知症やうつ病の発症リスクは、ワインを適度に飲むことで低下することが示唆されている[18、19]。
高齢者では、他のアルコール飲料がたまにしか飲まないのに対し、ワインは特に食事中によく飲まれるアルコール飲料である。赤ワインの健康に対するプラスの効果は、さまざまなメカニズムでフリーラジカルを攻撃する抗酸化物質の存在に基づいていることが研究で示されている。
赤ワインの抗酸化物質の可能性は、フランス人の人口では、食事による飽和脂肪の摂取量が比較的多いにもかかわらず、心血管疾患の発生率が比較的低いというフレンチパラドックスの結果によって強調されている。フランスのパラドックスは、様々な重要な分子を含む環境に基礎を置いている可能性があり、その利点は主に、ワイン中の他の成分とアルコールの共同、累積、または相乗効果に関連している可能性がある。
研究者たちは、ワインに存在する200種類以上のフェノール化合物のバイオアベイラビリティとその分子的・栄養的特性、ワインの消費に影響を与える環境、社会的・家族的要因、アルコールの健康への影響との関係を発見するために研究を進めている。
果物や野菜に含まれるポリフェノールの利点はますます受け入れられつつあるが、ワイン、特にフェノール酸とポリフェノールを豊富に含む赤ワインが、どのようにしてさらなる健康上の利点をもたらすのかは、まだ完全には解明されていない[20、21]。
アルコール摂取による障害の多くは、大量に消費されたアルコールに関連している。人口の約10%が米国で消費されるアルコールの75%を飲んでいる[22]。適度なワインの飲酒は、いくつかの健康上の利点があるかもしれないが、過度のアルコール消費は、いくつかのがん、心臓病、その他の慢性疾患、および精神衛生上の問題のリスクを増加させる。慢性的なアルコール消費は、脳の持続的な変化をもたらし、行動制御の低下と否定的な結果を回避することの難しさを駆動する。
アルコールは認知症の危険因子として検討されており、飲酒と認知症の関係が証明されている。慢性的なアルコール乱用は神経変性過程の有意な活性化をもたらし[23]、アルコール関連認知症の有病率は認知症の全症例の約10%を占めている[24]が、軽度から中等度の飲酒が健康上の有益性を有するかどうかは、まだ明らかにされていない[25]。
アルコール摂取量と認知転帰との関係は、高レベルのアルコール消費の定義の違い、乱用の期間、アルコール消費の開始年齢、性別、乱用期間と離脱期間の交互性などによって複雑になっている。
アルコール誤用とアルツハイマー病との関連が記述されており、アルコール依存はアルツハイマー病の有意かつ独立した予測因子であることから[26]、本レビューではワイン摂取量とアルツハイマー病との関連を検討することを目的とした。
2. 神経変性とアルツハイマー病
神経変性疾患は、寿命が延びていることもあり、有病率が増加している年齢依存性の疾患である[27]。神経変性疾患は、脳の特定領域の神経細胞の喪失が不可逆的かつ進行性であり、運動認知機能や行動機能の喪失に関連する疾患群である。主な神経変性疾患には、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、ハンチントン病などがあり、いくつかの病原性や臨床的特徴が加わっている。神経変性疾患の主な負担は認知症が占めており、アルツハイマー病は認知症の約60~70%を占めている。世界アルツハイマー病報告書2016によると、2015年の認知症患者数は4、680万人で、2050年には1億3、150万人まで増加すると予測されている。臨床的特徴と記憶障害の神経精神医学的評価に基づいて、アルツハイマー病の可能性が高いとしか診断できず、確実な診断は死後の脳変性の検査でのみ可能である[28]。
神経変性疾患の発症には、遺伝的および環境因子を含むいくつかの因子が影響を及ぼす。アルツハイマー病発症のリスクは、アポリポ蛋白E(APO-E)、糖尿病、加齢、喫煙習慣、社会経済的地位の低下などの因子と関連している。アルツハイマー病発症のリスクの低下は、身体的・認知的に刺激的な活動、地中海式食生活の遵守、軽度から中等度のアルコール摂取、および高レベルの教育と関連しているようである[29]。脳では、有毒タンパク質の蓄積とミトコンドリア機能の低下が、進行性のニューロン損傷の前兆となる事象である。直接的な神経炎症、金属蓄積、ミトコンドリア機能不全と関連する酸化ストレスは、神経変性において重要な役割を果たしている[30、31]。神経変性に関連する病理学的事象のカスケードは、核酸、タンパク質、脂肪、DNAやタンパク質のグリコシル化に作用するフリーラジカルの大量産生によって特徴づけられ、アポトーシスや壊死を誘導する。アルツハイマー病のβアミロイド(アミロイドβ)やパーキンソン病のαシヌクレイン[32]のように、分解やミスフォールディングの原因となる構造的および機能的変化を受けるいくつかのタンパク質は、高齢者の被験者に少量存在する可能性がある。酸化ストレスは脂質の過酸化を引き起こし、その生成物はタンパク質と反応して細胞内沈殿物を形成する;酸化ストレスはグリア細胞の活性化を誘導し、炎症性サイトカインを放出して神経変性を強化する。
アルツハイマー病は進行性の神経変性疾患であり、65歳以上の人口の5%以上が罹患している。アルツハイマー病の神経病理学は、神経原線維のもつれ、反応性ミクログリア周辺の老人斑、アミロイドβ(アミロイドβ)の沈着、および神経細胞と脳機能の進行性の損失の存在によって特徴づけられる[33]。神経細胞の死は、記憶障害、人格の変化、およびその他の症状の原因となる。脳の炎症はアルツハイマー病のもう一つの特徴であり[34]、病気の前臨床段階から末期まで存在し、活性化したミクログリアとプラークを縁取り、サイトカインを分泌する反応性アストロサイトによって示されるように、このように神経炎症反応を増加させる[35]。アルツハイマー病における炎症の中心的役割は多くの研究によって強調されており、アルツハイマー病の発症は神経細胞のコンパートメントに限定されるものではなく、中枢および末梢免疫系も関与していることが確認されている。IL-1β、IL-6、TNF-α、トランスフォーミング成長因子(TGF)-β、およびIL-18などの高レベルのプロ炎症性サイトカインが脳、脳脊髄液、末梢血で発見されており、アルツハイマー病がより広範囲の炎症状態と関連している可能性が示唆されている[36、37、38]。
1990年代後半以降、アミロイドβの蓄積と神経原線維性血管のもつれの沈着がアルツハイマー病の主な原因と考えられてきた[39、40]。最近では、酸化的損傷による活性酸素種(ROS)産生の増加[41]、ミトコンドリア機能の低下[42]、金属ホメオスタシスの変化、抗酸化防御の低下[43]など、アルツハイマー病の病因の代替的な説明が出現しており、これらはアミロイドβと高リン酸化タウタンパク質の産生と蓄積に影響を与え、ミトコンドリア機能障害とROS産生を悪化させる悪循環を引き起こしている可能性がある。アセチルコリンエステラーゼ(AChE)の発現は実質的に変化しており、その活性はアミロイドβプラーク内とその周辺では増加するが、アルツハイマー病患者のほとんどの脳領域では減少する。肥満と神経変性疾患との関係を調べる研究が多く行われており、認知症の主要な危険因子の一つとして、アディポカインの調節障害と相関するメタボリックシンドロームや腹部肥満が挙げられる[44、45]。
アルツハイマー病は明らかに複雑な多因子性症候群であり,喫煙,運動,生活習慣,食生活,教育などの因子が中心的な役割を果たしている可能性があることは一般的に一致している。
3. アルコール飲料の摂取。アルツハイマー病のリスクか保護か?
異なるメカニズムを介しているとはいえ、アルコールの無摂取と過剰摂取の両方が認知症リスクの増加と関連している[46]。Dengらは、飲酒と認知症リスクの関係を明らかにし、認知障害リスクの上昇とアルコールの大量消費が関連しており、認知症リスクの低下は軽度から中等度の飲酒と関連していることを証明した[47]。
Xuらは、軽度認知障害患者におけるアルコール摂取量と認知機能低下との間にJ字型の関係を報告し、アルコール飲料の大量摂取と完全禁酒が認知症リスクを上昇させ、軽度から中等度の飲酒が認知症リスクの低下と関連している可能性を示した[48]。多くの研究でアルコールがアルツハイマー病発症のリスク因子または保護因子になりうるかどうかが明らかにされているが、証拠は決定的なものには程遠く、禁酒、中等度または重度の飲酒と認知症リスクとの関連は不明のままである。
一般的に、アルコールのアルツハイマー病への影響を検討した文献には、アルコール消費量の測定の妥当性、期間(日、月)、消費量(連続的または可変的)、飲酒者の認知評価など、いくつかの限界がある。環境、社会経済、生活習慣の要因は、アルツハイマー病の未知の原因と一緒に、アルツハイマー病におけるワイン摂取の役割の不確実性に寄与する可能性がある。累積的な証拠から、思春期の間欠的なエタノール摂取は、エタノール誘発性神経細胞死と認知障害の両方に対する脳の弱さを増強することが明らかになっている。ヒトのアルコール脳を対象とした研究では、生涯のアルコール摂取の割合や量と、脳全体の損傷や神経細胞数の減少との間に相関関係があることが明らかになった。ほとんどの研究では、ワイン、ビール、蒸留酒の区別はなく、区別した研究では、これらの異なる種類のアルコールの影響に違いはないと報告されていた。このように、アルコール摂取とアルツハイマー病の発症との複雑な関係を明らかにし、アルコール摂取に伴うリスクやベネフィット、特にワインの食事や摂取が、他の危険因子に関係なく、認知機能の低下を遅らせ、アルツハイマー病から保護するのに役立つかどうか、そしてどのように役立つのかを明らかにするには、さらなる詳細な研究が必要となるであろう。
3.1. 適度なアルコール摂取
ワインの適度な摂取が臓器やシステムにポジティブな影響を与えるという証拠が存在する。げっ歯類モデル、心筋細胞、内皮細胞を用いたいくつかの研究の結果、適度なアルコール摂取は、アデノシン受容体、プロテインキナーゼC(PKC)、一酸化窒素合成酵素が関与する抗炎症プロセスをサポートし、心臓保護を促進する可能性があることが示された。
Collisらは、脳内のアルコール関連の抗炎症性ヒートショックプロテインとプロテインキナーゼの修飾は、心臓で観察されるものと類似していることを報告している[49]。これらの観察は、アルコール摂取と認知症との関連性に関する研究を奨励している。心血管リスクと適度なアルコール摂取量との間には逆相関があることが強調されているが、これは消費量が多いと無効になる。
「アルコール摂取はアルツハイマー病に対する保護因子か?」という質問に答えるために、いくつかの全身的なレビューが行われた。まとめてみると、文献は決定的な答えを出すのに十分な証拠を提供していない。
ある研究では軽度から中等度/定期的な飲酒がアルツハイマー病に対する保護効果があると報告されているが[47]、他の研究では中等度から高レベルの飲酒の保護効果が報告されているが、年齢や性別、民族、アルコールの測定値、臨床評価、標準化された認知評価の使用など多くの変数があり、十分な結論を導き出すことができない[50、51、52、53、54、55]。
Zuccalàらは、認知機能障害が高または中等度のアルコール消費量と性と比例して関連していることを示した[56]。ある縦断的研究では、アルコール摂取量と認知症との関連を調べ、中年の非飲酒者は中等度の飲酒者に比べて認知症発症のリスクが高く、特にワインを飲む人に顕著な影響があることが示された。
コホート研究では、赤ワインに含まれるレスベラトロールの存在により、軽度または中等度のアルコール摂取がアルツハイマー病のリスクを減少させるか、または有意に変化しない可能性があることが示されている[57、58]。
週1~14単位(1単位=10mLまたは8gの純アルコール)のアルコール摂取が認知症のリスクを増加させるという証拠は存在しないが、週14単位以上のアルコール摂取は年齢とともに認知症のリスクを直線的に増加させる。
このように、飲酒量が増えると認知症のリスクは徐々に増加する。男性と女性ではアルコール摂取量が質的にも量的にも異なるにもかかわらず、認知へのアルコールの影響には性差は認められなかった[59]。
ロッテルダム研究では、55歳以上の人では、軽度から中等度の飲酒(1日1~3杯)は認知症リスクの低下と相関があり、この結果はどの種類の飲料にも特に限定されないことが報告されている[60]。ヨーロッパの他の研究では、適度なアルコール摂取は認知症リスクの低下と相関があることが報告されている[61、62]。
いくつかの研究では、飲酒者と非飲酒者が比較されており、その結果、軽度から中程度の量のワインを飲む人は禁酒者よりもアルツハイマー病の生涯リスクが低く、非飲酒者と禁酒者の両方でアルツハイマー病のリスクが低下することが示されている[63]。
飲酒の量やタイミングは男女で異なるが、中等度の飲酒が認知に及ぼす影響は男女ともに認められた。全体的に、若い被験者では、軽度から中等度の飲酒で認知が損なわれることはないようであるのに対し、高齢の被験者では、軽度から中等度の飲酒は認知症や認知機能低下のリスクを低下させるようである。
65歳以上のコホートを対象とした研究では、軽度または中等度の飲酒は認知症やアルツハイマー病のリスクを低下させるが、ビールや酒類の飲酒は認知症のリスクとは関連していないことが示された。
解析はアポリポ蛋白E(APOE)-4の有無に応じて層別化し、軽度から中等度のワイン摂取とアルツハイマー病のリスク低下との関連は、APOE-4対立遺伝子を持たない被験者に限定されることが示された。
したがって、中等度の飲酒による認知リスク効果の低下は、APOE-4対立遺伝子の存在によって無効化された [58]。APOE-4対立遺伝子を持たないフィンランド人の乱飲者を対象とした研究では、認知症のリスクが有意に減少したが、APOE-4対立遺伝子を持つ乱飲者では認知症のリスクが有意に増加したと報告されている[64]。
アルコールとAPOE-4のアルツハイマー病発症年齢への影響を分析するために実施された研究では、飲酒者におけるAPOE-4対立遺伝子の欠如はアルツハイマー病発症の早期化と関連していることが明らかになった[65]。飲酒量が中等度の女性では、APOE-4とは無関係に認知機能低下のリスクが有意に減少していた [66]。
APOE-4対立遺伝子が認知リスクに対する適度なエタノール摂取の保護効果に影響を与えるかどうかという疑問はまだ解決されていない[58]。アストログリア細胞によって形成されるグリンパ系 [67] が中枢神経系で発見されたが、これは可溶性タンパク質や代謝物を除去し、アミロイドβ18やTau23などの神経毒性を持つ可能性のあるタンパク質のクリアランスに重要な役割を果たしている可能性がある。
エタノールへの急性および慢性暴露がグリンパティック系機能に及ぼす影響を調べた。急性および慢性の過剰なアルコール摂取に起因するグリンパティック系機能の低下、そして驚くべきことに、低急性用量または低慢性用量のアルコールで処理されたマウスでは、グリンパティック系活性の増加が観察された[68]。このように、グリンパティック系機能の増加とグリア線維性酸性タンパク質発現の低下が組み合わさって、低量のアルコールを習慣的に摂取している人の認知症リスクの低下に重要な役割を果たしている可能性がある。
いずれの研究も、軽度から中等度のワインの飲酒が、地中海式食生活や身体活動などの健康的なライフスタイルや習慣と関連している場合には、プラスの効果がさらに顕著になることを確認している。
動物モデルでは、アミロイド-βおよびα-シヌクレインによって誘導されるシナプス損傷は、低濃度のアルコールによって打ち消される可能性があることが示されており[69]、抗酸化特性に起因するポリフェノールは、神経保護を提供する可能性がある。
3.2. ワインの大量消費
慢性的なアルコール摂取は、心臓や肝臓の問題以外にも、認知障害や脳障害と関連している。過度の飲酒による認知症の特徴に関心が高まっており、神経病理学的研究と画像研究の両方で、アルコールの過剰で長期的な使用が脳の構造的・機能的損傷に関与している可能性が示唆されている[70、71、72]。慢性的または過度のアルコール摂取は、アルツハイマー病で観察されたものと同様の側頭葉の損傷を引き起こす可能性がある [73]。前頭前野、大脳皮質、小脳の白質の喪失、視床下部と小脳の神経細胞の喪失が観察された[74]。
コリン作動性機能障害と神経炎症は認知症の特徴的な特徴であり、アセチルコリン(ACh)受容体アゴニストまたはAChE阻害薬がアルツハイマー病患者の認知機能を改善し、炎症性サイトカインのレベルを低下させることが確認されている。
エタノール摂取は、コリンアセチルトランスフェラーゼ(ChAT)の発現を低下させ、ChAT+ニューロンの損失を誘導し、炎症性サイトカインおよびその受容体などの神経免疫シグナル伝達をアップレギュレートし、神経免疫シグナル伝達の増加と関連してNF-κB p65(pNF-κB p65)のリン酸化を増加させる[75]。
慢性的なアルコール使用は、ニューロンのコリン作動性経路の薬理学的操作の肯定的な効果によって確認されているように、コリン作動性ニューロンの変性と関連している[76]。アルコールは海馬におけるアセチルコリンの合成と放出を調節することで認知に影響を与え、ムスカリン受容体とベンゾジアゼピン受容体の喪失を誘発してアルツハイマー病の認知障害に寄与する可能性がある[77、78]。このように、アルコール摂取がアルツハイマー病と関連している可能性のあるメカニズムの1つは、コリン作動系に対するアルコールの影響である。
アルツハイマー病では、ほとんどのリスク遺伝子座はミクログリアで優勢に発現している遺伝子に位置しているか、またはその近くにあり、ミクログリアがアルツハイマー病の進行に決定的な役割を果たしているという仮説を確認した。ミクログリアの活性化はヒトアルコール依存症患者の脳で検出されたが、ミクログリアの活性化がアルコール誘発性神経変性の原因または結果であるかどうかの議論はまだ開かれたままである [79]。
Toll様受容体(TLR)、高可動性グループボックス1(HMGB1)、マイクロRNA、およびプロ炎症性サイトカインおよびそれらの受容体は、アルコールに反応して脳の自然免疫細胞であるミクログリアとニューロン間のシグナル伝達に関与している。エタノールは高濃度では、アストロサイトおよびミクログリアにおけるTLR4シグナル伝達を活性化する可能性があり[80、81]、炎症性メディエーターの産生を誘発することで神経細胞死を誘導する。
エタノールはミクログリア細胞を活性化し、その形態、貪食反応、TNF-αやIL-1βなどの炎症性サイトカインや一酸化窒素(NO)などの炎症性メディエーターの産生を変化させ、神経変性を引き起こす可能性がある。エタノールは、関連する濃度で、ミクログリアの活性化とサイトカインおよび炎症性メディエーターの分泌を誘導するという研究が報告されている[81]。
エタノールを慢性的に投与すると、サイトカインや炎症性メディエーターの産生が増加し、神経細胞死を誘導することが報告されている[82]。活性化したミクログリアが産生する高レベルの炎症性メディエーターは神経細胞にとって有害であるという観察結果と一致している。エタノールは、グリア細胞における COX-2 および iNOS 発現 NO 産生のアップレギュレーションを誘導し [80、86]、サイトカインや炎症性メディエーターの産生および発現を促進するシグナル伝達経路を誘発し、脳内での細胞死を誘発する [82]。
数多くの研究結果から、神経免疫シグナル伝達がアルコール関連脳障害の発症に重要な役割を果たしていることが示唆されている。慢性エタノールは、神経免疫遺伝子に対する全身および脳の応答の両方を感作し、その結果、視床下部-下垂体-副腎(HPA)介在性の末梢性サイトカインの増強をもたらし、神経免疫応答をさらに悪化させ、神経変性を増加させる [87、88、89、90]。
神経免疫シグナル伝達に加えて、グルタミン酸興奮毒性もアルコール性神経変性と関連している。慢性的なアルコール暴露後に成人脳で観察された神経細胞の変性は、アルコールの慢性的な摂取が神経細胞の損失を伴うグルタミン酸の興奮毒性と酸化ストレスを引き起こすという神経毒性仮説を生み出した[91]。慢性アルコール中毒の成人モデルにおける神経破壊の根本的な原因が興奮毒性であるとするならば、さらなる研究が必要である[92]。
アルコールの影響は年齢にも関係している;20歳前にアルコール摂取を開始した被験者は、20歳以降に飲酒を開始した被験者よりも、複数の記憶課題においてより深刻な障害を示した [93]。思春期の大量飲酒は、前頭前野および海馬領域の損傷と関連しており、神経認知機能障害および視覚空間機能、言語機能、注意機能にも関連している [94、95]。
Pascualらは、思春期にエタノールを断続的に摂取すると、大脳新皮質、海馬、小脳の炎症と細胞死、認知機能障害が誘発されることを示しており、エタノール誘発脳障害における炎症の役割を支持している[96]。全体として、アルコールは神経炎症を介してアルツハイマー病病理の発生と持続をサポートしている可能性がある。
動物を対象とした研究では、アルコールの長期摂取が海馬、視床下部、小脳などの脳の異なる領域で変化を誘発し、注意、学習、記憶において重要な役割を果たしているコリン作動性神経伝達の障害を伴うことが実証された[97]。慢性的なアルコール摂取が前脳基底部コリン作動性核と脳幹コリン作動性核の両方に及ぼす影響が研究されている。
その結果、アセチルコリン生合成に関与するコリンアセチルトランスフェラーゼ(ChAT)の発現低下が認められた[98、99]。いくつかの研究では、ChATの減少がアルツハイマー病や他の神経変性疾患患者の記憶や認知障害と相関していることが示されている[100、101]。TLR4応答の重要な役割は、エタノール投与後のTLR4+/+マウスの大脳皮質におけるミクログリアの活性化(CD11b+細胞)と、エタノールによって誘発される神経炎症性障害の観察から確認されているが、TLR4欠損マウスでは確認されなかった。
Fernandez-Lizarbeら[81]は、エタノール処理したミクログリアの条件付き培地が培養ニューロンのアポトーシスを誘導することを実証した。ラットでは、脳回路におけるアルコール摂取に関連した変化がTLRを介した神経免疫シグナル伝達と関連していることを示唆する証拠が増えている[102]。Qinらは、エタノールの1日10回の投与と急性投与の両方で、マウスの脳内で炎症性サイトカインと微小グリアの活性化が持続的に増加することを示している[103]。
4. ワインの成分がアルツハイマー病分子標的に及ぼす影響
ほとんどの研究では、アルツハイマー病のリスクとワインの摂取量との間に有意ではない関連性が報告されているが、これは必ずしもアルコールが影響を与えないということではない。ワインの摂取がアルツハイマー病発症のリスクに影響を与えるメカニズムは完全には解明されていない。
ワインの健康への影響がエタノールに起因するものなのか、ワインの微量成分に起因するものなのか、あるいはそれらの相乗効果に起因するものなのかはまだわかっていない。ワインの微量成分と他の微量成分の作用を区別することは困難である。アルコールフリーのワインを使用していても、エタノールがないとワインの化合物のバイオアベイラビリティーが変化するため、この問題は混乱する。
アルコールの有益な効果は、主にポリフェノールに起因する可能性がある。アルツハイマー病に対するポリフェノールの有用な結果は、主に、レスベラトロール、エピガロカテキン-3-ガレート、およびケルセチン[104、105、106]のような特定のポリフェノールの強化食の効果を考慮して、アルツハイマー病のための動物モデルを用いた調査で報告されているか、またはポリフェノールの混合物、すなわちブドウ種子抽出物と赤ワイン[107、108、109、110]のようなものである。これらは血液脳関門を通過する能力を持っているので、ブドウ製品に存在するものを含む食事ポリフェノールは、神経毒誘発性病変からニューロンを保護するために、脳内の酸化ストレスや炎症反応のシグナルカスケードを弱めるために、誤って折り畳まれたタンパク質やポリペプチドと相互作用し、毒性凝集体の形成を防止し、認知と記憶力を向上させる(図2)[111]を持っているので、アルツハイマー病と戦うために有望な神経調節剤と考えられている。
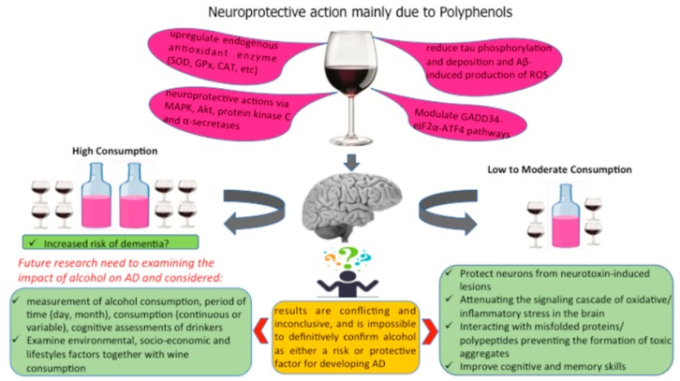
図2 脳を保護する可能性のあるワインの様々な成分
いくつかの研究では、赤ワインの摂取による健康効果はレスベラトロールによるものであることが示されており、レスベラトロールの量は赤ワインに含まれている量によって大きく異なる。レスベラトロールの神経保護効果は、エタノールやその他の酸化剤によって誘導されるニューロン細胞死に対して示唆されている[112]が、焦点性脳虚血における強力な神経保護活性[113]や抗酸化作用、イオンチャネル調節(Ca2þチャネル)に対しても示唆されている。
Antonioらは、レスベラトロールがエタノール誘発性神経毒性から保護することを報告している[114]。レスベラトロールは、アミロイドカスケードの多くの分子機構を標的とした、アミロイドβフィブリル形成の阻害[115、116]、ジシンテグリン、メタロプロテアーゼドメイン含有タンパク質10のサーチュイン依存性活性化によるアミロイドβ産生の減少[117]、オートファジーおよびリソソゾームによるアミロイドβ分解[118]など、アルツハイマー病の発症にいくつかの効果を有する。
レスベラトロールは、抗酸化剤および抗炎症剤として作用するアミロイドカスケードを中断させ、タウのリン酸化と沈着、およびアミロイドβに誘発される活性酸素種(ROS)の産生を減少させる可能性がある[119]。フリーラジカル消去能力[120]以外にも、レスベラトロールは、スーパーオキシドジスムターゼ(SOD)、グルタチオンペルオキシダーゼ(GPx)、カタラーゼ(CAT)、ヘムオキシゲナーゼなどの内因性抗酸化酵素をアップレギュレートし、キサンチンオキシダーゼなどの活性酸素の産生に関与する酵素をダウンレギュレートする能力を示している[121]。
レスベラトロールは、ミトコンドリアの活性酸素の産生を抑制し、ヒドロキシル、スーパーオキサイド、金属誘導ラジカルを効果的に除去することができ、その結果、Sirtuin1-Peroxisome proliferator-activated receptor gamma、 coactivator 1 α (SIRT1-PGC-1α)経路の活性化によるミトコンドリアの活性とバイオジェネシスを強化し、ミトコンドリアのバイオエネルギー生産性を強化する[122、123、124]。
レスベラトロールによって活性化されたサーチュイン-1(SIRT1)は、タウのアセチル酸への直接的な脱アセチル化を誘導し、そのプロテアソーム分解を助ける [125]。ホスホ-タウの毒性(サイクリン依存性キナーゼ5-p25依存性タウのリン酸化によって誘導される)が減少する可能性がある;したがって、(PGC-1α、およびp53の脱アセチル化が促進される。
レスベラトロールは、IL-8および顆粒球-マクロファージコロニー刺激因子放出、サイトカイン刺激性のiNOS発現、末梢血単核細胞によるサイトカイン産生CD4+およびCD8+ T細胞の発現を阻害することにより、試験管内試験(in vitro)および生体内試験(in vivo)での神経炎症状態を低下させる能力を示した[126、127]。
レスベラトロールは、ミトコンドリアATP合成酵素および複合体III、脂肪酸合成酵素、プロテインキナーゼC、プロテインキナーゼC、マイトジェン1によって活性化されるプロテインキナーゼであるp53、TNF-α、およびNF-κBなど、肥満の病因に関与するいくつかのタンパク質および経路と相互作用する。
Milneらは、様々なレスベラトロールアナログが、エネルギー恒常性を改善することにより、インスリン抵抗性を低下させることができることを報告している[130]。
糖尿病マウスにおいて、レスベラトロールによるAMPキナーゼの活性化は、アテローム性動脈硬化および肝障害から保護することが示されており、De La Lastraら[131]の観察と一致している。Aruomaら[132]は、低分子プロアントシアニジンの食物バイオファクターであるオリゴノールが、酸化ストレスや追加因子を調節することで神経保護効果を発揮することを報告している[133]。
学習と記憶障害を特徴とするアルツハイマー病の3xTg-アルツハイマー病マウスモデルを用いて、ワインのポリフェノール化合物を低用量で投与すると、非Tgマウスで得られた結果から示唆されるように、健康なコントロールに望ましくない副作用なしに病気の進行を遅らせることができた。
ポリフェノール濃縮栄養が複数の疾患修飾メカニズムを調節することにより、アルツハイマー病患者に利益をもたらす可能性があるという観察から、ポリフェノール化合物の開発は、アルツハイマー病の治療および/または予防のための代替戦略を提供する可能性がある[134]。
ケルセチンはワインに含まれ、その色と味に影響を与える。この機能に加えて、ケルセチンはフラボノールの代表的な分子であり、低密度リポ蛋白質の減少による動脈硬化リスクの低減、IL-1β、C反応性蛋白質、単球化学戦術蛋白質-1レベルの低減など、人間の健康に多くの有益な効果を有する。ケルセチンは強力な抗酸化物質の一つとして同定されており、活性酸素を効果的に除去することでアルツハイマー病の恩恵を受けることができる。
ケルセチンは、アストロサイトおよびニューロンにおけるグルタチオン(GSH)レベルを増加させることにより酸化ストレスの減少を誘導し、これはおそらくアミロイドβおよびτレベルの減少に関与している。無細胞、細胞ベース、in silico研究では、ケルセチンはアミロイドβ合成を抑制する能力を示した[135]。
ケルセチンは試験管内試験(in vitro)および生体内試験(in vivo)でアミロイドβ毒性を抑制することができるが、詳細なメカニズムはまだ解明されていない。ケルセチンはアミロイドβ合成以外にも、アミロイドβフィブリルの形成と伸長の阻害を誘導するとともに、あらかじめ形成されたアミロイドβフィブリルを刺激して不安定化させる[136、137]。
アミロイドβオリゴマー化に必要であることが証明されているアミロイドβ40とアミロイドβ42の初期のタンパク質-タンパク質相互作用は、ケルセチン-3-O-グルクロニドの干渉を受けて起こる[138]。ケルセチンは、有毒分子に対する神経保護効果を発揮し[139]、細胞死のメカニズムを調節し、酸化ストレスや興奮毒性に対する神経細胞の抵抗力を高め[140]、iNOSを阻害し、COX-2の発現を調節し、抗炎症活性を発揮する[141]。
研究では、cAMP応答エレメント結合タンパク質(CREB)、c-Jun N末端キナーゼ、マイトジェン活性化タンパク質、マクロオートファジー、カルシウムホメオスタシス、プロテアソーム分解、Gアルツハイマー病D34-eIF2α-ATF4経路など、アルツハイマー病発症に関与するいくつかのシグナル伝達経路が、ケルセチンとその代謝物によって調節される可能性があることが報告されている[139、142]。
ケルセチンはまた、アルツハイマー病 表現型を改善するサーチュイン-1(SIRT-1)アゴニストおよび AChE 阻害剤としての役割を果たしている[143]。ケルセチンは、抗酸化物質として作用することで、アルツハイマー病や酸化ストレス関連の神経変性疾患において保護効果をもたらす可能性がある。
文献は、エピガロカテキン-3-ガレート(EGCG)が様々な神経変性疾患のリスクを低下させる可能性があることを示している。
EGCGは、マイトジェン活性化プロテインキナーゼ(MAPK)、Akt、プロテインキナーゼC、αセクレターゼを調節することにより神経保護活性を発揮し[144]、非アミロイド性αセクレターゼおよびβセクレターゼ経路に作用してアミロイド前駆体タンパク質(APP)の処理に影響を与えることが知られている[145]。
アミロイドβ誘導細胞毒性は、Aktシグナル伝達経路の活性化 [146] またはアセチルコリンエステラーゼ阻害剤として作用するEGCGの存在下でアセチルコリンのレベルを増加させることで克服できる。
アミロイドβにより誘発された神経細胞のアポトーシスに対する神経保護は、活性酸素を効果的に除去することで達成された。また、EGCCは既存のオリゴマーをアンフォールドされたモノマー状態にリモデリングする能力を持っているため、τ誘導性神経毒性から神経細胞を救出することが可能である[147、148]。
EGCGの食事摂取は、生物学的活性によるものであり、主に抗酸化特性によるものであるため、アルツハイマー病におけるその潜在的な有益な効果について広く研究されてきた。カテキン型モノマーとプロアントシアニジンオリゴマーからなるオリゴノールは、抗酸化活性および抗炎症活性を有するブドウ種子またはライチ果実由来のポリフェノール化合物である。
オリゴノールの抗酸化作用は、SIRT1の活性化に直接または間接的に関連していることが研究で示唆されている。オリゴノールは、iNOS、COX-2、NF-κBp65、酸化ストレスに関連するmRNA発現をダウンレギュレートする可能性がある。酸化ストレスや炎症過程は主に多くの神経変性疾患と関連していることから、オリゴノールは酸化ストレス誘発性炎症に対する活性を介して神経変性を保護する効果があると考えられている[148]。
5. 結論
アルツハイマー病は高齢者の間では一般的な疾患であり、全死亡原因の第6位、障害の最も一般的な原因の一つであり、認知症の約60~80%はこの疾患が原因となっている。アルツハイマー病の発症を遅らせたり、予防したりする方法の一つとして、アルツハイマー病の修正可能な危険因子に働きかけることが考えられるが、その中でも特に食事が重要な役割を果たしている。
ワインの消費率は常に増加しているため、ワインが認知機能障害の修正可能な危険因子であるかどうかを評価するために多くの研究が行われてきたが、その結果は相反するものであった。過度のワイン消費は脳に悪影響を及ぼすことから、直接的な神経毒作用によって認知症のリスクを高めるが、軽度から中程度のワイン消費では、年齢に依存して認知症や認知機能の低下のリスクを低下させると考えられている。最近では、ワインの消費が認知機能の低下を防ぐ要因となる可能性があるとする文献も出てきており、ワインの健康特性とポリフェノールの含有量およびその抗酸化特性との関連性が指摘されている。ワインの消費量の増加は、高血圧や糖尿病などの認知症の発症を促進する要因と関連している。このように、アルツハイマー病の保護、減衰、または激化は、ワインの消費量や頻度、個人の特性、個人のライフスタイルに依存している可能性がある。このように、ワイン消費がアルツハイマー病に及ぼす影響を明らかにし、包括的に理解するためには、さらなる研究が必要とされている。
