Contents
「おい、アルツハイマーは病気じゃないぞ、これは脳細胞の萎縮プログラムだ!」
ブレデセン博士の研究所にて
概要
日本で近年認知され始めている、カリフォルニア大学(UCLA)ブレデセン博士が開発したリコード法/RECODE-PROTOCOLという認知症の改善回復を目指した治療プログラムがあります。
現在リコード法という呼び名で知られつつありますが、ここではブレデセン博士に敬意を評してブレデセンプロトコルとして紹介したいと思います。

luskinconferencecenter.ucla.edu/your-guide-to-visiting-the-ucla-campus/
UCLA = カリフォルニア大学ロサンゼルス校
1919年に設立された、ハーバードやスタンフォードと並ぶアメリカの名門大学、13人のノーベル賞受賞者を輩出、UCLA医学部門は(THE)世界大学ランキング 第12位(東京大学は39位)
ブレデセンプロトコルは、世界で初めてアルツハイマー病症状を逆転させた症例報告です。
(2017年1月 PubMed)
オリジナル論文
www.ncbi.nlm.nih.gov/pmc/articles/PMC4221920/(英語)
日本語訳

CNNの記事
www.cnn.co.jp/fringe/35057633.html(日本語)
認知機能低下の逆転 新しい治療プログラム(2014)
www.ncbi.nlm.nih.gov/pubmed/25324467
日本語訳

ブレデセン博士の経歴
神経変性疾患の基礎研究者
ブレデセン博士は、1993年にプログラム細胞死に関わる「依存性受容体」を発見した神経変性疾患の専門家として、国際的に認められている研究者です。
ブレデセン博士が所属する研究所では二人のノーベル賞受賞者を輩出しています。そのうちの一人プリオンの発見でノーベル賞を受賞したスタンリー・B・プルシナー博士はブレデセン博士の直接の指導者でもあり、ブレデセン博士もプリオンとアルツハイマー病の関連性についての研究に携わっています。
現在は、ブレデセンプロトコルの有効性が知られるようになり、現在海外で急速に広がりを見せているため、併用療法を利用したアルツハイマー研究の分野の科学者としても認知されてきています。
ブレデセンプロトコルの理論的背景
リコード法 アルツハイマー病には36の穴があるまでスキップして読んでください。
アミロイド仮説のパラドックス
私たちにできることはただ、最善の理論に偽がないかどうかを探ることである。
カール・ポパー
アミロイド仮説
もっとも有力とされている?古典的モデルのひとつであるアミロイド仮説では、
「アミロイドβはそれ自体が強い毒性をもっており、アミロイドβやその凝集物の化学的または物理的な特性による毒性作用によって神経細胞に障害を与え、神経原線維変化を引き起こし、それらの連鎖反応によってアルツハイマー病が生じる」
と考えられており、もちろんそのように考えられてきた理由、間接的証拠も存在します。
若年性アルツハイマー病とリスク遺伝子
ダウン症候群の全員が発症するわけではない
例えば、ダウン症候群の患者さんでも遺伝子の問題から過剰なアミロイドβが発現しており、多くの患者さんが40歳までにアルツハイマー病の神経病理学的な症状を発症します。
しかし、まずダウン症候群の患者さんも、全員がアルツハイマー病症状を発症するわけではなく、そのことへの過小評価がなされているという研究者の指摘があります。
プレセニリン遺伝子変異には独自の役割がある
また、家族性アルツハイマー病患者の発症原因遺伝子として知られるプレセニリン1,2の遺伝子異常は、アミロイドβ42と43の産生の増加をもたらすことがわかっています。
またプレセニリン遺伝子に関しても、アミロイドβの増加をもたらすAPP切断とは異なる、重要な生理学的役割があることが研究でわかってきています。
アミロイド仮説のプレセニリン遺伝子変異はアミロイドβ蓄積ではなく、プレセニリン機能の喪失による大脳皮質の炎症反応と関連している可能性が指摘されています。[R]
老年性アルツハイマー病とリスク遺伝子
また、老年性のアルツハイマー病患者さんと関連付けられているリスク遺伝子にも、アミロイド仮説と直接関連付けるには微妙なものが多く存在します。
自然免疫と関わるApoE遺伝子
ApoE遺伝子はアルツハイマー病の発症に寄与する、もっとも強力な遺伝子のひとつとして知られています。
ApoE4はアミロイドの排出経路に関与することでアミロイドβの蓄積と凝集を引き起こすと考えられていますが、ApoEは本来、自然免疫と深く関連しており、炎症などアミロイドβとは直接関連しない経路への影響によっても、アルツハイマー病の発症に働きかけます。
アミロイドβと直接関係しない多数のADリスク遺伝子候補
その他近年、アルツハイマー病の発症リスク因子候補として浮かび上がってきた、HLA-DRB5 / DRB1、INPP5D、MEF2C、CR1、TREM2、MEF2C、PTK2B、CELF1、NME8、CASS4、INPP5D など、
これらはみな免疫応答や炎症反応を誘導する、軸索輸送障害を引き起こす、ミクログリアの細胞機能に関わる等々といったもので、直接アミロイドβを増産させるものではありません。
www.ncbi.nlm.nih.gov/pubmed/15734686/
www.ncbi.nlm.nih.gov/pubmed/22216330/
onlinelibrary.wiley.com/doi/full/10.1111/joim.12191
アミロイドβを蓄積しても発症しない
一部の人々(アルツハイマー病マウスも含め)では大量のアミロイドβペプチドを脳内に凝集しているが、アルツハイマー病症状を示さないということも研究者の間では知られていると思います。
認知症ではない健康な高齢者の脳であっても、老人斑の分布は認知症患者と同じくらい広範囲におよぶことがあります。[R][R]
80~85歳の認知症症状を示していない高齢者の40%(厳格に適用すると20%)は、実質的にアルツハイマー病患者と同じ神経病理をもっています。[R]
奇妙な脳障害部位の進行
さらに、アルツハイマー病の進行がアミロイドβの連鎖障害だとすると、なぜアミロイドβが脳部位を均一にダメージを与えずに、進行に伴って順序立てて障害を引き起こすのかといったことについての明快な説明がつきません。
アミロイドβの生理学的な機能は不明なまま
ブレデセン博士も述べていますが、アミロイドβが元々もっている生理学的な機能が一体なんなのか、加齢に伴いアルツハイマー病リスクが上昇するのはなぜなのか、ということもアミロイド仮説では明らかになっていません。
アミロイドβ抗体による重篤な副作用
ご存知の方も多いかと思いますが、アミロイドβを脳内から除去する抗体製薬は、一部の被験者で重大な副作用をもたらし、効果があった被験者に対しての改善効果もきわめて限定的なものです。そして、その理由も明らかになっていません。
他にもここでは書ききれないほどの多くの理由が存在しますが、よかったら以下の記事を参照してください。
アルツハイマー病・アミロイドβとは何なのか
前進をもたらすのは大胆な考察のみであり、事実の蓄積ではない。
アルバート・アインシュタイン
ブレデセン博士は、最初にアルツハイマー病とはそもそも何なのか、自然現象として、人類の進化の中でアルツハイマー病(アミロイドβ、ApoE遺伝子)が一体どういう意味をもつのか、そのことを突き止めようとしました。
アミロイドβの与えられた役割
まず結論から「アミロイドβ・ApoE4遺伝子の役割は何なのか?」ということを述べてしまうと、
「脳を外敵から守る生物学的な保護目的として存在する」
「アルツハイマー病は脳の防御反応の一種である」
ということです。
これらの断片的な仮説はすでに多く研究者から提唱されていました。ブレデセン博士らは基礎研究者としてより具体的にメカニズムを見出し、さらに膨大なアルツハイマー病関連研究を検討し総括したうえで、アルツハイマー病の治療プログラムにまで発展させたといえるかと思います。
少し長くなりますが、そのことを追って説明していきます。
プログラム細胞死
ヒトを含めたあらゆる多細胞生物は、必要に応じて細胞が自ら死ぬ仕組み(プログラム細胞死)をもっています。
ブレデセン博士らは、シャーレの中でアルツハイマー病の神経細胞がどのように死んでいくかを観察したところ、アルツハイマー病を含めた神経変性疾患が、プログラム細胞死が発動したのと同じ生化学的なステップを得て自殺する様子を見出しました。
アルツハイマー病の脳細胞は、何か毒性などによって外敵から物理的に殺されるのではなく(毒を加えた場合、神経細胞は抵抗を見せた)、なぜだか細胞自らが自殺を行うように死んでいったわけです。
通常、細胞の自殺そのものは適切な場所で適切に行われることは、細胞の生まれ変わりであったり異常な細胞を処理するために必要であり、ガンもこの細胞死が適切に行われないことで悪性腫瘍として増殖してしまいます。
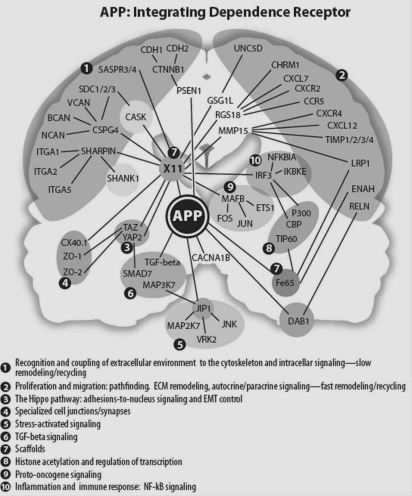
依存性受容体
ここで、ブレデセン博士らグループ1993年に発見した依存性受容体が登場します。
この依存性受容体(DpR)の最大の特徴は、一般的な受容体は結合物質(リガンド)が受容体と結合していない時は不活性であるのに対して、依存性受容体は手榴弾のピンを抜くように、リガンドが受容体から離れることで活性化(プログラム細胞死が発動)されます。
このように、リガンドの結合状態に依存して細胞が生存していることから「依存性受容体」という名づけられました。
現在約21種類の依存性受容体が同定されています。

www.ncbi.nlm.nih.gov/pubmed/20495383
依存性受容体として振る舞うアミロイドβ前駆体タンパク質
ブレデセン博士らは、依存性受容体が神経細胞においても発現しているのではないかと考え研究をしたところ、このアミロイドβ前駆体タンパク質(APP)が、依存性受容体として振る舞うことを発見しました。
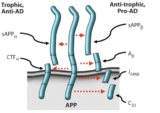
アミロイドβ前駆体タンパク質(APP)とは、神経細胞に発現している受容体の一種で、このAPPの切り出し方によって毒性のあるアミロイドβや、神経保護作用をもつsAPPαなどのアミノ酸ペプチドが産生されます。
そしてsAPPαが作られている時は、sAPPαが依存性受容体の鍵となって神経細胞死を防いでいたのです。
そして、APPがアミロイドβを作り出す側に切り替わると、保護装置(安全ピン)であるsAPPαが減少し、その受容体が発現している細胞を自殺へと向かわせます。
言い換えると、アミロイドβは神経細胞の自殺プログラム発動保護装置を邪魔することで、細胞に障害を与えるとも言えます。
シナプス恒常性バランス
細胞自殺による間引き
すでに述べたように、この安全装置の阻害による神経細胞の自殺は、細胞に栄養が十分に得られなかったり回復不可能なダメージを受けたりして機能を果たさない場合には、むしろ自殺を促して処理を促進する必要があります。
そのことによって他の細胞との世代交代しなければならないからです。細胞の間引きと言えるかもしれません。
アルツハイマー病ではない健康な人の脳の中では、このシナプスの形成・維持(シナプトブラスティック)とシナプス解体(シナプトクラスティック)が脳の中で絶えず繰り返しており、そのバランスを保つことで神経の可塑性が保たれています。
アミロイドβの平衡バランス
ここでアミロイドβなどの因子が過剰に供給されると、依存性受容体であるAPPがシナプス解体側に傾き、最終的に脳細胞全体の萎縮につながってしまいます。
アルツハイマー病患者の脳では、このシナプスの動的平衡バランスが崩れており、脳が自ら「萎縮プログラム」を発動し続けてしまっている状態だと考えたわけです。
ひとつ重要な点は、このバランスの崩れはアルツハイマー病を発症していない人の脳の中でも生じうる点にあります。
アミロイドβ前駆体は大工にも解体屋にもなる
建築に例えると、建物を築くためには大工が必要ですが、一方で古い家を壊す解体屋も必要なように、脳の中でも、同じ人が(APP)が大工になったり解体屋になったりすることで機能を果たしています。
一度解体屋(アミロイドβを含む4つのペプチド)が優勢になってしまうと、このアミロイドβがミイラや吸血鬼のように、大工さんになる予定の人までも解体屋さんに誘いこんでしまいます。。

癌も骨もバランスで成立する
実は神経シナプスにかぎらず、癌の増殖や骨芽細胞の骨形成においても、まったく同様に相反する二つの機構の綱引きが行われることで仕組みを支えています。
癌を例にとるなら、癌を自然現象として見た場合、がん遺伝子の活動(Oncogene activity)と、腫瘍抑制因子の恒常性バランスが崩れることにより、腫瘍が増殖しガンを発症するという視点が成立することは、すでに専門家の間で理解されています。
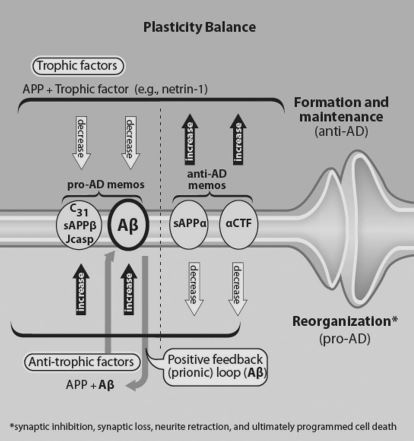
<参考> APPプロセシング代謝

sAPPα、p3、AICD
(細胞維持(保護)に働く3つのペプチド)
↓
APPプロセシングの変化(α/β切断比の低下)
抗トロポニン作用、ネトリン-1と多くの栄養サポート(コラーゲン(I型およびIV型)、ヘパラン硫酸プロテオグリカン、ラミニン、グリピカン、F-スポンジン)の阻害
↓
sAPPβ、アミロイドβ、Jcasp、C31を生成
(シナプス喪失、シナプス伝達の低下につながる4つのペプチド)
↓↑
ここで誕生したアミロイドβが再びα/β切断比を低下させ、シナプス喪失の4つのペプチドを生成する。
プリオニックループ障害
この悪循環が繰り返され、さらなる神経突起の退縮、プログラム細胞死の促進へとつながる。
シナプス可塑性バランス 模式図
環境条件によって異なるアルツハイマー病のタイプ
アミロイドβは戦時の兵隊&司令官
なぜこのようなことが起こるのか? 最初に述べたように、これまでずっと悪玉だとされていたアミロイドβはシナプス解体の指示、勧誘だけではなく、脳内の細菌やウイルスなどへ対抗するための内因性の保護因子でもあることに起因します。
つまり突然やってくる毒性に対抗するためには、兵隊(アミロイドβ)を非常召集でかき集めなければならないため、再帰的に短期間で増幅するメカニズムが生体的な役割として脳に備わる必要があったわけです。
そして、アミロイドβが増幅する環境条件の違いによって、3つサブクラスがあることも突き止めました。
1型は過剰な刺激による過剰反応
細菌やウイルス、炎症、ストレスなどの外敵が領地に入って攻めてきたため、アミロイドβ爆弾を投下して防ごうしているようなものです。残念ながらアミロイドβ爆弾はナパーム弾のように敵のみならず、自らの土地(脳細胞)にも被害を与えてしまいます。
また本来は炎症などのストレス因子が低下すれば、保護因子であるアミロイドβも減少しなければならないのですが、アルツハイマー病患者(1型)では、アミロイドβ自体が再帰的に、またはその他リスク因子とネガティブなフィードバック関係に陥ることでアミロイドβ非常事態宣言がイケイケドンドンで過剰反応してしまい、シナプス解体モードに過剰に傾いてしまった状態です。
2型は節約モードによる過敏反応
2型も1型と同様に多くの外敵からの影響によっても、シナプス解体モードに切り替わってしまっているのですが、高齢化にともなって、栄養不足、ホルモンの低下などプログラム細胞死に対抗する保護因子自体が低下しており、1型よりもわずかな要因で萎縮側に切り替わりやすくなっている状態です。
これは、アミロイドβ前駆体タンパク質の過剰反応というよりも、脳が無駄にエネルギーを消費しないようシナプスを解体することで節約しようとする仕組みが伴ったものです。
収入が少なくなったために豪邸の管理費を維持できず、庭を小さくしたり、管理人を解雇したりしているようなイメージとでも言えばいいでしょうか。
特に人間の記憶活動は、それらと相互接続している関連皮質が高い可塑性を維持して置かなければならないため、脳に非常に高い負担がかかります。
www.sciencedirect.com/science/article/pii/S0896627300811095
脳にとって大事なのは記憶や思考ではなく、とにかく生き残らなければならないという脳の側にとっての合理的な生存本能があります。
これにより、生存に直接関係しにくく維持費のかかる記憶能力を担う細胞からコストカットされ、生命に不可欠となってくる本能的な記憶は末期になって失われていくということの説明が可能になります。
また特に2型におけるビタミンやホルモンなど栄養素の不足は、脳が節約をしなければという栄養シグナルとして作用していると考えられます。
3型は誤作動反応ではなく、まさに戦争状態
注意しなければならないのは、一部の患者では(3型アルツハイマー)この非常事態宣言が、過剰反応、過敏反応ではなくまさに戦争が起きているがゆえに(外敵がまだ脳内に存在してアミロイドβが対処する必要がある)発動されています。
このケースにおいて戦闘中の軍隊(保護因子)であるアミロイドβを除去してしまうと、外敵に脳を荒されてしまうことになります。
1型は行き過ぎた正当防衛であるのに対して、3型では実際に敵がわんさかいる状況でナパーム弾をばらまいている状況です。
また1型の敵が比較的正体のはっきりした敵国のようなものであるのに対して、3型の敵(毒素)は多国籍的なテロ犯のようでもあり、領地のどこから侵入してくるのかわからない(3型の引き金となる毒素の多様性)怖さがあります。
もしこのブレデセン博士の仮説が正しいとするならば、
- 脳の警報が過剰反応(1型・2型)なのか正常な反応(3型)なのかを突き止める。
- 1型・2型の場合には、防御反応を引き起こしてしまっているアミロイドβを含めた因子を阻害または除去し、正常に作動させる因子を補充することでスイッチを保護の側に押し返す。(1型は危険因子の阻害、2型は保護因子の補充が重要)
- 3型の場合には、まず特異的な原因(金属・毒素など)を除去することで防御反応を緩和する、後に1型・2型と同じ手続きをとる。
という流れがあってシナプスの恒常性のバランス回復が見込まれ、
4. 二次的に生じた機構の障害を修復していく
となってはじめてアルツハイマー病の根治治療の可能性が開かれることになります。
また、アルツハイマー病が一つの疾患ではあり得ないという所以でもあります。
36の発症リスク因子
上記の仮説に基づき、ブレデセン博士たちグループは、シナプスの可塑性バランスに影響を与えるすべての分子化合物(非常事態宣言を発動させてしまう因子)を探索しました。
その結果、アミロイドβ前駆体タンパク質の保護と細胞死のスイッチ切り替え(APPプロセシング)に影響を与えるシグナルは、アミロイドβだけではなく、その他の何十もの分子化合物がシナプス恒常性バランスに影響を与えるというが発見されました。
この時に36の寄与因子が同定されたことから、ブレデセン博士が例えとして使う「36の屋根の穴」という比喩にもつながっています。
よく知られた代謝因子
発見されたシグナルにはエストロゲン、テストステロン、甲状腺ホルモン、インスリン、炎症性転写因子であるNF-κB、長寿遺伝子として知られるSirt1、ビタミンD、などといった、知る人にはとっては聞き慣れた因子も含まれます。
また、そういった因子、分子化合物に限らずその根底にはストレスや睡眠といった日常生活に類する項目までもが、直接、間接的にAPPプロセシングに影響を与え、アルツハイマー病を防ぐのか、引き起こすのかといった切り替えスイッチに影響をあたえることも明らかになっています。
抗恒常性フィードバック
そこで、ブレデセン博士はこの裏をひっくり返して、それらの因子に同時に働きかけることで、崩れたシナプス形成と解体の恒常性が回復するのではないかと考えたわけです。(つまりアルツハイマー病が可逆的に回復する。)
この考え方が示す重要なポイントは、多因子の複合的な作用によって成立する神経可塑性バランスを正常なセットポイントに戻すのなら、
単一の治療薬ではなく多標的治療プログラムであらねばならない、ということです。
この考え方に基づいてデザインされた治療プログラムが「ブレデセンプロトコル」であり、当サイトで紹介している「リコード法」です。
動画 「アルツハイマー病のプリオニックループ障害について」ブレデセン博士 (英語)
論文 アルツハイマー病における神経変性:カスパーゼとシナプスの相互依存
デール・E・ブレデセン
www.ncbi.nlm.nih.gov/pmc/articles/PMC2709109/ (英語)
次の記事




