Contents
Recent advances in our understanding of mast cell activation – or should it be mast cell mediator disorders?
www.ncbi.nlm.nih.gov/pmc/articles/PMC7003574/
要旨
はじめに
マスト細胞が放出する複数のメディエーターが原因で、脳を含む多くの臓器に影響を及ぼす複数の症状を呈する患者が増加している。これらのユニークな組織免疫細胞は、免疫グロブリンE(IgE)によって誘発されるアレルギー反応に重要であるが、免疫、薬物、環境、食物、感染症、ストレスなどの誘因によっても刺激され(活性化されないヒスタミンやトリプターゼを伴わない複数のメディエーターが分泌されることが多い。肥満細胞障害のスペクトルの提示、診断、および管理は非常に混乱している。その結果、専門医は最近、ほとんどの患者を除外することを犠牲にして、神経精神症状を除外し、診断基準をより厳格にしている。
対象領域
1990年1月から 2018年11月までに発表された論文をMEDLINEを用いて文献検索を行った。使用した用語は、活性化、抗ヒスタミン薬、アトピー、自閉症、脳霧、ヘパリン、KIT変異、IgE、炎症、IL-6,IL-31,IL-37,ルテオリン、肥満細胞、肥満細胞症、メディエーター、筋痛性脳脊髄炎・慢性疲労症候群、マイコトキシン、放出、分泌、テトラメトキシルテオリン、トリプターゼであった。
専門家の意見
いずれかの肥満細胞メディエーターの血清または尿中濃度の上昇を伴う状態は、そのような上昇を説明できる併存疾患がない場合には、肥満細胞活性化障害とみなされるべきであり、より好ましくは「肥満細胞メディエーター障害(MCMD)」と総称されるべきである。強調すべきは、マスト細胞メディエーターの同定と、その放出を抑制する薬剤やサプリメントの開発である。
キーワード
活性化、抗ヒスタミン剤、自閉症スペクトラム障害、脳霧、KIT変異、サイトカイン、IgE、炎症、IL-6,IL-37,ルテオリン、肥満細胞、マストサイトーシス、メディエーター、筋痛性脳脊髄炎・慢性疲労症候群、マイコトキシン、テトラメトキシルテオリン、トリプターゼ
1. はじめに
ここ数年、アレルギー、喘息、湿疹、鼻炎、食物過敏症などのアトピー性疾患が異常に増加している。さらに、アレルギーと一致する症状、および/または炎症を呈し、多くの臓器に影響を与えているが、認識できる誘因がないか、またはアレルギー以外の誘因が多すぎるという患者の症例が多数存在している。これらの症状(表1)は、肥満細胞から分泌(放出)されるメディエーターに由来し、潮紅、そう痒症、血圧低下、胃腸の不定愁訴、頭痛、過敏症、倦怠感、記憶喪失、および神経精神医学的問題を含む。その結果、肥満細胞疾患または肥満細胞障害(MCD肥満細胞活性化疾患または肥満細胞活性化障害(MCAD)など、これらの症状を捉えるために多くの異なる名称が提案されてきた。
表1. 肥満細胞媒介性疾患の患者によくみられる症状
・循環器:胸痛、低血圧、血圧低下性失神、頻脈
・皮膚科:血管性浮腫、皮膚炎、潮紅、そう痒症、色素沈着性じんま疹
・消化器:腹部のこわばり・痛み、腹部膨満感、下痢、食道炎、吐き気、嘔吐
・筋骨格系:骨・筋肉痛、変性性椎間板疾患、骨粗鬆症・骨減少症
・鼻眼:鼻づまり、そう痒症、涙目
・神経症:頭痛、記憶力・集中力の低下(脳霧感覚障害、末梢神経障害
・呼吸器:嗄声、喉の痛み、喘鳴、喉の腫れ、喘鳴
・全身性:アナフィラキシー、疲労感
残念なことに、このような障害の命名と診断の両方において、これらは多くの紛らわしい側面を持っている。第一に、「活性化」という用語は、一般的に受容体または酵素の活性化のために予約されているのに対し、「刺激」は細胞のために使用されている。第二に、肥満細胞の刺激は、肥満細胞肉腫の場合のように、肥満細胞のメディエーターのすべて、あるいはいかなる肥満細胞メディエーターも分泌されずに増殖することを意味しているかもしれない。次に、「分泌」という用語は、通常、分泌顆粒内に貯蔵されたメディエーターのために予約されているが、「放出」という用語は、貯蔵されたメディエーターおよび新しく合成されたメディエーターの両方に使用される。それはそれとして、肥満細胞メディエーターの放出は、多くの生理学的および病理学的設定で発生する可能性がある。さらに悪いことに、肥満細胞が関与する疾患を模倣したり、併存したりする疾患が他にも数多く存在する(表2)。その結果、罹患した患者さんは、診断が下されるまでに10~20年、多くの異なる専門医を受診し、その間に多くの薬を処方されることが多く、重度の薬物相互作用により疾患の症状や経過をさらに複雑にしている。
表2. 肥満細胞疾患とよく併発する疾患
・慢性炎症反応症候群(CIRS)
・線維筋痛症症候群(FMS)
・エーラス-ダンロス症候群(EDS)
・湾岸戦争病
・間質性膀胱炎・膀胱痛症候群(IC/BPS)
・過敏性腸症候群(IBS)
・こうにしょうこうぐん
・多発性化学物質過敏症(MCSS)
・筋痛性脳脊髄炎・慢性疲労症候群(ME/CFS)
・ポストライム症候群
・姿勢性起立性頻脈症候群
・心的外傷後ストレス障害(PTSD)
2. マスト細胞生物学
マスト細胞は、造血前駆体に由来する免疫細胞であり、組織の微小環境[1]で成熟している。マスト細胞はアレルギー反応の発現に重要な役割を果たしているが、環境や心理的ストレスのセンサーとしても機能している[3,4]。血管周囲のマスト細胞は、内皮の隙間からフィロポディアを伸ばして皮膚血管をプローブし、血管から免疫グロブリンE(IgE)を捕捉することが示されている[4]。マスト細胞はまた、自然免疫系(感染性病原体に対する宿主防御、毒素の中和)や適応免疫応答[5-9]にも参加しているが、抗原提示[10,11]やT細胞応答[12-14]の調節[15]、自己免疫[16]、炎症[17-19]にも参加している。
マスト細胞は、外部環境とのインターフェースとなる組織に存在し[20]、主にIgE依存性反応(アレルゲン)によって刺激される。アレルゲンに加えて、マスト細胞は、細菌、薬物、食品、真菌、重金属、有機リン酸塩、ウイルス、および「危険信号」[2]を含む様々な異なる誘因(表3ならびにコルチコトロピン放出ホルモン(CRH)[21]、ニューロテンシン(NT)[22,23]、およびサブスタンスP(SP)を含む特定の神経ペプチドによっても刺激される。NT [24,25]およびSP [26-29]の両方が炎症プロセスに関与することが知られている。現在、多くのカチオン性薬物は、低親和性Gタンパク質共役型受容体MRGPRX2の活性化を通じて肥満細胞を刺激することが示されている[30]。肥満細胞は一般的に非アレルギー性の誘因に反応し、メディエーターが脱顆粒せずに選択的に放出されることもあるため、ルーチンの組織学でこれらの肥満細胞を同定することは困難である[31](表4)。
表3. 肥満細胞脱顆粒の細胞トリガー
- アセチルコリン
- 補完フラグメント
- C3α、C4α、C5α
- 薬物
- 局所麻酔薬
- ラクタム系抗生物質
- 神経筋接合部遮断薬
- バンコマイシン
- IgE
- IgG1
- IgG4
- リゾホスファチジルセリン
- ペプチド
- アドレノメドゥリン
- CGRP
- エンドルフィン
- エンドセリン
- 好酸球顆粒蛋白質
- ヘモキニン-1
- レプチン
- マストパラン
- ニューロテンシン
- エヌジーエフ
- PTH
- ソマトスタチン
- SP
- トロンビン
- VIP
- 物理的条件
- 冷たい
- 熱
- 圧力
- ストレス
- 振動
表4. 脱顆粒を伴わないマスト細胞のトリガー
媒介者のトリガー
ペプチド
CRH VEGF
SCF IL-6
サイトカイン
IL-1β IL-6
IL-33 IL-31
IL-33 CX CL8(IL-8
IL-33+SP TNF、VEGF
重金属
アルミニウム
カドミウム
水銀
除草剤
アトラジン
グリホサート
病原体
ボレリア(ライム病)※TNF
エルピーエスティーエヌエフ
ポリ(I:C)(ウイルス)IL-6,TNF
スポロトリックス(カビ)* IL-6,TNF
*真菌毒素
刺激を受けると、マスト細胞は、β-ヘキソサミニダーゼ(β-hexヒスタミン、腫瘍壊死因子(TNFトリプターゼなどのプレフォームドメディエーター(表5)を迅速(1~5分)に脱顆粒して分泌する。マスト細胞は、あらかじめ形成されたTNF [32]を貯蔵する唯一の細胞型であり、このTNFは急速に分泌され、T細胞のリクルートおよび活性化に影響を与える [33-35]。マスト細胞はまた、プロスタグランジンD2(PGD2)やロイコトリエンなどの新たに合成されたリン脂質産物を放出する [36-38]。マスト細胞はまた、サイトカイン[39]、ケモカイン(TNF、CCL2,CCL8)、ヘモキニン-1(HK-1)、レニン[19,40]など、刺激の6-24時間後に多くのde novo合成されたタンパク質メディエーターを分泌する(表4)。マスト細胞由来のCCL2およびCXCL8は、炎症部位への他の免疫細胞のリクルートを増強する[41]。
表5. マスト細胞メディエーター
- プレストアード
- バイオジェニックアミン
- ドーパミン
- ヒスタミン 5-ヒドロキシトリプタミン
- ポリアミン
- スパーミジン、スペルミン
- サイトカイン
- TNF
- 酵素
- アリールスルファターゼA
- ベータヘキソサミニダーゼ
- β-グルクロニダーゼ
- ベータグルコサミニダーゼ
- ベータDガラクトシダーゼ
- カルボキシペプチダーゼA
- カテプシンB,C,D,E,L
- キマーゼ
- ガーンザイムB
- キノゲナーゼ
- ホスホリパーゼ
- レニン
- トリプターゼ
- メタロプロテアーゼ
- (CPA3, MMP9, ADAMTSS)
- 成長因子
- エフジーエフ
- エヌジーエフ
- エスシー
- TGFβ
- VEGF
- ペプチド
- アクチス
- アンジオジェニン
- アンジオポエチン
- カルシトニン遺伝子関連ペプチド
- コルチコトロピン放出ホルモン
- エンドルフィン
- エンドセリン
- ヘモキニン-1
- キニン(ブラジキニン
- レプチン
- メラトニン
- ニューロテンシン
- ランクル
- ソマトスタチン
- サブスタンス-P
- ウロコルチン
- 血管作動性腸管ペプチド
- プロテオグリカン
- コンドロイチン硫酸
- ヘパラン硫酸
- ヘパリン
- ヒアルロン酸
- セルグリン
- デノボ合成
- ケモカイン
- IL-8(CXCL8MCP-1(CCL2MCP-3(CCL7)。
- MCP-4,RANTES(CCL5Eotaxin(CCL11
- サイトカイン
- IL-1β、IL-4,IL-5,IL-6,IL-15,IL-17,IL-31,IL-33,TNF
- 成長因子
- SCF、β-FGF、ニューロトロフィン3,NGF。
- PDGF、TGFβ、VEGF
- 一酸化窒素
- リン脂質代謝物
- ロイコトリエンB4
- ロイコトリエンC4
- 血小板活性化因子
- プロスタグランジンD2
さらに、コルチコトロピン放出ホルモン(CRHまたは因子、CRF)も肥満細胞で合成される [42] ことから、自己分泌作用を持つ可能性が示唆されている [17,43]。特にCRHR-1はヒト培養肥満細胞で発現しており、CRHR-1の活性化によりトリプターゼを介さずに血管内皮増殖因子(VEGF)の産生が誘導される[21]。
肥満細胞は、追加の「危険」シグナル[45]と同様に、特にそう痒症を誘発するIL-31を分泌することができる[44](表4)。ミトコンドリアDNA(mtDNA)[34,46]は、自己炎症反応[47-50]を引き起こし、アレルギー反応[51]を増強し、直接的な神経毒性効果[52]を有する。我々は、自閉症スペクトラム障害(ASD)の子供の血清中にmtDNAが増加していることを報告している[53]。もう一つの重要な危険信号は、線維芽細胞や内皮細胞から分泌されるアラーミンIL-33[54]であり、多くのアレルギー[55]や炎症性疾患[56]に関与している。IL-33は、肥満細胞および好塩基球からのヒスタミンの分泌に対するIgEの効果を増強する[54,57]。最も広く使用されている除草剤であるグリホサートがIL-33の発現と気道炎症を誘導することは興味深いことである[58]。
我々は、IL-33がヒト肥満細胞からのVEGFの分泌を刺激するSPの能力を、脱顆粒せずに増強することを示した[59]。また、最近、SPとIL-33を併用して投与すると、培養ヒト肥満細胞からTNF [60]およびIL-1β [61]の遺伝子発現および分泌が顕著に増加することを報告した。肥満細胞はIL-33 [62,63]やSP関連ペプチドHK-1 [64]を分泌することができ、自己分泌の増強を示唆している。さらに、肥満細胞から分泌されるトリプターゼが細胞外IL-33に作用し、成熟したより活性の高いIL-33を生成し[65]、これが肥満細胞を刺激してIL-1βを分泌させ、これが肥満細胞を刺激してIL-6を分泌させる[66]。さらに、肥満細胞由来のTGFβはTh17細胞の発生を促進し、肥満細胞はIL-17を自ら分泌することもできる[67]。
刺激された肥満細胞は、異なるシグナル伝達経路[70-73]と分泌経路[70,74]を利用して、多数の生理活性メディエーター[19,68,69]を分泌することができる。重要な経路の一つは、哺乳類のラパマイシン標的(mTOR)[75]の経路であり、ヒト培養マスト細胞においてSPによって刺激されることが示されている[76]。複数のメディエーターを分泌する能力は、マスト細胞がその周囲の環境の他の細胞型、特にT細胞と積極的に相互作用することを可能にする[77,78]。興味深いことに、肥満細胞メディエーターの分泌は概日時計によって制御されることが示されている[79,80]。
各メディエーターは、特定の臨床的特徴につながる可能性がある。例えば、ヒスタミンは頭痛、血圧低下、そう痒症と関連し、トリプターゼは炎症とフィブリノーゲン溶解と関連し、サイトカインとケモカインは全身性の炎症と疲労の体質的症状と関連し、PGD2は潮紅と関連し、ロイコトリエンは気管支収縮と関連している。その結果、肥満細胞由来のメディエーターは、アレルギー性疾患、喘息、肥満細胞症[2]だけでなく、アトピー性皮膚炎、乾癬、筋痛性脳脊髄炎・慢性疲労症候群(ME/CFS)[81]、線維筋痛症症候群(FMS)[82]、冠動脈疾患、肥満[83]、ASD[17,50,84]の病態にも寄与している可能性がある。
症状の重症度は、メディエーターを分泌する肥満細胞の能力、循環するIgEのレベル、サイトカインおよびケモカインの存在[85]、特にIL-33[59]、さらには、特に肥満細胞症を患う患者における蜂毒による刺激などの高リスクの条件の共存など、多くの因子に依存する[86-89]。スズメバチ刺傷に対する反応はアナフィラキシーにつながる可能性があり、突然の激しい潮紅、喉の腫れ、気管支収縮、および低血圧を特徴とし、死に至るまで進行する可能性がある [90]。好塩基球もまた、アレルギー反応や他の炎症反応に参加しているが、その主な引き金はIgEであり、トリプターゼを含まないことを除いては、マスト細胞のそれに多少似ている[91,92]。CD63およびCD203cの同定を介して、好塩基球活性化の関与を文書化するための様々なアッセイが提案されている[93,94] [93-95]。
3. 肥満細胞障害の分類と診断上の特徴
このトピックは、様々な専門家やコンセンサスグループによって異なる用語が使用されているため、非常に混乱している。例えば、「肥満細胞疾患」、「肥満細胞障害」、「肥満細胞症候群」という用語はしばしば互換的に使用されている。このレビューでは、「肥満細胞疾患」という用語は、多くの亜種またはサブタイプを含むために使用されている。
肥満細胞が関与する疾患 [96,97] は伝統的に、原発性、二次性、特発性の3つの一般的なカテゴリーに分類されてきた [98,99]。しかし、症状の発生および重症度の遺伝的およびエピジェネティックな原因に関する新しい情報 [100] は、表6に示すように、これらの疾患の理解および分類に対する新しいアプローチを必要としている。歴史的に、「原発性」は、これらの障害が骨髄、皮膚、または他の組織/器官における肥満細胞の増殖に機能的な結果をもたらす遺伝的および/またはエピジェネティックな変化によって引き起こされることを暗示するために使用されてきた。
表6. 肥満細胞障害の分類
クローン性マスト細胞増殖障害
- 1. 全身性肥満細胞症(不活発、攻撃性)
- 2. 皮膚肥満細胞症(じんま疹性色素変性症、びまん性、毛細血管拡張性発疹性黄斑変性症)
- 3. 肥満細胞白血病(MCL)
- 4. 肥満細胞肉腫(MCS)
- 5. 皮外肥満細胞腫(良性)
- 6. モノクローナル肥満細胞活性化症候群(MMAS)
肥満細胞メディエーター障害(特発性)
- 1. 異常なクラスタリングを伴わないモノクローナル
- 2. ノンクローナル
- 3. 特発性アナフィラキシー(IA)
反応性マスト細胞増殖/メディエーター放出障害
- 1. IgE介在性過敏症反応(食物、昆虫アナフィラキシーなど)
- 2. 薬物誘発性(例:バンコマイシン、オピオイド、タキサン、筋弛緩剤、アデノシン、非ステロイド性抗炎症剤)
- 3. 肥満細胞過形成(慢性感染症、新生物、自己免疫疾患、幹細胞因子が過剰になっている可能性があるために関連している)
3.1. クローン性肥満細胞増殖障害
3.1.1. 全身性肥満細胞症
全身性肥満細胞症(SM)は、一定の基準が満たされていれば、少なくとも1つの皮外組織、典型的には骨髄に肥満細胞が浸潤していることによって定義される[101]:骨髄生検での肥満細胞クラスターの1つの主要基準と1つのマイナー基準(例えば、基底血清トリプターゼの上昇、紡錘形肥満細胞または世界保健機関(WHO)によって定められた3つのマイナー基準(表7)[102]。しかしながら、これらの基準は、コドン816(D816V)またはその近くの他のコドンにおけるKIT遺伝子における「機能獲得」変異の存在に強く基づいている。全身性肥満細胞症は、(a)不随意性、(b)侵攻性、または(c)血液学的非肥満細胞系疾患に関連するものとして特徴付けられる。時には、単一の骨髄生検で肥満細胞クラスターを見逃すこともある。我々の研究では、1回の生検でエビデンスがあったのは17%の患者のみであったが、腸骨クレスト生検を2回行うと83%の患者で肥満細胞症のエビデンスがあった[103]。
表7. 全身性肥満細胞症の診断基準
主要基準
a.髄内生検切片および/または髄外臓器で検出された肥満細胞の多巣性、密な浸潤(集合体で15個以上の肥満細胞)。
マイナー基準
a.髄内生検切片またはその他の髄外臓器において、浸潤液中のマスト細胞の25%以上が紡錘形または非定型の形態であるか、または骨髄吸引塗抹液中の全マスト細胞の25%以上が未熟または非定型である。
b. 骨髄、血液、または他の皮外臓器におけるコドン816(通常はKIT D816V)におけるKITの機能点変異の獲得
c. 骨髄、血液、または他の皮外臓器におけるCD2および/またはCD25の肥満細胞の異常な免疫フェノタイプ(正常な肥満細胞マーカーに加えて
d. ベースラインの血清総トリプターゼが持続的に上昇している(>20ng/ml)。
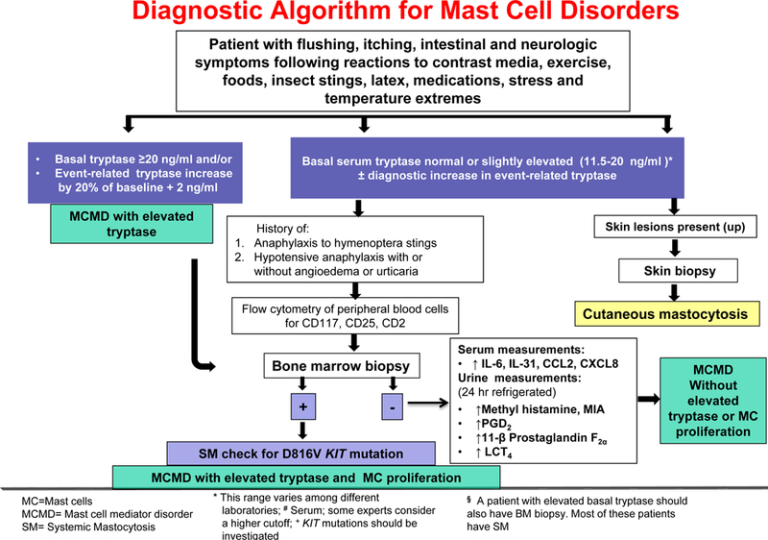
肥満細胞は、トリプターゼと幹細胞因子(SCF)の表面受容体であるKIT(CD117)の免疫組織化学的検査で同定すべきである。CD117はGI管、特に門脈三叉路で選択されるマーカーと考えられている。トリプターゼ、CD117(KITCD25に対する抗体を用いたフローサイトメトリー免疫フェノタイピングは、骨髄生検に移行する前に、疑われる症例では末梢血で行うことができる(図1)。骨髄塗抹標本ではマスト細胞が少なく、多くの細胞が損傷しているため、異常なマスト細胞を特定することは困難である。
図1
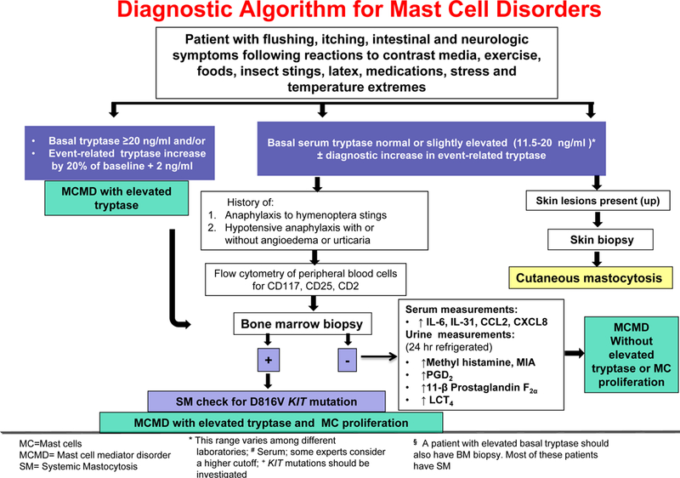
肥満細胞メディエーター障害の診断基準として提案されている、クローン性および非クローン性のサブタイプ、および血清トリプターゼ上昇の有無に重点を置いた診断基準を図式化したもの。
典型的には、患者は骨髄生検の候補と考えられる。(a)トリプターゼ>20ng/ml;(b)以前に血圧低下エピソードおよび/または失神の既往歴を有する;(c)成人患者におけるびまん性皮膚肥満細胞症(CM);(d)原因不明のアナフィラキシー、またはハチドリに対する特異的IgE検査が陰性であってもハチドリに刺されて誘発されたアナフィラキシーを説明することができない場合 [104-106]。その後、骨髄または末梢肥満細胞を検査して、SM患者の90%以上に存在するKIT変異D816Vの存在を確認すべきである[107]。(e) SHとは異なる症状を伴う昆虫誘発性アナフィラキシー [108];(f)原因不明の骨粗鬆症、肝巨大症、および脾巨大症の存在(SMの侵攻性変種の疑い)[104]。(g) MCAD(慢性骨髄球性白血病や骨髄異形成症候群のようないくつかの血液学的非マッス細胞系統、その他の骨髄増殖性新生物やリンパ増殖性疾患)を有する患者における末梢血数の異常[109](図1)。
SM患者に見られる最も一般的な変異は、マスト細胞に影響を及ぼすKITのコドン816に位置する点変異である。(a) マスト細胞の自律的な増殖と増殖を促進する [110];(b) マスト細胞が高濃度のSCFでIL-6を放出する引き金となる [111];(c) D816V変異はマスト細胞に影響を与える。D816V突然変異は、SMの基準を満たさない個体においても発現することがあり[86,99,106,112-114]、その場合、患者はモノクローナル肥満細胞活性化症候群(MMAS)を有すると考えられる(下記参照)。KITの機能的に活性化する遺伝子変異(例えば、D419H、V560G)がいくつか存在するが、一般的ではない;これらの変異は、罹患した肥満細胞の検出可能な形態学的変化を誘発しない;これらの変異は、疾患の進展および/または特定の症状の発現に影響を与える可能性がある [59]。
他のいくつかの遺伝子変異(例えば、FIP1L1-PDGFRA)は、構成的に活性化された血小板由来成長因子受容体-α(PDGFRA)をもたらし、原発性好酸球性障害と関連している。ある研究では、好酸球症を伴う全身性肥満細胞症患者19人のうち10人(56%)がこの特異的な変異を有しており、この変異が存在する場合には、基礎となる全身性肥満細胞症を示唆している[115]。
3.1.2. 皮膚肥満細胞症
このサブカテゴリーでは、罹患した皮膚は最も一般的にじんま疹性色素変性(UP)またはびまん性CMとして現れ、水疱性CMまたは孤立性肥満細胞腫としてはそれほど頻繁ではない [96,116]。成人のCMとは異なり、小児では骨髄生検は推奨されない [117,118]。一般に、小児のCMはほとんどの小児で思春期までに退行すると考えられているが [116]、この点を証明する系統的な縦断的研究はない。しかし、ベースラインの血清総トリプターゼの増加は、黄斑部皮膚肥満細胞症の存在[120] [121]または末梢血中のKIT D816Vの検出[122]と同様に、SMのリスクがある小児を識別する[119]。興味深いことに、ほとんどの皮膚病変にKIT D816Vが存在しないことは、骨髄の外にコミットされた幹細胞が存在する可能性を示唆している。この場合、皮膚における肥満細胞増殖を誘発する分子は、NGF [123]、RANTES [124]、あるいは毛包間葉系の前駆体に作用するCRH [125]である可能性がある。小児における新たなUP病変が外傷部位にしばしば発生することは興味深い。
黄斑部多発性毛細血管拡張症はCMの一種であり、じんま疹とは関連していない [126]。
3.1.3. モノクローナル肥満細胞活性化障害
このサブカテゴリーは、ベースラインの血清トリプターゼの上昇がまれに認められる、ハチの巣刺されに対する全身反応を有する患者、または原因不明のアナフィラキシーのエピソードを有する患者に限定される [127]。これらの患者では、骨髄生検で骨髄吸引液中にも検出可能な変異型KIT D816Vを運ぶモノクローナル肥満細胞 [128]、および/またはCD2またはCD25の異常発現が検出される。しかしながら、SMの診断基準は、1つまたは2つのマイナーな基準しか満たされておらず、満たされていない[104]。
結論として、肥満細胞メディエーターの放出に起因する症状は、ほとんどの原発性肥満細胞障害に存在するが、それらはまた、かなり異なっている。(a) 多巣性骨髄肥満細胞凝集体およびUPの可能性はSM患者にのみ認められる;(b) D816V KIT変異および骨髄肥満細胞上のCD25異常発現はSMおよびモノクローナル肥満細胞活性化障害(MMAD)の患者を特徴づける。(c) ベースライントリプターゼの上昇、およびベースライン24時間尿メチルヒスタミンまたはPGD2/11β-PGF2αの上昇がほとんどの患者で認められる;(d) 抗メディエーター療法の反応は可変的であり、特発性アナフィラキシー(IA)を有する患者ではおそらく効果がない[99]。
3.2. 反応性肥満細胞障害
これらの患者では、KIT D816Vの変異は認められず、フローサイトメトリーではCD25の発現が陰性であることが多い[98]。
3.2.1. IgE介在性過敏症反応
これらは、前述のようにアレルゲン結合型IgEによる高親和性IgE受容体(FcεRI)の凝集による典型的な反応(例えば、食物、昆虫)である。
3.2.2. 薬物誘発性
マスト細胞は、筋弛緩剤、非ステロイド性抗炎症剤、オピオイド、タキサン、バンコマイシンなどの多数の薬物に反応することができる。このような薬物は、G共役型受容体を介して直接または間接的にマスト細胞を刺激することができる[129]。最近、MRGPRX2受容体が、多くのカチオン性薬物に対する偽アナフィラキシー反応に関与していることが発見された[30]。
3.2.3. 肥満細胞過形成
この文脈での過形成は、播種性肥満細胞密度の増加として定義され得る。この亜変異体には、慢性感染症、新生物、および自己免疫疾患のような、異なるメカニズムで肥満細胞を刺激することができる異なる疾患が含まれる[98]。例えば、乾癬は異常なIFN-γによって特徴づけられ、これは高親和性IgG受容体のアップレギュレーションを通じて肥満細胞を誘発する [130]。関節リウマチ患者のマスト細胞は、それぞれの受容体に結合することにより、C3aおよびC5aを介して刺激される[130]。感染症患者では、マスト細胞は、微生物またはウイルス病原体に共通の分子パターンを認識するToll様受容体(TLR)[131]の直接的な活性化を介して刺激される。
しかし、SM患者の腸内マスト細胞の数が増加したという報告が多数ある[132]が、SMが存在しない場合には「腸マストサイトーシス」と呼ばれることもある[133]。
腸管肥満細胞症と呼ばれることもある[133]。
4. 肥満細胞メディエーターの障害
4.1. クローン性肥満細胞増殖障害
これらの患者のほとんどは、肥満細胞メディエーターの放出と一致する症状を有している可能性がある。
4.2. 非クローン性肥満細胞メディエーター障害
ほとんどの患者は、特定の基準を満たすかどうかによって、非クローン性マスト細胞活性化障害(nc-MCASマスト細胞活性化症候群(MCASまたは特発性MCAS[127](図2)とも呼ばれるこのカテゴリーに該当する[99,134-136]。
図2 クローナルおよび非クローナルサブタイプに関する肥満細胞メディエーター障害の推定発生および重複性
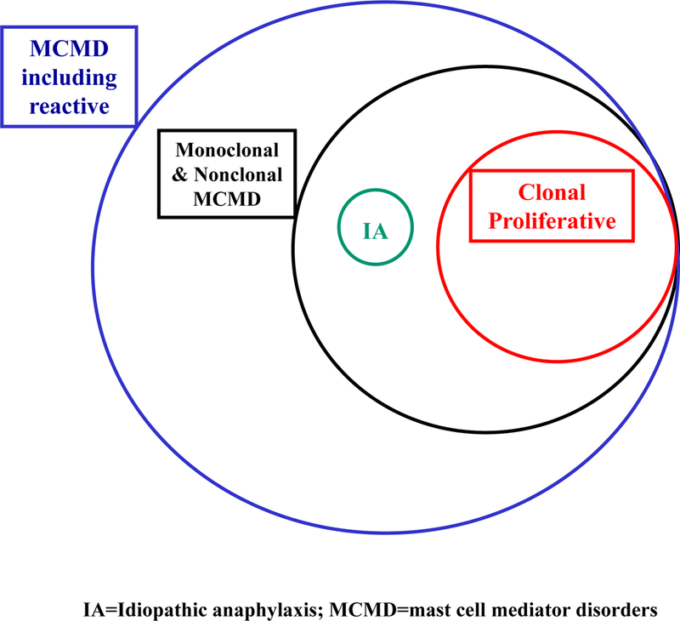
(a) 臨床徴候および症状;(b) 血清および/または24時間尿中肥満細胞メディエーターまたはそれらの代謝物の増加の記録;および(c) マスト細胞の刺激またはそれらのメディエーターの作用を阻害する薬物による治療後の症状の軽減。
上記の第2の基準は、神経学的症状を除外し、血清トリプターゼレベルを強調することにより、最近修正された [137,138] 、血清トリプターゼ上昇の有無にかかわらず、このような患者の2つのサブクラスを必ず導く。対照的に、肥満細胞症学会の症状調査では、90%以上の患者が「ブレインフォグ」[139]を主訴とし、「ストレス」が重要な引き金となっていることが報告されている[140,141]。精神神経症状は多くの場面で報告されている[142-145]。さらに、肥満細胞障害の患者は、CRHを介して感情的ストレスの影響を深く受けている[21,33,38,43]。ある症例では、感情的ストレス後にUPが劇的に拡大し[146]、別の症例では骨髄肥満細胞がCRHR-1を発現していることが示された[147]。すでに議論されている潜在的な誘因に加えて、神経精神疾患におけるカビおよびマイコトキシンの影響も含めるべきである[148,149]。例えば、酵母はマスト細胞を刺激して脱顆粒せずにIL-6およびTNFを分泌させ[150]、また、ボレリア・ブルグドフェリ・スピロケイトも同様である[151]。
このサブカテゴリーの障害は、D816V KIT変異に基づいて、同定可能な原因、アレルゲン特異的IgE、および検出可能なクローン性肥満細胞を有していない。環境または内因性刺激、内在性肥満細胞の欠損が関与している可能性がある。肥満細胞の状態を説明する最良の方法は、異常な刺激を示す「不安定」であるということである[152]。肥満細胞のこの「不安定」な状態は、ポジティブシグナルおよびネガティブシグナル[153]、より低い刺激閾値、あるいは肥満細胞メディエーターの「正常」な分泌によって影響を受けることがあるが、周囲の組織の異常な反応(例えば、ジアミン酸化酵素およびヒスタミンN-メチル転移酵素などの異化酵素の欠乏)によっても影響を受けることがある。さらに、不安定な肥満細胞は、元の引き金がもはや存在しなくても、同じ引き金または異なる引き金にさらされた場合に、より迅速かつより深刻に反応するように肥満細胞を駆り立てる過去の引き金の「代謝記憶」を保持しているかもしれない。そのような例としては、CRHを介したストレスが肥満細胞にIgE [51] やNT [23] の作用を促す能力が挙げられる。
カルチノイド症候群、褐色細胞腫、胃腺腫、およびVIP腫などの疾患は、症状の多くを説明しうるが、特定の診断検査によって除外しなければならない。例えば、血清クロモグラニンAはカルチノイド症候群のバイオマーカーであるが、SMではない[154]。肥満細胞のクローン性がない場合、肥満細胞メディエーター(例えば、血清トリプターゼ、24時間尿中N-メチルヒスタミン、PGD2,11β-PGF2αなど)が症状のある患者で測定される(図1)。これらが上昇しない場合は、さらなる臨床評価が必要である[118]。特発性MCASは、ME/CFS [81]、線維筋痛症症候群[82]、IBS [155,156]などの患者の一部に見られるように、他の様々な頻発する臨床症状の根本的な原因である可能性がある。
活性化」は通常、主に血清トリプターゼレベルの上昇に焦点を当てた肥満細胞メディエーター [157] の放出によって推論される。しかし、肥満細胞はトリプターゼがなくても多くのメディエーター、特にサイトカインやケモカインを分泌することができるので、血清トリプターゼレベルは不十分であり、誤解を招く可能性がある[31,60,61]。トリプターゼは肥満細胞にとって重要な特異的メディエーターであり、好塩基球からも少量分泌されるが、選択するマーカーとして推奨されている[158,159]。血清トリプターゼは通常、αおよびβトリプターゼの両方に結合するB12モノクローナル抗体(mAb)で検出される。G5mAbはβトリプターゼに対して10倍の親和性で結合しているため、αの方は全トリプターゼとβトリプターゼの差として計算される。肥満細胞活性化の指標として必要な血清トリプターゼの最小増加は、次の式から定義されることが報告されている:ベースライントリプターゼレベルの20%+2 ng/ml+ベースライントリプターゼレベル=肥満細胞活性化の定義を満たす上記の値[98]、通常は≥20 ng/mlである。しかしながら、このアルゴリズムの感度は、症状の解消と採血の間隔が長くなるにつれて低下する [138];さらに、過去に広く議論されてきたように、この式を支持する発表されたデータはない [160]。
さらに、トリプターゼ測定は、偽陽性の結果につながるいくつかの条件によって影響を受ける可能性がある。(a)リウマチ因子の存在、(b)症状出現後0.2-4時間以内の血清トリプターゼの測定 [98] もし血清トリプターゼの症状を示すベースラインレベルが利用可能であれば、急激な上昇が信頼できる指標と考えられる;(c)ベースラインは患者の完全な回復後、またはすべての症状が完全に解決した後少なくとも24-48時間の無症状期間中に評価されなければならない[161-163]、そして(d)トリプターゼアルゴリズムの感度は臨床重症度の低下とともに低下する[138]。
ヒスタミンは肥満細胞に特異的であるが、ヒスタミンは非常に迅速に代謝される(<1分)ので、血清レベルは有用ではない。さらに、血清レベルは、(a)好塩基球からの放出 [158,159];(b)組織損傷;(c)静脈うっ血、採血および検体調製中の溶血または凝固、または不適切な遠心分離/保存;(d)ヒスタミンを豊富に含む食事 [164]により増加することがある。最も有益な検査は、24時間尿または最初の朝の採尿中の代謝物N-メチルヒスタミン(ヒスタミンの30%)または1-メチルイミダゾール酢酸、MIA(ヒスタミンの60%)の測定であるが、採血中は冷蔵保存し、検査室に冷蔵で送らなければならない;さらに、患者は、生体アミンを含む食品(例えば、採血前24時間、バナナ、チーズ、ほうれん草、サワーカラス、クミン、および他の香辛料)の消費を避けるべきである。
血清PGD2は有用であるかもしれないが、その放出は、(a)末梢血サンプルの処理による細胞要素;(b)アテローム性動脈硬化症の治療に使用されるナイアシンまたはナイアシン生成物を豊富に含む食事に起因する;および(c)その正常な血清レベルについて確立された基準がない。さらに、PGD2は血中で急速に代謝され、その代謝物である11β-PGF2αを測定することによって検出するのが最善であると先に議論した。ある論文では、MCASで研究された25人の患者のうち、24人の尿11β-PGF2αがほとんどの患者で上昇しており、潮紅やかゆみと最も相関していたと報告されている[166]。
ヘパリンは特異的な肥満細胞メディエーターであり、SM患者の血清中のヘパリンの上昇が記録されている[167]。
炎症性疾患がない場合、血清IL-6はSMにおける疾患の重症度および予後と相関することが示されている[168-170]。最近の論文では、CCL2の血清レベルの上昇が侵攻性SMと強く相関していることが報告されている[171]。我々は最近、SPまたはIgEの有無にかかわらず、IL-33で刺激された培養ヒト肥満細胞からの印象的なIL-31の分泌を報告した[44]。SPの増加したレベルは、SM患者の血清中に報告されている[172]。
4.3. 特発性アナフィラキシー
これらの患者は、(a)生命を脅かすアナフィラキシー反応、(b)エピソード間のトリプターゼのベースラインレベルの上昇、(c)肥満細胞のクローナリティの欠如、および(d)急性発症を特徴とする。アナフィラキシーは、IA患者(じんま疹が存在し、血清IgEが有意に上昇している)と低悪性度SM患者(アナフィラキシーエピソード中にじんま疹がなく、血清トリプターゼレベルが有意に上昇している)では異なる場合がある [112]。最近の証拠は、樹状細胞が細胞外マイクロベシクル(エクソソソーム)を介して皮膚の肥満細胞にアレルゲンを送達する可能性があることを示している[173]。明らかに、マスト細胞もまた、T細胞に特異的に指示される可能性のある細胞外マイクロベシクル[174]を分泌することができる[175]。
5. ヒスタミン感受性
また、ヒスタミンに敏感な患者や、ジアミン酸化酵素遺伝子に変異があり、ヒスタミンを代謝できない患者も考慮しなければならない。
6. 活性化閾値
肥満細胞が刺激されてメディエーターを放出することができる理由は、多くの理由が考えられる(表8)。引き金の組み合わせは、個々の引き金よりも重要であり、マスト細胞の刺激閾値を下げ、追加の引き金のためにマスト細胞を「プライム」することができるからである[176](表8)。異なるトリガーの相乗効果の例は数多くある。我々は、CRH と NT の組み合わせが、トリプターゼを介さずに VEGF の分泌を刺激すること[23]や、ヒト培養肥満細胞における互いの受容体の発現を誘導することに相乗的な作用を持つことを報告した[177]。また、NT[177]とSP[178]がヒト肥満細胞上でCRHR-1の発現を増加させることを示した。さらに、SPはIL-33受容体ST2の発現を増加させ、IL-33はヒト肥満細胞上のNK-1受容体を増加させた[60]。また、SCF による肥満細胞への刺激も ST2 を交差活性化させる [179]。
表8. 肥満細胞メディエーター障害のための提案された病原性機序
抑制性分子/経路の発現/機能低下による活性化閾値の低下
細胞内
- PTEN ↓
- コンドロイチン硫酸塩 ↓ ↓
- セルギリン↓
- スペルミン/スペルミジンン ↓
- TGFβ ↓
細胞外
- デフリスイン↓↓
- IL-10 ↓ ↓
- IL-37 ↓
- IL-38 ↓ ↓
- TGFβ ↓
非アレルギー性トリガーの組み合わせ
- ペプチドとサイトカイン
- SP + IL-33
- NT + CRH
- HK-1 + IL-33
認められていないトリガー
- CRH
- ボレリア毒素
- ブラッドキン
- CGRP
- RCAP
- マイコトキシン
- エヌジーエフ
- ポリ(ライセンス
- PTH
- ストレス
オートクリン効果
- 自己分泌メディエーターの分泌
- CRH
- NK-1
- ニューロテンシン
- トリプターゼ
オートクリン受容体の発現
- 自己分泌メディエーターの分泌
- NT→CRHR-1 ↑
- SP→CRHR-1 ↑
- CRH→NTR ↑の
- SP→STZ ↑
- IL-33 → NK-1 ↑
7. 合併症
症状の多くは、肥満細胞が関与しているかどうかにかかわらず、他の病理学的実体に由来するものである可能性があるため、症状と薬物療法に対する反応やその欠如だけでは診断には十分ではない。それにもかかわらず、他の全身疾患がなく、同時に多系統の症状が現れていることは、肥満細胞障害の存在を強く疑わせる。他の疾患に起因する可能性のある肥満細胞障害を示唆する症状には、以下のようなものがある。(a) 「潮紅」は、ナイアシンの摂取と同様に、更年期障害、カルチノイド症候群、褐色細胞腫、甲状腺の髄質癌にも関連している。b)心血管系の障害は、心筋梗塞、心内膜炎、自律神経機能障害(dysautonomiaおよび姿勢起立性頻拍症候群(POTS)に関連している可能性がある。 g. (d) 神経学的症状は、パニック発作、片頭痛、てんかん、中枢神経系(中枢神経系)腫瘍と関連している可能性がある。(e) 呼吸器症状は、喘息、「胸焼け」、血管性浮腫の一部でありうる;(f) 皮膚症状は、急性中毒性皮膚炎、乾癬、高副甲状腺ホルモン(PTH尋常性天疱瘡、および全身性エリテマトーデス(SLE)と関連している可能性がある。その他の併存疾患としては、冠動脈過敏症[180,181]、多発性化学物質過敏症症候群(表1)[182]などがある。特に関連する2つの疾患は、最近脳の局所炎症と関連している筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)とASD [81]である[183]。
肥満細胞症を持つ小児はASDを発症するリスクが10倍高いことを報告していた[184]。ASDは広汎性の神経発達障害であり、コミュニケーションの障害、および制限された反復的な行動の存在によって特徴づけられる[185-187]。肥満細胞から分泌されるメディエーターによるアレルギー症状は、ASDの重症度と有意に相関している[183,188]。最近の論文では、新規の体細胞性KIT変異K509Iを持つびまん性皮膚肥満細胞症が結節性硬化症と関連していることが報告されており、そのほとんどの患者がASDを有する可能性があるとされている[189]。大規模な疫学研究では、未就学児のアレルギーや喘息がASDと有意に関連していることが報告されている[190-193]。アトピー性皮膚炎とASDとの有意な関連を示した系統的レビューでも同様の結論が得られている[194]。さらに、アレルギー症状の存在は、ASDの小児における脳ペプチドに対する血清自己抗体の存在と強く相関していた [195,196] [197]。
炎症は、組織や引き金に応じて多数の成分が関与する複雑な免疫プロセスである [198]。脳の炎症におけるサイトカインの具体的な役割は、これらの「危険信号」[45]が現在では3つの異なるグループに分類されているため、まだ十分に理解されていない。(a)炎症性サイトカイン、(b)アラーミン、(c)ストレッサーインであり、分泌パターンと生物学的特性が異なる[199]。脳の自然免疫は主にミクログリア[200]が関与しており、マスト細胞[201,202]と通信している。ヒスタミンやトリプターゼなどのマスト細胞由来のメディエーターは、ミクログリアを活性化させることができる[203]が、ASDの子供の脳で増加することが知られているインターロイキンIL-1β、IL-6,TNFなどのプロ炎症性メディエーターの分泌につながる[204]。マスト細胞は脳内に存在する[205]が、特に視床下部、視床、第三脳室に存在する[206,207]。マスト細胞は、松果体、下垂体、甲状腺にも見られる[3]。
マスト細胞は、血液脳関門(BBB)の透過性を調節することができるため、「脳への免疫ゲート」[208]として機能することができ[209-211]、神経炎症や脳障害に関与している[76,212]。
したがって、適切な臨床評価のためには、症状の種類、期間、誘因を含む詳細な病歴、慎重かつ集中的な身体検査、および特定の臨床検査が必要である。MCD患者の親族の間では、MCDの有病率が偶然に予想されるよりも高いため、家族歴は非常に重要である[213]。
8. 治療アプローチ
8.1. 免責事項:治療法は議論されているが、安全性の保証や声明は暗示されていない
残念ながら、増殖性肥満細胞障害の遺伝的原因と、放出される複数のメディエーターの影響が、治癒的な治療法がない理由である[214-216]。誘因への曝露を制限し、症状を軽減することが治療の主な目的である。メディエーター、特にサイトカインの分泌を抑制することが望ましいであろう[39]。
一般的な誘因としては、アルコール、防腐剤、香辛料、熱、寒さ、薬物[抗生物質、非ステロイド性抗炎症薬(NSAIDsオピオイド、神経筋接合阻害剤]、放射性物質、ヒメノプテラ刺傷、物理的刺激(圧力、摩擦エストロゲン、およびストレスの多い状態が挙げられる[113]。鞭毛虫に対する反応はnc-MCADの症状である可能性があり[217]、これらの患者はジフェンヒドラミン(ベナドリル、好ましくは液体ゲル)と自己投与型の筋肉内エピネフーリン(エピペンまたはアナペン)を携帯すべきである。患者は通常、抗ヒスタミン薬、モンテルカスト、およびクロモリンを投与される(表9)。
表9. 肥満細胞メディエーター障害の治療アプローチ
1. 抗ヒスタミン薬(セチリジン、ジフェンヒドラミン、ヒドロキシジン)
2. 抗好酸球作用を有する抗ヒスタミン薬(ケトチフェン、ルパタジン)
3. 抗セロトニン作用を有する抗ヒスタミン剤(シプロヘプタジン)
4. 複合抗ヒスタミン作用を有する三環系抗うつ薬(ドキセピン)
5. フラボノイド(ルテオリン、高純度で吸収率アップのケルセチン
6. 抗ロイコトリエン(モンテルカスト)
7. クロモリンナトリウム
8. ステロイド(メチルプレドニゾロン)
9. エピネフーリン(エピペン、アナペン)
10. 抗IgE(オマリズマブ)
11. TK阻害剤(イマチニブ)
12. 変異型KITを発現する肥満細胞に対するキナーゼ阻害剤(ミトスタウリン、アバプリチニブ)
8.2. 抗ヒスタミン薬
肥満細胞の増殖と肥満細胞メディエーターの分泌を防ぐことが最終的な目標である。患者は通常、ヒスタミン(H1,H2)受容体拮抗薬(抗ヒスタミン薬)で治療される(表9)。第二世代の抗ヒスタミン薬(ロラタジン、セチリジン、フェキソフェナジン)が好まれるのは、鎮静作用が少なく、心臓の興奮に対する影響がないからである[218]。しかし、侵襲的処置(例えば、放射線学的検査)の前または最中には、第一世代のジフェンヒドラミンまたはヒドロキシジンが最良であろう。H1受容体拮抗薬であるケトチフェンもまた、弱い眼球肥満細胞阻害薬であり、第三の選択肢として使用されてもよい[219]。好酸球性食道炎または胃腸炎を呈する多くの患者は、抗血小板活性化因子(PAF)および抗好酸球性特性作用も有するルパタジンで治療するのが最善である[220];ルパタジンはまた、培養肥満細胞を阻害することができる[220,221]。H2-抗ヒスタミン薬(ラニチジン、ファモチジン)は、胃の過分泌をブロックするために使用される[117]。しかし、ヒスタミン-1受容体拮抗薬もまた抗コリン作用を有しており[222]、過剰投与は尿閉と関連しており[223]、精神状態に悪影響を及ぼす可能性がある[224,225]。
8.3. マスト細胞阻害薬
肥満細胞安定剤」という用語が一般的に使用されているにもかかわらず [226] 、そのような臨床的に有効な薬物は存在しない。肥満細胞安定剤」として知られるクロモグリク酸二ナトリウム(クロモリンナトリウム)は、腹部膨満感や痛みなどの大部分のGI症状を軽減する。クロモリンは経口投与され、用量を分けて投与される [117]。クロモリンはタキフィラキシー [227] を起こすため、1年かけて100mgチッドから400mgチッドに増量する必要がある。しかし、クロモリンは溶解しにくく、経口で吸収されるのは5%未満であり、患者の約15%に重度の下痢を引き起こす可能性がある。クロモリンはまた、患者の約 10% の脱毛症を引き起こすことができる。最近のデータでは、ヒト肥満細胞を安定化させるクロモリンの能力に疑問を投げかけている [228] ことさえあり、そう痒症に対するその有益な効果は、代わりにC線維末梢感覚神経の阻害によって媒介されているのではないかと思われる [229]。
8.4. ロイコトリエン受容体拮抗薬
肥満細胞症ではロイコトリエンE4の分泌増加が報告されている[230]。システイニル-ロイコトリエン受容体拮抗薬モンテルカストは、難治性の症状を有する患者、特に肺病変(喘息、喘鳴)を有する患者に使用されることがある。
8.5. アセチルサリチル酸
難治性の潮紅と尿中11β-PGF2aの上昇を有する患者の中には、プロスタグランジンの過剰産生を有するものがある [230]。これらの患者では、臨床的改善のためにアセチルサリチル酸(ASA)が有効である可能性がある [117,231,232]。しかし、他の患者は過敏症反応を経験し、脱感作治療を必要とすることがある[230,233]。
8.6. オマリズマブ
血清IgEが上昇しているかどうかにかかわらず、アレルギー性喘息および慢性じんま疹に承認されている抗IgEヒト化マウスmAbであるオマリズマブを頻繁に使用することで、患者は大きな利益を得ることができるだろう。オマリズマブはまた、病理学的にIgE値が上昇していない患者でも改善する[234]。オマリズマブは、遊離血清IgE分子のFc部分に可逆的に結合し、循環免疫複合体を形成し、肥満細胞や好塩基球上のFcεRIへのIgE結合を減少させる。その結果、FcεRIの発現はダウンレギュレートされ、驚くべきことに、他の誘因(例えば、圧力)に対するこれらの細胞の反応性も低下する[235]。オマリズマブの新しいバージョンであるメポリズマブも同様に適しているかもしれない。
しかし、オマリズマブは相補体固定免疫複合体を形成する可能性があり、重度の「血清病様反応」を含む重篤な過敏症反応を引き起こす可能性があるため、クリニックでの管理下での投与が必要である。米国FDAとEU EMAは、本剤に付随する専門情報にこれらの潜在的な重篤な副作用を記載するよう指示している。
オマリズマブが免疫系の構成要素を標的としていることを考えると、感染症や新生物のリスクを高める可能性がある。
8.7. コルチコステロイド
コルチコステロイドは、特にアナフィラキシーの急性エピソードからの蘇生後、皮下エピネフーリン(EpiPen)やβ-アゴニストの使用とともに、難治性の症状を持つ患者に大きな利益をもたらす可能性がある[117]。しかし、ステロイドに対する過敏症の例が報告されており、ステロイドの長期使用はアステオポローシス、うつ病と関連している。
8.8. 毒物免疫療法
昆虫に刺された後のMMCAS患者、特に毒特異的IgEが陽性であった場合には、生涯毒免疫療法(VIT)による治療が必要である[236]。この治療は生命を脅かす副作用を伴う可能性があるため、個々の患者のリスクとベネフィットを考慮した上で、管理下の診療所で慎重に実施すべきである。
8.9. 免疫Ig
他のすべてが失敗した場合、患者は免疫Ig(ivIg)で治療されることがある。
8.10. 特定の薬剤
D816V KIT変異を有さない進行性SM患者には、チロシンキナーゼ阻害薬(TKI)であるイマチニブが投与されることがある。別のTKIであるダサチニブは、D816V KITを発現する肥満細胞を試験管内試験で阻害するが、臨床試験での成功は証明されていない。最近承認されたプロテインキナーゼC(PKC)阻害剤(以前はPKC412として知られていた)であるミドスタウリンは、D816V KITを発現する肥満細胞を阻害することができ、最近では、侵攻性SMや肥満細胞白血病などのクローン性増殖性肥満細胞障害の進行型に対して承認された[237]。しかし、PKCは肥満細胞だけでなく、ほとんどの細胞に存在する重要な酵素であり、そのため、ベネフィットとリスクの評価は慎重に行われなければならない。実験的なTKIであるアバプリチニブ(以前はBLU-285として知られていた)は、変異したKIT肥満細胞を減少させる能力がさらに高いようである[238]。
8.11. フラボノイド
ケルセチン(3′,4′,5,7,9-ペンタヒドロキシフラボン)およびルテオリン(3′,4′,5,7-テトラヒドロキシフラボン-NOTルテイン、これはカロテノイドである)のようなフラボノイドは、強力な抗酸化作用、抗炎症作用、および複数の標的を阻害することによって作用する神経保護作用を有する天然に存在するポリフェノール化合物である[239-241]。より多くの水酸基を含むフラボノールは、より大きな抗酸化作用と抗炎症作用を持つことが以前に示されている[19,209,242]と同様に、抗喘息作用もある[218]。
8.11.1. ルテオリン
ルテオリンは肥満細胞を抑制し、気管支肺胞液中のヒスタミン分泌を減少させた。ルテオリン-7-O-グルコシドは、骨髄マスト細胞からの脱顆粒とロイコトリエン産生を阻害した[247]。ルテオリンはまた、ヒトT細胞[78]、ケラチノサイト[248]、アストロサイト[249]の刺激を抑制した。ルテオリンはミクログリアの活性化および増殖を阻害した[250-254]。ルテオリンを含有する製剤は、最近、ASDの小児において有意な効果があることが示された[242,255]。
ルテオリンはまた、神経保護作用[256-258]を持っており、ヒト肥満細胞[244]と同様にメチル水銀誘発性ミトコンドリア損傷[259]からチメロサール誘発性炎症性メディエーターの分泌から保護された。ルテオリンは神経成長因子(NGFグリア由来成長因子(GDGF脳由来神経栄養因子(BDNF)を含む神経栄養因子の合成と分泌を誘導した[260]。ルテオリンは、BDNF活性を有することが示された7,8-ジヒドロフラボンと構造的に関連しており[261]、ASDの症状を有する患者のほとんどが罹患しているレット症候群のマウスモデルで症状を軽減することが示されている[262]。さらに、3,4ʹ-ジメトキシフラボンはパルタナトスに対して保護効果があることが示された[263]。
ルテオリン、テトラメトキシルテオリンともに、ヒト白血病HMC-1マスト細胞における刺激的な細胞内カルシウム増加[245]やNF-κBの活性化をブロックした[264]。さらに、ポリフェノールは分泌小胞融合を阻害して肥満細胞の分泌を抑制することが報告されている[265]。ルテオリンの4つの水酸基をメトキシ基で置換することで、明らかに抗炎症活性が増強され、神経変性疾患への有用性が報告されている[266-268]。
フラボノイドは経口投与後に吸収されにくく(10%未満)[269,270]、広範囲に代謝される[270-272]。我々はルテオリンの構造アナログである3,4ʹ,5,7-テトラメトキシルテオリン(テトラメトキシルテオリン)を研究しており、ヒト培養ミクログリア[251]やマスト細胞[76]に対してルテオリンよりも強力な阻害剤である。食餌性フラボンのメチル化は代謝安定性と腸管吸収を大幅に改善した[273]。
フラボノイドは一般的に安全であると考えられており[274-277]、多くの薬物の一般的な結果である化学的に誘導された肝臓毒性から保護することさえできる[278]。さらに、ルテオリンもテトラメトキシルテオリンも、培養ヒト肥満細胞[245]、T細胞[78]またはケラチノサイト[279]の生存率に影響を与えません。ルテオリンはまた、ASD [242,280]、ポストライム症候群[281]、脳霧[139]の症状を改善したが、大きな副作用はなかった。
しかし、最も安価なソースはピーナッツ細胞と空豆であり、それぞれG6PD個体でアナフィラキシーまたは溶血性貧血につながる可能性があるため、ソースと純度が不明なフラボノイド製剤の使用には注意が必要である。
ルテトラメトキシルルテオリンを含むスキンローション[282]と一緒に使用するのが最善であり、肥満細胞が十分に阻害されるまでに数週間を必要とする。ルテオリンはまた、抗アレルギー作用があることが報告されているビタミンD3と併用してもよい[283]。
9. まとめ
肥満細胞メディエーター放出障害を有する患者の治療アプローチとして考えられるのは、以下の通りである(表9)。(1)抗ヒスタミン薬(セチリジン、ジフェンヒドラミン、ヒドロキシジン);(2)抗好酸球作用を有する抗ヒスタミン薬(ケトチフェン、ルパタジン);(3)抗セロトニン作用を有する抗ヒスタミン薬(シプロヘプタジン);(4)複合抗ヒスタミン作用を有する三環系抗うつ薬(ドキセピン)。(5)フラボノイド類(ルテオリン、高純度で吸収率の高いケルセチン);(6)抗ロイコトリエン類(モンテルカスト);(7)クロモリンナトリウム;(8)ステロイド類(メチルプレドニゾロン)。(9)エピネフーリン(エピペン、アナペン);(10)抗IgE(オマリズマブキナーゼ阻害剤(イマチニブ、ミトスタスリン、アバプリチニブ)は、侵攻性SMまたは肥満細胞白血病の場合には予約すべきである。
骨痛は肥満細胞障害の患者ではかなり一般的であり、対処すべきである[160,216]。肥満細胞を強く誘発するモルヒネとは異なり、合成オピオイドのトラマドールとピリトラミド(米国では入手できない)は忍容性があるようである。ケタミンやプロポフォールは、単独またはロアラタジンと併用して麻酔に用いることができる。一部の患者は経皮吸収型フェンタニルにも耐性がある。オピオイド受容体拮抗薬である低用量のナルトレキソンも有用であろう。
片頭痛の患者には、シプロヘプタジンまたはプロクロルペラジンが予防的に有効であるが、これらはいずれもヒト肥満細胞を阻害する [284]。
10. 専門家の意見
最近のレビューでは、健康[285]および疾患[215,286]における肥満細胞の役割、特に非アレルギー性誘因に対する反応性が強調されている[286,287]。KIT変異を定義し、肥満細胞増殖に関与するチロシンキナーゼ(TK)をブロックする薬剤の開発にはかなりの進歩があった[288]。しかし、KIT変異だけでは肥満細胞増殖障害を誘発できないことが明らかになってきており、最近の治療薬研究の目的はマルチターゲット薬の開発である。さらに、非IgE媒介性誘因による肥満細胞刺激についての理解はまだ不十分であり、肥満細胞媒介物質放出の臨床的に有効な阻害剤はまだ存在しない。この問題の考えられる理由の一つは、げっ歯類肥満細胞の使用に過度に依存していることであり、その結果はヒトの炎症性疾患を反映していないことが次第に示されてきている[289]。
さらに、末梢血または臍帯血から培養した不死化マスト細胞および一次正常マスト細胞はいずれも、8~12週間の増殖を必要とし、分泌顆粒の発達が不十分な「未熟」な細胞である[60]。より重要なのは、異なる組織からの肥満細胞は、表現型的に非常に異なっている[290]。例えば、脳の肥満細胞はFcɛRI [207]を発現していない、皮膚の肥満細胞は、心臓の肥満細胞ではないが、モルヒネによってトリガされている。さらに、サイトカイン/ケモカインの放出や他のメディエーターの違いもまだわかっていない。病理的な機能と比較して、有用な生理機能に寄与すると考えられるメカニズムやメディエーターを同定し、それらを刺激したり、阻害したりすることが望まれる。例えば、マスト細胞は、糖尿病の創傷治癒を調節することが報告されているが[291]、癌の増殖および転移に寄与することが報告されている[292]。
最後に、松果体、視床下部、下垂体、甲状腺、子宮などの神経内分泌器官にマスト細胞が存在するという謎がある[3]。これらの所見は、MCMDを持つ多くの女性が性欲とオーガズムの増加を報告しているという我々の観察結果を説明している可能性がある[3]。興味をそそられる関連する観察は、求愛中の雌ハトの手綱骨のマスト細胞数の増加であり[293]、マスト細胞が刺激された新生雌ラットでは雌の「表現型」が発達していた[294]。
研究の焦点は、(a)異なる組織を模倣した正常なマスト細胞培養の確立、(b)マスト細胞がメディエーターを選択的に放出して異なるトリガーに応答する能力の研究、(c)マスト細胞の炎症性メディエーター放出に関与する分子イベントの同定、(d)NGFや血小板由来成長因子(PDGF)などSCF以外の成長因子の役割の研究、(e)マスト細胞との相乗効果の研究である。(e)SPやIL-33などのトリガーの相乗作用の研究;(f)細胞外マイクロベシクルの役割の決定[295]。(g)ポリアミンのアグマンチン(アルギニンの脱炭酸の産物)[296]、スペルミジンとスペルミン(オルニチンの脱炭酸の産物)[297,298]、ヘパリンとコンドロイチン硫酸[299]のような生来の阻害剤を同定する。
ある論文では、IL-1βおよびCXCL8のFcεRI刺激マスト細胞分泌を選択的に調節するが、TNFまたはMCP-1は調節しない、プロトタイプの阻害性受容体(マスト細胞機能関連抗原、MAFA)について報告されているが、明らかなさらなる開発はなされていない。
抗炎症性サイトカインIL-37 [301-303]の潜在的なマスト細胞阻害能力には、少なくともマスト細胞が関与している疾患において、最近関心が寄せられているが[303,304]、ヒトマスト細胞の直接的な阻害は今のところ報告されていない。
記事のハイライト
- 特定の基準の場合はMCMDという用語を使うべきである。
- トリプターゼは肥満細胞に特異的であり、診断に用いられるが、分泌されないことが多く、その機能はいまだに不明である。他の血清肥満細胞メディエーター、特にIL-6およびIL-31,ならびにCCL2およびCXCL8,および尿(24時間)ヒスタミン代謝物(メチルヒスタミン、MIAPGD2代謝物(11β-PGF2αおよびLTE4の測定は、他の炎症性疾患がない場合に考慮されるべきである。
- 肥満細胞のための組織切片のスクリーニングは、CD117(すべての肥満細胞を同定する)とトリプターゼ(脱顆粒された肥満細胞を同定する)の免疫組織化学を組み合わせるべきである。
- 肥満細胞の表現型の多様性とメディエーターの合成/放出をin situで同定するために、シングルセルレーザーマイクロキャプチャーとqRT-PCRを使用する必要がある。
- 肥満細胞は概日時計によって制御されていることが示されているため、肥満細胞メディエーターの測定タイミングと患者の症状に特別な注意を払う必要がある。
- 現在のところ、MCMDの治療法はない。肥満細胞の刺激を防ぎ、肥満細胞メディエーターの影響を軽減することが必要である。適応と忍容性に応じて段階的に治療を増やすことが推奨される。
有効な肥満細胞阻害剤の開発を最優先すべきである。テトラメトキシルテオリンおよびIL-37の使用による最近の有望な結果は、適切な剤形で拡大されるべきである。