alz-journals.onlinelibrary.wiley.com/doi/full/10.1002/alz.12113
要旨
序論
いくつかの薬理疫学的研究では、プロトンポンプ阻害薬(PPI)が認知症のリスクを有意に増加させることが示されている。しかし、その根本的なメカニズムは明らかにされていない。本研究では、プロトンポンプ阻害薬が認知症リスクを増加させるメカニズムを説明するために、これまでにないプロトンポンプ阻害薬の作用機序を発見したことを報告する。
研究方法
アセチルコリン(ACh)の生合成を担うコアコリン作動性酵素であるコリンアセチルトランスフェラーゼ(ChAT)に対して、PPIの高度なin silicoドッキング解析および詳細な酵素学的評価を行った。
結果
この報告書は、PPIがChATの阻害剤として作用することを説得力のある証拠を示しており、高い選択性と、その生体内試験の血漿および脳濃度をはるかに下回る前例のない効力を持つ。
考察
コリン作動性機能障害が主要な認知症疾患の原動力であることを示すエビデンスが蓄積されていることを考えると、我々の知見は、PPIの長期使用が認知症の発症率を増加させる可能性があることを機械的に説明するものである。このことから、高齢者や認知症患者、筋萎縮性側索硬化症患者におけるPPIの長期使用を制限することが求められている。
1 はじめに
コリン作動系は、体内で最も古く、最も広く普及している神経系および非神経系のシグナル伝達系の一つであり、進化の観点から、多様な生物学的プロセスや器官において制御機能を獲得していた。コリン作動性ニューロンとその突起は、アセチルコリン(ACh)の生体合成酵素であるコリンアセチルトランスフェラーゼ(ChAT)の細胞内存在によって同定される。ACh受容体を発現する他のすべての下流のニューロンおよび非興奮性細胞は、コリン受容性細胞である。Ch1とCh2は海馬複合体を、Ch3は嗅球を支配している。これらのコリン作動性核と脳全体に広がる神経突起は、最近、前脳基底部の個々のニューロンの形態と接続性とともに、3D全脳アトラスとして詳細にマッピングされた2。さらに、13本の頭蓋神経(副交感神経系を構成するCN0とI-XII)に由来する広範なコリン作動性神経突起が全身に達し、それによって多様な器官、筋肉、腺の自律神経機能を制御している4,5。
文脈での研究
- システマティックレビュー。PubMed 検索を用いて文献をレビューした。評価された文献のリファレンスリストは、関連論文のためにさらにスクリーニングされた。いくつかの薬理疫学的研究から、プロトンポンプ阻害薬(PPI)への長期暴露は認知症リスクを有意に増加させることが示されているが、この関連性の根本的なメカニズムは明らかにされていない。しかし、この関連性の根本的なメカニズムは明らかにされていない。コリン作動性機能障害が主要な認知症疾患の原動力であることを示すエビデンスが蓄積されていることから、我々はPPIがコリン作動性酵素、特にコリンアセチルトランスフェラーゼ(ChAT)の機能を変化させるかどうかを検討した。
- 解釈。ヒトのChAT構造のin silico分子ドッキング解析により、PPIはChATと相互作用することが明らかになった。ChATタンパク質の試験管内試験での初期解析では、PPIとChATの相互作用がChAT活性を有意に阻害することが確認された。さらなる系統的な酵素学的解析により、PPIは前例のない高い選択性と可逆性を持つChAT阻害剤として作用することが示された。ヒトにおけるこれらの薬剤の既知の濃度との比較から、PPIが有意な抗コリン作用を示す可能性が高いことが示唆され、ヒトにおけるPPIの有害事象がいくつか記録されている。これらの知見は説得力のあるものであるため、高齢者や認知症の患者には特に注意して、PPIは可能な限り短期間処方されるべきである。
- 今後の方向性。今後の方向性:PPIの抗コリン作用の臨床的意義を確認するためには、血漿中および脳脊髄液中のPPI濃度の測定と併せて、今後の薬理疫学的研究が大いに必要である。
原因や分子機構の違いに関わらず、様々な神経変性疾患(一般的に認知障害や運動障害の発現につながる)では、コリン作動性ニューロンネットワークの変性が最も重要な特徴となっている。例えば、アルツハイマー病は、レビー小体型認知症(DLB)パーキンソン病認知症(PDD)ダウン症(DS)と共通して、脳全体のコリン作動性神経突起の早期かつ重度の変性が主な特徴の一つである7-13。また、線条体には黒質系を標的とするコリン作動性介在ニューロンが存在し、パーキンソン病14,皮質基底変性症候群(CBD)や進行性核上性麻痺(PSP)に関与している。 15-19 もう一つの特に壊滅的な神経変性疾患は、筋萎縮性側索硬化症(ALS)であり、コリン作動性運動ニューロンの高度に選択的な変性が重要な病態生理学的所見の一つである致命的な運動ニューロン疾患である。死後のALS研究では、大型の運動ニューロンの数とChATの陽性率の両方が著しく低下していることが示されている20, 21。
22, 23 興味深いことに、ある報告では、ALS患者の脊髄運動ニューロンに細胞内アミロイドβが蓄積していることが示されている。いくつかの証拠から、アミロイドβペプチドとコリン作動性機械とニューロンの完全性との間には、アミロイドβペプチドがコリン作動性機械のいくつかの構成要素、すなわちアセチルコリンエステラーゼ(AChE)ブチリルコリンエステラーゼ(BChE)高親和性コリントランスポーター、およびコアとなるACh生合成酵素ChATとの直接的なアロステリック相互作用を通じて調節的な役割を果たしていることが示唆されている。
蓄積された証拠はさらに、コリン作動性機能障害が臨床症状の発現よりも ずっと前に起こる可能性があることを示している。29 同様に、ALSの初期症状には通常筋力低下が含まれており、コリン作動性の運動ニューロンが疾患の経過の中で早期にかつ進行的に影響を受けていることが示されている。30, 31 これらのことは、アミロイドβペプチドとコリン作動性機能の間に明らかに密接な相互ループがあることと相まって、コリン作動性機能障害がアルツハイマー病の結果というよりもむしろ推進力となっている可能性を示唆している。この仮説に沿って、抗コリン作用を有する薬剤への長期的・累積的な曝露は、単に認知症に似た臨床症状をもたらすだけでなく、実際に認知症の発症率を増加させることが報告されている多くの薬理疫学的研究から得られた知見がある。
それにもかかわらず、認知症の発生率と他の薬剤の使用との間には、同様の薬理学的疫学的関連性が報告されているが、現在のところ抗コリン作用を有する薬剤の有害性は知られていない。代表的な例としてプロトンポンプ阻害薬(PPI)があり、いくつかの薬理学的疫学的研究でPPIは認知症のリスクを有意に増加させることが示されている41-44(議論がないわけではないが45)。PPIは、胃食道逆流症や消化性潰瘍などの多酸性障害の管理に使用される最も一般的な薬の一つであり、その多くは市販されている。
現在のところ、PPIへの曝露と認知症リスクの増加との間には、信頼できる基礎的なメカニズムは存在していない41-43。ここで、我々はPPIが同定された抗ChAT活性を介してAChの生合成を低下させることで認知症リスクを増加させるというもっともらしいメカニズムを示しているだけでなく、コリン作動系の機能不全がアルツハイマー病型認知症の原動力であると考えるべきであるという仮説を報告する。
2 材料と方法
2.1 in silico解析
最初のバーチャルスクリーニングを経て同定された米国食品医薬品局(FDA)承認PPI医薬品を対象にin silicoドッキング解析を行い、ChATタンパク質の活性部位での結合様式を明らかにした。タンパク質データバンク(PDB)データベースからChAT(PDB ID: 2FY3)46の結晶構造をし、水素添加、側鎖修復、末端処理、原子型固定、プロトン化状態設定、結合次数固定、電荷添加、側鎖アミド固定を行い、ChATの3次元構造を作成した。準備された構造は、以前のタンパク質調製ステップの間に生じたひずみを除去するために最小化された。ChATの活性部位に共結晶化したリガンドを用いて、定義された結合ポケット、すなわち「プロトモール」を生成した。薬物の化学構造は、RとSの両方の立体異性体を網羅してスケッチされ、3次元構造に変換された。血液脳関門(BBB)透過性を有する化合物の選択を確認するために、ライブラリは、以前に詳細に説明したように、BBB透過性を有する可能性のある中枢神経系(中枢神経系)薬物のための修正リピンスキーパラメータと比較してスクリーニングされた48 。最後に、準備した化合物のデータセットは、SYBYL-X 2.1.149でインターフェースされたSurflex-Dock GeomX(SFXC)モジュールを使用してChATの活性部位にドッキングされ、化合物はTotal_Score(-logKd)を使用してランク付けされた。
選択した化合物の理論的親油性(BBB透過性の指標として)は、与えられたpH値における化合物のオクタノール-水係数を表すlogD値のin silico計算によってさらに推定された。計算は ChemAxon 社の Instant JChem 18.8.0 ソフトウェアを用いて 6.5~8.0 の pH 範囲で行った。
2.2 試験管内試験酵素動力学的分析
2.2.1 組換えヒトChATの精製
26, 27, 48, 50 簡単に言うと、DYT培地に、pProEXHTa-ChAT(Brian Shilton50 からの寛大な贈り物)で形質転換した大腸菌 BL21 Rosetta2 細胞の前培養物を接種した。菌体を37℃で増殖させ,0.5 mM IPTGで0.5 ODで誘導した。His6-ChATを18℃で約16時間発現させた。その後、細胞を採取し、製造者の指示に従って「Ni-NTA fast start Kit」(Qiagen)を用いてHis6-ChATを精製した。溶出バッファーを、30 kDaカットオフAmicon Ultra濃縮器(Merck Millipore)を用いて、保存バッファー(10 mM Tris pH 7.4,500 mM NaCl、10% [v/v]グリセロール)に交換した。ChATタンパク質は、カロリンスカ研究所/SciLifeLab(http://ki.se/psf)のProtein Science Facility(PSF)により作製し、精製した。タンパク質調製物をアリコートし、ドライアイス上で凍結し、-80℃で保存した。タンパク質の純度は、クーマシーブルー色素で染色したドデシル硫酸ナトリウムポリアクリルアミドゲル(SDS-PAGE)を用いて決定した。総タンパク質濃度は、BioRad DC protein Assay(BioRad)を用いて測定した。
2.3 試験管内試験でのハイスループット酵素キネティックアッセイ
2.3.1 AChEおよびBChE活性阻害アッセイ
Ellmanの比色アッセイの修正バージョンを設計し、以前に記載したように、リアルタイムでBuChEおよびAChEの酵素活性に対するin silicoヒットの活性をモニターするために、ハイスループットアッセイ用に適応させた48。試薬、ヨウ化ブチリルチオコリン(BTC)ヨウ化アセチルチオコリン(ATC)5,5′-ジチオビス(2-ニトロ安息香酸;DTNB)は、シグマ-アルドリッチ(セントルイス、MO、米国)から購入した。アッセイは、Nunc 384ウェルプレート上で実行した。簡潔に言えば、プールされたヒト血漿の1:1600希釈溶液および1:750希釈(最終濃度133 ng/mL)精製組換えヒトAChEタンパク質(シグマ、猫番号C1682)の25μL/ウェルを、それぞれBuChEおよびAChE活性の測定のために使用した。ウエルは、室温で30分間、100μM濃度のin silicoヒットの25μL/ウエルでプレインキュベートした。コントロールウェル(ヒットなし)には、バッファのちょうど25μL/ウェルを添加した。30分後、DTNB(最終濃度0.4 mM)とBTC(最終濃度5 mM)またはATC(最終濃度0.5 mM)を含む、Na / Kリン酸緩衝液で調製したカクテルミックスの25μLを各ウェルに添加した。プレートをマイクロプレート分光光度計リーダー(Infinite M1000,Tecan)を用いて読み取り、吸光度の変化を波長412nmで30秒間隔で15〜20分間モニターした。ネガティブコントロールは酵素を含まないウェルとし、各ヒットはオクテプリケートで行った。
2.3.2 フルオロメトリー ChAT 阻害アッセイ
26, 27, 48 試薬、塩化コリン、アセチルコエンザイムA(ACoA, A2181)および7-ジエチルアミノ-3-(4-マレイミドフェニル)-4-メチルクマリン(CPM)は、シグマアルドリッチから購入した。ChATアッセイは、以前に記載されているように、96ウェルまたは384ウェルプレートのいずれかでリアルタイムで実行することができた26, 27, 48
初期活性阻害スクリーニングを96ウェルプレートを用いて行った。簡潔に言えば、希釈緩衝液(10mM Tris-HCl、pH7.4,150mM NaCl、1.0mM etyhlenediaminetetraacetic acid [EDTA],0.05% [v/v])中で,0.212μg/mL(最終濃度)の組換えChATを100μMの異なるin silicoヒット(50μL/well)で室温で10〜30分間インキュベートした。Triton X-100)を添加した。) 次に、カクテルA(塩化コリン[最終濃度150μM]、ACoA[最終濃度13.3μM]、およびCPM[最終濃度15μM]を含む希釈緩衝液)50μLを各ウェルに添加した。カクテルAを添加した直後に、マイクロプレート分光光度計リーダー(Infinite M1000,Tecan)を用いて15〜20分間、1〜2分間隔で390nmで励起した後、479nmで蛍光の変化を動態的にモニターした。
各in silicoヒットを少なくとも3回繰り返して実施した。各96ウェルプレート上で、阻害剤を含まないいくつかの酵素ウェルもまた、対照として、および阻害レベルを推定するために、測定中に含まれた。ネガティブコントロールは、酵素を含まないウェルであった。各ヒットに対するパーセンテージ阻害は、基準としての酵素コントロール値(100%活性)に基づいて計算した。酵素のリアルタイムキネティクスを評価する場合は、フルオロメトリーChATアッセイを使用した。酵素活性の 98%以上の阻害を示したトップヒットは、さらなる速度論的研究のために選択された。
2.4 トップヒットの酵素反応パラメータ(Ki、IC50,および作用モード
酵素速度論的研究のために、阻害アッセイと同様のプロトコルに従った; μMからnMまでの範囲の5つの異なる濃度の希釈シリーズは、各選択されたトップヒットについて調製した。酵素速度論については、塩化コリンの濃度を320〜10μMの間で変化させたが、AcoAは10μM(最終)で一定に維持した。各PPI化合物濃度は二重に測定した。酵素活性の速度(∆FU/時間のキネティックデータとして)を計算し、GraphPad Prism 8解析ソフトウェアを使用して解析した15。阻害定数(Ki)値は、用量反応曲線から決定し、半最大阻害濃度(IC50)値は、酵素活性の割合対化合物濃度の対数をプロットし、非線形回帰酵素キネティクス阻害関数を使用してデータをフィッティングすることによって計算した。
ミケリス・メンテン定数(Km)および最大速度(Vmax)値は、非線形回帰ミケリス・メンテン運動関数を用いてデータをフィッティングした後、基質速度曲線から計算した。さらに、データは Lineweaver-Burk プロットをプロットするために使用され、プロットは線形回帰関数を使用して適合された。
3 結果
3.1 PPIはヒトChATに対して高いin silicoスコアを示す
コリン作動性ニューロンとその広範な脳内投影をマッピングするための新しい生体内試験ポジトロン断層撮影(PET)イメージングトレーサーの開発のための進行中の研究プロジェクトの文脈で、私たちは、FDA承認薬のサブセットのin silicoスクリーニングを開始した(図1A)。このin silicoスクリーニング解析により、すべてのPPI(オメプラゾール、ランソプラゾール、パントプラゾール、ラベプラゾール、テナトプラゾール、イラプラゾール)をヒトChATの潜在的なリガンドとして同定した。次に、すべてのPPIについて高度なin silico分子ドッキング解析を行ったところ、すべてのPPIはコアとなるコリン作動性酵素ChATに対して高いin silico結合スコアを示した(表1)。最も一般的なPPIであるオメプラゾール、ランソプラゾール、パントプラゾールの3Dおよび2D表現を図1Bに示す。最初に、これらのin silico高得点PPIは、その後、100μMの単一濃度での社内リアルタイムキネティックChATアッセイ26,48によって試験管内試験でスクリーニングされた。このスクリーニング条件では、すべてのテストされたPPIは、ChAT酵素の活性のほぼ完全な阻害を示した(図1C)。注目すべきは、オメプラゾールのS-エナンチオマー、すなわちFDA承認薬であるエソメプラゾールを単独で試験したことである。エソメプラゾールはまた、この最初の試験管内試験スクリーニングにも合格した。
図1
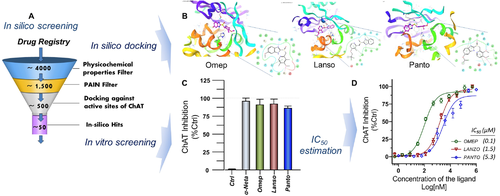
米国食品医薬品局の医薬品登録からの新規コリンアセチルトランスフェラーゼ(ChAT)阻害剤の同定のためのin silicoおよび試験管内試験スクリーニングのワークフロー。A、in silicoスクリーニングの手順と最も重要な選択フィルター。詳細については、材料と方法のセクションを参照してほしい。これらのin silico解析により、プロトンポンプ阻害剤(PPI)がトップスコアリング化合物として同定された。B、ChATの触媒ドメインの結合ポケット内のオメプラゾール、ランソプラゾール、およびパントプラゾールのそれぞれのドッキング解析の結果。インセットは、化合物の結合の2次元表示である。C、薬剤の100μMの単一濃度での高in silicoスコアリングPPIの初期試験管内試験スクリーニングの結果。基質濃度は、コリンについては150μM、アセチルコエンザイムAについては10μMであり、PPIおよびα-NETA(既知の市販のChAT阻害剤)の阻害効果を、緩衝化されたコントロール(Ctrl、阻害剤なし;100%活性)の存在下での酵素の活性と比較した。D、最も一般的に使用されるPPI、すなわちオメプラゾール、ランソプラゾール、およびパントプラゾールについての半最大濃度(IC50)推定曲線。IC50値は、GraphPad Prism 8の非線形回帰関数を用いて用量反応曲線にフィッティングした後に算出した。値は平均値±平均値の標準誤差として示した。オメプ=オメプラゾール、ランソ=ランソプラゾール、パント=パントプラゾール
表1. コリンアセチルトランスフェラーゼの代表的な同定リガンドのin silico分子ドッキングスコア
化合物名 a Total_score (-logKd) b Crash c Polar
(R)-オメプラゾール 9.457 -4.158 3.373
(S)-オメプラゾール 9.374 -2.706 1.653
(R)-ランソプラゾール 7.803 -0.766 0.547
(R)-パントプラゾール 8.457 -1.253 3.297
(S)-パントプラゾール 9.151 -2.409 2.248
(R)-テナトプラゾール 8.433 -2.257 1.262
(S)-テナトプラゾール 8.782 -1.236 1.586
(R)-ラベプラゾール 9.902 -2.659 3.855
(S)-ラベプラゾール 9.013 -3.44 1.912
(R)-イラプラゾール 8.774 -2.376 2.378
(S)-イラプラゾール 7.55 -1.714 2.478
a トータルスコアは、-log(Kd)で表されるSurflex-Dockのトータルスコアである。
b クラッシュは、タンパク質へのリガンドの不適切な浸透、および回転可能な結合によって分離されたリガンド原子間の相互浸透(自己衝突)の程度を表する。クラッシュスコアが0に近いものは良好である。
c 極性は、総スコアに対する極性相互作用の寄与度である。
さらに、オメプラゾールまたはエソメプラゾールの主要代謝物の一つであるオメプラゾールスルホンを試験した51 。このことから,オメプラゾールの主要代謝物であるオメプラゾールは,脳内 ChAT に対する生体内試験 活性は,あるとしても非常に弱いものと考えられた。
3.2 ヒトのChATに対するPPIのIC50値は低マイクロモル範囲である。
次に、最も一般的に使用されているPPIであるランソプラゾール、オメプラゾール(およびエソメプラゾール)パントプラゾールのIC50値を決定した。これらの解析は、ChATがAChの生合成に必要とするコリンを150μM、アセチルコエンザイムA(アセチル-CoA)を10μMの基質濃度で行った。これらの解析から,オメプラゾール,ランソプラゾール,パントプラゾールは,それぞれ0.1μM,1.5μM,5.3μMのIC50値から推察されるように,ChATを著しく阻害することが明らかになった(図1D)。このことから,ChAT阻害剤としてのオメプラゾールは,ランソプラゾールやパントプラゾールに比べて約15~50倍の強力な阻害力を有していることが示唆された。オメプラゾールのSエナンチオマーであるエソメプラゾールのIC50は0.05~0.07μMであった。このIC50の範囲は、ChAT阻害剤としてのオメプラゾールのIC50の約半分である。オメプラゾールはラセミ混合物であり、ある濃度で50%のエソメプラゾールが含まれている。したがって,オメプラゾールのラセミ体による ChAT 阻害は,エソメプラゾールが完全に関与していると考えられる。
3.3 ヒトのChATに対するPPIの阻害定数(Ki)はナノモルの範囲である。
しかし、IC50 値は酵素基質の濃度などによって変化しやすく、ある条件下ではIC50 の解釈にやや問題がある。そこで我々は、基質と薬剤の複数濃度を含む系統的な酵素阻害動力学解析を行った。これにより、最も信頼性の高い阻害定数(Ki)と、ChATの阻害剤としてのPPIの作用機序を決定した。
その結果、オメプラゾールのKiは70~140nM、エソメプラゾールのKiは50~70nMであった(図2A)。非線形酵素-リガンド動態解析の結果、このPPIはコリン濃度に対して高い確率で(99%以上)ChATの混合競合的可逆的阻害剤として作用することが示された。この作用モードは、図3Aの古典的なLineweaver-Burkプロット分析によってもグラフ化されている。この作用モードの重要な意味合いは、オメプラゾール(および/またはエソメプラゾール)は、酵素の状態(すなわち、遊離状態にあるか、基質コリンと結合しているか)に関係なく、酵素に高い親和性で結合するということである。それはまた、コリンの内因性生体内試験濃度が、化合物が完全な競合阻害剤として振る舞うときに予想されるように、この化合物によるChATの阻害を最小限に防ぐことができることを意味する。
図2 最も強力なプロトンポンプ阻害剤の酵素阻害速度解析
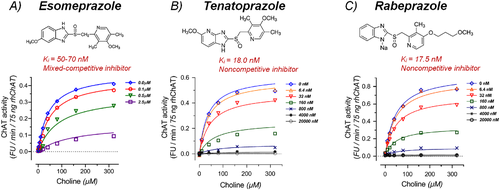
グラフ(A)(B)および(C)は、それぞれエソメプラゾール、テナトプラゾールおよびラベプラゾールの特定濃度の存在下で、基質であるコリン(10から320μMの範囲)の異なる濃度でのコリンアセチルトランスフェラーゼ(ChAT)酵素活性の基質速度曲線を示している。また、各化合物の二次元構造も掲載した。非線形回帰分析を用いて阻害定数(Ki)値および阻害モードを推定したが、これらは(A)-(C)にも示されている。これらは、GraphPad Prism 8を用いて決定した。値は、平均±平均標準誤差(SEM)として示されている。小さなSEM値のためにエラーバーが見えないことに注意する必要がある。
図3 コリン-アセチルトランスフェラーゼ(ChAT)阻害剤としてのプロトンポンプ阻害剤の作用モードのLineweaver-Burkプロット図
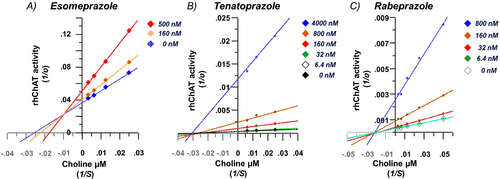
A、エソメプラゾールは、線がx軸上で互いに交差しているため、混合競合可逆性リガンドとして振る舞う。BとC、線がx軸上で互いに交差しているので、テナトプラゾールとラベプラゾールは、それぞれChATの非競合的可逆性リガンドとして振る舞う。
さらに,他の2つのPPIがエソメプラゾールよりもさらに高いChAT阻害活性を示した。テナトプラゾールは18nMのKi値を示し(図2B)ラベプラゾールは17.5nMのKi値を示した(図2C)。また,両者とも非競合的な可逆性ChAT阻害剤として作用した(図3BおよびC).非競合的な作用モードは、ラベルプラゾールとテナトプラゾールの両方が遊離酵素とコリン結合酵素の両方に対して同等の高い親和性を有し、基質であるコリンの生体内濃度に関係なくChATを阻害することができることを示唆している。
ChATは、コリンとアセチル-CoA(またはAChと-CoA)という2つの基質を同時に利用する酵素である。そこで、アセチル-CoAに関するPPIのKi値と作用モードを調べた。オメプラゾールおよびエソメプラゾールについて、アセチル-CoAの濃度範囲が0〜100μMの場合の酵素動態解析を行った。その結果を図4に示す。非線形回帰分析では、オメプラゾールについては6.5μMのKiが推定された(3.2〜9.7μMの範囲、図4A)。また,エソメプラゾールのKiは4.2μM(2.2~16.0μM,図4B)であった。これらの分析はさらに、99%の確率で、オメプラゾールがアセチル-CoAとの関係では混合競合阻害剤として振る舞うのに対し、エソメプラゾールは完全競合阻害剤のように振る舞うことを示した(図4)。
図4 基質としてのアセチル-CoAに関して、最も強力なプロトンポンプ阻害剤(PPI)の酵素阻害動力学解析
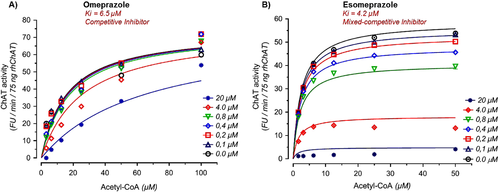
AおよびB、基質であるアセチル-Co酵素A(ACoA)の濃度が異なる場合のコリン-アセチルトランスフェラーゼ(ChAT)酵素活性の基質速度曲線(それぞれ、様々な濃度のオメプラゾールおよびエソメプラゾールの存在下で)。値は、平均±平均の標準誤差(SEM)として示されている。SEM値が小さいため、エラーバーは見えないことに注意する必要がある。半最大阻害定数(Ki)値とリガンドの作用モードは、GraphPad Prism 8を用いたACoA結合部位の非線形回帰分析によって決定された。
3.4 PPIはChATの強力な阻害剤として知られているα-NETAよりも高い効力を持つヒトChATを阻害する
これらの化合物の効力を十分に理解するために、私たちは最も強力なChAT阻害剤として知られているα-NETAという市販の化合物についても試験を行った。
3.5 PPIはヒトChATに対して関連酵素よりも高い選択性を示する
ChAT酵素の酵素ポケットは、AChまたはコリンを基質とする他の酵素と類似点を共有している可能性がある。したがって、我々は、PPIがコリンオキシダーゼ(コリンをベタインに酸化する)およびAChシグナル伝達を終了させるためにシナプスに放出されたときにAChを加水分解するAChEおよびBChEの活性にどのように影響を与えるかを試験した。
100μMの高いスクリーニング濃度では、5つのPPIのうち4つは、ヒトAChEの30%未満の阻害を示した(図5A)。これらのPPIは、ヒト血漿BChE活性の10%未満の阻害を示した(図5B)。これらのPPIのいずれも、コリンオキシダーゼの活性に影響を与えなかった(データは示されていない)。
図5
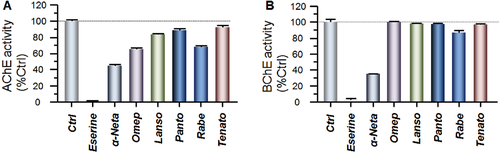
コリン-アセチルトランスフェラーゼ(ChAT)関連コリン作動性酵素に対するプロトンポンプ阻害剤(PPI)の阻害作用。A、各PPIの100μMの単一濃度でのアセチルコリン分解酵素アセチルコリンエステラーゼ(AChE)に対するPPIの活性の結果。B、ブチリルコリンエステラーゼ(BChE)の対応する結果。AChEおよびBChEの公知の阻害剤であるエセリンをポジティブコントロールとして使用し、PPIとの比較には公知のChAT阻害剤であるα-NETAを使用した。薬物の非存在下での酵素の活性をコントロールとして使用した(Ctrl:阻害なし、100%活性)。各化合物をオクタプリプリケートで実行し、データは平均値±平均値の標準誤差として示した。オメプ=オメプラゾール、ランソ=ランソプラゾール、パント=パントプラゾール、ラーベ=ラベプラゾール、テナト=テナトプラゾール
PPIのChATに対するIC50またはKiが0.017から5.3μMの間であることを考慮すると、これらのPPIは、少なくとも20(100μM/5.3μM)から5800倍(100μM/0.017μM)の間で、AChEまたはBuChEよりもChATに対して高い親和性を示した。比較として、α-NETA(既知のChAT阻害剤)は、AChEとBuChEの両方で34μMであったのに対し、ChATでは88nMのIC50値を示し、ChATに対する選択性が386倍であることを示している27。
ChATに類似した様々なアシル転移酵素もまた、その基質の一つとしてアセチル-CoAを使用しており、PPIがこれらの酵素も阻害するのではないかという疑問が生じている。図4に示すように,オメプラゾールは6.5μM,エソメプラゾールは4.2μMであった。コリンを基質とする ChAT に対するオメプラゾールの Ki 値が∼0.1 μM であることから、オメプラゾールは ChAT 上のアセチル-CoA 結合部位に対する親和性・選択性が少なくとも 65 倍(6.5/0.1 = 65)低いことがわかった。エソメプラゾールのアセチル-CoAに対する対応するKi値(4.2μM)とコリン(0.05-0.07μM)を比較すると、アセチル-CoA部位に対するエソメプラゾールの選択性が60〜84倍(4.2/0.07=60または4.2/0.05=84)低いことが示唆された。これらの解析から、PPIはアセチル-CoAを基質とし、コリンを基質としない他のアシル化酵素に対する活性が少なくとも60~80倍低いことが明らかになった。
3.6 PPIの血漿中濃度と予想される脳内濃度は、ヒトChATのKi値よりも数倍高い
例えば、オメプラゾールのヒト血漿中濃度範囲は、標準的な20mgを単回経口投与した場合,0.23~23.2μMである53 。また、logD(親油性の指標)を算出したところ、オメプラゾールが2.4,エソメプラゾールが2.4,ラベプラゾールが2.1,テナトプラゾールが2.2であった。これらの理論的指標は、PPIがBBBを通過する可能性があることを示している。ラットを用いた研究はこの評価と一致しており、脳/血中濃度比は0.1~0.15であり、オメプラゾールの脳透過性は約10~15%であることが示唆されている52。56 最後に、非ヒト霊長類のラジオ標識オメプラゾールの標準取り込み値(SUV)は1.5であり、生体内試験のPET画像と合わせて、ラジオトレーサーとしてのオメプラゾールが脳に到達し、脳の全領域にほぼ均等に分布していることが明らかになった(未発表データ)。すべてのPPIは分子構造の類似性が高いことから、少なくとも他のPPIも同じレベルの脳透過性が期待できると考えられる。したがって、保存的な脳内濃度範囲は150~3000nMであり、これはオメプラゾールやエソメプラゾールのKi値よりも少なくとも1.5~30倍高い脳内浸透レベルを示している。しかし,ラベプラゾールやテナトプラゾールのKi値よりも8~170倍高い値であった(図2)。
4 考察
本報告は、PPIがコリン作動性シグナル物質AChの生合成を担う重要なコリン作動性酵素を阻害することができるという説得力のある証拠を提供している。また、この点において、PPIは、この酵素の最も強力な阻害剤の一つであるα-NETAよりも、より強力で選択的なコリン作動性シグナル物質の阻害剤であることを示した。また、阻害定数によって決定されるPPIの効力は、1日10〜20mgの標準的な投与量であっても、ヒト患者のこれらの薬剤の既知の血漿中濃度よりも数倍低いことを発見した。しかし、これらの薬剤の高用量は珍しいことではなく、多くの国でPPIのいくつかは市販で購入することができる。これらの知見と、PPIへの曝露と認知症の発生率を関連づけた薬理疫学的研究の結果41-44は、臨床的に関連した抗コリン作用を発揮する確率という点で、PPIの副次的な作用モードが憂慮すべきものであることを指摘している。
アルツハイマー病に対する最良の戦略は、危険因子を発見し、可能であれば排除することであることを考えると、今回の知見は重要であり、特に高齢者やすでに認知症を患っている患者においては、PPIの使用は認知症の発症とその進行の両方の正当な危険因子であると考えるべきであることを示唆している。
さらに、PPIの抗コリン作用は、ALSや関連する運動ニューロン障害など、コリン作動性機能障害が関与している可能性のある他の疾患にも関連している可能性が高い。したがって、本知見は、ALSおよび関連する運動ニューロン障害のリスク因子(またはリスク修飾因子)としてのPPIの使用に関する具体的な薬理・疫学的研究を保証するものである。
我々の知る限り、抗コリン作用を有する薬剤はすべてコリン作動性受容体、特にムスカリン系のサブタイプのアンタゴニストとして作用しているが、同定された標的が重要なACh合成酵素であることは初めてである。このように、コリン作動性受容体(ChAT)を阻害することによる生物学的影響に関する研究は少ない。コリン作動性受容体は、中枢神経系のみならず末梢臓器にも存在し、その多様性は大きい。この多様性は、他の受容体サブタイプを介して、ある受容体アンタゴニストの抗コリン作用を生物学的にある程度緩和することができる可能性がある。この可能性はChATにはない。なぜなら、ChATはすべてのコリン作動性細胞およびニューロンの細胞質内でAChを生合成することができる唯一の既知の細胞質酵素だからである。PPIは中枢神経系、末梢神経系(末梢神経系)腸管神経系(ENS)のコリン作動性界面にアクセスすることから、コリン作動性受容体のアンタゴニストよりも、PPIのコリン作動性阻害作用の方が、より広範な長期的影響を媒介することが予想され、今後の研究で慎重に検討する必要がある。
また、PPIがACh分解酵素であるAChEとBChEの活性を同時に阻害することができるかどうかを検討した。その結果、PPIはこれら2つの酵素に対しては無視できるほどの活性を示した。この知見は、以下のような重要な意味を持つ。もしPPIがChATとACh分解酵素の両方を阻害した場合、その抗コリン作用(すなわち、AChの産生を減少させる)は、そのコリン作用を増強する作用(ACh分解の阻害)によって否定された可能性がある。したがって、期待される正味の生物学的影響は低いと考えられる。しかし、上記の分析では、コリンエステラーゼに対するコリンエステラーゼに対するPPIの選択性が20~5800倍と非常に保守的に見積もっても、PPIのChAT阻害作用は絶対的に優勢であるため、その可能性は非常に低いことが示されている。このように、PPIの見かけ上の抗コリン作用とその結果は、コリンエステラーゼに対するPPIのはるかに弱い活性によって緩和される可能性は低いと考えられる。
同様に、オメプラゾールとエソメプラゾールのアセチル-CoA対コリン結合部位のKi値をChAT上で比較すると、PPIはアセチル-CoAを基質の一つとして使用し、コリンを基質としない他の酵素に対して60〜84倍も低い親和性や選択性を示す可能性が高いことが予測される。重要な例外として、ミトコンドリア酵素のカルニチンアセチル転移酵素(CART)があるが、これはChATよりもはるかに低い程度ではあるが、AChを生合成することができることが示されている。それにもかかわらず、他のアシル基転移酵素、特にCARTについては、さらなる酵素動態解析が必要である。
生物学的影響との関連では、PPIは20年間のデータと世界中の何百万人もの人々に使用されていることから、安全性のプロファイルが十分に文書化されていることが議論されている。しかし、本報告書の調査結果や前述の認知症発症率とPPIの関連性に関する薬理学的疫学的研究から示唆されたメカニズムの後知恵を考えると、PPIの抗コリン作用による生物学的影響を否定することはできないことが明らかになった。むしろ、PPIの抗コリン作用の病態生理的影響は、少なくとも2つの主な理由で長い蓄積時間を必要とするため、臨床的に検出したり主張したりすることが困難であることを示しているにすぎない。理論的には、PPIの最も一般的な投与量のレジメン(すなわち、1日1回)に従うと、薬物の血漿中濃度は5時間以内に初期濃度の3%未満にまで急速に低下する(薬物の5t½)。したがって、薬剤の抗コリン作用の持続時間は、特にコリン作動系が高度に適応性があり、短期的な障害に対して抵抗性であることが知られているため、即時の臨床的顕現を可能にするには短すぎるかもしれない。第二に、コリン作動性ニューロンには細胞内AChデポが存在することが示されており、これによりニューロンはChAT活性に限られた短期的な障害を受けた後にAChを放出することが可能になる57。それにもかかわらず、特定の条件下では、コリン作動系はそのような短期間の障害に対してさえ非常に脆弱であるかもしれない。例えば、ストレス刺激はコリン作動性回路の長期的な過剰興奮状態を引き起こすことがよく知られている58 。これは、コリン作動性神経細胞の活動に大きな負荷を与える他の条件と同様に、長期の使用、PPIの毎日の摂取頻度の増加、および/または高用量レジメンでも同様のことが起こる可能性がある。このような状況下では、このコアとなるコリン作動性酵素に対する短時間の障害でさえ、通常はまれな副作用と考えられている症状やPPIの過剰摂取の症状として現れることがある。これらの既知の症状は、混乱、焦燥感、幻覚、抑うつ、めまい、ぼんやりとした視界、筋力低下、転倒、骨折のリスク、便秘などであり、これらはすべて抗コリン作用と関連していることが知られている59。また、PPIの抗コリン作用は高齢者においても、年齢が上がるにつれてコリン作動性が低下するため、より関連性が高いと予想されている61, 62。
これら3つのPPIのうち、認知症発症リスク比の推定値が最も高かったのはエソメプラゾールであった(ハザード比2.12)41 。実際、オメプラゾールの全体的な抗ChAT活性は、そのS-エナンチオマーであるエソメプラゾールに起因していることが明らかになった。
しかし、若年健常者を対象としたPPIの短期曝露の影響を調べた研究がある63 。各種認知測定は、Cambridge Neuropsychological Test Automated Batteryソフトウェアを用いて評価した。その結果、PPIへのこのような短期間の暴露でも、評価された認知領域の大部分に有意な影響を与えることが明らかになった。対照的に、プラセボ群では有意な変化は観察されなかった63 。研究者らはまた、コーエンのd検定値を用いてPPIへの曝露の効果の大きさを評価し、観察された結果が実用的かつ臨床的に有意であることを示した。研究者らは、PPIは異なる認知領域に影響を与え、アルツハイマー病との関連性があると結論づけた。63 このことは、今回の報告との関連では、各PPIの他の薬物動態特性がChAT阻害剤としての効力(すなわち、Ki値)と同様に関連している可能性を示唆しているのかもしれない。そのような特性としては、ChATに対する相対的なBBB透過性、タンパク質結合性、エナンチオマー特異的活性、ChATに対する代謝物の活性などが考えられるが、これらはすべて更なる調査が必要である。しかし、我々は市販されているオメプラゾール/イソメプラゾールの主要代謝物の一つであるオメプラゾールスルホンを試験した。この代謝物は、母体であるオメプラゾールがこの濃度では完全に酵素を阻害するのに対し、100μMの濃度ではChATを30%程度阻害することがわかった。したがって、オメプラゾールまたはエソメプラゾールの場合、この代謝物の活性は、前述の研究で観察された認知障害に関して、これらの 2 つの治療群間で差がないことに関連しているとは考えられない。
アルツハイマー病研究分野で最も重要な質問の一つは、病気の原因または原動力を特定することに関係している。数多くの薬理疫学的研究では、強い抗コリン作用を持つ薬剤への長期的・累積的な曝露が認知症の発症と関連していることが示されている33-40。しかし、現在のアルツハイマー病分野のコンセンサスは、アルツハイマー病における初期のコリン作動性欠損は、アルツハイマー病における病理学的事象の結果に過ぎないというものである。本報告書の所見は、多くの薬理学的疫学研究33-40の結果と一緒に、このコンセンサスを強く否定し、むしろ初期のコリン作動性欠損がアルツハイマー病様認知症の原因と考えられるべきであることを指示している。これは、高齢化がアルツハイマー病の最も強い危険因子であり、神経系と非神経系のコリン作動系の両方が年齢に依存して低下するという事実とも一致している61, 62。
そこで問題となるのは、コリン作動性欠損がどのように駆動力として作用するのかということである。説得力のある証拠が、複雑で多層的なメカニズムを示唆している。ChATの酵素動態解析では、アミロイドβ、特にアミロイドβ42ペプチドがChAT活性のアロステリック増強剤として作用し、生理的なアミロイドβ濃度で酵素効率を約30%増加させることが示されている26。アミロイドβは脳内の全体的なAChの恒常性に重要な役割を果たしているとの仮説が立てられている26, 32 と、現在のデータから得られた後知恵から、PPIによるChATの阻害は、ChATのアロステリック増強因子であるアミロイドβ42ペプチドのレベルを増加させることでChATの活性を回復させる代償的フィードバックループを開始するのではないかという仮説が立てられている。この仮説に沿って、アミロイドβはChATバリアントタンパク質の核への転座を誘導し、最終的にはAPPの代謝を変化させ、アミロイドβの産生を減少させることが報告されている65, 66 。このように、PPIによるChATの阻害は、多かれ少なかれ同時に様々な結果をもたらす可能性がある。しかし、これらの現象が相乗的に働くのか、離散的に働くのか、あるいは対立的に働くのかについては、さらなる研究が必要である。
25, 67-71 実際、まだ完全に認識されていないAChの機能の1つは、内在性ミトコンドリアのアポトーシス経路の予防に関連しているように思われる。一方で、AChの生合成はミトコンドリアのバイオエネルギー機能に直結しており、ChATによる生合成には、主に解糖時にミトコンドリア内で産生される補酵素であるアセチル-CoAを等モル量必要とする。一方、ACh はミトコンドリア外膜に存在するミトコンドリアのニコチン性 ACh 受容体を活性化することで、ミトコンドリア由来の細胞アポトーシス経路を制御している69 。71 その逆で、コリン作動性シグナル伝達の阻害はアポトーシスを引き起こすことが示されている72, 73 。これにより、細胞内の ACh 産生やレベルを直接または間接的に低下させるような条件や薬剤は、神経変性を引き起こす可能性がある。
リンパ球は、ChATを含むほぼ完全なコリン作動性メカニズムを持っており、AChを自己免疫調節因子として使用している。抑制されていない神経炎症性カスケードが様々な神経変性疾患の重要な特徴であることを考えると、ChATの遮断は、特に高齢者の間では、神経変性疾患や自己免疫疾患の多様なスペクトルの影響を受けやすくなる素因因子として作用する可能性がある。
以上のことから、PPI曝露とアルツハイマー病発症の関連性に関する報告の中で見られたいくつかの論争を、これらの一見複雑な多段階のメカニズムが説明していると考えられる。
結論として、我々はPPIがコアコリン作動性酵素ChATの活性を可逆的に阻害するという説得力のある証拠を初めて報告し、世界中の何百万人もの人々が使用している最低用量であっても、前例のない選択性と効力を持っている。この予想外の作用機序と薬理・疫学的観察は、コリン作動系の機能障害との関連でPPIの更なるメカニズム研究を保証するものである。
