Contents
Protein Expression of Angiotensin-Converting Enzyme 2 (ACE2) is Upregulated in Brains with Alzheimer’s Disease
pubmed.ncbi.nlm.nih.gov/33567524/
鼎奇悦1,Nataliia V. Shults1,Sergiy G. Gychka2,Brent T. Harris3,Yuichiro J. Suzuki1,*OrcID.
1ジョージタウン大学医療センター薬理学・生理学教室(ワシントンDC 20007,米国
2ウクライナ,01601キエフ、ボゴモレツ国立医科大学病理解剖学第2部
3ジョージタウン大学医療センター、ワシントンDC 20007年、米国の神経内科と病理学の学部
受理された。2021年1月13日 / 改訂:2021年1月30日 / 受理:2021年2月4日 / 掲載:2021年2月8日 2021年2月4日 / 公開:2021年2月8日
要旨
アルツハイマー病は慢性の神経変性疾患であり、世界的に認知症の主な原因を占めている。現在、世界では、アンジオテンシン変換酵素2(ACE2)を受容体として宿主細胞に侵入するウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)のパンデミックが発生している。COVID-19では、神経学的症状が発現することが報告されている。本研究では、アルツハイマー病患者の脳内でACE2のタンパク質発現レベルが上昇していることを明らかにした。ACE2発現量の増加は年齢に依存しないことから、アルツハイマー病とACE2発現の直接的な関係が示唆された。酸化ストレスはアルツハイマー病の病態に関与しており、本研究で調べたアルツハイマー病患者の脳では、より高いカルボニル化蛋白質とペルオキシレドキシン6(Prx6)のチオール酸化状態の増加が見られた。また、アルツハイマー病の脳では、ACE2タンパク質の発現量の増加と酸化ストレスとの間に適度な正の相関関係が認められた。以上のことから、本研究はアルツハイマー病とSARS-CoV-2の受容体であるACE2との関係を明らかにした。これらの結果は、アルツハイマー病とCOVID-19の両方を有する患者を注意深くモニタリングし、脳内のより高いウイルス負荷と長期的な有害な神経学的影響を明らかにすることの重要性を示唆している。
キーワード
アルツハイマー病; ACE2; アンジオテンシン変換酵素2; 脳; コロナウイルス; COVID-19; 酸化ストレス
1. 序論
アルツハイマー病は慢性の神経変性疾患であり、世界中で認知症の主な原因となっており、65歳以上の高齢者の有病率は10~30%と推定されており、多くの高齢者に影響を与えている[1,2]。米国だけでも推定500万人がアルツハイマー病に罹患しており、この国の高齢者の死因の第5位である。しかし、アルツハイマー病の原因についてはほとんど知られておらず、現在のところ治療法はない[3,4]。酸化ストレスと活性酸素種(ROS)の産生[5,6]はアルツハイマー病に関与している[7,8,9,10]が、抗酸化物質の臨床試験では効果的な治療法として期待されていない[11,12]。したがって、アルツハイマー病における酸化ストレスの役割をさらに理解する必要がある。
コロナウイルスはポジティブセンス一本鎖RNAウイルスであり、風邪の原因となることが多い[13,14]。しかし、一部のコロナウイルスは 2020年のパンデミックで世界が目の当たりにしたように、致死的になる可能性がある。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、新型コロナウイルス感染症(COVID-19)を引き起こした[15,16]。これまでのところ、世界で9000万人以上がSARS-CoV-2に感染しており、深刻な健康、経済、社会問題を引き起こしている。SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)を受容体として宿主細胞に侵入する[17,18]。高齢者、特に心血管疾患を有する人は、重度のCOVID-19状態を発症しやすいことが指摘されている[16,19,20]。
現在の焦点は、死亡率を減少させるためにCOVID-19の肺と心血管の側面を治療することであるが、COVID-19患者の36%で神経学的症状が発現したことが報告されている[21]ことから、この疾患が長期的な神経学的影響を及ぼす可能性があることが示されている。したがって、COVID-19と脳との関係を理解することが重要である。本研究では、SARS-CoV-2の宿主細胞受容体であるACE2の発現レベルをモニターし、アルツハイマー病患者の脳でACE2タンパク質がアップレギュレートされていることを明らかにした。
2. 研究成果
2.1. ACE2タンパク質の発現
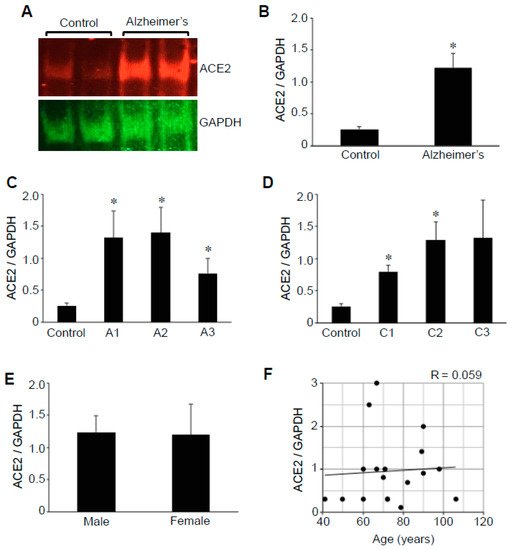
海馬はアルツハイマー病の影響を受ける脳の主要な構造物である[22,23]。我々は、アルツハイマー病患者の海馬脳組織におけるACE2のタンパク質発現量をウエスタンブロット法で測定し、対照群と比較した。ACE2タンパク質の発現は、アルツハイマー病患者の脳では対照群と比較して高いことがわかった(図1A)。ACE2とグリセルアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH)の比を定量したところ、その平均値は4.7倍で統計学的に有意であった(図1B)。また、アルツハイマー病患者13名のACE2/GAPDH比の平均値は1.22±0.2であったのに対し、対照群5名の平均値は0.26±0.04と高い整合性を示した。GAPDHの発現量は、対照群(21,554±1021デンシトメトリー単位)とアルツハイマー病群(21,315±1471デンシトメトリー単位)で同程度であった。
図1 アルツハイマー病患者の脳では、ACE2タンパク質の発現がアップレギュレートされている。
対照群とアルツハイマー病患者の脳(海馬)ホモジネートを、ACE2およびGAPDHに対する抗体を用いてウェスタンブロッティングに供した。A)代表的な結果 (B) 棒グラフは、ACE2とGAPDHの比率の平均±SEMを示す(アルツハイマー病ではN=13,コントロールでは5)。C)棒グラフは、様々なAβプラークスコアについてのACE2とGAPDHの比の平均±SEMを示す(文字Aで示す)。N=コントロールは5,A1は5,A2は5,A3は3。D)棒グラフは、様々な神経プラークスコアについてのACE2とGAPDHの比の平均±SEMを示す(文字Cで示される)。N = コントロールを5,C1を2,C2を7,C3を4。記号*は、p < 0.05でコントロール値と有意に異なることを示す。E)ACE2とGAPDHの比の平均値±SEMを示す棒グラフ(N=男性8,女性5)。男性と女性では有意差は認められなかった。F)散布グラフは、年齢対ACE2発現(N=18)を表す。ピアソン相関係数R=0.059(弱い正の相関)。
本研究の対象となった患者のABCグレード[24]によるアルツハイマー病の重症度は、Aβプラークスコアが2または3の患者が61.5%、神経性プラークスコアが2または3の患者が84.6%であり、ほとんどが中等度から高度の範囲であった。ACE2タンパク質の発現をAβプラークスコア(図1C)または神経性プラークスコア(図1D)と関連させて解析したところ、ACE2の発現レベルは疾患の重症度とは関連していないことが判明した。このように、重症度の低いアルツハイマー病患者でもACE2の発現量が有意に上昇していることが明らかになった。さらに、アルツハイマー病患者では、ACE2発現量に男女差は認められなかった(図1E)。本研究では、アルツハイマー病患者の年齢は60~106歳(平均78.8±4.2歳)対照者の年齢は41~79歳(平均60.4±7.8歳)であったが、ACE2蛋白質の発現には年齢依存性は認められなかった(図1F)。
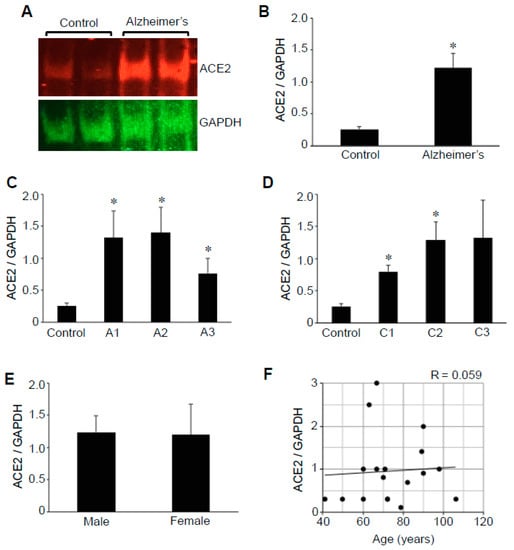
13名のアルツハイマー病患者のACE2/GAPDH比は0.3~3(平均1.2±0.2)であったが、対照群では0.26±0.04(平均0.26±0.04)と高い一致性を示した(図2A)。アルツハイマー病患者のホルマリン固定パラフィン包埋組織の図2(パネルB1)に示す銀染色画像は、アミロイド斑や神経斑、神経原線維のもつれを示した[25,26]。さらに、ヘマトキシリンおよびエオシン染色によりアミロイド斑が検出され [27,28,29]、タウAT8抗体を用いた免疫組織化学により、アルツハイマー病患者の海馬組織サンプルにおいてセリン202およびスレオニン205にリン酸化されたタウが発現していることが示された[30](図2,パネルB2)。
図2 アルツハイマー病患者のACE2発現および組織学的評価の結果のグループ内の変動
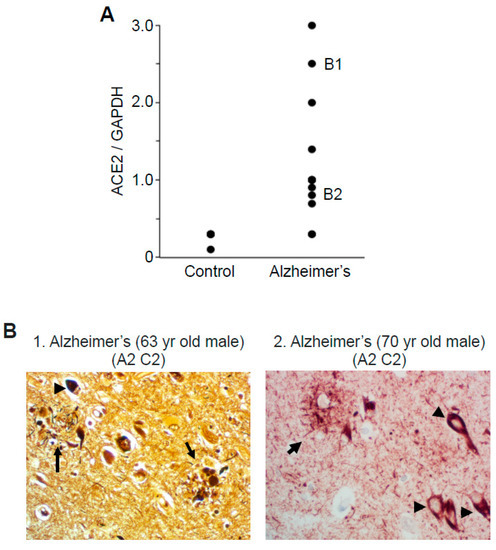
A)対照群とアルツハイマー病患者の脳(海馬)ホモジネートをACE2とGAPDHに対する抗体を用いてウエスタンブロット法で調べた。ドットグラフは、対照群とアルツハイマー病患者のACE2とGAPDHの比率の値を示している。また、グラフ中には、パネルBの組織学的結果が示された患者のパネル番号が示されている。B)アルツハイマー病患者からのホルマリン固定パラフィン包埋海馬組織を切り取り、Bielschowsky銀染色(B1)またはPHF-1/p-Tau免疫組織化学(B2)に供した。年齢、性別、Aβプラークスコア(文字Aで示される)神経斑スコア(文字Cで示される)を各スライドに記載した。脳実質には、暗いアミロイドコア(矢印)と神経原線維のもつれ(矢印)を特徴とする神経斑などの病変がある。
2.2. タンパク質のカルボニル化
酸化ストレスは、アルツハイマー病の個人の脳で発生することが示されている[7,8,9,10]。一貫して、OxyBlot Kitを使用してカルボニル化タンパク質の2,4-ジニトロフェニルヒドラジン(DNPH)誘導体化によってモニターされるように、様々な海馬タンパク質のタンパク質のカルボニル化は、コントロール(図3A)のものと比較してアルツハイマー病と脳内のより高いカルボニル化タンパク質を示した。その結果、アルツハイマー病患者では対照群に比べてタンパク質のカルボニル含量が7.8倍も高く、その差は統計的に有意であることが明らかになった(図3B)。カルボニル含量とGAPDHの比は、アルツハイマー病患者では0.7~2.9(平均値1.4±0.15)であったが、対照群では0.1~0.2(平均値0.2±0.02)であった。海馬脳のタンパク質カルボニル含量に関連したAβプラークスコア(図3C)またはニューライトプラークスコア(図3D)の我々の分析は、アルツハイマー病の重症度に依存する傾向を示している可能性があるが、患者の脳組織間では有意な差は認められなかった。重症度を問わず、対照群とアルツハイマー病患者の間では、一貫して統計学的有意差をもって、タンパク質カルボニル含量が高いことがわかった。
図3 アルツハイマー病患者の脳ではタンパク質のカルボニル化が亢進している。コントロール被験者とアルツハイマー病患者の脳(海馬)ホモジネートをOxyBlotを用いて調べた。
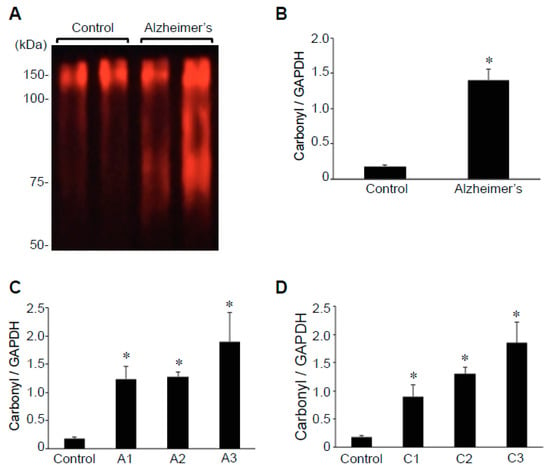
A)代表的な結果(B) 棒グラフは、GAPDHに対するカルボニル化蛋白質の比率の平均±SEMを示す(アルツハイマー病ではN=13,コントロールでは5)。C)棒グラフは、様々なAβプラークスコアについてのGAPDHに対するカルボニル化タンパク質の比率の平均±SEMを示す(文字Aで示される)。N=コントロールは5,A1は5,A2は5,A3は3。D)棒グラフは、様々な神経プラークスコアについてのGAPDHに対するカルボニル化タンパク質の比率の平均±SEMを示す(文字Cで示される)。N=コントロールを5,C1を2,C2を7,C3を4。記号*は、p < 0.05でコントロール値と有意に異なることを示す。
2.3. タンパク質レドックス状態モニタリングキットプラスペルオキシレドキシン(Prx6)の分析
SulfoBiotics-Protein Redox State Monitoring Kit Plusは、15 kDaのProtein-SHIFTERを使用して、還元されたシステイン・スルフヒドリル基に添加した後、目的のタンパク質を免疫学的に検出することで、特定のタンパク質のチオール酸化還元状態を評価することができる[31]。両方のシステイン残基が酸化されたヒトPrx6の場合、Protein-SHifterが結合しないため、タンパク質は25 kDa(すなわちPrx6の分子量)で移動する。片方のシステインが還元されると、15 kDaのProtein-SHifterがこのシステインに結合し、40 kDaの複合体を形成し、Prx6バンドをシフトさせる。両方のシステイン残基が還元されると、2つのProtein-SHIFTERがこのタンパク質に結合して、25 kDaのPrx6の合計30 kDaのシフトを可能にし、55 kDaの種を形成する。我々は以前に、未処理の培養ヒト平滑筋細胞において、Prx6分子が還元状態で優勢であり、-SulfoBiotics- Protein Redox State Monitoring分析において55 kDaのバンドを示すことを発見した[31]。細胞を過酸化水素で処理すると、55 kDaのバンドが25 kDaではなく、ほとんどが40 kDaに変換される結果となり、ヒトPrx6タンパク質の2つのシステインのうちの1つだけがこの酸化の影響を受けやすいことを示唆している[31]。一連の実験により、55kDaから40kDaへの種のシフトは、触媒システイン47の酸化によるものであることが決定された[31]。
このシステムを用いて、アルツハイマー病患者と対照者の海馬脳におけるタンパク質チオールの状態をモニターした。培養細胞を過酸化水素[31]で処理することによって生成され得る状況と同様に、アルツハイマー病患者の脳内のPrx6タンパク質分子の大部分が、1つのProtein-SHifterの添加に対応する40 kDaの種として存在することを発見した(図4A)。デンシトメトリー解析の結果、アルツハイマー病患者の脳では、対照群と比較して40〜55kDaのPrx6種の比率が2.5倍高いことが明らかになった(図4B)。対照的に、25~55 kDa、25~40 kDaの比率では有意差は認められず、アルツハイマー病患者の脳では非触媒性システインが一貫して酸化されていないことが示唆された。アルツハイマー病患者の40~55kDaのPrx6種の比率の範囲は0.3~1.2(平均値=0.9±0.08)であったのに対し、対照群では0.2~0.5(平均値=0.36±0.05)であった。40〜55 kDa種の比率によって測定されるPrx6チオール酸化は、タンパク質のカルボニル化と相関していることがわかった(図4C)。
図4 Prx6のシステイン酸化は、アルツハイマー病患者の脳でアップレギュレートされている
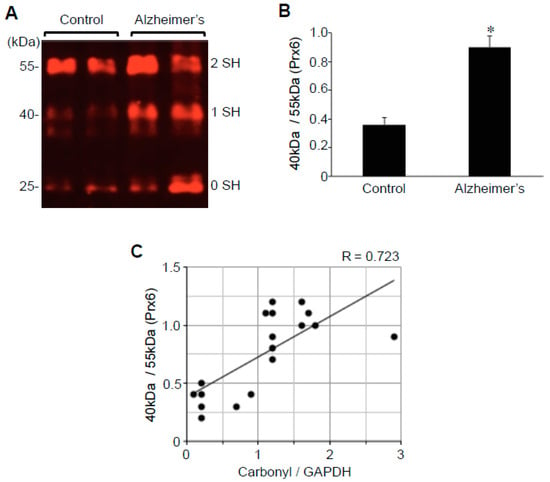
対照群とアルツハイマー病患者の脳(海馬)ホモジネートを-SulfoBiotics- Protein Redox State Monitoring Kit Plusを用いてPrx6のシステイン酸化を調べた。遊離タンパク質のチオール基を、還元されたスルフヒドリル基に対する親和性の高いマレイミドを含むProtein-SHifter Plusで標識した。各Protein-SHifterは15kDaのシフトを引き起こす。電気泳動後、ウエスタンブロッティングの効率を高め、生物学的サンプル中の特定のタンパク質の検出を可能にする紫外線へのゲルの曝露により、Protein-SHifter Plusの部位が除去された。ヒトPrx6の場合、完全に酸化されたシステイン残基を持つタンパク質は25 kDaで移動する。1個の還元されたシステインを持つタンパク質はProtein-SHifterに結合して40kDaで移動し、2個の還元されたシステイン残基を持つタンパク質は55kDaで移動する。我々の先行研究では、40 kDaのバンドは、触媒的システイン(Cys47)が酸化されたPrx6を表していることが判明した[31]。A)25 kDa(0還元スルフヒドリル)40 kDa(1還元スルフヒドリル)および55 kDa(2還元スルフヒドリル)バンドを示すPrx6抗体を使用した代表的なウエスタンブロット結果
B)棒グラフは、40kDaのPrx6バンドと55kDaのPrx6バンドの比の平均値±SEMを示す(アルツハイマーの場合はN=13,対照の場合は5)。記号*は、p<0.05でコントロール値と有意に異なることを示す。C)散布グラフは、タンパク質のカルボニル化対Prx6チオール酸化(N = 18)を表す。ピアソン相関係数R=0.723(正の相関)。
Prx6種の40~55kDaの比率に関連したAβプラークまたは神経性プラークのスコアの分析では、患者の脳組織間では統計的に有意な差は認められなかったが、Prx6チオール酸化は、対照群とどの程度の重症度のアルツハイマー病患者間でも統計的に有意に一貫して高い値を示した。
2.4. Prx6 タンパク質発現
また、アルツハイマー病患者の脳では、コントロールの脳と比較してPrx6タンパク質の発現レベルが高いことがわかった(図5A)これは酸化ストレスに応答して抗酸化防御機構が活性化されていることを反映している可能性がある。ローディングコントロールとしてGAPDHタンパク質を使用し、デンシトメトリー分析を行ったところ、アルツハイマー病患者の脳とコントロールの脳の間でPrx6のタンパク質発現レベルが有意に(6.5倍)異なることがわかった(図5B)。アルツハイマー病患者の脳で決定されたPrx6とGAPDHの比の範囲は0.9〜2.5(平均=1.4±0.1)であったのに対し、対照の脳では0.01〜0.5(平均=0.2±0.08)であった。Prx6タンパク質発現は、タンパク質のカルボニル化(図5C)と強く相関しており(図5D)また、40〜55 kDaの種の比率によって測定されるPrx6チオール酸化(図5D)と同様に、Prx6タンパク質発現は、タンパク質のカルボニル化(図5C)と強く相関していることがわかった。
図5 Prx6タンパク質発現は、アルツハイマー病患者の脳でアップレギュレートされている
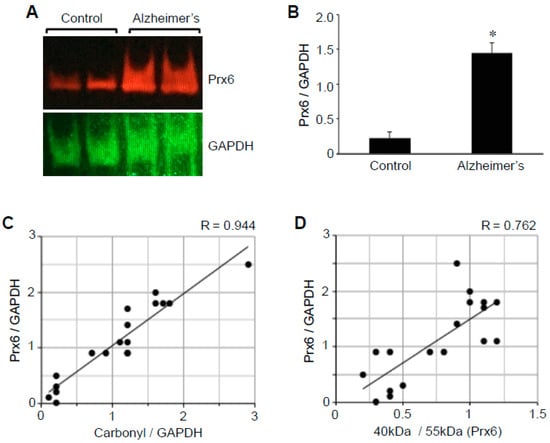
コントロール被験者およびアルツハイマー病患者からの脳(海馬)ホモジネートを、Prx6およびGAPDHに対する抗体を用いてウェスタンブロッティングに供した。A)代表的な結果 B)棒グラフはPrx6とGAPDHの比率の平均±SEMを示す。記号*は、p<0.05で対照値と有意に異なることを示す。C)散布グラフは、タンパク質のカルボニル化対Prx6発現(N = 18)を表す。ピアソン相関係数R=0.944(強い正の相関)。D)散布図は、Prx6チオール酸化対Prx6発現(N = 18)を表している。ピアソン相関係数R=0.762(強い正の相関)。
海馬脳のPrx6量に関連したAβプラークおよびニューライトプラークのスコアの分析は、アルツハイマー病の重症度に依存する傾向を示している可能性があるが、患者の脳組織間では統計的に有意な差は認められなかった。Prx6含有量は、コントロールとどの程度の重症度のアルツハイマー病患者の間でも統計的有意差をもって一貫して高いことが明らかになった。
2.5. ACE2と酸化ストレスの相関分析
図6は、全18サンプル(アルツハイマー病患者13名、対照5名)を用いて、ACE2と様々な酸化ストレスパラメータとの関係を調べるための相関分析の結果を示している。ACE2発現とタンパク質カルボニル含量との間のピアソン相関係数R値は0.517であり(図6A)ACE2発現とPrx6チオール酸化状態との間のR値は0.567であった(図6B)。また、ACE2発現とPrx6発現との間のR値は0.687とやや高いことがわかった(図6C)。このように、ACE2タンパク質発現は、酸化ストレスパラメータおよび抗酸化物質のアップレギュレーションと適度な正の相関を有する。
図6 ACE2タンパク質発現と酸化ストレスとの関係を調べる相関分析
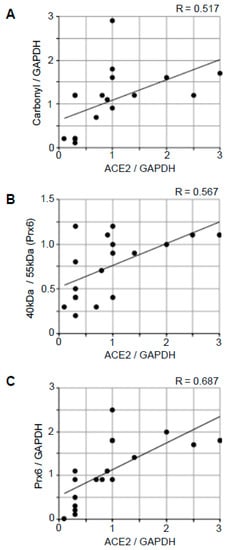
散布グラフは、(A)ACE2発現対タンパク質カルボニル化、(B)ACE2発現対Prx6チオール酸化、および(C)ウエスタンブロッティングデータを用いたACE2発現対Prx6発現を示す(N=18)。ピアソン相関係数は中程度の正の相関を示す。
3. 議論
ACE2の主要な生理機能は、血管収縮剤として作用するアンジオテンシンIIの血管拡張剤として作用するアンジオテンシン(1-7)への加水分解を触媒することで血圧を下げることである[32]。ACE2はまた、現在のCOVID-19パンデミックの原因となっているウイルスであるSARS-CoV-2の受容体としても機能する。SARS-CoV-2の主な標的は肺胞上皮細胞と気道の細胞であり、重度の肺炎と急性呼吸窮迫症候群を引き起こす[33]。脳では、免疫組織化学により、内皮細胞や動脈平滑筋細胞でACE2タンパク質の発現が検出された[34]。また、培養脳グリア細胞[35]やマウス脳神経細胞[36]でもACE2の発現が確認されている[37]。
本研究の主な知見は、アルツハイマー病患者では対照群に比べて脳内ACE2発現が高いことである。アルツハイマー病の重症度とACE2発現との間に相関関係は認められず、軽症でもACE2はアップレギュレートしていることが明らかになった。これらの結果は、どのような重症度のアルツハイマー病患者でもSARS-CoV-2に感染すると、脳細胞へのウイルスの侵入率が高くなることを示している。したがって、アルツハイマー病患者は、COVID-19の影響を強く受けるリスクがある。アルツハイマー病患者の脳におけるACE2タンパク質発現には性差は認められず、ACE2タンパク質発現は年齢に依存しなかった。このことから、アルツハイマー病とACE2発現には直接的な関係があると考えられる。ACE2はこのウイルスの宿主細胞受容体であるため、この関係のメカニズムを解明することで、アルツハイマー病の発症機序や、SARS-CoV-2感染者の管理戦略が明らかになる可能性がある。
酸化ストレスはアルツハイマー病の発症に関与しており、多くの研究で酸化ストレスパラメータのモニタリングが行われている[7,8,9,10]。したがって、酸化還元過程はACE2遺伝子の発現を制御する役割を果たしている可能性がある。先行研究[38]と同様に、我々のアルツハイマー病脳サンプルでもDNPH反応性タンパク質のカルボニルが増加していることがわかった。
アルツハイマー病のヒト脳におけるタンパク質のチオール酸化に関する情報は限られている。タンパク質のチオール酸化還元状態は生物学的に極めて重要な役割を果たしている[39,40,41,42]。タンパク質は生体システムの機能分子であるため、その酸化還元状態は病態生理を直接反映している。生体試料中のスルフヒドリル基の酸化をモニターする方法は数多くあるが、ほとんどの技術では細胞や組織試料中の酸化の全体的な評価しかできず[43]、特定のタンパク質の酸化還元状態のモニターを容易に行うことはできない。一部の技術では、酸化されている個々のタンパク質を特定することができるが、これらのアプローチは難しく、時間がかかり、コストがかかる[44,45]。サルフォバイオティクス-タンパク質酸化還元状態モニタリングキットプラスは、生物学的サンプル中の関心のある特定のタンパク質の酸化還元状態の評価を便利で費用対効果の高い方法で簡単に行うことができるという点で注目すべきものである[31]。チオール生物学を理解するために、私たちは以前、-SulfoBiotics- Protein Redox State Monitoring Kit Plusシステムを用いてPrx6の酸化還元状態モニタリング分析を行った[31]。このシステムでは、15 kDaのProtein-SHIFTERが還元されたシステイン残基ごとに添加され、ゲル電気泳動を用いてProtein-SHIFTERによる移動度の変化を調べながら、タンパク質のチオール酸化還元状態を定義している。続いて、Prx6に特異的に存在するチオール状態をウェスタンブロッティングにより決定した。ヒトでは、Prx6タンパク質分子は1つの触媒性システインと1つの非触媒性システインを含んでいる。培養細胞を過酸化水素で処理すると、触媒性システインの酸化が起こり、非触媒性システインへの影響はほとんどないことがわかった[31]。今回の研究では、アルツハイマー病患者の脳内でも、Prx6の非触媒性システインに大きな影響を与えることなく、触媒性システインが優先的に酸化されることが示された。Prx6の40〜55kDa種の比率測定によるタンパク質チオール酸化は、タンパク質のカルボニル化の程度と相関していた。
ペルオキシリドキシンは、ペルオキシダーゼ抗酸化酵素の一群である[46,47]。ペルオキシリドキシンの6つのメンバーが同定されており[46,47,48,49]、Prx1からPrx5は、過酸化水素の水への2電子還元を行う2つの触媒システインを含む[46,47]。しかし、Prx6は、触媒的システインを1つしか持たないユニークなペルオキシリドキシンであり、おそらくグルタチオンを利用して2電子還元のために2番目の電子を受け取ると考えられる[50,51]。今回の研究では、アルツハイマー病患者の脳でPrx6タンパク質の発現が高いことも発見されており、これらの脳は抗酸化防御機能が高まるように適応されているという概念を支持している。Prx6に関する我々の結果と同様に、アルツハイマー病でも脳内のPrx1とPrx2のタンパク質発現量が増加していることが報告されている[52]。我々の研究では、Prx6タンパク質発現量の増加は、タンパク質のカルボニル化およびPrx6チオール酸化によって測定される酸化ストレスの程度と強く相関していた。
脳ACE2タンパク質発現と、タンパク質のカルボニル化、Prx6のシステイン酸化、Prx6タンパク質発現を含む様々な酸化ストレスパラメータとの相関分析は、正の関係を示した。ACE2とPrx6の関係が最も高いことがわかった。しかし、これらの酸化還元パラメータとACE2の発現との相関は緩やかであり、アルツハイマー病におけるACE2遺伝子の発現調節には他の因子が関与している可能性が示唆された。ACE2発現の上昇のメカニズムに酸化ストレスが関与しているのか、ACE2の増加が酸化ストレスを促進するのかについては、今後の研究が必要である。
4. 材料と方法
4.1. 患者サンプル
アルツハイマー病と診断された死亡患者と、アルツハイマー病や他の神経疾患のない対照者からの凍結脳(海馬)組織を、ワシントンDCのジョージタウン大学医療センターブレインバンクから入手した。同じ患者からホルマリン固定およびパラフィン包埋海馬組織も入手した。これらの患者は通常自宅で死亡しており、ほとんどの症例では完全解剖は行われていなかった。死亡した患者の遺体は、組織採取が可能になるまで冷蔵保存された。アルツハイマー病患者の死後間隔の平均値は13.8±1.9時間であり、対照者の死後間隔は15.2±2.5時間であった。コントロールの脳組織は、同じプロトコルを用いて得た。アルツハイマー病のためのABCグレーディングは、ブレントハリス、神経病理学者とこの論文の共著者によってバンキングの時点で、以前に記載されているように組織学的に行われた[24]。
4.2. 組織ホモジネートの調製
凍結海馬の脳組織を、Kontesガラス組織粉砕機を用いて、10%トリクロロ酢酸(VWR International、Radnor、PA、USA)溶液の4容量でホモジナイズした。ホモジナイズした組織を氷上で30分間インキュベートし、AccuSpin Micro R遠心機(ThermoFisher Scientific, Waltham, MA, USA)を用いて4℃で8000rpmで4分間遠心した。得られたペレットをアセトンで3回、エタノールで1回洗浄した。ペレットを風乾させ、ライセート緩衝液(-SulfoBiotics- Protein Redox State Monitoring Kit Plus, Dojindo Molecular Technologies Inc. 次いで、サンプルを13,000rpmで10分間遠心し、上清を回収した。細胞溶解物のタンパク質濃度は、Pierce bicinchoninic acid assay(Thermo Fisher Scientific, Waltham, MA, USA)を用いて測定した。
4.3. ウェスタンブロッティング
等量のタンパク質サンプル(5μg)を還元性ドデシル硫酸ナトリウムポリアクリルアミドゲルで電気泳動した。次に、タンパク質をイモビロン-FLトランスファーメンブレン(MilliporeSigma, Burlington, MA, USA)に電気泳動した。膜は、25℃で1時間Odysseyブロッキングバッファー(LI-COR、リンカーン、NE、米国)でブロックし、ウサギACE2抗体(カタログ番号4355; Cell Signaling)ヤギ抗GAPDH抗体(カタログ番号PLA0302; MilliporeSigma)またはウサギ抗Prx6抗体(カタログ番号P0058; MilliporeSigma)で一晩インキュベートした4℃で。洗浄した膜をIRDye 680RDまたはIRDye 800CW(LI-COR)で暗所で25℃で1時間インキュベートした。シグナルはOdyssey Infrared Imaging System (LI-COR)を用いて得られ、ウエスタンブロットバンド強度をデンシトメトリーで分析した。
4.4. タンパク質のカルボニル化の測定
タンパク質側鎖のカルボニル基をDNPH [53]で誘導体化し、OxyBlot Protein Oxidation Detection Kit (MilliporeSigma)を使用して検出するための2,4-ジニトロフェニル(DNP)ヒドラゾン誘導体を形成した。次いで、イモビロン-FLトランスファーメンブレンを抗ウサギIRDye680RDで1時間インキュベートした。その後、Odyssey Infrared Imaging Systemを用いてシグナルを捕捉し、バンド強度をデンシトメトリーで分析した。
4.5. タンパク質チオールレドックス状態のモニタリング
タンパク質のチオール酸化還元状態は、-SulfoBiotics- Protein Redox State Monitoring Kit Plus (カタログ番号SB12; Dojindo Molecular Technologies)を用いてモニターした。サンプルは、製造元の指示に従い、Protein-SHifter Plusで標識した。細胞抽出物をSDS-PAGEに供した後、ゲルをトランスイルミネーター上で紫外線照射し、Protein-SHifterを除去した。ゲル中のタンパク質は、その後、イモビロン-FLトランスファーメンブレンに電気的にトランスファーされた。膜をOdysseyブロッキングバッファーで25℃で1時間ブロッキングし、ウサギ抗Prx6抗体(カタログ番号P0058; MilliporeSigma)で一晩インキュベートした。洗浄した膜を抗ウサギIRDye 680RDで25℃の暗所で1時間インキュベートした。その後、信号をOdyssey Infrared Imaging Systemを用いて捕捉し、バンド強度をデンシトメトリーで分析した。
4.6. 統計的分析
平均値および平均標準誤差(SEM)が計算された。2つのグループを2群間で比較し、2つ以上のグループ間の差を分散分析(ANOVA)によって決定した。
5. 結論
以上のことから、アルツハイマー病患者の脳を調べた結果、酸化ストレスに関連して ACE2 タンパク質がアップレギュレーションされていることが示唆された。ACE2遺伝子発現のメカニズムに酸化還元過程が関与しているのか、あるいはACE2が脳内の酸化ストレスを制御しているのかを明らかにするためには、さらなる研究が必要である。我々は、アルツハイマー病患者13名と対照5名を対象に解析を行った。後者の患者数は比較的少ないが、本研究で測定したすべてのパラメータにおいて、これらの患者の観察値は非常に一貫していた。また、アルツハイマー病患者は対照群に比べて平均年齢が高いが、ACE2の発現は年齢に依存しないことがわかった(ピアソン相関係数は0.059と非常に低い)。このように、これらの制限が、アルツハイマー病自体がACE2タンパク質発現の増加と関連しているという我々の結論を減衰させるとは考えられない。我々の結論は、Letters to the Editorとして発表されたLimら[54]のゲノムワイド関連解析で、アルツハイマー病患者の海馬でACE2 mRNAの増加が検出されたという報告によっても裏付けられている。対照的に、Kehoeら[55]は、このような患者ではACE2ペプチダーゼ酵素活性が低下していることを報告している。我々の結果は、アルツハイマー病におけるACE2タンパク質の発現レベルを報告した最初のものである。現在のパンデミックにおけるSARS-CoV-2受容体としてのACE2タンパク質の重要性に照らすと、アルツハイマー病患者におけるACE2の高レベルの発現がCOVID-19に対する反応に影響を与える可能性を考慮すると、アルツハイマー病患者の脳におけるACE2の問題についての更なる調査が必要である。