Contents
Progress in Research on SARS-CoV-2 Infection Causing Neurological Diseases and Its Infection Mechanism
オンラインで公開 2021年1月13日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7838637
Lintao Wang,1,2,† Zhiguang Ren,2,3,† Li Ma,2,4 Yanjie Han,2,5 Wenqiang Wei,2,3 Enshe Jiang,2,6,* and Xin-Ying Ji2,*.
要旨
COVID-19はその発生以来、世界的に急速に広がり、現在では大きな公衆衛生上の問題となっている。SARS-CoV-2は呼吸器系に影響を与えるだけでなく、中枢神経系にも大きな害を及ぼす可能性があることを示す証拠が増えてきている。そのため、SARS-CoV-2感染が神経系に与える影響を詳しく調べることは非常に重要である。本稿では、COVID-19期にSARS-CoV-2が中枢神経系に侵入する可能性のあるメカニズムと、SARS-CoV-2感染による神経学的合併症について検討した。
キーワード:神経学的合併症、嗅神経、ACE2,中枢神経系、SARS-CoV-2,COVID-19
序論
新規コロナウイルスは、これまで知られていなかったβ-コロナウイルスで、一本鎖ポジティブRNAウイルスである。世界保健機関は2019-nCoVと命名し、国際ウイルス分類学委員会はSARS-CoV-2と命名した。このウイルスは、コロナウイルス亜科の肉腫ウイルス亜科に属する。SARS-CoV-2は、ヒトに感染するコロナウイルスファミリーの7番目のメンバーである(1, 2)。
SARS-CoV-2は 2019年にCOVID-19を引き起こしたウイルスである。SARS-CoV-2に感染すると、重度の急性呼吸器症候群を引き起こす可能性がある。SARS-CoV-2は、世界中でヒトに感染・拡大する可能性が高い(3)。武漢でCOVID-19の最初の症例が診断されて以来、世界のSARS-CoV-2感染者数はここ数ヶ月で指数関数的に増加している。COVID-19はもともと呼吸器感染症として記載されていたが、現在では神経系の症状を含む多臓器感染症との見方が強まっている。中国国家衛生委員会が発行した「冠状肺炎の診断と治療に関する新ガイドライン」の更新版(中国NHCotPsRo 2020)では、一部のCOVID-19患者の病理組織学的サンプルで、SARS-CoV-2の浸潤が肺、脾臓、肝門部リンパ節、心臓と血管、肝臓と胆嚢、腎臓、脳、副腎、食道、胃、腸を含む多臓器に関与していることが示されたと指摘している。特に脳組織では、浮腫みや神経細胞の部分的な変性が観察された(中国 NHCotPsRo, 2020)。 SARS-CoV-2 に感染した細胞では、細胞死や高リン酸化、タウタンパク質の転位などの神経変性変化が観察されたが、これらの変化は甲状腺機能亢進症やアルツハイマー病などの病態でも観察される(4)。中枢神経系がSARS-CoV-2のリザーバーとして機能している可能性があり、一部のグループでは、SARS-CoV-2感染後6時間から72時間後までに、脳器官の神経細胞内にウイルス粒子が徐々に蓄積することが観察されており、感染後数日以内にウイルスが神経細胞内で活発かつ効果的に複製されていることが示唆されている。しかし、いくつかのグループは、ウイルス感染が最初の数日では効果的に複製されないことを観察し、中枢神経系がウイルスの長期的な貯蔵庫として機能する可能性を示唆した(4)。SARS-CoV-2が潜在的な神経侵襲効果を持つことを示す証拠が増えてきている(5)。COVID-19患者の1/3以上が中枢神経系症状(めまい、頭痛、意識障害、急性脳血管障害、運動失調、てんかん)を含む神経系症状を呈すると推定されている。末梢神経系症状(味覚障害、嗅覚障害、視覚障害、神経痛)(6)。
これまでのところ、中国でのパンデミックは効果的に抑制されているとはいえ、COVID-19のパンデミックは世界的に見ても非常に深刻である。統計によると、世界では5,400万人以上の確定症例があり、1,500万人以上の既存の確定症例があるとされている。この世界的な公衆衛生上の緊急事態の中で、私たちは依然として非常に深刻な状況に直面している。SARS-CoV-2感染に直面した場合、SARS-CoV-2感染が神経系に与える影響やその侵入機構を理解することは、患者の合理的な治療を行う上で大きな意義がある。本論文では、SARS-CoV-2の神経系への影響を系統的に解析し、レビューしている(図1)。
図1 SARS-CoV-2が神経系感染症や神経系疾患を引き起こすメカニズムを解説する
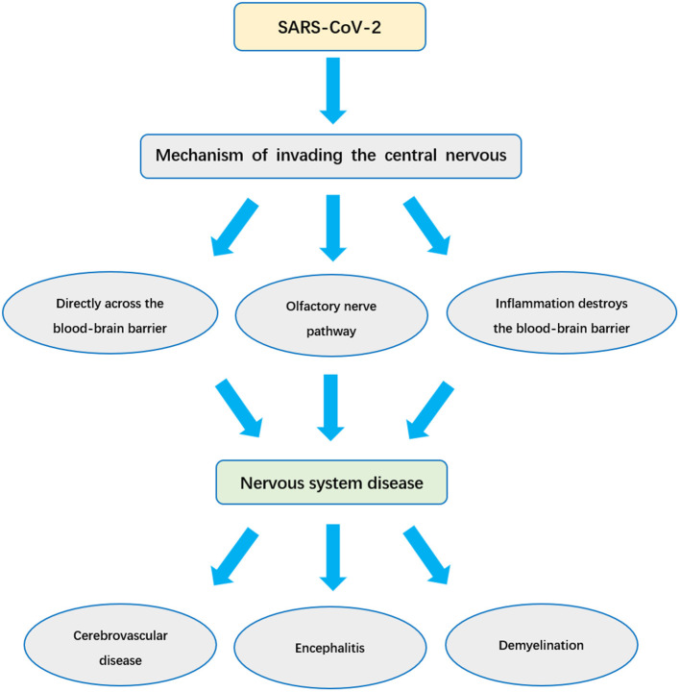
SARS-CoV-2が神経系に侵入する3つのメカニズム
中枢神経系は、高度に複雑な脳関門系によって守られており、ウイルスの侵入に対する第一の防御線となっている。脳関門は、血液-脳関門、血液-脳脊髄液関門、脳-脳脊髄液関門で構成されている。血液脳関門は、脳と血液の間のコミュニケーションに利用できる最大の表面積を持っている。脳毛細血管内皮細胞、細胞外マトリックス、アストロサイトポッドサイトから構成されている。血液-脳脊髄液バリアは、脳室の脈絡叢にある。脈絡叢の上皮細胞は、主に血液脳脊髄液関門のバリア機能を担っている。血液脳関門と血液脳脊髄液関門は、傍細胞の拡散を抑制し、常に変化する血液環境、感染症、毒素の影響から中枢神経系を保護し、中枢神経系の恒常性を維持するために重要である(7-9)。
中枢神経系の感染を引き起こすためには、まず、ウイルスが脳の保護バリアをうまく通過しなければならない。血液脳関門または血液脳脊髄液関門を通過するには、ウイルスの特別な適応が必要である。これにもかかわらず、SARS-COV-2は、感染後にいくつかの特殊な方法で急速に神経系に侵入することができる(10-13)。
SARS-COV-2が中枢神経系に侵入する主な方法としては、以下の3つが考えられる。(1) SARS-CoV-2はアンジオテンシン変換酵素2を介して血管内皮細胞に直接感染し、血液脳関門を直接通過する。(2) SARS-CoV-2は、嗅神経を介してシナプス結合を介して中枢神経系に侵入する。(3) SARS-CoV-2は炎症を誘発して脳バリアシステムを破壊し、中枢神経系に侵入する。
SARS-CoV-2は血管内皮細胞に直接感染し、血液脳関門を通過する。
研究により、SARS-COVと同様に、SARS-COV-2はACE2を使用して細胞内に侵入できることが示されている(14,15)。SARS-CoV-2のスパイクタンパク質(Sタンパク質)は、ウイルス膜から突出した三量体であり、各単量体には受容体結合ドメイン(RBD)が含まれている。これを介して、ウイルスタンパク質は、多くの宿主細胞の表面にあるACE2受容体と直接相互作用することができる。Sタンパク質は、SARS-CoV-2がACE2受容体に結合する(細胞に感染する)ための主要なツールであり、ACE2に強く結合することができる(16)。したがって、Sタンパク質はCOVID-19の治療やワクチン開発の重要なターゲットとして利用される可能性がある。
また、宿主細胞プロテアーゼは、ウイルスの侵入や細胞への感染にも重要な役割を果たしている(17,18)。SARS-CoV-2の表面のSタンパク質のS1サブユニットは、最初に神経細胞のACE2受容体に結合して標的細胞の表面に付着し、その後、ウイルスのS2サブユニットは、宿主細胞のセリンプロテアーゼTMPRSS2によって活性化され、ウイルスは神経細胞に侵入することができる(19)。したがって、TMPRSS2活性は、宿主細胞におけるSARS-CoV-2の感染と伝達に非常に重要であり、神経合併症の重要な病因となっている(20-22)。
SARS-CoV-2のSタンパク質活性は、従来のコロナウイルスに比べて弱いが(23)、SARS-CoV-2のSタンパク質活性は、従来のコロナウイルスに比べて弱い。しかし、SARS-CoV-2のSタンパク質のACE2への結合親和性は、SARS-CoVのSタンパク質のACE2への結合親和性の10〜20倍である(15)。これは、SARS-CoV2の受容体結合ドメインが、いくつかの重要なアミノ酸残基において、これまでのコロナウイルスとは異なるという事実に起因する(17)。それは4つの正に荷電した残基と5つの負に荷電した残基を含むので、SARS-CoV-2 Sタンパク質はSARS-CoV Sタンパク質よりもわずかに正に荷電している。SARS-CoV-2のSタンパク質とSARS-CoVのSタンパク質の間の電荷差は非常に小さいが、この効果は、ウイルス粒子上に多数のSタンパク質が存在することによって増幅されることができる(16)。
SARS-CoV-2のRBDと細胞のACE2受容体との界面では、Sタンパク質のアミノ酸含有量の違いにより、Sタンパク質と宿主細胞の受容体との間でより特異的な相互作用が起こり得る。したがって、SARS-CoVと比較して、SARS-CoV-2は、非特異的相互作用および特異的相互作用を介して、ヒトの体内の異なる標的との相互作用を確立する可能性が高い。これらのすべては、最終的にSARS-CoV-2がヒト細胞に侵入する能力を高めることができ(16)、これは、COVID-19がより強い病原性、伝染性、およびより大きなグローバルな影響力を有する理由を説明することができるかもしれない(17)。
SARS-CoV-2とSARS-CoV Sタンパク質との間のこの電荷の違いは、内皮細胞の接着や血液脳関門の横断に大きな影響を与える可能性がある(16)ため、血液脳関門の血管内皮細胞に感染したSARS-CoV-2は、脳への到達効率が高く、血液脳関門を直接中枢神経系に横断することが可能である(16)と考えられる。
神経系におけるACE2の分布を調べたところ、ACE2は、脳弓下器官、孤束核、延髄の腹外側領域などのさまざまな脳領域、および運動皮質や運動皮質などの領域で発現していることがわかった。空間分布解析によると、ACE2は黒質にも発現していた(24-26)。グリア細胞や神経細胞にACE2受容体が存在することから、脳障害や神経症状を引き起こすSARS-CoV-2の標的となる可能性があると考えられている(27)。
また、ACE2は肺、動脈、心臓、腎臓、腸、脳の細胞外表面(細胞膜)に広く付着している(16,28,29)。呼吸器系の関与に加えて、SARS-COV-2感染は多臓器機能障害を引き起こす可能性がある。呼吸器症状が優勢であるにもかかわらず、心筋、腎臓、腸、肝臓に感染後の障害があり、おそらくACE2は免疫、炎症、心血管疾患の間の重要なリンクを提供している(17)。
新型コロナウイルス肺炎の剖検では、脳浮腫と神経細胞の部分的な変性が認められた(30)。しかし、SARS-CoV-2が神経細胞やグリア細胞に存在することを証明する十分な剖検エビデンスはない。これを証明するためには、さらなる研究が必要である。
嗅神経経路
12対の頭蓋神経のうち、嗅覚神経は実在する神経ではなく、中枢神経系の伝導束である。嗅神経自体の特殊な位置と構造と相まって、SARS-CoV-2が中枢神経系に侵入するメカニズムにおいて、嗅神経を介して中枢神経系に侵入するウイルスもまた、主要な方法の一つであると推測される(32, 33)。そして、嗅神経はこのように中枢神経系に侵入する方法を提供し、血液脳関門をうまく迂回し(34-36)鼻上皮と中枢神経系との間のチャネルを効果的に作っている。呼吸器感染の初期段階では、SARS-CoV-2は嗅神経を介して脳に入ることができる(37)(図2)。
図2 SARS-CoV-2は、嗅神経を介して脳に侵入する
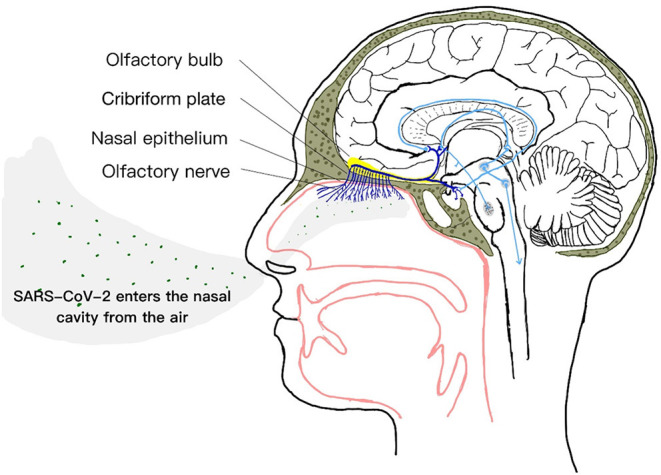
鼻腔内では、特殊な嗅神経上皮は、主に支持細胞からなる先端面を有し、嗅毛を含むニューロンの樹状突起を支持している(38)。嗅覚ニューロンの樹状突起は、鼻の気道で直接露出している(10)。嗅覚系は、通常の条件下ではウイルス神経の侵入を制御するのに非常に効果的であるが(39)しかしながら、いくつかの研究からのデータは、鼻呼吸器上皮細胞がACE2およびTMPRSS2を発現していることを示している(31,38,40-42)。上述したように、SARS-CoV-2は、ACE2および宿主細胞のセリンプロテアーゼTMPRSS2の助けを借りて細胞内に侵入することができる。
嗅神経上皮に位置するACE2およびTMPRSS2の発現は、SARS-CoV-2の中枢神経系への潜在的な侵入ポイントを示している(31)ので、ウイルスは嗅神経に侵入することができる。神経細胞の逆行性または前向性輸送は、キネシンおよびキネシンによって実現される(37,43,44)。感染過程において、SARS-CoV-2は、嗅神経を利用して錐体骨の篩状板を通過し、脳への浸潤を引き起こす(45,46)が、その結果、脳の関連領域へのSARS-CoV-2の迅速な神経細胞間伝播をもたらし、その結果、脳神経細胞の表面に発現しているACE2と相互作用する(47-49)。SARS-CoV-2の感染性が高く、嗅覚機能障害に関連しているのは、このような細胞トロピズムが理由であると考えられる(38)。
SARS-CoV-2は鼻腔内の鼻呼吸器上皮細胞に直接作用することができるため、嗅覚機能障害は疾患の初期段階でしばしば起こる。軽度から中等度の症例では、突然の嗅覚および味覚の喪失は、SARS-CoV-2ウイルス感染初期の最も強い予測症状と考えられており(50)この軽度の非特異的な症状は無症状になることがある。あるいは軽度の感染者の唯一の症状である。アノスミア(嗅覚脱失)に関連した症状の報告は、SARS-CoV-2感染の徴候であり、COVID-19の徴候とみなすべきである(51,52)。一過性脳浮腫などの神経疾患を伴う場合は、SARS-CoV-2の神経侵襲性を第一に考慮すべきである(38)。
SARS-CoV-2による嗅覚機能障害は、以下の4つの機序で説明できると考えられる。
- 鼻粘膜のウイルス感染は、嗅粘膜を含む鼻組織の炎症を誘発し、それによって臭気化学物質と嗅覚受容体の間に閉塞性のバリアを作ることができる;
- 嗅覚受容体への直接的な損傷は、臭気信号の伝達を妨げる可能性がある;
- ウイルスは、神経刺激性であるため、嗅神経の経路に沿って嗅覚を担当する脳の領域を攻撃することができる;
- 嗅覚の喪失は、実際には脳浮腫と部分的な神経変性の後遺症である可能性がある。これら4つのメカニズムのいずれかまたはすべてが、COVID-19の嗅覚喪失につながる可能性がある(53)。
したがって、早期の嗅覚喪失と長期的な嗅覚との関係を探ることは、特別な臨床的・予後的価値を持つ(54)。
嗅神経上皮がACE2やTMPRSS2を発現していることは多くの研究で証明されているが、嗅球から中枢神経系への伝達束にACE2,TMPRSS2,SARS-CoV-2が広く存在していることを証明する十分かつ強力な研究はない。今後、これらの矛盾を解消するためにはさらなる研究が必要であり、また、SARS-CoV-2が嗅球内に存在することを証明するためには、より多くの剖検報告が必要である。最後に、ヒトの嗅神経伝導路におけるSARS-CoV-2感染細胞の分布を調べた。
コロナウイルスは炎症反応を誘導して血液脳関門系を破壊する
炎症による血液脳関門の破壊も、SARS-CoV-2が中枢神経系に侵入する方法の一つである。SARS-CoV-2に感染すると、以下の3つの方法で多くの炎症性メディエーターを産生することで血液脳関門を破壊することができる。
SARS-CoV-2は、免疫細胞によるサイトカインの放出を直接誘導する。
SARS-CoV-2が人体に侵入すると、ウイルスは単球/マクロファージ、好中球、T細胞、ナチュラルキラー細胞、マスト細胞などの免疫細胞を活性化する。活性化された免疫細胞は、サイトカインを合成して放出することでウイルスを殺す(55-59)。これらのサイトカインは、主にインターフェロン(IFN)インターロイキン(IL)ケモカイン、および腫瘍壊死因子(TNF)を含む(60)。それらの機能の一部は炎症反応を促進するものであり、一部は炎症反応を抑制するものである。これらのサイトカインは、健康なヒトの体内ではバランスのとれた状態に維持されている。これらの中でも、プロ炎症性因子は他の免疫細胞を活性化してリクルートし、免疫細胞はより多くのサイトカインを分泌し、より多くの免疫細胞を活性化してリクルートし、このように正のフィードバックサイクルを形成する(55)。
SARS-CoV-2は、免疫細胞が過剰な免疫を産生し、サイトカインが制御されず、大量のサイトカインが放出され、正のフィードバックを増幅させ、バランスを崩し、制御されていない機能不全の免疫応答をマーキングし、全身の炎症を引き起こし、炎症応答をさらに悪化させ、病気の重症度を増大させる。この過剰な免疫反応はウイルスを殺すことができるが、それはまた、いくつかの追加の損傷を引き起こす可能性がある。その中でも、血管が最もダメージを受けた。サイトカインストームが血管壁をより容易に貫通させ、血液脳関門が障害され(61)ネオコロナウイルスが脳内に侵入し、対応する中枢神経系の症状を誘発する。
グリア細胞の活性化は炎症性サイトカインを放出する
神経刺激性ウイルスの中には、グリア細胞の炎症促進状態を誘導し、サイトカインを分泌させるものがある(62)。前述したように、グリア細胞はACE2を発現しており、嗅神経や血液由来などの経路で中枢神経系に侵入するSARS-CoV-2もグリア細胞を活性化して親炎症状態を誘導するのではないかと推測されている(37, 63)。また、コロナウイルスに感染すると、グリア細胞がインターロイキン-6,インターロイキン-12,インターロイキン-15,腫瘍壊死因子αなどの炎症因子を大量に分泌することが実験で確認されている。(52). また、これらのサイトカインは血液脳関門を傷つけ、コロナウイルスの脳内への侵入をさらに促進し、中枢神経系疾患の症状を引き起こす。
これまでのところ、SARS-CoV-2患者のグリア細胞の剖検報告はまだ不十分である。我々は、既存の文献に基づいて、この可能性のあるメカニズムを提案している。今後の研究では、SARS-CoV-2がACE2を介してグリア細胞に感染するのか、あるいはグリア細胞内にSARS-CoV-2に結合する他の受容体があるのかを証明するために、より多くの剖検報告が必要である。
血管内皮成長因子が炎症を誘導する
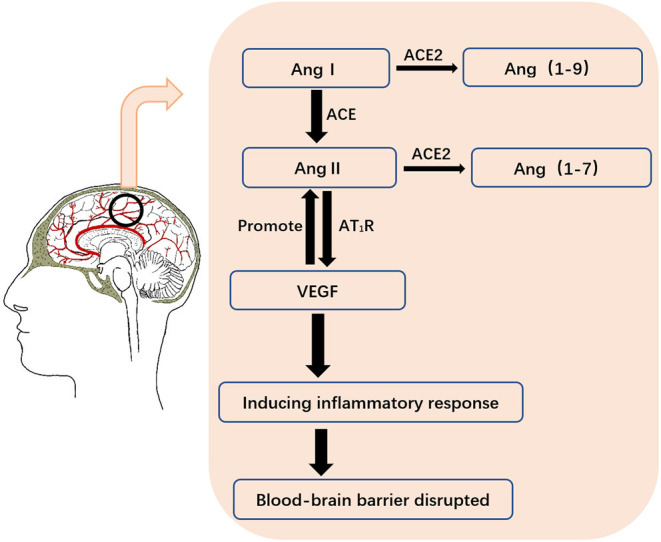
血管内皮増殖因子(VEGF)は中枢神経系に広く分布している(64)。また、SARS-CoV-2とACE2の組み合わせは、炎症反応に関与するレニン-アンジオテンシン系を活性化し、アンジオテンシンII(AngII)とアンジオテンシンII型1受容体(AT1R)の結合により、VEGFの合成をさらに促進することができる。実際、脳疾患では、VEGFは血管新生を促進するだけでなく、炎症反応を誘導して血液脳関門を破壊する(64,65)。
炎症は血管形成の前駆体であり伴侶であり、血管伝染性の増加と炎症性細胞のリクルートによって明らかになる(65)。ACE2は、Ang IおよびAng IIをそれぞれAng 1-9およびAng 1-7に触媒する重要な酵素である(66)。SARS-CoV-2がACE2を攻撃すると、この酵素の不活性化により、ACE/AngII/AT1R軸シグナルが増強され、その後、過剰なAngII産生が生じる。SARS-CoV-2に感染した脳では、AngIIの累積フィードバックがACE2の増加を促進した。VEGFは逆にAng IIを増強し、TNF-α、IL-1β、IL-6,IL-8,ICAM-1などの炎症性サイトカインの放出という悪循環を形成している(64,67)。さらに、これらのサイトカインのうち、インターロイキン-6(IL-6)は、プロ炎症性サイトカインの重要なメンバーであり、COVID-19症状の重症度と正の相関がある。COVID-19の重症度の指標の一つとして使用され得る(37,58)(図3)。
図3 VEGFによって引き起こされる炎症は血液脳関門を破壊する
SARS-CoV-2による神経系疾患の臨床症状
SARS-CoV-2によって引き起こされる可能性のある神経疾患は、➀脳血管疾患などの関連肺疾患や全身疾患による神経系への影響、➁脳炎などの中枢神経系へのウイルスの直接侵入、➂ギラン・バレー症候群(GBS)などの感染後の免疫介在性合併症の可能性、③脱髄性疾患の可能性、の3つに大別される。
脳血管疾患とは、脳の血管に発生し、頭蓋内の血液循環が乱れることで脳組織に障害を起こす疾患群を指す。
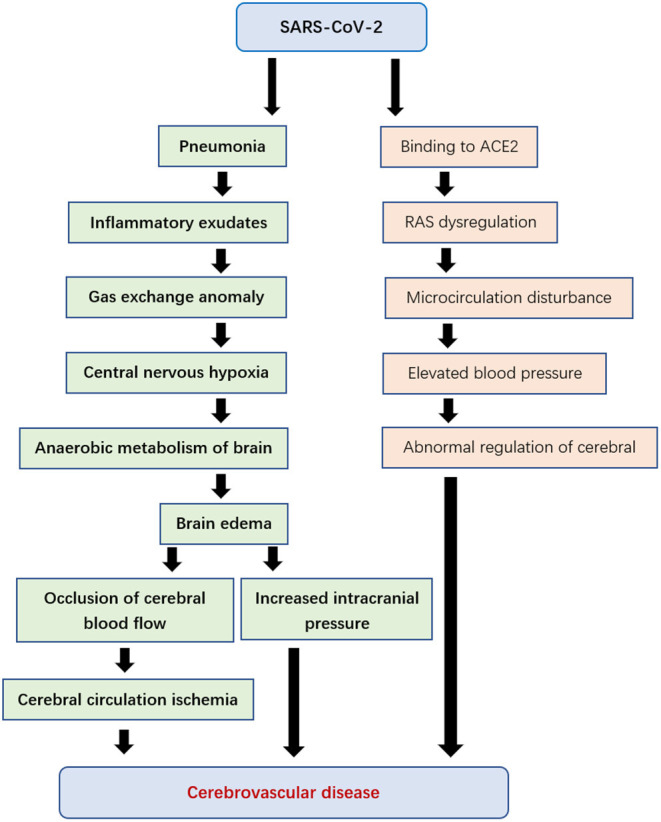
SARS-CoV-2に感染した患者の主な症状は肺疾患であるが、脳血管疾患もある(68)。ウイルスが肺組織で増殖すると、びまん性の肺胞性炎症性滲出液や間質性炎症性滲出液が生じ、さらにはヒアリン膜形成を起こす。これにより、肺胞ガス交換異常、中枢神経系の低酸素症、脳組織の嫌気性代謝の亢進、細胞間浮腫の誘発、脳血流の閉塞、脳循環の虚血を引き起こし、頭蓋内圧の上昇とともに脳機能が徐々に悪化していく。急性虚血性脳卒中などの急性脳血管障害の発生を誘発することもある(3,37)。
一方、血圧上昇による脳出血もACE2受容体の発現が原因である可能性がある(69, 70)。ACE2は心・脳血管保護因子の一つであり、血圧調節や抗動脈硬化機構に重要な役割を果たしている(71)。SARS-CoV-2は、ACE2受容体に作用してレニン・アンジオテンシン系(RAS)のバランスを崩し、微小循環障害を引き起こし、脳血流調節に影響を与え(72,73)血圧の異常上昇を引き起こし、脳出血や虚血性脳卒中のリスクを高める可能性がある(図4)。
図4 SARS-CoV-2による脳血管疾患
脳炎とは、病原体による脳実質の炎症性病変のことで、神経細胞の損傷や神経組織の損傷などがある。急性期のエピソードを特徴とし、頭痛、発熱、吐き気、嘔吐、倦怠感、痙攣、意識障害などが一般的な症状である(37)。現在、SARS-CoV-2に感染した多くの患者にウイルス性脳炎が存在することから、この神経学的合併症の存在がさらに推測されている(74-77)。
北京大丹病院の治療チームは、SARS-CoV-2感染者の脳脊髄液中にSARS-CoV-2が存在することをゲノムシークエンシングにより確認し、ウイルス性脳炎を臨床的に確認した(37)。これにより、SARS-CoV-2が脳炎を引き起こすことの確かな根拠が得られた。しかし、SARS-CoV-2に感染した患者の脳組織画像には炎症の兆候は見られなかった(78)。SARS-CoV-2はMERS-CoVやSARS-CoVのようにウイルスの液胞を産生するのではないかと推測され、この仮説が成り立つならば、液胞化は感染に対する防御である可能性がある。この問題はさらに研究を重ね、より多くの病理学的症例を明らかにする必要がある。
SARS-CoV-2の患者では、SARS-CoV-2は免疫細胞を刺激して様々なサイトカインを産生し、その結果、神経脱髄を引き起こす免疫応答プロセスを引き起こすことができる(79)。例えば、SARS-CoV-2はギラン・バレー症候群を引き起こす可能性がある(80,81)。ギラン・バレー症候群は、急性特発性多発神経炎または対称性多発神経炎としても知られており、急性多発神経障害である(82)。臨床症状は、進行性の上行性対称性麻痺、四肢麻痺、および様々な程度の感覚障害である(83)。SARS-CoV-2による神経脱髄の正確な病態は明らかにされておらず、さらなる研究が続けられている。
今後の展望
COVID-19は世界への挑戦である。現在、SARS-CoV-2が中枢神経系に侵入し、神経系疾患を誘発し得ることが十分に証明されている。SARS-CoV-2の中枢神経系への侵入経路として考えられるのは、感染した内皮細胞への直接侵入、嗅神経を介した侵入、炎症を誘発して脳関門系を破壊することによる侵入などである。これらの経路はいずれもACE2受容体に関連しているため、COVID-19患者の中枢神経系保護のためのより良い対策を講じるためにも、SARS-CoV-2とACE2の関係をさらに研究する必要がある。実際、ヒト呼吸器ウイルスは、三叉神経、脳脊髄液、リンパ系など、他の異なる経路でも中枢神経系に侵入する可能性がある。今回取り上げた3つのメカニズムはSARS-CoV-2にも当てはまる可能性があるが、決定的な病理学的証拠が出るまでは、SARS-CoV-2の他の侵入メカニズムにも警戒しなければならない。さらに、COVID-19患者における脳炎、脳血管疾患、神経脱髄症状、および嗅覚変化は、すべてSARS-CoV2感染に関連している可能性が高いことが、既存のデータから推測できる。これらの症状は、患者の重症度や予後の指標となる可能性がある。これらの知識を理解することは、中枢神経系症状の予防と治療、およびCOVID-19患者のリハビリテーションのために非常に重要である。
さらに、最近の研究では、Nrp1などの神経細胞に発現する他のタンパク質もSARS-CoV-2の受容体になる可能性があることが指摘されている。今後の研究では、SARS-CoV-2が代替受容体を用いて中枢神経系に侵入できるかどうかを検証する必要がある。
