Contents
Prenatal epigenetics diets play protective roles against environmental pollution
www.ncbi.nlm.nih.gov/pmc/articles/PMC6524340/
要旨
発生期の生殖細胞および着床前胚は、それらの細胞内のエピゲノムが劇的に消去・再構築されているため、内因性および外因性の環境因子の影響を最も受けやすいと考えられている。栄養、気候、ストレス、病原体、毒素、社会的行動などの環境因子への曝露は、配偶子形成期および初期胚発生期に子孫の病気感受性に影響を与えることが示されている。
ゲノムに保存されている遺伝情報の発現を決定する早生期のエピジェネティックな改変は、出生前の曝露とその後の表現型の変化を結びつける一般的なメカニズムの一つと考えられている。大気汚染、内分泌撹乱化学物質から重金属に至るまで、環境汚染はすでに人間の健康に重大な影響を与えていることが、研究によってますます示唆されている。
さらに、証拠の増加は、現在、エピゲノムの関連する変更にそのような汚染をリンクしている。
エピジェネティクスダイエットは、ブロッコリーのイソチオシアネート、大豆のゲニステイン、ブドウのレスベラトロール、緑茶のエピガロカテキン-3-ガレート、果物のアスコルビン酸などの生理活性のある食物化合物のクラスを指し、エピゲノムを修飾して健康上の有益な結果につながることが示されている。
このレビューでは、主にエピゲノム上の出生前環境汚染曝露の原因と結果、および環境汚染に対するエピゲノム異常を中和する上で中心的な役割を果たす可能性がエピジェネティクスダイエットの潜在的な保護的役割に焦点を当てます。
キーワード
エピジェネティクスダイエット、環境汚染、DNAメチル化、ヒストン修飾、miRNA
背景
世界保健機関(WHO)の報告書によると、18億人の子どもたち(世界の子どもたちの約93%)が毎日汚染された空気を吸っており 2016年に急性下気道感染症で死亡した60万人の子どもたちにつながっていると推定されている。
WHOの別の最近のデータによると 2012年には、大気汚染、水質汚染、土壌汚染、化学物質の暴露、気候変動、紫外線照射などの環境リスク要因が、100以上の病気や怪我を伴う1,260万人の死亡を引き起こしたことが示されている。蓄積された証拠は、環境汚染が人間の健康に深刻な影響を与えていることを強く示唆している。
疫学研究は、環境要因への早期の人生、特に出生前、曝露がそのような肥満、心血管、糖尿病、さらには後の人生で癌などの様々な慢性疾患に異なる感受性につながる変更されたエピジェネティックプロファイルを介して、胎児の永続的な代謝や生理的変化を引き起こす可能性があることを示唆している。
エピジェネティクスは、DNA配列の変化なしに遺伝子発現における有糸分裂的または減数分裂的な遺伝的変化を指す[1, 2]。エピジェネティクスは、1940年代にコンラッド・ワディントンによって「…表現型をもたらす環境と遺伝子の相互作用」[3]として最初に定義された。DNA、ヒストン蛋白質、RNA、ノンコーディングRNAに対する特定の化学修飾は、クロマチンのコンフォメーションと遺伝子発現を調節する複雑な調節ネットワークを形成している。
DNAのメチル化とは、一般的にメチル基がシトシン環の5-炭素に付加されて5-メチルシトシン(5mC)になるプロセスを指する。DNAのメチル化は、ほぼ独占的にCpG部位(DNAの長さに沿った塩基配列のライナー配列の中で、シトシンヌクレオチドとグアニンヌクレオチドが隣り合わせに存在するDNAの領域)に存在している[4]。
ヒストン修飾とは、アセチル化、リン酸化、メチル化、ユビキチン化、スモイル化、アデノシン二リン酸(ADP)リボシル化など、ヒストンタンパク質のテールドメインでしばしば起こる翻訳後修飾の多様な配列のことである[5]。
エピゲノムとは、ゲノム全体にわたるこれらの潜在的な遺伝的変化のすべてを完全に記述したもの[6]を指し、その中でもDNAメチル化とヒストンの共有結合的修飾は、これまでによく研究されてきた最も重要なエピジェネティック制御である。
哺乳類の胚は、生殖細胞の発生期と着床前の時期を含む、エピジェネティックなリプログラミングの2つの主要なサイクルを経験しており、この間、エピゲノムは内因性および外因性の環境因子に対して脆弱である。出生前のエピゲノムリプログラミングの摂動は、子孫の疾患感受性に影響を与えることが示されている。
成人病の胎児の基礎(FEBAD)仮説は、そのような栄養や環境刺激などの出生前の侮辱は、後の人生で病気のリスクが高くなるにつながる発達プログラミングを妨害することができることを仮定している[7]。
健康と疾病の発生起源(DOHaD)は、発生可塑性を記述するために使用される別の同様の概念であり、遺伝子型から表現型への移行時に環境の合図が重要な役割を果たすことを指摘している[8, 9]最近では、DOHaDの焦点は、胎内栄養不良から、生物の生理に影響を与え、成人期に疾患感受性を変化させる可能性のある非栄養因子へと拡大している。これらの非栄養的危険因子の中でも、早期の環境汚染物質への曝露が注目されている。
蓄積研究は、エピジェネティクスは、環境刺激、胎児のプログラミング、および成人期の表現型をリンクする最も重要な分子メカニズムの一つである可能性があることを提案している。それらの可逆的な性質のために、エピジェネティックな変更は魅力的な治療ターゲットになってきている[2]。証拠の増加体は、母体の食事は子孫の永続的な代謝変化に関連付けられており、実質的に栄養プログラミングと呼ばれる子供と大人の健康を向上させることができることを示している。
この文脈では、栄養エピジェネティクスが浮上し、環境要因による発達の摂動を防ぐための新しい方法を提供する。エピジェネティクスダイエットは 2011年に私たちの研究室によって造語、エピゲノム[10]を調節することができる生理活性食物化合物のクラスを指する。研究は、エピジェネティクス・ダイエットが、DNAメチル化、ヒストン修飾、マイクロRNA(miRNA)調節などのエピジェネティックな調節に重要な役割を果たしていることを示している。
いくつかの生物活性化合物は、汚染によって引き起こされるエピゲノムへのダメージを打ち消したり、減衰させたりする可能性がある。最も顕著な例として、メチル供与体を母体に補給することで、公衆衛生上懸念される内分泌かく乱化学物質であるビスフェノールAによって誘導されるDNAのメチル化を逆にすることが示されている[11]。
このレビューの目的は、エピゲノムに対する環境汚染物質への早期生活、特に出生前暴露の影響と原因、および親のエピジェネティックな食事補給が環境汚染誘発性の悪影響を防ぐ可能性のあるメカニズムに関する最近の研究成果の要約を提供することである。私たちのレビューは、ますます深刻化する環境汚染に対処するための新しい予防および治療戦略に意味を提供する。
配偶子形成と胚発生におけるエピジェネティックな安定性
哺乳類の胚では、エピゲノムのリプログラミングには2つの大規模な波がある(図1)。第一の波は精子と卵の融合から着床前まで、第二の波は生殖細胞の発生中に起こる[12, 13]。ここでは、エピゲノムの中で最も重要な構成要素の一つであるDNAメチロム、哺乳類におけるリプログラミング、環境への感受性についてレビューする。
図1 ヒトの配偶子形成・胚発生期におけるDNAメチル化の動態とエピジェネティックな安定性の模式図
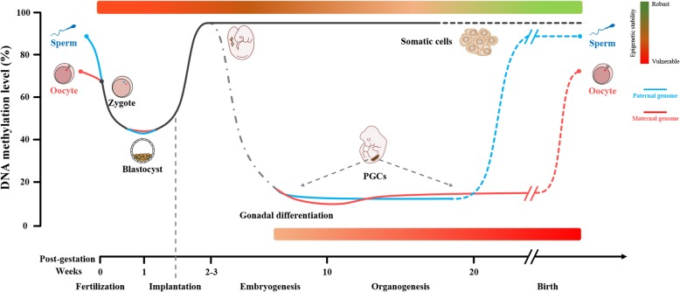
生殖細胞におけるDNAメチル化リプログラミング:ヒトの原始生殖細胞(PGC)は発生初期に脱メチル化し、生殖腺分化から配偶子形成までの間、精子母細胞と卵子母細胞のDNAメチル化は受精まで徐々に上昇し、受精時には精子は卵子母細胞よりも高いメチル化レベルに達する。
胚発生時のDNAメチル化リプログラミング:受精後、最初の1週間以内に、父方のゲノムのDNAメチル化が低いレベルに達する初期の胚盤胞期に、接合体のメチル化レベルが最も低いレベルに減少する;その後、体細胞の系統では、安定したメチル化レベルを持つ成熟した体細胞に発展するまで、de novoメチル化が発生する。
発生時のエピジェネティックな安定性:エピジェネティックな安定性はDNAメチル化レベルに比例する。青線は父方のゲノムを示す。赤線は母方ゲノムを示す。灰色の破線は成熟した体細胞を示す。赤から緑へ、エピゲノムの脆弱性から堅牢性までを示す。PGCは原始生殖細胞。Guoら[14]、HembergerとPedersen[46]とZhuら[20]からの許可を得て使用している。
胚発生初期のエピゲノムリプログラミング
受精後、初期胚では劇的な脱メチル化が起こる。精子(86%、中央値)と卵子(72%、中央値)のメチル化の量は急速に減少し、初期の胚盤胞期胚(32-64細胞)の内部細胞塊(ICM)では最小レベル(43%、中央値)に達する[14,15]。この過程では、両親から受け継いだ初期胚特有のメチル化パターンや後天的なエピジェネティック修飾は消去されるが、多能性の確立に重要なインプリント遺伝子のメチル化領域は正確に保持されている。例えば、父方のゲノムに含まれるインプリンティング遺伝子H19 [16] と Rasgrf1 [17] は、DNA メチルトランスフェラーゼ1 (DNMT 1) [19] の作用により、受精後の広範な脱メチル化から保護されている [18]。ゲノム全体の脱メチル化の前に、父方ゲノムの顕著な変換は、精子クロマチンのプロタミンがアセチル化ヒストンに置換されている卵細胞質で発生し、脱メチル化がクロマチンリモデリングにリンクしている可能性が示唆されている[18]。最近の研究では、2細胞期以降、父方のゲノムで起こる脱メチル化は母方のゲノムで起こる脱メチル化よりもはるかに速く、徹底しており、この高い母方のゲノムメチル化は着床後の段階まで、特に胚外絨毛で維持されていることが明らかになった[20, 21]。この知見は、DNAメチル化が母方ゲノムと父方ゲノムに非対称的に分布していることを示している。逆に、父方ゲノムに比べて、母方ゲノムは初期胚に多くのDNAメチル化メモリーを寄与している可能性があり、したがって、汚染物質、ウイルス、栄養不良などの有害な環境因子は、受精期に母方ゲノムのメチル化パターンを変化させ、急性異形成や後世の疾患感受性につながる可能性が高い。それは、脱メチル化とde novoメチル化は、初期胚のグローバルなメチル化が胚盤胞段階で最低レベルに到達する前に動的平衡を維持することが指摘されている[20]。着床後、デノボメチル化の第一波が起こり[1]、胚盤胞期にはDNMTによってDNAメチル化パターンが再構築される。しかし、不思議なことに、父方のエピゲノムを再メチル化するタイミングは母方のエピゲノムよりも早く、その中でもH19は典型的な例である[22]。生後2〜3週齢頃になると、ヒト胚の細胞は比較的安定したメチル化レベルを持つ成熟体細胞へと徐々に成長していく[14](図11)。
受精期のエピゲノムリプログラミング
ヒトの原始生殖細胞(PGC)は、胚発生の初期段階で産生される。PGCは、卵母細胞と精子の胚前駆細胞であり[15]、子孫に遺伝情報を伝達し、種の存続を維持することができる。通常の状況下では、着床後の胚のほとんどの組織や器官のゲノムDNA上のDNAメチル化マーカーは基本的に安定したままであるが、PGCのDNAメチル化マーカーは、着床前胚の第一波よりもはるかに徹底した第二の大規模な消去と再構築を経験することになる[14]。妊娠約10〜11週後、PGCのグローバルなDNAメチル化は、着床後初期の胚では90%以上であったものが、着床後初期の胚では7.8%、雌のPGCでは6.0%にまで激減する[14]。PGCのほとんどの領域のDNAメチル化記憶は完全に消去されるが、いくつかの反復配列は、特に進化的に若い配列とアルファ衛星のような高いレベルの残留メチル化を保持している[14, 23, 24]ので、潜在的な世代交代エピジェネティクスの基礎を示唆している。低メチル化の期間を経て、男性生殖細胞の再メチル化は胚発生の後期に起こるが、女性生殖細胞のde novoメチル化は出生後、長期にわたる発生過程のために起こる。ヒト精子細胞のグローバルなDNAメチル化は、卵母細胞のそれよりも高いことが示されている[14]。生殖細胞におけるリプログラミングの目的としては、主にインプリンティングを持つ種で起こるインプリンティングのリセット[18]、個々の内因性および外因性環境因子の影響を受けた後天的なエピジェネティック修飾の除去[18, 25, 26]、および活性脱メチル化[27]やX染色体不活性化[28, 29]による突然変異率の低下という3つの目的が考えられる(図11)。
後期発生におけるエピゲノムリプログラミング
胎児の適応は、近年新たに登場した概念であり、初期の胚発生や着床とは切り離された発達後期のエピジェネティックな調節の役割を解釈している。この文脈では、微妙なエピジェネティックな変更は、胎児の遺伝子型が発達環境因子の広範な様々な応答を可能にする。妊娠初期は胎児にとって最も影響を受けやすい時期であるが、胚発生後期、乳児期、および幼児期における環境刺激は、後の人生においても長期的な健康への影響を及ぼす可能性があることに留意すべきである[9, 30]。研究では、成人期に補充された高脂肪食(HFD)が骨格筋の大規模なメチル化変化を誘発することが示されている[31]。思春期前後の葉酸補給は、PPARα遺伝子のハイパーメチル化とDNMT活性の低下を誘導することが示されている[32,33]。さらに、離乳後のマウスにメチルドナー欠損食を与えた場合、IGF2インプリンティングの恒久的な消失、mRNA発現の調節障害、c-Mycやc-Rasなどのプロトオンコゲーンの低メチル化が認められた[34]。これらの研究はすべて、ヒトのエピゲノムの可塑性は成人期にも持続する可能性があり[31]、エピジェネティックなメカニズムが生涯にわたる適応に関与していることを示唆している[35]。
遺伝子発現と細胞のアイデンティティにおけるDNAメチル化の役割
エピジェネティックな修飾の中で最も重要なものの一つとして、DNAメチル化は遺伝子発現の局所的な制御に重要な役割を果たすことができる。CpG島(CGI)とは、CpG部位の頻度が高く、主に非メチル化されている短いDNA配列である[36]。CGIは一般的に、少なくとも200bpを有し、CGの割合が50%を超える領域として定義される。プロモーターおよび遠位の調節領域のCGIにおける複数のメチル化CpG部位は、ヌクレオソームを不安定化し、タンパク質をリクルートし、その結果、クロマチン構造のリモデリングおよび転写抑制を引き起こす可能性がある[37]。メチル化されたCpG部位は、異なるセットのメチル-CpG結合タンパク質(MBP)によって認識され、エピジェネティック修飾因子を引き付けて部位特異的なクロマチン組織を管理することで、DNAメチル化シグナルを転写抑制状態に変換することができる[38]。一方、CpG部位のメチル化は、E2F1,c-Myc、CTCT、CREBなどの特定の転写因子の結合を阻害し、転写開始を阻害することができる[39]。DNAメチル化はまた、ヌクレオソームの位置を変えて転写複合体をリモデリングし、遺伝子の転写を阻害することもある。さらに、遺伝子発現はプロモーター領域と遺伝子本体のメチル化レベルによって同時に制御される可能性があることを示す証拠が増えてきている[40, 41]。
また、DNAメチル化は、細胞の同一性の確立と維持のために極めて重要であり、不可欠である。胚性幹細胞(ESC)の多能性には、グローバルなハイメチル化が必要である[42]。細胞分化の過程で、ESCは徐々に可塑性を失い、分化した細胞型にアイデンティティを狭めていく。この過程で、多能性、発生、配偶体特異的な遺伝子のDNAメチル化が世界的に増加するとともに、遺伝子エンハンサー領域だけでなく、系統特異的な制御領域のDNAメチル化が失われ、異なるメチルノミックプロファイルを持つ細胞のアイデンティティが定義される [39]。組織や臓器によって異なるメチロムを持つため、環境因子への曝露は、組織特異的な方法でDNAメチル化パターンの変化や健康への悪影響をもたらす可能性がある [43-45]。
エピジェネティックな安定性と環境因子
エピジェネティックな安定性は、静的モデルではDNAメチル化とヒストン修飾の量に比例する[46]。ゲノムDNAのグローバルなハイメチル化は、ゲノムの不安定性や染色体の構造異常につながる可能性があり、これは癌や老化の一般的な表現型でもある[47,48]。逆に、特に胎盤におけるグローバルなハイメチル化は、妊娠糖尿病やダウン症などの発達障害と関連している[49,50]。これらのことから、DNAメチル化のバランスがヒトの遺伝的安定性と個人の健康にとって極めて重要であることが示されている。動的モデルでは、エピジェネティックな改変は可逆的であるため、エピゲノムは永続的に脆弱である。幹細胞の割合が生物のエピジェネティックな脆弱性に寄与していることから、発生に伴ってエピゲノム全体の安定性が徐々に低下するのは、組織や臓器における幹細胞の割合の減少が少なくとも部分的には原因である可能性があることが示唆されている[46]。
ヒトを含む哺乳類では、エピゲノム、特にDNAメチル化パターンは、配偶子形成と初期胚発生において全体的に確立されている。また、エピゲノムの可塑性は、幅広い発生可能性を持つ細胞の生成にも寄与している[18]。この点で、生殖細胞および着床前胚におけるエピジェネティック・リプログラミングは、初期胚発生および胎盤発生において特に重要である[51]。このことは、初期発生段階におけるエピゲノムの摂動が、異常な胎児および胎盤の発生に寄与しているという憶測につながる[52]。このような個体発生の敏感な時期に環境からの刺激によって引き起こされるエピジェネティックな調節障害は、疾患感受性の変化、さらには人生の後半での表現型の変化につながるライフコース全体にわたって持続する可能性がある[13, 14]。
これまでの研究では、特定の遺伝子型が、発育中の持続的な環境条件に反応して、さまざまな表現型を生み出すことができるという、発育可塑性が確認されている[53-55]。DOHaD現象はまた、初期の環境キューと代謝異常やその他の疾患の晩年リスクとの関係も記述しており、エピジェネティックなメカニズムがこれらの要因をつなぐ架け橋となりうる[56-58]。内分泌かく乱化学物質や重金属や生物活性食品成分などの環境汚染物質に反応してエピジェネティックな変化が起こるかどうかは、介入のタイミングが鍵を握っている。例えば、我々の最近の研究では、出生前の植物化学物質は、出生後や成人期に同じ曝露を受けた場合よりも、エピジェネティックパターンに深く影響を与える可能性があることが示された[59]。同様に、介入の時間窓は、個体の異常発達を防ぐためのエピジェネティック摂動の有効性に特に重要である[60]。
出生前の環境汚染とエピジェネティックな調節障害
発達プログラミングの概念は、脆弱性の影響を受けやすい時期に環境の介入が行われると、後の人生において遺伝子発現の機能的な調節障害や疾患の発症につながる可能性があることを強調している[61]。早期発生、特に胚発生期の発生は、多くの慢性代謝性疾患や癌の発症と発症に重要な役割を果たしていることが示されており、エピジェネティックなメカニズムがこれらのプロセスに関与していることが示唆されている[35]。DNAメチル化とヒストン修飾を含む一般的なエピゲノムは、初期胚と生殖細胞で確立されており、ライフサイクルを通して非常に安定した修飾状態を維持していると考えられている。特に出生前および出生後早期に発生する気候因子や環境毒性物質などの環境刺激が、エピジェネティックなプログラミングを変化させ、病気への罹患率の変化や子孫の不可逆的な表現型の変化につながる可能性があることが、エビデンスの広がりとともに確認されている[62]。これらの危険因子の中でも、環境汚染物質への出生前暴露はより注目されており、感受性遺伝子における制御配列の異常なエピジェネティック修飾と関連していることが繰り返し発見されている[63,64]。ここでは、異なるカテゴリーのいくつかの出生前環境汚染物質と、エピジェネティックな調節を介した胚および出生後の発達への潜在的な影響をレビューする。
環境大気汚染
環境大気汚染には、様々な大きさと組成の粒子状物質(PM)およびガス状汚染物質が含まれる[65]。早期の大気汚染への曝露、特に妊娠中の大気汚染は、妊娠中の女性や胎児だけでなく、発育中の胎児にとっても大きな健康上の脅威である[66]。大気汚染は胎盤を通過する可能性があるため、短期的にも長期的にも様々なアレルギー性合併症と関連していることが示されている[67-69]。大気汚染の影響の根底にある特定の分子メカニズムは完全には解明されていないが、エピジェネティックな変化は、大気汚染への暴露を様々な健康被害に結びつける主要な要因の1つであると考えられている[15, 72]。
粒子状物質
研究は、500 nmよりも小さい直径を持つPMが胎盤の障壁を通過することができ、粒子も、その直径が240 nmよりも小さい場合には、胎児の血流に到達することができることを示している[71]。Janssenらは、5μg/m3の2.5μmよりも小さい空気力学的直径を有する粒子(PM2.5)への曝露は、胎盤組織におけるグローバルDNAメチル化の減少(2.2%)をもたらしたことを発見した[73]。胎盤のグローバルDNAメチル化[73,74]および遺伝子特異的(LINE1およびHSD11B2)メチル化[75]の変化は、受精から着床までの期間を含み、環境ストレスの影響を最も受けやすい妊娠初期にPM2.5に曝露された場合にのみ観察されたことに留意すべきである。また、出生前のPMへの暴露は、胎盤のミトコンドリアDNA(mtDNA)含量の減少[76]とミトコンドリアゲノムのDNAハイメチル化[77]に関連していることも報告されている。PM2.5曝露は、妊娠中の重要なホルモンであり、エネルギー代謝に重要な役割を果たすレプチン遺伝子のプロモーター領域のDNAメチル化の減少(0.2-2.7%、P < 0.05)およびPARPプロモーターのハイパーメチル化と関連していることが示されている[78] [79]。さらに、母体の粒子への曝露もmiRNAを標的としている。miR-21,miR-146a、およびmiR-222の発現の減少は、妊娠第2期のPM2.5曝露と関連していることがわかったが、第1期ではmiR-20aおよびmiR-21の発現の増加が観察された[80](表1)。
表1 出生前の大気汚染への暴露とエピジェネティックな変化との関連を報告しているヒトの研究の要約
| 汚染 | 暴露段階 | エピジェネティックな変化 | 参照。 |
|---|---|---|---|
| 粒子状物質 | 出生前 | CpG部位でのDNAメチル化の変化 | [ 65 ] |
| 最初の学期 | 胎盤の全体的なDNAメチル化との正の相関 | [ 74 ] | |
| 後期 | 下部胎盤レプチンプロモーターのメチル化 | [ 78 ] | |
| 妊娠初期 | LINE1およびHSD11B2の胎盤DNAメチル化に関連 | [ 75 ] | |
| 出生前 | miR-21,miR-146aおよびmiR-222の発現低下; miR-20aおよびmiR-21の発現増加 | [ 80 ] | |
| 妊娠 | mtDNAメチル化レベルの増加とLINE-1メチル化レベルの減少 | [ 77 ] | |
| 出生前 | 妊娠中の全体的なDNAメチル化の減少 | [ 73 ] | |
| 出生前 | LINE1、OGG1、APEX、PARP1のDNAメチル化の増加 | [ 79 ] | |
| 喫煙 | 出生前 | 子孫で特異的にメチル化された遺伝子に対応するほぼ3000のCpG | [ 85 ] |
| 母性 | 男性と女性のGFI1、AHRR、PRNP遺伝子のCpG部位でのDNAメチル化レベルの変化 | [ 110 ] | |
| 子宮内 | エピジェネティックな修飾を通じて重要な生物学的経路に影響を与える | [ 84 ] | |
| 母性 | 小児血液中のMYO1G、CNTNAP2およびFRMD4A遺伝子の異なるメチル化 | [ 107 ] | |
| 子宮内 | グローバルDNA低メチル化; 25個の遺伝子に関連する31個のCpG部位 | [ 99 ] | |
| 出生前 | 15のCpG部位でのメチル化の変化 | [ 100 ] | |
| 出生前 | MYO1GおよびCNTNAP2の5つのCpGでのメチル化の差異。暴露された子孫に何年も留まる | [ 88 ] | |
| 子宮内 | FRMD4AおよびCllorf52でのCpGメチル化の増加; 再現性のあるエピジェネティックな変化は小児期まで持続する | [ 87 ] | |
| 子宮内 | 乳児の110遺伝子領域の185CpGでのメチル化の変化 | [ 101 ] | |
| 子宮内 | 臍帯血単核細胞、頬上皮および胎盤組織におけるAHRRの低メチル化 | [ 44 ] | |
| 子宮内 | TSLPプロモーターでのメチル化の変化 | [ 106 ] | |
| 母性 | RUNX3遺伝子内のいくつかの遺伝子座のメチル化パターンの変化 | [ 102 ] | |
| 子宮内 | 増加IGF2 DMR | [ 105 ] | |
| 子宮内 | 改変されたLINE-1およびAluYb8メチル化レベル | [ 83 ] | |
| 母性 | 10個の遺伝子にマッピングされた26個のCpGのエピゲノム全体でのDNAメチル化の差異 | [ 104 ] | |
| 母性 | エピゲノム全体の胎盤DNAメチル化の差異 | [ 82 ] | |
| 妊娠 | Sat2のメチル化の低下 | [ 96 ] | |
| 母性 | BNDF-6エクソンのDNAメチル化の増加 | [ 108 ] | |
| 妊娠 | 胎盤におけるmiR-16,miR-21およびmiR-146aのダウンレギュレーション | [ 109 ] | |
| 子宮内 | グローバルなDNAメチル化は、臍帯血中のコチニンレベルと逆相関する | [ 95 ] | |
| 子宮内 | 胎盤のCYPIAIプロモーターでのメチル化の減少 | [ 103 ] | |
| 出生前 | AluYb8のメチル化が低い; LINE1の異なるメチル化; AXLおよびPTPROのメチル化の増加 | [ 98 ] | |
| 多環芳香族炭化水素 | 出生前 | 臍帯血におけるLINE1DNAメチル化との逆の関係 | [ 119 ] |
| 出生前 | 臍帯白血球の全体的なメチル化の減少 | [ 118 ] | |
| 出生前 | ACSL3の5′-CpGアイランドにおけるメチル化の変化 | [ 120 ] | |
| いいえ2 | 出生前 | ADORA2Bメチル化の関連する変化 | [ 65 ] |
| 出生前 | 抗酸化物質およびミトコンドリア関連遺伝子における異なる子孫DNAメチル化 | [ 122 ] |
喫煙
母体のタバコの煙は、母体自身と胎児にとって個人的な大気汚染の一形態である[73]。喫煙はコントロール可能であるが、女性喫煙者の半数以上が妊娠後も喫煙を継続している[81]。喫煙への胎内暴露はDNAメチル化パターンの変化と関連しており[82-85]、そのような変化はライフコース全体を通して持続する可能性があり[85-88]、胎児の発育障害[83,89]、早産[90,91]、および子孫の晩年に呼吸器疾患、心血管疾患、および特定の小児がんを含む他の慢性疾患につながる[92-94]。妊娠中の母親の喫煙のメチル化標的は、ゲノムワイドであり[85, 95-101]、胎盤組織におけるラント関連転写因子3(RUNX3)アリル炭化水素受容体リプレッサー(AHRR)およびチトクロームP450 1A1(CYP1A1)などの特異的なものである可能性がある[44, 102, 103]。新生児臍帯血サンプルにおけるAHRR、成長因子独立1(GFI1)インスリン様成長因子2(IGF2)PRドメイン含有8(PRDM8)ディスクラージホモログ関連タンパク質2(DLGAP2)胸腺間質リンパポエチン(TSLP)CYP1A1[44,85,104-106]。およびミオシン1G(MYO1G)コルタクチン関連タンパク質様2(CNTNAP2)およびヒト表皮幹細胞マーカーであるFRMD4A、小児の血液中のミオシン1G(MYO1G)[107]。思春期末梢血細胞における MYO1G、CNTNAP2,および脳由来神経栄養因子(BDNF) [88,108]、成人末梢血顆粒球における反復要素サテライト2(Sat2) [96]、および新生児頬部上皮におけるAHRR [44]。母体のタバコ喫煙もまた、miRNAの発現異常と関連している。Maccaniら[109]は、妊娠中の喫煙が、胎児のプログラミングに影響を及ぼす可能性のあるmiR-16,miR-21,およびmiR-146aの胎盤発現をダウンレギュレートすることを実証した。興味深いことに、DNAメチル化に対する出生前のタバコの煙の影響は、性別に特異的である可能性がある。男性胎児は女性よりも母体喫煙の影響を受けやすいことが示されており[110]、IGF2遺伝子の差分メチル化領域(DMR)のDNAメチル化の変化は女の子よりも新生児の男の子の方が顕著であった[105]のに対し、Bowwland-Bothは有害な結果を報告している[111]。さらに、父方の喫煙よりも母方の喫煙の方が子孫のメチル化強度にはるかに強い影響を与えることが示された研究がある[15](表11)。
多環芳香族炭化水素
多環芳香族炭化水素(PAH)は、2つ以上の縮合ベンゼン環を持つ芳香族炭化水素である[112]。これらは主に、化石燃料、家庭用木材、および大気中に広く分布する他の有機材料の不完全燃焼中に形成される[113]。PAHは、遺伝毒性や発がん性などの有害な生物学的影響を持つ難分解性有機汚染物質(POPs)である[112,114]。一部のPAHはステロイドホルモンに似ており、脂質可溶性であるため、脂肪組織に蓄積する。これらのPAHは、胎盤関門および胎児の血液脳関門を越えて移行する可能性さえある。PAHへの出生前暴露は、胚の発生に複数の悪影響をもたらすという証拠が増えている [115-117]。高レベルのPAHsへの胎内曝露は、アメリカ人および中国人コホートにおいてゲノムDNAメチル化の減少と関連している [118, 119]。また、交通関連 PAH への出生前暴露は、新生児の臍帯血中の喘息発症に影響を与えるアシル-CoA 合成酵素長鎖ファミリーメンバー 3 (ACSL3) 遺伝子のハイパーメチル化と関連していることが示されている[120](表(表11))。
その他の大気汚染
主要道路の近くに住む妊婦は、交通関連の大気汚染の影響を受けやすく、胎盤組織内の長間隔核素子1(LINE-1)遺伝子のDNAメチル化の低下を示すことが報告されている[121]。異常なDNAメチル化パターンは、NO2に胎内暴露された新生児のミトコンドリア関連遺伝子および抗酸化防御関連遺伝子に認められている[122]。ディーゼル排気ガスへの胎内暴露は、心血管関連疾患および物質代謝に関与する遺伝子のメチル化の変化と関連している[123](表(表11))。
内分泌かく乱化学物質
内分泌かく乱化学物質(EDC)は、環境中に広く存在する化学物質の一群である[124]。EDCsは、フタル酸塩(プラスチック軟化剤)ポリ塩化ビフェニル、殺虫剤、ダイオキシンクラスの化合物を含む外因性の合成化学物質または天然化学物質であり、ホルモン様活性を示し、内因性ホルモンの作用を修飾、遮断、または模倣することにより内分泌機能を混乱させる可能性がある [15, 125-127]。特定のEDCへの出生前暴露は、心血管疾患、糖尿病、不妊、および癌を含む長期的な健康影響を引き起こす可能性があることを示唆する証拠が増加している [128-130]。発育中の生物はホルモンアナログに対して非常に敏感であるため[127]。これらの影響はまた、エピジェネティックプログラミングの混乱と相関している[11,131-133]。
ビスフェノールA
ビスフェノールA(BPA)は、現代社会ではポリカーボネートプラスチックの製造に大量に生産され、どこでも使用されていることから、特に懸念されるEDCである[134]。データによると、BPAはヒトの尿サンプルの95%から検出されることから、BPAが広く使用されているか、または暴露されていることが示唆されている[135]。粒子状物質と同様に,BPA は胎盤を介して移動し,胎児に蓄積する可能性もある [136].胎内での BPA 暴露は,生殖機能の変化,代謝障害,乳がんや前立腺がんなどのホルモン関連腫瘍と関連している [137].マウスを用いた研究では、胎内での BPA 曝露に起因する異常なメチル化パターンが胚性幹細胞の生殖細胞層分化の前に確立されていたことが示されている[11]。さらに、BPA 曝露前のマウスモデルでは、エピゲノムを安定的に変化させることで子孫の表現型も変化しているという説得力のある証拠が提示されている[11]。興味深いことに、胎内のBPA曝露羊ではmiRNAの発現が変化していることが観察された[142]。ヒトにおける DNA メチル化の遺伝子特異的解析では,胎盤のメチル化パターンの変化,胎児の肝臓と腎臓のメチル化パターンの変化が BPA への出生前暴露と関連していることが明らかになった [114, 143, 144].カテコール-O-メチルトランスフェラーゼ(COMT)およびスルホトランスフェラーゼ2A1(SULT2A1)遺伝子は、2つの外来物質代謝酵素をコードする役割を担っており、これら2つの遺伝子のプロモーターでのメチル化の増加がBPA暴露ヒト胎児肝臓で明らかにされている[145]。また、環境に関連する量の BPA への周産期暴露は、男性生殖細胞系におけるエピゲノム異常を介した男性不妊の世代間継承を示していることも注目に値する(146-148)(表2
)。
表2 EDCsへの出生前暴露とエピジェネティックな変化との関連を報告する研究の要約
| 化学薬品 | モデル | 暴露段階 | エピジェネティックな変化 | 参照。 | |
|---|---|---|---|---|---|
| ビスフェノールA | マウス | 子宮内 | 乳腺におけるEZH遺伝子発現の増加 | [ 138 ] | |
| 人間とマウス | 周産期 | 反復DNAにおける示差的DNAメチル化 | [ 141 ] | ||
| 人間 | 子宮内 | 胎児肝臓におけるゲノムワイドなDNAメチル化の変化 | [ 144 ] | ||
| 人間 | 第1学期から第2学期 | 胎児肝臓のCOMTおよびSULT2A1プロモーターでの部位特異的メチル化の増加 | [ 145 ] | ||
| マウス | 離乳への先入観 | 低メチル化および発現の増加AのVYのアグーチマウスモデルにおける遺伝子 | [ 11 ] | ||
| マウス | 子宮内 | Hoxa10遺伝子プロモーターのメチル化の減少 | [ 139 ] | ||
| ラット | 周産期 | 改変された肝DNAメチル化 | [ 140 ] | ||
| 羊 | 出生前 | microRNA発現の変化 | [ 142 ] | ||
| マウス | 子宮内 | プロモーター関連CGIでの高メチル化と低メチル化の両方 | [ 132 ] | ||
| 人間 | 子宮内 | 胎盤の全体的なメチル化と積極的に関連している | [ 143 ] | ||
| ヴィンクロゾリン | マウス | 子宮内 | H19およびGtl2のメチル化の減少; Peg1、Snrpn、およびPeg3のメチル化の増加 | [ 151 ] | |
| ラット | 子宮内 | 男性生殖系列におけるエピジェネティック修飾の変化 | [ 150 ] | ||
| ラット | 子宮内 | F3世代の精子プロモーターエピゲノムにおけるメチル化の変化 | [ 152 ] | ||
| マウス | 子宮内 | マウス精子エピゲノムにおける修飾のエピジェネティックな世代間遺伝 | [ 124 ] | ||
| POPs | ダイオキシン | マウス | 子宮内 | 筋肉と肝臓のIgf2r遺伝子のメチル化の増加 | [ 175 ] |
| マウス | 着床前 | インプリントされた遺伝子H19およびIgf2のメチル化状態の変化 | [ 176 ] | ||
| ジエチルスチルベストロール | マウス | 子宮内 | 乳腺におけるEZH遺伝子発現の増加 | [ 138 ] | |
| マウス | 子宮内 | Hoxa10遺伝子の高メチル化と長期的な発現変化 | [ 177 ] | ||
| マウス | 新生児 | c-fosのエクソン-4の低メチル化 | [ 178 ] | ||
| メトキシクロル | マウス | 子宮内 | でメチル化を変えH19とGtl2とでメチル化を増加PEG1、SNRPN、およびPEG3 | [ 151 ] | |
| ラット | 子宮内 | ERβプロモーター領域の高メチル化 | [ 179 ] | ||
| PBDE | 人間 | 出生前 | 胎児の血液中のAluとLINE-1のDNA低メチル化 | [ 168 ] | |
| 人間 | 母性 | 臍帯血におけるTNF-αの低メチル化 | [ 169 ] | ||
| 人間 | 子宮内 | 胎盤におけるIGF2およびNR3C1の低メチル化 | [ 170、171 ] | ||
| PFOA | 人間 | 出生前 | 精子細胞の低メチル化 | [ 173、174 ] | |
| 人間 | 出生前 | 臍帯血における全体的およびIGF2低メチル化 | [ 95、172 ] | ||
ビンクロゾリン
ヴィンクロゾリンは、果樹や野菜の植え付けやワイン産業で一般的に使用されている全身性殺菌剤である[149]。研究者たちは、ビンクロゾリンをEDCモデルとして使用し、精子形成不全、乳房および前立腺疾患、さらには高頻度(最大90%)で免疫機能異常を引き起こす抗アンドロゲン活性のため、疾患のエピジェネティックな世代間遺伝を調査した[1, 150-152]。妊娠中のビンクロゾリンへの雌ラットの曝露は、雄の子孫に不妊をもたらしたが、曝露の異なるタイミングは、異なる結果をもたらす可能性がある。胚発生日(E)8からE 14の間の曝露は、生殖細胞線のエピジェネティックなプログラミングの期間であるが、4世代後の世代の雄ラットの造精能力を低下させることができる[131,153]一方、後の妊娠期間(E 15からE 20)におけるビンクロゾリンの曝露は、成体の雄の生殖能力に影響を与えなかった[154,155]。このように、胚発生の初期段階でのビンクロゾリンへの雄ラットの曝露は、成人期の不妊率の増加を引き起こし、そのような影響は4世代に渡ることがある。前述の世代交代現象の分子メカニズムを調査したところ、ビンクロゾリンへの発生期の曝露は、雄性生殖細胞のリプログラミングに大きな影響を与え、複数世代に渡って安定的に伝達されうる異常なメチル化パターンを誘導することが明らかになった[156]。F3世代の精子エピゲノムにおける差動DNAメチル化同定は、世代間の影響を評価するためのエピジェネティックバイオマーカーとして使用することができる[124](表(表22))。
難分解性有機汚染物質
永続性有機汚染物質(POPs)は、環境に導入された後も長期間残存する人工有機(炭素ベース)化学物質の一群である [157]。これらの化学物質には、ジクロロ-ジフェニル-トリクロロエタン(DDT)ジクロロ-ジフェニル-ジクロロエチレン(DDE)ポリ塩化ビフェニル(PCB)2,3,7,8-テトラクロロジベンゾ-p-ジオキシン(TCDD)のほか、パーフルオロオクタン酸(PFOA)ポリ臭化ジフェニルエーテル(PBDE)ダイオキシン類が含まれる [114, 157]。特定のPOPsは、DDTのエストロゲン作用と抗黄体ホルモン作用、ダイオキシンとPCBの抗エストロゲン作用、DDTの抗アンドロゲン作用、PCBとダイオキシンの抗甲状腺作用などの内分泌かく乱作用を持つことが示されている(https://www.who.int/ceh/capacity/POPs.pdf)。蓄積された証拠は、出生前のPOPs曝露が、子孫の晩年に、有害な精神的および身体的発達 [158-161]、視覚認識記憶異常 [162]、神経発達遅延 [163]、生殖障害 [164,165]、肥満 [166]、および免疫疾患 [167]をもたらすことを示している。さらに、POPsへの出生前暴露によるこのような有害な健康影響は、エピジェネティックな調節障害と関連しており、例えば、DDT、DDE、PBDEへの暴露に伴う胎児血中の繰り返し要素(Alu(Arthrobacter luteus)およびLINE-1)のDNAハイメチル化[168]などが挙げられる。PBDEsへの曝露に伴うコア血液および胎盤における腫瘍壊死因子α(TNF-α)IGF2,および核受容体サブファミリー3グループCメンバー1(NR3C1)の低メチル化 [169-171]。PFOAへの曝露に伴う精子細胞および臍帯血サンプルにおけるグローバルおよびIGF2のハイメチル化 [95, 172-174];ダイオキシンへの曝露に伴うH19,IGF2およびIGF2r遺伝子のDNAメチル化の変化 [175, 176]。ジエチルスチルベストロールへの暴露に伴うHoxa10遺伝子のハイパーメチル化、c-fos遺伝子のエクソン4のハイパーメチル化、およびEZH遺伝子発現の増加[138, 177, 178]、およびメトキシクロルへの暴露に伴うPeg1,Snrpn、Peg3およびERβ遺伝子のメチル化の増加[151, 179]。さらに、特定のPOPsは、疾患感受性のエピジェネティックな世代間継承を促進することが示されている[148,180](表(表22))。
重金属
重金属とは、ある値(5 g/cm3)を超える密度を持つ金属を指し、数千年前から様々な地域で人間が利用してきた[181]。ヒ素、カドミウム、鉛、水銀を含む重金属は、様々な工業分野、農業分野、医療分野、家庭内分野などの現代環境に広く分布する汚染物質のもう一つの一般的なタイプである。汚染された水や食品の消費は、慢性的ではあるが低レベルのヒ素とカドミウムへの曝露の一般的な発生源である[182,183]。殺虫剤製造もヒ素暴露の一般的な発生源であり[184]、喫煙者はカドミウム暴露が高い傾向にある[185]。鉛は、鉛で汚染されたハウスダスト、住宅用土壌、鉛系塗料、ガラス張りの食品容器、および飲料水に多く見られる [186,187]。汚染された魚介類は、水銀摂取の主な供給源と考えられている[188]。胎内での重金属への曝露は胎児にとって有害であり、主に子孫に神経障害や癌を引き起こす[189]。このような有害な結果は、胚発生時に外部刺激の影響を受けやすいエピゲノムの摂動と関係していることが実証されている[190](表(表33))。
表3 重金属への出生前暴露とエピジェネティックな変化との関連を報告する研究のまとめ
| ヘヴィメタル | 暴露段階 | エピジェネティックな変化 | 参照。 |
|---|---|---|---|
| 砒素 | 子宮内 | 胎盤の特定の遺伝子のDNAメチル化状態の変化 | [ 191 ] |
| 出生前 | 動脈および胎盤におけるDNAメチル化の変化 | [ 199 ] | |
| 出生前 | 新生児の臍帯血におけるDNAメチル化の変化 | [ 192、193、196、197 ] | |
| 妊娠初期 | 臍帯血中のDNAメチル化の減少 | [ 194 ] | |
| カドミウム | 出生前 | 示差的にメチル化されたCpG部位 | [ 208 ] |
| 妊娠初期 | 性別およびおそらく人種/民族特有の影響を伴う子孫の複数のDMRでのDNAメチル化の変化 | [ 203 ] | |
| 母性 | 胎盤PCDHAC1プロモーターのDNAメチル化レベルの低下 | [ 206 ] | |
| 出生前 | 少女と少年で異なるDNAメチル化の変化 | [ 204 ] | |
| 母性 | 新生児とその母親の白血球におけるDNAメチル化レベルの変化 | [ 205 ] | |
| 水銀 | 出生前 | 乳児の臍帯血におけるDNAメチル化の増加 | [ 190 ] |
| 子宮内 | 胎盤サンプルにおけるEMID2遺伝子の低メチル化 | [ 230 ] | |
| 出生前 | 臍帯血サンプルのTCEANC2領域でのDNAメチル化に関連 | [ 231 ] | |
| 鉛 | 出生前 | MEC3DMR調節領域での高メチル化 | [ 223 ] |
| 子宮内 | PbとDNAメチル化の間の性特異的な傾向 | [ 222、227、228 ] | |
| 出生前 | 臍帯血におけるゲノムDNAとAluおよびLINE-1遺伝子の低メチル化 | [ 224 ] | |
| マンガン | 出生前 | 胎盤DNAメチル化の変化 | [ 229 ] |
ヒ素
出生前のヒ素曝露は、新生児の胎盤と臍帯血のDNAメチル化の変化と関連していることが示されている[191-197]が、おそらく性差[193, 194, 198]と時間差[194]の方法で行われている。例えば、DNAメチル化のレベルは男性の乳児では増加するが、ヒ素曝露を受けた母親から生まれた女性の乳児では減少することが示されている[193, 198]。妊娠後期のヒ素曝露は、妊娠初期よりも新生児の臍帯血DNAメチル化との相関が弱いことが示された[194]。さらに、DNAメチル化に対する出生前のヒ素曝露の影響は、異なる研究では完全に一致していない。一部のデータでは、ヒ素曝露とメチル化との間の負の相関を支持するものもあり[194, 199]、特定の研究ではハイパーメチル化におけるヒ素の役割を示したものもあった[199-201]。これらの研究をまとめると、ヒ素への出生前暴露はエピジェネティックな修飾を変化させると考えられ、ヒ素関連疾患の発症を調節しなくなる可能性があることが示唆されている。
カドミウム
カドミウムは半減期が長く、何十年も持続し、骨に蓄積して妊娠中に放出されることがある。カドミウムのこれらの特徴は、妊娠中の女性や胎児への毒性を拡大し、生殖障害、腎機能障害、特定の癌など多くの健康問題につながっている[202]。カドミウムへの妊娠初期の暴露は、性と可能性のある人種/民族固有の方法で、子孫の複数のDMRでのDNAメチル化の変化につながることが示された[203]。メチロームワイド関連研究(MWAS)はまた、受胎前を含む出生前、および胎内でのカドミウムへの曝露は、女性の子孫の器官発生および鉱化関連遺伝子のメチル化の増加、男性の子孫の細胞死関連遺伝子のハイパーメチル化[204]、白血球[205]および胎盤[206]におけるメチル化パターンの変化、ならびに正常組織[207]および末梢血でハイパーメチル化されているLINE-1のハイパーメチル化をもたらしたことを実証した。2つの米国出生コホートを対象とした別のエピゲノムワイド関連研究では、出生前のカドミウム曝露は、炎症性シグナル伝達や細胞増殖、出生体重に関与するCpG部位の異なるメチル化と関連していることが示された[208]。さらに、カドミウムへの出生前暴露はDNMT発現と逆に関連していることが明らかになった[207](表(表33))。
鉛
鉛は一般的な汚染物質であり、安全なレベルの暴露はなく、有益な生物学的役割もない [209]。同様に、鉛は骨に蓄積し、半減期は約30年である[210]。鉛はホモシステインのレベルを上昇させ、メチオニン-ホモシステインサイクルを混乱させ[211,212]、エピジェネティック修飾関連酵素の発現を再プログラムしうる[213]。これらのプロセスと合わせて、鉛への曝露は、特に胎児期に、異常なDNAメチル化[214-216]とヒストンアセチル化[217]などのヒストーム修飾を生物に引き起こす可能性がある。エピゲノムにおけるこのような変化は、最初は保存されている可能性が高く[218, 219]、その後、肥満、心代謝疾患、さらにはアルツハイマー病(AD)[220-223]などの臨床的異常をもたらす後世の内部および/または外部刺激によって誘発される。胎内で鉛に曝露された子供は、AluおよびLINE-1配列のメチル化低下を示し[224]、インプリントされた遺伝子のメチル化パターンが変化した[222, 223]。さらに、動物を用いた研究では、鉛曝露は疾患の病理学的プロセスに関与する特定のタンパク質を標的とするmiRNAの発現をも変化させることが示されている[225]が、曝露が後の人生で起こった場合には影響は見られなかった。重要なことに、母親の鉛曝露は孫にメチロムの指紋を残す可能性があり、その潜在的な多世代エピジェネティック継承を示唆している[226]。さらに、出生前の鉛曝露に対する顕著な性特異的プロファイルは、DNAメチル化変化に関しても見出された[222,227,228](表(表33))。
その他の重金属
マンガンへの胎内曝露は、胎盤[229]における差動メチル化と関連している。変異した免疫プロファイルや有害な乳児の神経行動学的転帰とリンクしていたDNAメチル化変化は、母親が妊娠中に水銀暴露を経験した新生児の胎盤だけでなく、臍帯血で発見された[190,230,231](表(表33))。
出生前暴露に関連したエピジェネティックな調節障害の特徴
胎盤のポータル機能
胎児の発育における曝露に関連した変化は、代謝と発育の潜在的な変化につながる[232]。一過性の器官として、胎盤は胎児の生存を確保し、妊娠中の胎児と母体の循環の間のゲートキーパーとしての役割を果たしている[61, 73]。それだけでなく、酸素、栄養物質、および母体から胎児へのホルモン[233]の転送を媒介する上で重要な役割を果たしているだけでなく、成長因子やホルモンを生成し、胎児の免疫寛容[61]を媒介することができる。
胚発生期の有害環境因子は、輸送、代謝、保護、および内分泌のすべての胎盤機能を混乱させる可能性があり、そのような影響は、曝露のユニークな足跡を提供する胎盤メチロム[234,235]にコードされ得る[65]。したがって、胎盤はかなりの可塑性、特に特徴的なDNAメチロームを示す[232, 236, 237]。
しかし、適応するための胎盤の能力を超えると、胎児の成長と発育が直接損なわれる可能性がある[61]。さらに、特定の環境毒物は胎盤を横断して、歪んだ胎児のリプログラミングや後世の病気の発病を引き起こす可能性がある[238]。
世代を超えた遺伝
世代間継承は、ある生物のある世代から次の世代に伝達されることができる非DNA配列に基づく継承を記述するために、かなり広義に使用されることが多い[239, 240]。F3世代(F2世代の子孫)は、F1(親世代の子孫)胚とF2(F1世代の子孫)生殖細胞の両方が、F0(親世代)の妊娠中の雌が環境因子に曝露されたときに直接曝露されるため、世代間継承を示す最初の世代である[241-244]。
非常に懸念されるのは、出生前の環境曝露によって誘発されたエピジェネティックな改変が生殖細胞線を介して後世に伝わり、子孫の疾患または障害の素因につながる可能性があるということである[1, 30, 245]。Guerrero-Bosagnaら。第一に、配偶子形成時の曝露;第二に、PGCにおけるエピジェネティックな侮辱;第三に、生殖細胞系、特に男性生殖細胞系におけるインプリンティング様のプログラミングが、胚発生初期のリプログラミングから逃れる;第四に、生殖細胞系における変化したエピゲノムが細胞や組織内で後続世代に伝達される;そして最後に、出生後の生活における関連疾患への感受性の増加[124]などの段階的なプロセスを含む環境誘発性エピジェネティックな世代間継承のための、もっともらしい分子メカニズム/条件を提案している。F0世代の妊娠中の女性のEDCへの曝露に起因するDNAメチル化を中心としたエピミュータンスは、これまでに男性生殖細胞株を介した世代間継承が実証されている[242, 246, 247]。精子のエピミュータシオンは通過回数の増加に伴って拡大する可能性があることを指摘すべきである[242]。
時期/年齢特異的感受性
受胎前、妊娠初期、乳児期、老年期という明確な時間窓は、年齢に応じた疾患感受性によって特徴づけられる [248]。エピゲノムはダイナミックな変化を受けており、脆弱であるため、胎児の初期発生期と配偶体形成期は環境刺激の影響を最も受けやすいと考えられている。ヒトの妊娠には3つの期間がある:第1期(1週から13週まで)第2期(14週から26週まで)第3期(27週から出産まで)。このように、受精から着床までの最初の期間は、環境刺激に対して非常に敏感なエピジェネティックなリプログラミングを受けているため、最も重要な発生段階と考えられており、子孫の後世の疾患感受性を決定する可能性がある。
性特異的応答/プロファイル
男性と女性のゲノムにおけるエピジェネティック・リプログラミングのダイナミックなプロセスは劇的な違いを示しており[14, 20]、これには胚性幹細胞におけるエピゲノムへの変化が含まれている[249]。前述のように、雄の胎児は雌よりも母体の喫煙に対する感受性が高いことが観察されている[110]。また、ビンクロゾリン[156]やBPA[146-148]への発生学的曝露は、男性生殖細胞線を介して異常なメチル化パターンの世代間継承を示すことが示されている。さらに、カドミウム[203,204]と鉛[222,227,228]への妊娠初期の暴露は、性別に特異的な方法で子供のDNAメチル化を変化させる結果となった。
出生前暴露に関連したエピジェネティックな調節異常の潜在的なメカニズム
酸化ストレス
PMを例にとると、吸入された粒子は、まず母体の肺から血流中に移動し、その後胎盤のバリアを通過して酸化ストレスを誘発する可能性がある[122,250,251]。酸化ストレスによって誘導されるDNA損傷は、出生前暴露に応答して、いくつかの候補遺伝子におけるメチル化の差異と関連している[120, 252]。DNA損傷は、機能不全が発育中の胚にとって致死的であるDNMT [253] のDNAテンプレートへの結合を阻害し、それによって低メチル化を引き起こす可能性がある [254]。DNAの低メチル化はゲノムや染色体の不安定性を引き起こすことが実証されており[255-257]、二分脊椎[259]や新生児の低出生体重[260]などの異常胚発生[258]と関連していることが実証されている(図2)。
図2 汚染物質が誘発するエピジェネティックな調節障害の潜在的なメカニズムの図
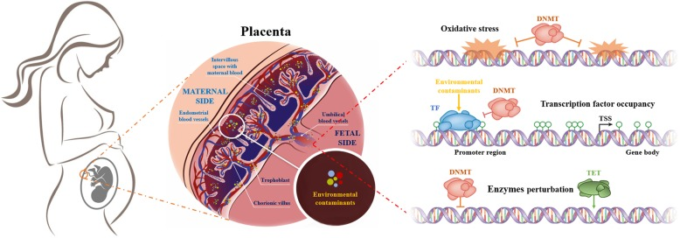
環境汚染物質は、呼吸、摂取、飲用、接触などにより母体の血液中に吸収される。その後、特定の環境毒性物質は、3つの潜在的な方法でエピジェネティックな制御異常を引き起こし、胎盤のバリアを通過し、胎児の血流に蓄積することができる。DNA の酸化的損傷は DNA メチルトランスフェラーゼ(DNMT)の DNA テンプレートへの結合を阻害する可能性がある。転写因子(TF)の活性化は DNA へのアクセスから DNMT を阻害し、遺伝子特異的なハイメチル化をもたらす。Martinら[114]およびLuytenら[232]からの引用および許可を得て使用する。略語
DNMT、DNA メチルトランスフェラーゼ、TSS、転写開始部位、TF、転写因子、TET、テン-イレブン転座
転写因子占有率
遺伝子特異的なDNAメチル化パターンについては、転写因子占有説は、遺伝子調節領域上の転写因子の存在により、DNAメチル化機械へのブロッキングアプローチが起こる可能性、またはその逆が起こる可能性を提案している[261, 262]。同様に、環境化学物質が遺伝子調節領域上の転写因子の存在または不在を誘発する場合、これは部位特異的なメチル化パターンをもたらす可能性がある[114](図22)。
関連酵素の摂動
ゲノム全体のメチル化パターンについては、環境の影響により、DNMTや10-eleven translocation(TET)酵素ファミリーの機能や、S-アデノシルメチオニン(SAM)のDNAへの利用可能性が変化する可能性があることが示されている[114] (図22)。
明らかに、エピジェネティックな修飾は可逆的である可能性があり、出生前の環境刺激の有害な転帰に関与する特徴とメカニズムをより深く理解することは、異常なエピジェネティックマーカーを標的とした新たな効果的な治療法の探索を促進する可能性がある。これまで、エピジェネティック薬理学的治療には、FDAの承認を受けているヒストン脱アセチル化酵素(HDAC)阻害薬やDNMT阻害薬が用いられ、HDACやDNMTを阻害することで臨床的な効果が得られてきた[15]。それにもかかわらず、最近の研究では、「エピジェネティクス・ダイエット」に含まれる特定の生理活性化合物が、エピジェネティック・プロファイルに影響を与えるDNMT阻害剤、HDAC阻害剤、または/またはmiRNA調節剤として作用し、環境汚染に対する潜在的な保護的役割を果たす可能性があることが解明されている。
エピジェネティクスダイエットとエピジェネティックレギュレーション上のそれらの役割
早生期の食事栄養は、改変されたエピゲノム[35]を介して発達運命に深く影響を与えることができる。雌の幼虫は、栄養のエピジェネティクス[263]の最も典型的な例であるローヤルゼリーの有無にかかわらず、女王蜂または無菌の働き蜂に発展することができる。しかし、女王蜂に成長する幼虫の割合は、DNMT3のノックダウンによって増加し、早生ローヤルゼリーの消費と成虫の表現型との間のDNAメチル化を介して、少なくとも部分的には、橋渡しの役割を示唆しているだろう[264]。特定の食品の早生期の補給はまた、発育中の胎児に有害な影響を及ぼす可能性がある。メタアナリシスの結果は、出生前のアルコール曝露がげっ歯類胚におけるタンパク質合成、mRNAスプライシング、およびクロマチン調節を障害する可能性があることを示している[265]。大きな関心事は、生物活性のある食物成分の数が、いわゆる「エピジェネティクス・ダイエット」[30]の消費を通じてエピゲノムを改変するように作用することである。ここでは、エピジェネティックな食事とエピゲノム修飾におけるそれらの役割を詳述する(表4)。
表4 エピジェネティックな食事とエピジェネティックな調節におけるその性質
| 分類 | 食品の例 | 成分 | エピジェネティック効果 | 参照。 |
|---|---|---|---|---|
| ポリフェノール |  |
ケンペロール | HDAC阻害 | [ 323、324 ] |
| SIRT3アクティベーション | [ 322 ] | |||
| フロレチン | DNMT阻害 | [ 325 ] | ||
 |
アピゲニン | DNMT阻害 | [ 326、327 ] | |
| HDAC阻害 | [ 326 ] | |||
| HMT阻害 | [ 327 ] | |||
| ルテオリン | DNMT阻害 | [ 327、328、330 ] | ||
| HDAC阻害 | [ 329、330 ] | |||
| HMT阻害 | [ 327 ] | |||
| SIRTアクティベーション | [ 329 ] | |||
 |
ヘスペリジン | DNMT阻害 | [ 331 ] | |
| ケルセチン | DNMT阻害 | [ 275、326、332 ] | ||
| HAT阻害 | [ 334 ] | |||
| SITR1アクティベーション | [ 333、344 ] | |||
 |
コーヒー酸 | HDAC阻害 | [ 335、336 ] | |
| クロロゲン酸 | HDAC阻害 | [ 335 ] | ||
 |
アリルメルカプタン | HDAC阻害 | [ 337 ] | |
| 二硫化ジアリル | HDAC阻害 | [ 338 – 340 ] | ||
 |
アントシアニン | DNMT阻害 | [ 325、341 ] | |
| miRNAの調節 | [ 342 ] | |||
| ピセアタンノール | SIRT1アクティベーション | [ 333、343、344 ] | ||
| プロシアニジン | DNMT阻害 | [ 283、479 ] | ||
| HDAC阻害 | [ 283、480 ] | |||
| SIRT1変調 | [ 346、347 ] | |||
| miRNA変調 | [ 342、345、348 ] | |||
| レスベラトロール | DNMT阻害 | [ 268、283 – 286 ] | ||
| HDAC阻害 | [ 283、285、287 – 289 ] | |||
| miRNAの調節 | [ 284、299 – 303 ] | |||
| SIRT1アクティベーション | [ 292 – 296 ] | |||
| MeCP2の減少 | [ 285 ] | |||
 |
カテキン(EGCG) | DNMT阻害 | [ 274、275、285、481 ] | |
| HAT阻害 | [ 270、482 ] | |||
| HDAC阻害 | [ 276、285、481、483 ] | |||
| MeCP2の減少 | [ 285 ] | |||
| miRNAの調節 | [ 278、279、281 ] | |||
| テオフィリン | HDACの活性化 | [ 349、350 ] | ||
 |
ビオカニンA | DNMT阻害 | [ 350 ] | |
| ダイゼイン | DNMT阻害 | [ 351 ] | ||
| エクオール | BRCAの脱メチル化 | [ 352 ] | ||
| ゲニステイン | DNMT阻害 | [ 285、306 – 309 ] | ||
| MeCP2の減少 | [ 285 ] | |||
| HDAC阻害 | [ 285、306、309 ] | |||
| HATアクティベーション | [ 311、313 ] | |||
| miRNAの調節 | [ 271、318 – 321 ] | |||
 |
クルクミン | DNMT阻害 | [ 285、353、484、485 ] | |
| MeCP2の減少 | [ 285 ] | |||
| HAT阻害 | [ 354 ] | |||
| HDAC阻害 | [ 285、355、356 ] | |||
| miRNAの調節 | [ 357、486 – 489 ] | |||
| ビタミン |  |
葉酸 | 一炭素代謝 | [ 386、490、491 ] |
| HMT規制 | [ 491 ] | |||
| エピゲノム調節 | [ 492 ] | |||
| miRNAの調節 | [ 405、493 – 495 ] | |||
| ビタミンC | DNAの脱メチル化 | [ 360 – 366 ] | ||
| ヒストンの脱メチル化 | [ 367 – 370 ] | |||
| エピゲノム調節 | [ 358 ] | |||
 |
ビタミンD | DNAメチル化 | [ 375 – 379、468、469、496 ] | |
| ヒストン修飾 | [ 372、374、380、381 ] | |||
| エピゲノム調節 | [ 372、470 ] | |||
| miRNAの調節 | [ 497 – 499 ] | |||
 |
コリン | DNAメチル化 | [ 393 – 398、401 – 404 ] | |
| ヒストンのメチル化 | [ 405 ] | |||
| miRNAの調節 | [ 405 – 407 ] | |||
| その他 |  |
イソチオシアネート | HDAC阻害 | [ 419 – 422 ] |
| スルフォラファン | HDAC阻害 | [ 269、276、409 – 412 ] | ||
| DNMT阻害 | [ 276、414、415 ] | |||
| miRNAの調節 | [ 414、416 – 418 ] | |||
 |
ウィザフェリンA | DNMT阻害 | [ 285、411 ] | |
| HDAC阻害 | [ 269、285、411 ] | |||
| HMT阻害 | [ 269 ] | |||
| HATアクティベーション | [ 269 ] | |||
| miRNAの調節 | [ 500 ] | |||
 |
Se | DNAメチル化 | [ 436、437、439 – 444 ] | |
| ヒストン修飾 | [ 436、438 ] | |||
| DNMT阻害 | [ 436 ] | |||
| HDAC阻害 | [ 438 ] |
ポリフェノール
ポリフェノールは、植物由来、特に果物や野菜に由来する二次代謝物として広く分布している[266]。蓄積された文献によると、これらのフィトケミカルは抗酸化作用、抗炎症作用、および人間の健康に有益なその他の効果を持つことが示されている[267]。多くのポリフェノールは、ブドウのレスベラトロールによる DNMT 阻害 [268]、ブロッコリーのスルフォラファンによる HDAC 阻害 [269]、緑茶の(-)-エピガロカテキン-3-ガレート(EGCG)によるヒストンアセチルトランスフェラーゼ(HAT)阻害 [270]、ダイズのゲニステインによる miRNA 阻害など、エピジェネティクスの調節における特性を示している [271]。
EGCG
カテキンは緑茶に含まれる最も豊富なポリフェノール化合物であり、その中でもEGCGは活性化合物の50%以上を占めている[272, 273]。別にDNAメチル化[274-276]におけるその既知の役割から、EGCGはまた、ヒストン修飾とmiRNAモジュレーターとして機能する。他の緑茶ポリフェノールと比較して、EGCGは、p300,CBP、Tip60,およびPCAFを含む様々なHAT酵素を標的とした最も強力なHAT阻害剤の特性を示す[270]。我々の研究では、EGCGはSFNと組み合わせることで、ヒストン修飾によるクロマチン構造のリモデリングだけでなく、ERαプロモーターのメチル化パターンを変化させ、それによってERαの発現を再活性化し、ER陰性乳癌における抗ホルモン(タモキシフェン)治療の再感作を可能にすることが実証された[276]。別の研究では、EGCGはヒストンのメチル化とアセチル化を調節することでクロマチンをコンパクトにし、がん関連遺伝子を沈黙させることができるポリコムグループ(PcG)タンパク質に影響を与えることが示されている[277]。さらに、EGCGはまた、ヒト鼻咽頭癌CNE2細胞[278]、変形性関節症軟骨細胞[279]、骨肉腫細胞[280]、および自然発症高血圧ラット[281]においてmiRNAの発現を調節することが明らかにされている(表(表44))。
レスベラトロール
レスベラトロール(RSV)は天然のポリフェノール化合物であり、ピーナッツ、ベリー類、ブドウに多く含まれ、特に赤ブドウの皮に多く含まれている[282]。RSVは、DNMT[268, 283-286]およびHDAC阻害[283, 285, 287-289]の能力を介したエピジェネティックな制御により、抗酸化性、抗炎症性、抗血管新生性、および抗癌性を示す。サーチュイン1(SIRT1)は、酸化ストレス、老化、肥満、腫瘍に寄与するタンパク質を脱アセチル化するNAD+依存性ヒストン脱アセチル化酵素である[290]。重要なことに、SIRT1はDNMT1活性の調節にも関与している[291]。一連の研究は、RSVが様々な代謝経路におけるSIRT1活性化と関連していることを示している[292-298]。さらに、新しい研究では、RSVが血栓除去[299]、2型糖尿病(2型糖尿病)治療[300]、臨床膵管腺癌(PDAC)予防[301]、変形性関節症治療[302]、および抗炎症[303]においてmiRNA調節因子として作用することが示唆されている(表(表44))。
ゲニステイン
ゲニステイン(GE)は植物性エストロゲンであり、主に大豆に含まれる主要なイソフラボンである[304]。GEは、肥満、インスリン抵抗性、代謝性疾患の抑制、炎症や複数の癌の予防など、健康に有益な特性を示すことが示されている[305]。前述のように、GEなどのポリフェノールはまた、DNAメチル化[285,306-309]およびヒストン修飾[285,306,309,310]に対して顕著な効果を示す。GEが介在するプロモーターのメチル化やヒストンの過剰アセチル化によって、p16,p21,RARβ、CCND2,GSTP1,MGMT、BTG3などのいくつかの腫瘍抑制関連遺伝子が再活性化されることが示されている[311-316]。我々の予備的研究では、GEはまた、乳癌モデルにおいてhTERTプロモーターのクロマチン構造のリモデリングだけでなく、遺伝子座特異的なハイメチル化によって、ヒトテロメラーゼの触媒サブユニットであるヒトテロメラーゼ逆転写酵素(hTERT)を抑制することが明らかになった[317]。さらに、GEは、乳がん、前立腺がん、大腸がん、および腎がんの予防においてmiRNAモジュレーターとして作用する可能性がある[271,318-321](表(表44))。
その他のポリフェノール
他のポリフェノールもまた、リンゴのカエンフェロール[322-324]およびフロレチン[325]、セロリのアピゲニン[326,327]およびルテオリン[327-330]、柑橘類のヘスペリジン[331]およびケルセチン[332-334]などのように、DNA阻害、HDAC阻害、HAT活性化、およびmiRNA調節における特性を少なくとも部分的に介して、ヒトおよび動物における様々な健康上有益な効果に関与している。コーヒーのカフェイン酸[335,336]およびクロロゲン酸[335];ニンニクのアリルメルカプタン[337]およびジアリルジスルフィド[338〜340];ブドウのアントシアニン[325,341,342]、ピセアタノール[333,343,344]およびプロシアニジン[283,342,345〜348]。緑茶のテオフィリン[349,350];大豆のビオカニンA[350]、ダイゼイン[351]、およびエクオール[352];およびウコンのクルクミン[353〜357](表(表44))。
ビタミン類
ビタミンC
ビタミンC(L-アスコルビン酸)は、コラーゲンの架橋に不可欠な役割を果たしていることが知られている[358]。最近の研究では、エピジェネティック制御におけるビタミンCの機能が明らかにされている。生理的なpH条件下に存在するビタミンCの形態であるアスコルビン酸は、活性DNA脱メチル化[360-366]やヒストン脱メチル化[360, 367-369]、エピゲノムリプログラミング[358]に補因子的に関与していることが明らかになっている。5mCの5-カルボキシルシトシン(5caC)への酸化を触媒するTETジオキシゲナーゼには3つの補因子があり、そのうちアスコルビン酸は最近発見され検証されている。JHDM1A、1B、3Aを含む十文字C(JmjC)-ドメイン含有ヒストンデメチラーゼ(JHDM)もまた、ヒストン脱メチル化のための補因子としてアスコルビン酸を必要としている[369-371]。さらに、最近の研究では、マウス胚性幹細胞におけるH3K9me2脱メチル化におけるビタミンCの特異的な役割が明らかにされた[368](表(表44))。
ビタミンD
一般的にビタミンD受容体(VDR)として知られるカルシトリオール受容体の発見により、転写応答の調節とその根底にあるエピジェネティックなメカニズムにおけるビタミンDの役割が徐々に明らかになってきている[372]。VDRは転写因子のメンバーである。ビタミンDの活性型はカルシトリオールと結合するが[373]、VDRは主にオープンクロマチンの部位に結合する。ヒト白血病細胞株THP-1をVDRリガンドである1,25-ジヒドロキシビタミンD3(1,25-D3)で処理すると、クロマチンへのアクセス性が大幅に増加した[374]。エピジェネティックな制御におけるビタミンDの主な役割は、DNAの脱メチル化とヒストンのアセチル化に関連している。大腸癌の腫瘍抑制遺伝子である腺腫性ポリポーシス(APC)遺伝子のプロモーターのメチル化状態とビタミンD治療が負の相関があることを示す証拠がある[375]ほか、ディックコプフ関連タンパク質1(DKK1)[376]、E-カドヘリン[377]、PDZ-LIMドメイン含有タンパク質2(PDLIM2)[378]、およびp21[379]などがある。試験管内試験実験では、1,25-D3処理は、一連のJHNMの発現に影響を与えるだけでなく、H3K27ac [374]、H3K9ジメチル化 [380]、およびH3K9ac [381]のようなヒストンアセチル化およびメチル化を介して遺伝子発現を調節することが示されている[372]。最近の研究では、miRNAの調節を介したビタミンDの抗癌性が明らかにされている([382]でレビューされている)(表(表44))。
葉酸
葉酸または葉酸は、プテロイルグルタミン酸としても知られている水溶性のB複合ビタミンで、通常は緑黄色野菜や動物の肝臓に存在する。生物学的には、ビタミンB12(VB12)と一緒に葉酸は、一炭素代謝と胚発生に重要な役割を果たしている。この文脈では、葉酸の低食事摂取量は、様々な臨床症状、特に神経学的および発達障害[383]に関連付けられている。メチル供与体として、葉酸はメチオニンサイクルに参加し、最終的にはDNAやタンパク質のメチル化のためにメチルを提供し、それによってクロマチン構造を変化させ、遺伝子発現を調節する[384]。葉酸の状態不良に起因するDNAの低メチル化は、がん関連遺伝子の不適切な発現と関連している[385]が、葉酸欠乏はDNAの低メチル化と低メチル化の両方を引き起こす可能性があることを指摘すべきである[386]。さらに、葉酸の補給は、DNAメチル化パターンの調節[389,390]を介して、がんのリスクを低下させることが示されている(表(表44))。
コリン
葉酸のように、コリンは、SAM、DNAのシトシンのメチル化、ヒストンのリジン、およびRNAのアデニンだけでなく、他の分子[391,392]のシトシンのメチル化を含む多数のメチル化プロセスのための普遍的なメチルドナーに変換することができる前駆体の一つである。妊娠したメチル化インジケーターマウスにコリンや他のメチルドナーを多く含む食事を与えると、それぞれAvy [393,394]とアクシン(Fu)[395]遺伝子のメチル化状態を変化させることにより、茶色のコートとその尾のキンクで生まれた子孫をもたらした。また、他のいくつかの例では、コリンを含む食事の補給により、IGF2,Srebf2,Agpat3,Esr1,Fasn、およびCdkn3の遺伝子におけるCpG部位のメチル化レベルが変化したことが実証されている[396-398]。一方、妊娠ラットにコリン欠乏食を与えた場合、IGF2はDNMT1の発現をアップレギュレーションすることでハイメチル化された[399]。ヒトでは、コリンの母体供給は、特に脳の発達のために、胎児と乳児の発達のために不可欠である。したがって、余分なコリンは、妊娠中および母乳育児中の女性に必要である。さらに、コリンは、人間の腫瘍の進行を減らす役割を持っている。この証拠として、Sunらは、低コリン摂取は肺がん(30%)上咽頭がん(58%)および乳がん(60%)のための全体的なリスクを増加させることを発見したが、がんの発生率は、コリン(100 mg/日)のサプリメントの後に11%減少する[400]。コリンがエピジェネティックマーカーの修飾を介して癌の発生を抑制することができるという研究は、よく文書化されている。コリン欠乏食は、がん遺伝子(例えば、c-myc)[401]のハイメチル化をもたらすだけでなく、いくつかの腫瘍抑制遺伝子(例えば、p16,p53,およびCx26)[402-404]のハイメチル化ももたらす。さらに、食事性コリン濃度はまた、ヒストンメチル化[405]およびmiRNA発現[405-407]に影響を与える(表(表44))。
その他のエピジェネティクスの食事
イソチオシアン酸塩
イソチオシアネート(ITC)は、植物のグルコシノレートの酵素加水分解によって生成される。スルフォラファン(SFN)は、ブロッコリー、ケール、キャベツ、大根、マスタードなどのアブラナ科野菜に自然に存在するイソチオシアネートである[30, 408]。これは、ヒストンアセチル化が遺伝子転写の傾向の増加と明確に関連しているため、ゲノム全体および特定の遺伝子レベルでのヒストンアセチル化の増加につながる可能性がある[413]。さらに、SFNはDNMT阻害[276, 414, 415]やmiRNAの調節[414, 416-418]にも効果があることが示されている。SFN以外の他のITC[419-422]も、エピジェネティック修飾における特性を介して、ヒトおよび動物において様々な健康上の有益な効果が示されている(表(表44))。
ウィザフェリンA
最初に報告されたウィタノライドであるウィザフェリンA(WA)は、ウィタニアソムニフェラ由来の天然ステロイドラクトンであり、抗炎症作用[423, 424]、抗転移作用[425]、抗血管新生作用[426]、特に抗腫瘍活性[427-429]を含む多機能性のため、ますます関心が高まっている。重要なことに、WAは薬理学的に達成可能な濃度で乳腺腫瘍において強力な抗癌活性を発揮する[430]。vel Szicらによる最近の研究では、トリプルネガティブMDA-MB-231とエストロゲン受容体陽性MCF-7の両方の細胞にWAを投与したところ、グローバルなDNAのハイパーメチル化が認められ、MDA-MB-231のDNAメチル化レベルはMCF-7細胞よりも低かった。一方、メチル化パーチュレーションに関連した特異的遺伝子は双方向性(ハイパーメチル化とハイパーメチル化の両方)であり、これら2つの細胞株間では対照的であった。著者らはまた、観察されたハイパーメチル化が、PLAU遺伝子プロモーターにおけるH3K4me3の減少と関連していることを発見した[431]。しかし、以前の試験管内試験研究では、8および10μMのWAで処理された細胞はDNMT阻害活性を発揮した[285]。さらに、WAはIL-6遺伝子プロモーター領域でのクロマチンアクセシビリティの低下と関連している[432]。我々の研究室からの2つの研究もまた、WAが乳癌細胞においてDNMTおよびHDAC阻害剤として作用したことを示しており、このような活性はSFNと組み合わせることで強化された[269, 411](表(表44))。
セレン
セレン(Se)は、通常、穀類、ナッツ類、野菜に含まれる必須微量元素であり[433]、セレノシステイン、亜セレン酸ナトリウム、セレン化ナトリウム[434]などの異なる形態を有している。セレンは、免疫力の強化や抗がん作用など、人間の健康に向けた有益な効果のためにかなりの注目を集めている。妊娠中の適切なセレン摂取量はまた、酸化ストレス[435]から保護することにより、成功し、健康的な妊娠を促進することができる。それにもかかわらず、マウンティング研究は、エピジェネティックなメカニズム、特にDNAメチル化の調節にその優先順位をリンクしている。Seで処理した前立腺癌細胞は、プロモーターの部分的なDNAメチル化レベルとH3K9acをアップレギュレートすることでGSTP1の発現を再活性化することが示されており、一方でHDAC活性とH3K9メチル化を阻害している[436]。さらに、Se欠損はゲノムDNAのハイメチル化とp16およびp53のプロモーターのハイメチル化をもたらした[437]。さらに、Mirandaらは、亜セレン酸ナトリウムとメチルセレン酸の両方が乳がん細胞におけるDNMT1発現を阻害することを発見した。さらに、メチルセレニン酸処理群と亜セレン酸ナトリウム処理群では、それぞれH3K9me3とH4K16acの減少が観察された[438]。マウスおよびラットの研究において、Seを補充した食事は、大腸組織におけるDNAメチル化の増加[439,440]および肝臓[441,442]および心臓におけるグローバルDNAメチル化の減少[443]をもたらし、さらに、Tp53のエクソン特異的座[442]および2つの炎症関連遺伝子(TLR2およびICAM1)のプロモーター領域におけるメチル化の増加[444]をもたらした(表(表44)参照)。
増え続ける証拠の体は、野菜、果物、ナッツ、および飲料の栄養価の高い成分および非栄養価の高い成分が、免疫改善、アポトーシス阻害、および癌予防などの人間の健康の重要な生命プロセスに関与するエピジェネティックプロセス(例えば、DNA、タンパク質およびRNAの共有結合修飾、miRNA変調、クロマチンリモデリング)を調節し得ることを示している(表(表4).4)。また、環境汚染に対する潜在的な保護機能が注目されている。
環境汚染物質に対する出生前エピジェネティクスダイエットの潜在的な保護役割
それは現在、環境汚染への出生前の暴露は、エピジェネティックな制御異常を介して胚および出生後の発達の悪影響を誘導することが明らかである。同様に、親の栄養暴露はまた、生涯を通じて子孫の健康を決定し、子孫に長期的なエピジェネティック摂動を誘発する可能性がある[30,445,446]。栄養介入が制御可能であり、しばしば有益であるのに対し、前者はしばしば受動的な状況で発生し、ヒトの深刻な健康問題につながる。エピジェネティック薬理学的療法および化学予防における食事性化合物の潜在的な特性が示されている研究が増えている。典型的な例として、Dolinoyらによって実施された研究は、母親のメチル食事と植物性エストロゲンの補充は、BPA [11]への胎内および新生児暴露によって誘導された子孫の毛色の変化とハイメチル化を打ち消したことを実証し、母親の栄養補給は、環境刺激に起因するエピゲノム異常を減衰させたり、否定するための潜在的な予防的アプローチである可能性があることを示唆している。ここでは、我々はエピジェネティックな調節を介して環境曝露に対する出生前栄養の潜在的な可能性を検討する。
母体の食事対EDCs
上述のように、BPAは典型的なユビキタス内分泌活性化合物である。SAMは、DNA、タンパク質、およびRNAのメチル化プロセスのための普遍的なメチルドナーとして機能する。葉酸、VB6,VB12を含むビタミンB群、およびコリン、メチオニン、およびベタインなどのアミノ酸は、それらすべてが直接または間接的にSAMの前駆体として作用するように、メチル供与体栄養素として分類される。Dolinoyの研究[11]では、彼らは最初に雌マウスをAvy/aのオスとの交尾の2週間前から妊娠と授乳期間を通して50 mg/kgのBPA飼料に曝露した。その結果、毛色の変化は、Agouti 遺伝子の 9 つの CpG サイトのメチル化の減少と関連していることが判明した。印象的なことに、雌マウスにメチル供与体(葉酸4.3 mg/kg、ビタミンB12 0.53 mg/kg、ベタイン5 g/kg、塩化コリン7.97 g/kg)を補給した後、子孫のBPA誘発性DNAメチル化は否定された。それは具体的にどの栄養素がこの混合メチル食でより重要な役割を果たしたかは明らかではないが、メチル化の上昇は、父方のメチルドナーの補充は、出生前のEDC曝露に対する潜在的な栄養介入である可能性があることを示し、EDCによって引き起こされるエピゲノム上のハイメチレーションを逆転させる可能性がある。重要なことに、Avyの子孫のハイパーメチル化関連遺伝子を介して母親のメチルドナーの食事によってもたらされたシフトされた毛色分布は、生殖細胞の伝達[146-148]を介してエピゲノムの変化を介してエピジェネティックな継承を介してトランスジェニックに伝達することができる栄養反転BPA誘発エピゲノムの変更を示唆し、複数世代[447]を介して継承されることが示されていた。さらに、食事によるビタミンBの補給は、塗料中の農薬によって引き起こされる有害な影響を減衰させるように見える[448]。
主に大豆に存在する植物性エストロゲンであるゲニステインへの母親の食事暴露は、また、ゲノムメチル化をアップレギュレートすることにより、子孫の毛色をシフトすることが示されている[449]。Dolinoy の研究では、処女の a/a 雌マウスに 50 mg/kg の BPA と 250 mg/kg のゲニステインを投与したところ、子孫の Agouti 遺伝子における BPA 誘導性のハイメチル化が中和された [11]。BPAのようなポリカーボネートプラスチックは人間の体内に遍在的に使用されており、大豆製品は広く消費されているため、ゲニステインが胎児期の栄養介入を介して負の環境毒性影響を防止する能力は、有望な見通しを持っている。
妊産婦の食生活対喫煙
DNAメチル化マーカーは、一連の遺伝子のメチル化変化がタバコの使用にリンクすることが示されているとして、父性喫煙の潜在的な指標である可能性がある。これらの遺伝子の中で、特にcg05575921遺伝子座で、AHRRのハイメチル化は、しばしば発見された[104,450-452]。アフリカ系アメリカ人コホートを対象とした最近の研究では、AHRRにおける喫煙誘発DNAの脱メチル化は、メチル代謝における重要な調節因子であるメチレンテトラヒドロ葉酸還元酵素(MTHFR)のメチル化の増加によって調節された[453]。一貫して、Zhangらは、十分な母親の葉酸レベルが部分的に新生児のエピゲノム上の母親の喫煙の悪影響を緩和するだけでなく、子供の健康[110]に可能性があることを発見した。また、リッチモンドとジュベールは、子孫のDNAメチロムに母親の喫煙と一炭素微量栄養素の暴露の影響を対比させ、暴露のこれらの2つのカテゴリは、子孫のエピゲノムに潜在的な反対の影響を持っており、独立して動作することがわかった[454]。
母体の食事対メタボリックシンドローム
メタボリックシンドローム(MetS)は、肥満、高血圧、脂質異常症、インスリン抵抗性などの一連の代謝障害によって特徴づけられる進行性の表現型である[30, 455]。上記で見直したように、環境汚染物質への母親の暴露は、子孫に同様のエピゲノム異常とMetSにつながることが示されている。それは、母親の食事メチルドナーは、エピジェネティックなメカニズムを介してMetSを調節する可能性があることが示された。Wolffらは、妊娠中のAvy/aマウスにおけるメチル供与体の補充が、DNAのハイペルメチル化によって子孫のMetS表現型を防ぐことを明らかにした[393]。さらに、メチル食(葉酸、VB12,ベタイン、およびコリン)は、DNAハイペルメチル化を介して同じマウス株で肥満を予防することが示されている[456]。妊娠中の葉酸とVB12の不均衡は、子孫のインスリン抵抗性と肥満[458]につながるが、ヒトにおける同様の研究はまた、出生前の葉酸補充は、ネパールの農村部[457]の子供のMetSの発生率を減らすことができることを実証した。
母性の大豆の補充はまた、ヘテロ接合の実行可能な黄色agouti(Avy/a)子孫のAvy膀胱内粒子(IAP)レトロトランスポゾンで遺伝子座特異的なDNAハイペルメチル化を誘導し、擬似agoutiに向かって彼らのコートの色をシフトし、その間、成人期に肥満の発生率を減少させる[449]。
ダイエット vs. 周囲の微粒子
PMへの曝露は、エピゲノムの制御異常を介して全身の炎症と酸化ストレスを誘発する可能性がある。最近の研究では、B-ビタミン(葉酸2.5mg/d、VB6 50mg/d、VB12 1mg/d)の補給により、PM2.5誘発のDNAメチル化を防ぐことで、ミトコンドリアのDNA量の減少とDNAメチル化の減少をほぼ完全に防ぐことが示された。一方、これらのメチル基を供給する栄養素は、DNMTsやMTHFRなどの必須酵素と相互作用することで、DNAのメチル化を最小限に抑えることができる可能性がある[72]。これらの知見は、本研究は成人の高PM2.5濃度(250μg/m3)の短時間(2時間)暴露として実施されたが、大気汚染によって誘導されるDNAメチル化の損失をビタミンB群が回避する可能性があることを指摘している。Lucockらが言及したように、Zhongらの研究は、暴露因子におけるB-ビタミンの役割に注目しているが、結論を出すのはまだ時期尚早である[459]。興味深いことに、Zhongらはまた、このようなビタミンBの食事は、心臓の自律神経機能障害と炎症に対するPM2.5曝露の影響を緩和することができることを報告している[460]。
ダイエット対ヘビーメンタル
食事による葉酸補給は、クロム[461]やヒ素[462,463]を含む環境汚染物質によって引き起こされる悪影響を少なくとも部分的に防ぐことが示されている。Wangらは、クロメート生産工場の労働者を対象とした研究を実施し、血中のグローバルなDNAハイポメチル化とDNA損傷が血清葉酸の減少と関連していることを発見し、葉酸補給がゲノムの安定性を維持し、クロメート患者のがん発症をブロックする可能性があることを示唆している[461]。さらに、適切な葉酸は、ヒ素暴露成人の末梢血白血球(PBL)[462]およびAlu反復要素[463]におけるDNAメチル化を修飾することが示されており、ヒ素毒性における一炭素代謝栄養素の保護的役割の可能性が示唆されている。
上記の一炭素代謝栄養素およびフィトケミカルを除き、出生前のビタミンC [464-467]、ビタミンD [468-471]、および特定のポリフェノール[59,472-474]の補給は、エピジェネティックな制御を介して、生物学的に正常な成長および発育を維持し、病気への感受性を低下させ、腫瘍の潜伏期間を延長することが示されている。これらのエピジェネティックな薬剤は、環境毒物によって誘発されるエピゲノム異常を抑制するために使用される可能性がある。それは、環境負荷を標的とした出生前栄養介入の調査はまだ探索段階にあり、より多くの研究が必要であることが認識されるべきである。
環境汚染物質に対する出生前栄養介入の潜在的な考察
介入の窓
ヒトの第一期胚の生殖細胞分化と着床前の着床を含む初期の生活、および乳児期は、エピゲノムのリプログラミングを混乱させるための外部環境刺激の影響を受けやすい。早期に曝露された場合、妊娠後期や成人期の曝露と比較して、より深刻な結果が発生する可能性がある。
同様に、環境の侮辱に抵抗するための栄養介入の最適なウィンドウがある。エピゲノム、環境障害、エピジェネティクスの食事の特性と病気の感受性の動的変化との関係を深く理解することは、エピジェネティックな化学予防と薬理学的治療[35]でかなりの進歩につながる可能性がある。
エピジェネティクス剤のグローバルな影響
上述したように、エピジェネティクス食は通常、DNMT阻害やHDAC阻害などのグローバルなエピジェネティック修飾を示す。数多くの知見は、早生期栄養補給がエピジェネティックに有害な薬剤への曝露の悪影響を軽減することを示しているが、それらの潜在的な、大規模なエピジェネティック摂動による複数の遺伝子における予測不可能な標的のために、いくつかの懸念が提起されている、まだ不明である。より標的を絞った戦略が開発され、将来的にはエピジェネティック治療が臨床の場で強力な選択肢となることが約束されている[15]。
多重汚染物質の曝露
ヒトは、単一の汚染物質ではなく、多くの環境要因にさらされていることは注目に値する。前に詳述したように、ほとんどの研究では、単一の汚染源によるエピゲノム異常のみを調査している。したがって、栄養戦略を開発する際には、カテゴリー、投与量、期間などの複数の汚染物質の評価を考慮に入れるべきである[114]。
栄養バランスと組み合わせ
早期の栄養介入には栄養バランスが注目される。そうでなければ、逆効果になる可能性が高い。その証拠として、母体のVB12が低く、葉酸値が高いと、子孫の肥満発症率やインスリン抵抗性が高まることが示されている[458]。また、DeVitaとVincentは、組み合わせ戦略は、個別に治療するよりも癌に対してより良い治療効果を持っていることを報告した[475]。
最も探索されているエピジェネティクス薬のコンビナトリアル戦略は、DNMT阻害剤とHDAC阻害剤である[476, 477]。これに伴い、食事性エピジェネティック修飾化合物とがん研究におけるコンビナトリアル戦略との相互作用を研究することで進歩を遂げている[268, 269, 276, 283, 409, 411, 478]。
環境毒性物質曝露によって引き起こされる同様のエピゲノム異常を考えると、エピジェネティックな食事の組み合わせ添加は、環境破壊に抵抗するためのより有望なアプローチである可能性がある。
結論
増加する証拠は、出生前の食事の介入が部分的にエピゲノムの制御異常を回避することを通じて、環境汚染物質への暴露によって引き起こされる有害な転帰を打ち消す可能性があることを示している。疾患、暴露、および特定の遺伝子を標的としたアプローチは、負の環境刺激への胎児の適応に関与するエピジェネティックなプロセスはまだ包括的な理解を欠いているので、緊急に栄養や薬理学的介入のために必要とされている。また、時間、性別、および遺伝的背景特異的、用量依存的、および親の栄養介入へのグローバルな応答だけでなく、複数の汚染物質に対するバランスのとれた栄養体制は、さらに調査されるべきである。

