Contents
Premises among SARS-CoV-2, dysbiosis and diarrhea: Walking through the ACE2/mTOR/autophagy route
オンラインで公開2020年9月2日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7467124/
要旨
最近、中国で新しいコロナウイルス(SARS-CoV-2)が発見された。その感染力の高さから、すでにほとんどの国でパンデミックしており、瞬く間にパンデミックとなっている。最も一般的な症状は呼吸器系の問題であるが、SARS-CoV-2の感染は消化管にも影響を及ぼし、炎症や下痢を引き起こす。
しかし、これらの腸管症状に関連するメカニズムはまだ十分に理解されていない。SARS-CoV-2は、ウイルスの侵入機構として宿主細胞内のアンジオテンシン変換酵素受容体2(ACE2)に結合し、肺や腸に感染することが明らかになっている。すでに他のウイルスもACE2への結合を介して腸の症状と結びついている。
この医学的仮説論文では、SARS-CoV-2の内部化に伴うACE2のダウンレギュレーションは、オートファジーの増加に伴うmTORのメカニズム標的の活性化の低下につながり、腸内環境異常を引き起こし、下痢を引き起こすのではないかと推測されている。
さらに、腸内環境異常は肺を介して呼吸器系に直接影響を及ぼす可能性がある。ACE2/腸/肺軸を調節する他のウイルスについては、オートファジーや腸管障害が消化器症状の発現に関与していることなどの手がかりがあるが、SARS-CoV-2感染症におけるACE2/mTOR/オートファジー経路についてのエビデンスはまだない。
そこで、我々は、新型コロナウイルスが腸内細菌叢に変化をもたらし、ACE2/mTOR/オートファジー経路を介して腸球に下痢を引き起こすことを提案する。腸内細菌叢が制御されていないと、他の疾患や腸外症状への感受性が高まり、肺に遠隔障害を引き起こす可能性があるという前提に基づいて、我々の仮説は支持されている。
これらの関連性は、前述の仮説を評価し、SARS-CoV-2感染による腸内細菌叢の異常を制御することで、肺障害の減少や疾患の予後の改善を確認することを目的とした今後の研究を示唆し、奨励するものである。
キーワード
コロナウイルス、SARS-CoV-2,下痢、生活習慣病
序論
コロナウイルスは、コロナウイルス科に属するウイルスで、単純型でエンベロープされたRNA型の遺伝物質を持つ[1], [2]。最重症の重症急性呼吸器症候群(SARS)の発症に関係している。WHOのデータによると 2002年に発生したSARS-CoV(8,000人近くが感染し800人が死亡)や、約2,500人が感染し858人が死亡した中東呼吸器症候群MERS-CoVなど、世界的にコロナウイルス感染のアウトブレイクが懸念されている[3], [4]。
最近、中国の武漢で新たなコロナウイルスが発見された。SARS-CoV-2は、従来のものに比べて致死率は低いが、伝染レベルは強調されており[5]、世界のほとんどの国に到達しており、瞬く間にパンデミックとなっている[6]。最も一般的な症状は呼吸器系の問題に関連しているが、コロナウイルス感染症は消化管にも影響を与える。SARS-CoV2を用いた最近の研究では、感染者の肛門スワブ中に高濃度(約40%)のウイルス遺伝物質が存在することが示されている[7] [8]、[9]ことから、腸管感染が特徴的である。ウイルスによる腸管感染は、炎症や腸のけいれんから下痢に至るまで、さまざまな合併症を引き起こす可能性があり、変動はあるものの、症例の30%に達することもある[10], [11]。
概念的には、下痢は腸管通過の増加によって特徴づけられ、毎日の腸の動きが3回以上激しくなり、その起源に応じて粘液や血液を伴うことがあり、栄養素の吸収が困難になり、電解質や水分の損失を引き起こす[12], [13]。様々な病因型の中には、アデノウイルス、ヒトカリシウイルス、アストロウイルス、ロタウイルス、ノロウイルスなどに起因するウイルス性下痢症がある[14]。
下痢のプロセスにはいくつかの要因が含まれている可能性があり、例えば、腸内恒常性の不均衡を引き起こす抗生物質の使用(dysbiosis)による常駐微生物叢の減少などである[15]。ラパマイシンの機械的標的としての細胞内経路のシグナル伝達(mTOR)は、細胞のオートファジーに直接関連するキナーゼ型タンパク質のセット[17]であり、腸内Na+/H+[18]およびATPaseポンプ(Na+/K+)を介したチャネル開口部の流れを助け、この障害にも関与している[19]、[20]。
腸内毒素症は、下痢性疾患の発症中に基本的な役割を果たす。しかし、他のシステムや臓器の恒常性維持にも重要な役割を果たしている。Ahluwaliaら[21]は、腸内毒素症の変化が腸-肝臓-脳軸の障害を引き起こし、プロ炎症性全身状態、脳機能の変化、肝硬変と関連していることを示した。腸内細菌叢の不均衡は、肺免疫および宿主の防御に寄与するため、肺を介して呼吸器系に影響を及ぼす可能性がある[22]。そのため、腸内細菌叢の研究は、呼吸器疾患の発症に強く関連している[23], [24]。
仮説
SARS-CoV-2は、腸球にも存在するACE2に結合することが知られている。この酵素へのウイルスの結合は、その祖先である SARS-CoV と SARS-CoV-2 の両方において、その調節の緩和をもたらす。他のウイルスでは、ウイルスの内部化に引き金となるmTORの減少が観察され、これはすでにオートファジーの増加とバイオシスの異常と関連していた。しかし、SARS-CoV-2感染時のバイオシス異常のメカニズムについては、現在のところ不明な点が多い。我々は,新型コロナウイルスが腸球のACE2/mTOR/オートファジー経路を介して腸内細菌叢の変化を引き起こし,それがCOVID-19患者の消化器症状に至るのではないかと推測している.
仮説の評価
SARS-CoV-2に対する新たな治療標的の探索が急務となっているため、コロナウイルスの感染と複製戦術の理解に焦点を当てた研究がいくつか行われている。文献報告によると、SARS-CoV-2のウイルス表面スパイク糖タンパク質(Sタンパク質)はACE2に結合し、また、ウイルスの侵入機構として、膜関連型II膜貫通型セリンプロテアーゼ(TMPRSS2)などの宿主プロテアーゼによるSタンパク質のタンパク質分解的切断を必要とすることが明らかにされている[25], [26], [27], [28]。
このウイルスは、ACE2およびTMPRSS2も発現していることから、腸内で直接同定されたウイルス遺伝物質である腸管細胞に感染して複製する能力を有することが知られている[29], [30], [31]。これらの患者はCOVID-19の初期に下痢、嘔吐、腹痛などの腸管症状を呈することがあるため[32], [33], [34], [35]、このような症状を呈すると考えられている。そのため、SARS-CoV-2の消化管への影響を考慮した感染症治療・管理が必要である[33], [34], [36]。
SARS-CoVやMERS-CoVによる他のコロナウイルスは、消化管環境で生存し、腸管細胞に感染し、下痢を引き起こす能力を持っている[32], [37]。しかし、重要な観察は、SARS-CoVおよびSARS-CoV-2ウイルスのスパイクタンパク質が腸球中のACE2に結合して消化管作用を促進するのに対し、MERS-CoVはジペプチジルペプチダーゼ4(DPP4)に結合し、異なるメカニズムで作用することができるということである[28], [38]。
研究では、新型コロナウイルスが下痢を引き起こす原因の一つは、感染した腸管細胞の粘膜透過性が変化し、腸管細胞での吸収不良を引き起こすことにあると考えられている[39]。また、他のウイルスでも、ACE2の調節障害を介して腸管障害を引き起こすものがある[40], [41], [42]。これは、これらの細胞に存在すると考えられるACE2がトリプトファンなどのアミノ酸の取り込みに関与し、その結果、細胞増殖、タンパク質の合成、生産に関連する調節因子であるmTORの活性化につながるためであると考えられ、栄養素の検出やトリプトファン/ニコチンアミド経路によって直接活性化される[16]。研究は、ACE2がダウンレギュレートされると、トリプトファンの減少があり、それによってmTORの活性化が低下し、腸内細菌叢の不調が生じ、下痢を引き起こし、大腸炎などの他の疾患から腸内炎症に対する感受性が増加することを示唆している[16]、[43]。さらに、科学的研究は、アンジオテンシン1-7の枯渇や中性アミノ酸トランスポーターB0AT1欠損など、ACE2の調節障害と相関する他のタンパク質や基質が、トリプトファンなどのアミノ酸取り込みの低下や消化管症状と相関していることを示している[43], [44], [45]。
それでも、議論され、研究されるべき重要な事実は、mTORC1シグナル伝達複合体に存在するmTORが、オートファジー(オートファゴリソーム形成のためにリソソームと融合する二重膜構造の細胞内損傷成分のエンドサイトーシスと分解プロセス)にも関係しているということである[46], [47]。研究では、このプロセスがαおよびβ-コロナウイルスの複製に関与していることが示されており、ウイルス複製に関与するタンパク質と内因性のLC3(オートファゴソームのためのタンパク質マーカー)との共局在化が発見されている[48]。新しいコロナウイルスは、ヒト宿主においてもこのような複製機構を利用している可能性があると考えられている[47]。
mTORの阻害は、オートファゴソームマーカーAtg5の発現によって示される腸内オートファジーの活性化を引き起こす。この過程で、腸球に多く存在する腸管上皮ブラシ境界Na+/H+交換体タンパク質であるNHE3のオートファジー分解が起こり、NaClの吸収に関係していることが明らかになった[18]。Yangら[18]によると、mTORC1複合体の阻害剤であるラパマイシンを投与すると、NHE3のレベルが低下し、結果としてNa+/H+交換活性が低下し、ヒトおよびげっ歯類の腸内で吸水が起こり、腸液が増加して分泌型の下痢を特徴とする。このことから、オートファゴソームの形成を抑制することがmTORの役割ではないかと推測される。このようなオートファゴソームの活性化の低下は、SARS-CoV-2の腸管細胞への感染に伴うACE2のダウンレギュレーションの結果であり、オートファジーの引き金となり、下痢を伴うウイルスの複製につながる可能性がある。
興味深いことに、オートファジープロセスは腸内細菌叢をも制御しており、その増加は下痢に関連していることが研究で示されている[49], [50]。オートファゴソーム形成に必要なタンパク質であるAtg5もまた、微生物が腸管上皮表面に接触するのを防ぐパネス細胞を制御している[49], [50]。これらの証拠は、オートファジープロセスがCOVID-19の腸内微生物叢の変化に関係しているのではないかと推察させる。しかし、腸内細菌叢自体がmTORを誘導し、腸内オートファジーを直接制御することも可能である[51], [52], [53], [54]。先に見たように、この経路の規制緩和は、分泌性下痢プロセスで最高潮に達する。
以前に報告されたように、新しいコロナウイルスによって引き起こされる腸管症状に関連するメカニズムはまだ十分に理解されていない。このウイルスが微生物相を変化させることは知られているが、このプロセスにACE2/mTOR/オートファジー経路が関与していることを示す証拠はまだない。SARS-CoV-2のコンピレーションでは、i) ACE2との相互作用とそれに続くダウンレギュレーション、ii)腸内環境異常の発生の証拠がある、iii) SARS-CoV-2に感染した細胞ではmTORC1がダウンレギュレーションされていることが示されている。さらに、他のコロナウイルスは微生物相の変化を伴うことが研究で示されている[33], [55], [56], [57], [58], [59], [60], [61]。ACE2 [25]を介して細胞内に侵入したSARS-CoV-2は、オートファゴリソソームの活性化と腸内細胞への集合を引き起こし、ラパマイシン[18]、[43]の投与で示されているように、腸内毒素症、腸内炎症および下痢を引き起こす可能性のあるmTOR阻害[57]を誘発している可能性がある。さらに、ACE2経路および基質の調節障害はトリプトファンの取り込みを低下させ、これは他の研究でmTOR阻害の原因の一つとして同定されたプロセスであり、腸疾患に関連している[16], [43], [44], [45]。このように、SARS-CoV-2は腸内細菌叢の変化を引き起こし、その結果、腸球におけるACE2/mTOR/オートファジー経路を介して下痢を引き起こすことが示唆された。以上の仮説とそれを裏付ける証拠を図1に示する。
図1 SARS-COV-2による腸内環境異常と下痢のメカニズム。
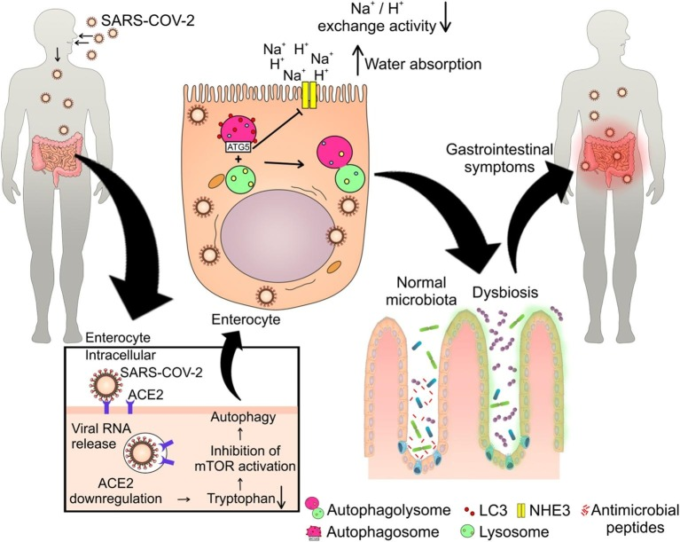
SARS-COV-2は体内に入った後、ACE2と結合することで腸管細胞に感染し、このヒト酵素の調節障害を引き起こし、その結果、トリプトファンの取り込みが減少し、mTORの活性化が減少する。これは、Na+/H+交換活性の低下、吸水量の増加、下痢を引き起こすオートファゴリゾームの形成につながる可能性がある。さらに、mTOR活性の低下は、パネス細胞による抗菌ペプチドの産生を低下させ、腸内細菌叢のアンバランスに関連した腸内腸内毒素症や胃腸障害を引き起こすことになる。
このように、今回の仮説が確認されたことは、SARS-CoV-2感染者の下痢症状を緩和することに焦点を当てたマイクロバイオータを対象とした新たな治療法の展望を生み出す可能性がある。腸管免疫系は肺などの他の臓器の免疫系の恒常性維持に重要であるため、腸内細菌叢が制御されていないと、他の疾患や腸外症状に対する感受性が高まる可能性があることが文献で報告されている[62], [63]。
仮説の結果と考察
消化管微生物叢の構成と機能の変化は、いわゆる「腸-肺軸」[62], [63]を介して、免疫調節を介して相互に呼吸管に影響を与える可能性がある。さらに、腸内毒素症によって引き起こされる高レベルの炎症性サイトカインは、以前に結核などの他の疾患における肺の完全性の障害と関連していた[23]。証拠は、SARS-CoV-2が炎症反応の連鎖を通じて消化器系にダメージを与えることを示している[11]。
しかし、現在までのところ、SARS-CoV-2感染におけるこのような消化器系の損傷と肺の損傷との間に、この仮説論文で提案されているようなオーケストレーションされたステップを経た関連付けはまだなされていない。我々は、ACE2/mTOR/オートファジー経路からの可能性のあるオートファジーの増加によって引き起こされるマイクロバイオータの調節障害が正のフィードバックにつながっていると考えており、ここでは、腸管障害よりもプロ炎症性サイトカインの増加が、SARS-CoV-2感染陽性患者の肺障害の悪化と関連している可能性があると考えている。この証拠は、肺障害の減少と疾患の予後の改善を確認するために、抗生物質治療を受けている患者だけでなく、ウイルスに感染している患者のCOVID-19または基礎疾患における腸内環境異常を調節することを目的とした今後の研究を示唆し、奨励するものである。
COVID-19患者にみられる症状の中に胃腸症状が含まれていることは注目に値する。今後の研究では、この医学的仮説で提案された経路を用いて、これらの患者が以前に基礎疾患または貧弱な食生活によって引き起こされた腸内環境異常を有していたかどうかを調査することが奨励されている。これらの報告は我々の仮説を裏付け、支持するものであり、今後、SARS-CoV-2感染症における下痢症状のメカニズムや治療法を明らかにし、ウイルス感染と消化管症状との関連性や、肺症状の悪化に腸内毒素症が関与している可能性をよりよく理解するための研究が重要であることを示している。
