Contents
Precision clinical trials: a framework for getting to precision medicine for neurobehavioural disorders
www.ncbi.nlm.nih.gov/pmc/articles/PMC7955843/
2021年1月
Eric J. Lenze, MD,corresponding author Ginger E. Nicol, MD, Dennis L. Barbour, MD, PhD, Thomas Kannampallil, PhD, Alex W.K. Wong, PhD, Jay Piccirillo, MD, Andrew T. Drysdale, MD, PhD, Chad M. Sylvester, MD, PhD, Rita Haddad, MD, J. Philip Miller, AB, Carissa A. Low, PhD, Shannon N. Lenze, PhD, Kenneth E. Freedland, PhD, and Thomas L. Rodebaugh, PhD.
要旨
精神疾患などの神経行動学的疾患では、プレシジョン・メディシン(個々の患者に合わせた治療)の目標が達成されていない。これらの疾患は動的に複雑であるため、精密医療を推進するにあたって、従来の無作為化臨床試験の方法では不十分である。
我々は、個別にカスタマイズされた治療法を包含する精密臨床試験フレームワークという実用的な解決策を提示する。このフレームワークには以下のものが含まれる。
- (1)短期間の介入後に患者の反応を測定し、その後、患者をフル経過の治療に無作為に割り振り、急性期の反応を用いて長期的な転帰を予測する「治療標的強化」
- (2)試験中に治療パラメータを調整して治療を個別に最適化する「適応型治療」
- (3)生態学的瞬間評価などの手法を用いて予測変数と転帰変数を高い精度と信頼性で測定する「精密測定」
このレビューでは、精密臨床試験を要約し、精密神経画像、経頭蓋磁気刺激-脳波デジタル表現型などの新しいバイオマーカーや、統計・機械学習モデルの進歩など、研究課題を提示している。これらのアプローチを検証し、精密臨床試験の枠組みを広く取り入れることで、神経行動学的疾患に対する精密医療のビジョンを達成することができるであろう。
神経行動学的疾患の負担と精密医療の必要性
神経行動学的疾患は、うつ病、不安障害、精神病などの精神医学的、神経学的、行動学的症候群、認知症などの発達障害や加齢に伴う認知機能の低下、薬物使用障害、肥満などの複雑な神経生物行動学的疾患1,煩わしい耳鳴りや慢性疼痛などの身体的疾患から構成される。これらの障害は、身体障害2,死亡率3,医療費増加の大きな要因となっている。これらの障害に対する治療法には、薬物療法、神経調節装置、行動・生活習慣への介入などがあるが、これらはすべて、脳と行動を対象として、症状を改善し、認知機能障害を軽減するものである4,5。
神経行動学的疾患が依然として高い負担を強いられているのは、効果の高い治療法がないためであり、その原因の少なくとも一部は、病態生理が十分に理解されていないことにあると考えられる。心血管疾患や脳卒中のように病態生理が解明されている疾患では、包括的なターゲットを絞った予防戦略を開発し、普及させることができる6,7。スタチンと降圧剤の併用療法8や血行再建術の進歩など、複数の心血管危険因子を対象とした予防アプローチにより、罹患率と死亡率が大幅に減少した。一方、神経行動学的疾患に対する「ブロックバスター・ドラッグ(圧倒的な売上をあげる大型新薬)」は、ブロックバスター的な改善をもたらしていない。例えば、うつ病や不安障害に対するプラセボ対照試験では、平均効果量が非常に小さいことが示されている9,10,11。統合失調症は、抗精神病薬で完全に寛解することはまれであり、これらの薬には神経系や心代謝系の副作用もある12。認知行動療法などの行動療法は、薬物療法に比べていくつかの利点があるかもしれないが(例えば、長期追跡調査における費用対効果13)実際に実施された場合には、治療提供の忠実性14,15が低く、アドヒアランスも低下する。16,17 モバイルヘルスの介入は、アクセスと治療の到達範囲の改善を約束するが、利用研究によると、ほとんどの介入の治療参加は約2週間後には減少することが報告されている18,19 最後に、神経行動障害は慢性化する傾向があり、短期的には治療に肯定的な反応を示しても再発する20,21。
プレシジョン・メディシンの定義
プレシジョン・メディシン(個別化医療、層別化医療とも呼ばれる)は、個人差を考慮した治療法22として概念化されており、個人に合わせた治療を行うことを主な目的としている。プレシジョン・メディシンは、神経行動障害の負担を軽減するための有力な解決策となるであろう。なぜなら、プレシジョン・メディシンは、最も効果が期待できる患者に薬剤、神経調節装置、行動療法を投与し、その効果を最適化するからである。
米国国立衛生研究所(NIH)のプレシジョン・メディシン・イニシアチブでは、プレシジョン・メディシンを「遺伝子、環境、ライフスタイルなどの個人差を考慮した病気の治療と予防のためのアプローチ」と定義している24。この構想では、個々の患者の広範な生物行動学的評価によって、診断カテゴリー内の治療に関連する不均一性が明らかになるとしている。例えば、「うつ病」は単一の疾患ではなく、多くの神経生物学的、行動学的、環境的な原因を持つ異質な症候群である。このシナリオでは、医療従事者は、患者の生物学的、環境的、行動的パラメータに基づいて患者の特徴を把握し、患者が報告したデータやセンサーによる行動の表現型を用いて、個々の患者のニーズに合った治療法を選択することができる。
無作為化比較試験における現在の精密医療アプローチの短所
27 その証拠に、気分障害28,不安障害29,精神病30,薬物使用31,摂食障害32において、治療の指針となる臨床的に有効なバイオマーカーが存在しない。また、心理療法などの行動療法の指針となる行動マーカーについても、同様の進展のなさが指摘されている33。我々は、このような進展のなさは、精密医療のパラダイムの概念化と、神経行動学的無作為化対照試験(RCT)で検証する方法に欠陥があるためだと考えている。この欠陥のあるアプローチは、神経行動学的障害の複雑さを3つの点で考慮していない9,34-37。
第一に、患者のサブグループは、介入の効果の大きさを調節すると仮定される無作為化前のベースラインマーカー(すなわち、調節因子)によって定義され、これは、例えば、心血管疾患でよく用いられるアプローチである。このアプローチは、疾患の病態生理がよく知られていることを前提としており、静的なベースラインマーカー(遺伝子型やその他のバイオマーカーなど)が確実にサンプルを豊かにする(すなわち、治療の恩恵を受ける可能性が最も高い患者サブグループを区別する)ことができる。しかし、神経行動学的疾患の治療経過は、患者とその治療の間の複雑でダイナミックな相互作用であり、治療への曝露、期待効果、忍容性、治療者との関わりによって変化する神経生物学的特性を含む。治療前の変数は、このような多くの患者と治療の相互作用の良い予測因子ではないであろう。
第二に、RCTの治療群は通常、特定の治療の暴露(または用量)を提供することに焦点を当てている。柔軟性が認められる場合でも、その範囲は限られており、通常はその場しのぎとなる。臨床医学では、治療反応を用量反応曲線、つまり治療前から治療後への変化を治療曝露の関数として一次元的に描く習慣がある。しかし、神経行動学的な治療反応は、用量反応曲線に従わない可能性がある。患者のニーズ、好み、心理社会的な状況、神経生物学的な変化に伴って、急性期および長期的に複雑で非線形な方法で変化する可能性がある33。
第三に、神経行動障害のRCTでは、不正確な評価でアウトカムを測定することが少ない。個別に関連する脳や行動の変化を特定する能力は、高いレベルの測定精度と適切な統計モデルに依存するが、RCTではどちらも広く使われていない38。不正確な評価は、変動性の高い行動マーカー39や再現性の低い神経画像マーカーなどの予測因子の測定を妨げることもある40。
これらの欠陥の結果、RCTでは、治療期間中に患者の行動や神経生物学が変化することで変化する可能性のある最適な治療法やオーダーメイドのレジメンを、動的かつ正確に決定することはできない41。
プレシジョン・クリニカル・トライアル
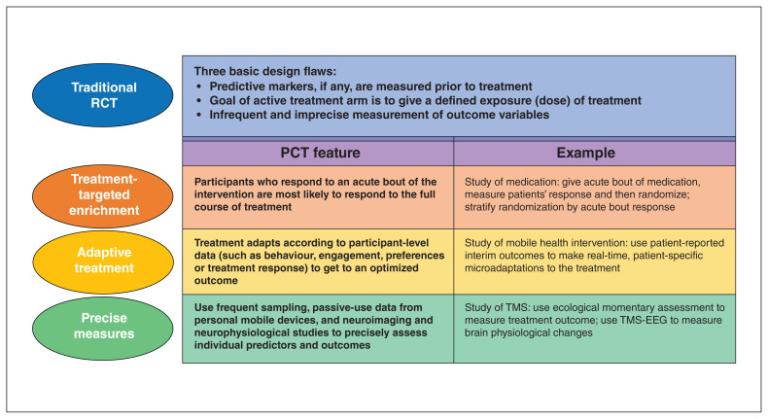
このような設計上の欠陥を克服するため、我々は精密臨床試験(Precision Clinical Trial: PCT)と名付けたフレームワークを提案する。このフレームワークは、最も効果が期待できる個々の患者に最適な治療法を提供することを目的とした、一連の臨床試験デザインの決定から構成されている(図1)。ここで重要なのは、神経行動障害は複雑であり、その病態生理はほとんど解明されていないため、個々の患者に最適な治療を行うためには、標準的なRCTとは異なる臨床試験方法が必要であることを認識した上で、PCTは実用的なフレームワークであるということである。
図1 精密臨床試験の枠組み
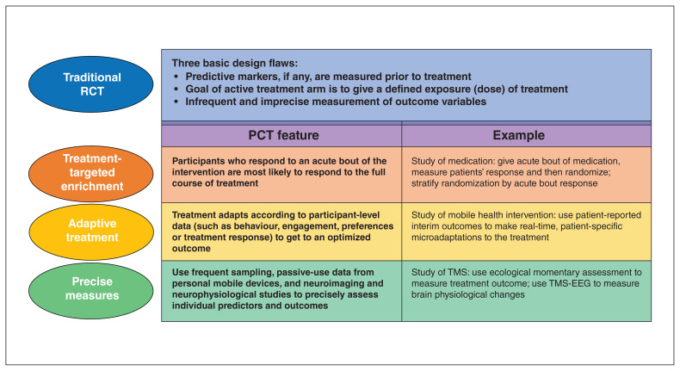
EEG = electroencephalogram(脳波)PCT = precision clinical trial(精密臨床試験)RCT = randomized controlled trial(無作為化比較試験)TMS = transcranial magnetic stimulation(経頭蓋磁気刺激)
PCTの枠組みは、過去数十年の間に登場した多くの臨床研究手法を包括している。しかし、これらの手法は単独で開発されたものであり、多くの神経行動学の研究者には理解されていないため、広く利用されるには至っていない。我々は、スマートフォンによる精密測定の実現性、有望なバイオマーカーと個人における治療効果をモデル化する統計的手法の出現、治療法の開発と試験における精密医療の明確な道筋を示す新たな規制指針、という3つの進歩が収束したことにより、「転換点」が訪れたと主張する。その結果、個人差に対応するための手法が、精密医療を推進するための臨床試験に広く利用できるようになった。いくつかの方法は、個人に合わせた治療を目的とした治療モデルから生まれた臨床試験デザインであり、例えば、N-of-1試験(例:患者を急性期の治療に無作為に割り当てる。また、二重無作為化嗜好試験(患者を無作為に割り付け、患者が希望する治療を受けるか、無作為に選んだ介入を受けるかを決定する)44や、個々の患者に合わせた治療を行うデザイン(Just-in-Time Adaptive Intervention Trial、Just-in-Time Adaptive Intervention Trialなど)など、臨床試験デザインの概念革新から生まれた方法もある。45,46や、初期治療に反応しなかった患者を増量条件または切り替え条件に再ランダム化する逐次多相適応無作為化試験(SMART)47など)がある。これらの新しいデザインは、より効率的で経済的、かつスケーラブルな治療法の開発に貢献するだけでなく、治療法の開発を通じて治療パラメータを経験的に検討し、改良することができる。46 同様に、予測因子や結果の測定が進歩したことで、研究者は、スマートフォンやセンサーを用いた外来での評価や、精密な脳マッピングや神経生理学的手法を用いて、正確で粒度の高い個別の測定値を得ることができるようになった。また、新しい統計学的手法により、研究者は個人レベルで病気の時間的動態をモデル化することができる。
PCTフレームワークは、これらの多くの方法論的進歩を3つの関連する補完的な機能に統合している。
- 治療標的強化:PCT では、個々の患者の脳や行動の反応を調べるために短期間の治療を行い、その後、無作為にフル経過の治療を行い、短期間の治療に対する患者の反応がフル経過の治療に対する結果をどのように予測するかを検討する。
- 適応型治療:PCTは、短期的および長期的に、反応を最適化するためにパラメータが時間とともに変化する介入をテストする。
- 精密測定:PCTは、予測因子および転帰に関して、個々の患者の高精度で信頼性の高い脳および行動の測定を実施する。
精密医療を進めるためには、この3つの機能を連携して実現する必要がある。図2は、認知トレーニングの臨床試験でPCTのフレームワークを使用する場合の例である。
図2 認知トレーニングの精密臨床試験の例

dlPFC=背外側前頭前野、fMRI=機能的MRI
特徴1:治療をターゲットにしたエンリッチメント
従来のRCTにおける精密医療の検証方法は、ベースラインのエンリッチメント因子、つまり治療結果を予測(または中庸)する治療前の生物学的・行動学的な測定値を探索することであった。このような予測因子は、遺伝学の用語に倣ってエンリッチメント因子と呼ばれているが50,51,神経画像、末梢分子(プロテオミクスなど)症状(共存する不安など)行動なども同様に簡単に見つけることができる。しかし、このような「ベースラインのみ」のアプローチは、抗うつ薬反応の遺伝的予測因子の決定が進まないことに代表されるように、神経行動障害ではほとんど成功していない52。
このような成功例がないのは、神経行動障害の治療結果が、
患者とその治療法の間の複雑な相互作用であることを反映しているのではないかと考えている。この複雑さのために、生物学的または行動学的な治療前のベースライン特性は、患者と治療の相互作用、ひいては治療結果を予測するには不十分である。一部の介入は弱いと思われるが、治療前の変数のみに基づくサンプルエンリッチメントは、治療反応を高度に予測するには感度と特異性が不十分であると考えられる。
これに対して、PCTは、患者と治療の間の相互作用を直接測定することで、治療結果を予測する。これを行う最も簡単な方法は、無作為化の前にすべての患者を介入に短時間さらし、その急性反応(脳および/または行動)を測定することである。例としては、急性の認知トレーニングに対する認知パフォーマンスの変化、薬の単回投与に対する迅速な症状の変化、またはモバイルヘルス介入に短時間さらした際のデジタル測定による行動の変化、および治療を継続するための自己申告の動機付けなどがある。これらの中には、反応が適格基準の一部となるランイン臨床試験53と考えられるものもある。その後、患者を無作為化し、急性期の反応を無作為化後のアウトカムの予測変数として用いる。
このデザインの特徴は、我々が「治療ターゲットの強化」と呼んでいるもので、ある介入に対する個人の初期の反応は、その介入に対するその後の反応を予測する可能性が高いという概念に基づいている。同様に、N-of-1試験は、行動変容研究や臨床医学56において、患者を異なる治療法の短期間の経過に無作為に割り振り、その後、最も好ましい治療法の長期経過を提供することで、患者の長期的な反応を最適化するように発展してきた。
ある治療に対する個々の患者の初期の脳や行動の反応が、その患者の長期的な反応全体を予測できる可能性がある場合、治療をターゲットにしたエンリッチメントが可能となる。例えば、反復経頭蓋磁気刺激(rTMS)の1回の投与で、有益な認知効果が得られる58。同様に、暴露療法などの行動療法は、急性の暴露に対する患者の初期反応に基づいて治療を誘導する。また、ケタミンや神経ステロイドのように、迅速な症状反応をもたらす薬理学的治療法の多くは、長期的な反応の急性期の予測因子としての役割を果たす可能性がある59。従来のアウトカム評価では迅速な効果が検出できない場合でも、研究中の治療法の多くは、非侵襲的な神経生物学的測定(脳波60や機能的MRI[fMRI]を含む)61やモバイル技術を用いた認知・行動の表現型62を用いて、ヒトで検証できるメカニズムを持っており、治療反応の確実な予測因子となる可能性がある。また、急性期の患者のアドヒアランスとエンゲージメントを評価することで、長期的なアドヒアランス、エンゲージメント、治療効果を予測することができる。
奏効する可能性が最も高い患者に試験を集中させることは、概念的に魅力的であり、試験の成功率を高め、参加者がなぜ奏効するのかを明らかにするための分析の検出力を向上させる可能性がある63。これらの治療ベースのエンリッチメント因子を、いつ、どのように試験するか、また、臨床試験または一連の試験でどのように使用するか(例えば、最初は探索的に、次に層別化変数として、最終的には組み入れ基準として)など、まず探索し、次に検証することが重要になる。エンリッチメント戦略を開発、検討、検証するこれらの戦略は、米国食品医薬品局(FDA)の現在のガイダンスでは実際に奨励されている65。
治療目的のエンリッチメントの概念に対する抵抗の原因の一つは、そのような予測因子が存在するのであれば、なぜ我々は既に発見していないのかということである。その答えの一つは、反応には個人差があるにもかかわらず、66 神経行動学の研究では、最終的な反応の予測因子として治療との相互作用を検討したものはほとんどないということである。抵抗の第二の原因は、治療が必要なのに治療効果が期待できない参加者を除外するという考え方への懸念である。しかし、このような参加者は、異なるメカニズムで作用すると考えられる治療法に焦点を当てた他の研究で必要とされている。実際、治療目的の強化因子に参加者を集中させることで、診断基準や症状基準など、他の組み入れ基準への依存度が低くなる可能性がある。このことから、神経行動学の分野では、遺伝的濃縮に基づ いて患者を募集するが、影響を受ける多くの器官系が認められてい る腫瘍学で見られるようなバスケットおよびアンブレラ臨床試験デザイン (急性反応に基づいて患者を無作為化するが、多数の診断が認められる)を 使用することになるかもしれない70 。以上のことから、治療目標を定めたエンリッチメントの概念は十分に支持されており、神経行動学的治療から最も恩恵を受ける可能性の高い患者を特定するために大いに期待されるものである。
治療目的のエンリッチメント因子を含めることは、伝統的な(すなわち、治療前の)エンリッチメント因子を犠牲にする必要はなく、メンタルヘルス(例えば、うつ病26,71)や依存症(例えば、ニコチン依存症72)では最近有望な知見が得られている。しかし、神経行動障害の治療が動的に複雑であることを考えると、臨床的に価値のある程度まで治療結果を予測するためには、治療を対象とした因子が必要になる可能性が高いと考えられる。
特徴2:適応型治療(アダプティブ・トリートメント)
エビデンスに基づいた治療は、異なる状況(例えば、異なるサブ集団や環境)に適応され、治療の適応がサブ集団における介入効果を改善または減少させる多くの方法を体系的に特徴づけることへの関心が高まっている(実施科学から生まれている)73。PCTの設定では、治療は、個々の動的な症状、ニーズ、状況を反映した反復的な対策に反応する。
従来の臨床試験では、柔軟性があったとしても最小限にとどめられていることが多い(例:固定用量の薬物試験、固定プロトコルの行動介入)。これはおそらく、医薬品の承認を裏付ける「十分かつよく対照された試験」という指針を保守的に解釈しているためである74。対照的に、順応的治療は臨床治療では一般的に行われている。薬や用量は個々の患者の忍容性や症状の重さに基づいて調整され、行動療法はセッションごとに進行し、臨床医は患者の反応に基づいてどのように進め、何を強調すべきかを選択する。また、ステップケアや共同ケアモデルでは、症状が持続または悪化した場合に治療を強化することが組み込まれている。しかし、このような適応は通常、その場限りのものであり、適応の有効性、タイミング、種類に関するデータが体系的に収集されていないことが多いため、このような適応が実際に個々の治療結果を改善するかどうかを評価することができない。
患者が治療法(対照)に無作為に割り振られた後は、多くの方法で治療を適応させることができる。SMARTのような臨床試験デザインでは、無反応者の治療のために2回目の無作為化を導入し、特定の事前定義された治療の増強(例えば、投与量の増加または投与時期)または治療の代替を明示的に試験することで、適応を厳密に検証する。同様に、ステップケア介入75では、単一の不変の介入ではなく、治療の順序をテストするが、通常は各ステップごとに次の無作為化を行わない。モバイルヘルス介入研究で見られるジャストインタイムの適応型介入46は、反応を反復的に評価し、明らかな失敗の場合には治療パラメータを自動的にシフトする。これらはアウトカムベースの適応の例であり、事前に規定した治療反応の測定値に基づいて治療法の変更が行われる。このような変更には、通常、投与量の調整や治療の増強が含まれる。一方、preference-based adaptationは、患者のニーズや好みを聞き出し、それに合わせて治療法を変更するものである。例えば、1日のうちで患者が希望する連絡時間を継続的に聞き出し、その時間帯にのみ通知を送信するようなモバイルヘルスの介入が挙げられる。適応型介入は、短期的には治療への参加を妨げる障壁を克服することで個人の反応を最大化し、長期的には臨床的悪化を早期に発見することで、反応を強化するために介入を強化または変更することを目的としている。アダプティブ・トリートメントの背景にある科学的な動機は、個々の患者にとって有益でない治療パラメータを排除しつつ、適切なタイミングで適切な量の治療を行うことで、治療能力を最適化することにある46,77。
当初、適応策の有効性を最適に比較・検証するための PCT では、治療を段階的に変更・強化したり、マイクロ無作為化を行うことが考えられる78 。より進んだ試験では、適応策の自動応答バージョン、すなわち、工学やコンピュータサイエンスの自己適応システム(コンピュータソフトウェアなど)の概念に基づいて「自己適応型治療」と呼ばれるものが含まれる79。自己適応型治療には、客観的・受動的に収集されたデータ(ウェアラブル機器による)と、主観的・能動的に収集されたデータ(携帯電話やウェアラブル機器での生態学的瞬間評価による)の両方を含む、豊富で継続的なデータ入力が必要となる。また、個別の治療を予測するためにリアルタイムでデータを取り込む機械学習アルゴリズムも必要となる。このシナリオは、今のところモバイルヘルス治療で成功する可能性が最も高いものであるが、他の治療法でも、スマートフォンやセンサーのデータを電子カルテと統合して使用し、治療適応のための自動プロンプトにつながる可能性のある自己適応型の治療法が考えられる。
自己適応型の治療法を開発・検証することを目的とした精密臨床試験では、治療反応をモデル化するためのデータ分析アプローチが必要となる。このようなアプローチは、治療の変化は常に直線的で能動的(グループレベル)であるという(誤った)仮定を捨て、多くの場合、多次元的な動的で特質的(人に固有)なプロセスであることを受け入れるべき理由を説明することができる。例えば、治療研究においては、個人(またはidiographic)レベルでの実験的分析によるダイナミックなアプローチが必要であると主張している人もいる。80我々は、研究者が最低限、PCTにおいて直感的な治療適応を用い、実施科学から得られる文脈的適応に関する知識の増加を利用し、適応戦略(例えば、preference-based v. outcome-based)の利点をプロスペクティブにテストして、最も強固な戦略に関する基礎知識を深めることを推奨する。
最後のシナリオは、デバイスベースの治療の課題である、治療開始時に関連する可能性のあるパラメータの数の多さに対処するものである。例えば、rTMSのパルスタイミングの選択肢だけでも、高周波刺激、低周波刺激、θバースト刺激、脳波同期刺激などがあり、81 患者によっては、ある周波数の刺激に優先的に反応し、他の周波数には反応しないこともある。最適ではないパラメータで治療を行い、反応がないことを確認してからパラメータを調整するのはあまり意味がない。そこで,各パラダイムを患者ごとに短期間でテストし,急性期の反応に基づいて各患者に最適な個別パラメータを特定し,その最適パラメータでフル経過を提供するという方法がある。うつ病や認知機能低下などの症状に対するrTMSなどの機器の効果を高めるためには、N-of-1試験のようなこの試験が必要になるかもしれない。前述したように、認知機能や神経生理学的な指標(EEGなど)は急性に変化するため(例えば、1回のrTMSセッション内で)パラメータの最適化の選択の指針となり得る。
特徴3:精密な測定
行動を正確に測定することは難しく、行動の変化を正確に(すなわち、高い解像度と信頼性で)測定することはさらに難しい。反応に影響を与えたり媒介したりする要因をテストするためには、予測変数と結果変数の両方が非常に高い信頼性を持っていなければならない38。
38,82 従来の精神医学的な測定法は、比較的少ない機会に臨床で集中的に評価することで信頼性の課題に対処しようとしている。また、これらの評価は、回顧的な報告と平均化(すなわち、「過去7日間で…」)に大きく依存する傾向がある。また、これらの評価は、回顧的な報告と平均化(例:「過去7日間に…」)に大きく依存している。このような依存は、再帰性バイアスや利用可能性バイアスなどの複数の認知バイアスをもたらし、測定値を対象となる現象から数段階取り除くことになる84。頻度の低い回顧的な評価では、時間的(すなわち、日内、日間)および異なる文脈(例:家庭、地域、職場)における神経行動症状の動的な変化を評価するのに必要な時間的分解能を得ることができない。限られた機会に評価をさらに強化しても、これらの問題は解決されておらず、そうすることはありえない36。残された有望な戦略は、より少ない数の質の高い項目に焦点を当てて、測定の頻度を増やすことである85。
したがって、PCTでは、正確で、繰り返し、リアルタイムで、文脈的に妥当な評価を行う。生態学的瞬間評価86(EMA)は、1日または1週間に複数回、現在の瞬間の経験を尋ねる外来データ収集法で、思考、感情、行動を頻繁にリアルタイムでサンプリングすることができる。この方法は、「クリニックでの1回限りの測定」に比べて87 多くの利点がある。例えば、アウトカム研究のための神経行動症状のより安定した推定値の生成、88 理論的に関連した構成要素間の動的変化の評価、89 神経行動障害患者の想起バイアスの低減、90,91 個人内の因果関係のモデル化などが挙げられる92 より具体的には、EMAは研究者に、実世界の環境でリアルタイムに治療反応をモニターする能力を与える。EMAは、症状や行動の瞬間的な変化を正確に測定することができるため、治療目的の強化のために急性の変化を測定したり、治療の経過を集中的にモニタリングして、進行中のEMAデータに基づいて適応や治療の最適化を行うことも可能である。
さらに、臨床試験にEMAを使用することで、変数間の関連性を正確に推定することができる。例えば、ストレス要因を経験した後に憂鬱な気分に移行する傾向を阻止するための介入を計画することができる。その場合、ある変数のレベルだけでなく、2つ以上の変数(例えば、抑うつ気分とストレス因子)の間の関連性にも関心がある。適切にデザインされたEMA研究では、両方の変数とその時間的な整合性を正確に測定することができる。したがって、これらの関連性に影響を与えるようにデザインされた介入策を生成・試験し、関連性が時間とともに変化するかどうか、そしてその変化が治療結果を予測するかどうかを調べることができる93。
科学の歴史は、測定の改善が新しい発見をもたらすことを示している。EMAの使用は、標準的な測定に比べて概念的に明らかに優れている96。例えば、clinicaltrials.gov(2019年7月20日実施)で、登録内容のどこかに「ecological momentary assessment」という用語が含まれている完了済みの第2,3,4相臨床試験を検索したところ、43件の研究しか見つからなかったのに対し、EMAの代わりに「depression」で同じ検索をしたところ7820件の研究が見つかった。これらの研究を検討した結果、喫煙(n=10)と気分障害(n=9)に焦点を当てた研究がわずかにあり、不安とストレス(n=6)摂食障害と肥満(n=3)HIV(n=4)に焦点を当てた研究はほとんどなかった。膨大な数の神経行動学的疾患がまったく表現されなかった。これは驚くべきことではないかもしれない。なぜなら、EMAは伝統的に、はっきりとした利益のない、高価で負担の大きい測定技術とみなされてきたからである。しかし、スマートフォンが爆発的に普及し、低価格のEMAの選択肢が多数あることから、こうした障壁は低下している。99我々は、転換点に達し、EMAにシフトする時期が来ていると主張する。
精密医療のための測定・分析方法の進歩
PCTの転換点に向けてこの分野を後押ししているもう一つの進歩は、次世代の個別化された評価と治療につながる、測定と統計分析の新しい技術である。
新たな測定方法
デジタルフェノタイピング
デジタルフェノタイピングとは、加速度計や全地球測位システムのデータ、キーボードの使用状況など、マルチモーダルなスマートフォンの連続センサーデータを受動的に収集することである。センサーデータは受動的かつ継続的に収集され、多くの場合、患者が既に所有している機器から収集されるため、このアプローチは、患者の負担を最小限に抑えながら、長期的かつ現実的なモニタリングを行うことが可能であり、再発や再燃の早期警告サインとなりうる行動の動的かつ微妙な変化を捉えることができる。
デジタルフェノタイピングはまだ初期段階にあり、拡張可能なパッシブセンサーデータの収集、処理、分析をサポートし、このアプローチを神経行動障害の臨床評価および治療に統合するためには、さらなる研究が必要である。例えば、デジタルフェノタイピングを用いて、うつ病の症状が悪化する前兆となる行動の変化を検出し、これらの変化が検出されたときに、臨床症状のさらなる悪化を防ぐために、それぞれに合わせた介入コンテンツを配信するようにPCTを設計することができる。うつ病の症状は、個人間では異質であるが、個人内ではステレオタイプになる傾向がある。そのため、患者は、積極的に落ち込んでいるベースライン時に評価され、その後、寛解、維持または再発防止の段階まで追跡される可能性がある。最終的に、デジタルフェノタイピングは、治療をより充実したものにするための個人のシグネチャーを提供し、反応に応じた治療の適応を助け、精密測定のためのEMAを補完する(代替することはできないだろうが)。今のところ、モバイルヘルス技術を使用しているPCTは、デジタルフェノタイピングデータを収集し、これらのデータを使用して、病気の経過と反応のデジタルマーカーを作成し、検証することも検討すべきである。患者の積極的な参加にあまり依存していないPCTで、モバイル技術による表現型データ収集を採用することは、より一貫性、頻度、精度の向上につながり、標準化に適している可能性があり、精密医療の発展につながる可能性がある103。
神経画像
ここでは、脳内の神経活動を高い空間分解能で間接的に測定するfMRIに焦点を当てている。タスクベースfMRIは、外部からのタスクに反応して誘発される脳活動を測定するもので、安静時fMRIは、静かに寝ている間の異なる脳領域間の脳活動の相関を測定するものである。
近年、ニューロイメージングのデータ収集・解析技術が進歩し、脳機能を高精度に測定できるようになったことで、ニューロイメージング研究を精密医療に取り入れることが可能になった。個々の患者から数時間の画像データを収集するプレシジョン・ブレイン・マッピングでは、大脳皮質全体の機能的ネットワークの構成や、扁桃体などの皮質下の構造に個人差があることが明らかになっている108。このような長時間のスキャンを用いた研究では、タスクベースの脳活動と安静時の脳活動の両方を高い信頼性と精度で得ることができるため、研究者は集団ではなく個人に焦点を当てることができる。また、この方法では、介入に応じて一時的に生じる脳機能の変化を確実かつ信頼性高く測定することができる109。
なぜなら、人間の脳のように広い探索空間において、治療目標を事後的に導き出すことは、現在のデータセットに過度に適合することになり、臨床への一般化を制限するからである。うつ病の神経画像に基づく具体的な治療目標としては、報酬に対する誘発活動(タスクベースfMRI110)デフォルトモードネットワークの結合性(安静時fMRI111)あるいは脳全体の活性化パターンを利用した複雑な多変量解析アルゴリズムなどが考えられる26。機能的MRIは、安静時の接続性や複数の脳ネットワークの相互接続性など、多くのターゲットを一度に測定することができる。ある例では、うつ病の患者に対して、報酬ネットワークとデフォルトネットワーク回路の活動パターンを修正するために、特定の認知トレーニングプログラムのパッケージを設計することができる。患者は、PCTの原則である「治療対象の強化」と同様に、スキャナ内での急性の治療に対する脳の反応に基づいて治療対象として選択される。治療は、治療に対する患者の神経の反応に基づいて定期的に更新される可能性があり、これはPCTの適応型治療の原則と一致する。図2はこれらのシナリオを示している。もう一つの可能性は、脳活動のリアルタイム測定をニューロフィードバックのソースとして使用することにより、fMRIを治療そのものとして使用することである。患者は、自分自身の脳活動を直接調整するように訓練され、その訓練技術は患者の個人的な病理のバージョンに適合させることができるのである113。
TMS-EEG
TMS-EEG(Concurrent Transcranial Magnetic Stimulation and Electroencephalography)60は、もう1つの精密技術である。シングルパルスまたはペアパルスのTMSとEEGを組み合わせることで、脳回路の機能と整合性を測定し、神経可塑性を調べることができる。この手法では、TMSを治療としてではなく、プローブとして使用する。脳波を用いて、運動野や背外側前頭前野などの異なる脳領域を標的とした単一のTMSパルスによって誘発される皮質の興奮性を測定することができる。また、あるTMSパルス(個人の運動閾値または閾値以下のパルスに相当)に対する脳の反応が、様々なパルス間隔を持つ次のTMSパルスに対する反応にどのような影響を与えるか(例えば、抑制するか)を評価することもできる114。114,116 したがって、TMS-EEG は PCT の枠組みによく適合している。TMS-EEG は、治療に対する脳の急性反応を特定するために用いることができ117 、治療パラメータや適応を迅速に最適化することができる可能性がある。
例えば、認知機能を改善するための治療法で、神経可塑性を改善するメカニズムがあると考えられている場合を考えてみよう(θバースト刺激rTMSなどのTMS自体も含む)。介入の急性発作の前後にTMS-EEGを使用すると、提案されたメカニズムのターゲットの関与を客観的にテストし、神経可塑性に対する介入の効果を早期に客観的に測定し、エンドポイントの反応を予測することができる。この早期反応は、介入の適応、パラメータの変更、モダリティの追加、あるいは全く別の介入を必要とする非反応者の特定に用いることができる。
高度な解析技術
現在利用可能な分析技術は、以下に適応されていれば、我々が提案する革新をすでに扱うことができる:全体的にデータ量が多いにもかかわらず、有意な欠落データを伴う集中的な縦断的データ(すなわち、測定を何度も繰り返すが、いくつかの測定を一緒に行うのは少数である);参加者内および参加者間で値が変化する複数の予測因子;予想される効果を前もって特定し、すでに収集されたデータが予想される効果を支持するか反論するかを決定する能力。このような手法では、膨大な量のデータと多数のパラメータを扱うため、ベイズ推定量の使用が鍵となると考えられる118。機械学習アプローチや他のベイズモデリングアプローチをこのフレームワークに追加することで、特定の時期ではなく試験中に自動的にモデリングを行うことができる。
高度な機械学習アルゴリズムは、デジタルフェノタイピングやその他のデータリッチな測定技術とともに開発されるべきである。機械学習モデルは、ルールベースのモデルとは対照的に、例から学習し、以前に見たことのないデータに対して予測を行うことができる119,120。機械学習モデルは、放射線学や病理学における画像処理から、臨床結果の予測(敗血症の早期発見、再入院など)まで、さまざまな臨床領域で利用されている。最近のスコーピングレビューによると、うつ病、アルツハイマー病、認知機能の低下、統合失調症、自殺などのメンタルヘルス疾患の特徴を明らかにするために、300以上の論文が機械学習アプローチを用いていることが判明した121。これらの研究は、画像データ、調査、ウェアラブルや携帯電話のセンサー、ソーシャルメディア(Twitter、Facebook)のデータなど、さまざまなデータソースを用いて行われている。しかし、これらの研究はほとんどが探索的なものであり、その臨床的有用性についてはさらなる検証が必要である。デジタルフェノタイピングや上記のような新しい測定法(イメージングやTMS-EEG)を用いた精密臨床試験では、機械学習アルゴリズムを用いて収集されたデータを探索し、介入に対する参加者の脳や行動の反応について、微妙な時間的な洞察を得ることができる。現在、機械学習アプローチは、臨床試験から収集されたデータの二次解析に使用されている。例えば、ウェアラブルや携帯電話からのデータは、患者の活動に関する大量の時間的データを提供することができる。このような臨床試験の時間的データは、対応する構造化されたアウトカムデータが臨床試験の一部として収集されているため、ロバストな予測分析が可能になるという大きな利点がある122。
ベイズ推定に関して、PCTのコンセプトは、より多くのデータを患者から収集すべきであるというだけでなく、特定のデータの重要性は患者によって異なることを示唆している。必要なのは、すべての人に対する1つまたは2つの重要な予測因子に関する知識(従来の方法)ではなく、各患者にとっての最良の予測因子に関する知識であり、この組み合わせは人によって異なる可能性があることを認めている。グループ内の各個人に対する最良の予測因子を決定することは、複雑な命題である。ベイズ推定量は、このような複雑な問題に対して特に効率的であり、新しいベイズ推定量のセットがこの目的のために開発された。80,123これらのアルゴリズムは、正確で予測的な行動モデルに素早く収束し、グループ全体に期待すべきことではなく、個人に期待できることを教えてくれる。さらに、これらの新しいフレームワークは、個人にデータが蓄積されると自動的に改善される推定プロセスを使用しているため、新しい情報から学ぶことができる。これらの手法はベイジアンであるため、個人に関する最良の推測(例えば「事前」)から使い始めることができる。事前は、グループに関する知識、理論、または個人から既に得られているデータに基づいているかもしれない。そして、基本的なタスクは、問題の人物が我々の最良の推測とどのように異なるかを評価することである。このプロセスは「差分推論」と呼ばれ、能動的な学習プロセスによって収集された正確なデータが最適化されると、迅速に実行することができる124。
上述した統計的、機械学習的、ベイズ的なアプローチの利点の一つは、結果を直接個人に適用できることである。つまり、ある変数が他の変数を予測するという発言は、通常、グループレベルのデザインに基づいて行われるため、実際に言っているのは、これらの変数がグループメンバー間で共働するということである。一方、イディオグラフィック・アプローチでは、一人の人間の中で時間を超えて変数が共働するかどうかを検証する。33,125 研究者や研究意欲の高い臨床医は、機械学習やベイズ法が「やってくる」のを待つ必要はないことを認識すべきである。つまり、統計的な検定やモデルをグループだけでなく、個人にも適用できるように考えるべきなのである。これらのアプローチはますます利用可能になり、現在の使用に耐えうるものとなっている49。
精密臨床試験のための研究アジェンダ
PCTとNIH、FDA及びスポンサーのイニシアティブとの整合性
PCTのフレームワークでは、精密医療を推進するための臨床試験には、3つの特徴(治療目標を定めたエンリッチメント、適応型治療、精密測定)のすべてが必要であるとしている。特に、測定の精度を高めずに、治療目標を定めたエンリッチメントやテーラーリングを行っても、治療に関連するサブグループや効果サイズを高める治療適応を特定することはできないであろう。これらの機能を導入することは、多くの臨床試験担当者にとって、従来のアプローチから完全に離れることになるかもしれない。このフレームワークは、NIH内のいくつかの大規模なイニシアチブ、特に主に神経行動学的条件を扱う研究機関(例えば、NIMH、National Institute on Drug Abuse、National Institute on Alcohol Abuse and Alcoholism、National Institute on Aging、National Center for Complementary and Integrative Health、National Center for Medical Rehabilitation Research)と一致していることに留意する必要がある。64 同様に、PCTのフレームワークはNIHのPrecision Medicine Initiativeにも対応しているが、先に述べたように、このフレームワークは治療中の変数に焦点を当てることを要求しており、これはNIHが現在、ベースライン、主に遺伝的変数に焦点を当てていることとは大きく異なるものである。
神経行動学的疾患のための医薬品およびデバイスの臨床試験は、主に企業から実施され、その治療法の知的財産権のライフサイクルと密接に結びついている。今日まで、通常のビジネス、すなわち、FDAが定義した条件(大うつ病など)の範囲内で小規模な試験を行い、その後大規模な試験を行うことから、グループベースの有意な(そして通常は小規模な)治療効果を実証するという目標に向けて移行することにはほとんど関心がなかった。127 精密な臨床試験を行うことで、この失敗率を改善することができる。最近の例では、FDAが承認した初めての非モノアミン系大うつ病治療薬であるエスケタミンが承認された。この承認は、PCTの特徴を備えた1つの重要な試験、すなわち、個別に最適化された投与量で反応した患者を対象とした無作為化離脱試験から得られたものである128。大きな治療効果サイズを示したこの試験は、3つの従来型RCTとともに実施されたが、そのうち2つは主要評価項目に対する有効性を示すことができなかった。2つ目の兆候は、新しい治療法が承認されているにもかかわらず、まだ十分に使用されていないことである。これはおそらく、費用がかかるために(例えば、保険の適用範囲が制限されるなどして)配給制になっていることが一因である。高価な治療法の使用を制限するには、安価な治療法に何度も失敗したというような恣意的な要因ではなく、治療対象を充実させる(効果がある可能性が高い人にのみ治療を行う)ことで、より効果的に行うことができる。第三に、産業界のリーダーたちは、PCTの枠組みに沿った実験的技術を求めており、NIHの実験的治療法のアジェンダを刺激している129。FDAは、会議やガイダンス文書の中で、PCTフレームワークの多くの特徴を説明している。その中には、患者を充実させるためのリードインフェーズ、治療に関連する患者集団を定義し、結果を予測するための65の機械学習法130,RCTにおいてより正確な評価(「より高い測定感度」)を行うためのデジタル技術などが含まれている131。
また、慈善団体は、科学的発見を効果的な神経行動学的治療法に迅速に転換し、神経行動学的障害の罹患率を低下させることを使命としているため、PCTの方法論に生来の関心を持っていることに留意したい。要約すると、PCTの枠組みは、神経行動学的臨床試験の資金提供者や規制者にとって非常に興味深いものであり、臨床試験担当者はこの一致を利用して、PCTの手法を研究に導入することができる。
PCTの実施
治験担当者は、PCTの3つの特徴をすぐに利用することができる。すなわち、無作為化前の急性期とその急性期における綿密なデータ収集、段階的な適応による治療の最適化、既存の測定法のEMA版を用いた測定精度の向上、測定精度が向上したことを確認するための妥当性と信頼性のテストである。これらの技術を広く使用することで、PCT法の応用が進むと同時に、特定の疾患や患者集団のために、より新しく、より強固で、より実現可能な方法を開発する条件が整います。とはいえ、より正確なアウトカム評価のためにかなりの検証が行われるまでは、「寛解」のようなわかりやすいヒューリスティックスを捨てることは提唱しない。今のところ、従来の方法はPCTの特徴と一緒に実施されるべきである。
PCTの方法と原則の検証
PCTの枠組みは、公理的なものとしてではなく、厳密な調査と検証を必要とする広く開かれたフロンティアとして提案されている。最終的に、PCT 手法の大規模な採用と受容には、治療メカニズム、治療効果、個人レベルの 変動性に関する我々の理解を向上させながら、個人レベルでの治療反応を促進することを証明する 必要がある。PCTフレームワークの導入を促進するためには、一連の戦略とツールの検証(すなわち、治療に基づくエンリッチメント、自己適応療法、精密測定の信頼性と適切な感度・特異性の決定)が重要だ。神経生理学的および行動学的レベルで個人に関する高品質の情報を提供することができるアプローチと、それに関連するデータ分析技術は、開発とテストの両方が必要である132。この成果が達成されれば、精密臨床試験担当者は、探索すべき広大なフロンティアだけではなく、利用できるツールボックスを手に入れることができる。この目標を達成するために、各PCTでは、治療の効果の大きさだけでなく、エンリッチメントやパラメータ最適化戦略の妥当性も検証する必要がある。
PCTのフレームワークの原則も検証する必要がある。フレームワークの多くは、急性期の変化が長期的な変化を予測するという仮説に依存しているが、これはすべての治療法に適用できるとは限らない。例えば、対人関係療法では、初期の利益が長期的な治療効果を予測していないが、このシナリオは、変化の測定が不正確であることによる人工物かもしれない133。
PCTを臨床現場に広く展開するためには、臨床的な革新以上の進歩が必要である。PCTのアプローチを最終的に検証するには、その大規模な使用と、規制当局やスポンサーに受け入れられるかどうかにかかっている。PCTの中には、懐疑的な見方を克服してこれらの戦略を十分に検証するために、大規模なサンプルサイズを必要とするものもある。大規模なサンプルサイズの必要性に対する解決策として、分散型臨床試験などが提案されている134。このような研究では、研究の実施場所が参加者から離れているため、ここで提唱されているのと同じデータ収集技術であるEMAやデジタルフェノタイピングが、遠隔地でのアウトカム評価の解決策として考えられている。つまり、PCTと分散型臨床試験には共通の手法があり、お互いの進化と実施に相乗効果をもたらす可能性がある。
PCTの指針としてのプラグマティズムとフィージビリティー
現在、精密研究に必要なデータの量と質は、何時間ものfMRIセッションから、いくつかの動的分析モデルに必要となるかもしれない一人の人間における数百回のEMA測定まで、集中的な測定によってのみ得ることができる135。EMAやデジタルフェノタイピングを使用する際に作成されるデータファイルを管理するというパラダイムでさえ、圧倒されるかもしれない。これらの測定負担は、RCTにおいてデータ収集を可能な限り無駄なく低負担で行うという「大規模単純試験」の理念とは対照的である。
しかし、現在は困難に思える測定方法も、将来的には実用的なものになると考えられる理由がある。なぜなら、PCTは、患者に関する結論を出すために最も有用なデータを強調するからである。PCTでは、最初は膨大な量のデータを扱う必要があるが、最も有益なデータを抽出し、その後のプロジェクトでデータと分析に優先順位をつけるのに役立つはずである。言い換えれば、最初に多くのデータを集めれば集めるほど、将来的に必要なデータの量は少なくて済むということだ。
この戦略は、1つの治療法の開発ライフサイクルの中で容易に発展させることができる。例えば、うつ病の新薬が開発されたとする。小規模な患者を対象とした予備的な試験(フェーズ2aに相当)では、TMS-EEGなど、薬剤のメカニズムに関連するEMAやその他の技術を用いた測定に投資する。集中的な測定は、急性期の非盲検段階で行い、いつ、どのようにして治療目的の強化を行うのが最も効果的なのかを見極め、次に無作為化段階で、各患者の経過がどのように変化するのか、いつ、どのようにして治療を適応させるのか(投与量の変更、増強、必要に応じたカウンセリングなど)を見極める。続く試験(第2b相)では、これらの戦略を検証し、治療効果の大きさ(および患者の満足度などの他の重要な結果)を向上させる価値があることを再現性をもって確認する。次に、大規模な第3相試験では、より簡潔なデータ収集を行い、各患者の評価は、効果の可能性や治療法の適応を判断するために必要な場合にのみ行い、規制当局に受け入れられるエビデンスを作成する。最後に、治療法が臨床現場に届く頃には、これらの目標設定、適応、測定の戦略は、患者と臨床医の両方にとって使いやすいものとなり、データ管理やアルゴリズムの多くはバックグラウンドで行われるようになるであろう。
このようにプラグマティズムとフィージビリティが求められていることから、使いやすさを向上させるための技術的な変化は、コンセプトや手法の進歩と同様に重要であると言える。その一例として、過去10年間にスマートフォンが広く普及したことで、EMAを導入する際の障壁が低くなり、デジタルフェノタイピングへの道が開かれた。もう一つの新しい例は、患者が報告したアウトカムを提供・収集するための電子カルテ一体型インフラの開発であり、これにより測定のための新しい道が開かれた136,137。NIHのPROMIS(Patient-Reported Outcomes Measurement Information System)インフラを利用することで、これらの患者報告型アウトカムは、ほとんどのインターネット対応機器の患者ポータルを介して実施することができ、患者の回答は電子カルテに組み込まれ、日常的な臨床使用が可能となる138。
結論
PCTの最も強力な論拠は、究極的には患者を中心としたものであり、今PCTを採用すれば、臨床医学のあり方を変えることができる。楽観的な見方をすれば、1世代後にはPCTの方法論的ツールは十分に検証され、合理化され、臨床現場での実施が可能になっているであろう。臨床家は、患者を恩恵を受ける可能性の高い治療法に迅速に割り当て、適応アルゴリズムを用いて治療パラメータを個人に合わせて最適化することができるであろう。
このシナリオでは、患者は、しばしば最適でない、あるいは効果のない治療につながる、長い試行錯誤のプロセスに着手する必要がなくなる。むしろ、最初の治療は検眼のようなもので、「AとBのどちらが良いか」を考えながら最適な治療法を選択することになる。そして、治療の過程では、患者のニーズと結果を評価し、急性期および長期的に良好な結果が得られるように自動的に調整する、個別のオーダーメイド治療が行われる。最後に、患者はより幅広い治療の選択肢から恩恵を受けることになる。なぜなら、集団全体では効果が小さい治療法でも、特定のサブグループでは大きな効果を発揮することが発見される可能性があり、特に個々の患者に最適化された場合はそうなるからである。
もし、このシナリオが正しく–神経行動学的治療の個々のテーラーリングが可能であれば、これらの障害の高い負担と現在の治療の最適でない結果を考えると、PCTによる公衆衛生上の利益は莫大なものになるであろう。RCTは、神経行動障害の治療法として見直されるべき時期に来ており、PCTの採用は、我々と患者を精密医療へと導くことになるであろう。
謝辞
本論文で報告された研究は、米国国立衛生研究所(NIH)のNCATS(National Center for Advancing Translational Sciences)からワシントン大学臨床・トランスレーショナル科学研究所(UL1TR002345)に助成されたものである。内容は著者個人の責任であり,必ずしもNIHの公式見解を示すものではない。E. Lenze博士は,Taylor Family Institute for Innovative Psychiatric ResearchおよびCenter for Brain Research in Mood Disorders(ワシントン大学)から追加資金を得た。資金提供者は,本稿の作成,レビュー,承認に一切関与していない。