Contents
Potential Impact of the Multi-Target Drug Approach in the Treatment of Some Complex Diseases
www.ncbi.nlm.nih.gov/pmc/articles/PMC7440888/
オンラインで公開2020年8月11日
Xolani H Makhoba,1 Claudio Viegas Jr,2 Rebamang A Mosa,1 Flávia P D Viegas,2 and Ofentse J Pooe3
要旨
これまで人類が直面してきた様々な病気の負担を管理・解消するための努力は評価されなければならない。しかし、いわゆる難病の世界的傾向の高まりは、製薬業界をはじめとする創薬プラットフォームを圧迫し続けている。
過去には、1剤1ターゲットに関心が集まり、複数のターゲットを持つ医薬品は望ましくない選択肢とみなされていた。単一標的薬の成功にもかかわらず、病因が一連の生化学的事象と複数の生体受容体の同時作動に依存する複雑な疾患に対しては、これらの薬の効果が限られていることは疑いの余地がない。そのため、複雑な疾患に対しても有効な薬剤を開発するために、さまざまなアプローチが提案されていた。
かつては、植物化合物をスクリーニングして薬を作ることに焦点が当てられてたが、今日では、併用療法やマルチターゲット薬が話題になっている。最近では、マルチターゲット薬は、最も困難な疾患と戦うための有望な手段として注目されており、新たな研究の重点分野となっている。
本レビューでは、多因子疾患の代表的なものとして、マラリア、結核、糖尿病、神経変性疾患に焦点を当て、マルチターゲット薬のアプローチが様々な複合疾患に与える影響について議論する。また、第四次産業革命を視野に入れた創薬の問題点を解決するための代替案についても議論する。
キーワード:マルチターゲット薬、マラリア、糖尿病、結核と創薬
序論
いわゆる難病に起因する世界的な罹患率・死亡率の増加に対応するために、創薬・設計は決して静的なものではなく、常に動的なものとなっている1,2。従来、治療薬の創製は、特定の病態に支配的な存在と考えられる単一の生物学的実体を標的とした高選択性化学物質の設計に基づいて行われていた1,2 。しかし、単一の分子標的を対象とした高選択的・特異的な治療薬は、特に複雑な疾患に対しては有効性に乏しいことが証明されている。また、高度に選択的な治療薬は、薬剤耐性の発生率の増加と関連している。
例えば、アルテミシニンやクロロキンなどの薬剤は、伝統的にマラリアの治療に使用されていた。一方、1型糖尿病の治療にはインスリンが最も利用されているが、2型糖尿病の管理にはいくつかの経口血糖降下剤が利用されている。がん治療薬としては、カルボプラチン、アドリアマイシン、フルオロウラシルなどが挙げられる。しかし,病態が一連の生化学的事象と複数の生体受容体の作用に依存している多因子疾患に対するシングルターゲット薬の有効性は限られているため,薬物設計の戦略を見直さなければならなかった。このような背景から、ここ数年の間に、医薬品化学は、医薬品候補のデザインとプロスペクションにおいて、より敏捷性、安全性、そしてより効率的な方向性に到達することができる新しいツールや代替品を模索していた。
単剤での治療では効果が得られないものもあることから、臨床現場でのより良い結果を求めて、新しい治療戦略としてポリファーマコロジーの採用が奨励されていた。ポリファーマコロジーとは、複数の分子標的または複数の生化学的経路に作用する医薬品の設計または使用と定義することができる。このマルチターゲットアプローチには様々な形態があり、薬剤の関連付け、薬剤の組み合わせ、または複数のリガンドを持つ単一の薬剤の組み合わせなどが考えられるが、これらはすべて複数のターゲットを対象としている。しかし、併用療法の非効率性、薬物と薬物の相互作用による悪影響、薬物動態、毒性、溶解性、バイオアベイラビリティー、コストなどが異なることから、新たな創薬戦略の登場が期待されている。最も最近のアプローチは、現在、2つ以上の分子標的を同時に認識する単一の薬剤を検討している。この最新の戦略では、複数の生物受容体による分子認識を可能にする異なる構造のサブユニットを単一の足場に組み合わせ、多因子疾患の病態生理に関与する生化学的ネットワークに相互に接続された複数の標的に同時に作用させることを提唱している5-7。
本レビューでは、シングルマルチターゲット創薬アプローチと創薬の潜在的な影響について議論する。主にマラリア、結核、糖尿病、神経変性疾患などの複合疾患を対象とする。また、第四次産業革命を視野に入れて、現状の問題点を解決するための代替案についても議論する。本レビューの情報は、google scholar、PubMedなどの各種データベースから引用している。
創薬の進化
科学の先駆者たちが現在話題の治療薬の原料として薬用植物を使用した最初の世紀から何十年もの間(図1),治療薬は伝染性疾患や非伝染性疾患の治療に重要な役割を果たしていた(16,17).16,17 1820 年にマラリアの治療薬として初めて化学的に精製されたキニーネがシンチョナ樹皮から単離されて以来、他にもいくつかの天然化合物や合成化合物が開発されていた(図 1)。創薬・合成は、単一の生物学的実体を標的とする高度に選択性の高い化学的実体の設計に基づいて行われてきた。しかし、一般的に単剤療法と呼ばれる単一標的薬は、その使用を制限するいくつかの課題に直面している。これらには、望ましくない副作用や薬剤耐性の発生率の増加、および病原体が一連の生化学的事象と複数の生物受容体が同時に作用する複雑な疾患に対する有効性の制限が含まれる。
図1 1820~1920年代以降の抗マラリア薬の発見とその作用機序、抵抗性
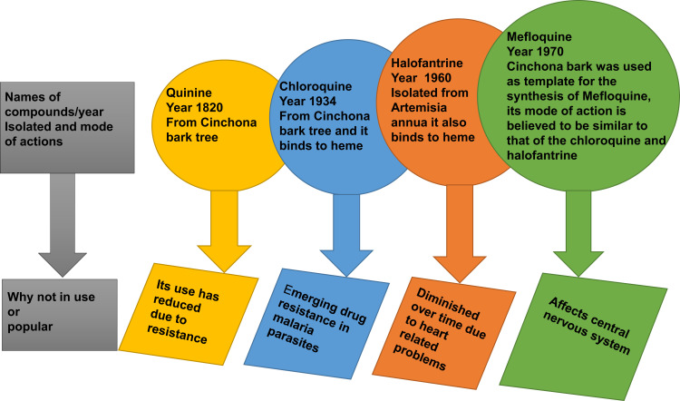
これらの薬剤の多くは、抵抗性や副作用の証拠が増えたことにより、その使用量や効果が著しく低下していたことが描かれている。
このような薬剤耐性の発達などによるいわゆる難病の重荷を克服するために、創薬・設計プラットフォームは、代替アプローチの見直しと再考を迫られてた。その結果、新たな治療戦略としてポリファーマコロジーが導入されることになった。18 単剤治療からの併用療法の導入は、さまざまな慢性複合疾患を根絶するための有望なアプローチであると考えられてた。現在では、複数の分子標的に作用する単剤への関心が高まっている。この最新の戦略では、複数の生体受容体による分子認識を可能にする異なる構造のサブユニットを単一の足場に組み合わせて使用することが提唱されている5-7。
マラリアにおけるマルチターゲット薬剤
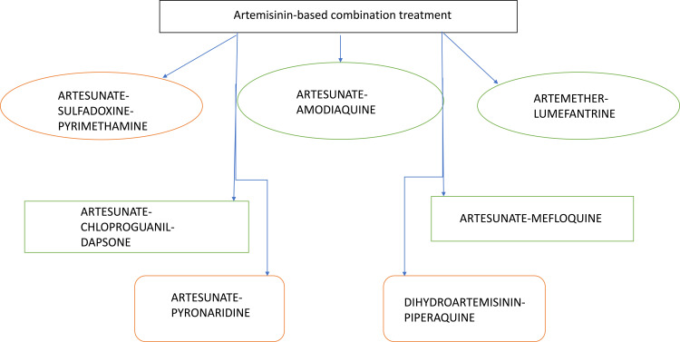
マラリアの発生率は2010年から 2017年の間に世界的に減少し、危険にさらされている人口1000人当たりの症例数は72件から59件になった。これは期間中の18%の減少を示しているが、リスクのある人口1000人当たりの症例数は過去3年間59件で推移している。2017年のマラリア症例の大半はWHOアフリカ地域(2億人または92%)で、次いでWHO東南アジア地域が5%、WHO東地中海地域が2%となっている19,20 マラリア治療における多剤耐性の広がりと新しい抗マラリア化合物の不在により、毎年1,100万人が死亡するマラリアに対する新しい薬剤レジームの緊急性が求められている19-22 マラリア寄生虫に対する代替的な新しい治療アプローチとして、薬剤の組み合わせへの関心が高まっている。アジスロマイシンはマクロライド系抗生物質であり、小児における安全性の高さから抗マラリア薬として特に魅力的である。キニーネとの併用試験では、アジスロマイシンは非合併性のファルシパルム・マラリアの治癒に高い有効性を示しており、最近の予防試験では、アジスロマイシンがウイルス性マラリア原虫の予防にも高い有効性を示すことが示唆されている。併用療法は優れた臨床効果を示し、抗マラリア薬の耐性化を遅らせることから、P. falciparum malariaの管理における最良のアプローチとして広く受け入れられている。現在、P. falciparum malariaの治療には、アルテミシニンをベースとした併用療法(ACT)が推奨されている。即効性のあるアルテミシニン系化合物は、異なるクラスの薬剤と組み合わせて使用される。併用薬としては、ルメファントリン、メフロキン、アモジアキン、スルファドキシン/ピリメタミン、ピペラキン、クロルプログアニル/ダプソンなどがある(図2)。アルテミシニン誘導体としては、ジヒドロアルテミシニン、アルテサン酸塩、アルテメザーなどが挙げられる。共剤とは、2つの異なる薬剤を1つの錠剤に配合したもので、両方の薬剤を確実に使用するために重要なものである。アルテミシニンをベースとした併用療法の副作用プロファイルは、パートナー薬剤によって決定される。しかし、ほとんどのマラリア常在国では、アルテミシニンを用いた併用療法を必要とする患者のうち、実際にアルテミシニンを用いた併用療法を受けているのは少数派にすぎない23 。ATCに加えて、マラリアでは数千人の人々に影響を与え続けている地域では、トリプルアルチメシン併用療法が報告されている。今回のレビューでは、ATCに焦点を当て、その中でも多くの併用療法が報告されている。
図2 P. falciparumに対する厳選されたアルテミシニン系配合治療薬
ポリアミンの構造と性質については、これまでに広く研究が行われてきた。ポリアミンは、その多環性の性質から、DNA や他のタンパク質などの様々な生体分子と相互作用し、マラリアや癌の治療薬として理想的なターゲットとなっている。一方、ポリアミンは、熱ショックタンパク質の合成に関与していると考えられており、分子シャペロンとも呼ばれており、新たに合成されたタンパク質が誤って折り畳まれて細胞死に至るのを防ぐ役割を担っている。リガンドと分子標的の構造活性関係を理解することは、創薬基盤を構築する上で極めて重要である。このように、ポリアミンと分子シャペロンの両方を標的とすることで、マラリア寄生虫やがんの治療に応用できる可能性があると考えている。
癌治療
Globcan(2012)の報告によると、がんはエイズ、結核、糖尿病、マラリアを合わせたものよりも多くの人を殺している。例えば、米国のみでは、がんは2018年に100万人の命を奪っており、アフリカが2番目に高いと報告されている34)がん治療のための最も人気のある薬には、カルボプラチン、アドリアマイシン、フルオロウラシルなどがある。他の複雑な疾患と同様に、単剤療法から併用療法を導入することは、がん治療において前向きなアプローチであるように思われた。がんの治療に併用化学療法を用いるようになったのは、1960年代に、抗生物質を組み合わせて抵抗性のリスクを減らすことで結核を治療するというアプローチが、がんの治療にも有効ではないかと科学者たちが考えたことがきっかけである35 。それ以来、他の多くのがんに対しても併用化学療法が採用されるようになった。
1970年代には、肺がんに対しては単剤よりも併用化学療法の方が効果が高く、「逐次化学療法」(化学療法薬を一度に使用するのではなく、一度に一種類ずつ順番に使用する)よりも効果が高いことがわかっていた。化学療法にチェックポイント阻害療法と呼ばれる新しいタイプの免疫療法が加わったのは、ここ10年ほどのことである。この治療法は、免疫系の重要な調節因子を標的としており、刺激を受けると免疫学的刺激に対する免疫反応を低下させることができる36 。チェックポイント阻害剤は、がん細胞がT細胞にシグナルを送るために使用する受容体を遮断することによって作用する。状況によっては、化学療法薬を追加することで、免疫療法薬がより効果的になるように思われる。現時点では、併用化学療法がより適切な場合もあるし、がんによっては単剤化学療法の方が良い場合もある37 。以前は、選択性の欠如が抗がん剤の創薬の大きな障害と考えられていたが、最近では、マルチターゲットアプローチ戦略に基づいて、より強力で効果的な抗がん剤の設計と発見が行われるようになってきた38。
マルチターゲット特性を有する抗がん剤の例としては、ヒト上皮成長因子受容体2(HER2)および上皮成長因子受容体(EGFR)チロシンキナーゼのATP競合性を有する可逆的な阻害剤であるラパチニブや、新規の経口PI3K-δ, γ阻害剤であるデュベリシブなどが挙げられる39。デュベリシブは、進行性血液悪性腫瘍に対して非常に有望な臨床効果を示している40 。最近のがん治療の新しい戦略として、マルチターゲット抗がん剤としてのハイブリッド化合物の設計と合成がある。最近の新しいがん治療戦略として、マルチターゲット抗がん剤としてのハイブリッド化合物の設計・合成が行われている。
マイコバクテリウム結核
結核は空気感染症であり 2017年だけでも約130万人が死亡している42,43。肺は結核菌による主な攻撃ラインであり、症状は激しい咳、発熱、胸痛として現れることが多い。WHOによると、結核だけで1分間に4人の死亡者を出しており、単一感染による世界的な死因の第2位と認識されている43,44 。2017年に報告された結核患者は約1,000万人で、半数以上(580万人)が男性です43 。現在の結核に対する第一選択薬による治療は、複雑化した結核症例に対する効率性、薬物関連の副作用、薬物療法の長期化(6~12ヶ月)など、さまざまな限界がある45。
さらに、結核の治療は、抗生物質耐性、特に多剤耐性結核(MDR-TB)と広範な薬剤耐性結核(XDR-TB)の開発と蔓延によって複雑化している42 。結核感染症の治療に使用される第一選択薬には、イソニアジドとリファンピシンがあり、通常、最初の2ヶ月間はピラジンアミドとエタンブトールが追加される46 。48 ほとんどの結核感染は再活性化の可能性を持つ潜伏感染であり、世界人口の約3分の1がM.結核に潜伏感染している49 。
結核治療における天然物のマルチターゲット化の可能性
薬用植物は伝統的に結核などの肺疾患の治療に用いられてきたが、その多くはまだ十分に解明されていない50 。さらに、ほとんどの植物種や化合物は、結核の必須タンパク質や結核の潜伏に寄与するタンパク質バイオマーカーに対して明示的に試験されていない51 。薬用植物は多種多様な化学構造を有しており、M.Tuberculosisに特異的に作用する幅広い力を発揮することが示されている。過去10年間で、新たに承認された薬剤は天然物由来のものが25種類あり、さらに31種類の薬剤が第III相臨床試験中または過去に承認されている。過去10年の間に、多くの研究者がアロマジンジャー、ローゼル、セレベスペッパー、バナナの葉などの食用植物からの抽出物を強力なMDR-TB阻害剤として報告している54,56,57。
マルチターゲット特性を有する抗結核薬の例としては、細胞壁生合成に関与するトランスポータータンパク質である MmpL3 および MmpL11,メナキノン生合成に関与する MenA および MenG を阻害することが報告されている SQ109 およびその誘導体が挙げられる58 。さらに、Li et al 2014)は、M. tuberculosis、真菌、P. falciparum 寄生虫を含む様々なグラム陽性・グラム陰性菌に対する SQ109 誘導体の阻害能力を実証している58-60。
マイコバクテリウム結核の薬剤開発とファージベース治療の可能性 抗結核治療の可能性
結核のようなほとんどの感染症に対する新薬の発見は、間違いなくゆっくりとした困難なプロセスであった。しかし、最近のプレトマニドの米国食品医薬品局(Food and Drug Administration)の承認は、50年ぶり3番目の抗結核薬である。ベダキリン、プレトマニド、リネゾリドのトリプルコンビネーションは、広範な薬剤耐性結核に対して高い有効性を持つ「ゲームチェンジャー」となる可能性があると報告されている61 。2015年には、ピラゾロ[1,5-a]ピリジン-3-カルボキサミドであるTB47という強力な抗TB薬が発見され、TBとの闘いに新たな希望をもたらした63 。さらに,この化合物は極めて低い濃度でM. bovis,M. ulcerans,M. marinum,M. smegmatis,M. abscessusの生育を抑制する高い抗菌性を示したが,TB47はリファンピシン(0.2 μg/mL)に比べて0.008 μg/mL以上の強力な殺菌活性を示した。 2 µg/mL)63,64 Liu et al 2019)は最近、TB47が呼吸器チトクロムbcc複合体と直接相互作用し、他の第一選択薬の存在下で相乗的にM.結核菌の増殖を阻害する潜在的な抗結核剤であることを実証した。TB47はまた、酵母感染症(Candida albicans)やESKAPEスーパーバグ(Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Escherichia coli)の増殖も抑制している64,65。
バクテリオファージまたはファージは、特定の細菌細胞に感染して溶解するウイルスである67 。細菌感染症に対するファージ治療は、1920年代初頭に初めて使用されたが、その後、抗生物質の発見により好まれなくなった。ファージ・コードされたタンパク質の一群であるファージ・リチン化酵素(エンドリシンまたはリシンとも呼ばれる)は、細菌の標的特異性に優れているため、抗生物質耐性菌の治療に非常に魅力的である68-70。 -75,76 Schuchらは、エンドリシンCF-301と抗生物質を併用することで、メチシリン耐性黄色ブドウ球菌の治療において、それらの併用抗菌活性が増強されることを実証している。エンドリシンCF-301とバンコマイシンまたはダプトマイシンの併用は、抗生物質のみの使用と比較して、ブドウ球菌感染マウスの生存率を増加させる結果となった71,73。マイコバクテリオファージ由来のタンパク質である SWU1 gp39 は M. smegmatis の細胞壁伝染性を増加させ、エリスロマイシンやアンピシリンなどの各種抗生物質の有効性を高めている77 。ファージ治療は広く受け入れられてはいないが、ジョージアに拠点を置くようなファージ治療センターは、ESKAPE病原体を含む多剤耐性スーパーバグに感染した様々な患者にファージをベースとした治療法を提供している。Dedrick氏と共著者によると、最近、薬剤耐性のMycobacterium abscessusに感染した15歳の患者の治療にバイオエンジニアリングされたファージが使用された78 。この症例報告によると、静脈内3ファージカクテル治療が使用され、感染した皮膚の目に見える治癒、創傷の閉鎖、肝機能の改善が得られたという。
抗糖尿病薬の創薬動向
糖尿病は、慢性的な高血糖によって特徴づけられる複雑な代謝性疾患であり、急速にパンデミックレベルに達している世界的な健康問題となっている80,81 。糖尿病患者で観察される持続的な高血糖は、糖尿病の様々な衰弱効果の原因となっている。糖尿病のさまざまなタイプの中で、2型糖尿病(細胞性インスリン抵抗性を特徴とする)が最も一般的であり、糖尿病の症例数が最も多い。この進歩は、一部では、疾患の性質に対する理解が継続的に高まっていることに起因していると考えられる。糖尿病は、単一のタンパク質および/または経路の機能不全または制御異常によってのみ引き起こされるのではなく、むしろ複数の生化学的プロセスの配列によって引き起こされる。これらは、インスリン分泌の欠乏、主要なインスリン標的臓器におけるインスリンシグナル伝達系の障害、グルコースと脂質代謝の最終的な障害を含む3,4,85 糖尿病の複雑さのために、その絶対的な治療のための検索が進行中である。
現在の抗糖尿病治療
糖尿病管理では血糖コントロールが中心となってきたため、長年にわたりインスリン注射が糖尿病管理の主な形態となっていた。また、インスリン抵抗性を特徴とする2型糖尿病(2型糖尿病)の有病率の増加に伴い、様々な経口血糖降下薬が導入されてきた。これらは、インスリン増感剤(ビグアナイド、チアゾリジンジオン、TZD)や分泌促進剤(スルホニル尿素、メグリチニド)α-グルコシダーゼ阻害剤の形で導入され、インスリン作用には直接作用せず、ブドウ糖の腸管吸収を制限するだけのα-グルコシダーゼ阻害剤の形で導入された5。
近年、ジペプチジルペプチダーゼ-IV(DPP-IV)やナトリウム-グルコース共輸送体-2(SGLT2)阻害薬などのシングルターゲットの抗糖尿病薬が2型糖尿病治療薬として承認されている5。SGLT-2阻害薬は、他の抗糖尿病薬とは異なり、腎のSGLT-2タンパク質(ブドウ糖の再吸収の80~90%を担う)を阻害することで作用し、尿中のブドウ糖の排泄を増加させる。
糖尿病との絶え間ない闘いの中で、DPP-IVやSGLT2阻害薬などの最新の抗糖尿病薬の出現を受けて、様々な併用療法が導入され、利用されてきた。その中には、二重併用療法(メトホルミンとスルホニルウレア、またはメトホルミンとDPP-IV阻害剤)三重併用療法(メトホルミン、TZD、DPP-IV阻害剤)さらには四重併用療法(メトホルミン、TZD、DPP-IV、SGLT2阻害剤)などがある。糖尿病管理のための薬物開発でこれまでに行われたすべての偉大な進歩にもかかわらず、現在の抗糖尿病薬の臨床的限界は、単剤療法として、または併用療法のいずれかで、満足に糖尿病とその合併症を停止させることができる新規な薬剤の必要性の証拠である。糖尿病の多面的な性質を考慮すると、シングルターゲット薬ではなく、マルチターゲット薬の発見と開発が、この病気との戦いに勝利するための最善のアプローチであることが証明されるかもしれない。
マルチターゲット経口抗糖尿病薬に向けて
糖尿病のような複雑な疾患に対してマルチターゲット薬を開発するという考え方は、創薬の分野で急速に発展している。マルチターゲット抗糖尿病薬の新たなパラダイムに向けた取り組みの中で、ソタグリフロジンやイメグリミン(図3)など、すでにいくつかの化合物が有望な結果を示すことが報告されており、糖尿病患者さんに希望を与えている。
図3 イメグリミンとソタグリフロジンの化学構造

ソタグリフロジン
ソタグリフロジンは、SGLT1とSGLT2の両方を阻害することにより、腸管でのグルコース吸収と腎でのグルコース再吸収を減少させる作用がある6 。本剤は、糖尿病性ケトアシドーシス、下痢、性器感染症などのリスクが高いとされているが、その二重の効果により、選択的なSGLT2阻害剤よりも優位性がある。ソタグリフロジンは、1型糖尿病を対象とした第3相臨床試験を終了したとの報告があるが、2型糖尿病を対象とした第3相臨床試験はまだ完了していない7 。しかし、欧州医薬品庁(EMA)は最近、1型糖尿病患者のインスリン治療の補助薬としてソタグリフロジンの承認を発表した。
イメグリミン
イメグリミンは、経口抗高血糖薬の新しいクラス(グリミン)の第一候補でもある。イメグリミンのメカニズムは、これらの主要臓器のミトコンドリアのバイオエネルギーを調節し、グルコースに反応してインスリン分泌を刺激し、インスリン感受性を向上させると同時に、肝性グルコース新生を抑制することに関連している。その抗高血糖効果に加えて、この化合物はまた、膵β細胞のアポトーシス8と糖尿病のミクロおよびマクロ血管の損傷の予防のために重要な酸化的損傷から保護することが報告されている。
マルチターゲット抗糖尿病薬の潜在的な供給源としての天然物
糖尿病状態における高血糖と高脂血症との間の確立された関連に加えて、高血糖誘発性酸化ストレスは、糖尿病合併症に関連するいくつかのグルコース代謝経路を刺激することがさらに報告されている。したがって、新規な抗糖尿病薬を設計または探索する際には、化合物の抗酸化性および抗炎症性も考慮することが不可欠である。11,12 試験管内試験および生体内試験モデルの糖尿病研究では、ジンセノサイドRb1,13-15,88 メチル-3β-ヒドロキシラノスタ-9,24-ジエン-21-オエート(RA-3)89-92やマンギフェリン93,94(図4)などの植物由来化合物が糖尿病に対する有望なマルチターゲット効果を示すことが報告されている(表1)。天然物のバイオアベイラビリティ、有効性、標的への特異性のレベルはまだ議論の余地があるが、計算化学の助けを借りれば、これらの潜在的な障害となる課題を克服することができるだろう。植物由来のリード分子は、より効果的なマルチターゲット抗糖尿病薬の開発のために、直接、または構造テンプレートとして使用することができる。
表1 糖尿病に対するマルチターゲット効果が期待できる植物由来化合物の一部
| 工場 | 活性化合物 | 報告された効果/メカニズム | 参照 |
|---|---|---|---|
| メギ尋常性 | ベルベリン | ↓血糖値; ↓G6P活性; ↑インスリン感受性; ↑β細胞保護; ↓糖新生 | 15 |
| サンシチニンジン | ジンセノサイド-Rb1 | ↓血糖値; ↓脂肪細胞の脂肪分解; ↑インスリン感受性; ↑GLP-1分泌; ↑膵島β細胞の保護 | 13 – 15、88 |
| Protorhus longifolia | RA-3 | ↓血糖値; ↓G6P; ↑インスリン感受性; ↓IL-6; ↓血中脂質[TG、TC、LDL]; ↑HDL; ↑膵島β細胞の保護; ↑抗酸化状態 | 74 – 76 |
| マンゴーインディカ | マンギフェリン | ↓血糖値; ↑HK&↑GK; ↓G6P; ↑インスリン、感受性; ↓血中脂質[TG、TC、LDL]; ↑HDL; ↑グリコーゲン合成; ↑抗酸化状態; ↓α-グルコシダーゼ; ↓NF-kβ | 78、79 |
| Vitis vinifera | レスベラトロール | ↓血糖値; ↓α-アミラーゼおよびα-グルコシダーゼ; ↓糖新生; ↑β細胞機能とインスリン作用; ↑抗酸化状態 | 3 |
注↑-増加・活性化、↓-減少・抑制。
略語
HK、ヘキソキナーゼ、GK、グルコキナーゼ、G6P、グルコース-6-リン酸化酵素、TG、トリグリセリド、TC、総コレステロール、LDL、低密度リポ蛋白質、VLDL、超低密度リポ蛋白質、HDL、高密度リポ蛋白質、IL-6,インターロイキン-6,NF-κβ
図4 糖尿病に対するマルチターゲット効果が期待される植物由来化合物の化学構造を紹介する

今日はどこにいるのか
ここ数年、医薬品化学は、より迅速に、より安全に、より効率的に創薬候補をデザインし、探索することができる新しいツールや代替品を模索していた。このような背景から、特定の標的に選択的に作用するリガンドの開発に焦点を当てた創薬戦略が再検討されていたが、多因子疾患での採用は限定的であった。82,95-103 このような有効性と治療上の安全性の限界を克服する必要性は、現在のいわゆる還元主義的なパラダイムである「1 ターゲット 1 薬」(図 5)の変化を支えている。単剤治療や市場の決定に基づいた治療法では効率性に欠けることから、臨床現場でのより良い結果を求めて、新しい治療戦略としてのポリファーマコロジーという概念が生まれていた。この最新の戦略では、複数の生体受容体による分子認識を可能にする異なる構造のサブユニットを単一の足場に組み合わせ、生化学的ネットワークに相互に接続された複数のターゲットに同時に作用することで、多因子疾患の病態生理に関与することが提唱されている5-7。
図5 還元主義的アプローチ(マジックバレット)とポリファーマコロジーの概念的側面
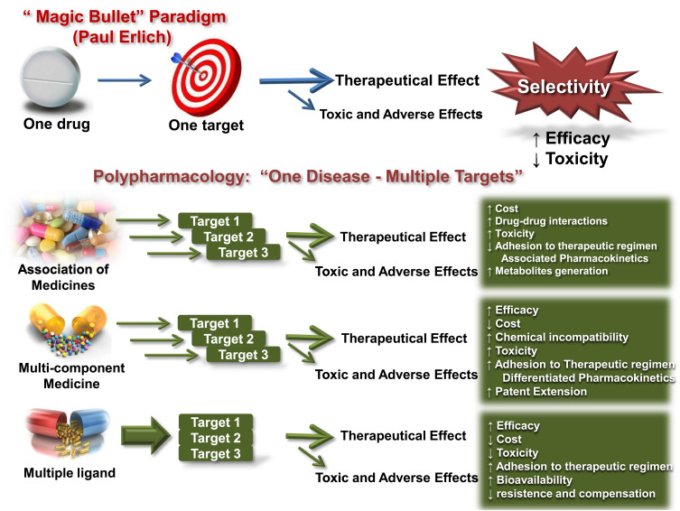
ポリファーマコロジーの概念の理解は 2000年から 2017年までの462の新規分子実体(NME)のうち、マルチターゲットを持つ86の新薬が米国のFDAによって承認されたことに例証されている2,104。 2,104 同一疾患に関連する多機能性薬物(MTD)やマルチターゲット指向性リガンド(MTDL)を考慮するこのアプローチは、アルツハイマー病(AD)やパーキンソン病(PD)などの神経変性疾患を中心に、いくつかの疾患に対する新薬候補のドラッグデザインの概念と空間を変え、特別な注目を集めている。アルツハイマー病とパーキンソン病を代表的な多因子性疾患とすると、これらの疾患は異なる病態であるにもかかわらず、本質的な酸化ストレスや炎症過程と直接的または間接的に関連した一連の生化学的・生理学的カスケードイベントなどの共通の特徴を保持している。
製薬業界は積極的に抗コリン薬をAD治療のために販売しているが、これらの薬剤は、治療効果がなく、神経変性疾患の進行を抑制する能力も中程度にとどまっているだけで、わずかな一過性の効果しか示されていない。新薬を求めて製薬業界が多額の投資を行っているにもかかわらず、神経変性疾患のための革新的な低分子治療法の進歩は非常に緩やかなものであったというのが実情である113 。
アカデミックな科学者や製薬会社の科学者のグループに、なぜAD の有効な薬がないのかと尋ねた場合、彼らは、おそらくADの根本的な病因が創薬に必要なレベルで理解されていないと答えるだろう。病原経路や潜在的な治療標的の継続的な調査は重要だが、この情報の欠如は、薬物に向けた進歩の欠如を正当化するものではない。
創薬の歴史は、特定の分子標的や疾患の病因に関する知識の欠如が、ほとんどすべての治療薬クラスの創薬や開発を妨げるものではないことを証明している。逆に、ADとPDに関する20年間の研究の間に、ADとPDの管理のための効果的な代替案を発見するための正しい方法として、「アミロイド仮説」と「ドーパミンに基づく戦略」をそれぞれ支持するいくつかの注目を集めた出版物があった。しかし、これらの理論のほとんどは、アカデミアの外では薬の候補につながることはない。産業界にとっては、ある問題をめぐる論争は、病態に関する知識の欠如を反映しているようであり、投資に対する関心の低さや不安感の議論として使われる可能性がある82,106,112,114-117
105 もしかすると、ターゲット駆動型の創薬が唯一、あるいは最も成功した新薬への道であるという考え方が蔓延していることが、神経変性疾患に対する進歩の障害となっているのかもしれない。このような病態では、異常なタンパク質フォールディング、タンパク質分解経路、ミトコンドリア機能不全、不均衡なエネルギー産生、軸索輸送過程の障害、酸素と窒素ラジカル種の制御不能な産生、炎症シグナル伝達、そして最終的に誘導された細胞死を含む多くの生理学的変化が存在する102,108,109,118-120。その結果、Aβオリゴマーが過剰に産生され、チャネル活性を持つ多孔質構造を形成してシナプス障害を引き起こし、グルタミン酸受容体を修飾して興奮障害を引き起こす。
さらに、これらの悪条件下では、回路の過興奮性、ミトコンドリア機能不全、リソソーム障害、シナプス可塑性、神経細胞、神経新生に関与するシグナル伝達経路の変化が誘発される121。AD条件下では、キナーゼのアップレギュレーションとホスファターゼのダウンレギュレーションにより、タウタンパク質の異常な過リン酸化が生じ、二重らせん状の不溶性フィラメントと神経原線維性タングル(NFT)として知られるもつれた構造が発生し、神経細胞の変性やシナプス機能障害につながる。NFTはもともとニューロンの内部で形成され、その死後、これらの構造は細胞外環境に放出され、アストロサイトやミクログリア細胞に取り込まれる。108,114 慢性炎症は、脳組織の損傷の結果として、脳内に常駐する免疫細胞の中で最も豊富に存在するミクログリアの活性化に関係している。活性化されると、ミクログリアはTNF-α、インターロイキン-1β(IL-1β)IL-6,フリーラジカル(例:NO、スーパーオキシド)などのサイトカインを含む炎症性および神経毒性因子を産生し、これらは神経細胞の損傷に寄与し、タウ病理を悪化させ、慢性炎症および神経変性の進行に寄与する120,123。
酸化ストレス(OS)は、細胞代謝に関与する生化学的変化の間に生体が産生する活性酸素や窒素種の過剰な生成に対抗するために、自然の抗酸化防御システムが機能しない結果として、ADの発症に重要な因子であると認識されている。ADの文脈では、過去20年間の文献データは、AChE、BACE-1,酸化酵素、生体金属(例えば、Fe2+、Cu2+、Zn2+)グルタミン酸受容体(例えば、NMDA)セロトニン受容体(5-HTR)ヒスタミン受容体(H3)およびホスホジエステラーゼを含む9つの分子標的が、ADの新規な疾患修飾薬の候補を探索する際にほとんど利用されてきたことを示している。さらに、酸化ストレス、ミトコンドリア機能不全および神経炎症は、アストロサイトおよびミクログリアの活性化とともに、創薬戦略において広範囲に考慮されてきた。実際、酸化還元状態の調節障害は神経変性に積極的に寄与し、ADやPDの進行にも寄与するいくつかの細胞イベントや経路を誘発する。
エピジェネティック仮説は、最近のAD治療のもう一つのアプローチである。この観点から、転写レベルでの遺伝子発現を制御するメチル化反応やヒストンアセチル化反応によるDNAの改変は、ADやPDの発症において重要な役割を果たしていると考えられている。特定の神経伝達物質受容体(例えば、ドーパミン、セロトニン、ヒスタミン、ニコチン、ムスカリン)および特定の酵素(例えば、PDE、AChE、BuChE、MAO)を含む、上記で議論したすべての側面について、ADおよびPDは、現在、相互に連結したネットワークの中で動作する多数の生化学的および細胞イベントを持つ、高度に複雑な病因を持つ神経変性疾患として認識されている114,123。このようなNDSの特殊な病態生理的特徴は、糖尿病、癌、慢性炎症、高血圧などの他の多因子疾患と同様に、より良い治療結果を得るためには、創薬に対する考え方を変えるべきであるということが、科学者の間で明らかにコンセンサスになっている。そのため、これまでの薬理化学や薬理学的戦略とは異なり、高活性で選択的なリガンドの設計は、この種の病態に関与する分子標的を修飾するための最も効果的で適切なアプローチではないことが証明されている。
複数の分子標的に焦点を当てて疾患と闘うこと、または複数の疾患に関連する効果の調節を求めることは、新しい概念ではない。実際、併用療法やポリファーマコロジーは、1つの病態に関連する2つ以上の症状や障害をコントロールする方法として、この戦略を示している。過去10年間で、科学界は、創薬のための新しい窓として、マルチリガンドデザインを考慮することの重要性を認識してきたようである。実際、複数の分子標的や生化学的経路を同時に修飾することを目的としたリガンド設計のための様々な合理的な戦略を報告する論文が増えている。4,12,37,96,97,99,100,102,103,106,110-113,120,123 このように現在も変化し続けているシナリオは、これまでの単一標的薬の治療限界を克服するためのより合理的なアプローチとして、選択された多数の分子標的の同時モジュレーションに基づく新しい疾患修飾薬候補の発見に向けた薬理化学者の努力を示すものであることは間違いない。
マルチターゲット探索の未来は?
様々な複合疾患に対する単剤治療が発見されて以来、そのアプローチは抵抗性や副作用のために単剤治療から三剤治療へと変化し続けている。マルチターゲット薬物治療アプローチは、単剤治療がうまくいかないと思われるときに、明るい未来を秘めている。ポリファーマコロジーの概念は、製薬会社や研究者にも受け入れられ、マルチターゲット薬の開発にも力を入れている。科学的な報告によると、疾患治療におけるマルチターゲット薬のアプローチにより、耐性の問題は過去のものになる可能性がある。その出発点は、相互作用するタンパク質を確立するために、計算機的アプローチを用いてタンパク質ネットワークをスクリーニングすることである。これにより、感染症の場合に寄生虫、細菌、真菌の生存に重要な役割を果たすタンパク質のアイデアが得られる。これらのタンパク質は、過酷な環境下や、例えばP. falciparumのような寄生虫が宿主に侵入したときに相互作用するため、その生存に不可欠なタンパク質を大量に産生する。多くの場合、これらのタンパク質は直接または間接的に相互作用しているため、これらのタンパク質を標的とするには、その構造や活性についての深い知識が必要となる。これらの情報に基づいて、マルチターゲット性を有する化合物を設計することができる。したがって、マルチターゲット薬の探索は今後も続き、複雑な疾患を根絶するための有効な治療法を見つけることが、私たちの最後の希望となるであろう。
