Contents
Potential immunotherapies for traumatic brain and spinal cord injury
www.ncbi.nlm.nih.gov/pmc/articles/PMC6033730/
オンラインで2018年4月18日に公開
Raj Putatunda,a John R. Bethea,b and Wen-Hui Hua,∗.
概要
脳や脊髄を含む中枢神経系(CNS)の外傷は,依然として世界の主要な罹患率と障害の原因となっている。一過性の外傷と比較して,二次的で持続的な外傷のメカニズムを明らかにすることは,過去数十年の間に多くの研究者の注目を集めてきた。二次障害時の不毛な神経炎症は、中枢神経系障害の基盤となる基質として頻繁に同定されてきたが、現在のところ、これが修復において有益な役割を果たすのか、有害な役割を果たすのかを決定する決定的な研究はない。最近の先駆的な研究により、無菌性の神経炎症と中枢神経系の修復を制御する上で、自然免疫反応と適応免疫反応が重要な役割を果たしていることが明らかになった。最近、中枢神経系損傷の治療のために、いくつかの有望な免疫治療戦略が開発された。本総説では、中枢神経系損傷における自然免疫応答と適応免疫応答の役割の解明、潜在的な免疫治療薬の開発と特性評価、およびこの分野における未解決の問題について、最近の進展を報告する。
キーワード
脳損傷、脊髄損傷、自然免疫・適応免疫、炎症反応、免疫療法、二次障害
略語の説明
APCは抗原提示細胞、ASCはカルボキシ末端CARDを含むアポトーシス関連斑状タンパク質、BBBは血液脳関門、中枢神経系は中枢神経系、脳脊髄液は脳脊髄液、DAMPは危険関連分子パターン、ECMは細胞外マトリックス、HDACはヒストン・デアセチラーゼ、HMGB1は高運動性グループボックス1,Hspは熱ショックタンパク質。IL(インターロイキン)IVIG(静注用免疫グロブリンG)MHC(主要組織適合性複合体)NFκB(核内因子κB)NLR(ヌクレオチド結合ドメインロイシンリッチリピート)PAMP(病原体関連分子パターン)RAGE(進行性糖化最終生成物の受容体)SCI(脊髄損傷)TBI(外傷性脳損傷)Th(Tヘルパー細胞)TLR(Toll様受容体
はじめに
外傷性脳損傷(TBI)は、依然として世界中で死亡や障害の大きな原因となっている。ヨーロッパでは 2012年にTBIによる死亡者数が約82,000人、入院者数が210万人、3 中国ではTBIによる死亡者数が194,850人(人口10万人あたり12.99人)となっている4。TBIから生還した人は、認知機能、動作、感覚(視覚や聴覚など)感情機能(性格の変化、うつ病など)の障害など、一時的または永続的な障害に直面する。これらの問題は、患者さんだけでなく、家族や地域社会にも影響を及す。また、TBIは、心的外傷後ストレス障害、慢性外傷性脳症、慢性神経炎症に関連している。
さらに、外傷性脊髄損傷(SCI)は、社会にとって大きな経済的負担となっており、1人の患者の生涯で発生する直接費用は50万ドルから 200万ドルに上る。米国では、毎年約17,000人が新たに脊髄損傷を発症し、240,000~337,000人が脊髄損傷を抱えて生活している6。損傷時の平均年齢は、1970年代の29歳から 2016年には42歳に上昇している7。
TBIもSCIも、年齢や性別を問わずあらゆる人に影響を与える。これらの障害はいずれも重大な罹患率と死亡率を引き起こし、初期の機械的な一次傷害と持続的な二次傷害がある。二次傷害は、患者に見られる神経学的障害に大きく寄与する。最近では、中枢神経系損傷後の二次的な炎症/免疫反応への関与として、常在する免疫細胞とリクルートされた免疫細胞の逐次的な活性化が広く研究されている15。TBIおよびSCIに対する多くの治療法が開発されており、外科的減圧術、メチルプレドニゾロン、血圧上昇などの初期の神経保護療法に加え、リルゾール、ミノサイクリン、マグネシウム、治療的低体温、脳脊髄液(脳脊髄液)ドレナージなどの最近開発された神経保護介入法も含まれている16。また、ミノサイクリン、セトリン™、抗NOGO抗体、細胞ベースのアプローチ、生体工学的なバイオマテリアルなど、いくつかの創薬ターゲットについても、有望な臨床試験が進行中です17 。過去数年間、免疫調節戦略は大きな成功の可能性を示していた。この総説では、二次障害における免疫反応の重要性を強調し、TBIとSCIの両方の治療における免疫療法の将来の可能性を探る。
中枢神経系免疫のパラダイムシフト
中枢神経系は、抗原による免疫反応に耐性があることから、長い間、免疫に恵まれた器官とみなされてきた。このように自然免疫反応が鈍いのは、主に血液脳関門(BBB)の存在によるものと考えられる。BBBは、脳内皮細胞のタイトジャンクションと基底膜、血管周囲のアストロサイトの末端足部によって相対的な不伝染性が維持されている。さらに、脳実質内には古典的なリンパ管や樹状細胞のような抗原提示細胞(APC)が存在せず、主要組織適合性複合体(MHC)クラスIおよびII分子のレベルが低いことも、中枢神経系内での免疫反応が限定的である一因と考えられる。そのため、従来は、中枢神経系実質内に免疫細胞が存在することは病理学的特徴であり、中枢神経系損傷後の免疫反応は有害な役割を果たしていると認識されていた。しかし、このパラダイムは過去20年間で変化してきた。18, 19 免疫系は常に免疫モニタリング状態を維持しており、外部の病原体からのシグナルだけでなく、特にTBI、SCI、脳卒中などの無菌性損傷の場合には、損傷組織からのシグナルも偵察していることを示す証拠が増えている20。
中枢神経系内に常駐するミクログリアやアストロサイトが自然免疫反応に関与していることが知られている。生理的条件下では、数百万個の免疫細胞が脳脊髄液を循環し、髄膜や脈絡叢の上皮に存在する。これらの免疫細胞には、T細胞、B細胞、単球/マクロファージ、樹状細胞、および好中球が含まれる。21, 22, 23, 24 このことは、中枢神経系由来の抗原が深頸部リンパ節で免疫反応を引き起こすという観察からも裏付けられる。25, 26, 27 興味深いことに、この反応は、より有害な炎症性のT細胞反応を避けるためか、体液性の反応としてB細胞に偏っている。脳脊髄液からの樹状細胞は、頸部リンパ節のB細胞濾胞に移動することが分かっている28, 29。
中枢神経系の免疫特権に関するパラダイムの変化は、健康/生理学的条件下での中枢神経系の免疫(免疫モニタリングと寛容)についての新しい理解をもたらしている。さらに、中枢神経系一次傷害後の二次傷害の開始または媒介において、すぐに利用可能な免疫反応が優位な役割を果たすのは、中枢神経系内に既存の免疫システムがあるからかもしれない。常駐する免疫細胞(ミクログリア、アストロサイト)と浸潤する免疫細胞(T細胞、B細胞、単球、マクロファージ)の両方が、中枢神経系損傷において有益な役割と有害な役割を果たす。多発性硬化症やアルツハイマー病のような神経変性疾患では、免疫/炎症反応をブロックする免疫療法がかなりの効果を示している。
中枢神経系損傷後の自然免疫反応
自然免疫細胞の活性化
中枢神経系損傷の初期炎症反応は、自然免疫反応のメカニズムであると考えられ、最初に危険関連分子パターン(DAMPs)が生成され、常駐する自然免疫細胞(ミクログリアやアストロサイト)が炎症性サイトカイン/ケモカインを産生し、その後、浸潤する自然免疫細胞がリクルートされることが特徴である(図1)。浸潤する自然免疫細胞には、単球(後にマクロファージに分化する)マスト細胞、顆粒球(好塩基球、好酸球、好中球)樹状細胞、ナチュラルキラー細胞などがある。中枢神経系損傷後数分以内に、インターロイキン(IL)-33,ATP、熱ショックタンパク質(Hsp)、高運動性グループボックス1(HMGB1)などのアラーミンが、損傷した髄膜、グリアリミタン、実質白質から速やかに放出される36, 37。IL-33は中枢神経系、特にオリゴデンドロサイトとアストロサイトに高発現しており38, 39,ミクログリア/マクロファージをリクルートすることで中枢神経系損傷に重要な役割を果たしている39。40 これらの即時型アラキシンは、自然免疫細胞の病原体関連分子パターン(PAMPs)やToll様受容体(TLRs)プリン体受容体などのDAMPセンサーと結合して、核内因子κB(NFκB)シグナルを活性化し、炎症遺伝子の発現やサイトカインの放出を誘導する41, 42, 43。
図1 中枢神経系損傷後の自然免疫反応と適応免疫反応の時間経過と二重の役割
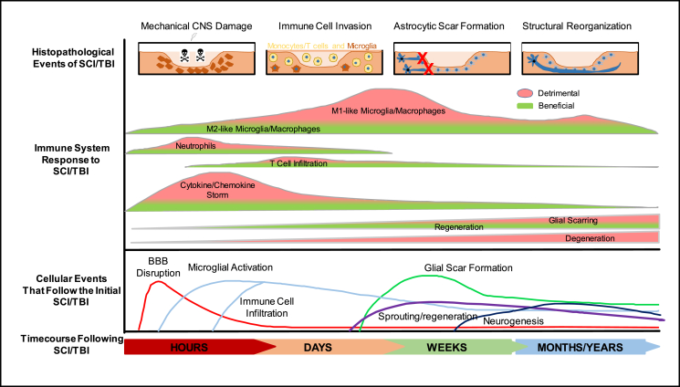
数時間以内に、中枢神経系の一次的な機械的損傷により、細胞膜、血管系、BBBが破壊され、アラキシンが速やかに放出され、常駐する免疫細胞が活性化され、続いて二次的な炎症/免疫反応が起こる。その後、数日から数週間の間に、免疫細胞の継続的な浸潤とサブタイプの変換により、神経再生に有益な効果と有害な効果が生じ、アストロサイトの活性化によりグリアの瘢痕化と再生不全が誘発される。中枢神経系損傷後、数ヶ月から数年かけて限定的な神経新生と神経再生が起こる。2, 243より引用した。
HMGB1は、核内に局在するDNA結合型転写因子で、ユビキタスに発現している。HMGB1は、TLR4やRAGEなどの受容体を介して強力な炎症刺激を与える。36 TLR4とRAGEはともに、NFκBの活性化を介して自然免疫/炎症反応に関与する46。
単球は、中枢神経系の損傷後に最初に浸潤する自然免疫細胞の主要なタイプであり、無菌性の炎症の伝播に寄与している47, 48。単球は、CD115+Ly6ChiCD62+CCR2hi古典型、CD115+Ly6CloCD62-CCR2lo非古典型、およびこれらのマーカーを多様に発現する中間サブセットに分類される49。50 古典的な単球は、損傷部位に浸潤して組織マクロファージを生成する。51 非古典的な単球は、パトローリング単球と呼ばれ、BBBなどの血管内皮を調査し、病的な状況下でのみ血管外に浸潤する。52 非古典的/パトローリング単球は、CX3CR1フラクタルカイン受容体を高レベルで発現しており、TBI後にCX3CRL1を発現する細胞に移動することができる。さらに、CCR2選択的アンタゴニストであるCCX872でCCR2+マクロファージを標的にしたところ、TBIによる炎症反応が有意に減少し、海馬依存性の神経認知機能が改善された56。CX3CR1ノックアウトマウスでパトローリング単球を選択的に除去すると、TBI47やSCI後の好中球浸潤が有意に減少する57。したがって、CX3CR1シグナルを標的とすることは、中枢神経系損傷に対する選択的な免疫療法となりうる。しかし、パトローリング単球は、脳卒中の進行と回復に重複して関与しており58,無菌性の興奮毒性モデルでは神経保護機能を示す59。
浸潤している好中球は、移動性が高く、高い貪食能力を持ち、中枢神経系損傷後の脳実質内の損傷要素を洗浄する60, 61。好中球は、BBBの破壊とそれに続く脳浮腫の形成にも関与している62, 63。浸潤している樹状細胞は、損傷した細胞によって活性化され、T細胞に抗原を提示し、適応免疫反応を引き起こす64, 65。
マスト細胞は、主にアレルギー反応の発症に関与するミエロイド細胞である。64, 65 肥満細胞は、主にアレルギー反応に関与する骨髄系細胞であり、皮膚、腸、気道などの外部環境にさらされる組織内に広く存在することに加え、中枢神経系、特に leptomeninges66 や血管周囲にも観察されている。これらの炎症性メディエーターは、ミクログリアの活性化と神経炎症を誘発する。また、髄膜のマスト細胞はBBBを損傷し、好中球や活性化T細胞を傷害部位に動員する。したがって、マスト細胞を抑制することは、中枢神経系損傷に対する神経保護療法となる可能性がある69, 70。
中枢神経系の二次傷害におけるインフラマソームの重要な役割
インフレマソームは、病原性微生物や無菌的な損傷・ストレス信号に対する自然免疫応答として機能する多タンパク質の細胞内複合体である。インフレマソームは、カスパーゼ、特にカスパーゼ-1の活性化を制御し、炎症性サイトカインであるIL-1βやIL-18の生成を促す。PAMPsやDAMPsは、TLR、ヌクレオチド結合ドメインロイシンリッチリピート(NLR)C型レクチン、膜結合型のレチノイン酸誘導遺伝子I様受容体などのパターン認識受容体によって認識される。これらのパターン認識受容体は、主にミクログリアやアストロサイトなどの自然免疫系細胞に発現している。TLRが活性化されると、NFκBシグナルを介してインフラマソームのプライミングが誘導され、NLRはほとんどの細胞タイプでインフラマソームのアセンブリーを刺激する。TLR2とTLR4は、細胞のHsp60とHsp70を検出する。TLR5は細菌の鞭毛を検出する。NLRは、尿酸結晶や凝集したペプチドなどの内因性の細胞生成物によって活性化されることがある。NLRはまた、ATP刺激によるプリン体受容体の活性化によって誘発される細胞質のイオンフラックスを検出する。
中枢神経系ではいくつかのインフラマソーム複合体が同定されており、中でもNLRP1とNLRP3が最も研究されている72, 73, 74。インフラマソーム複合体は活性化される前にあらかじめ組み立てられた状態で存在しており、中枢神経系の損傷後に自然免疫系を迅速に活性化することを可能にしている75。各インフラマソーム複合体は、細胞質センサー(すなわちNLR)、アダプタータンパク質(すなわちカルボキシ末端CARDを含むアポトーシス関連スペック様タンパク質、ASC)、エフェクターであるカスパーゼを含んでいる76。これらのインフラマソームが活性化されると、成熟型/活性型のカスパーゼ-1が産生され、炎症性サイトカインであるIL-1βやIL-18が産生され、中枢神経系損傷後の二次的な炎症反応に寄与する78。
中枢神経系損傷後の活性化ミクログリア/マクロファージとアストロサイトの二重の役割
ミクログリアは、中枢神経系における自然免疫応答において重要な役割を果たしている。ミクログリアは形態的にも機能的にもダイナミックであり、安静時の隆起した定常状態(M0)から、活性化した非貪食性(M1)または貪食性(M2)の極性状態に至るまで様々である79。M2ミクログリアは、IFNγ、IL-6,TNF-αによって刺激され、APCのように機能する。M2aはIL-4やIL-13によって刺激され、炎症を抑制する働きがある。80, 81 M2bはTLRによって刺激され、M2cはTGF-β、IL-10,アポトーシス細胞によって刺激される。
ミクログリアは、中枢神経系を調査するだけでなく、神経発生、84 神経細胞の分極化、シナプスの再構築/可塑性を制御するという基本的な役割を担っている85。ミクログリアは、様々な成長因子を放出することで、神経細胞の分化と成熟を決定する。ミクログリアは、シナプスの形成と成熟をサポートする。病的な状況下では、ミクログリアは非常に反応性が高く、急速に活性化、増殖、構造変化を起こす。ミクログリアは、侵入してきた病原体や局所的なダメージを与えるシグナルに対する免疫防御の第一線を担っている。ミクログリアは、サイトカイン/ケモカイン、糖脂質、リポタンパク質、ペプチド、ヌクレオチド、折りたたまれていないタンパク質の集合体、その他の異常に処理されたタンパク質など、さまざまな種類の炎症メディエーターを感知することができる。また、様々なタイプの炎症誘発性および抗炎症性サイトカイン/ケモカイン、成長因子、マトリックス分子なども生成される。これらの炎症性メディエーターは、ミクログリアの表現型の変化を引き起こし、中枢神経系損傷後のミクログリアの有害または有益な機能を媒介する。
アストロサイトは、神経細胞を栄養的にサポートするだけでなく、シナプスの刈り込み、神経毒の除去、神経原性刺激、血流調節、カリウム/ナトリウムの緩衝など、多くのプロセスで不可欠な役割を果たしている。TLRやNLRのシグナルに応答して、アストロサイトは、IL-1β、IL-6などのサイトカイン、CCL2,CXCL1,CXCL10,CXCL12などのケモカイン、いくつかの補体成分を含む自然免疫/炎症メディエーターの大部分を産生する89, 90。NFκBシグナルは、中枢神経系の二次障害における炎症反応に関与することがよく知られている。この保護効果は、CXCL10,CCL2,TGF-β97などの様々な炎症性サイトカイン/ケモカインの減少とオリゴデンドロゲン形成の促進に起因すると考えられている100。101 コンドロイチン硫酸プロテオグリカンは、アストログリアの瘢痕化の主要成分であり、アストログリアのNFκB阻害によって有意に発現が低下する。
中枢神経系損傷後の適応免疫反応
適応免疫反応は、中枢神経系損傷後に、深頚部リンパ節、髄膜腔(脳脊髄液を含む)および局所損傷部位で最も顕著に起こる(図1)。T細胞の反応は、中枢神経系に限定された抗原に特異的であると考えられる。最近の研究では、免疫T細胞が髄膜血管を介して脳脊髄液や髄膜腔に侵入することが明らかになった23。髄膜T細胞は、いくつかのケモカインを介して実質に浸潤する可能性がある。103 いくつかの証拠は、T細胞が髄膜や脳脊髄液に、後膜や硬膜の血管または脈絡叢を介して入ることを示した。
103 血管細胞接着分子1(VCAM1)に対するvery late antigen 4(VLA4,別名インテグリンα4β1)の結合は、T細胞の血管外遊出と中枢神経系へのホーミングに重要である106, 107 VLA4に対する中和抗体でこの相互作用を阻害すると、T細胞の血管外遊出が減少する。
T細胞は、表面に結合したT細胞受容体を介して抗原を認識し、一般的にCD8+細胞傷害性T細胞とCD4+ヘルパーT細胞(Th)に分類される。CD8+ T細胞は、MHCクラスI(MHC I)分子によって提示される抗原を認識し、CD4+ T細胞は、主に樹状細胞、マクロファージ、B細胞などのAPCによって提示されるMHC II抗原を認識する110 特定のペプチドによって活性化されると、CD4+ T細胞は増殖し、特定の二次刺激にさらされると、特定の脅威に対抗するために分化する111 様々な刺激を受けると、Th細胞は、Th1,Th2,Th9,Th17,T調節細胞、T濾胞ヘルパー細胞など、いくつかのサブタイプに分化する。例えば、Th1細胞はIL-2,INFγを、Th2細胞はIL-4,IL-5,IL13を、Th9細胞はIL-9,IL-10,IL-21を、Th17細胞はIL-17,IL-23をそれぞれ産生する112。T濾胞ヘルパー細胞は、CD40Lを発現し、IL-21とIL-4を分泌する。113 生理的条件下では、リンパ球(主にT細胞)は、髄膜、脳脊髄液、脈絡叢などの中枢神経系を取り巻く境界をパトロールし、神経行動機能を制御している114。例えば、遺伝的に髄膜のT細胞を枯渇させたり、薬理学的に深頚部リンパ節にT細胞をトラップしたりすると、動物モデルでは神経認知機能が損なわれる115, 116。しかし、免疫細胞のパトロールの役割の基礎となる分子メカニズムはまだほとんどわかっていない。
適応免疫反応にはB細胞も関与しており、B細胞はゲノムの再配列により固有の抗原特異的受容体を発現し、抗体を産生する。TBIとSCIはともにB細胞を刺激して病原性抗体を生成し、SCI後の二次的な組織損傷や神経機能障害の原因となっている117, 118。
中枢神経系損傷後の自然免疫反応を利用した免疫療法
自然免疫反応は、中枢神経系損傷後の無菌性炎症や神経再生不全に大きな役割を果たしている。メチルプレドニゾロンのような幅広いステロイドを用いた一般的な免疫抑制レジメンは、何十年もの間、脊髄損傷やTBI患者の治療に広く用いられてきた。残念ながら、これらの免疫抑制レジメンは、自然免疫反応の炎症促進および抗炎症活性の両方を抑制するため、依然として成功していない。119,120 最近では、炎症促進性のM1様反応を改善し、抗炎症性のM2様陽性組織リモデリングを促進する選択的免疫調節アプローチが開発されている。マクロファージ/ミクログリアは、自然免疫反応において重要な役割を果たしている。そのため、マクロファージやミクログリアを標的とした免疫調節療法は、中枢神経系の損傷の治療において有望視されている。
TBIおよびSCI後のミクログリアを標的としたミノサイクリン
ミノサイクリンは、臨床的に利用可能なテトラサイクリンクラスの抗生物質であり、中枢神経系損傷後の複数の段階で広範な神経保護効果を示する121。そのメカニズムのほとんどは、中枢神経系損傷後の自然免疫反応を抑制する能力に関係している。例えば、中枢神経系損傷後のミクログリア活性化の抑制、122, 123, 124 HMGB1トランスロケーションの減衰、122カスパーゼ-1125の抑制、IL-1β, TNF-α, Cox2などの炎症性メディエーターの放出の抑制などです121。また、第2相臨床試験では、脊髄損傷後の運動機能の改善が認められている129。
中枢神経系損傷後の自然免疫細胞における細胞外マトリックス(ECM)とエクソソーム
131 自己のミクログリア/マクロファージをECMや他の免疫調節因子でex vivoで前極化し、M2ライクな表現型を獲得してから患者に移植することができる132, 133, 134 さらに、自己のマクロファージを用いた細胞療法はTBIやSCIを改善することが示されている135。細胞に関連した副作用の可能性や、マクロファージや幹細胞の注入が困難であることから、エクソソームは、低免疫原性、高い有効性、効率的なBBB伝染性、活発な細胞コミュニケーション、ミクログリアの貪食刺激などの多面的な利点があるため、細胞療法に代わるものとして開発されてきた136, 137, 138。139, 140, 141 ECM-極性化または遺伝子工学を介してカプセル化された成分を変更することにより、エクソソームを選択的に産生し、中枢神経系損傷後の有益な免疫反応を調節することができる137。142, 143 例えば、ASC siRNAを負荷したエクソソームは、生体内試験で損傷したBBBを通過し、損傷後の脊髄におけるASCタンパク質レベルを低下させ、カスパーゼ-1の活性化とIL-1βの産生を有意に減少させることができる144。これらのインフラマソームを含むエクソソームは、末梢の免疫細胞と融合して、炎症反応や免疫反応を活性化する可能性がある72, 73。
免疫調整のための脂質低下薬
スタチンのような脂質低下薬は、広範な免疫調節作用と抗炎症作用を持っている。スタチンの中でもアトルバスタチンは、TBI147, 148, 149, 150, 151, 152, 153, 154およびSCIを対象とした多くの前臨床試験で神経保護効果を示している。155, 156, 157, 158 アトルバスタチンの神経保護効果には多くのメカニズムが関与していると考えられるが、ミクログリア/マクロファージの分極化がより優位な役割を果たしていると考えられる159。TBIマウスへのアトルバスタチンの急性投与は、 ミクログリア/マクロファージの活性化と免疫細胞の浸潤を 抑制することにより、炎症反応を効果的に減少させた159。アトルバスタチンを用いたいくつかの臨床試験では、 TBI147およびSCIに対して非常に有望な治療効果が示されたが、 機能回復の改善が認められなかった臨床試験もある148, 160。より大きなコホートサイズとより長い多施設での評価期間を伴う更なる臨床試験が必要である。
中枢神経系損傷の治療標的としてのインフラマソーム
インフレマソームのプライミングと活性化は、自然免疫反応と中枢神経系損傷後の無菌性炎症の主要な構成要素である。したがって、インフレマソーム反応を標的とする免疫療法は、中枢神経系損傷(TBIおよびSCI)に対する有望な抗炎症アプローチであるかもしれない。中枢神経系損傷後のインフラマソーム反応の複雑さとそのメカニズムについては、いまだに多くの研究がなされているが、77, 144いくつかの概念実証研究では、インフラマソームの集合と活性化に接触することが期待されている161。
初期の研究では、ラットの流体打撲による脳損傷の直後に抗ASC中和抗体を投与すると、病理組織学的および機能的回復が有意に改善することが示された162。163, 164 カスパーゼ-1阻害剤(Ac-YVAD-cmk, VX-765)やパンネキシン-1阻害剤(Probenecid, Brilliant Blue FCF)を用いてパイロプトーシスをブロックすることで、インフラマソームを介した炎症を防ぎ、中枢神経系損傷を改善することができる161, 163 オメガ3脂肪酸は、NLRP3インフラマソームの活性化を阻害することで、神経炎症を抑制し、神経学的転帰を改善する165 脂溶性の静脈麻酔薬であるプロポフォールは、活性酸素依存的なNLRP3インフラマソームの活性化を阻害することで、TBIから保護することが示されている166。アンジオテンシンII受容体拮抗薬であるテルミサルタンは、NLRP3インフラマソームを介したIL-1βとIL-18の蓄積を阻害することにより、外傷性脳浮腫を減少させる167。メラトニン投与は、NLRP3インフラマソームに関連したパイロプトーシスを阻害することにより、くも膜下出血後の初期脳損傷を軽減する168。脊髄損傷後にエストロゲンや間質細胞由来因子-1α(SDF-1α)を投与すると、局所的なインフラマソームの活性化を阻害することで神経保護機能を示す169。170 レスベラトロールは、SIRT1を介して活性酸素の産生を減少させ、NLRP3の活性化を阻害することで、炎症反応を軽減し、TBIを改善する171 高気圧酸素(HBO)処理は、ミクログリアのNLRP3インフラマソームシグナルを調節し、IL-1β/IL-18の蓄積を減少させることで、実験的TBIにおける炎症反応を軽減する172。173 BAY 11-7082(NFκB経由)やA438079(P2X7経由)などのNLRP3阻害剤は、炎症反応を抑制し、TBI後の機能回復を改善することが示されている75, 174 マンギフェリンは抗炎症剤として広く用いられており、中枢神経系損傷後の神経保護効果もNLRP3阻害に起因するとされている175。ヘムオキシゲナーゼ-1146,Rhoキナーゼ阻害剤fasudil176,柑橘系フラボノイド配糖体ルチン177とケルセチン178,天然トリテルペノイド化合物アシアティック酸179,ドーパミン受容体アゴニストA-68930など、SCIに対する神経保護効果を示すいくつかの治療法が、インフラマソームを標的とすることが示されている180。
しかし、Nlrp1(-/-)マウスやAsc(-/-)マウスを用いたいくつかの研究では、TBI後のNLRP1インフラマソームの役割は本質的ではないことが示されている181。これは、この特異的なインフラマソームノックアウトの発達的な補償に起因すると考えられる。IL-1βはインフラマソーム活性化の主要なエンドポイントであることから、IL-1raやIL-1β中和抗体などのIL-1βを標的とした治療法がTBI182, 183やSCI184後に神経保護効果を示すことは、インフラマソーム治療が中枢神経系損傷の治療に非常に有望であるという結論を支持するものである。フラマソームを標的とした前臨床研究の大半が、TBIやSCIに対してポジティブな治療効果を示していることから、中枢神経系損傷に対する臨床試験が早急に必要であると考えられる185。
脊髄損傷およびTBIに対するHDAC阻害剤
ヒストン脱アセチル化酵素(HDAC)は、ヒストン上のアセチル基を除去することで、ヒストンの周りにDNAをより強固に巻き付けることができ、遺伝子の転写を抑制する。HDAC阻害剤は、遺伝子転写を活性化するために広く開発・利用されている。TBI後、バルプロエート、酪酸ナトリウム、ITF2357,トリコスタチン-A、スクリプテイド、4-ジメチルアミノ-N-[5-(2-メルカプトアセチルアミノ)ペンチル]ベンズアミド(DMA-PB)などの様々なHDAC阻害剤を用いた治療は、いくつかの動物モデルにおいて、神経炎症の緩和、運動機能回復の改善、学習/記憶の促進を有意にもたらした186, 187, 188, 189, 190 これらのHDAC阻害剤は、細胞の生存、増殖、分化に関与する多くの神経保護遺伝子の転写発現を優先的にアップレギュレートする。191 TBI後の灰白質と白質の両トラクトはHDAC阻害により有意に保存される186, 192 同様に、バルプロエートやRGFP966などのいくつかのHDAC阻害剤は、炎症反応を抑制し、神経新生を促進し、軸索再生を刺激することによってSCIに対する神経保護効果を有することが示されている193, 194, 195, 196 HDAC3の発現は、SCI後の損傷部位の自然免疫細胞(ミクログリア/マクロファージ)でアップレギュレートされている196。TBIとSCIの両方において、ミクログリア/マクロファージの活性化を抑制することが、HDAC阻害療法による神経保護効果の基礎となる主要なメカニズムである。186, 194, 196 これらのエキサイティングな前臨床研究の結果は、中枢神経系の損傷の治療のためにミクログリアを標的としたHDAC阻害剤を使用する有望な将来の治療法を提供するものである193。
単球を標的としたナノ粒子・薬剤
単球由来のマクロファージは、中枢神経系損傷後の初期の炎症性損傷に主に寄与している197。中枢神経系損傷の初期段階で単球の浸潤を選択的に遮断することは、初期の自然免疫反応による有害な影響を防ぎ、居住するミクログリア/マクロファージの有益な効果を維持することになる198。このように、SCI後の生分解性ナノ粒子の静脈内投与は、損傷部位への単球の浸潤を安全かつ選択的に制限し、中等度および重度のSCI後の機能回復を有意に改善する。
ラキニモドは、多発性硬化症201,202やその他の自己免疫疾患の治療のために臨床的に使用されている免疫調整経口薬である。203 その免疫調整作用は、主に神経変性疾患における単球の中枢神経系への浸潤を抑制することに起因する。
ヒト白血球抗原(HLA)-DRα1ドメインとマウスMOG-35-55ペプチドを共有結合させた新しいバイオエンジニアリングタンパク質(DRα1-MOG-35-55)は、単球反応を調節し、TBI後の組織学的および臨床的転帰を改善することが示されている206, 207。
中枢神経系損傷後の適応免疫反応に対する免疫療法
B細胞を標的とした新しい神経保護治療薬
免疫グロブリンG(IVIG)静注療法
IVIGはポリクローナルIgGを含み、良好な薬理学的安全性をもって、ギラン・バレー症候群、慢性炎症性脱髄性多発神経炎、川崎病などの免疫不全や自己免疫疾患の臨床患者の第一選択薬として広く使用されている209, 210 IVIGはまた、虚血型障害における神経保護効果についても検討されている210, 211, 212 動物実験では、SCI213またはTBI214後の急性期にIVIGを投与すると、神経機能の回復が著しく向上する。IVIGは、中枢神経系における炎症性サイトカインの産生、免疫細胞の侵入・活性化、補体の活性化を抑制することで過剰な免疫反応を抑えるだけでなく、中枢神経系損傷後に侵入した病原体に対する免疫抑制を回復させる17。213, 215, 216, 217 自己免疫疾患や免疫不全症の治療にIVIGが長期にわたっ て使用されていることや、動物実験で中枢神経系損傷に対する有効性が 期待されていることから 211, 213, 214 IVIGはSCIおよびTBIにおける臨床試験の潜在 的な候補である。
中枢神経系損傷後のモノクローナル抗体
117,118 RAGノックアウトマウスのB細胞欠損はSCI後の機能回復を改善する220。221 リツキシマブやオビヌツズマブなどの治療用CD20抗体は、中枢神経系損傷の治療のための新しい免疫療法を提供する可能性がある。
T細胞を標的とした治療(末梢および中枢神経系)
CXCL10アンタゴニスト226や中和抗体227, 228は、T細胞の浸潤を抑制し、神経細胞死を抑制し、軸索再生を増加させ、SCI後の機能回復を改善することが示されている。
フィンゴリモドは、スフィンゴシン1リン酸受容体S1P1を標的とした経口効果のある免疫抑制剤で、再発寛解型多発性硬化症の治療に臨床的に使用されている229.230。230 S1P1の内在化を誘導し、リンパ球をリンパ節に隔離することで、リンパ球の循環人口と組織への輸送を減少させる231, 232 多発性硬化症や他の自己免疫疾患に加えて、フィンゴリモドの治療効果は、他の多くの神経変性疾患や中枢神経系損傷においても報告されている。脊髄損傷に対しては、フィンゴリモドを全身投与することで、神経炎症を抑制し、運動機能や膀胱機能を改善することができる233, 234。フィンゴリモドを局所投与することで、反応性グリオーシスを抑制し、神経細胞死を防ぎ、脊髄損傷後の運動機能回復を改善することができる235。フィンゴリモドをTBI後1時間から3日間連続して投与すると、20種類ものサイトカイン/ケモカイン、浸潤したT細胞およびNK細胞が有意に減少し、制御性T細胞の割合と抗炎症性IL-10の濃度が増加した 236 フィンゴリモドは、TBI後の全般的なミクログリアの活性化、BBB損傷、軸索損傷を抑制し、神経機能を改善する。236 フィンゴリモドは、ミクログリアの活性化、BBB損傷、軸索損傷を抑制し、TBI後の神経機能を改善する。臨床応用が広く行われ、治療効果が広く報告されていることから、フィンゴリモドやその他の免疫抑制剤は、T細胞のトラフィッキングや滲出を標的とした中枢神経系損傷の治療に有望である237。
しかし、適応免疫反応は、中枢神経系損傷後の神経回復を助ける保護的自己免疫としても機能する可能性がある。238, 239 保護的自己免疫では、適応免疫細胞(特にT細胞)が自己構成要素を認識し、自己反応性の反応を増強する240, 241 前臨床試験において、ミエリン塩基性タンパク質に由来する合成ペプチドA91を免疫すると、SCI後に強い神経保護効果を示した。240, 242 しかし、臨床治療に移す前に、このペプチドの安全性、投与量、スケジュールを検討する必要がある。
挑戦的な問題と将来の方向性
自然免疫反応と適応免疫反応の両方が、TBIとSCIの両方の二次障害の進行に重要な役割を果たしている。いくつかの免疫調節戦略は、今後数十年以内に患者に導入される可能性が高い。しかし、将来の研究のために、いくつかの挑戦的な問題に取り組んだり、調査したりすることが可能である。中枢神経系と免疫系の境界に位置する巡回免疫細胞、特にT細胞と単球は、生理的状態と病的状態の両方で重要な役割を果たしている(図1)。現在のところ、多くの未知の機能が解明されていない。例えば、髄膜免疫細胞の特異性や多様性は、どのような因子や分子機構によって決定されるのか?また、これらの髄膜免疫細胞は、病的状態においてどのようにして中枢神経系実質に侵入するのか?常駐免疫細胞と侵入免疫細胞の間のクロストークは、初期の炎症性損傷と後期の神経回復プロセスにどのように貢献しているのか?中枢神経系における自然免疫細胞と適応免疫細胞の様々なサブタイプが特定されている。これらのサブタイプの特徴や機能、そしてサブタイプの相互変換の基礎となるメカニズムは、まだ明確にされていない。最も重要なことは、中枢神経系損傷後に自然免疫応答と適応免疫応答が有益または有害な役割を果たすためのタイミング/ウィンドウと通過プロセスは何かということである。中枢神経系損傷後の不適応な免疫反応を、好ましい創傷治癒反応に導くためには、新しい免疫治療薬が必要である。中枢神経系損傷後、末梢の免疫系は免疫抑制を示すが、T細胞の疲弊が中枢神経系内で起こり、慢性的な損傷中の神経変性や神経回復に影響を与えるかどうかは、まだほとんど分かっていない。
