Contents
pubmed.ncbi.nlm.nih.gov/36718314
Med Hypotheses.2023 Feb; 171: 111015.
オンライン公開 2023年1月25日
pmcid: pmc9876036
PMID:36718314
K.アセベド=ウィテハウスa,⁎とR.ブルノブ
要旨
合成mRNAの治療応用は30年以上前に提案され、現在、COVID-19を制御するための公衆衛生戦略の一環として大規模に使用されているワクチンプラットフォームの1つの基礎となっている。
現在までに、合成mRNAの生体内分布、細胞への取り込み、エンドソームからの脱出、翻訳速度、機能的半減期、不活性化速度、異なる細胞種におけるワクチン誘発抗原発現の速度や期間に関する研究発表はない。
さらに、治療用合成mRNAのゲノム統合の可能性はないという仮定にもかかわらず、ワクチンmRNAとトランスフェクト細胞のゲノムとの相互作用を調べた最近の研究は1件のみで、内因性レトロトランスポゾンであるLINE-1はmRNAが細胞に入った後にサイレンス解除され、完全長ワクチンmRNA配列の逆転写と核内侵入につながることを報告している。
この発見は、合成mRNAに起因するエピジェネティックおよびゲノム修飾が生じる可能性を考慮すると、安全性に関する大きな懸念となるはずだ。
私たちは、感受性が高い人において、ヌクレオチド修飾合成(nms-mRNA)の細胞質クリアランスが阻害されることを提案する。nms-mRNAが細胞質内に持続的に存在すると、内因性トランスポーザブルエレメント(TE)が制御され活性化され、mRNAコピーの一部が逆転写される。nms-mRNAと逆転写されたcDNA分子の細胞質への蓄積は、RNAとDNAの感覚経路を活性化する。
これらの同時活性化により、非自己核酸に対する同調した自然反応が始まり、I型インターフェロンや炎症性サイトカインの産生が促され、これが制御されないと自己炎症および自己免疫疾患につながる。
そして、感受性が高い人は、DNA損傷、慢性的な自己炎症、自己免疫、癌のリスクが高まることが予想される。
現在、nms-mRNAワクチンの大量投与が行われていることから、合成mRNAの細胞内への取り込みによって開始される細胞内カスケードと、これらの分子事象の結果を完全に理解することが不可欠かつ緊急の課題となっている。
キーワード
自己免疫、自己炎症、DNA損傷、内在性トランスポーザブルエレメント、ゲノム統合、IFN、LINE-1、mRNAワクチン、nms-mRNA、TREX-1
はじめに
外因性mRNAは、1990年に初めて治療や予防に使用することが提案された[1][2][3]。それ以来、RNAを用いた新規治療薬の開発に対する関心は高く、また高まっている。現在、メッセンジャーRNA(mRNA)と低分子干渉RNA(siRNA)という2種類のRNAベースの技術が、がん免疫療法、タンパク質置換療法、ゲノム編集、ワクチン接種などに臨床応用されている。この技術を取り巻く中心的な考え方は単純で、mRNAベースのアプリケーションでは、欠損または変化したタンパク質の正常なバージョンを合成することによって体性欠陥を修正する遺伝的指示を伝達したり[1]、特定の免疫応答を誘導する抗原性タンパク質を作成する指示を伝達することができる[4]。一方、siRNAベースのアプリケーションでは、配列特異的に病気関連遺伝子を沈黙させる[5]。COVID-19のパンデミック以前に、米国食品医薬品局(FDA)または欧州医薬品庁(EMA)から臨床承認を受けたRNAベースの治療薬は、4つの合成脂質ナノ粒子(LNP)-mRNAまたは化学修飾siRNA薬(patisiran、givosiran、lumasiran、inquisiran)だけだった[5]。これらは、急性肝ポルフィリン症、I型高酸素尿症、ヘテロ接合性家族性高コレステロール血症、遺伝性トランスサイレチン介在性アミロイドーシスなどの珍しい疾患の治療薬として市販されている。
mRNAを使用して病原体に対する特異的な免疫応答を生成できることが初めて示されてから30年近くが経過したにもかかわらず、COVID-19パンデミック以前は、ヒトに使用するmRNAに基づくワクチンは、前臨床試験や臨床試験で開発・試験されただけだった[6]。2020年、COVID-19パンデミックの結果、mRNAベースのワクチンは前例のないスピードで開発された。1年足らずで、2つのmRNAベースのCOVID-19ワクチンが設計、製造、試験され、ヒト集団への一般的かつ広範囲な使用が許可された。緊急の公衆衛生状況下では、迅速な決断が求められることが多く、必然的に最低限必要な情報に基づかないものもある。しかし、緊急事態の如何にかかわらず、決して手を抜いてはならないものがあり、特に、見過ごすと人間の健康に深刻な影響を与える可能性があるものは、絶対に手を抜いてはならない。言い換えれば、緊急時の公衆衛生対策であっても、primum non nocere(まず害を与えるな)という基本的な前提に従うべきである。予防や治療のための薬理学的介入は、その使用に伴う潜在的な副作用を一つ一つ考慮すれば、すべて両刃の剣であると主張することができるが[9]、COVID-19 mRNAワクチンの接種に同意する前に、受領者は、即時および長期安全性について何がわかっていて何がわかっていないかについて必ず知らされなければならない。このことは、ワクチン認可後すぐに医学・科学界に明示的に喚起されたが[10],[11]、少なくともほとんどの国では組織的に行われていない。
COVID-19ワクチンが臨床疾患を悪化させるリスクについて、ワクチン試験対象者にインフォームドコンセントで開示する。
抗体依存性増強(ADE)のリスクは、現在行われているCOVID-19ワクチンの臨床試験のプロトコルや同意書では十分に隠されており、このリスクを患者が十分に理解することは難しく、これらの試験における被験者の真のインフォームドコンセントを妨げている。
本研究から導かれた結論と臨床的意義: インフォームド・コンセントのための患者理解という医療倫理基準を満たすために、現在ワクチンの治験を受けている研究対象者、治験に募集している研究対象者、ワクチン承認後の将来の患者に対して、ADEの特異で重大なCOVID-19リスクは顕著に、かつ独立して開示されるべきであるし、されるべきだった。
SARS-CoV-2の集団予防接種:国際保健機関、規制当局、政府、ワクチン開発者に回答を求める、ワクチンの安全性に関する緊急の質問
現在までに報告されている副作用の高い発生率や、ワクチンによる疾患増強、Th2免疫病理、自己免疫、免疫回避の可能性を考えると、特に臨床試験から除外されたグループにおける大量接種の利点とリスクについて、よりよく理解する必要がある。
SARS-CoV-2ワクチン接種のリスクは、注意を促す声にもかかわらず、医療機関や政府当局によって最小限に抑えられたり無視されたりしてきた。あらゆる治験用生物医学プログラムと同様に、データ安全監視委員会(DSMB)と事象判定委員会(EAC)は、リスク軽減を実施する必要がある。
もしDSMBやEACがそれを行わないのであれば、私たちは集団予防接種の一時停止を要求することになるだろう。もしDSMBやEACが存在しないのであれば、これらの委員会を集め、批判的で独立した評価を開始するのにかかる時間の間、特にワクチンに関連した死亡や重篤な副作用のリスクが最も高い人口集団に対して、ワクチン接種を直ちに停止すべきである。
ヌクレオシド修飾合成mRNA(以下、nms-mRNA)の安全性プロファイルは、完全に理解されているとは言いがたい。合成mRNAの生体内分布、細胞への取り込み、エンドソームからの脱出、翻訳速度、機能的半減期、不活性化速度、異なる細胞種におけるワクチンによる抗原発現の速度および期間、ならびに宿主ゲノムとの潜在的相互作用を評価する試験は迂回された。承認された2つのmRNA COVID-19ワクチンに含まれるようなnms-mRNAを導入する際の安全性に関する大きな懸念の1つは、このような修飾が最終的に分裂中および非分裂中の細胞におけるエピジェネティックおよび/またはゲノム修飾につながるという可能性である。残念なことに、情報が不足しているにもかかわらず、これらのワクチンプラットフォームのリスクとベネフィットを扱ったほとんどの科学的レビューは、その高い安全性を強調し(例えば[12]、[13]、[14])、プラスミドDNAベースのワクチン[17]や一部のベクター化ワクチン[18]、[19] で(頻度は低いものの)起こりうるにも関わらず、これらのワクチンにはゲノム統合のリスクがないとしている[15],[16].しかし、合成mRNAワクチンであるCOVID-19が認可され、大量導入される以前は、私たちの知る限り、mRNAワクチンの摂取によるエピジェネティック現象(クロマチン構造の変化など)、再転写されたnms-mRNAの染色体統合、遺伝毒性、発がんの可能性について実験的に検証した論文は一つもなかったことを理解する必要がある。ワクチン認可後の14カ月間、これらの可能性の一つを検討した査読付き研究は、ワクチンnms-mRNAが内因性トランスポーザブルエレメント(TE)の発現を活性化し、逆転写を受けて細胞核に入ることを示した、私たちが知る限りたった一つの研究である[20]。
設計中のCOVID-19ワクチンの安全性懸念の軽減に焦点を当てた、疫病対策イノベーション連合(CEPI)とブライトン共同研究(BC)の緊急ワクチン安全性プラットフォーム(SPEAC)の科学ワーキングミーティングの2020年初頭の合意報告書では、nms-mRNAの潜在的遺伝毒性に関する研究の証拠を提示せず、このテーマに関する研究の欠如に対する懸念を表明しなかった([21]参照)。では、COVID-19の免疫に使用されたnms-mRNAに基づくワクチンは宿主ゲノムに挿入することができないという主張を支持する科学的証拠は何なのだろうか?ワクチン接種者の細胞に遺伝毒性や発がん性に関連する有害作用が期待できないことを示した科学的根拠は何だろうか?合成mRNAワクチンの安全性に関する査読付き文献を徹底的にレビューすると、すべての論文が引用文献を示さずに高い安全性に言及しているか、あるいは、外来mRNAは非統合プラットフォームであり、「[…]や挿入型変異原性の潜在リスクはない」とする最近のレビュー研究[22]を引用しているが、その主張を裏付ける科学的根拠は示されていない。実際、生体内試験前臨床で使用可能なmRNAワクチンのリストを示すレビュー論文で引用された38の研究のうち、遺伝毒性または潜在的な発がん性を調査したものは1つもなかった。同様に、引用されたヒト臨床試験中または終了した8つのmRNAワクチンのすべてについて、そのような研究は行われていなかった[22]。
2020年12月の最初の配備後、COVID-19 mRNAワクチンは、世界中の多くの国の個人に広く配布されている。この論文を書いている時点で、世界保健機関(WHO)のデータ1によると、これまでに7億8200万回以上のmRNAワクチンが投与された。WHOによると、平均して1.69回接種されていることを考えると1、接種回数からすると4億6200万人以上の人が少なくとも1回はnms-mRNAワクチンを接種していることになる。さらに、nms-mRNAワクチンは、他の感染症や非感染症から守るために現在開発中である[23]。このようなワクチンの大量投与を考慮すると、潜在的な安全シグナルを特定し、そのような事象を引き起こすメカニズムを理解し、それに応じて推奨事項を調整することは、科学や医学界から期待されているだけでなく、必須である。
仮説
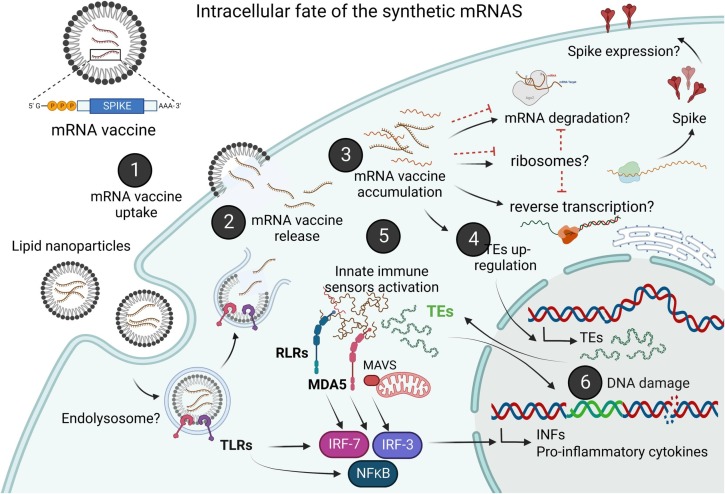
遺伝的あるいは生理学的に感受性が高い個体では、nms-mRNAのクリアランスが阻害されるという仮説がある。細胞質内にnms-mRNAが持続的に存在すると、内因性のトランスポーザブルエレメント(TE)が制御され、ワクチンmRNAの逆転写が起こる。nms-mRNAと逆転写されたcDNA分子の細胞内蓄積は、内在性細胞質RNAおよびDNA感知経路を誘発する。これらの経路が同時に活性化されると、非自己核酸の両タイプに対する協調的な自然反応が始まり、I型インターフェロンと炎症性サイトカインの産生が促され、これが制御されないと自己炎症性疾患や自己免疫疾患につながる。活性化したTEは、再転写されたワクチンmRNAの挿入変異誘発のリスクを高め、コード領域を破壊し、腫瘍抑制遺伝子の変異のリスクを高め、持続的なDNA損傷につながる可能性がある。私たちの仮説を図1にグラフで示した。
図1 私たちの提案する仮説の模式図
ワクチンの細胞内送達(1) 後、ワクチンnms-mRNAは脂質ナノ粒子から細胞質に放出され(2)、細胞質に蓄積される(3)。このとき、TE発現が不活化され(4)、RLRs、RIG-I、MDA-5、TREX1などの異物RNAや細胞質DNAセンサーが起動し、炎症性サイトカインやIFNタイプの発現が増強される(5)。TE活性は、挿入型変異誘発やゲノムの不安定化を介してDNA損傷を引き起こし、炎症性サイトカインやI型IFNの発現を促進する可能性がある(6)。インフラマソームの活性化は、cGAS-STINGを介したI型IFN産生を阻害するため、I型IFNがインフラマソームを阻害し、活性化したインフラマソームがI型IFN産生も阻害するという慢性制御回路を確立する制御的役割も持っていると考えられる(図には記載なし)。
仮説の評価
合成mRNAの生来的認識と細胞内運命
ウイルス感染時、自然免疫による外来RNAの検出を仲介する細胞内感知経路は、エンドソームのtoll-like receptor (TLR) 3, 7, 8と細胞質のRIG-I-like receptor (RLRs) である。RLRファミリーは、レチノイン酸誘導性遺伝子I(RIG-I)、メラノーマ分化関連遺伝子5(MDA-5)、laboratory of genetics and physiology 2(LGP2)遺伝子の3メンバーからなる[24]。活性化したRLRは、ミトコンドリア抗ウイルスシグナル伝達タンパク質(MAVS)と結合し、TBK1およびIKKキナーゼをアップレギュレートし、転写因子NF-κB、IRF-3、およびIRF-7を活性化する。これらの因子が活性化すると、核に移動し、I型インターフェロン(IFN)や炎症性サイトカインの誘導的産生を含む強力な反応を開始する。これらの分子は、他のいくつかの遺伝子の発現を上昇させ、その多くは外来核酸の分解など、顕著な抗ウイルス作用を持つ[25],[26].I型IFNを誘導するだけでなく、RLRとMAVSはアポトーシスを活性化し、感染細胞の自己破壊を促進する[27]。
ウイルスRNAはまた、ヌクレオチド結合ドメイン、ロイシンリッチリピート含有タンパク質(NLRs)NLRP3インフラマソームの活性化を介して細胞死を引き起こし、IL-1βなどの炎症性サイトカインを誘導することができる[28]。さらに、特定の細胞系では、RNASE L、IFN誘導性dsRNA依存性プロテインキナーゼR(PKR)、アポリポプロテインB mRNA編集酵素触媒ポリペプチド(APOBEC3G)、トリパーサイトモチーフ含有タンパク質(Trim) TRIM5αなどの細胞内在性抗ウイルス因子があらかじめ存在している、Tetherin/BST-2、SAMHD1、TREX1、IFITM、およびIFITファミリータンパク質は、IFN反応の開始前であっても、ウイルス成分に結合してウイルス複製を直接ブロックすることができるが、これらの因子のほとんどは、IFNによってさらに誘導されて抗ウイルス効果を増幅できる[29],[30],[31].
ウイルス性RNAとは対照的に、ワクチンnms-mRNAは、ヌクレアーゼ分解からの安定化と保護、細胞質半減期の延長、小型リボソームサブユニットへの結合促進、および翻訳効率の向上を目的として、核酸塩基N1-methylpseudouridine (m1Ψ)[32]を組み込んで修飾されている[33].細胞内に蓄積されたnms-mRNAが、ウイルス性RNAで起こるのと同様に細胞質センサーを活性化できるかどうかは、これまで深く研究されてこなかった。このテーマで発表された数少ない研究の一つは、ヌクレオチドが修飾されたRNA分子は、RIG-I様自然免疫活性化経路の初期シグナルを妨害し、シュードウリジンを含むRNAはRIG-Iに結合するが、強固な自然免疫シグナルに関連する正規のRIG-I構造変化を引き起こさないことを示している[34]。しかし、nms-mRNAが自然免疫受容体の認識を介してIFN依存性の免疫応答を誘導することができると考えるのは妥当である[35],[36],[37].例えば、MDA-5はウイルス性RNAを認識するだけでなく、合成RNAや内因性RNAも認識し[38]、一本鎖のdsRNAにも結合することができる[39]。非修飾の外来mRNAが宿主RLRに結合すると、ワクチン導入細胞で「抗ウイルス状態」をもたらす自然免疫経路が活性化し、外来mRNAの細胞内安定性と翻訳速度が低下するという証拠がある[40]。しかし、現在のワクチンのnms-mRNAについては、このようなことはないようだ。現在、ワクチンの腋窩リンパ節の胚中心内で、接種後少なくとも60日間は修飾核酸を検出できることが知られている[41]。
核酸の細胞内センサーの認識モチーフとなるパターンについては多くのことが分かっているが、現在市販されているmRNAワクチンに含まれるnms-mRNAの認識については、まだ本格的に理解されていない。RIG-Iの細胞質RNAの認識シグナルは、遊離の5′-三リン酸である[42],[43].化学的に合成されたRNAを用いた追加の研究では、RIG-Iによる免疫刺激活性には、RNA配列そのものよりも、RNAリガンドの遊離5′-三リン酸末端に近接する10〜20ヌクレオチドの範囲の塩基対領域が必須であることが分かった[44],[45]。同様に、MDA5の活性化、およびシグナル伝達アダプターであるMAVSの関与の重要な決定要因と考えられているのは、RNA配列ではなく、RNAの長さと二次構造である[46],[47]。
IFNを直接活性化するのではなく、細胞内制限因子がIFN反応の開始前からsmn-mRNAを検出し翻訳を阻害することで、RNA認識を自然免疫反応の最初のトリガーの1つとする可能性がある。これらの制限因子の中には、IFN誘導型四級ペプチド反復配列タンパク質(IFIT)細胞質タンパク質がある([29]、[48]で概説)。IFITタンパク質は、IFN非依存的な経路で発現することができ、5′-三リン酸(5′-ppp)部分を含むウイルスRNAを認識したり[49]、2′-O-メチル化を欠く[50]ことができる。言い換えれば、IFITは、ウイルスRNAに見られるが、細胞のmRNAには存在しない特定のRNAモチーフを認識し、IFITタンパク質が5′-pppウイルスRNAに直接結合すると、IFN活性化を必要とせず、ウイルスの翻訳と複製を阻害する。したがって、ワクチン摂取後のnms-mRNAの細胞内蓄積と持続は、他のRNAセンサーの中でもMDA-5とIFITファミリータンパク質を直接活性化し、合成RNAに対する組織的自然免疫反応を開始し、慢性的な「抗ウイルス細胞状態」に導くと考えるのは妥当である。
RLRによるウイルスゲノムおよびサブゲノムRNAモチーフの認識について何が分かっているかに関わらず[51]、nms-mRNAが細胞内RNAセンサーとどのように、そしてどれくらいの期間相互作用するかは依然として不明である。細胞質内で高度に安定化したnms-mRNAの運命を理解することは不可欠だが、まだ未解明であり、nms-mRNAワクチンの緊急使用承認やヒトへの使用承認前には検討されなかった。同様に、免疫認識をさらに変化させ、免疫シグナル伝達経路を調節しなくなる可能性のある、切断された。mRNA、短いdsRNA断片、およびその他の汚染物質がワクチン内に存在するかどうかも、私たちの知る限りでは検討されていない[52]。
bmj.com/content/372/bmj.n627.long
欧州医薬品庁(EMA)は、12月にPfizer-BioNTech社のcovid-19ワクチンの分析を行っていたところ、サイバー攻撃の被害に遭った。BMJ誌はこの文書を検討し、規制当局が商業生産用に開発されたワクチンのバッチに含まれる無傷のmRNAの量が予想外に少なかったことに大きな懸念を抱いていたことを明らかにした。
しかし、mRNA-nanolipidワクチン化合物の広い生体内分布[53]、および合成修飾mRNAの翻訳能力の向上と持続性を考慮すると[33]、mRNAベースのワクチンは、様々な組織において持続的な炎症と持続的な抗ウイルス細胞状態を誘導できると考えるのは無理のない話である。ここで仮定された分子事象の生物レベルの結果については、本論文で後述する。
外来RNAの逆転写とゲノム統合
一般に、RNAウイルスのゲノムは宿主のゲノムに統合することはできないと信じられていた。しかし、エボラウイルス、マールブルグウイルス[54]、水疱性口内炎ウイルス、リンパ球性絨毛膜炎ウイルスなど、いくつかのウイルスについて、ヒトや他の哺乳類の宿主において、非レトロウイルス性サブゲノムウイルスRNAの宿主細胞への統合の証拠が報告されており[55],[56],[57], ヒトレトランスポゾンによって非レトロウイルス性RNAゲノムが逆転写されて、その後、ゲノム挿入できるものと現在考えられている[56].SARS-CoV-2のRNAは、感染性ウイルスを排出していない多くのCOVID-19回復患者から数ヶ月間検出されており、ワクチン接種後にLong-COVIDの症状を示した50人のコホートを追跡した研究のプレプリントでは、同様の所見が報告されている[59]。この現象の説明として、SARS-CoV-2ゲノムの一部が、感染した体細胞内で逆転写とゲノム統合を受け、統合された配列の持続的な転写につながった可能性が提案された。最近の論文では、トランスフェクトされたヒト細胞内でSARS-CoV-2配列の逆転写コピーの存在を検出し、統合されたサブゲノムSARS-CoV-2セグメントの活発な転写を発見した試験管内試験研究によってこの仮説が確認された[60].統合された配列はSARS-CoV-2ゲノムの3′末端にしか対応していないことから、このようなゲノム挿入の結果、生存可能な感染性ビリオンを生成することはできないが、分析した2人のCOVID-19患者の様々な組織でウイルス-ホストキメラ転写体が観察された[60]。
mRNAワクチンを考える場合、現在のパラダイムでは、合成RNAはワクチン接種者の細胞のゲノムに統合することはできないとされている。しかし、肝がん細胞を用いた最近の研究[20]では、Pfizer/BioNTechワクチンmRNA BNT162b2が、ヒト細胞の細胞質内で逆転写を受け、ゲノムトランスポーザブルエレメント(TE)であるLINE-1の活性化によって核内に侵入することが示された。ゲノムTEは、内在性レトロウイルス(ERV)、長点間核要素(LINE)、短点間核要素(SINE)、DNAトランスポゾンからなり、活性化すると、自身または他の配列をコピーして、そのコピーをゲノムに挿入する繰り返し配列である[61]。ゲノムの不安定性の原因となるため、初期胚発生期を除く哺乳類の体細胞の大部分で抑制されており、TEの異常発現は、がんから自己免疫疾患まで様々な疾患と関連している[62]。
ヒトTEは、ウイルスが細胞内に侵入した後、最も早く制御が解除される宿主要素の一つであり、その活性は抗ウイルス遺伝子発現、特にIFN-β[63]とIFN-γ[64]を著しく増強する。活性は、シス作用するエンハンサー・プロモーターを介して、あるいは自然免疫センサーが細胞質で転写されたTE配列をウイルスRNAとして誤認することで生じる。マウスやヒトで行われた研究によると、ウイルス感染の過程でERVやLINEの発現が変化し、抗ウイルス遺伝子、免疫応答遺伝子、主要組織適合性複合体(MHC)遺伝子のアップレギュレーションが先行することから、アップレギュレーションしたTEが、保存されている初期の細胞内宿主防御応答の重要な構成要素であることが示唆されている[63]。細胞はまた、TEが採用するウイルスRNAに似たdsRNA構造を異常に認識し、I型IFN応答を引き起こすことができる。ヒトでは、LINE-1成分は、RIG-IとMDA-5を介したRNA感知経路の活性化を介して自然免疫シグナルを引き起こし、IFN発現をアップレギュレートし[65]、異物RNA感知と遺伝子制御を介して炎症反応を開始する[66].TEを介したIFN活性化は、構成的なI型IFN活性化、癌、および細胞老化によって特徴付けられる自己免疫疾患の発症において役割を果たす([67]によりレビュー)。
Zhangら[60]は、統合されたSARS-CoV-2ゲノム配列の両端に隣接して、ヒトLINE-1エンドヌクレアーゼ成分のコンセンサス認識部位を検出したことから、観察された現象は、少なくとも部分的にはLINE-1の関与によるものではないかと提案した。LINE-1は、ヒトを含む哺乳類のゲノム内に非常に多く存在し[68]、1億6000万年以上にわたってコピーを増幅してきた[69]。ヒトゲノムに含まれる50万コピーのLINE-1のほとんどは、切断された繰り返しやレトロトランスポジションに影響を与える変異を持つコピーとして存在している[70]。しかし、セルフコピーして他のゲノム領域にトランスポーズすることができる完全長コピーがおよそ150個存在する[71]。このシス効果はLINE-1がサイレンシングされていない細胞では一般的だが、あまり一般的ではないが、LINE-1が発揮するトランス効果もあり、それは他の遺伝子配列の逆転写と挿入をもたらす[72]。
生殖細胞系列やヒトのほとんどの体細胞において、LINE-1活性は通常、低分子干渉RNA(siRNA)を介した遺伝子サイレンシング[73]、ヒストンおよびDNAメチル化[74]、APOBEC3[64]およびSAMHD1[75]、[76]の酵素活性などの異なる分子機構により抑制されている。しかし、着床に先立ち、内細胞塊と外胚葉細胞はデノボな内因性LINE-1挿入を示し[77]、胚性幹細胞と多能性幹細胞を用いた試験管内試験の研究では、レトロトランスポジションを引き起こす内因性LINE-1の転写と翻訳について述べられている[78].これは、胚発生の初期段階では、細胞環境がLINE-1の活発なレトロトランスポジションをサポートし[79]、胚の体細胞はLINE-1のレトロトランスポジションの分子制限をダウンレギュレートするためで、おそらくLINE-1活性が体細胞モザイクの生成に重要な役割を果たすためと考えられる[80]。興味深いことに、出生後の生物では、神経細胞やグリア細胞などの一部の細胞タイプでは、LINE-1活性の制限が少なく、神経系の体細胞ゲノム変異につながり[70],[81]、これは神経発生に寄与しているが、LINE-1活性が異常に高い場合には神経精神疾患にもなる[83]。LINE-1は現在、成熟したTリンパ球でも活性があることが知られており、T細胞の静止と疲弊を制御する役割を担っている[84]。
Zhangら[60]が報告した結果に基づき、ワクチンmRNAでも逆転写と核内移行という同じ現象が観察されるかどうかを調べた独立した研究がある。ヒト肝細胞株(Huh7)とPfizer/BioNTech mRNAワクチンを用いて、Aldénら[20]は、実際に、外来mRNAがLINE-1の両ORFを活性化し、SARS-CoV-2 スパイクプロテインをコードする全長ワクチンmRNA(BNT162b2)の逆転写と核移行が起こることを発見した[85]。逆転写はワクチン曝露後わずか6時間で起こり、逆転写されたBNT162b2 cDNAは細胞核に入ることが確認された[20]。この実験に肝細胞株を選んだのは意図的なものであった:Pfizer/BioNTech社のmRNAワクチンの薬物動態に関する報告では、接種部位に次ぐ高濃度のワクチンmRNAが接種後数時間後に肝臓で検出されたことが明らかにされている。さらに、ラットやマウスで実施された脂質ナノ粒子mRNAデリバリーシステムの研究では、一過性の肝毒性の証拠が示され[86],[87],[88]、nms-mRNAワクチンの安全性の懸念となりうることが示唆された。Aldénら[20]が報告した結果は、この研究が癌細胞株を用いて行われ、LINE-1は癌細胞で転写活性化する傾向があることを考えると、一般化すべきではない[89]。しかし、BNT162b2のmRNAを投与したがん細胞では、生理食塩水のみを投与したがん細胞よりもLINE-1の転写とタンパク質発現が高かったことから[20]、ワクチンmRNAの逆転写と核内転位は、がん細胞株でLINE-1がすでに活性化していたためではないことが示唆された。つまり、現在までのところ、mRNAワクチンを接種した人の体細胞で同じ現象が起きないとする科学的に有効で生物学的に適切な理由はないのである。
LINE-1を介した炎症
TE発現の宿主ゲノムサイレンシングは、ほとんどの非胚発生組織において、ゲノム損傷だけでなく、時機を逸した炎症または持続的な炎症を防ぐために重要である。LINE-1レトロトランスポゾンの発現を抑制できなかった場合、LINE-1の遺伝子座特異的コピーの発現が増加し、IFN活性化に関連した炎症シグネチャーを伴うことになる[90]。しかし、前述のように、外来RNA(すなわち、ウイルス性または合成)に細胞内がさらされると、TEが再活性化し、TEを共用して「抗ウイルス状態」を開始することが明らかになりつつある。TEsの活性化は、SARS-Cov-2感染で起こることが知られており[91]、他のRNAウイルス[92],[93],[94], [95], DNAウイルス[96]の感染でも、異なる細胞型や宿主種で観察されているのと同様であった。
活性化されたTEは、シス作用するエンハンサー機能を介して、またはssRNA、dsRNA、合成RNA、細胞内RNAを検出できるRIG-IやMDA-5などのパターン認識受容体[24]によってウイルスモチーフとして認識されることにより、抗ウイルス遺伝子発現を刺激すると考えられる[97]。さらに、転写されたTE配列はdsRNAを形成することができ、そのdsRNAは、先に述べたようにパターン認識レセプターによって認識され、持続的な抗ウイルス、炎症性細胞状態を引き起こすことができる[98]。これは、自己免疫疾患や自己炎症性疾患の発症につながる可能性がある[99]。したがって、安定化し持続するワクチンnms-mRNAは、生体内分布後にワクチンにさらされた組織において炎症を促進し持続させる可能性があると考えるのが妥当である。LINE-1活性による自然免疫反応の慢性的な活性状態が生じ、逆転写、核内取り込み、再転写配列のゲノム統合が維持・促進されるであろう。言い換えれば、ワクチンnms-mRNAの投与により、深刻な臨床結果をもたらす分子悪循環が生じ、投与するたびに悪化する可能性が最も高い。
LINE-1が介在するDNA損傷とp53遺伝子変異
コピーされた配列のLINE-1転置にはゲノムDNAの両鎖の切断(DSB)が必要であることから、その活性を抑制しないと生殖細胞や体細胞で二本鎖DNA切断を引き起こす可能性がある[100].多くの癌細胞において、LINE-1活性は、特に乳癌、卵巣癌、子宮内膜癌、大腸癌などの発癌の鍵となるp53変異やコピー数の変化[89]と相関があることが知られている。他の組織も同様に影響を受ける可能性がある。例えば、C型肝炎ウイルス(HCV)細胞の形質転換に関する研究では、HCVの慢性感染による炎症の持続の結果、LINE-1の発現が発癌性形質転換の前に活性化され、ウイルスの排除後も、沈黙していないLINE-1が肝細胞癌のゲノム不安定性に寄与することが示された[101]。LINE-1の発現を試験管内試験で誘導すると、DSBの調整と感知、DNA損傷応答経路の開始に重要な触媒的タンパク質複合体であるMRN複合体メンバーRAD50[89]のリン酸化が増加した[102].したがって、期待されるワクチンターゲット(樹状細胞、リンパ節、筋肉細胞など)および意図されないワクチンターゲットである体性組織(例:.肝臓、副腎、脾臓、卵巣、および脳)[53]は、これらの組織における遺伝毒性および発癌のリスクを高める可能性があり、TE配列の新しい挿入コピーは、連続する各細胞世代に伝達されて体細胞ヒトゲノムを変更することができることを考えると[103]、持続するワクチンmRNAからのLINE-1の持続的活性が発癌に重要であると考えられる。前述したように、リスクは接種を受けるたびに増加すると考えられる。これらの分子現象は、グリア細胞[70],[81],Tリンパ球[84], 老化細胞[104]など、もともとLINE-1が多く発現している意図したワクチン標的細胞や意図していない細胞、またDNA損傷修復機構が低下した細胞でより頻繁に起こることが予想される。特に、細胞性適応免疫応答が抑制されていたり、最適でない個体や、LINE-1活性が異常に高い神経精神疾患患者では、感受性が高くなるであろう[83]。さらに、SARS-CoV-2 Spike遺伝子を導入した細胞は、DNA損傷に対する反応の増大、ROS産生、老化した細胞状態を示し、それが、隣接細胞のパラクリン老化や内皮機能障害につながることがすでに示されている[105]。この研究の著者らは、ワクチン接種後の抗原刺激期間が短いと予想されるため、ワクチン接種者が同様の効果を示すには不十分かもしれないと推測しているが、nms-mRNAとそのコード化タンパク質はともに数週間生存し発現することが現在知られており[41]、このような効果が実際に広まることはもっともなことであると考えられる。
細胞質に蓄積されたDNAが炎症反応を活性化させる
外来RNAの認識に加え、細胞質DNAもIFN刺激性DNA(ISD)反応と呼ばれるシグナル伝達カスケードによって検出されることがある。この感覚経路は、外来RNAの認識に関与するのと同じ転写因子であるインターフェロン制御因子3(IRF3)を介して強力なI型IFNの産生を活性化する[106]。本稿の前半では、安定化した細胞質nms-mRNAが持続することで生じると考えられる分子カスケードを説明した。次に、再転写されたワクチンDNAが細胞質に蓄積されることによって生じるであろう運命と生物学的影響について説明することにする。
環状GMP-AMP合成酵素(cGAS)は、ウイルス、細菌、ミトコンドリア、小核、内在性レトロエレメントのDNAなどの細胞質二本鎖DNAを結合する主要な細胞質免疫センサーである。cGASの活性化により、環状ジヌクレオチド環状GMP-AMP(cGAMP)が生成され、これがインターフェロン遺伝子の刺激因子(STING)を介してI型インターフェロン応答を活性化する。STINGシグナルはNF-κBの転写活性化を引き起こし、I型IFNであるIFN-αやIFN-βを含む炎症性サイトカインの合成を開始させることができる[107]。したがって、cGAS-STING経路は、外来DNAに対する免疫防御と腫瘍由来DNAに対する免疫防御を仲介している[108],[109].しかし、細胞質に漏出した自己DNAや、蓄積した自己DNAを除去できなかったことによるcGAS-STING経路の異常な活性化は、自己炎症性疾患や自己免疫疾患の原因となり、腫瘍形成を促進することもある[109],[110].このため、I型IFNや炎症性サイトカインをアップレギュレートする核酸センサーの自己DNAによる活性化を防ぐためには、蓄積した細胞質非生産的逆転写DNAやL1レトロトランスポゾン、LTR内在性レトロウイルス、SINE要素などの内在性レトロエレメント由来の断片を適切に取り除くことが不可欠である。
Hanと共同研究者[111]は最近、N遺伝子内の代替ORFによってコードされるSARS-CoV-2 ORF9bが、RIG-I/MDA5-MAVSシグナルの細胞質dsRNA感知経路によって誘導されるI型およびIII型IFNの活性化を阻害することによって抗ウイルス免疫を負に制御すると発表した、また、SARS-CoV-2感染は、細胞質DNA感知経路のタンパク質であるTRIFとcGAS-STINGシグナルカスケードのタンパク質であるSTINGによって、それぞれI型とIII型のIFN誘導を抑制することができることが明らかになった。驚くべきことに、cGAS-STING経路は、DNAウイルスではなくRNAウイルスによって引き起こされる病気であるCOVID-19の重症例における異常なI型IFN応答の重要なドライバーとして最近報告されている[112]。核とミトコンドリアにおける細胞DNAの厳格な区分けは、自己DNAを感知しないために必要であることを考えると、SARS-CoV-2感染後の細胞質免疫刺激DNAのソースはまだ不明だが、感染後のLINE-1による逆転写で説明できるかもしれない[60].相互に排他的ではない説明として、重症のCOVID-19患者における細胞質DNAの源は、SARS-CoV-2スパイクプロテインによって誘発されたミトコンドリア機能不全によって引き起こされた血管内皮細胞内の断片化したミトコンドリアDNAであるというものがある[113]。細胞質に放出されると、断片化したミトコンドリアDNAは内皮細胞内のcGAS-STING経路を活性化する可能性がある。したがって、TEが早期にnms-mRNAを活性化した後、細胞質に蓄積した逆転写ワクチンmRNAがcGAS-STING経路の活性化につながったという仮説は妥当であると考えられる。細胞質内に蓄積されたDNAは、cGAS/STING依存的な自然免疫活性化につながる自己免疫刺激分子となりうる。
Trex1多型と内因性レトロエレメントの蓄積が、mRNAワクチン接種後の心筋炎の直接的な原因となる可能性がある
哺乳類細胞に広く発現するタンパク質である3′–>5′DNAエキソヌクレアーゼ、3′修復エキソヌクレアーゼ1(TREX1、以前はDNase IIIとして知られていた)は、DNA分子の3′端からヌクレオチドを除去することによって一本鎖DNAおよび二本鎖DNA基質を分解する[114],[115].TREX1は、DNA基質を除去することにより、細胞質自己DNAに対する自然免疫寛容を維持し、自己免疫の開始を防止するのに役立っている。研究により、TREX1の変異は、TREX1欠損細胞の細胞質への自己DNAの蓄積をもたらし、上述のように、cGAS-STINGを介したI型インターフェロン反応の慢性活性化により全身性の炎症と自己免疫を誘発することが示されている[116]。TREX1変異に関連する自己炎症および自己免疫疾患の例としては、全身性エリテマトーデス、アイカルディ・グティエール症候群、クリオフィブリノゲン血症、シルブラン全身性エリテマトーデス、クリー脳炎、脳白質筋萎縮症を伴う網膜血管症などが挙げられる([117]により概説)。
細胞質DNAの未解決または過剰な蓄積は、TREX1遺伝子の強固な転写を誘導するISD経路を直接活性化し、IRF3依存のI型IFNの生産を開始する[118].I型IFNの増加は自己免疫疾患の典型であり、おそらくTREX1酵素の障害による細胞質自己DNAの蓄積に関連し、自己DNAに対する宿主の自然免疫寛容を維持できず、臨床的結果をもたらす異常な自然免疫応答をもたらす。例えば、TREX1欠損マウスは、心臓組織におけるIFN-β mRNAの劇的な過剰発現によって特徴付けられるIFN依存性応答により、進行性の拡張型心筋症および循環不全、ならびに脾臓および胸腺の両方におけるリンパ系器官の病的変化を伴う致死性のリンパ球性炎症性心筋炎を発症し[119]、自己免疫心筋症に合致する。自己免疫病理と一致して、TREX1欠損マウスからの血清は、免疫組織化学アッセイで心臓組織を強く染色する高濃度のIgG自己抗体を含んでいた。TREX1欠損マウスから採取した自己抗体は、ノックアウトおよび野生型の心臓抽出物に不明瞭に結合できたことから、炎症性心筋炎に関連する自己抗原はTREX1ノックアウト心臓に特異的ではないことが示され、エピトープの拡散で予想されるように、高齢のTREX1欠損マウスの血清ではより広い自己反応性が観察された[118]。
これらの知見は、mRNA ワクチン接種者,特に若い男性で、2 回目の接種後に急性心筋炎や心筋膜炎が報告される例が増加し[120],[121],[122] ,FDAが、COVID-19 mRNA ワクチンの2 回目の接種後に心筋炎や心膜炎のリスクが増加するという警告を発したことに照らしても見逃せない3. ヒトのTREX1遺伝子は変異を示し、TREX1遺伝子の一塩基多型(SNP)は、ヒトの感染症[123]や自己免疫疾患[124]の重篤な転帰に関連していることを考慮する、TREX1や、細胞質DNAセンサーを直接または間接的に制御するタンパク質をコードする他の遺伝子の多型が、nms-mRNAワクチンへの感受性を決定し、免疫への反応に影響し、mRNA COVID-19ワクチン接種後の心筋炎を含む重度炎症障害への感受性に影響する可能性がある。
仮説の実験的検証
私たちの仮説は、ヒトの外来RNAやLINE-1を含むTEに対する免疫応答が類似しているラットなどのモデル動物を用いて実験的に検証する必要がある。また、ワクチン接種者と非接種者のサブセットで、発現量の異なるTEと免疫遺伝子の転写物の高解像度ゲノム比較解析を行い、私たちの仮説を検証する必要があるだろう。このようなアプローチは、細胞質RNAやDNAによって引き起こされるTEと炎症性遺伝子制御ネットワークとの関連に光を当て、nms-mRNAワクチンがもたらす遺伝毒性、変異原性、発がん性、免疫原性のリスクについての理解に貢献するものと思われる。
その際、次のような疑問が生じる:1)TEsのmRNA発現はワクチン接種者と非接種者で異なる、2)TREX-1のmRNA発現はワクチン接種者と非接種者で異なる、3)INFs、IRF3、インフラマソームマーカーのmRNA発現はワクチン接種者と非接種者で異なる、4)心臓組織に対するIgG自己抗体や検出できる反応性がワクチン非接種者よりも接種者で高い頻度で認められるか。
結果論と考察
私たちは、ワクチンmRNAが細胞の自然抗ウイルス反応のカスケードを引き起こし、内因性TEのアップレギュレーション、およびIFN産生を含む保存経路を介したRNAおよびDNAセンサーの活性化を誘発し、ワクチントランスフェクト細胞および近隣の細胞内で慢性抗ウイルス状態を維持する何百ものIFN標的遺伝子の発現を促進するという証拠を提示し論証した。また、nms-mRNAに対する自然界反応の根底にある可能性のある新しいメカニズムも示唆した。
また、SNPsなどの個体間の遺伝的変異や、主要なシグナル伝達分子の転写物のスプライス変異体は、外来および自己の細胞質核酸の正確な除去を妨げ、持続的な炎症反応のアップレギュレーションにつながり、自己炎症および自己免疫疾患、ゲノム不安定性およびがんのリスクを増加させる可能性がある。したがって、nms-mRNAの暴露とその後の蓄積は、外来核酸に対する細胞内反応の複雑さを増し、TLR、RIG-I、MDA-5、IFITs、cGAS-STINGに依存しない上流経路を通じてTEsとIFNシグナルをアップレギュレートすると考えられる。これは、合成mRNAの治療応用に対する細胞応答の理解において、新たなパラダイムとなるであろう。nms-mRNAワクチンに施された修飾は、細胞内mRNAの安定性[32]と翻訳効率の向上[33]をもたらすが、仮説の通り、自己炎症反応や自己免疫反応の重要な決定因子となる可能性もある、TEや他の核酸センサーを活性化し、タイプ1インターフェロンや炎症性サイトカインの発現を引き起こし、細胞質自己DNAに対する宿主の自然免疫寛容を破壊することにより、非自己と自己の細胞質モチーフを識別する細胞の自然な能力に影響を与える[125]…
IFNは、その細胞表面または細胞質レセプターがウイルス分子パターンを識別すると、すべての細胞タイプによって合成・分泌される[126]。核酸センサーの適切かつ適時な活性化は、宿主が感染性ウイルスを排除するために不可欠である。しかし、核酸センサーに対するnms-mRNAの影響や、これらの持続的な核酸に対する細胞内応答の程度と結果は、まだ知られていない。nms-mRNAワクチン接種後、IFN-αやIFN-βをコードする遺伝子を含む関連遺伝子のアップレギュレーションを介して持続的な抗ウイルス細胞状態を誘導することは、おそらく自己炎症性疾患や自己免疫疾患の素因となりうる炎症性遺伝子ネットワークの慢性アップレギュレーションにつながると思われる。さらに、プロ炎症状態と細胞内RNAおよびDNAセンサーの活性化により、内因性レトロエレメントが不活性化される。これらの分子事象は、ゲノム、染色体、細胞の不安定性、発癌のリスクを増大させるだろう。
中東呼吸器症候群(MERS)[127]、SARS-CoV[128]、インフルエンザ[129]のマウスモデルは、I型およびIII型IFNの活発な誘導を示すが、COVID-19患者におけるこれらのサイトカインの関与は議論の余地がある。Broggiら[130]は、重症COVID-19患者の鼻・口腔咽頭ぬぐい液中のIFNのmRNAレベルは、健常対照者のそれと差がないことを発見した。一方、重症患者の気管支肺胞洗浄液では、炎症性サイトカインとI型(IFN-α、IFN-β)、-III型(IFN-λ)のIFNレベルが上昇した。これは、ウイルス感染の初期段階における上皮表面での抗ウイルス免疫反応におけるIII型IFNの関与と一致し[130]、呼吸器および胃腸の障壁における自然免疫反応と適応免疫反応の相互作用におけるI型およびIII型IFNによる調整活動を示唆している。
SARS-CoV-2自然感染に対する免疫応答とCOVID mRNAワクチン接種に対する免疫応答の最近の比較分析では、免疫細胞の表現型および転写プロファイリングにより、COVID-19患者ではI型およびII型IFNの顕著なアップレギュレーションが明らかになったが、ワクチン接種者では明らかにならなかった[131]。これらの観察は、抗COVID-19 mRNAワクチンが、強固な適応免疫応答を誘発する一方で、I型IFNシグナルを積極的に抑制するという考えと一致すると解釈された。Ivanovaら[131]の観察に基づき、VAERSデータベースからワクチン接種後の有害事象の報告を用いて、Seneffら[132]は、SARSは、IFNシグナルを積極的に抑制し、頑健な適応免疫応答を引き出すと解釈した。[132]は、SARS-CoV-2 mRNAワクチン接種は、IFNシグナルを障害し、タンパク質合成の制御とオンコサーベイランスに影響を与え、神経変性、免疫血小板減少、心筋炎、ベル麻痺、肝臓病、適応免疫応答の抑制、DNA損傷修復の低下、腫瘍形成のリスク増加への道を開くことができると論じた。私たちは、Seneffら[132]の見解と相補的であり、標的細胞や活性化される分子シグナル伝達経路の違いにより、nms-mRNAワクチン接種者と自然感染者の間でIFN制御が異なることを提案している。呼吸器や腸管の上皮表面は自然感染の主戦場であるが[133]、nms-mRNAワクチンの筋肉内投与、全身分布、組織蓄積は自然の粘膜バリアを回避し、全身レベルで危険感知シグナルや非自己DNAやRNAの細胞内検出を引き起こす。これについては、すでにいくつかの実験的な証拠がある。TLR3とRIG-I-MDA-5経路の両方を生体内試験で刺激する二本鎖RNAの合成アナログ(ポリイノシン:ポリシチジル酸;ポリI:C)をマウスに気管内投与すると[134]、ポリI:C投与後の初期と後期の両方で、肺に存在する樹状細胞が最高レベルのIFN-λ転写体を発現した。一方、上皮細胞、単球、肺胞マクロファージは、ポリ(I:C)に反応してIFNや炎症性サイトカインを発現したが、IFN-λは発現しなかった。生体内試験のデータと一致して、試験管内試験のTLR7刺激は炎症性サイトカインのアップレギュレーションを誘導するだけで、ポリ(I:C)と三リン酸ヘアピンRNA(3p-hpRNA)の細胞内送達によるRIG-IとMDA-5の活性化は、MAVS依存的にIII型IFNではなく、高レベルで誘導した[130].
ワクチン接種者において観察され[131]、Seneffら[132]によって議論されているI型IFN産生の積極的な抑制は、ワクチン接種時に検出された宿主由来の分子によるNLRP3、AIM2、またはMxAインフラマソームの活性化によって引き起こされるI型IFNシグナル伝達の調節障害を反映していると考えられる。[132]は、合成mRNA、抗ウイルスRNAse L経路によって生成されたRNAの切断産物、または再転写DNAの細胞質への蓄積として、細胞の危険性やストレスの内因性指標を検出した際に、宿主由来の分子によって呼び出されるNLRP3、AIM2またはMxA inflammasome活性化によって引き起こされるI型IFNシグナルの調節不全を反映している[135]。インフラマソームの活性化は、自己および外来の活性化因子に応答して起こり([136]に総説あり)、保護と有害の両方があり得る。IL-1βはNF-κBとc-JunN-terminal kinaseのシグナル伝達経路を活性化することで全身の炎症反応を刺激し、急性炎症性疾患によく見られるサイトカインストームを引き起こすため、いったん活性化すると、免疫病理の推進力となりうる[28]。したがって、ウイルス感染時には、有害な炎症性亢進反応を防ぐために、インフラマソームの活性化とIL-1βの産生が厳密に制御される。I型IFNは、NLRP3インフラマソームの強力なネガティブレギュレーターとして働き、強力な抗ウイルス剤としての役割と、恒常的な免疫制御因子としての役割の両方を担っている。インフラマソームの活性化は、DNAウイルス感染時にcGAS-STINGを介したIFNの産生を阻害するなど、自然界の抗ウイルス防御において制御的な役割を果たすこともあり[137]、I型IFNがインフラマソームを阻害し、活性化したインフラマソームがI型IFN産生も阻害するという制御回路が明らかになっている[138]。
SARS-CoV-2や他のヒトコロナウイルスは、感染した細胞でインフラマソームを誘発し[139],[140]、血清のインフラマソームマーカーはCOVID-19の重症度と関連している[141].中等度から重度のCOVID-19患者の末梢血単核細胞(PBMC)および剖検時の死後患者の組織では、NLRP3インフラマソームが活性化していた[141]。しかし、nms-mRNAワクチンも、直接的または間接的に、IFN依存的または独立的な方法でインフラマソームを活性化し、活性化後にI型およびIII型IFN産生を抑制できるかどうかはまだ不明である。
これまでのところ、nms-mRNAが誘発する免疫原性の基礎は、まだ完全に理解されていない。例えば、mRNAのキャップ2′-Oメチル化は、IFN誘導RNA結合タンパク質による認識を妨げる[142]。また、RIG-I結合親和性と自然免疫シグナルの活性化への影響に関する合成RNA5′末端修飾の問題に取り組むいくつかの研究により、以下が示唆されている。5́’キャップ修飾は、強い、最適でない、または廃止されたIFNシグナルのいずれかを駆動することができる([138]でレビュー)、一方、合成RNAの影響もある。5́MDA-5やcGASの活性化に対する′修飾はまだ決定されていない。私たちは、mRNAワクチンの安全性をよりよく理解するために、コントロールされた実験的研究を緊急に必要としている。具体的には、nms-mRNAがSARS-Cov-2感染時に活性化されるものとは異なる細胞内核酸センサーを活性化するかどうか、nms-mRNAがIFN依存的あるいはIFN非依存的に内在センサーあるいは細胞ターゲットによって早期に直接検出されるかどうかを知る必要がある、そして、LINE-1を介した逆転写と統合の増加により、免疫刺激性の自己DNA、ゲノム不安定性、変異原の潜在的な供給源となるTEの早期アップレギュレーションと細胞質蓄積の根底にある分子メカニズムを理解しなければならない。自己DNAの除去経路が損なわれた細胞は、ゲノムの不安定性を示し、悪性化するリスクが高いことが知られている。したがって、TREX1などのDNAセンサーをコードする遺伝子に特定の遺伝子多型を持つ個体が、nms-mRNAやTEのアップレギュレーションに伴うDNAの蓄積に関連した細胞ストレスや炎症刺激にさらされると、重度の炎症性疾患や自己免疫疾患の発症、発がんのリスクが高くなると考えられる。もしそうであれば、nms-mRNA技術を用いた集団ワクチン接種という「一長一短」のアプローチは、人類にとって安全な公衆衛生対策とは言えないだろう。
特に、nms-mRNAが脳[82]、骨髄[84]、被接種者にすでに存在する場合はがん細胞や前がん細胞に侵入した場合[143]、あるいはワクチンが妊娠初期の女性に投与されてnms-mRNAが胚細胞にトランスフェクトした場合[77]など、私たちの仮説が確認されれば公衆衛生に対する影響は驚異的で、すでに行われている大規模なCOVID-19ワクチンの文脈では恐ろしいことになるだろう。私たちの仮説が正しいと証明された場合、他のmRNAワクチン候補は、その下流のシグナル伝達メカニズムの範囲と健康への潜在的影響を完全に解明するために、ワクチンmRNAに加えられた合成5′キャップ、GC含量、ポリAテール、UTRの修飾の一つまたは組み合わせによって活性化する細胞質および核センサー、内在因子およびシグナル伝達経路を完全に調査すべきであるということは当然であろう。これらの研究から得られる知識は、mRNAワクチンやmRNAを用いた治療法のヒトの健康に対する安全性を、証明されていない仮定を超えて理解するために極めて重要である。
競合する利害関係の宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる既知の競合する金銭的利益または個人的関係がないことを宣言する。