Contents
Potential Fast COVID-19 Containment With Trehalose
www.frontiersin.org/articles/10.3389/fimmu.2020.01623/full
世界各国で驚異的な数のCOVID-19症例が確認されており、どの国もSARS-CoV-2感染症に免疫のない国はないことが明らかになっている。資源に乏しく、医療システムが脆弱な国では、独自の伝染病のパンデミックに苦戦しており、急速に拡大するこの感染症では、より不確実な状況に陥っている。
最前線の医療従事者は、命を救うための努力の中で感染症に屈している。COVID-19の治療法の開発が急務となっているが、潜在的な薬物治療法の有効性に関する臨床データは限られている。世界各国では、「カーブをフラットにして」医療システムへの圧力を軽減するために留守番命令を実施しているが、経済が再開した後にどのように展開されるかは不明である。
天然のグルコース二糖類であるトレハロースは、オートファジーシステムを介してウイルスの機能を損なうことが知られている。ここでは、SARS-CoV-2の感染・伝播を予防する治療法としてトレハロースを提案する。
はじめに
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるパンデミックコロナウイルス疾患2019(COVID-19)が世界各地で急速に拡大している。2020年6月5日現在、世界保健機関(WHO)は、COVID-19による全世界での患者数6,515,796人を確認し、38万7,298人の死亡を報告している。現在利用可能な治療法は、症状をコントロールし、組織の灌流を保証し、多臓器不全症候群を回避することを目的としている。これは、酸素療法、呼吸不全症例での機械的換気、敗血症性ショックを管理するための血行力学的サポートの使用によって達成される(1)。残念ながら、先進医療システムは、治療と入院を必要とするCOVID-19患者の流入に追いつくのに苦労している。ますます懸念されるのは、医療システムが弱く、脆弱な人口を抱える国では、このウイルスが有害な影響を及ぼす可能性があるということである。現時点では、SARS-CoV-2 の感染および感染伝播を効果的に制御できる米国食品医薬品局(FDA)承認の治療法は知られていない。本レビューでは、COVID-19封じ込めのための予防的治療法としてトレハロースを提案することを目的としている。
トレハロース(α,α-トレハロース)は天然に存在する糖であり,多くの生物のエネルギー源として機能するグルコース分子を2つ持つ非還元性二糖類である。トレハロースは、植物、藻類、真菌類、酵母、細菌、昆虫、その他無脊椎動物など様々な生物に存在している。2000,米国FDAはトレハロースに安全性(GRAS)ステータス(2)として一般的に認められた。凍結や脱水に対する保護効果から、トレハロースは食品、健康、医薬品の魅力的な成分となっている(2)。トレハロースの製造プロセスが最適化されているため、入手が容易で安価である。ヒトはトレハロースを合成することはできないが、小腸はトレハロースを特異的な酵素トレハラーゼによって2つのD-グルコース分子に加水分解することができる。トレハロースの加水分解活性は通常低いため、血糖値やインスリン値の軽度の上昇を引き起こすだけである(3, 4)。一方、グルコースとフルクトースからなる二糖類であるショ糖は、経口摂取後すぐに血糖値とインスリン値の両方を上昇させる(5)。一方、未加水分解トレハロースは、マウス、ラット、マカクへの経口投与後、血流中に速やかに吸収され、投与後15分~1時間でピークを迎え、マカクでは投与後12時間まで検出可能であった(6,7)。非ヒト霊長類における薬物動態データは、トレハロースに対するヒトの反応を促す有望な誘因となる。ヒトでは、トレハロースを 1 日 10 g/日摂取すると、12 週間の間、耐糖能が改善され、インスリン抵抗性への進行が減少し、収縮期血圧が低下した。したがって、トレハロースは、グルコースレベルおよびインスリン抵抗性の増加とは関連しない全身的な利益を誘導することができる(8)。全体として、これらの研究は、SARS-CoV-2 の感染および伝播の予防のためのトレハロース治療の実現可能性と安全性を支持するものである。
1925年以降、トレハロースの化学的および生物学的特性を理解することを目的とした研究がいくつか行われてきた。トレハロースは神経変性疾患や代謝性疾患における保護効果が注目されている(9-12)。トレハロースの保護効果は、その化学的シャペロン特性によるものと考えられていた(13)。しかし 2007年にトレハロースがオートファジー誘導物質であることが確認された(14)。高度に保存された細胞内分解プロセスであるオートファジーは、主要な制御複合体である哺乳類のラパマイシン標的(mTOR)によって制御されている(15, 16)。興味深いことに、トレハロースはmTORとは独立してオートファジーを誘導する(14)。哺乳類細胞培養において、トレハロース処理は、それぞれハンチントン病およびパーキンソン病に関連する両方のオートファジー基質である変性ハンチンおよび変性α-シヌクレインのクリアランスを増強することができる(14)。トレハロースの効果は、オートファジー関連5(ATG5)タンパク質複合体にアンカーされたファゴフォアからのオートファゴソームの形成に不可欠な微小管関連タンパク質1A/1B-軽鎖3(LC3)IIIの蓄積に依存している(14)。しかし、トレハロースはmTOR阻害剤ラパマイシン(14)によって減少するmTOR基質上の特定部位のリン酸化レベルを減少させないので、これらはmTOR阻害とは無関係である。その後、転写因子EB(TFEB)は、この現象に必須ないくつかの遺伝子の発現を誘導することから、リソソソームバイオジェネシスの主要な調節因子であることが同定された(17)。トレハロースがオートファジー誘導因子として登場すると、いくつかの研究グループはトレハロースを用いてTFEBの役割を実証し、TFEBをリン酸化するAKT(プロテインキナーゼB)(S467A)の活性を低下させ、TFEB阻害因子であるmTORとは無関係にTFEBを核に移動させることが観察された(18)。さらに、トレハロースは、TFEBを活性化することができ、その後、クロスプレゼンテーションを促進する可能性がある(18,19)。
母体の糖尿病では、発達中の神経上皮細胞で抑制されたオートファジーは、発達中の胎児(20)の神経管の欠陥(NTDs)につながる。トレハロースの投与は、このオートファジーの欠陥を回復し、高血糖誘発性のNTDsを防止した(21)。別の試験管内試験研究では、トレハロースは高グルコース培養細胞におけるLC3オートファゴソーム形成、ユビキチン結合タンパク質p62の高いクリアランス、神経幹細胞の分化、マイトファジー、およびレティキュロファジーを促進した(22)。サンフィリッポ症候群またはムコ多糖症(MPS)III型は、神経変性リソソーム貯蔵障害である。トレハロースで処理されたMSP IIIのマウスモデルでは、神経細胞およびグリア細胞におけるオートファージ性液胞のクリアランス、ならびにTFEB転写ネットワークの活性化に関連した神経学的改善が示された(23)。心筋梗塞の心臓リモデリングモデルでは、トレハロースの使用により野生型マウスの転帰が改善された(24)。一方、オートファジー制御に重要なタンパク質であるBeclin-1を遺伝的に欠損したマウスにトレハロースを投与しても保護効果はなかった(24)。また、トレハロースはLC3やp62クリアランスを増加させた。これらの結果は、トレハロースによるオートファジーが心保護効果を発揮することを確認した(24)。また、トレハロースの投与はマウスとウサギの高脂肪食誘発性動脈硬化をそれぞれ抑制し、減少させることが確認された(25-27)。マシュハド医科大学は現在、血管炎症およびアテローム性動脈硬化に対する抗炎症剤としてトレハロース(15g/週、12週間)を静脈内投与することの有益な効果を試験するための介入的臨床試験をスポンサーしている(clinicalTrials.gov、NCT 03700424)。末梢動脈疾患(PAD)患者は血管合併症と血小板活性化の亢進に関連している。ブドウ糖酸化の減少、酸化ストレス、オートファジーは、PAD患者の血流低下に寄与する因子である(28)。PAD患者における内皮機能、酸化ストレス、血小板機能、オートファジーに対するトレハロースの効果にアプローチする臨床試験が現在行われている(clinicalTrials.gov、NCT 04061070)。
感染症の文脈では、オートファジー誘導は、自然免疫応答および適応免疫応答の発達の両方にとって重要である。一部の微生物はオートファジーを回避し、生存および増殖戦略として利用することさえあるが、オートファジーは、細胞内感染のほとんどを制御するための有効な方法である(29)。免疫応答を回避することでよく知られている病原体であるヒト免疫不全ウイルス(HIV)もまた、オートファジーのフラックスに影響を及ぼすことで知られている(30)。HIVはオートファゴソームの数を増加させ、オートファゴソームの成熟を阻害し、オートファゴソームとリソソームの融合を阻害する(31)。CD4+ Tリンパ球がHIV感染の主要な標的であるという事実にもかかわらず、生物を非病原性マイコバクテリアなどの日和見微生物に対して非常に感受性の高いものにするのは、HIV感染した自然免疫細胞である(32)。3MAまたはBeclin-1 siRNAによるオートファジー阻害は、Jurkat細胞株におけるHIVウイルス産生を減少させたが(31)最近の研究では、トレハロースが試験管内試験で末梢血単核細胞(PBMCs)におけるHIV感染によって障害されたオートファジーを回復させることが示されている(表1)(32)。また、トレハロースの後処理により、HIV感染者のPBMCにおけるHIV負荷が減少した(32)。ヒトサイトメガロウイルス(HCMV)や水痘帯状疱疹ウイルス(VZV)などの他の疾患関連ウイルスに対するトレハロースの抗ウイルス効果は、試験管内試験 で実証されている(表 1)。トレハロースの作用機序は、オートファジーを有意に誘導することにある。トレハロースは、HCMV ウイルスの遺伝子発現を抑制し、複数の細胞型におけるウイルスの拡散を抑制した(34)。トレハロースを用いた前処理と後処理の両方で、HCMV と VZV の複製が減少した(35)。興味深いことに、Clark et al 2018)はHCMV感染細胞において、トレハロースがintra-multivesicular bodies(MVBs)ウイルスの形態を変化させ、内膜トラフィッキングの制御に関与するタンパク質であるRas-like GTPase 11(Rab11)のダウンレギュレーションを介してウイルス液胞成熟のトラフィッキングをリダイレクトすることを報告している(図1)(33)。ウェストナイルウイルス(WNV)に感染したマウスの初代皮質培養物では、トレハロースは LC3-II のタンパク質発現の増加によってオートファジーの活性化を誘導したが、オートファジーの活性化は WNV の増殖には有意な影響を及ぼさなかった(37)(表 1)。同様のオートファジー活性化は、トレハロースで処理したヒト初代気道上皮細胞で観察されたが、オートファジー誘導はヒトライノウイルス(HRV)感染に対する抗ウイルス機能を低下させた(36)(表1)。
表1. トレハロースによる抗ウイルス効果のまとめ

図1. SARS-CoV2 の複製とトレハロースによる阻害
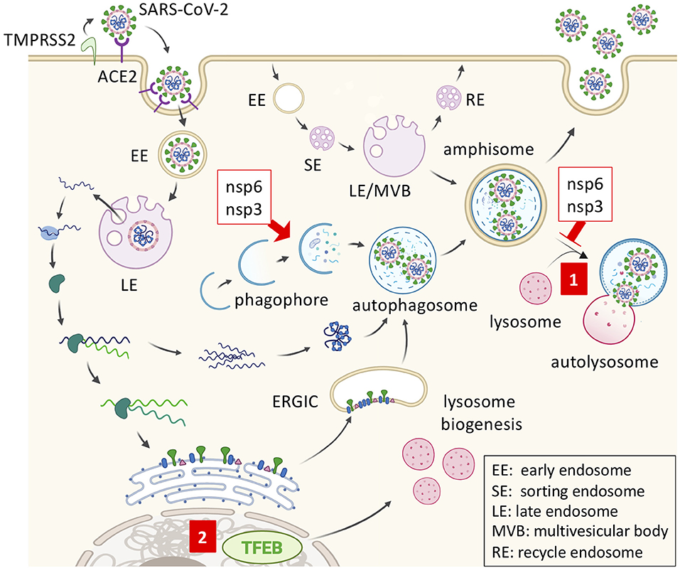
SARS-CoV-2 は、標的細胞内でアンジオテンシン変換酵素 2(ACE2)と結合し、膜融合を介して侵入する。その後、ウイルスは内部化され、エンドソームコンパートメントを介して輸送される。ウイルスゲノムは放出され、宿主リボソームによってウイルスRNAポリメラーゼを合成するために使用され、それによってウイルスRNAサブゲノムが複製される。ウイルスの構造タンパク質は合成され、小胞体(ER)に固定される。一旦、ウイルスはER-ゴルジ中間コンパートメント(ERGIC)に組み立てられ、オートファゴソームに移動すると、アンフィソームからエキソサイトーシスによって放出されることがある。コロナウイルス非構造タンパク質6(nsp6)とnsp3はオートファゴソーム形成を促進するが、オートファゴソームとリソソームの融合を阻害する。(1) トレハロースは、ウイルス二重膜小胞のトラフィッキング後のウイルス分解のためのアンフィソーム-リソソソーム融合を促進する可能性がある。(2) トレハロースはまた、転写因子EB(TFEB)を活性化し、リソソームの生合成を促進する可能性がある。
β-コロナウイルスである重症急性呼吸器症候群コロナウイルス(SARS-CoV)や中東呼吸器症候群コロナウイルス(MERS-CoV)は、オートファゴソームとリソソームの融合を阻害するウイルスタンパク質をコードしており、その中には膜関連パパイン様プロテアーゼ(PLp-TM)などが含まれている(38)。また、コロナウイルスは、ATG7に依存しない方法で、LC3を介したオートファゴソーム様二重膜小胞で複製する(39, 40)。様々なウイルスがオートファジー機構をハイジャックしてウイルスの複製やウイルスの成熟に利益をもたらすため、クロロキン(クロロキン)やトレハロースなどのオートファジー調節剤を用いて細胞のオートファジーを調節することは、ウイルス性疾患の治療において非常に重要である(41)。これに関して、コロナウイルスは、オートファゴソーム形成を促進するが、オートファゴソーム-リソソーム融合を阻害する非構造タンパク質6(nsp6)およびnsp3を発現しており、トレハロースによるオートファジーフラックスの誘導が、潜在的なCOVID-19の封じ込めに有益であり得ることを示している(図1)(38,42)。アンジオテンシン変換酵素2(ACE2)は、エンドサイトーシスを介したウイルスの侵入を媒介するSARS-CoVs受容体として不可欠な役割を果たしている(図1)(43)。特筆すべきは、最近報告されたLC3-associated endocytosis (LANDO)であり、これはLC3がβアミロイドを含むRab5+クラスリン+エンドソームに共役することで起こるが、ミクログリア細胞における外因性抗原をクリアするためのもう一つの重要なメカニズムである(44)。LANDOは、以前に観察されたLC3依存性およびATG7非依存性のコロナウイルス複製を説明することができる、コロナウイルス複製の可能性を有する別の過小評価されたLC3-ベシクルである可能性がある。しかし、LC3-ファゴソームとLC3-エンドソームの両方が単膜小胞であるのに対し、コロナウイルス複製は二重膜小胞で起こるという二面性がある(40)。これまでのところ、トレハロースのLANDOに対する効果は知られていないが、トレハロースが異なるタイプのウイルスに対してオートファジー依存性の抗ウイルス活性を示すことは明らかである。
COVID-19 治療戦略、開発および課題
COVID-19の感染拡大を遅らせ、医療への負担を軽減するための主要な戦略は、感染者を家庭内で隔離し、社会的距離を置くことであった(45, 46)。しかし、患者数の増加が続いていることから、多くの国では「留守番」が普及を抑制するための対策となっている。COVID-19の新たな症例は刻一刻と加速しており、このパンデミックが収束するまでにどれだけの時間がかかるかは専門家にもわからない。一方で、商業、貿易、観光、世界的なサプライチェーンの損失は、このウイルスが今後何年も世界経済に与える悪影響について、経済専門家たちを悩ませている。世界経済は、世界的な緊急対策がなければ、今年の第1四半期に2800億ドルの損失を予測している(47)。国連貿易開発会議(UNCTAD)は、世界経済の2兆ドルの赤字を予備的に予測している(48)。
COVID-19パンデミックに対応して、米国FDAは安全で効果的な治療法を確保するための作業を続けている。現在、COVID-19の治療および管理のために調査および開発されている潜在的な治療法は、多数の抗ウイルス剤、免疫療法、およびワクチンで構成されている(49)。抗ウイルスヌクレオチドアナログ剤であるレムデシビルは、ヒト気道上皮細胞培養物などの複数の試験管内試験系において、SARS-CoVおよびMERS-CoVの複製を阻害することができる(50,51)。レムデシビルは、SARS-CoV-2に感染したアカゲザルにおいて有望な結果を示しており、国立アレルギー・感染症研究所がスポンサーとなっているレムデシビルの適応型COVID-19治療試験が終了している(clinicalTrials.gov, NCT 04280705)(52)。この試験とGileadがスポンサーとなった試験(clinicalTrials.gov, NCT 04292899)に基づき、米国FDAはCOVID-19の治療薬としてレムデシビルの緊急使用を承認している(53)。HIVプロテアーゼ阻害剤であるロピナビル/リトナビルは、ベロE6細胞におけるSARS-CoV-2複製を阻害することが確認された(54)。中国・武漢で入院したCOVID-19患者にロピナビル/リトナビルの併用療法を行った。しかし、効果は中等度であり、13%の患者は副作用のために治療の早期中止を余儀なくされた(55)。軽度~中等度のCOVID-19患者に対するインターフェロンβ-1b、ロピナビル・リトナビル、リバビリンの新規トリプル抗ウイルス療法併用療法は、症状の緩和、ウイルス脱落期間の短縮、入院期間の短縮において、ロピナビル・リトナビル単独療法よりも安全性が高く、優れていた。しかし、プラセボ群がないことは、この試験のいくつかの制限事項の1つであった(56)。
クロロキンおよびその構造アナログであるヒドロキシクロロキン( ヒドロキシクロロキン)は、抗炎症作用および免疫調節作用を有する抗マラリア薬として使用されるFDA承認薬であり、COVID-19治療のためにリダイレクトされ、評価されている別の治験薬の抗ウイルス治療薬である。試験管内試験試験では、SARS-CoV-2,SARS-CoV-1,およびMERS-CoVに対するクロロキンの有意な活性が示されている(49,57)。クロロキンはリソモトロピック剤であり、エンドソームとオートファゴソームの両方の酸性化を阻害することにより、融合エンドソーム-リソソームおよび融合オートファゴソーム-リソソーム(オートリソーム)の機能を損なう(58-60)。クロロキンは、ACE2を介したエンドサイトーシス後のウイルス複製に必要なサイトゾルへのコロナウイルスRNAの侵入を阻害する(図1)(61)。前臨床試験での根拠とエビデンスにより、クロロキンはCOVID-19の治療薬として臨床試験段階に移行した。FDAはCOVID-19患者に対するクロロキンと ヒドロキシクロロキンの緊急使用を承認した(62)。残念ながら、これらの薬剤が本疾患に対して有効であることを証明する大規模な無作為化試験はまだ存在しない。興味深いことに、マクロライド系抗生物質であるアジスロマイシンおよびエリスロマイシンは、ウイルスの内部化を阻害することができる特異的な抗ウイルス効果を有する。オセルタミビルとアジスロマイシンの併用療法は、インフルエンザの治療に無作為化臨床試験で使用されている(63)。フランス保健省は、SARS-CoV-2感染患者を対象とした ヒドロキシクロロキン-アジスロマイシン非盲検非ランダム化臨床試験を承認し、サンプル数の少ない試験で有望な結果を示した(64)。残念ながら、クロロキン-azithromycinで治療されたCOVID-19患者では、不整脈が潜在的なリスクであることが十分に記録されている(65,66)。
レムデシビル、ロピナビル/リトナビル、クロロキン、およびアジスロマイシンは、試験管内試験でSARS-CoV-2複製を阻害するのに有効であることが示されている。しかし、症状のある患者に発症から1週間後に治療を行うと、有効性は低下する。この時点で、患者はすでにウイルスの拡大期から炎症期に移行しており、サイトカインストームを引き起こしている可能性がある(67)。例えば、インフルエンザ感染時には、ウイルス脱落期は感染後2~3日後にピークを迎える(68)。オセルタミビル(タミフル)の無作為化比較試験のメタアナリシスでは、感染症の早期治療により臨床症状の緩和が促進され、下気道合併症のリスクが低下したことが示されており、抗ウイルス薬治療は適切なタイミングで行う必要があることが示唆されている(69,70)。COVID-19の重症患者には抗ウイルス薬の単剤治療では十分ではない可能性があり、併用療法として抗炎症薬の補充が必要であろう(71)。サノフィとレジェネロンは、COVID-19感染症患者の「サイトカインストーム」による肺の組織損傷を改善するために、インターロイキン-6(IL-6)阻害剤サリルマブ(Kevzara)の第2/3相試験を発表した(clinicalTrials. gov, NCT 04315298)Swedish Orphan Biovitrum(SOBI)では、COVID-19感染症患者における炎症亢進と呼吸困難の軽減を目的としたAnakinra(IL-1受容体拮抗薬)とEmapalumab(抗IFN-γモノクローナル抗体)の第2/3相試験も開始された(clinicalTrials.gov, NCT 04324021)。全体として、これらの薬剤が一般に利用できるようになるまでには、さらに多くの臨床研究試験が必要である。
また、SARS-CoV-2に対するワクチンの開発に向けた取り組みも進められている。評価中の主なCOVID-19ワクチンは、全ウイルスワクチン(ヤンセン社のAdVacとPER.C6技術を用いたアデノウイルスベクター化ワクチン)組換えタンパク質サブユニットワクチン(Novavax社の組換えナノ粒子技術)核酸ワクチン(Moderna/NIH/CEPI社のmRNAワクチン)である(72)。パンデミック・パラダイムで開発されたワクチンは、開発段階から商業化まで数ヶ月から数年かかる(72-74)。したがって、COVID-19封じ込めのためのより迅速かつ手頃なアプローチが必要である。その抗ウイルス特性、利用可能性、およびFDA承認のため、トレハロースは、COVID-19のための有望な予防的治療法として直ちに評価される価値がある。
- いくつかの非特異的抗ウイルス薬が、少数の指定病院で臨床試験中である。SARS-CoV-2のウイルス脱落のタイムラインはよく知られていないが、抗ウイルス薬は、病気の発症時に投与すれば、より有益であろう。COVID-19(75)の管理にはタイムリーな診断が鍵となるため、より正確で迅速な診断検査はまだ進行中である。
- 陽性と診断された無症候性または軽度の患者に対する薬物療法や明確なガイドラインはない(76,77)。これらの患者は自宅で隔離されたままでいなければならず、他の家族に感染する可能性が高くなる。
- 質の低い医療制度を有する社会経済的に不利な国は、COVID-19に対する最新の戦略を実施している米国や欧州の一部の国と比較して不利な立場に置かれることになる(78, 79)。新しい低コストの戦略が切実に必要とされている。
- いくつかの国でワクチンの開発が始まっているが、利用可能になるまでには少なくとも1はかかるだろう。
- 無症状の患者は偽陰性のPCR検査結果を受けている可能性があり、これはCOVID-19陽性例を過小評価する原因となる。したがって、コミュニティ内でのウイルスの拡散を防ぐ努力を複雑にしている(80)。
- 現在のロックダウン対策は広がりを制限しうるが、完全に止めるには十分ではないかもしれない。
SARS-CoV-2の即時封じ込めのためのトレハロース治療の考え方
これまでのところ、SARS-CoV-2の感染に対する当面の介入は、接触者の追跡、隔離、社会的距離をとることが中心であった。パンデミックを緩和するためにこれらの物理的な距離を置く手段を適応させることで、いくつかの国では感染曲線を平坦化させることができた(81)。世界中の都市は経済の再開を始めているが、COVID-19の第2の波が再開から2~4週間後に始まると予測されている(82)。SARS-CoV-2のパンデミック後の感染動態は、冬期に再発生し、この病気の再来がさらに3年間続く可能性があると予測している(83)。一度だけの社会的遠距離措置を用いた様々なシナリオの数学的モデリングでは、社会的遠距離措置が解除された場合の感染の再来をシミュレートしている(83)。このように、強制的な社会的距離と経済のシャットダウンを周回する追加的な方法が必要である。あるいは、集団免疫への道筋としては、時間をかけて集団予防接種か自然免疫化のいずれかが必要になるだろう。しかし、後者のアプローチは、人口の大部分が病気に屈することを示唆している(84)。基本的な再生産数であるR0は、ナイーブな集団における感染因子の伝播性を表しており、伝播動態に応じて変化する可能性がある(85)。そのため、R0は集団間で異なる。SARS-CoV-2のR0は 2020年1月~2020年2月の最近の研究では1.4~6.49の範囲であると報告されている(86)。R0が6.49であれば、感染拡大を食い止めるためには85%の個体が免疫を持っている必要があり、1-1/R0となる。人口動態、文化的影響、接触率、人口密度などの伝染動態の要因により、異なる集団が集団免疫を獲得するまでにどれくらいの時間がかかるかは不明である(87)。したがって、リスクが低いと考えられる個体を標的とすることで、脆弱で免疫のない個体を保護するためのコミュニティ保護を構築することができる。
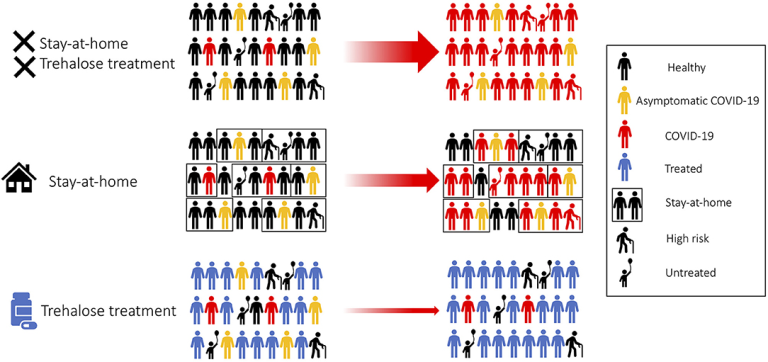
我々は、COVID-19の予防および封じ込めのための実用的で手頃な安全な治療法としてトレハロースを提案する。トレハロースは、ウイルスの複製に必要な細胞小器官に影響を与える可能性がある。我々は、健康な成人、医療従事者、無症状、軽度のCOVID-19患者からなる大規模なコミュニティ試験を推奨する(図2)。疾病管理センター(CDC)は最近、感染症の症状が出ていない段階でのSARS-CoV-2の感染が報告されているため、予防的アプローチとしてトレハロース治療を行うことが望ましい(88,89)。COVID-19陽性の患者の家族は、トレハロース治療を受け、家庭内でのSARS-CoV-2感染の二次感染率が16.3%(図2)であることから、自己検疫で自宅に留まることが推奨される(90)。成人とは異なり、子どもはCOVID-19の観察症例率が低い。小児はほとんどが無症状であるか、基礎となる健康を脅かす状態が存在しない限り、医師の診察を必要とするほど症状が軽度である(91,92)。最近では、小児科病院でCOVID-19に関連した重度の川崎様疾患に罹患した小児の症例が確認されている(93)。これは、各国が教育制度を再開しようとしているときには大きな懸念材料であり、SARS-CoV-2感染症の長期的な小児への影響はいまだに不明である。血管機能の改善を目的としたトレハロース(100g/日)の経口補液に関する臨床試験が50~77歳の健康な成人を対象に行われている(94)。トレハロースは安全であることが証明されているが、高齢者や高齢者の多くが慢性疾患を患っていることから、トレハロースの有効性を評価する際には不適切であるか、注意が必要である。健康な成人にトレハロースを投与することで、集団レベルでの感染抵抗性が高まり、感染の連鎖がブロックされる。この治療の結果、高齢者や医学的に危篤状態にある人への感染リスクは、間接的に感染から保護されるため、大幅に減少する(図2)(95)。さらに、トレハロースは、TFEBを活性化し、その後、交差提示を促進する可能性がある(18,19)。したがって、トレハロースは、特にCOVID-19症例の第2波に遭遇する段階で、SARS-CoV-2に対する集団免疫を促進するための別の利点を有し得る。この治療戦略は、抗ウイルス臨床試験を実施するための資源を持たない国にとって、より有益であると考えられる。
図2. SARS-CoV-2 の迅速な封じ込めのためのトレハロース治療
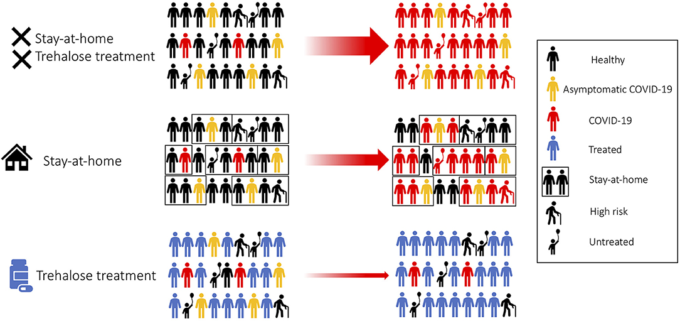
健康な成人や無症状の患者をトレハロースで治療することで、コミュニティウイルスの封じ込めが加速する。
トレハロース治療の開発における潜在的な注意事項と現在の限界
成人へのトレハロース投与についてはかなりの研究が行われているが、小児、健康関連の問題を抱える成人、高齢者におけるトレハロースの安全性については、まだ十分なデータがないことを理解することが重要である。我々は以前に、トレハロースが急性呼吸窮迫症候群(ARDS)の「ツーヒット」マウスモデル(LPSと機械的換気によって誘発される)を悪化させ、他のオートファジー活性化がARDSを抑制することを報告している(96)。したがって、トレハロース治療は、重度のCOVID-19を有する集中治療患者、特にサイトカインストーム症候群またはARDSを呈する患者を治療するのには不適切であろう。炎症性サイトカインに関しては、トレハロースは、マウス腹膜マクロファージにおけるLPS誘導IL-1βおよびTNF-α分泌を抑制することが示されている(97)。我々の実験的試験管内試験データでは、トレハロースの前処理がマクロファージにおけるLPS誘導性IL-6産生を抑制することが示されている(未発表)。アメリカ感染症学会のインフルエンザ管理に関する臨床実践ガイドラインにもあるように、抗ウイルス薬による早期治療が症状や合併症のリスクを軽減するとされている。同様に、トレハロースもSARS-CoV-2感染症の初期段階では、抗炎症薬としてより大きな効果を発揮する可能性がある。後期の重症COVID-19患者を治療するだけでは十分ではないだろう。その代わりに、FDAが承認した他の緊急時の医薬品による介入がより効果的であろう。トレハロースは抗ウイルス治療薬として大きな利益をもたらす可能性があるが、食用トレハロースはクロストリジウム・ディフィシル(Clostridium difficile)の病原性を増強する可能性があることが研究で示されている(98)。SARS-CoV-2感染に対するトレハロースの効果に関する試験管内試験研究は、ある種のウイルスがオートファジーシステムをハイジャックし、トレハロース治療(例えば、HRV)でその複製を強化することができるので、まだ調査する必要がある(36)。トレハロースの効果が確認されれば、アカゲザルモデルでの試験は、ヒト臨床試験のための適切な開始用量を確立するために理想的であろう。成人におけるトレハロース投与の大部分は、4.8~10g/日の範囲である。オートファジーの肺の変化は、マウスへの1 g/kgのトレハロースの使用で確認されており、これはヒトでは60kgごとに4.8 g/日に相当する(96)。糖尿病の研究では10g/日を使用した(8)が、急性冠動脈の臨床試験では2.1g/日を使用した(clinicalTrials.gov, NCT 03700424)。30g の用量は、健康な女性の下剤目的で使用されている(3)。SARS-CoV-2を標的とするための体重あたりのトレハロースの有効量およびヒト血中トレハロースの薬物動態はまだ決定されていない。特筆すべきは、16~18時間の絶食はオートファジーを活性化することも知られているが、以前に報告されたように、ウイルス感染には良い戦略とは言えない(99)。したがって、COVID-19の予防的治療として絶食を推奨しない。代表的なmTOR依存性オートファジー活性化剤であるラパマイシンは、免疫抑制作用を有するため、SARS-CoV-2の予防的治療としては不十分である可能性がある(15)。
SARS-CoV-2は世界的に拡大し続けているため、異なるコミュニティへの影響についての知識と理解を得ることが重要である。提案されているトレハロース治療法は、より高価な治療法を求めることができない人々を保護する可能性がある。COVID-19の研究や試験が無期限に進行中であり、経済が苦しい中、迅速な封じ込めのためには、より費用対効果の高い選択肢が検討されるべきである。COVID-19のパンデミックがその種の最後のものではないので、ウイルス感染症のためのより安全な治療法の調査は、継続的な優先順位であるべきである。我々は、世界中の公衆衛生機関への検討のためにトレハロースを提案する。