Potential Effects of COVID-19 on Cytochrome P450-Mediated Drug Metabolism and Disposition in Infected Patients
2021年2月4日
要旨
新型コロナウイルス感染症(COVID-19)は 2019年12月に初めて確認されて以来、世界的な健康危機となっている。発熱、咳、頭痛、息切れに加えて、免疫応答に基づく炎症の激しい増加が、重症急性呼吸器症候群コロナウイルス(SARS-CoV-2)ウイルス感染の特徴となっている。このナラティブレビューでは、COVID-19の病態生理と、薬物代謝および処分に対するそのもっともらしい影響をまとめ、批判している。
炎症性サイトカイン(例えば、インターロイキン、腫瘍壊死因子α)の放出は、「サイトカインストーム」としても知られており、変化した分子病態生理をもたらし、最終的には肺、心臓、肝臓の臓器障害をもたらす。様々な肝機能検査(例えば、アラニンアミノトランスフェラーゼ、アスパラギン酸アミノトランスフェラーゼ、総ビリルビン、アルブミン)の実験値は、COVID-19患者における潜在的な肝細胞障害を示唆している。
肝臓はタンパク質合成の中枢であり、シトクロムP450(CYP)が媒介する薬物代謝の主要部位であるため、肝機能の状態にわずかな変化があっても、キセノバイオティクスの肝クリアランスに影響を与える可能性がある。また、非SARS-CoV-2ウイルス感染者を対象とした過去の研究では、感染に関連したサイトカインの増加と炎症によってCYP酵素が抑制されることが示されている。
治験薬であるCOVID-19の他に、患者は併存疾患の治療薬を服用している可能性がある;特に、高血圧、高血糖、および肥満を有する患者は、平均的な集団よりもCOVID-19に対してより脆弱であることが疫学的研究で示されている。このことは、治験薬(例えば、レムデシビル、デキサメタゾン)と併存疾患の治療薬の両方がCYP介在性肝代謝の低下によって影響を受ける可能性があるため、患者の薬物-疾患相互作用のプロファイルを複雑にしている。
全体として、医療従事者がCOVID-19とCYP駆動型薬物代謝の相互作用に注意を払い、適切な投与量の調整または影響を受けた薬剤の中止を目標にすることが肝要である。
キーポイント
- 炎症と非常に高いサイトカインレベルはCOVID-19患者によく見られる。
- 炎症性サイトカインは、肝機能障害およびシトクロムP450(CYP)酵素の抑制に寄与することが知られている。
- COVID-19患者では、インターロイキンや腫瘍壊死因子αなどの炎症性蛋白質によるCYP介在性薬物代謝の抑制により、肝薬物クリアランスが著しく低下する可能性がある。
はじめに
2020年10月14日現在、世界保健機関(WHO)は、新型コロナウイルス感染症(COVID-19)の患者数37,888,384人、全世界での死亡者数1,081,868人を報告している[1]。2020年3月、WHOはCOVID-19をパンデミックと宣言した[2]。米国(総症例数7,728,436人、死亡者数213,626人)がパンデミック全体の震源地となっているが、ヨーロッパやアジアのいくつかの国も大きく貢献しており、毎日約30万人の新たな症例と数千人の死亡者が報告されている[1]。WHOによるCOVID-19のリスク評価は非常に高く、現在もワクチン開発に向けた激しい努力が続けられている[2]。Severe Acute Respiratory Syndrome Coronavirus(SARS-CoV-2)は、現代におけるこの大規模パンデミックの原因菌である。SARS-CoV-2は 2019年12月に中国の武漢で出現した新型人獣共通感染症ウイルスである[3]。臨床的原因不明の肺炎を発症した患者群で同定された[4]。SARS-CoV-2は、陽性センス一本鎖RNAウイルスからなるコロナウイルス科に属する。SARS-CoV-2は 2002年に重症急性呼吸器症候群(SARS)2012年に中東呼吸器症候群(MERS)を引き起こした重症呼吸器症候群コロナウイルス(SARS-CoV)の姉妹ウイルスであることから、国際ウイルス分類学委員会(International Committee on Taxonomy of Viruses)の頭文字をとったものである[5]。
この病気がどのようにしてヒトに発生したのかは未だ議論の余地があるが、ヒトに感染するウイルスはコウモリのコロナウイルスと遺伝的に約96%同一であることから、現在の文献ではコウモリが感染源であると考えられている[6]。しかし、最初のパンデミックは中国の武漢の「湿地市場」で始まったようであり、コウモリが直接ヒトに感染した可能性は低いと考えられる。他の仮説としては、コウモリやパンゴリンなどの中間体がウイルスをヒトに運んだ可能性も考えられる[6]。パンデミックの最初の6ヶ月間は、ヒト間の感染経路についての理解が進んでったが、現在では、呼吸器飛沫と直接接触がCOVID-19の主な感染経路であることが広く受け入れられている。また、感染した患者の糞便からもウイルスが検出されており、糞便から口腔内への感染の可能性が開けている[6]。感染した患者が閉鎖された環境で長時間近くにいる場合には、エアロゾル化感染の可能性も残っている[2, 6]。ヒト宿主におけるウイルスの取り込み方法としては、上気道口腔咽頭管のアンジオテンシン変換酵素2(ACE2)受容体が考えられている。これらのACE2受容体は肺の上皮細胞に豊富に発現しており、消化管にも存在しており、これは最も一般的な感染形態と相関している[6]。
この疾患の初期性のため、科学界は2020年にCOVID-19とその関連領域の研究に取り組んだ。膨大な研究努力にもかかわらず、COVID-19の病態生理がSARS-CoV-2感染患者の肝機能、薬物代謝、薬物動態に及ぼす影響を理解する上では、知識のギャップがある。SARS-CoV-2の多臓器標的を考慮すると、COVID-19の治療や既往症の管理に用いられる薬剤の薬物代謝状況や薬物動態を把握することは極めて重要である。特に,特定の疾患(高血圧,糖尿病,高脂血症など)を有する患者は一般集団に比べて感染しやすいことが確立されており[4,7],COVID-19患者のポリファーマシー中の薬物関連毒性を最小化するためには,肝薬物代謝が不可欠であることが示唆されている。このナラティブレビューでは、COVID-19の病態生理(例えば、サイトカイン、炎症、肝機能)COVID-19以外の状態での感染/炎症が媒介する薬物処分の例(例えば、薬物代謝酵素調節、薬物代謝)およびCOVID-19薬剤の薬物動態および併存疾患の管理に使用される薬剤に対するそれらのもっともらしい影響について、文献を検討し、比較した。
文献検索戦略
このナラティブレビューの目的で 2020年10月12日までの論文をPubMed、Medline、Google Scholarデータベースで検索した。原著研究、症例研究、FDAのパッケージインサート、およびレビュー記事は本研究に含まれていた。学会要旨
および未発表の電子版は本研究から除外した。文献検索を行うために、以下のキーワードの組み合わせを使用した。”COVID-19」、「新型コロナウイルス感染症」、「SARS-CoV-2」、「重症急性呼吸器症候群コロナウイルス2」、「2019-nCOV」、「2019年新規コロナウイルス」、「コロナウイルス」、「併存症」、「薬物代謝」、「シトクロムP450」、「薬物動態」、「炎症」、「サイトカイン」。文献検索と論文の評価は、著者が独自に行った後、所見を分析する前にリコンサイルを行った。今回の研究では、英語で発表された論文で、ヒトを対象とした研究またはヒト由来の試験管内試験モデルを報告した論文に限定した。
COVID-19の病態と臨床発表
COVID-19の臨床症状は様々であるが、ほとんどの患者が持つ初期症状は発熱、咳、頭痛、および息切れである[8]。患者の中には、完全に無症状であるにもかかわらず陽性と判定された患者もいるが、これは本疾患の感染に対処する場合には問題となる。一般的に、観察可能な症状は感染後4日目以降に現れ始め、10日目頃には炎症反応がより重症化する。しかし、感染者は、発熱、咳、呼吸困難などの容易に識別可能な症状を示すようになる直前に最も感染しやすいようである[4, 8]。COVID-19患者の症状および合併症は、在宅隔離患者と入院患者で大きく異なり、集中治療室(ICU)患者では全身状態が徐々に悪化している[7]。ウイルス感染、特にコロナウイルス科のウイルス感染では、初期段階の後、免疫反応に基づく炎症が疾患の特徴である。その後、炎症は臓器障害の前駆体となるが、時に臓器障害が軽度であっても分子病理学的変化が起こることがある[3]。感染に対する免疫反応の間にサイトカインのレベルが驚異的なペースで上昇するため、患者は「サイトカインストーム」を経験し、最終的にはいくつかのメカニズムによって臓器不全や敗血症性ショックを引き起こす可能性がある[9, 10]。糖尿病、高血圧、肥満などの併存疾患を持つ患者は、通常の健康な人よりもはるかに高い確率でこの病気に感染し、より重症化した[4]。年齢もCOVID-19患者の重症度および死亡率を決定するもう一つの主要な因子である[8]。
肺は酸素交換の役割のため、最も灌流量の多い臓器の一つである。COVID-19がACE2受容体を介して肺に入ると、ユビキタスに発現しているACE2受容体を介した臓器への取り込みと同様に、血液を介して体内のどこにでも輸送される。ウイルスはその後、肝臓や小腸を含む体内のほとんどの臓器に存在するACE2受容体を発現する他の臓器にも侵入することができる[11]。肺に加えて、心血管系、肝系、神経系がSARS-CoV-2に一般的に感染する [5,10]。急性呼吸窮迫症候群(ARDS)は本疾患の最も一般的な合併症であり、通常、重症患者には人工呼吸が必要である。この原稿を作成した時点では、挿管前の鎮静に使用される一般的な薬剤(例えば、デクスメデトミジン、フェンタニル、ロラゼパム、ミダゾラム、およびプロポフォール)の親用量はFDAの医薬品不足リストに載っていた[12]。患者に最適な鎮静と鎮痛を使用することが、人工呼吸器を使用する前に挿管を行う唯一の倫理的かつ安全な方法である[13]。
COVID-19患者の臨床検査パラメータ
血液学的および生化学的な臨床検査値の異常は、健常者と軽症患者と重症患者で有意に異なっていた [3]。一般的な範囲外の検査値には、アルブミン、リンパ球、血小板レベルの低下、血清フェリチン、プロカルシトニン、C反応性蛋白(CRP)乳酸脱水素酵素(LDH)白血球数、アラニンアミノトランスフェラーゼ(ALT)アスパラギン酸アミノトランスフェラーゼ(AST)心筋トロポニンI、血清クレアチニン、赤血球沈降速度(ESR)レベルの上昇、および一連の炎症性マーカーが含まれる[3]。X線画像診断を受けた患者では、ARDSの徴候である両側性の開口部が見られることが極めて一般的である[3, 14]。メタアナリシスでは、患者の87.5%が両側に浸潤しており、肺で感染が急速に広がっていることを示している[14]。LDHレベルは、広範な組織損傷を受けている患者を表すことができる。アルブミンレベルの低下、炎症関連マーカーの増加、肝臓酵素レベルの上昇は、炎症が疾患のタイムラインの初期に肝臓に影響を与えている可能性が高いことを示唆している。同様に、トロポニンレベルの上昇と免疫原性反応は、これらの患者の心臓損傷を示唆している [10]。
COVID-19患者における炎症の増加
SARS-CoV-2感染症に対する防御における強力な免疫学的反応が、COVID-19患者の特徴として報告されている。サイトカインとともに好中球対リンパ球比、CRP、ESR、フェリチン、プロカルシトニンレベルは、感染に関連した炎症の典型的なマーカーである。メタアナリシスでは、患者の58.3%が高血清CRP(3mg/l以上)41.8%が高ESRであり、炎症のレベルが高くなっていることが示されている[3]。COVID-19患者の代表的な臨床報告におけるCRPおよびLDH値を表11に示す。炎症の促進による臓器機能障害による死亡は、重症COVID-19患者では最も一般的なシナリオの1つである可能性がある [6, 8, 15]。炎症性カスケードは臓器ごとに異なるが、その開始を含むいくつかの側面は類似している。ウイルスの収縮の最初の数日の間に、体は病原体による侵入を認識し、これにより炎症性サイトカインおよびケモカイン、最も一般的にはインターロイキン(ILs)腫瘍壊死因子α(TNF-α)インターフェロンγ(IFNγ)および単球化学吸引性タンパク質1(MCP1)の局所放出が促進され、体の限られた区画への感染が制限される [16]。その後、ウイルス力価のピーク時には、サイトカインおよび他の免疫原性タンパク質の激しい産生および放出が観察されるCOVID-19患者において、全身の炎症が「サイトカインストーム」として現れる。COVID-19患者における増加した炎症性マーカーの例を表22に示す。炎症性メディエーターは、ウイルスとともに細胞傷害を引き起こし、瘢痕組織や線維化の形成、機能喪失や虚血、そして最終的には腫瘍壊死を引き起こす[16]。高LDHは、細胞傷害の初期徴候であり、その後にSARS-CoV-2感染による劇症的な影響が生じる [17]。報告されている最も一般的な臓器障害は、肺、心臓、および腎臓の順である。肺の炎症は、コンピュータ断層撮影(CT)または胸部X線撮影によって検出される。ある系統的レビューでは、CTスキャンを受けた患者の87%以上が両側に病変があることが示された。同じレビューでは、78.8%の患者が多葉性病変を有していたことが示されている[14]。これらの観察から、ウイルスは肺に多くのACE2受容体が存在するためか、また、肺が口腔咽頭ルートを介してウイルスが人体に侵入した後の最初の主要臓器であるという事実にも起因して、肺で迅速に拡散することが示されている[6]。このレビューの焦点である肝臓への損傷を引き起こすためには、COVID-19によって引き起こされる炎症は、全身性であるか、または肝ACE2受容体を介した肝臓の直接感染によって引き起こされなければならない。
表1 COVID-19患者における肝機能検査および炎症関連マーカーの要約。データは平均値(SD)または中央値(四分位間距離)のいずれかで記載されている
| AST(U / l) | ALT(U / l) | T.ビリルビン(µmol / l) | アルブミン(g / l) | CRP(mg / l) | LDH(U / l) | 参照。 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | |
| 34(27–45) | 58(41–93) | 41(23–65) | 67(47–100) | 19(13–26) | 22(18–28) | ND | ND | ND | ND | ND | ND | [ 61 ] |
| 24.39(9.79) | 38.87(22.55) | 21.22(12.67) | 37.87(32.17) | 10.27(4.26) | 14.12(6.37) | 40.41(3.24) | 34.40(4.11) | 18.27(29.87) | 80.75(69.18) | 177.26(55.29) | 346.10(257.26) | [ 97 ] |
| 24.0(21.5–26.5) | 47.0(28.0–74.5) | 16.0(13.3–21.8) | 42.0(32.5–50.0) | 7.8(6.4–9.5) | 8.8(7.9–10.5) | 37.2(35.8–38.8) | 29.6(28.6–33.0) | 22.0(14.7–119.4) | 139.4(86.9–165.1) | 224.0(200.3〜251.8) | 537.0(433.5–707.5) | [ 98 ] |
| 34・0(24・0–40・5) | 44・0(30・0–70・0) | 27・0(19・5–40・0) | 49・0(29・0–115・0) | 10・8(9・4–12・3) | 14・0(11・9–32・9) | 34・7(30・2–36・5) | 27・9(26・3–30・9) | ND | ND | 281・0(233・0–357・0) | 400・0(323・0–578・0) | [ 26 ] |
| 33.21(18.24) | 27.80(11.42) | 24.50(15.75–37.75) | 27.00(21.0–41.0) | ND | ND | ND | ND | 18.76(22.20) | 39.37(27.68) | ND | ND | [ 9 ] |
| 25.9(9.5) | 51.2(18.7) | 19.0(13.5–26.0) | 27.0(23.0–50.0) | 8.8(4.1) | 13.2(5.5) | ND | ND | 7.6(3.1–57.3) | 62.9(42.4–86.6) | 221.5(71.2) | 462.4(190.6) | [ 96 ] |
| 22.00(17.65–31.75) | 34.0(27.0–47.0) | 18.70(13.00–30.38) | 22.0(15.0–34.0) | ND | ND | ND | ND | 3.22(1.04–21.80) | 109.25(35.00–170.28) | ND | ND | [ 99 ] |
| 29(23–41) | 67(38–90) | 22(15–34) | 47(22–66) | 9.5(8.4–12.9) | 11.3(9.4–20.7) | ND | ND | ND | ND | 227(171–329) | 456(254–588) | [ 100 ] |
| 37.5(26.6) | 100.3(97.0) | 30.1(26.3) | 58.8(93.6) | 8(4) | 11(6) | 39(5) | 30(3) | 42(67) | 177(95) | 555.5(184.0) | 1272.6(542.1) | [ 35 ] |
| 22.2(7.2) | 44.8(20.8) | 17.5(10.8–26.0) | 21(15.5–40.5) | 9.1(3.6) | 15.8(6.8) | 35.8(30.7–38.5) | 31.6(27.1–32.7) | 12.9(3.5–55.7) | 134.6(73.2–164.1) | 256.0(232.0–286.5) | 497.5(428.0〜867.8) | [ 18 ] |
| 42(29–64) | 25(20–32) | 26(19–39) | 22(15–35) | ND | ND | 37(35–39) | 33(30–35) | 111(64–191) | 30(8–59) | ND | ND | [ 101 ] |
| 29(21–38) | 52(30–70) | 23(15–36) | 35(19–57) | 9.3(8.2–12.8) | 11.5(9.6–18.6) | ND | ND | ND | ND | 212(171–291) | 435(302–596) | [ 102 ] |
| 25.0(20.0–33.3) | 45.0(31.0–67.0) | 20.0(14.8–32.0) | 28.0(18.0〜47.0) | 8.4(5.8–11.2) | 12.6(9.4–16.7) | 36.3(33.7–39.5) | 30.1(27.9–33.0) | 26.2(8.7–55.8) | 113.0(69.1–168.4) | 268.0(214.3–316.5) | 564.5(431.0–715.8) | [ 19 ] |
| 25(16–52) | 43.5(35–96) | 20(12–61) | 28.5(12–177) | ND | ND | ND | ND | 81(64–24) | 201(110–453) | 343(209–537) | 622.5(378–867) | [ 103 ] |
| 26.53(12.73) | 51.23(88.67) | 31.68(27.75) | 42.37(48.88) | ND | ND | ND | ND | 12.93(18.48) | 49.63(48.11) | ND | ND | [ 104 ] |
| 27.5(19.0–42.0) | 40.0(27.0–61.5) | 22.0(14.0–40.5) | 27.0(20.0–37.0) | 8.7(6.5–12.3) | 9.6(8.3–16.3) | 33.0(30.6–38.1) | 33.2(31.2–35.6) | 36.0(19.3–91.0) | 86.4(37.9〜105.5) | ND | ND | [ 105 ] |
| 27(21–40) | 27(19–50) | 22(16–34) | 23(14–49) | ND | ND | 34.9(5.3) | 30.3(5.1) | 45(16–115) | 92(43–208) | ND | ND | [ 106 ] |
| 45(25–59) | 61.5(44–83) | 31.5(21–46) | 34(23–49) | 10.6(8.7–13.9) | 11.7(8.7–19.5) | 36.5(33.8–39.3) | 34.6(31.8–35.9) | 60.3(23.6–154.4) | 165.65(82.45–241.4) | 316(247–397.25) | 521(416–636) | [ 107 ] |
| 24(21–30) | 29(22–60) | 22(14–36) | 31(14–45) | 10(7.7–15) | 11.3(8.5–13.9) | 40.7(4.0) | 34.4(5.2) | 6.7(1.8–10.7) | 19.5(9.4–41.1) | 209.2(52.2) | 356.9(204.6) | [ 22 ] |
| 26.0(19.0–45.0) | 35.0(21.0–53.5) | 24.0(16.5–45.5) | 24.0(13.5–41.0) | ND | ND | 37.7(33.75–40.8) | 34.40(31.30–37.25) | ND | ND | 238.0(189.0–321.0) | 395.0(274.5–589.0) | [ 24 ] |
| 22.4(16.9‐30.5) | 33.6(25.7‐44.2) | 21.7(14.8‐36.9) | 26.6(14.5‐33.3) | 8.6(5.6‐14) | 9.8(7.8‐15.6) | 49.9(37.4‐43.6) | 36(33–38.5) | 7.7(1.9‐31.1) | 91(52.7‐136.3) | 212(179.5–259) | 309(253.8–408.3) | [ 108 ] |
| 33(24.5–56) | 38(30–68.3) | 27(16–41) | 30(20.5–56.5) | ND | ND | ND | ND | 51.1(20.4–86.3) | 168.9(90.2–220.8) | 347(261–482) | 491(378–660) | [ 109 ] |
| 33.0(20.0–54.5) | 33.5(21.0–68.2) | 24.0(16.5–38.5) | 29.5(20.2–45.8) | 10.3(7.6–17.0) | 14.5(9.8–21.7) | 29.0(28.1–33.0) | 27.9(24.1–30.4) | 66.0(29.0〜122.5) | 108.9(58.8–149.4) | 373.0(274.5–618.5) | 558.0(417.2–742.5) | [ 110 ] |
ASTアスパラギン酸アミノトランスフェラーゼ、ALTアラニンアミノトランスフェラーゼ、T.ビリルビン総ビリルビン、CRP C反応性蛋白質、LDH乳酸脱水素酵素、ND未決定
表2 COVID-19患者における炎症性バイオマーカーの代表例。データは、平均値(標準偏差)または中央値(四分位間距離)のいずれかとして記載されている
| IL-1α(pg / ml) | IL-2R(U / ml) | IL-6(pg / ml) | IL-8(pg / ml) | IL-10(pg / ml) | TNFα(pg / ml) | 参照。 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | 軽度 | 重度 | |
| ND | ND | ND | ND | 10.60(5.13–24.18 | 36.10(23.00–59.20) | ND | ND | ND | ND | ND | ND | [ 9 ] |
| ND | ND | 677(496-1016) | 1538(1214–1937) | 13.0(2.4–39.8) | 124.5(65.1–199.9) | 11.0(6.8–21.8) | 49.1(25.2–92.4) | 5.2(5–7.5) | 14.9(5.9–18.6) | 9.1(6.1–11.0) | 17.1(8.4–20.2) | [ 18 ] |
| ND | ND | 566.5(448.0–858.3) | 1189.0(901.0–1781.0) | 13.0(4.0–26.2) | 72.0(35.6–146.8) | 11.4(7.8–20.2) | 28.3(18.7–72.1) | 5.0(5.0–8.4) | 12.8(8.8–19.6) | 7.9(6.7–9.6) | 11.8(8.6–17.6) | [ 19 ] |
| ND | ND | ND | ND | 25.00(3.90) | 83.31(29.78) | ND | ND | ND | ND | ND | ND | [ 20 ] |
| ND | ND | 0.93 a(0.55–1.73) | 90 a(0.47–1.60) | 3.82(2.19–9.87) | 24.11(1.14–54.37) | ND | ND | 3.13(2.15–4.57) | 6.41(3.24–11.02) | 1.35(1.12–1.73) | 1.48(1.39–1.74) | [ 21 ] |
| ND | ND | ND | ND | 10.6(5.8–21.4) | 18.7(14.7–43.7) | ND | ND | ND | ND | ND | ND | [ 22 ] |
| 0.53 | 8.85 | 0.41 a | 1 a | 3.17 | 37.52 | 6.76 | 15.55 | 6.6 | 33.02 | 5.85 | 15.21 | [ 23 ] * |
| ND | ND | ND | ND | 7.70(5.27–19.71) | 28.91(15.89–57.70) | ND | ND | 6.11(5.10〜7.07) | 7.75(6.15–9.37) | ND | ND | [ 24 ] |
| ND | ND | 655.0(483.5–916.5) | 1174.0(915.0–1552.5) | 13.1(3.8–23.5) | 59.7(33.5–137.4) | 12.2(7.8–9.0) | 26.0(14.9–49.4) | 5.0(5.0–6.8) | 9.5(6.7–15.9) | 8.7(6.8–10.8) | 11.0(8.0–14.8) | [ 111 ] |
| ND | ND | ND | ND | 41.36(15.69–180.92) | 64.62(40.35–141.6) | 5.45(3.25–9.72) | 6.7(3.94–11.32) | ND | ND | [ 112 ] | ||
| ND | ND | 800(638–1145) | 1030(942–1496) | 27.2(12.6–62.0) | 84.3(22.6–137.8) | 19.5(13.1–45.3) | 47.5(20.2〜101.0) | 6.7(5.0–10.3) | 11.1(5.8–16.6) | 9.1(7.3–11.1) | 9.9(7.9–21.2) | [ 109 ] |
| ND | ND | ND | ND | 31.8(22.1–69.5) | 93.2(35.5–214.9) | ND | ND | ND | ND | ND | ND | [ 110 ] |
ILインターロイキン、NDは決定されていない
*通常対COVID-19
a IL-2 (pg/ml)として測定され、この列の残りのデータはIL-2Rとして表示される。
いくつかの研究により、SARS-CoV-2の重症例患者では、IL-1β、IL-2R、IL-6,IL-8,IL-10,IL-12,IL-18,IFNγ、MCP1,およびTNF-αの血清レベルが上昇していることが説得力を持って報告されている[9,18-24]。サイトカインストーム」によって引き起こされる全身性炎症は、本質的には分子病態生理学的カスケード、最終的には臓器不全への道筋である。サイトカインの中でも、IL-1,IL-6,TNF-α、およびIFNγが広く解析されている[17]。COVID-19患者のサイトカインレベルを報告した研究では、IL-6と疾患の重症度との間に非常に密接な正の関係があったため、IL-6のレベルはより一般的にモニターされていた。SARS-CoV-2の重症例の患者は、感染の異なる段階でIL-6濃度が2~5倍に上昇している[25]。IL-6濃度の上昇(>24.3pg/ml)は、COVID-19の重篤な症状と強い相関関係を示している[25]。より高いIL-6レベル(> 24.3 pg/ml)の存在は、感度73.3%、特異度89.3%で重症症例を検出することができた[9]。他の研究では、「サイトカインストーム」現象とICUへの通院や人工呼吸器の使用を必要とする患者との関連性が指摘されている[26, 27]。Bangashらは、IL-6と死亡率との間に間接的な関連があることを示しており、IL-6レベルが高いICUに入院したCOVID-19患者の死亡率は44%であった[28]。同様に、高レベルのIL-6,フェリチン、および死亡率との直接的な関連性は、Mehtaら[15]によっても示されている。興味深いことに、IL-6は感染の瞬間から死亡または治癒するまで、ほとんどの患者で着実に増加していることが示された[29]。COVID-19患者におけるサイトカインレベルの知識は、炎症状態の理解を容易にし、最終的には薬物代謝酵素発現、薬物代謝、および薬物動態に対するそれらの潜在的な影響を予測することができる。以下では、非SARS-CoV-2感染/炎症におけるサイトカインの増加、それらの薬物代謝および薬物動態への影響、そして最終的にこれらがCOVID-19患者にどのように反映される可能性があるかを検討してきた。軽度のCOVID-19患者と重度のCOVID-19患者ではサイトカインレベルが有意に異なることが報告されており[9, 18-24]、このことは、疾患の重症度に応じて、炎症や薬物動態、あるいは薬物関連毒性が個人間で異なる可能性が高いことも示唆しているのではないかと考えられる(図11)。
図1 COVID-19関連炎症が肝シトクロムP450調節、薬物代謝、クリアランスに及ぼす影響の可能性
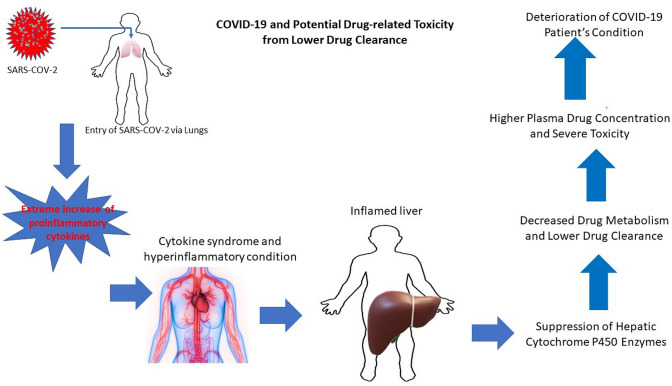
COVID-19患者における肝機能の状態
SARS-CoV-2感染時には、肝臓はウイルスの標的となる主要な臓器の一つである。ACE2受容体は肝臓で発現しているため、ウイルスの直接的な攻撃と全身の炎症、および肝機能を標的とした炎症性免疫原性タンパク質の二重の効果があると考えられる[17]。以前のコロナウイルス感染症と同様に、COVID-19関連患者では、ALT、AST、アルカリホスファターゼ(ALP)γグルタミルトランスペプチダーゼ(GGT)ビリルビンおよびアルブミンレベルの上昇の程度が異なることが肝細胞障害で示唆されている[17]。一般的に、ALT(またはAST)の上正常値(ULN)が少なくとも2倍になると、医療チームの注意を引く [17, 30, 31];しかしながら、文脈が重要であることを認識することは極めて重要である。ALTは肝機能異常の信頼できるマーカーであるが、ALTに対するASTの比率(>1)は進行性の線維化または肝硬変を指している[30-32]。肝機能のマーカーは一般的に上昇していたが、上昇の割合については研究にばらつきがある。肝細胞障害のマーカーを見る際には、2つの側面、すなわち、達成されたレベルの高い範囲と、肝マーカーに異常があるCOVID-19患者の割合を分析すべきである。COVID-19患者コホートの結果を解析したところ、肝機能マーカーは通常ULNと比較して最大5倍まで上昇しており、場合によっては非常に高い数値を示していることが示された[17]。例えば、COVID-19患者ではALTが7590 U/lまで上昇していた[27]。さまざまな研究でCOVID-19患者の約30%がASTおよびALT値が正常範囲を超えている(>40 U/l)。ある研究では、患者の50.7%がALT値が高く、患者の18.2%がAST値が高いことが示された[27]。別の研究では、患者の45%がAST高値を示し、患者の21%がALT高値を示し、肝酵素の上昇と疾患の重症度との間に強い相関関係があるという、同様の結果が示されている[27]。死亡した患者では、肝臓マーカーレベルの異常の有病率は約78%である[27]。異常な結果が得られた患者の割合は、ASTまたはALTの<または>40 IU/lの層別化で考慮されていたことに留意することが肝要である。しかし、近年の主要な臨床ガイドラインでは、ULNの数値は40 IU/l未満であるべきであることが説得力を持って強調されており、例えば、肝保護目的では男性のALT ULNは30 IU/l、女性は19 IU/lであるべきである[33]。この基準値を考慮に入れると、肝機能検査が報告されているCOVID-19患者のほとんどが上昇していることになる。以前、研究者や臨床家は、肝臓酵素と肝臓の健康に対するULNの因果関係を確立することが非常に重要であると見解を述べている[28]。COVID-19患者における肝機能検査を報告した代表的な研究の要約を表11に示す。肝臓はタンパク質合成の中枢であるため、COVID-19による代謝プロファイルのわずかな変化であっても、酵素発現の変化による内因性物質の生合成や外来生物の生分解など、肝細胞の内在的な機能に大きな影響を与えることになる[34]。アルブミンの減少と肝酵素レベルの上昇は、炎症が肝臓に影響を与えていることを示唆している[35]が、肝細胞障害は、生理的、治療的、毒性の転帰の変化を含む内因性物質や外来物質の代謝に幅広い影響を及ぼす可能性がある。
シトクロムP450酵素発現および薬物代謝に対する炎症の影響
薬物代謝酵素 (DME) は、ほとんどの医薬品の生体内変換および最終的な薬物動態に重要な役割を果たしている。代謝とは、薬物の親油性化学構造を変化させて親水性を高め、排泄しやすくするプロセスである。薬物の代謝のほとんどの場合、それは薬物を不活性化するが、少数の薬物(例えば、クロピドグレル)では、生物活性化が代謝の第一の結果である。第3のクラスの薬物は、最初は活性であるが、代謝後に活性な代謝物を持つ(例えば、モルヒネ)[36]。シトクロムP450(CYP)酵素は、治療用低分子薬物、環境毒性物質、および健康補助食品の代謝において重要な役割を果たす第I相DMEのスーパーファミリーである[37]。CYP酵素は一般的に、水酸化を含む広範囲の酸化反応を触媒し、薬剤をより水溶性にし、腎臓が薬剤を排泄することを可能にする。現在、スーパーファミリーには57のCYPアイソフォームが存在し、18ファミリーと43サブファミリーに分類されている。1~4族の酵素は主に外来生物の代謝に関与し、5族以上の酵素は内因性ホルモンやビタミンなどの生理物質の生合成や排泄に寄与している[37]。薬物の60%以上がCYP3A4によって代謝されるため、CYP3A4は相互作用の可能性について最も重要な代謝酵素である。他の主要なDMEには、CYP1A2,CYP2B6,CYP2C9,CYP2C19,およびCYP2D6が含まれる。同様に、第II相DME(例えば、UGT、SULT)もまた、キセノバイオティクスの肝代謝および排泄において重要な構成要素である[37]。この議論には、内因性因子および外因性因子によって頻繁に誘導または阻害される外来生物学的代謝CYP酵素の発現および機能の調節が含まれる。炎症によるCYP発現および機能の変化は、薬物の血漿プロファイルおよび排泄の異常につながり、これが副作用および薬物毒性に関連した致死的転帰を促進することになる[37]。
サイトカインおよびその他の炎症性タンパク質のCYP制御への影響
IL-1,IL-6,IFNγ、およびTNF-αなどの免疫原性タンパク質は、ウイルス感染時にCYP酵素を抑制することができる[38, 39]が、SARS-CoV-2感染時のCYP調節に関するデータはまだ得られていない。それにもかかわらず、サイトカインや他の炎症性タンパク質によって制御されるCYP調節プロファイルは、過去に広く研究されてきた。また、非SARS-CoV-2ウイルス感染や他の炎症性疾患がCYP調節に及ぼす影響は、COVID-19患者におけるもっともらしい絵を描くために使用することができる。肝細胞を用いた試験管内試験では、IL-6が主要なCYPアイソザイムの発現を(40%以上)減少させることが示されている[39]。IL-6が介在する発現の低下は、CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,およびCYP3A4アイソザイムにおいて差動的に観察された[39]。CYP2B6およびCYP3A4は、炎症関連CYPダウンレギュレーションにおいて最も影響を受けるアイソフォームであることが報告されている[39]。COVID-19患者において一般的に検出される炎症性サイトカインがCYP発現に及ぼす影響を表33に示す。CYP発現に対する炎症性サイトカインの影響を表33にまとめた。
表3 炎症性サイトカインがチトクロムP450(CYP)酵素(mRNAまたはタンパク質)の発現に及ぼす影響
| マーカー | CYP1A2 | CYP2B6 | CYP2C9 | CYP2C19 | CYP2D6 | CYP3A4 | モデル | 参照。 |
|---|---|---|---|---|---|---|---|---|
| IL-1β | ND | ND | ND | ND | ND | ↓↓↓ | ヒト肝癌細胞 | [ 87 ] |
| IL-6 | ND | ND | ND | ND | ND | ↓↓↓ | ||
| TNFα | ND | ND | ND | ND | ND | ↓↓↓ | ||
| IL-1β | ND | ND | ND | ND | ND | ↓↓↓ | ヒト肝細胞 | [ 45 ] |
| IL-1β | ↔ | ↔ | ↔ | ND | ND | ↔ | ヒト肝細胞 | [ 113 ] |
| IL-6 | ↔ | ↓↓↓ | ↓ | ND | ND | ↓↓↓ | ||
| IL-6 | ↓↓ | ↓↓↓ | ND | ND | ND | ↓↓↓ | HepaRGセル | [ 114 ] |
| IL-1 | ↓↓↓ | ND | ND | ND | ND | ↓↓↓ | ヒト肝細胞 | [ 115 ] |
| IL-6 | ↓ | ND | ND | ND | ND | ↓↓ | ||
| TNFα | ↓↓ | ND | ND | ND | ND | ↓↓ | ||
| IL-1 | ND | ↔ | ↔ | ↔ | ND | ↓↓↓ | ヒト肝細胞 | [ 42 ] |
| IL-6 | ND | ↓↓↓ | ↓↓ | ↓↓ | ND | ↓↓↓ | ||
| TNFα | ND | ↔ | ↔ | ↔ | ND | ND | ||
| IL-2 | ND | ↓↓ | ND | ND | ND | ↓↓ | 末梢血単核細胞 | [ 116 ] |
| IL-6 | ND | ↓ | ND | ND | ND | ↓ | ||
| IL-10 | ND | ↔ | ND | ND | ND | ↔ | ||
| IL-6 | ↓↓↓ | ↓↓↓ | ↓↓↓ | ↓↓ | ND | ↓↓↓ | 凍結保存されたヒト肝細胞 | [ 40 ] |
↓は25%までの減少、↓は26~50%の減少、↓は50%以上の減少、↔は変化なし、CYPシトクロムP450,ILインターロイキン、NDは未定
ヒト肝細胞を用いた研究では、IL-6 が媒介する CYP 酵素のダウンレギュレーションは濃度依存的な現象であることが示された。1 ng/mlのIL-6を24時間投与した後、CYP3A4レベルは正常レベルの47%減少した[40]。CYP2B6およびCYP3A4と比較して、CYP2C9発現の抑制は、発現を65%低下させるために5 ng/mlのIL-6を必要としたため、より回復力がある[40]。CYP3A4,CYP2B6およびCYP2C9のIL-6によるダウンレギュレーションの平均EC50値は、それぞれ1.2,1.9および3.6 ng/mlである[40]。IL-6曝露によるCYPダウンレギュレーションの程度には個人差が認められた[41]。炎症を介したCYPダウンレギュレーションの発現におけるIL-6の役割は、IL-6欠損マウスモデルにおいて、炎症を誘導するために使用される化学物質であるターペンチンを使用することによって説明された。ターペンチンは、IL-6欠損マウスでは、野生型IL-6マウスとは対照的に、炎症やCYPダウンレギュレーションを引き起こすことができなかった[42]。さらに、著者らは、COVID-19患者に頻繁に存在する他の炎症性サイトカインの影響を測定した。TNF-α、IFNγ、TGF、およびIL-1はCYP3A4発現を有意にダウンレギュレートした[43]。複数のサイトカインが激しく上昇している「サイトカインストーム」において、CYP酵素に対するサイトカインの効果が相加的であるか相乗的であるかは不明である。いずれにしても、COVID-19患者が通常経験する炎症の種類によって、薬物代謝が大きく影響を受ける可能性があるように思われる。
炎症に関連したダウンレギュレーションのメカニズムは、非常に多様であり得る。アリール炭化水素受容体(AhR)構成性アンドロステイン受容体(CAR)およびプレグナンX受容体(PXR)は、それぞれCYP1,CYP2,およびCYP3ファミリー酵素の主要な調節因子である[44]。AhR、CAR、およびPXRの抑制に続いてCYP mRNAおよびタンパク質発現の転写的ダウンレギュレーションは、サイトカインおよび他の炎症を媒介する効果の最もユビキタスな経路である[37, 42, 43]。例えば、IL-1βはCAR発現を低下させる[43]。CYP酵素の抑制におけるIL-1βの役割は、抗IL-1bモノクローナル抗体であるゲボキズマブによるダウンレギュレーションの部分的な反転によって説明された[45]。炎症主導のCYP3A4抑制の別のメカニズムは、C/EBPβタンパク質に関与している。炎症性メディエーター(例えば、IL-1β、IL-6,TNF-α、IFNy)によって引き金を引かれたマウスは、C/EBPβの切り詰められたバージョンを産生し、それが完全バージョンの活性に拮抗してCYP3A4の阻害につながる[42]。さらに、酸化ストレスは、フリーラジカル機構を介してCYP発現を低下させることが知られている感染や炎症の間に一般的な現象である[46]。これは、既知のフリーラジカル消去剤であるビタミンEアナログの投与による炎症関連のダウンレギュレーションの減衰によって合理化された[42]。
感染症および炎症時の薬物代謝および投薬
CYP酵素の主な機能は、酸化反応を介して薬物の排泄を促進することである。したがって、CYP発現のウイルス感染およびサイトカイン関連のダウンレギュレーションは、ヒトにおける薬物動態および薬物動態に直接的な影響を与える。A型肝炎、インフルエンザAおよびB、アデノウイルス、単純ヘルペス、ヒト免疫不全ウイルス(HIV)など、いくつかのウイルスのCYP依存性薬物代謝への影響が研究されている[47]。SARS-CoV-2の薬物代謝酵素や代謝そのものへの影響の報告は少ないが、最近ではCOVID-19の異なる治験薬の薬物動態が限られた範囲で利用できるようになってきた。CYP3A4基質であるシクロスポリンの血漿中濃度の上昇と排泄の減少は、骨髄移植患者におけるIL-6レベルの上昇によって引き起こされた[42, 48]。シンバスタチンとシクロスポリンについても、同様の疾患薬物相互作用が生理学的な薬物動態シミュレーションによって確認されている[49]。CYP3Aプローブ基質であるミダゾラムの代謝は、グル経過-6-リン酸異性化酵素を用いて炎症状態を誘導した12時間後に、血清IL-6およびTNF-αレベルの上昇とCYP3A mRNAの抑制によって測定されるように減少した[50]。CYP1A2媒介のテオフィリンの肝クリアランスは、アデノウイルスまたはインフルエンザウイルスによって減少する[46]。同様に、炎症作用により、HIV患者ではCYP3A4によるプロテアーゼ阻害剤の代謝が低下した[51]。感染および炎症を介した薬物クリアランスの抑制およびその他の薬物動態パラメータの解析から、サイトカインのような免疫原性タンパク質が、薬理学的介入の治療および毒性の結果の個人差に直接寄与しうることが明らかになった。
感染患者におけるCOVID-19薬剤の薬物動態
COVID-19患者の治療レジメンは、多様な病態生理や症状を対象とすることを含むいくつかの理由から複雑である可能性がある。COVID-19患者における治験薬の薬物動態プロファイルには、主に抗ウイルス剤と抗原虫剤が含まれている。COVID-19に対する唯一の米国FDA承認薬であるレムデシビルは、COVID-19患者における薬物動態の報告は非常に限られている。Sorgelらは、親薬であるレムデシビルの濃度-時間曲線下面積、最大濃度、クリアランス、分布量が健康なボランティアと腎障害を有するCOVID-19患者で2.5~4倍異なることを報告している[52]。本剤のパッケージには、代謝の10%しかCYP酵素によって媒介されないことが記載されている[53]ため、高いPK値が腎障害の結果なのか、感染症に関連した代謝酵素のダウンレギュレーションの結果なのか、あるいはその両方が組み合わさったものなのかは不明である。ロピナビル/リトナビルおよびダルナビルは、HIVの治療薬として承認されている抗レトロウイルス薬であり、現在SARS-CoV-2の治療薬として再利用されている[54-56]。その結果、これらの抗ウイルス薬に関する最近のPK報告では、COVID-19患者におけるピーク・トラフ値の中央値をHIV感染者を対象とした過去の研究と比較している。サバイバーと非サバイバーCOVID-19患者の間で血漿ロピナビル濃度に有意な差があった。この研究に参加した13人の患者のCRP値の中央値は170 U/l以上であった[57]。別の研究では、IL-6>18pg/mlのCOVID-19患者、IL-6<18pg/mlの患者、SARS-CoV-2に感染していないHIV患者との間で、ダルナビルの経口クリアランス(CL/F)中央値に大きな差があったことが報告されている(2.78,7.24,9.75 l/h)[54]。しかし、IL-6 < 18 pg/mlの患者とHIV患者との間では、CL/Fに有意差は認められなかった。非成膜COVID-19患者とHIV患者(IL-6レベル31.0 pg/ml vs. 2.0 pg/ml)との比較では、SARS-CoV-2感染患者ではより低いダルナビルCL/Fが示された。IL-6はCL/Fと有意に相関した唯一の因子であった。検査された他の因子には、年齢、体重、BSA、血清クレアチニン、ALT、AST値、およびヒドロキシクロロキン投与の併用が含まれていた[54]。同様に、COVID-19患者の血漿ロピナビル濃度は、HIV患者と比較して6倍高かった(中央値CRP186mg/l)[55]。Marzoliniらは、COVID-19患者にロピナビルとヒドロキシクロロキンを併用投与した場合の血漿中ロピナビル濃度とヒドロキシクロロキン濃度について述べている[58]。COVID-19患者では、HIVコホートと比較してロピナビル濃度が高かった。CRP値が高い(>75mg/l)患者では、CRP<75mg/lの患者と比較してロピナビルのトラフ濃度が高かった。血漿中のヒドロキシクロロキン濃度はCRP値と相関しなかった。年齢(65歳未満または65歳以上)は、同程度のCRP値範囲の患者間で比較した場合、ロピナビル濃度に影響を与えなかった[58]。いくつかの研究では、COVID-19患者におけるロピナビルのトラフ濃度とCRP値との間に正の相関が観察された[55,58,59]。興味深いことに、IL-6受容体に対するモノクローナル抗体であるトシリズマブの投与後、ロピナビルのトラフ濃度は低下しており、これは炎症に関連した薬物代謝および肝クリアランスのダウンレギュレーションがCOVID-19薬の体内動態に大きな役割を果たしていることを示唆している[58]。このことは、活動的な感染または炎症の間に特定のCYP酵素の発現が炎症性タンパク質によって抑制されるという概念を検証している[38,39,41]。実際、ロピナビルとダルナビルは主にCYP3A4によって代謝されるが、同じ酵素はヒドロキシクロロキンの代謝にはマイナーな役割を持っている。このことから、炎症を介したCYP3A4のダウンレギュレーションは、COVID-19 CYP3A4基質薬の代謝低下、クリアランス低下、血漿中濃度の上昇につながる可能性が示唆された。トシリズマブの抗炎症作用は、上昇したサイトカインレベルおよび血漿中薬物濃度を低下させる能力を有している可能性があり、その結果、毒性の増加から患者を保護することができる[58]。PK現象の炎症主導の抑制は、併存疾患を管理するために投与される他の薬剤にも適用可能であり、患者の処分プロファイルを複雑にする可能性がある。例えば、移植患者に使用される免疫抑制薬であるエベロリムスは、抗ウイルス薬のCYP3A4阻害作用だけでなく、CYP3A4活性の低下によっても影響を受ける可能性がある[60]。COVID-19患者における薬剤の薬物動態の簡単な要約を表44に示す。
表4 COVID-19患者における抗ウイルス剤の薬物動態。1剤(ダルナビル)を除き、すべての濃度はロピナビルの濃度を示している
| 患者 | 投薬 | 濃度 | バイオマーカー | 観察 | 参照。 |
|---|---|---|---|---|---|
| 13 | ロピナビル/リトナビル | Cmax-Cmin 20〜30 mg / l | CRP中央値> 170 U / l | 炎症はCYP濃度の低下と関連していた | [ 57 ] |
| 30 | ダルナビル | CL / F:IL-6レベル> 18 pg / ml:2.78 l / h; IL-6レベル<18pg / ml:7.24 l / h(HIV:9.75 l / h) | IL-6の中央値31.0pg / ml(HIV 2.0 pg / ml) | IL-6は、経口クリアランスと有意な関連がある唯一の要因でした | [ 54 ] |
| 17 | ロピナビル/リトナビル | AUC:668,788ng・h / ml(HIV患者:113,200ng・h / ml) | CRP中央値186mg / l | 人工呼吸器を装着した患者; CRPとロピナビルトラフ濃度の間の正の相関 | [ 55 ] |
| 92 | ロピナビル/リトナビル |
Cminレベル:26.5 µg / ml CRP> 75 mg / l:30.7 µg / ml CRP <75 mg / l:20.9 µg / ml (HIV患者:7.1 µg / ml) |
非ICUCRPの中央値53mg / l; ICU CRP 89 mg / l | CRPとロピナビルトラフ濃度の間の正の相関。トシリズマブはトラフレベルを低下させました | [ 58 ] |
| 12 | ロピナビル/リトナビル | Cmax:18,150 ng / ml; Cmin:18,000 ng / ml(HIV:5365 ng / ml) | CRP中央値:48.9 mg / l | 入院患者 | [ 117 ] |
| 8 | ロピナビル/リトナビル |
Cmin:13.6 µg / ml (HIV:7.1 µg / ml) |
平均38.05mg / l | ロピナビルCmin対CRPの関連 | [ 59 ] |
| 21 | ロピナビル/リトナビル |
Cmin:15.235 µg / ml (HIV:4.882 µg / ml) |
CRP 77 mg / l | ヒドロキシクロロキンへの同時曝露 | [ 118 ] |
AUC濃度時間曲線下面積、Cmax最大濃度、Cmin最小濃度、CL/Fクリアランス、CRP C-反応性蛋白質、CYPチトクロムP450,ICU集中治療室
COVID-19患者における薬物代謝と薬物動態
肝機能障害よりも薬物代謝酵素発現への急性影響
COVID-19患者の肝臓健康データの多くは、肝酵素(AST、ALTなど)値が有意に上昇することを強く示唆しており、SARS-CoV-2感染期には肝臓が激しいストレスを受けることが明らかになっている[17,35,61]。しかし、急性期は比較的短いため、感染から回復した後の肝臓の健康状態がどのようになるかは現時点では不明である。炎症および感染に関連した肝障害の重症度によっては、患者は壊死および臓器不全を含む長期的な肝異常を経験する可能性がある[17, 61, 62]。肝機能障害の予後にかかわらず、他のウイルス感染症に匹敵するサイトカインレベルの上昇により、患者はCYP発現に対する急性抑制作用、薬物代謝の低下、薬物排泄の低下、および最終的には活性感染後48~72時間で局所および全身の薬物毒性を経験する可能性が高い[46, 47, 51]。他のウイルス感染と同様に、COVID-19の進行中の「サイトカインストーム」と同様に局所的および全身的な炎症は、CYP3A4,CYP2B6,およびCYP2C9を含む主要なCYP酵素のダウンレギュレーションを引き起こす可能性がある[46, 47, 51]。毒性のある薬物濃度は薬物誘発性肝障害の最も一般的な理由の一つである[63]ので、SARS-CoV-2感染時の異常な肝パラメータもまた、COVID-19の治療に使用されている実験薬、または併存疾患に対するFDA承認薬によるウイルス関連イベントと肝毒性の両方が寄与している可能性がある。肝臓の異常における個人差およびCYP酵素の炎症に関連したダウンレギュレーションは、考慮すべき他の著名な要因である[64, 65]。肝臓の異常の長さに関する不確実性とともに、患者はCYP発現における異なる急性反応を経験する可能性があり、これはCOVID-19の進行中の肝臓の健康状態を予測するためのさらなる課題を提起する可能性がある(図(図2).2)。
図2 COVID-19患者における健康な肝臓と炎症を起こした肝臓の薬物代謝と薬理学的転帰の違い
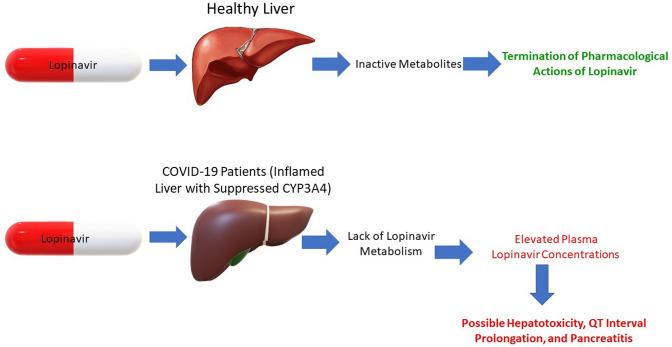
COVID-19に再利用された抗レトロウイルス薬のロピナビルを例に挙げたが、このプロトタイプフローチャートは、シトクロムP450酵素、特にCYP3A4アイソフォームを介して不活性代謝物に代謝される全ての薬剤に適用可能である。
疾患の病態生理が治験薬COVID-19の薬物動態に与える影響
現在、COVID-19を治療するための標準治療薬は存在しない。しかしながら、入院患者には、一般的に、この病態を管理するために実験的に承認された薬剤が幅広く投与されている。治療のほとんどは、発熱のためのアセトアミノフェンやARDSにつながる呼吸困難のための人工呼吸器などの支持療法によるものである[5]。SARS-CoV-2に対するFDA承認の治療法はないが、SARS-CoV-2の再利用薬または治験薬には、抗ウイルス薬(例:レムデシビル、ロピナビル、/リトナビル、ユミフェノビル、ファビピラビル)抗原虫薬(例:ヒドロキシクロロキン、イミフェノビル)抗原虫薬(例:ヒドロキシクロロキン、イミフェノビル)などがある。ヒドロキシクロルキン、イベルメクチン)コルチコステロイド(例えば、デキサメタゾン、メチルプレドニゾロン)およびモノクローナル抗体(例えば、トシリズマブ、炎症性タンパク質を中和するためのカクテル)[5,66]。
レムデシビルおよびファビピラビル
COVID-19治療に使用されているいくつかの薬剤のうち、RNAポリメラーゼ阻害剤であり、治験中のC-アデノシンヌクレオシドプロドラッグであるレムデシビルは、ある程度のポジティブな効果を示した数少ない薬剤の1つである[67]。多くの抗ウイルス薬と同様に、選択性を考慮すると、ウイルス細胞に入るまで完全にリン酸化されることはない。複数の臨床試験では、225mg以下の投与で直線的な薬物動態を示し、可逆的な肝毒性を有する比較的安全な薬物であることが示されている[67]。現在進行中のいくつかの第3相臨床試験では、レムデシビルの有効性が評価され、緊急時の使用許可が中等度のCOVID-19を有するすべての患者に拡大された[67]。レムデシビルの代謝に関する包括的な研究は報告されていないが、レムデシビルはCYP2C8,CYP2D6,CYP3A4の基質として、またCYP3A4とトランスポーターの阻害剤として同定されている[4]。併用炎症状態によるCYP3A4発現の抑制により、レムデシビルの排泄が低下する可能性があると考えられた。さらに、臨床試験では、200mgのローディング用量と100mgの輸液が投与されている[67]が、これは、薬物-薬物または薬物-疾患相互作用により、非線形な薬物動態と予測不可能な用量-毒性関係へと濃度(225mgを超える)が誘導される可能性を示唆している[67]。
Favipiravirは、COVID-19患者で評価されている別のRNAポリメラーゼ阻害薬である。アルデヒドオキシダーゼおよびキサンチンオキシダーゼの基質であり、CYP2C8およびアルデヒドオキシダーゼの阻害剤である。主な副作用として、高尿酸血症、肝機能異常等がある[5]。ファビピラビルの非CYP代謝経路[5]により、COVID-19患者の病態生理的要因がファビピラビルの処分に大きな影響を与えることはないと考えられる。
プロテアーゼ阻害剤 すでに存在している問題を複雑化させているのではないか?
もともと、ロピナビルとリトナビルのプロテアーゼ阻害薬の組み合わせがHIVの治療薬として承認されていた。しかし、この併用療法は、SARS-CoV-2に対する試験管内試験およびCOVID-19患者を含む、異なるコロナウイルスファミリーのメンバーに対するプロテアーゼ阻害についても評価されている。これまでのところ、試験管内試験での抗ウイルス活性はあるものの、いくつかの研究では有効性(例えば、ICU滞在期間、ウイルス負荷クリアランス)が示されている一方で、COVID患者ではこの併用療法と比較対照薬との差がないことが示されている[68]。しかし、この併用療法には有意な胃部副作用、肝毒性、膵炎があることが知られている[68]。ロピナビルとリトナビルはともにCYP3A4基質であるため、CYP3A4発現の炎症関連のダウンレギュレーション後にレベルが上昇する可能性がある。また、両薬剤はCYP3A4を阻害する能力を有することもよく知られている。これらの薬剤の組み合わせは、CYP2B6,CYP2C9,およびCYP2C19を含む他のCYPも誘導する[68]。CYP3A4発現の炎症関連のダウンレギュレーションに加えて、ロピナビル/リトナビルによるCYP3A4介在性代謝の自己阻害が、これらの薬剤の排泄に課題となる可能性がある。肝毒性を引き起こす可能性を考慮すると、本剤の併用は肝臓への毒性負荷を増加させる可能性がある。
クロロキンおよびヒドロキシクロロキン
パンデミックの最初の1ヶ月間(2020年3月)FDAはヒドロキシクロロキンの緊急使用許可を発行したが、後に2020年6月に取り消された;しかしながら、世界の他の地域では、COVID-19の治験治療薬および予防薬としてヒドロキシクロロキンが依然として使用されている[69]。これらの抗マラリア薬は、ウイルスの侵入を阻害し、それによりウイルス負荷を減少させることにより、COVID-19患者における抗ウイルス作用を有することが提案されてきた。いくつかの完了した、または進行中の臨床試験では、クロロキンおよびヒドロキシクロロキンの抗ウイルス効果を確立するための成功はあまり見出されなかった[70]。そのため、これらの抗マラリア薬は、心毒性、肝障害、および有害な視覚効果のために、非常に毒性が高いことが知られている[70]。これらの薬剤はいずれもCYP3A4およびCYP2D6によって代謝されることから、炎症状態におけるCYP3A4の機能が低下することで、よりCYP2D6に向かって代謝が促進される可能性が示唆されている。CYP2D6発現は、典型的な炎症性因子および一般的には非常に少ない化学物質によって誘導または抑制されないことを認識することが重要である;しかしながら、CYP2D6の多型が非常に頻繁に存在するため[71]、患者は、クロロキンおよびヒドロキシクロロキンの排泄の変化、および最終的には予測できない生命を脅かす薬害作用を経験する可能性が高い。
コルチコステロイド
コルチコステロイドは、COVID-19の治療選択肢として浮上してきた別の薬物群である [72]。RECOVERY試験では、通常のケア群と比較して、補助的な酸素を必要とする患者や人工呼吸を受ける患者のリスクが有意に減少した [72]。デキサメタゾンはCYP3A4酵素の誘導剤であり基質でもある [73,74]。デキサメタゾンの代謝低下は、高血糖および体液貯留などのコルチコステロイド関連の急性副作用につながる可能性がある [75]。
支持薬
患者の標準的なケアには人工呼吸のための薬物療法が明示的に含まれていないが、人工呼吸には薬物療法が必要であり、これらの患者の多くは人工呼吸を必要としていることを観察することは関連している。換気を行うためには、患者はまず麻痺していなければならず、麻痺するためには鎮静と鎮痛が必要である。人工呼吸後、患者は深部静脈血栓症の予防、ストレス性潰瘍の予防、および人工呼吸器関連肺炎の予防を受けるべきである [13]。プロポフォールは、麻痺前の深い鎮静に一般的に使用される薬物である。CYP2B6によって代謝されるため、IL-6の影響を大きく受ける[76]。フェンタニルは鎮静および鎮痛に使用され、CYP3A4によって代謝される[76]。ベンゾジアゼピン系薬剤は、大部分がCYP3A4基質であり、このクラスの薬剤との潜在的な疾患薬物相互作用を示唆している。ミダゾラムは鎮静をもたらすために一般的に使用され、CYP3A4によって代謝される[73]。これらの薬物のほとんどは、炎症を媒介とするCYP3A4またはCYP2B6の抑制により代謝が不足した後に血漿中濃度が上昇すると、非常に有害である可能性がある。
併存疾患のための薬剤に対するCOVID-19の潜在的影響
COVID-19関連の薬物療法とともに、患者はしばしば併存疾患のための薬物療法を受けており、特に既往症/併存疾患のある患者はSARS-CoV-2感染に対して最も脆弱である[7]。したがって、COVID-19の患者が疾患-薬物相互作用を起こす可能性は、COVID-19ではない患者に比べてはるかに高い。併存疾患を有する患者を対象に実施されたメタアナリシスでは、COVID-19患者に最も多くみられる3つの基礎疾患、すなわち、患者の16%が高血圧であり、患者の12.11%が心血管疾患を有し、患者の7.87%が2型糖尿病を有していた[7]。これらの患者は典型的にCYP酵素によって代謝される薬物を服用している。CYP3A4は、ほとんどのジヒドロピリジン系カルシウムチャネル遮断薬(アムロジピンおよびニフェジピンなど)すべての非ジヒドロピリジン系カルシウムチャネル遮断薬(ベラパミルおよびディルチアゼムなど)およびプロプラノロールを含む一般的に使用される抗高血圧薬によって代謝される [77-80]。イルベサルタンおよびロサルタンは、CYP2C9によって代謝される降圧薬である[81]。高血圧患者にも使用されることが多いスタチン系薬剤(プラバスタチン、ロスバスタチンを除く)などのコレステロール低下剤は、CYP3A4によって代謝される[82,83]。同様に、グリメピリド、グリピジド、グリブリドなどの抗糖尿病薬もCYP2C9によって代謝される[84]。IL-6は主要な薬物代謝CYP酵素(例えば、CYP2B6,CYP2C9,およびCYP3A4)をダウンレギュレートするので、併存疾患のための薬剤の投与はCOVID-19患者に有害である可能性がある。CYP3A4の抑制は、IL-6の上昇に対して非常に敏感であり、IL-6がわずかに上昇しても24時間以内にダウンレギュレーションされる [40]。同様に、CYP2C9もまた、より高濃度のIL-6によってダウンレギュレートされる。IL-1βもまたCARをダウンレギュレートし、その結果CYP2C9の発現が低下することになる[40]。降圧薬の代謝低下に起因する超治療的血漿レベルは、低血圧および他の関連する副作用をもたらしうる。これは、SARS-CoV-2による全身感染によってすでに引き起こされている低血圧を激化させる可能性がある。同様に、スタチン系薬剤の高濃度投与は横紋筋融解症を引き起こし、これは発熱性のCOVID-19患者がすでに経験している体の痛みを激化させる可能性がある[3]。抗糖尿病薬、特にスルホニル尿素系薬剤の血漿中濃度が最小毒性濃度を超えると、危険な低血糖症を引き起こす可能性があり、患者では食事や挿管が困難になることであるでに悪化している[3]。
COVID-19治療薬はCYPの機能性を修飾することを理解することが非常に重要である。COVID-19治療薬を投与することにより、併存疾患治療薬のすでに存在する薬物の処分に関連する問題を複合化させている可能性がある。例えば、リトナビルは強力なCYP3A4阻害剤であり、すでに抑制されたCYP3A4機能は、リトナビルによってさらに廃止され、最終的には降圧剤、抗糖尿病剤、およびコレステロール低下剤の排除を完全にブロックすることができる[68]。CYP3A4またはCYP2C9酵素を阻害または誘導することが知られているロピナビルやトシリズマブなどのCOVID-19治験薬でも、併存疾患治療薬の同様の代謝変化が起こりうる[39, 85]。このように、CYP酵素の調節障害を介した抗高血圧薬、コレステロール低下薬、および抗糖尿病薬の排泄の低下は、適切な毒性エンドポイントをモニタリングしなければ、患者にとって致命的なものとなり得る。
結論と提言
炎症を抑制し、CYPダウンレギュレーションを逆転させる薬剤
SARS-CoV-2の治療は、ウイルス負荷を低下させ、炎症の原因を取り除くことが第一の戦略であるが、炎症性タンパク質やシグナル伝達を中和するために抗炎症薬を使用することは、CYP酵素のダウンレギュレーションを逆転させることを含むいくつかの病態生理学的症状を減衰させるための間接的ではあるが効果的な方法であるかもしれない。現在、SARS-CoV-2を中和するように設計された2つのモノクローナル抗体カクテル製剤(LY-CoV555,REGN-COV2)が、COVID-19患者に対するFDAの緊急使用承認のために提出されている[86]。さらに、自己免疫疾患で使用され、生命を脅かす「サイトカインストーム」を防ぐために使用されるIL-6受容体に対するモノクローナル抗体であるトシリズマブは、試験管内試験で、CYP3A4,CYP2B6,CYP2C9,およびCYP2C19のmRNAおよび代謝に対するIL-6の抑制効果を減衰または廃止することが示されている[39,87]。同様に、抗TNF-α抗体(例えば、インフリキシマブ、アダリムマブ)の使用もまた、患者がCOVID-19-および併存疾患に関連する薬剤を排除するための最適なCYP媒介薬物代謝能力を有することを確実にすると同時に、生命を脅かす炎症を低下させる可能性のある方法であり得る[88]。メラトニンやビタミンDなどの健康補助食品もまた、炎症を軽減し、IL-6を含む「サイトカインストーム」を減衰させ、CYPの発現と代謝を回復させる可能性があることから、補助療法として注目されている[5, 89]。メラトニンはまた、組織の損傷から形成される活性酸素の除去を助け、治癒を促進することができる可能性がある[89]。したがって、薬物代謝が抑制されたCOVID-19患者は、炎症低下剤による治療後に改善された薬物クリアランスを示す可能性があるという仮説を立てた。実際、IL-6ブロッカー抗炎症抗体であるトシリズマブはCOVID-19患者のトラフロピナビル濃度を有意に低下させたが、これは薬物クリアランスの向上と炎症関連の低下した体内動態の逆転を示している[58]。
COVID-19治療期間中の合併症に対する代替薬の使用
COVID-19に関連することが多い併存疾患には、治療法の選択肢が豊富にある。高血圧および心不全の患者は、CYP酵素によって大部分が代謝されないACE阻害薬を使用することができる [90]。ウイルスはACE2受容体を介して拡散し、ACE2受容体を遮断することで体内への侵入を最小限に抑えることができるため、患者にとっては追加的な利点があるかもしれない。患者が過去に血管性浮腫に罹患したことがある場合、高カリウム血症がある場合、または急性心不全のリスクが例外的に高い場合は、CYP代謝がほとんどないチアジド系利尿薬を使用できるかもしれない[91]。ほとんどのβ遮断薬はCYP2D6によって代謝され、併用するとヒドロキシクロロキンがCYP2D6を阻害するため、注意して使用すべきである[92]。
同様に、糖尿病に対しては、患者のためにいくつかの選択肢がある。スルホニル尿素は、非COVID-19患者に投与すると低血糖症の固有のリスクがあるため、投与量の調整または中止が必要な薬物群である[93]。CYP2C9酵素およびCAR(酵素を調節する受容体)はCOVID-19関連の炎症の影響を受けるため[84]、スルホニル尿素薬が蓄積し、より重篤な低血糖を引き起こす可能性が高い。コレステロール低下薬の場合、ロスバスタチンは主にCYPで代謝されず、90%が糞便中に排泄されるため、アトルバスタチン/シンバスタチン等のCYP3A4基質と比較して有利となる[83]。肝機能がクリアされていない抗糖尿病薬、例えばリラグルチドやセマグルチドなどを考慮する必要がある[94]。いずれの場合も、特定のクラスのCYP代謝薬を服用している患者の安定化が優先されるのであれば、併存疾患に対する薬剤の用量調整がより望ましいと考えられる。
COVID-19患者におけるCYP抑制と薬物代謝低下のタイムライン
現在利用可能な情報から、SARS-CoV-2の初回感染後にCYPの発現および代謝がどの程度の速さで抑制されるか、あるいは抑制がどの程度持続するかを推測することは非常に困難である。サイトカインが測定された研究では、臨床検査は通常、患者が入院してから 2~5日後に行われた [26]。COVID-19感染の通常の経過では、患者は感染してから平均7日後まで入院しない。サイトカインおよび他の炎症性タンパク質を用いた試験管内試験研究では、CYP mRNAはサイトカインへの曝露から 24時間で最大抑制に達することが示されている[95]。したがって、感染の初期段階では、患者はCYP発現のダウンレギュレーションを経験し、代謝能力が低下すると考えられる。縦断的研究では、Liuらは重症と軽症のCOVID-19患者の間のIL-6レベルの違いについて良好な知見を提供した[96]。重症患者では、発症後3日未満でIL-6レベルが平均70pg/mlまで上昇し、その上昇は15日後にレベルが低下し始めるまで続いた[96]。軽症の患者では、IL-6はピークを持たず、病気の経過を通して平均20pg/mlのレベルを維持していた[96]。したがって、患者は、症状が出たり、入院したり、肝機能障害が疑われる前から、代謝の問題を経験している可能性がある。COVID-19の発症/期間や肝機能障害の程度に関係なく、患者は代謝能力の低下を経験する可能性があるため、「サイトカインストーム」と呼ばれる毒性のある薬物のレベルや、併存疾患に対する薬物による肝毒性の増加が、COVID-19患者の肝臓の異常な健康状態に寄与している可能性も十分に考えられる。重度の肝障害を経験する可能性のあるごく一部の患者を除いて、肝細胞は驚くべき再生能力を持っている[30]。薬物間相互作用に類似して、CYP酵素は通常、有害物質がもはや体内に存在しなくなった後、非常に迅速に回復する。この場合、主要な有害物質、すなわち炎症性サイトカインは、感染症発症後15日前後で正常レベルまで後退することが知られており、これによりCYPは徐々に回復することができるようになる[9, 18-24]。入院後の異なる時点でサイトカインレベル、肝機能検査、狭い治療指標薬の血漿を測定し、CYP媒介代謝系の回復を分析することが重要である。
第一線の医療従事者(医師、看護師、薬剤師)への提言
結論として、COVID-19患者は、免疫応答に基づく炎症を含む広範な病態生理学的変化を経験する。「サイトカインストーム」または非常に高いレベルのサイトカインがSARS-CoV-2感染者において確認されており、特に重症化している場合(例えば、ICU内、人工呼吸中、非生存者)[9,10]。炎症性タンパク質との相関関係では、肝酵素レベルもまた、重症患者では症状が軽度の患者よりも低下しているようである[9, 18, 19, 22]。長年にわたり、サイトカインレベルの上昇がCYP調節を強く抑制し、肝および他の臓器の薬物クリアランスを低下させることが、非SARS-CoV-2ウイルス感染症において十分に確立されてきた[46,47,51]。このことは、薬剤濃度の上昇が肝および他の臓器の機能不全を引き起こし得る場合、COVID-19患者における更なる合併症の窓を開く。COVID-19患者では、疾患や症状の治療に必要な薬剤、およびCOVID-19患者に多く見られる合併症の治療薬のためにポリファーマシーを経験する可能性があることを認識することは適切である[4, 7]。COVID-19患者では、ロピナビルやダルナビルなどのCOVID-19薬剤の血漿中濃度が上昇しており[54, 57]、このシナリオは他の薬剤にも適用できる。
重症COVID-19患者の治療計画には、追加の視点を加えることが不可欠である。薬剤師や医師はしばしば薬物間相互作用に非常に注意を払っているが、薬物-疾患相互作用は考慮されていない。COVID-19患者の炎症性タンパク質の影響、CYP調節、薬物動態をリアルタイムで捉えることは困難であるが、生理学に基づいたシミュレーションプラットフォーム(例:GastroPlus、SimCyp)が利用できるようになったことで、研究者はCOVID-19治療薬や合併症に関する患者の潜在的な代謝状態を予測することができるようになったと思われる。臨床医は、このアイソフォームに対するIL-6および他のサイトカインの強力な抑制効果のために、また、臨床における薬剤の大部分がこのアイソフォームによって代謝されるために、CYP3A4基質に特別な注意を払う必要がある[46,47,51]。併存疾患、特に高血圧、糖尿病、高脂血症などの慢性疾患では、薬剤の切り替えが必ずしも現実的ではないかもしれないことは理解できるが、治療指標の狭い薬剤は、中止や用量調整のために効果的に認識すべきである。COVID-19の治験薬(例えば、ヒドロキシクロロキン)や併存疾患用薬剤について、一定の間隔で血漿中薬物濃度を測定することは、感染者における治療上のウィンドウを確立するために必要である。これにより、治療薬モニタリングが容易になり、COVID-19患者の間の薬物濃度上昇に関連した肝機能障害と同様に、副作用を最小限に抑えることができる。外来患者については、患者および/または介護者は、血漿中濃度上昇による薬物毒性および望ましい介入についてカウンセリングを受けるべきである。炎症性サイトカインの有意に高いレベルが、重症のCOVID-19患者にほとんど見られ、彼らはモニタリングおよび介入の対象集団であることに注意することが重要である[9, 18-24]。これもまた、重症COVID-19患者は典型的には血漿中濃度の上昇による毒性を覆い隠すような無数の症状を経験し、多くの患者が生存していないため、代謝状態が悪化していることがまだあまり注目されていない理由であると考えられる。その結果、CYP代謝系の抑制と薬物代謝の低下がCOVID-19重症患者の臓器障害や死亡率の上昇に寄与しているのではないかと予測している。全体として、COVID-19の病態生理に関する知識とCYP発現状況や薬物代謝・薬物動態範囲の理解は、潜在的に薬物関連毒性を最小限に抑え、感染者の薬物療法を最適化することになると考えられる。
