Contents
- Possible Adverse Effects of High-Dose Nicotinamide: Mechanisms and Safety Assessment
- 要旨
- 1. はじめに
- 2. ニコチンアミドの効果を支えるメカニズムと生化学に関するブリーフ
- 3. 高用量のニコチンアミドの潜在的な毒性および有害作用
- 図2 高用量のニコチンアミドの副作用の可能性のある経路
- 表3 細胞や動物を対象とした研究で報告されている高用量ニコチンアミドの副作用の例
- 3.1. 遺伝毒性及び発がん性の可能性。3.1. 生殖毒性及び発がん性の可能性:ニコチンアミドの決定的な影響
- 3.2. サーチュイン活性の阻害:生体内では重要ではないかもしれない効果
- 3.3. 高NAD+/NADH比。高NAD+/NADH比:エネルギー代謝への懸念
- 3.4. 高レベルNAD+。タンパク質翻訳への影響
- 3.5. 高レベルのニコチンアミドメチル化 メチルプールの変化による潜在的な影響
- 3.6. 高レベルの ニコチンアミド メチル化 メチルプールの変化による潜在的な悪影響
- 3.7. metニコチンアミドの潜在的な陽性効果:提案されている副作用との矛盾
- 3.8. N-メチル-2-ピリドン-5-カルボキサミド:尿毒症毒素の一種である。
- 4. おわりに
Possible Adverse Effects of High-Dose Nicotinamide: Mechanisms and Safety Assessment
www.ncbi.nlm.nih.gov/pmc/articles/PMC7277745/
要旨
ニコチンアミド(ニコチンアミド)は、ビタミン剤として推奨されている量をはるかに上回る量を摂取することで、神経機能障害、うつ病などの精神疾患、炎症性疾患など、幅広い疾患や状態に有効であることが示唆されている。
近年、ニコチンアミド・アデニン・ジヌクレオチド(NAD+)前駆体の長寿効果に対する意識の高まりを背景に、臨床治療のみならず栄養補助食品としてのニコチンアミドの消費がさらに拡大しており、長期使用の安全性が懸念されている。しかし、副作用の可能性やそのメカニズムは十分に解明されていない。
ニコチンアミドの高濃度投与は、複数の経路で悪影響を及ぼす可能性がある。例えば、ニコチンアミドはそれ自体がゲノムの完全性を保護するポリ(ADP-リボース)ポリメラーゼ(PARP)を阻害する。NAD+プールの上昇は細胞のエネルギー代謝を変化させる。
一方、高レベルのニコチンアミドは細胞のメチル代謝を変化させ、DNAやタンパク質のメチル化に影響を与え、細胞のトランスクリプトームやプロテオームに変化をもたらす。また、ニコチンアミドのメチル代謝物であるメチルニコチンアミドは、特定の疾患や病態において役割を果たすことが予測されている。
本レビューでは、ニコチンアミドの考えられる副作用の包括的なリストを提供し、それらの基礎となるメカニズムの理解と、提起された安全性の懸念の評価を提供するために、文献検索を実施した。その結果、現在のニコチンアミドの使用レベルでの安全性は保証されているが、高用量での慢性的な使用に伴うエピジェネティックな変化の潜在的なリスクも見いだされた。また、より安全にニコチンアミドを使用するための今後の研究の方向性を示唆している。
キーワード
ニコチンアミド、メチルニコチンアミド、NAD+、副作用、PARP、SIRT1,SIRT3,ミトコンドリア、活性酸素、DNAメチル化
1. はじめに
1938年にElvehjemらがニコチン酸アミド(ニコチンアミドとして知られている)を用いた犬のペラグラの治療法を報告して以来[1]、ニコチンアミド(ニコチンアミド)はビタミンとして必要とされる量(例えば500〜3000mg)をはるかに上回る量で、様々な疾患や病態に応用されていた。
その有用性は、虚血性再灌流や同様の酸化ストレスからの神経細胞や血管細胞の保護[2]、アルツハイマー病やパーキンソン病などの神経機能障害の予防[3,4,5,6,7,8,9]、うつ病や他の精神疾患の治療[10,11]に観察されている。
化合物はまた、尿毒症性そう痒症、炎症性疾患[12,13,14]、光老化および皮膚癌[15]、さらにはHIVの生殖[16,17]の発症に対しても有望であることを示した(表1にまとめた)。糖尿病の発症予防効果は、いくつかのヒト試験で示されているが、その後の研究ではそのような効果がないことも報告されている[20,21]。また、いくつかの初期の研究では、うつ病や不安症などの心理状態の改善が認められている[22,23]。現在、ニコチンアミドは水疱性類天疱瘡[24]、皮膚癌[25]、にきび病変[26]などの皮膚疾患に使用されている。さらに、各種化粧品の有効成分として広く添加されている[27]。ヒトでの試験結果の例を表2に示す)。
表1 ニコチンアミド(ニコチンアミド)の高用量投与による有益な効果のまとめ
| 効果 | 効果の例 | 参考文献 |
|---|---|---|
| ATP枯渇に対する保護 | [ 2 ] | |
| ADの病状の減少と認知機能の低下 | [ 10 ] | |
| 改善された感覚および運動神経学的行動 | [ 3 ] | |
| 両側前頭脳損傷からの回復の増加 | [ 4 ] | |
| 神経保護 | 脳卒中を起こしやすい高血圧ラットにおける虚血性脳卒中の予防/遅延 | [ 5 ] |
| 外側膝状体神経細胞死の減少 | [ 6 ] | |
| 全体的な虚血後の海馬神経細胞死の減弱 | [ 7 ] | |
| ハンチントン病の表現型に関連する運動障害の改善 | [ 8 ] | |
| NAD +レベルとミトコンドリア機能の増加 | [ 9 ] | |
| うつ病と精神障害の改善 | うつ病の改善 | [ 28 ] |
| 社会的相互作用の増加 | [ 11 ] | |
| 抗炎症 | カラギーナン誘発性胸膜炎または自己免疫疾患の病変における好中球動員の減弱 | [ 12、13 ] |
| 関節炎活動の低下 | [ 14 ] | |
| 視力および難聴に対する保護 | 動物における網膜色素細胞死および加齢性黄斑変性症の減弱 | [ 29 ] |
| 視神経変性と緑内障の発生率の低下 | [ 30、31 ] | |
| 免疫調節 | 致死的なブドウ球菌エンテロトキシンBチャレンジ後のマウス生存率の改善 | [ 32 ] |
| 皮膚保護/抗 皮膚障害/化粧品 効果 |
炎症性サイトカインの発現のダウンレギュレーションとUV光に対する保護 | [ 33 ] |
| 抗線維症 | 肺線維症の発症の減弱 | [ 34、35 ] |
| 抗転移および 補助がん療法 |
膀胱腫瘍の成長と進行の低下 | [ 36、37 ] |
| 光防護と皮膚がんの発生率の低下 | [ 15 ] | |
| 抗HIVおよび-AIDS | プロウイルス統合の減少 | [ 16 ] |
| ウイルスRNA発現の低下 | [ 17 ] |
表2 ヒトを対象とした研究で示されたニコチンアミドの陽性及び陰性の影響 1.
| 影響を受ける臓器と状態2 | 観察された効果 | 用量と期間 | 参考文献 |
|---|---|---|---|
| 有益な効果 | |||
| 関節 | 尿毒症患者のかゆみの軽減 | 550mgを1日2回 (4週間) |
[ 38 ] |
| 膵臓β細胞 | β細胞機能の維持と改善 | 1日摂取量25mg / kg (4週間) |
[ 18、39 ] |
| 糖尿病の発生率の低下 | 500mgを1日2回 (2。5年) |
[ 19 ] | |
| 糖尿病がないことの発生率に影響はありません | 1日1200mg摂取量 (5年) |
[ 20 ] | |
| 糖尿病の予防または臨床的発症の遅延には効果がない | 1日摂取量1.2g (3年) |
[ 21 ] | |
| 肌 | ニキビの病変と重症度の軽減 | 4%ジェルを 1日2回 (8週間)塗布 |
[ 26 ] |
| 代謝とアポトーシスの変化を伴う免疫抑制の減弱 | UV照射前に5%ローションを塗布 | [ 40 ] | |
| 心理学 | うつ病に対する改善 | 1日摂取量0.5〜1.5 g (3週間) |
[ 22 ] |
| 不安からの解放。 | 試験の3時間前に2ugの用量 | [ 23 ] | |
| 腎臓 | リン、副甲状腺ホルモン、LDLの血清濃度を下げ、血清HDLを増やしました | 500mg /日(2週間ごとに増加) (12週間) |
[ 41 ] |
| 皮膚がん非黒色腫 | さまざまな種類の皮膚がんや光線性角化症の発生率の低下 | 500mgを1日2回 (4ヶ月) |
[ 42 ] |
| 有害な影響 | |||
| マイナーな影響 | 前頭葉の鈍い頭痛、吐き気、頭痛、めまい | 1〜18g 即時 |
[ 43、44 ] |
| 膵臓のβ細胞/血漿 | インスリン感受性の低下、酸化ストレスの増加(H 2 O 2) | 1日2g (2週間) |
[ 45、46 ] |
| 肝臓 | 実質細胞損傷、門脈線維症および胆汁うっ滞、肝損傷 | 1日3、9g (10日) |
[ 47 ] |
| リンパ球、血小板 | 尿毒症毒性関連の癌および血小板減少症 | 1300、1500 mg /日 (24週間) |
[ 48 ] |
| 腎臓/血小板 | 血清リンの減少と血小板減少症 | 1日0.52〜2 g (3〜6か月) |
[ 49、50 ] |
1 ヒトを対象とした研究例をいくつか紹介している。受益者効果の詳細については、参考文献[27]を確認する。2 皮膚を除くすべてのヒトへの適用において、ニコチンアミドは食事摂取により投与された。
1940年代初頭から、ニコチンアミドとナイアシン(ニコチン酸(NA)としても知られている)は、米国では食品補助食品として大量に消費されてきた。米国におけるナイアシンの一人当たりの消費量は、1940年代初頭にナイアシンの強化が義務化されて以来、2倍に増加している[51]。食品添加物、化粧品サプリメント、栄養補助食品におけるニコチンアミドの需要の高まりにより、その生産量は継続的に増加している。さらに、ニコチンアミドの有益な効果に関する最近の国民の意識の高まりにより、その生産量は2012年の56.520メトリックトンから 2016年には30%増の71.192メトリックトンへと大幅に増加している(Global Nicotiニコチンアミドide Market Research Report 2017)。
治療薬としてのニコチンアミドの効果は、特定の酵素を標的とした薬剤のように急性のものではなく、あるいは強いものではないかもしれない。ニコチンアミドの効果は、大部分が、代謝の恒常性維持に重要な役割を果たすニコチンアミド・アデニン・ジヌクレオチド(NAD+)のレベルの増加、および健康および長寿に重要な役割を果たす特定の酵素の活性の増加によって媒介される。
例えば、SIRT1は、加齢に伴う機能障害や酸化ストレスに対する抵抗力に重要な役割を果たす分子である。NAD+とSIRT1の両方の活性レベルは加齢とともに低下する。NAD+の補給によってこの変化を相殺することは、動物およびヒトの研究において、健康的な老化に有益であると提案されている[52]。
したがって、栄養補助食品としての ニコチンアミド の長期摂取は魅力的である。この傾向は、安全性の保証と ニコチンアミド の作用機序の明確な理解を必要としている。文献レビューでは、ニコチンアミドの様々な有益な効果およびその基礎となるメカニズムが提示されている(例えば、Song, 2019)[27]。
しかし、ニコチンアミドの潜在的な副作用についての評価は現在のところ不足している。このような効果を報告している研究は散在しており、包括的な分析はまだ行われていない。本レビューでは、ニコチンアミドの潜在的な副作用についての文献検索をまとめて提示し、潜在的な基礎となる分子メカニズムについての包括的な分析を提供する。
2. ニコチンアミドの効果を支えるメカニズムと生化学に関するブリーフ
ヒト細胞では、ニコチンアミドは容易にニコチンアミドモノヌクレオチド(NMN)に変換され、次いでニコチンアミドアデニンジヌクレオチド(NAD+)に変換される。細胞内のNAD+産生のためのこのサルベージ経路は、ニコチンアミド効果の多くにおいて重要な経路であるように思われる。これを裏付けるように、ニコチンアミドの効果のほとんどは、ニコチンアミドのNMNへの変換を触媒するニコチンアミド・アデニン・モノヌクレオチド・ホスホトトランスフェラーゼ(ニコチンアミドpt)[53]の阻害によって廃絶される(図1)。また、他のNAD+前駆体であるNAとニコチンアミドリボシド(NR)の効果は、ニコチンアミドの効果と大きく重なっている。
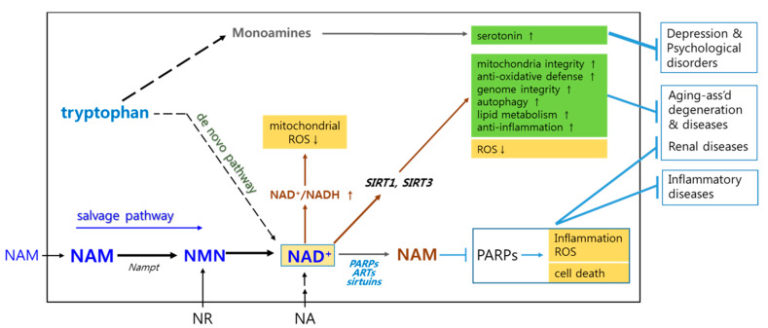
図1 ニコチンアミドの代謝経路と受益効果を模式的に示したもの
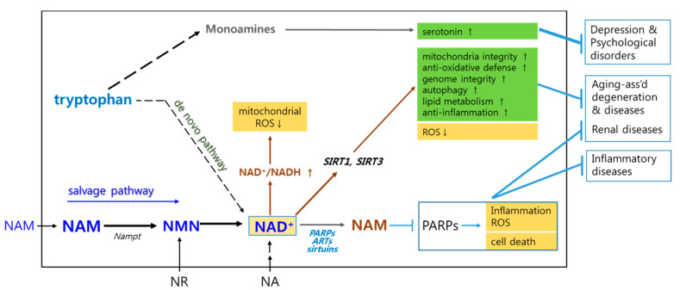
細胞内(灰色枠)では、ニコチンアミドは主にニコチンアミドモノヌクレオチド(NMN)を介してサルベージ経路を経てニコチンアミドアデニンジヌクレオチド(NAD+)に変換される。NAD+は還元されてNADHとなり、NAD+レドックスが確立され、ニコチンアミド処理はミトコンドリアのエネルギーと活性酸素の発生に影響を与える。また、NAD+はポリADP-リボースポリメラーゼ(PARP)サーチュイン、ADP-リボーストランスフェラーゼ(ART)などによってニコチンアミドとADP-リボースに分解されるが、ニコチンアミドはこれらをフィードバック阻害する。
これらのうち、PARPの阻害は、抗炎症作用、抗酸化作用、抗細胞生存作用の重要な経路となっている。NAD+の増加は、SIRT1やSIRT3などのサーチュインタンパク質を活性化し、抗酸化、ゲノム安定性、オートファジー、脂質代謝など、細胞に有益な様々な効果を発揮する。また、これらは共にミトコンドリアの質と完全性を維持し、活性酸素の発生を低く抑える働きをしている。これらの作用により、加齢に伴う変性疾患、腎疾患、炎症性疾患などに対して効果を発揮すると考えられる。これらの作用により、神経細胞や膵臓のβ細胞を保護することが期待されている。
一方、細胞内のNAD+プールのごく一部は、セロトニンの供給源でもあるトリプトファンからの新規合成によって供給されている。そのため、ニコチンアミドサプリメントはセロトニンレベルの維持に役立ち、それによってうつ病や精神疾患を緩和することができる。また、ニコチンアミドリボシド(NR)やニコチン酸(NA)を補給することで、NAD+レベルが上昇する。
細胞のNAD+レベル、それによってNAD+/NADH比は、ATP合成だけでなく、活性酸素種(ROS)の発生にも影響を与える[54,55]。したがって、NAD+は老化や多くの病態に関与していると考えられている[56]。ニコチンアミドによるNAD+レベルの上昇は、複数のメカニズムを介してミトコンドリアからの活性酸素の発生を減少させる(図1)。
NAD+/NADHの増加
第一に、NAD+/NADHの上昇はミトコンドリア膜電位の低下をもたらし、電子の逆輸送を介したスーパーオキシド生成の機会を減少させる[55,57]。
SIRT1 、SIRT3活性
第二に、高い NAD+ レベルは、代謝恒常性、細胞の生存と増殖、ストレス抵抗性、ミトコンドリアの維持に機能する NAD+ 依存性脱アセチラーゼである SIRT1 や SIRT3 などのミトコンドリアの品質管理に関与するタンパク質の活性化を促進する [27,58]。
SIRT1 活性は、ミトコンドリア生合成に関与する因子(ペルオキシソーム増殖因子活性化受容体γ-1α(PGC-1)α)やマイトファジー(オートファジー遺伝子タンパク質、ATG)を動員してミトコンドリアのターンオーバーを促進することで、ミトコンドリアの維持を促進している[27]。また、マンガン依存性スーパーオキシドジスムターゼ(MnSOD)やカタラーゼを誘導するフォークヘッドボックスプロテインO(FoxO)タンパク質の活性化を介して細胞の抗酸化防御を促進する[59]。
一方、SIRT3活性はMnSODの活性化を介してミトコンドリアのROS発生を抑制する[60,61]。また、SIRT3は、ミトコンドリアマトリックスタンパク質であるシクロフィリンDの脱アセチル化を介してミトコンドリア透過性遷移孔(mPTP)の閉鎖を誘導することで、ミトコンドリアの完全性を促進する[62]。SIRT1およびSIRT3タンパク質のこれらの抗酸化作用およびミトコンドリア促進作用は、酸化ストレスに対して脆弱なニューロンやその他の細胞を保護し[2,63,64]、骨髄幹細胞を含むヒト細胞の試験管内試験複製寿命を延長する上で重要な役割を果たしている[55,65,66,67,68]。
PARPの阻害
第三に、ニコチンアミドの抗酸化作用は、ポリ(ADP-リボース)ポリメラーゼ(PARP)の直接的な阻害によっても駆動される可能性がある。PARPは、鎖切断部位でDNAに結合し、DNA修復酵素をリクルートすることにより、ゲノムの完全性を保護する。その際、PARPはNAD+を分解し、ニコチンアミドとADP-リボースを生成する [69,70,71,72]。活性化されたPARPは、核内因子κB(NF-κB)の活性化を介して炎症を誘導する [73]。PARPs へのフィードバック阻害剤として作用することで、ニコチンアミド は炎症を抑制し、それによって炎症関連疾患に対する抗酸化作用や治療効果を発揮する[38,74,75,76]。ニコチンアミドはまた、重度のDNA損傷を受けた細胞を、PARPによるNAD+およびATPプールの枯渇によって引き起こされるアポトーシスまたは壊死から保護する。実際、ニコチンアミド投与による動物の膵β細胞の死の減衰は、PARP阻害を介した細胞保護、ミトコンドリアの完全性の向上、およびROSの生成の減少によって駆動されることが提案されている[77,78]。
SIRT1の活性化は、標的分子の脱アセチル化を媒介とした活性化により、他の多くの治療上有用な効果をもたらす。例えば、ペルオキシソーム増殖因子活性化受容体(PPAR)-αおよび-γの活性化による脂質分解および脂肪酸酸化の亢進 [79,80,81]、DNA 修復機構のメンバーである Ku70 の活性化によるゲノム完全性の保護 [82]、NF-κB [83]および p53 [84]の阻害による炎症およびアポトーシスの抑制などが挙げられる。これらの効果を合わせて、加齢に伴う変性や疾患を予防することができる[85]。ニコチンアミド による PARPs と NF-κB の阻害、および NAD+ 介在性 SIRT1 活性化は、腎臓病の重要な病因となる腎細胞の炎症、酸化ストレス、線維化、およびアポトーシスを緩和する[86]。
ニコチンアミド投与によるNAD+レベルの上昇は、腎および糞中のPi排泄をサポートし、末期腎不全に頻繁に関連している高リン血症を緩和する[87]。NAD+は、腎近位尿細管および腸におけるリン酸塩取り込みの主要な経路であるNa+-リン酸塩コトランスポーター(NaPi2aおよびNaPi2b)を阻害する[88,89]。
最後に、ニコチンアミドはうつ病や精神障害を改善することが示されている。また、片頭痛、めまい、乗り物酔い、双極性障害や行動障害、アルコール依存症、栄養失調による神経細胞死など、より広範囲の精神障害やその他の愁訴に対しても有効であることが示されている[90]。ニコチンアミドは、トリプトファンから合成される気分安定化ホルモンであるセロトニンを含むモノアミン神経伝達物質のレベルを上昇させることにより、このような状況下で作用する可能性がある。細胞内NAD+のごく一部はトリプトファンからの新規合成によって供給される [91]。ニコチンアミドの補充は、de novo NAD+合成の必要性を低下させ、それによってセロトニン合成を継続するためにトリプトファンを確保するだろう [92]。
3. 高用量のニコチンアミドの潜在的な毒性および有害作用
5 mMに近い用量のニコチンアミドは、培養中の細胞の生存性および複製能に正の効果を示す [65,93]。しかし、20mMを超える用量では、ニコチンアミドはアポトーシス死を引き起こし、半阻害濃度(IC50)または半細胞死用量は21.5mMと報告されている[94,95]。したがって、試験管内試験では、ニコチンアミドの有効量と毒性量の間には狭いギャップがある。動物実験では、ニコチンアミドのサンプルの50%の致死量(LD50)は、マウスでは経口投与で2.5g/kg、腹腔内投与で2.05g/kgであり、ラットではそれよりわずかに高いことが示されている[96]。これらの用量は、ヒトに外挿すると、それぞれ150および120gに近づく。これらの高用量のニコチンアミドの致死性は、生化学的効果よりもむしろ高張液による浸透圧ショックに起因すると考えられる。
一方、長期投与中であっても、ニコチンアミドの1日摂取量1g(または3gまで)に近い用量の耐性は、多くの研究で実証されている。例えば、欧州ニコチンアミド糖尿病介入試験(ENDIT)では、1日25~50mg/kgのニコチンアミドを5年間投与し、副作用が報告されなかった[20,97]し、最近の臨床研究では、1.5gのニコチンアミドを1日2回6ヶ月間摂取しても高齢者では安全であることが示された[NCT00580931]。
これらの研究は、現在広く普及している1日あたり500-1000mgの長期的な食事摂取の実践における安全性を保証するものである。健康なヒトに6gまでのニコチンアミドを空腹時に摂取した場合、頭痛、めまい、および嘔吐が発生したが[43]、これらの副作用は軽度であり、投与終了時には消失した。しかし、一定量以上のニコチンアミドを投与した場合には、動物において副作用が認められている。さらに、ニコチンアミドの生化学的性質から、投与による潜在的な副作用が懸念される。このため、ニコチンアミドおよびその代謝物の特性や作用機序について詳細に解析する必要がある(表3および図2にまとめている)。
図2 高用量のニコチンアミドの副作用の可能性のある経路
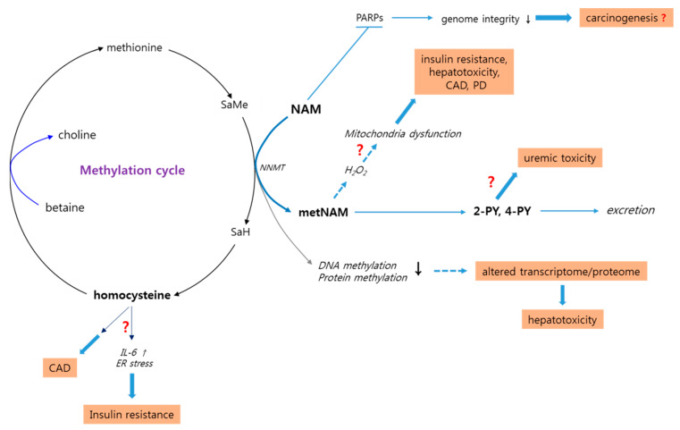
高濃度ニコチンアミドは複数の異なる経路で障害を誘発することが提案されている。
第一に、ニコチンアミドはPARPタンパク質を阻害し、それによって抗炎症作用を誘導するが、同時にゲノム不安定性を引き起こし、発がんにつながる可能性がある。
第二に、多量のニコチンアミドのメチル化は、細胞のメチルプールを低下させる。これにより、DNAやタンパク質のメチル化が低下し、それによって遺伝子発現やタンパク質活性のパターンが変化する。これは、肝ステアトーシスおよび線維化と病因的に関連していることが提案されている。一方、ニコチンアミドのメチル化はmetニコチンアミドを産生し、これが高レベルの活性酸素の発生とそれに続くミトコンドリアの機能障害を引き起こすことで、インスリン抵抗性、冠動脈疾患(CAD)パーキンソン病(PD)の発症を引き起こす可能性があると考えられている。しかし、Metニコチンアミドに誘導された活性酸素の発生が有害かどうかは明らかではない。MetニコチンアミドはさらにN-メチル-2-ピリドン-5-カルボキサミド(2-PY)に代謝され、その血中濃度の上昇は慢性腎障害を持つ患者に有害である可能性がある。一方、高レベルのニコチンアミドによるメチル化サイクルの増加は、ホモシステインの増加につながり、このホモシステインはインターロイキン-6(IL-6)の発現を増加させ、小胞体(ER)ストレスを誘発することで、インスリン抵抗性やCADの引き金となる可能性がある。しかし、高レベルのニコチンアミドとこれらの病態との間に提案されているこれらの関連性のほとんどは、実験的証拠によって十分に支持されていない。
表3 細胞や動物を対象とした研究で報告されている高用量ニコチンアミドの副作用の例
| 科目 | 効果の例 | 用量 | デュレーション | 参照。 |
|---|---|---|---|---|
| マウス胚性幹細胞の死 | 20 mM | 3〜4日 | [ 95 ] | |
| 腫瘍形成性。DNA損傷、および姉妹染色分体交換 | 1〜10 mM 10 mM |
3時間 40時間 |
[ 100、101 ] | |
| 細胞 | 25 mM | 48時間 | [ 102 ] | |
| SIRT1アクティビティの減少。細胞内ROSの増加、紡錘体欠損、およびミトコンドリア機能障害 | 5 mM | 6、12、24時間 | [ 106 ] | |
| ブロックされたミトコンドリア関連の転写。ハンチントン病モデルにおける運動障害の悪化 | 0.5、1 mM | 96時間 | [ 9 ] | |
| マウスとラット | 肝臓および腎臓組織における酸化的DNA損傷。耐糖能とインスリン感受性の障害 | 1または4g / kg、dw | 8週間 | [ 94 ] |
| 致死性の増加 | 4.5 g / kg、dw、 2.5 g / kg、ip |
40日 | [ 44 ] | |
| 膵島細胞腫瘍の発生 | 350 mg / kg、ip | 226日 | [ 107 ] | |
| 腎臓腫瘍の発生率の増加 | 350 mg / kg、ip | 死ぬまで | [ 108 ] | |
| 成長率の低下 | 1、2%、dw 1、2%、dw |
24日 20日 |
[ 109、110 ] | |
| 成長阻害、メチル欠乏、組織コリンレベルの低下、および肝脂質の増加 | 6、20、60 mg / 100 g bw、ip | 2、5週間 | [ 111 ] | |
| アセトアミノフェン誘発性の生化学的変化の改善が健康な動物における肝毒性の発生 | 500 mg / kg、ip | 1.5時間 | [ 112 ] | |
| 脂肪肝および線維症の発症 | 1%、dw | 6週間、 7ヶ月 |
[ 113 ] | |
| ドーパミン作動性ニューロンの神経変性 行動障害と構造的脳変化 |
500 mg / kg、ip | 28日 | [ 114 ] | |
| ミトコンドリア関連の転写の遮断、運動表現型の悪化 | 250mg / kg /日、sc | 28日 | [ 9 ] |
ip、腹腔内注射; dw、飲料水; およびsc、皮下注射。
3.1. 遺伝毒性及び発がん性の可能性。3.1. 生殖毒性及び発がん性の可能性:ニコチンアミドの決定的な影響
ニコチンアミドは、DNA鎖切断を認識し、修復を誘導する機能を持つPARPの活性を阻害する。そのため、PARP活性の抑制は、DNAの完全性の喪失や姉妹染色体交換(SCE)の亢進など、特定のタイプの癌と因果関係があると考えられている[98] [99]。このため、ニコチンアミドの発がん性および共がん性効果は初期の研究の焦点となっている。しかし、いずれの場合も大規模な結果は決定的なものではない。例えば、1~10mMのニコチンアミドや他のPARP阻害剤での処理は、NAではなくSCEの増加をもたらした[100,101]、25mMのニコチンアミド処理はチャイニーズハムスター卵巣細胞において染色体の大きな構造異常を誘導した[102]。一方、ニコチンアミド 欠損は PARP 阻害剤の SCE 誘導能を増大させた [103]。このことは、染色体保護におけるニコチンアミドのPARP非依存的な効果を示唆していると考えられる。また、SIRT1 活性化による DNA 完全性の保護 [82] が関与している可能性があるが、この研究では考慮されていなかった。一方、サルモネラ菌やチャイニーズハムスター線維芽細胞を用いて ニコチンアミド の変異原性をエイムズ試験で評価したところ、その結果はヌル効果を示した[104]。また、ニコチンアミドを3mM付近の線量で処理した場合、ガンマ線または紫外線照射後にDNA修復が増加することが報告されている[105]。ニコチンアミドの共発がん効果に関する研究もまた、決定的なものではない。
例えば、ニコチンアミド(350mg/kg)とストレプトゾトシンを併用して腹腔内投与したラットの64%に膵島腫瘍が形成されたが、ニコチンアミドまたはストレプトゾトシン単独投与したラットでは腫瘍は1個または全く形成されなかった[107]。しかし、ニコチンアミドとの共投与により腎腺腫が有意に減少したことが同グループにより報告されている[115]。一方、ニコチンアミド(350mg/kg、i.p.)を発がん性物質ジエチルニトロサミンと併用した場合、腎臓腫瘍の発生率は増加したが、肝臓腫瘍の発生率は減少した[108]。このことは、ニコチンアミドの臓器特異的な共発がん効果を示唆しているが、その根本的な理由は不明である。ニコチンアミドは、腫瘍開始および腫瘍促進の異なる段階で異なる作用を示す可能性がある。全体的に、発がんまたは腫瘍促進に対するニコチンアミドの効果は明らかではなく、ニコチンアミドの長期摂取に関してかなりの懸念を提起している。20年以上前に5年間実施され、高用量のニコチンアミドの安全性を謳ったENDIT試験の被験者を対象としたフォローアップ試験を実施すれば、この点で重要な情報が得られるかもしれない。一方、ニコチンアミドは肺がんに対する抗がん作用の可能性について臨床試験が行われている[NCT02416739]。
3.2. サーチュイン活性の阻害:生体内では重要ではないかもしれない効果
PARP と同様に、サーチュインファミリータンパク質は ニコチンアミド によるフィードバック阻害の影響を受けやすい。そのため、特定の生物学的機能における SIRT1 活性に関わる実験では、ニコチンアミド が好ましい阻害剤となっている[46]。例えば、分化する脂肪細胞におけるトリグリセリドレベルの低下における SIRT1 の役割に関する研究では、10 μM の ニコチンアミド が SIRT1 媒介によるトリグリセリドレベルの低下を減衰させた [116]。この阻害が生体内で起きれば、身体機能の深刻な低下を招くことになる。しかし、多くの研究では、ニコチンアミドの阻害効果は決定的なものではなかった。例えば、ニコチンアミドでの処理は、処理後6時間または12時間で調べた場合、マウスの卵母細胞におけるサーチュインタンパク質の活性を低下させたが、この効果は24時間で調べた場合には再現されなかった[106]。観察は、高[ニコチンアミド]の細胞状態が処置された被験者では短期間であることを示している。腹膜または経管投与されたマウスの肝臓では、組織の ニコチンアミド レベルは直ちに上昇し、10 分以内にほぼ 4 倍の誘導に達した(経管投与されたマウスの肝臓では)。しかし、このレベルはその後減少し、基底値より2倍近く高いレベルで維持された[46,117]。高用量のニコチンアミドを食事で摂取した場合、血中濃度の上昇も2時間維持される[46]。ニコチンアミドと同様に、NAD+のレベルは、同様の初期の時点から上昇し、動物組織[117]および培養ヒト細胞[65]では12時間以上にわたって上昇したレベルに維持されることが示されている。したがって、ニコチンアミドで処理された細胞や動物では、サーチュインタンパク質の活性は一時的に抑制され、すぐに活性化が延長される。ニコチンアミドによる生体内試験でのSIRT1阻害のこのパターンは、PARPのそれとは異なると予想される。PARPがDNA損傷時に急性に活性化され、NAD+を消費するのに対し、サーチュインは最小限の不活性を保ち、高レベルのNAD+によってのみ活性化される[118]。したがって、PARPが活性化されると、高レベルのニコチンアミドの存在は、その活性化の急性的かつ実質的な抑制をもたらす。対照的に、サーチュインの活性はわずかに一過性に低下し、その後のNAD+レベルの上昇によって上昇する。さらに、ニコチンアミドのIC50はSIRT1(50~180μM)よりもPARP-1(31μM)の方が低く[46]、SIRT1よりもPARP-1の方がより敏感にニコチンアミドの影響を受けていることがわかる。
3.3. 高NAD+/NADH比。高NAD+/NADH比:エネルギー代謝への懸念
ヒト線維芽細胞を対象とした研究では、ニコチンアミド処理は5mMで3日間処理した後、細胞のATPレベルを約10%低下させた[65]。これは、ミトコンドリアにおけるNAD+レベルの上昇とそれに伴うNADH/NAD+の減少に起因しており、これは電子輸送鎖への電子供給量の減少と酸化的リン酸化の減少をもたらす[55]。この効果が生体内で発生した場合、高レベルのATPを必要とする生理活動や臓器機能が影響を受ける可能性があり、これはニコチンアミドの非誘導的摂取に対する懸念を提起している。
初期の研究では、成長率の低下は、1または2 g/kgのニコチンアミドを40日間受けたラットで報告された[109,110]。ニコチンアミド処理は培養中の細胞の増殖率を変化させなかったが、細胞サイズに影響を与えた[55,65,68]。ヒト線維芽細胞および骨髄幹細胞のフローサイトメトリー解析では、ニコチンアミド処理により前方散乱(細胞表面の指標)が約10%減少することが示された(S. Song and E. Hwang, data not shown)。
一方、Handler and Dann [110]による後の研究では、増殖率の低下はmetニコチンアミドの合成に起因するものではないかと疑われている。
3.4. 高レベルNAD+。タンパク質翻訳への影響
NAD+は、ヒトを含む原核生物および真核生物の両方のmRNAおよびノンコーディングRNAの5’末端に付加されていることがわかっている[50]。通常、5’,5′-三リン酸結合したN7-メチルグアノシンはmRNAの最初のヌクレオチドに付加され、m7Gキャップ[119]を形成し、mRNAを分解から保護し、翻訳開始複合体のアクセプターとして機能する[120]。
対照的に、NAD+キャップされたmRNAは翻訳が悪く、急速に分解される[50]。ヒト細胞におけるNAD+キャッピングの機能および制御についてはほとんど知られていないが、これはNAD+が豊富に存在する場合により頻繁に起こる可能性がある。もしかすると、NAD+レベルは、細胞のエネルギーとタンパク質の翻訳効率を結びつけているのかもしれない。そうであれば、高レベルのNAD+は細胞内のタンパク質レベルにグローバルな影響を与え、その介入は身体の恒常性や癌などの病気の発症に深刻な影響を与える可能性がある。この安全性の懸念に対処するために、より多くの情報を収集する必要がある。
3.5. 高レベルのニコチンアミドメチル化 メチルプールの変化による潜在的な影響
1 日 200 μmol(または 0.3 mg/kg)で摂取された ニコチンアミド(通常の食事条件での健康な成人の場合)[121] は、主に肝臓でチトクローム p450 により代謝される。最初にニコチンアミド-N-メチル転移酵素(NNMT)によってN-メチルニコチンアミド(metニコチンアミド)にメチル化され、さらにN-メチル-2-ピリドン-5-カルボキサミド(2-PY)またはN-メチル-4-ピリドン-5-カルボキサミド(4-PY)に代謝される。約17.5μmolがこれらの代謝物の形で尿中に排泄される [122,123]。また、ニコチンアミドはニコチンアミド-N-オキシドに酸化されたり、6-ヒドロキシニコチンアミドに水酸化されたりするが、これらの代謝物の役割はヒトでは取るに足らないか、まだ不明である。
ニコチンアミドのメチル化は、主にDNAやタンパク質のメチル化に使用されるメチル基の細胞内での利用に影響を与える。CpG部位のシトシンにおけるDNAメチル化は、遺伝子発現を調節する[124]。異常なDNAメチル化は肥満や2型糖尿病に関与している[125,126]。アルギニン残基やリジン残基でのタンパク質のメチル化は、タンパク質の機能を修飾する[127]。例えば、ヒストンのメチル化は、遺伝子発現におけるヒストンの調節的役割に影響を与える。したがって、細胞内のメチルプールおよびメチル代謝の適切なレベルは、細胞の恒常性、特に遺伝子発現の調節において重要である。
メチル基は、S-アデノシルメチオニンサイクル(またはメチル化サイクル)において、メチオニンからS-アデノシルメチオニン(SAMe)に移行する。SAMeは、順番に、DNAやタンパク質にメチル基を降伏させ、ホモシステインとなり、ベタインまたは葉酸に依存する経路で5-メチルテトラヒドロ葉酸(5-MTHF)からメチル基を受容してメチオニンに変換される[128](図2)。ニコチンアミドはこのサイクルでメチル基の別の受容体として作用する。
ニコチンアミドN-メチルトランスフェラーゼ(NNMT)は、SAMeからニコチンアミドへのメチル基の移動を媒介する(図2)。通常の条件下では、ヒトの血中のニコチンアミド濃度は69μM [129]であり、ニコチンアミドに対するヒトNNMTのKMは約430μMとかなり高いので、非効率的なニコチンアミドメチル化を産生する[130]。しかしながら、ニコチンアミドレベルの増加は、ニコチンアミドメチル化の比例的増加をもたらし、それは血漿ベタイン濃度の減少を伴う[111,131]。
げっ歯類では、高用量のニコチンアミドを投与すると、肝臓のステアトーシスと腎臓の肥大を引き起こし、これはメチル供与体の枯渇に起因する効果であった[111]。さらに、ニコチンアミドの1または4 g/kgの食事摂取は、ラットのメチル代謝に関与する遺伝子の発現を変化させた[94]。しかし、これらの研究では、ニコチンアミドの量は比較的多く、ヒトでは50~200gに相当する量であった。
一方、ニコチンアミドのメチル化は、ニコチンアミドに対して低いKM(5 nM [132])を有するニコチンアミドptを媒介とする反応であるニコチンアミドのNMNへの変換によって相殺される可能性がある。したがって、細胞内でのニコチンアミドの増加の初期段階では、ニコチンアミドのメチル化よりもNMNへの変換が支配的であろうが、ニコチンアミドptのKMがNAD+の存在下で20倍近く増加することを考慮すると、これは言い過ぎかもしれない[133]。全体的に、ニコチンアミド の遺伝子発現やタンパク質の活性に対する影響を解析するためには、さらなる研究が必要である。
3.6. 高レベルの ニコチンアミド メチル化 メチルプールの変化による潜在的な悪影響
高レベルのNNMT発現およびmetニコチンアミド濃度は、肥満、2型糖尿病、肝毒性、パーキンソン病、および癌などの特定の疾患および状態に関与していることが報告されている(図2に要約)。したがって、ニコチンアミド投与は、これらの病態の病因因子として懸念される。しかし、これらの病態に共通のメカニズムが存在するかどうかは明らかではない。
3.6.1. インスリン抵抗性とメタボリックシンドローム
ニコチンアミド処理は、ヒト被験者(2g/日を2週間)[45]および動物(1または4g/kgを8週間)において、インスリン感受性の有意な低下をもたらした[94,134]。インスリン抵抗性におけるmetニコチンアミドの直接的な関与が示唆された。健康なラットにニコチンアミドまたはmetニコチンアミドのいずれかを投与すると、グルコースおよびインスリンのレベルが上昇した[134]。さらに、NNMT活性を阻害し、それによって血漿中のmetニコチンアミドレベルを低下させると、高脂肪食を与えた肥満マウスの体重が減少し、イヌリン感受性が改善された[135]。
metニコチンアミドがインスリン抵抗性を誘導するメカニズムはよく理解されていない。酸化ストレスの影響が考えられる。高レベルのmetニコチンアミドは血漿中のH2O2レベルを増加させ[134]、線虫ではニコチンアミドではなくmetニコチンアミドが酸化ストレスを誘発した[136]。
一方、NNMTはmetニコチンアミドの産生において、ホモシステインの前駆体であるS-アデノシルホモシステインも産生する[137](図2)。ホモシステインの血漿中濃度の上昇とインスリン抵抗性および心血管疾患との間の正の関連が報告されている[138,139,140,141]。
ホモシステイン濃度の上昇は、インスリンシグナル伝達の抑制因子であるインターロイキン-6(IL-6)[142]の産生を増加させ[143]、インスリン抵抗性の引き金となる小胞体ストレス[144]を誘導することでインスリン抵抗性を引き起こす[145]。したがって、metニコチンアミド自体または高レベルニコチンアミドによって駆動されるハイパーメチル代謝過程がインスリン抵抗性の亢進の原因となる可能性がある。
3.6.2. パーキンソン病
脳細胞は高レベルの生体エネルギーを必要とし、NAD+供給のためのサルベージ経路に大きく依存している[5]。この理由から、ニコチンアミドの投与はニューロンの生存率および脳機能を保護すると考えられている[27]。パーキンソン病(PD)(および他の脳疾患)では、有益な効果が観察されている。パーキンソン病のマウスモデルにおいて、ニコチンアミド投与はドーパミン作動性ニューロンを保護し、線条体ドーパミンレベルを持続させた[3]。さらに、マウスモデルでは、ニコチンアミド治療は運動機能を改善し、ドーパミン枯渇を減少させた[146]。これらの結果は、ドーパミン生合成に必要な補因子であり、パーキンソン病では一般的に不足しているグルタチオンの還元力を低下させるNADHのレベルがニコチンアミドを介して上昇したことによると提案されている[147]。さらに、SIRT1とSIRT3の活性を高めることは、ミトコンドリアの完全性と機能に重要なプラスの効果を発揮し、それによってエネルギーの恒常性を安定化させると考えられる。
しかし、ニコチンアミド代謝は神経毒性およびパーキンソン病にも関連している。ニコチンアミドを500mg/kgで投与すると、PDラットでは運動機能の低下速度が増加し、行動障害の発現が誘導された[114]。重要なことに、NNMTとmetニコチンアミドの両方のレベルがパーキンソン病患者の脳内で上昇している[148,149]。Metニコチンアミドはミトコンドリア複合体Iを阻害することで活性酸素の産生を誘導することが示唆されており、この複合体はその後活性酸素によって破壊される[150,151]。したがって、metニコチンアミドによるミトコンドリア機能不全がパーキンソン病の病因として提案されてきた。しかし、最近の研究では、metニコチンアミドはROSを産生するものの、複合体Iの活性には影響しないことが明らかになった[136]。その研究では、線虫の寿命を延ばすことにmetニコチンアミドは積極的に機能していた。したがって、ニコチンアミドによるパーキンソン病の劣化の効果やメカニズムは明らかではなく、より詳細な解析が必要である。
一方で、ニコチンアミドはサーチュイン蛋白質の阻害剤という先入観があることが、このような理解の不足につながっているのかもしれない。ハンチントン病モデルのマウスにおけるSIRT1活性化に関する最近の研究では、レスベラトロールがミトコンドリア機能の低下を減衰させ、運動協調や学習を改善したことが報告されている。その研究でSIRT1の阻害剤として採用されたニコチンアミドは、ミトコンドリア関連の転写を阻害し、運動表現型を悪化させることが報告されている[9]。しかし、ニコチンアミド のこのような悪影響に関するデータは、ニコチンアミド 投与によりレスベラトロールと同様の効果が得られることを示すアッセイとは矛盾していた。また、ニコチンアミドの投与量は、レスベラトロールと同等の効果が得られるほどの高用量ではない可能性がある。
3.6.3. 心疾患
metニコチンアミドとNNMT活性の血清レベルは、ヒト患者の冠動脈疾患(CAD)の重症度と関連している[152]。ミトコンドリア機能の低下は心不全やCADと因果関係があるとされており、したがって、ミトコンドリア機能への悪影響はCADと関連している可能性がある[153]。一方、高レベルのホモシステインはCADの危険因子である[154];したがって、metニコチンアミド自体ではなくメチル代謝がCADと関連している可能性がある。
一方、もう一つのNAD+前駆体であるニコチンアミドリボシド(NR)は、ミトコンドリアの微細構造を維持し、ROSおよび心筋細胞死を減少させながら心臓を効果的に保護することが示されており[155,156]、高レベルNAD+の心臓保護効果を示唆している。NR 処置が metニコチンアミド のレベルを増加させるという知見(限界レベルの ニコチンアミド 誘導増加と比較して 10 倍以上)[156]は、 metニコチンアミド のそれ自体の有害な影響を除外することができる。
3.6.4. 肝毒性
高用量のニコチンアミドはヒトおよびラットにおいて肝毒性を示した[47,112]。肝臓はNNMTを最高レベルで発現する器官であり[157]、したがって高濃度のニコチンアミドに対してより敏感である可能性がある。肝毒性については、活性酸素に依存しないメカニズムが提案されている。1 g/kgの量の ニコチンアミド を食事で補給したラットの肝細胞では、DNA メチル化レベルの用量依存的な低下が観察された [94]。
一方、高脂肪食と並行してニコチンアミドを摂取した場合、NNMTを過剰発現したマウスでは脂肪肝の悪化が認められた[113]。NNMTの過剰発現は肝NAD+量を低下させ、SIRT3活性を低下させ、脂肪酸酸化に関連する遺伝子の発現を阻害した。しかし、これはニコチンアミド治療を行った場合には期待できない。また、同研究では、プロモーターのメチル化の減少により結合組織増殖因子(CTGF)遺伝子の発現が増加したことが示されており、これが肝臓のステアトーシスや線維化に関係している可能性があると考えられる。
一方、より最近の研究では、一般的により純度の高いニコチンアミド製剤を使用したニコチンアミドの投与は良好な忍容性を示した[121]。このことは、毒性というよりも、汚染物質として存在していたNA [158] に由来する肝機能異常の可能性を示唆しているが、この可能性については慎重に検討されていない。一方、アルコールによる肝毒性に対するニコチンアミドの保護効果を報告する研究がある[159]。エタノールは細胞内のNADH/NAD+比を増加させるが、ニコチンアミドはNAD+レベルを増加させることでこれを相殺する可能性がある。
3.7. metニコチンアミドの潜在的な陽性効果:提案されている副作用との矛盾
エネルギー不足を経験している男性では、NNMT発現の上昇と脂肪分解の刺激により循環中のmetニコチンアミドレベルが上昇する [160]。このことは、低エネルギー状態での脂肪利用の亢進がmetニコチンアミドによって促進されることを示唆している。ヒト筋管の培養では、グルカゴンやインスリンの分泌レベルに影響を与えることなく、metニコチンアミドが分泌され、脂肪分解を刺激した[160]。したがって、metニコチンアミドはエネルギー貯蔵庫の利用を促進するミオカインとして機能することが提案されている。これは、metニコチンアミドによって誘発される肥満またはメタボリックシンドロームの観察と矛盾している[152,161]。また、ニコチンアミドとmetニコチンアミドの両方が、SIRT1のワームホモログであるSIR-2.1の非存在下でもC.elegansの寿命を延長させた[136]。この場合、metニコチンアミドはミトコンドリアの機能に適したレベルで活性酸素を生成すると考えられる。さらに、metニコチンアミドのSIRT1に対する直接的な効果が示唆されている。高脂肪食にmetニコチンアミドを補給すると、マウスの血清および肝臓コレステロールおよび肝臓トリグリセリドレベルが減少する。さらに、MetニコチンアミドはSIRT1タンパク質を安定化し、SIRT1標的の脱アセチル化を促進する。Metニコチンアミドによるプロテアソーム媒介分解からのSIRT1の保護が示唆されている[162]。また、高レベルの metニコチンアミド による肝細胞におけるトリグリセリドやコレステロールの合成低下、それによる脂肪肝の改善も報告されている[163]。
一方、ラットに 3~100 mg/kg の metニコチンアミド を静脈内投与した場合、ニコチンアミド ではなく、シクロオキシゲナーゼ-2 の活性化により血管拡張剤であるプロスタサイクリンの合成が亢進し、持続的な血栓溶解効果を示した[164]。
3.8. N-メチル-2-ピリドン-5-カルボキサミド:尿毒症毒素の一種である。
Metニコチンアミドは2-PYおよび4-PYに分解され、尿を通して排泄される[48]。2-CYはニコチンアミドまたはNAを摂取した後の尿中の主要な種である[165]。しかし、腎不全患者では保持され、それにより尿毒症毒素に分類される[166]。毒性はPARP阻害に起因するものと推定されてきたが[167]、エビデンスが不足している。
2-CYは、慢性腎臓病(CKD)患者の血中に慢性的に毒性を持つ無機リン(Pi)の滞留である高リン血症の治療のためにニコチンアミドを投与すると高リン血症のレベルが上昇することが明らかになったことから注目されている[49,87]。ニコチンアミド治療は、腎および糞中のPi排泄を増加させることで高リン血症を緩和する[88,89]。一方、2-PYは、腎機能障害のない個体では毒性がないようである。大規模な皮膚癌患者群を対象にした研究では、ニコチンアミドを1日2回500mgで5年間投与したところ、腎機能障害または尿毒症の症例は報告されていない[168]。
4. おわりに
ニコチンアミドの有益な効果について多くの研究が行われているにもかかわらず、臨床応用はあまり行われていない。その理由としては、特定の酵素を標的とした薬剤と比較して、ニコチンアミドの治療薬・医薬品としての有効性が限定的であることが考えられる。むしろ、加齢に伴うNAD+レベル、サーチュイン活性、ミトコンドリアの質の低下を考慮すると、加齢に伴う疾患に対してより効果的であると期待されている。
また、ニコチンアミドによる活性酸素の発生を抑制することは、加齢に伴う変性疾患の予防にも有効であると考えられる。これらのことから、長期的なサプリメントとしてのニコチンアミドの有用性が提唱されている。このため、ニコチンアミドの副作用については開示し、その分子機構を理解する必要がある。表2にまとめたように、ヒトで報告されている副作用は、いくつかの臓器、すなわち肝臓、腎臓、および血漿中の細胞に限定されている。膵β細胞も影響を受ける可能性がある。
しかしながら、記載されているように、ニコチンアミドの潜在的な副作用に対する細胞生物学的研究に基づく懸念は、PARP(および他のADP-リボシルトランスフェラーゼ)の直接的な阻害によって引き起こされるものに限定されるものではない。特にニコチンアミドを長期使用した場合には、NAD+レドックスのその後の変化やNAD+およびニコチンアミド代謝物のレベルの変化が懸念される。
本レビューでは、ニコチンアミドの臨床的・補助的使用に関する前向き研究の方向性についていくつかのポイントを示唆している。
第一に、ニコチンアミドの糖尿病への効果については、これまで議論のあったところである。ヒトではβ細胞機能の改善とインスリン感受性の低下が報告されている(表2)。しかし、ニコチンアミドは糖尿病治療薬の中でも魅力的な候補であり、糖尿病に対する有効性についてはまだ決定的な研究が必要とされている。
第二に、報告されているニコチンアミドの副作用のほとんどは使用中止時に消失したが[169]、長期または生涯の使用は、発がん、PDおよび2型糖尿病のような不可逆的な状態の潜在的な脅威をもたらす。この点では、ENDITのような過去の長期試験の被験者の追跡調査は貴重な情報を提供するであろう。
第三に、このようなレトロスペクティブ研究では解決できない問題があるかもしれない。生涯のニコチンアミド補給では癌は発生しなかったが、ラットでは発癌物質誘発性の腫瘍形成が促進された。さらに、妊娠中のラットへのニコチンアミド補給は、胎児の臓器におけるDNAメチル化パターンおよびmRNA発現の変化を引き起こした[170]。これらの研究は、ニコチンアミド治療の遺伝的およびエピジェネティックな効果を慎重に検討することを保証するものである。
第四に、より多くのヒトを対象とした研究が必要である。これらの報告されている副作用のほとんどは、臨床的に使用される用量よりも高い用量でのみ、または毎日の栄養補給のためにのみ発生する。動物に対する報告された影響は、ヒトを対象として使用される最高用量である3g/日の食事摂取量よりも少なくとも10倍以上高い用量で発生する。したがって、これらの有害な状態および転帰は、ニコチンアミドの一般的な医薬品または治療用用量によって誘発されることは期待されない。
それでも、モデル動物とヒトでは、寿命や生活様式だけでなく、薬物代謝にも違いが存在する。例えば、げっ歯類とヒトでは、異なる概日リズムを有しており、それがニコチンアミド-NAD+代謝に異なる影響を与える[171]。これらのことから、動物実験の単純な外挿によってニコチンアミドの効果を予測することは確かに困難である。ヒトを対象とした研究をさらに必要とするもう一つの要因は、ニコチンアミド代謝の薬理遺伝学における個人および年齢に関連したばらつきである。例えば、ヒトにおける NNNMT の酵素活性は、エピジェネティックな多型に起因する可能性が高く、5 倍以上の差がある[172]。したがって、ニコチンアミドの有効性に関する研究には、ニコチンアミド-NAD+代謝に関与する酵素の薬理遺伝学的および薬効エピジェネティクスに関する理解が必要である。
最後に、NAD+前駆体であるニコチンアミドリボシド(NR)およびニコチンアミドモノヌクレオチド(NMN)に関する多くの臨床試験が終了したか、または現在進行中である[ABOUTNAD(https://www.aboutnad.com/human-clinical-trials)]。これらの化学物質とニコチンアミドの効果を包括的に理解することは、これらのNAD+前駆体の生涯にわたる応用に関する貴重な情報を生み出すだろう。