Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8950470/
2022年3月10日オンライン公開
要旨
グリンパティック・クリアランス系は、中枢神経系におけるグリア依存性の老廃物排出経路であり、代謝産物やアミロイドベータのような可溶性タンパク質を排出することに専念している。脳グリンパティック系の障害は、神経血管疾患、神経炎症疾患、神経変性疾患の発症を増加させる可能性がある。
光バイオモジュレーション(PBM)療法は、脳の老廃物を効果的に排出するための非侵襲的な神経保護戦略として機能することができる。このレビューでは、脳から毒素や老廃物を除去するグリンパティック排出経路の重要な役割について議論する。
グリンパティック・クリアランスに対するPBM療法の神経治療効果に関する最近の動物実験についてレビューする。また、PBMが脳グリンパティック系に及ぼす細胞メカニズムにも注目する。動物実験では、髄膜リンパ管を介したアミロイドベータのクリアランスを通じて、PBMの脳循環系への有益な効果が明らかにされた。
最後に、PBMによる血液脳関門の伝染性の上昇と、それに続く血管拡張プロセスを介したリンパ管の弛緩からのAβクリアランスの上昇について議論される。PBMによる頭蓋内・頭蓋外リンパ系機能の促進は、脳脊髄液流出異常を伴う脳疾患の治療戦略として有望であると結論づけた。
キーワード 光バイオモジュレーション、近赤外光、グリンパティック系、髄膜リンパ管、アミロイドベータ、神経変性疾患、アルツハイマー病、パーキンソン病
1. はじめに
光バイオモジュレーション(PBM)療法は、非加熱および低レベルの用量でミトコンドリア成分の生化学的活性を変化させることにより細胞プロセスを刺激する可視および近赤外線(NIR)光の応用である[1]。
現在,PBMは大きな信頼を得ており、光医療は最も受け入れられている物理的手法の1つに急速になりつつあるPBMは、細胞増殖や微小循環を促進し、様々な外傷性疾患,急性疾患,慢性疾患における痛みや浮腫を緩和する効果的なアプローチであることが実証されている[2]。
経頭蓋および経鼻PBMを用いた脳の神経調節は、脳酸素化および代謝能力の増加とともに、脳血流動態を改善することが示されている[3,4]。また、脳へのPBM療法は、神経細胞の酸化ストレス、神経炎症、アポトーシスを改善し、神経新生とシナプス形成を促進することを支持する証拠が急速に増えている[5,6]。
現在までのところ、脳へのPBM療法による重篤な副作用は報告されていないが、高出力レーザー光源(クラス3Bおよび4)では、黄斑病変の危険性があるため、注意が必要である[7]。
脳へPBMを届けるために、光エネルギーを非侵襲的に届ける技術として、経頭蓋,鼻腔内,口腔内,血管内へのアプローチが提案されている。さらに、研究者は、遠隔組織(腹部や脛骨など)を対象としたPBM療法が、全身的なメカニズムを介して脳に神経保護効果をもたらす間接的または外見的効果をもたらすことを示唆している [8].
* *
最近の証拠では、髄膜リンパ管(MLV)は、中枢神経系(CNS)から脳脊髄液(CSF)と間質液(ISF)の両方を介して頸部リンパ節に高分子を排出することによって、脳の恒常性の維持に重要な役割を果たすことが示唆されている[9,10,11]。
脳リンパ系の障害は、神経炎症性疾患[12]、神経血管疾患[13]、脳損傷からの回復障害[12]の危険因子として考えられている。さらに、前臨床研究では、アルツハイマー病(AD)[9]やパーキンソン病(PD)[14]などの神経変性疾患における髄膜リンパ機能の障害が示されている。実際、髄膜リンパ管の機能障害はAD発症の一因であり、アミロイドベータ(Aβ)の凝集を加速させる[9]。
2018年から、ロシアの研究者グループが、脳のリンパドレナージ機能に対するPBM療法の調節作用を検証する努力を行っている。マウスADモデルにおける彼らの予備的な知見は、髄膜リンパ管を介したAβのクリアランスを通じて、NIR PBMが脳排水系に及ぼす潜在的な効果に光を当てた[15]。
また、彼らの追跡研究により、PBMによる血液脳関門(BBB)の伝染性の上昇が、脳からのAβのリンパ液クリアランスをさらに活性化することが明らかになった。この作用は、血管拡張プロセスを介したPBMによるリンパ管の弛緩の結果である可能性が最も高い[16]。さらなる実験により、頭蓋内出血(ICH)後の重篤な結果を予防するための重要な戦略である、脳からの血液産物のリンパクリアランスに対するNIR PBMの有益な効果について概説した[17]。
* *
このレビューでは、脳リンパドレナージシステムとその経路の概要を説明する。また、リンパドレナージシステム(頭蓋内および頭蓋外のリンパ管)が、脳から老廃物の代謝物や毒素を除去し、CNSの恒常性と免疫反応を維持する上で重要な役割を担っていることを説明する。
次に、リンパドレナージとクリアランスに対するPBMの神経治療効果に関する最近の動物研究をレビューする。最後に、PBMが脳リンパ系に及ぼす潜在的な影響について、基礎となる生物学的メカニズムを提案し、この有望な新しい治療アプローチに焦点を当てる。
2. 脳グリンパティック排出経路
2.1. 脳リンパ系とその構成要素、および経路
脳の異なる部位間のコミュニケーションに関する生理学的知見に基づき、脊椎動物の脳には特異的なリンパドレナージシステムの存在が示唆されている [18,19] 。2012年、Iliffらは、グリンパティック系と呼ばれる脳内の新規構造を初めて同定した[20]。
このシステムは、脳内の重要な体液クリアランスシステムと考えられている[21,22]。様々な蛍光トレーサーを用いたマウスモデルの研究により、この脳内グリンパティック排出経路が構築された[23,24]。
* *
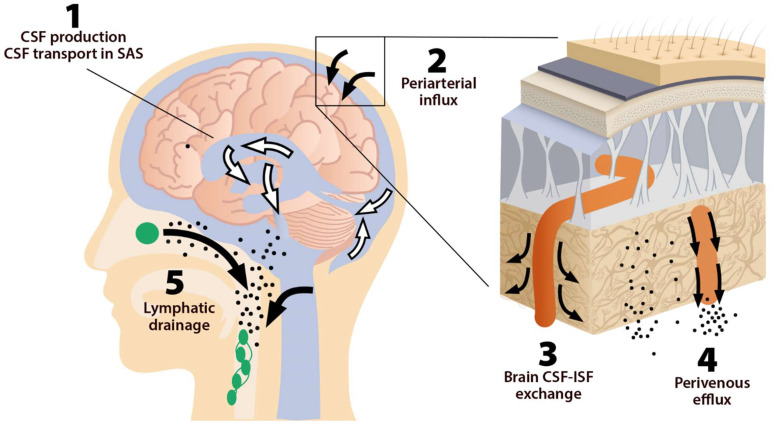
このシステムは5つの主要な機能的要素からなり、それぞれが脳脊髄液と間質液の移動を促進する(図1)。グリンパティック系の第1区画は、脳室の脈絡叢の上皮細胞による脳脊髄液の産生とクモ膜下腔での脳脊髄液の循環からなり、次いで第2区画は脳実質への脳脊髄液の動脈周囲への流入である。
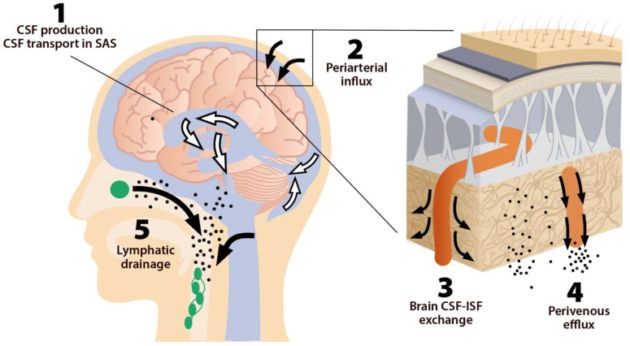
実際には、動脈周囲への流入とは、動脈周囲の空間に脳脊髄液が入り込み、脳組織の深部にまで浸透することを指す。平滑筋細胞による動脈の脈動は、動脈周囲腔に沿った脳脊髄液の内側への移動を強める[25]。髄液と脳脊髄液の交換は、このシステムの第三の構成要素であり、脳実質の間質空間で行われる(図2)。
図1 グリンパティック系の5つの構成要素
体液の輸送経路は5つのセグメントに分けられる。(1) 脳脊髄液(CSF)は脈絡叢で産生され、おそらくは脈絡膜外からの供給源(毛細血管流入と代謝水生成);(2) 動脈壁の脈動により脳脊髄液は血管周囲の空間に沿って脳深部へ送り込まれる;(3) 脳脊髄液はアクアポリン4(AQP4)水チャネルに支えられて脳実質に入り、神経膜内で拡散される
間質液(間質液)は脳脊髄液と混合し、(4)血管周囲に蓄積し、(5)髄膜リンパ管、頸部リンパ管、および脳神経と脊髄神経に沿って脳外に排出される。 脳と篩骨板からの液体は頸部リンパ管に流れ込み、鎖骨下静脈の高さで静脈系に排液される。
嗅覚・頸部リンパ液の排出経路は、主要なバルクフロー経路である
図2 脳組織への脳脊髄液の動脈周囲への流入(小さな白矢印)
細動脈に沿って形成された血管端脚のAQP4チャンネルに支えられた脳脊髄液-間質液交換。ここから、液体は軸索を離れ、アストロサイトに支えられた経路で、脳周囲空間に向かって移動する
アストロサイトのAQP4水チャネルは、間質液のこの静脈周囲への流出を促進し、硬膜リンパ管に排出される
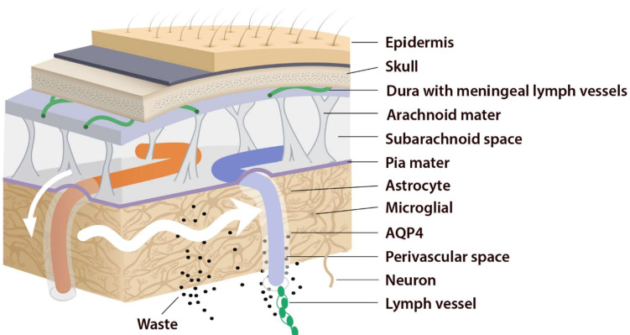
アストロサイトは、アクアポリン-4(AQP4)などの水チャネルを介して、動脈周囲空間と間質間の体液移動を促進すると考えられている[20,26]。
第4の構成要素は、グリンパティック流出であり、これは間質液の静脈周囲腔への流出からなる。髄膜リンパ系は第5の構成要素であり、グリンパティック・クリアランス系の最終的な下流クリアランスである。髄膜リンパ管は、CNSから老廃物やその他の溶質を排出する [9] 。この間質液は次に皮質表面(sulci)にあるleptomeningeal動脈に向かって流れ、最終的に頸部リンパ管に移動する [20] 。
* *
実際、このシステムは、グリア細胞 「gl 」の関与と、「リンパ系 」と同様の機能から、「グリンパティック 」と名付けられた[27,28]。脳グリンパティック系は、脳の実質部分から近傍のリンパ節へ間質液を排出するなど、いくつかの重要な生理的機能を有している。また、免疫系とのコミュニケーションにも関与しており、神経炎症に対する脳の反応を調節・モニタリングしている[29]。
さらに、グリンパティック・クリアランス系は、溶質のクリアランス以外にも多くの生理的機能を有している[30]。グリンパティック系は、血液脳関門(BBB)を越えて脂質を迅速に輸送し、グリアシグナルを促進する役割を担っていると仮定されている[31]。
さらに、脳脊髄液はコレステロールの輸送に不可欠なアポリポタンパク質Eの輸送に関与しており、最も注目すべきはシナプスの可塑性である[32]。脳脊髄液の流入は、アストロサイトおよびニューロンの代謝に必要なグルコースおよび他の重要な栄養素の輸送手段でもある [30]。
* *
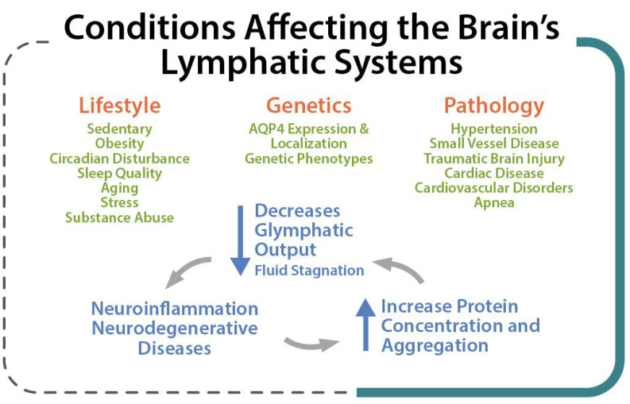
ライフスタイルの要因、遺伝、病的状態は、脳内クリアランスを調節し、神経変性疾患の発症リスクに影響を与えることがある[33]。遺伝的表現型,体位,加齢,睡眠覚醒周期などのいくつかの要因がこれらの生理的機能に影響を及ぼす可能性があり[23]、脳リンパ系の障害は、神経変性[34]、神経炎症[12]、神経血管疾患[13]、腫瘍の危険因子として、また脳損傷からの回復障害[12]として数えられる(図3)。病的状態は脳リンパ系に強く影響する。
高血圧,動脈硬化,小血管疾患など様々な血管障害[35]では、構成タンパク質の組成に変化が生じると、血管可塑性が著しく低下し、血管周囲経路への脳血流(CBF)が低下する。動脈狭窄(頸部または頭蓋内)では、CBFの遮断と血管周囲または血管傍の経路の閉塞が観察され[13]、脳脊髄液の流れの減少につながり、脳からの髄液クリアランスの喪失をもたらす。
グリンパティック系の機能不全は、ADやPDなどの多くの神経疾患と関連していることが実証されている[14,28]。グリンパティック系は、神経変性疾患の「最終的な共通経路」であると言われている[36]。
図3 脳リンパ系に強く影響する生活習慣、遺伝、病理学的条件
2.2. 髄膜リンパ管、嗅覚・頸部リンパドレナージ経路、および脳脊髄液循環との関連性
CNSには通常のリンパ管系がないため、ネズミやヒトの脳を使った一連の研究により、髄膜リンパ管がCNSのリンパ系であると同定された [37,38] 。髄膜リンパ管は間質液と脳脊髄液の排出のための重要なルートを提供しているようである。様々な高分子や免疫細胞は、CNSから頸部深部にあるリンパ節に流れ込む[39,40,41]。
最近になって、髄膜リンパ管が免疫応答の制御に関連し、神経炎症性疾患の病因にも関与している可能性があることが強く示された[42]。動物実験でも、AD[9]やPD[14]で髄膜リンパ機能が損なわれていることが示されている。動的造影MRIを用いた神経画像研究において、特発性パーキンソン病患者は、上矢状静脈洞とS状静脈洞に沿った髄膜リンパ管を通る流れの著しい減少、および深部頸部リンパ節(深部頸部リンパ節)の灌流の著しい遅延を示した [43] 。
* *
正常な生理的条件下では、嗅覚・頸部リンパドレナージ経路は主要なバルクフロー・ドレナージ経路として機能する。脳の前面(前頭蓋窩と鼻腔の間)に位置する篩骨、特に篩骨板は、脳脊髄液流出の重要な頭蓋外部位と考えられている [44]。
くも膜下腔の脳脊髄液は、嗅覚神経に沿って篩骨板を通り、鼻のリンパ管と頸部リンパ節に向かう。経路の終点では、脳脊髄液は頭蓋外リンパ系に沈着する [13]。脳脊髄液の継続的な循環と排出は、脳脊髄液の代謝産物を除去し、正常な神経機能を維持するために重要である。脳脊髄液の流出経路は、硬膜上矢状静脈洞のくも膜絨毛 [45] 、嗅神経、篩骨板を越えて、頸部リンパ路への流出 [46] である。
* *
篩骨板は篩骨にある柵状の骨板で、頭蓋腔と鼻腔を仕切っている(図4)。髄膜にリンパ管があるにもかかわらず [47] 、ヒトと他の哺乳類の両方で脳脊髄液が篩骨板を通過して排出されることが実証されている [48] 。脳脊髄液が頭蓋骨から排出される主な経路は、嗅覚神経に関連する篩骨板を通るものである [49]。
脳脊髄液は篩骨板を通過した後、嗅上皮の粘膜下層、鼻粘膜にあるリンパ管に吸収され、頸部リンパ節に排出される。篩骨板の損傷(外傷性脳損傷または外科的方法による)は、急性に髄液流出の閉塞を引き起こし、結果として安静時頭蓋内圧(ICP)の上昇と流出抵抗を引き起こすため、嗅経路が髄液流出の主要部位であることを強調している [50]。嗅覚軸索の間には、脳脊髄液の流出のための導管となる空間が存在する。これらの神経に損傷があると、篩骨板を介した脳脊髄液の流出が減少する可能性がある[49](図4)。
図4 嗅神経の周囲にある神経腔が篩骨板を通して鼻粘膜に侵入している
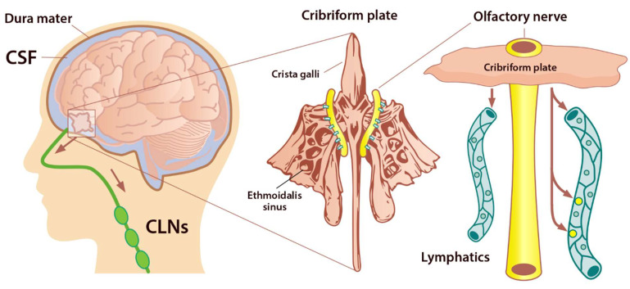
篩骨板は髄液の頭蓋外流出における重要な部位と考えられている
SASの脳脊髄液は嗅神経に沿って篩骨板を通過して鼻リンパに入り、頸部リンパ節に入る(Semyachkina-Glushkovskayaら2021年からの引用)
AQPは、脳を含む様々な組織において、細胞の水に対する伝染性を著しく高め、圧力勾配を下る体液の移動を促進する小さな積分膜タンパク質のファミリーである[51].これまでに、哺乳類では13のAQPが見つかっている(AQP0-12)。AQP1は脈絡叢で髄液の産生を維持し、嗅球の周辺,神経接合部,篩骨板の孔の裏にも発現している。さらに、鼻腔内にはAQP1,3,5が多く存在する。
これらのAQPは、体液を全身に運ぶのに不可欠な役割を果たす広範なリンパ管のネットワークを介して、嗅球やくも膜下腔から鼻腔への体液の流れを促進する。AQPは髄膜と篩骨板と嗅球の接合部に存在する[11]。篩骨板を横切るこれらの血管は、頭蓋内からの体液を鼻腔嗅覚神経に輸送する上で重要な役割を担っている。
髄液はリンパ管で吸収された後、より大きな管で多数のリンパ節を経由して運ばれ、最終的に体のリンパ系に沈着される。加齢により、鼻/篩骨板領域からの脳脊髄液の排泄速度が低下することも示されている[52,53]。
2.3. 睡眠と脳内クリアランス
グリンパティック系は、脳脊髄液と間質液間の対流を利用して、脳内または脳からの毒性代謝物を除去している。髄液は、傍動脈路に沿って脳実質(機能部分)に入り、髄液と交換される [54] 。間質液は、脳内の間質(細胞外)腔から傍動脈性排水路に沿って細胞外溶質を運ぶ(図1)。この活動は睡眠中に劇的に増強され、おそらくアストログリア細胞の収縮による間質容量の増加に関連している[55]。
睡眠はグリンパティック・クリアランスの主要な推進役であり、起きている間に非常に活発な脳に蓄積される代謝物や神経毒性廃棄物の脳からの排出を介して、脳機能の維持に不可欠であることを示す証拠が出現している [36,56].
* *
深睡眠時の脳内間質液の体積を覚醒時と比較すると、40~60%増加する[57].脳血管系を取り囲むアストロサイトのAQP4水チャネルは、この間質液の増加に寄与している。この間質液の増加は、適切なグリンパティック機能に必要であり、可溶性タンパク質、老廃物、および余分な細胞外液のクリアランスを促進する。
間質液の増加は、乳酸やAβといった神経毒性のある老廃物の脳からの除去を2倍速にすることにつながる。このような脳の老廃物の除去の増加は、ノンレイプ・アイ・モーション(NREM)睡眠中に起こり [58] 、グリンパティックの活動の大部分は、深い徐波睡眠中に起こる。睡眠の質が悪く、睡眠時間が短いと、脳脊髄液中のAβ量が増加し、Aβプラーク形成のリスクとなる[59]。
さらに、睡眠不足の後、海馬の間質液でタウレベルが増加することが示されている[60]。明らかに、これらの神経生物学的メカニズムは、AD、PD、ハンチントン病、前頭側頭型認知症などの神経変性疾患が睡眠障害と強く関連しているという事実を裏付けることができる[61]。
グリンパティック系を念頭に置くと、正常な老化の機能として睡眠の質が低下し、60歳以上の人は深いNREM(ステージ3)に入ることがほとんどないというのは興味深いことだ。グリンパティックな体液輸送の有効性は、徐波活動の有病率に直結している。したがって、加齢に伴う睡眠の質の低下は、脳の老廃物のクリアランスに壊滅的な低下をもたらし、神経変性疾患の発生リスクを潜在的に増加させる可能性がある[36]。
* *
最近の証拠により、エンドサイトーシスが睡眠中にBBBを越えて行われ、このプロセスの阻害がより多くの睡眠の必要性を引き起こすことが明らかにされた[62]。さらに、いくつかの研究により、睡眠不足は、C反応性タンパク質、インターロイキン(IL)-1β、IL-6,IL-17,インターフェロン-γ(IFN-γ)および腫瘍壊死因子-α(TNF-α)などのいくつかの炎症性メディエーターの活性を上昇させることが報告されている。
これらのメディエーターは、アストロサイトによるBBBの維持を抑制し、その伝染性の上昇を引き起こす[63,64]。睡眠不足は血管周囲に沿った流入効率を低下させ、その結果グリンパティック系の機能を損ない、マウスモデルにおけるAQP4の分極を乱すことが示されている[65]。
3. PBM療法
PBM療法または低レベル光/レーザー療法(LLLT)は、生物学的プロセスを刺激するための可視光および/または近赤外光の非熱的応用を指す[66]。ほぼすべてのPBM療法手順は、様々な光源(例えば、レーザー、発光ダイオード(LED)または広帯域光源)から400~1300nmの波長範囲に適用されている[67]。
PBM の最も認知されたメカニズムの一つは、ロシアの光生物学者である Tiina Karu によって提案されたものである[68]。彼女の初期の研究は、光-細胞間相互作用は、おそらく光-ミトコンドリア間相互作用と考えるべきであ ることを発見している[69]。
さらに600~850nmの波長の光を用いた研究により、ミトコンドリアの呼吸酵素であるシトクロムcオキシダーゼ(CCO)が細胞内での光吸収を担う主な光受容体であるという彼女の仮説が証明された[70,71]。
現在では、光エネルギーがCCOの金属中心で吸収され、その結果、電子が励起されると考えられている[72]。この光励起に伴い、CCO から一酸化窒素(NO)が光解離し、ミトコンドリア膜電位(MMP)の上昇をもたらす。これにより、ATP産生の増加が促され、細胞内Ca2+や活性酸素種(ROS)特にスーパーオキシドアニオン(O-2)とその安定生成物である過酸化水素(H2O2)などのシグナル分子のレベルが調節される[2]。
二次的な事象として、上記の一次反応は、細胞内の酸化還元電位、細胞内pH、環状アデノシン一リン酸(cAMP)レベル、核因子カッパB(NF-κB)等の酸化還元感受性因子の発現を変化させる。このイベントのカスケードに続いて、PBMによって誘導されるシグナル伝達プロセスは、転写因子および遺伝子発現の活性化をもたらし、最終的に、細胞代謝、細胞生存率、増殖、および分化などの多くの生物学的機能を促進することになる[73,74,75]。
* *
今日、PBMは、創傷治癒、歯科、筋肉や腱の修復、皮膚疾患、神経因性疼痛など、医療の多くの分野で最先端技術として応用されている[76]。さらに、最近の研究では、中枢神経系疾患の治療における神経保護介入としてのPBMの応用に焦点が当てられており[4,77]、神経リハビリテーションの分野でさらなるブレークスルーをもたらしている。低レベルの赤色/近赤外光が神経細胞の機能を刺激し、神経細胞死、低酸素、外傷、神経毒性の神経保護と予防につながることが示されている[4,6]。
経頭蓋PBMは、外部のレーザーまたはLED光源(例えば、携帯型プローブまたは装着型PBMヘルメット/ヘッドセット)から頭部へ非侵襲的に光を供給するものである。この光エネルギーは、頭蓋下組織と、ある程度は皮質表面に伝達される[4]。
鼻腔内PBMは、鼻孔から光エネルギーを供給する別の治療アプローチであり、うつ病、脳梗塞、認知症、クライネ・レビン症候群などの様々なCNS疾患において脳機能を促進することが示されている[78,79,80,81,82,83]。
3.1. PBMの脳排泄系への潜在的効果に関するエビデンス
最近、ロシアの研究者グループが、脳のリンパドレナージ機能に対するPBM療法の有益な効果の可能性に関する一連の動物実験を実施した[15,16,59,84,85,86,87]。彼らの発見は、頭蓋内および頭蓋外リンパのPBMが、髄液流出異常を伴う脳疾患の治療に対する有望なアプローチであるという新しい考えを打ち立てた[88]。ここでは、彼らの調査をレビューし、リンパの排出とクリアランスに対するPBMの神経治療効果の可能なメカニズムについて概説する。
* *
2019年、彼らは、PBM治療後の脳からのAβ分子のクリアランスの改善を示すことによって、経頭蓋PBMが動物ADモデルでリンパ排水を刺激するかもしれないという考えを検討した[15]。まず、1268nmレーザーの4種類の頭蓋内照射量(18,25,32,39J/cm2)が、脳内Aβ蓄積の減少にどの程度有効かを比較検討した。
頭蓋骨の温度上昇や脳の形態変化を伴わず、脳内Aβ沈着量の減少に有意に有効であったことから、32 J/cm2の頭蓋骨フルエンス(皮質フルエンスは4 J/cm2)が最適なPBMフルエンスとして選択された。39J/cm2はAβの蓄積を効果的に減少させるが、硬膜とくも膜の損傷と頭皮温度の2℃の上昇をもたらした。
次に、マウスの海馬にAβを注入してADの発症を調べ、脳内のAβ分布に対するPBM(32J/cm2)の影響を評価した。共焦点顕微鏡による解析の結果、PBMは小さなAβプラークの密度を積極的に減少させたが、大きなAβプラークの密度はPBMと無処置の間で差がなかった。また、PBM投与マウスの脳におけるAβの蓄積は、無処置群と比較して、深部頸部リンパ節におけるAβプラークの出現を伴っていた。
第三段階として、彼らは、右深部頸部リンパ節へのGNRの蓄積速度をモニターするために、生体内試験の光コヒーレンス・トモグラフィー(OCT)を用いて、脳から頸部リンパ管への金ナノロッド(GNR)のクリアランスに対するPBM効果を探索した。
OCTのデータは、PBMによって活性化されたGNRのクリアランスが、処置したマウスでより高いことを示した。大脳皮質、側脳室、脳室、海馬からのクリアランスは、それぞれ3.7倍、3.9倍、6.7倍、9.3倍と、治療したマウスで高くなった。
深部頸部リンパ節中のGNRのレベルを示す原子吸光光度法(AAS)の結果は、OCTデータとも相関し、PBMが脳の深部(海馬、脳室)および表層(cisterna magna、大脳皮質)の両方の領域からGNRのクリアランスを有意に増加させていることが示唆された。神経学的状態(驚愕反射、丸棒バランス、ビームウォーク課題によるテスト)および神経行動学的結果(新規物体認識課題によるテスト)も、ADマウスと比較してPBM投与マウスで改善がみられた[15]。
* *
髄膜リンパ管の破壊がAD発症の悪化因子であり、髄膜へのAβ沈着を促進するという事実を踏まえ 2020年、彼らは、組織からの液体輸送と老廃物除去の基礎となる主要な生理学的メカニズムと考えられているリンパ管のポンプ作用と収縮性に対するPBMの潜在的利益を調査した[59]。
彼らは、PBMが血管拡張を介してリンパ管の弛緩を促進することが、リンパ管内皮の伝染性を増加させ、それによってより大きな分子がリンパ管に輸送されることを可能にする基礎的なメカニズムの一つかもしれないという仮説の検証を開始した。
彼らの予備データでは、低いPBMフルエンス(5および10J/cm2)が収縮期および拡張期の両方で腸間膜リンパ管(頭蓋外および/または腹部リンパ管)の収縮振幅の減少を伴う弛緩を誘発した(最大反応は10J/cm2)。
これらの低いフルエンスはリンパ管を弛緩させるが、30J/cm2と70J/cm2の高いフルエンスは血管の収縮力を完全にブロックした。彼らのOCT画像診断の結果は、経頭蓋PBM後の収縮期と拡張期における髄膜リンパ管の直径の増加も示していた。
また、経頭蓋PBM後に髄膜リンパ管の拡張と血管内腔のマクロファージの増加が確認されたが、これは間質液(リンパ)の取り込みが増加したためと思われる。次の段階では、マウス脳からのGNRのクリアランスを分析することで、経頭蓋PBM(頭蓋骨のフルエンス64J/cm2)が髄膜リンパ管のドレナージ機能に及ぼす影響について研究された。
彼らは、以前のパイロット研究[15]と同様に、異なる脳領域(大脳皮質、大脳皮質、右側脳室、海馬)にGNRを注入し、生体内試験でOCTを用いて経頭蓋PBM前後の深部頸部リンパ節におけるGNRの蓄積をモニターした。PBMは、大脳皮質から深部頸部リンパ節へのGNRのクリアランスを55.7倍増加させた。
海馬、大脳皮質、左心室からのクリアランスもそれぞれ14.78倍、4.8倍、2.3倍と高い値を示した。彼らの発見は、経頭蓋および遠隔PBMが髄膜リンパ管の排出およびクリアランス機能を増強し、脳卒中や脳外傷などの神経疾患に対する治療標的、ならびに神経変性疾患の予防または遅延を提供する有望な証拠を提供した[59]。
* *
彼らの3番目の研究[87]では、経頭蓋1268nmレーザーPBMが、(1)脳から髄膜リンパ系を経て末梢リンパ系への2種類のトレーサー(GNRとエバンスブルー色素(EBD)のクリアランス,(2)マウスの腸間膜リンパ管伝染性に及ぼす効果を検討した。その結果、大脳皮質のフルエンス9J/cm2(頭蓋骨のフルエンス32J/cm2)は、2J/cm2や5J/cm2よりも髄膜リンパ管のクリアリング機能を刺激することが示された。
同様に、9J/cm2群のOCTデータは、cisterna magnaへの注入後、深部頸部リンパ節におけるGNRの蓄積速度が徐々に増加することを示した。また、PBMによる腸間膜リンパ管の拡張は、リンパ流に対する抵抗の減少に関連していた。
次の段階では、PBMがリンパ管に与える影響のメカニズムをより深く理解するために、9J/cm2の光がマクロファージなどの免疫細胞のリンパ管伝染性に及ぼす影響を調査した。その結果、PBMは、経内皮電気抵抗(TEER)の完全性の低下とタイトジャンクション(TJ)タンパク質(頸部リンパ節D、VE-カドヘリン、ZO-1など)の発現を介して、最も可能性の高いリンパ管から周辺組織へのマクロファージの移動を促進できることが明らかになった[87]。
* *
4番目の研究では、PBMを介したBBBの開放が、ADマウスの脳からのAβクリアランスの活性化の1つの可能なメカニズムであるかもしれないという仮説を検証することを目的とした[16]。まず、彼らは、深部頸部リンパ節におけるAβの免疫組織化学的分析を用いて、皮質フルエンス9 J/cm2(頭蓋骨フルエンス32 J/cm2)の1267 nm PBMのマウス脳からのAβクリアランスへの影響を研究した。
PBMを投与したマウスでは、深部頸部リンパ節におけるAβレベルが顕著に上昇し、PBMが脳からのAβクリアランスの刺激に有効であることが示された。また、定量解析の結果、PBM投与マウスでは深部頸部リンパ節に存在する免疫陽性Aβプラークの信号強度が高く、これらの結果を確認することができた。
この結果は、ADマウスの神経行動学的状態の改善と関連する、脳からのAβクリアランスのリンパ経路を明らかにするものであった。彼らの追跡実験は、PBMによるBBB伝染性の増加とそれに続くAβ漏出の増加が、PBMによる経内皮完全性の低下とTJタンパク質(頸部リンパ節D、VE-カドヘリン、ZO-1など)の発現低下の結果として最も起こりやすいことを示している[16]。
* *
彼らの5番目の研究は、脳室内出血(IVH)後の脳からの赤血球(RBC)クリアランスのリンパ経路を検討したものである。彼らは、経頭蓋PBMが脳室からの赤血球の排出を改善し、IVH後の予後を改善できるかどうかを検討した[17]。
まず、マウスとヒトの脳サンプル(IVHによる死亡の翌日)の免疫組織化学的および共焦点共焦点分析を用いて、赤血球が脳室から髄膜リンパ管を介して深部頸部リンパ節に移動することを示し、出血後の脳から赤血球がリンパ的に除去されることを確認した。
次に彼らは、ナイーブマウスの脳から赤血球が排除される経路を模倣して、皮質フルエンス9 J/cm2(頭蓋骨フルエンス60 J/cm2)の経頭蓋1267 nm PBMが右側脳室からのトレーサー(GNRとEBD)のリンパ液クリアランス刺激にどのような効果があるかを調べた。
GNRとEBDを脳室内に注入した後、深部頸部リンパ節への輸送は、PBM投与マウスでそれぞれ1.4倍と2.6倍に増加した。さらに、IVH後のマウス脳からの赤血球クリアランスに対するPBMの効果を直接評価したところ、深部頸部リンパ節に輸送される赤血球の数がPBM投与群で有意に多いことが判明した。
彼らは、PBMが、液体で満たされた脳室からクモ膜下腔への赤血球の排出を促進し、赤血球が髄膜リンパ管に輸送されると仮定した。これは、PBMによって髄膜リンパ管の緊張が変化することによって達成された。
最終段階として、右側脳室への血液の外科的注入の3日後に、皮質フルエンス9J/cm2で7日間に3回マウスをPBMで処理した。彼らは、PBMがIVH後のICPの迅速な回復に寄与し、死亡率が1.57倍減少し、ストレスレベルが有意に減少することを見いだした[17]。
* *
最後に、ADマウスを用いた最新の研究[84]では、経頭蓋PBMが脳リンパドレナージの活性化を介して、またおそらく脳エネルギー代謝の増加を介して脳からのAβクリアランスを刺激するという仮説が検証された。皮質フルエンス4 J/cm2(頭蓋フルエンス32 J/cm2)の経頭蓋1268 nmレーザーPBMを9日間照射すると、ADマウスの脳内のAβ斑が有意に減少し、髄膜リンパ管を介したAβのクリアランスが有意に増加した。
さらに、PBMによる脳の血中酸素飽和度(SpO2)の上昇が、リンパ系Aβクリアランスの促進に関与している可能性を明らかにした。彼らは、酸素飽和度の向上がミトコンドリアATP産生の改善につながり、それがリンパ管収縮力を刺激して髄膜リンパ系の排水およびクリアランス機能の向上につながることを示唆した[84]。
3.2. PBMと一酸化窒素
研究により、動物モデルおよびヒトの両方で、PBM中およびPBM後の血流増加が示されている [89,90] 。しかし、この血流の増加に関する重大な疑問は、未解決のままである。この血流の増加は、PBMが媒介するNOの産生から生じるのだろうか?
もしそうなら、実際の源は何なのだろうか?循環赤血球中のヘモグロビンから光解離したNOなのか、血管壁中の他の不安定なNO貯蔵物から光解離したNOなのか、それともミトコンドリア中のCCOと結合したNOの解離に由来するのか?しかし、赤色/近赤外光は、NOをCCOから解離させ、過剰なNOの結合によるシグナル伝達の結果を逆転させるのに最も適していると考えられている[2]。
* *
脳血管の灌流障害は、中枢神経系疾患の初期症状の1つとして広く知られている[91].動物実験では、PBMは、内皮型NO合成酵素(eNOS)タンパク質の活性化により、神経細胞のNO濃度およびCBFを改善し[90]、また、血管径を増大させることが示された[92].また、PBMはNOとグルタミン酸を介する可能性が最も高く、局所CBFに影響を与えることが示唆されている[90]。
魚住らは、PBMによる一過性のCBFの改善は、NOS活性とNOレベルにも依存することを見いだした。彼らは、ナイーブマウスの経頭蓋808nmレーザーPBMは、PBM開始直後に皮質のNOレベルを増加させ(50%)照射開始45分後にPBM照射側(30%)および反対側の半球(19%)で徐々にCBFを改善することを明らかにした[90]。
* *
PBMはまた、炎症と血管新生の調節を担う細胞経路の活性化、および血管拡張を通じて内皮機能を改善することが示されている[93]。890nmのNIR光は、健常者の静脈血中のNO濃度を有意に増加させることができた(照射後5分にピーク)[94]。
内皮 NOS (eNOS) は、血管やリンパ管の内面を覆う細胞である内皮細胞に存在する。eNOS は、血管を流れる血液の脈動によって活性化され、血管内の血柱が前進して停止する際に内皮細胞の膜に「せん断応力」をもたらすことがある。
実際、eNOSが産生するNOは、血管の直径を維持する(血管拡張)ので、様々な組織(皮膚、骨、筋肉、神経)の灌流を最適なレベルに保つことができる。このeNOSが介在するNOは、新しい血管の成長(血管新生)を活性化することもできる。
NOは平滑筋細胞を弛緩させるため、抵抗血管やリンパ管を拡張させ、組織の修復や損傷細胞の除去のための血液供給を増加させる[95]。実際、リンパ流の増加は代謝性老廃物を除去し、浮腫を減少させる。PBM後のNOS活性の上昇に続いて、おそらく細胞内Ca2+レベルの上昇により、NOが酵素的に産生されうることが示されている[2,96]。
* *
先に述べたように、PBMによる腸間膜リンパ管内皮の弛緩は、リンパ壁の伝染性の増大とTJタンパク質の発現の減少を伴うことが報告されている[87]。TJタンパク質は、成熟したリンパ管の構造化合物であり、リンパ管内皮を通して間質液および免疫細胞を移動させるのに不可欠な役割を果たす[88]。
実際、リンパ管内皮の伝染性の増加は、毒素が集合リンパ管によって輸送され、局所免疫細胞に接触して免疫反応を活性化することを可能にする主なメカニズムである。これらの作用は、PBMによるeNOS活性の上昇に関連している可能性がある。すなわち、PBMを介したリンパ管の拡張は、eNOS活性の上昇に起因している可能性がある[97]。
内皮のNO産生の改善はPBMのメカニズムとしてよく知られており[97],リンパの挙動がNOによって活発に制御されていることを考慮すると、PBMはリンパ内皮分離細胞におけるNO合成を活性化していると思われる。したがって、リンパ管の収縮力が、PBMによる脳からの高分子のリンパ管クリアランスの基礎的なメカニズムである可能性がある[88].
3.3. PBMと神経保護
研究者らは、Aβによって誘発される毒性に対するPBMの神経保護効果について探求してきた[99,100,101,102]。Da Xingの研究チームによって実施された一連の研究は、新規の発見を示した[99,100,102]。
まず、彼らは、レーザーPBM(632.8 nm、培養表面で2 J/cm2)により活性化されたAktが、Aβ25-35処理によりGSK3βと相互作用し、不活性化されることを提案した。この後、GSK3βの阻害により、β-カテニンは細胞質内に蓄積し、核内に移行する。その後、β-カテニンは転写補因子として働き、神経細胞の生存率を向上させる[99]。
次に、同じレーザー光源を用いたフォローアップ研究 [100] において、彼らは、2 J/cm2 が、PBM 後 24 時間と 48 時間にのみ、Aβ25-35 誘発毒性から SH-SY5Y 細胞を保護することを示した。Aβ25-35に暴露した後、SH-SY5Y細胞と海馬ニューロンの両方の細胞生存率がPBMによって用量依存的に増加し、2 J/cm2と4 J/cm2においてのみ有意な増加を示した。彼らの結果は、Aβ1-42の毒性から海馬のニューロンを保護するには、2J/cm2で十分であることも明らかにした[100]。
最近,Da Xingらは、ミトコンドリアCCO活性を増加させ、それによってcAMPとATPのレベルを増加させることによって、レーザーPBM(632.8nm,培養表面で2J/cm2)がSH-SY5Y-APPswe細胞においてPKA/SERT1シグナル経路を活性化してAβレベルの減少に導くことを発見した[102].DuggettとChazotは、1068nmの波長の神経保護効果も証明し、4.5J/cm2がCAD神経芽腫細胞をAβ1-42による細胞死から保護できることを提案した[101]。
1070nmのPBM(4.5J/cm2,10Hzパルスモード、頭皮表面)は、ミクログリアの活性化と血管新生の促進を通じて、ADマウスの脳内Aβレベルを減少させ、したがって認知能力を高めることも報告されている。NIR PBMは、アストロサイトよりもむしろミクログリアの反応を誘発し、形態の変化やAβとの共局在化を増加させる可能性がある。PBMに対するミクログリアの反応はAβレベルと負の相関があり、PBMはおそらくミクログリアの活性化を誘発し、ミクログリアをAβ負荷に動員することによって、Aβ沈着を減少させることが示唆された。
PBM投与後、血管周囲のミクログリアも減少した。一方、PBM投与したADマウスでは、脳血管密度の増加が観察された。この血管密度の増加は、Aβ負荷のクリアランスと正の相関があり、1070nmのPBMは、脳血管密度の増加を通じて最も可能性の高いAβ沈着を減少させることができることが示された[103].これらに加えて、630nmのレーザーPBM療法は、細胞外空間のAβ沈着を粉砕することによってAβで破壊された間質液の流れを減少させ、それによってADのAPP/PS1マウスモデルにおいて認知障害を逆転させることが示されている[104]。
3.4. 経鼻・全身PBM療法と脳内排泄系への影響
鼻腔内には毛細血管が多く、血流が比較的遅いことを考慮すると、血液中の血液細胞に対する全身的な作用が、経鼻PBM技術によって報告された神経治療効果に寄与すると推測される[78,81]。鼻腔内PBMは、CBFを増加させ [80]、血液粘度を低下させ [105]、血液レオロジー [105]、および血液凝固性状態 [106] -認知機能の改善 [107] および気分 [108] に関連する血液レオロジーにおける増強 – を示すことが分かっている。
脳の排水システムに関して、鼻腔内PBMはまた、篩骨-リンパ路の閉塞に対する効果的な治療として役立ち、それによって髄液の流出を改善する可能性がある。これは、PBMによるNOが、リンパ管の収縮とそれに続くリンパ流の増加を調節することができるために起こると考えられている[88,109]。このことから、以前に示された認知症や他の神経変性疾患に関する研究において、血液循環やリンパ系の排出機能の調節が経鼻PBMの根本的な作用機序である可能性が推測される[78]。
* *
最近、遠隔組織(例えば、腹部組織)を標的としたPBM療法が、脳の神経保護をもたらす全身性メカニズムを誘発する可能性が、研究者の大きな関心事となっている[83,110,111]。今日、AD[112,113]およびPD[74,114,115]の動物モデルにおいて、PBMの全身的効果の可能性を示す説得力のある例が多数存在する。
PBMの全身的または間接的な効果という現象の根底にあるメカニズムは明確ではないが、我々は、リンパ系に対するPBMの効果がその1つである可能性を提案する。上述したように、マウスの腹部領域の1267nmレーザーPBMは、収縮振幅の減少を伴う腸間膜リンパ管の弛緩をもたらし、その後、一部は髄膜リンパ管を介して、脳からのGNRのクリアランスの増加をもたらす[59]。
腹部を対象としたPBM療法は、腸内細菌叢を変化させ、未同定の循環メディエーターを放出し、脳に対する神経保護作用を促進することも示唆されている[113]。また、骨髄由来幹細胞、特に間葉系幹細胞は、BBBを容易に通過することができるため、PBMによる脳組織の神経保護を遠隔駆動することができると考えられている[116,117]][115,118]。
4. 結論
髄膜リンパ管は、脳脊髄液および間質液を介して中枢神経系から頸部リンパ節に高分子を排出することにより、脳の恒常性維持に重要な役割を果たしていることを示す証拠が出現している。脳リンパ系の障害は、神経炎症性疾患、神経血管疾患、脳損傷からの回復障害の危険因子と考えられている。
動物実験でも、ADやPDでは髄膜リンパ機能が低下していることが証明されている。特に、髄膜リンパ管の機能障害は、Aβの凝集を介してADの発症を加速させる可能性がある。このように、PBMによるグリンパティック系および頭蓋外リンパ系の機能促進は、髄液流出異常を伴う様々な脳疾患の治療薬として有望視されている。
頭蓋下、脳皮質、さらには皮質下構造への浸透性が良いため、経頭蓋PBMは髄膜リンパ管を刺激することができ、これは神経変性疾患に対するPBMの良好な臨床結果の基礎となるメカニズムの1つであるかもしれない[119,120]。
経頭蓋PBMは、水分子の構造に対する光の効果により、脳脊髄液/間質液構造の水性成分に影響を与え、より自由に流れる、滑りやすい効果を生み出すことができる。もう一つの要因は、PBMによって誘発されるNOの産生で、血液全体の灌流を増加させ、間質液/脳脊髄液の拡散成分を増加させることができる。
* *
生体調節波長(例えば、600-1300nm)を用いたヒト脳の皮質下領域に対する経頭蓋PBMの治療効果は、十分に理解されていないことに留意すべきである。これは、赤色光や近赤外光が頭蓋骨/頭皮を通して脳深部に浸透しにくいことが一因である。
このことから、ヒトの脳の深部構造に十分な光量を届けることは、経頭蓋PBMの分野ではまだ課題となっている。最近、この問題を克服する方法として、ナノ粒子工学とバイオフォトニック技術の組み合わせが提案されている。
第3の光窓(1550-1870nm)の光子が脳組織への伝染率が最も高いことを考慮すると、アップコンバートナノ粒子(UCNP)が、これらの光子をより高いエネルギーとより大きな生物学的効果を持つ可視および近赤外スペクトルに変換することによって、脳深部に光を届けるために役立つと推測される。UCNPはBBBを通過する能力が高く、また毒性が低いため、脳疾患への応用が期待される。
* *
ヒトへの応用を考えると、睡眠前のベッドですぐに経頭蓋光照射を行うと、頭蓋骨の表面温度が上昇し、温度勾配が大きくなって、血液のヒートシンクができ、睡眠中の脳を冷却することができると推測される。また、経鼻PBMは、髄液の排出が阻害されることで様々な脳の病態を引き起こす主な原因である篩骨板閉塞の治療にも有効な非侵襲的アプローチとなり得る。
PBMの経鼻投与は、血液の粘性を低下させる。すると、赤血球の積み重ね(ルーロー形成)が少なくなり、毛細血管よりも細い部分の微小循環の流れが良くなると考えられる。さらに、脳細胞も循環血液や異なる下層の臓器のPBMから間接的/全身的に恩恵を受ける可能性が示唆されている。
頸動脈とまたは椎骨動脈を横断するボディパッドLEDデバイスを使用した全身的なPBMアプリケーションは、ヒトの脳実質への血管拡張と血流の増加を促進することができる。体幹部およびまたは頸部リンパ組織上のLEDのボディパッド式アプリケーションは、おそらく深部頸部リンパ節の活性を増加させ、グリンパティックフローの引き込み面として作用することもできる。
胸部や腹部へのPBMの塗布は、腸間膜リンパ管を刺激し、リンパの流れを増大させるのに有効であることが証明されるかもしれない。最後に、光エネルギーに基づく療法であるPBMは、概日リズムの影響を受けるため、グリンパティック系および髄膜リンパ系へのPBM介入では、赤色/近赤外光を照射するタイミングがより重要になる。今後の研究により、グリンパティック系の5つの構成要素それぞれに対するPBMの光影響について明らかにされることが期待される。