Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6664299/
Photobiomodulation for Alzheimer’s Disease: Has the Light Dawned?
マイケル・R・ハンブリン1、2、3
要旨
癌に次いで、アルツハイマー病と認知症は、おそらく今日の西洋世界が直面している最も心配な健康問題である。多くの臨床試験では、認知症患者の認知機能の低下を安定化させたり、回復させたりする効果は認められなかったが、アルツハイマー病の病態は、βアミロイド斑やタウリン酸塩で構成されている。認知症の病理学的特徴であるβアミロイド斑やタウのもつれはよく知られているが、認知症になりやすい遺伝的要因や生活習慣の要因については、かなりの議論がある。
光バイオモジュレーション(PBM)とは、赤色または近赤外光を用いて治癒を促進し、痛みや炎症を和らげ、組織の死滅を防ぐ治療法である。近年、PBMは多様な脳疾患に応用されており、頭部に光を当てることで非侵襲的に適用されることが多い(経頭蓋PBM)。
本レビューでは、tPBMの脳内作用機序について考察するとともに、tPBMを用いてアルツハイマー病の動物モデルを治療した研究をまとめた。また、tPBMをアルツハイマー病や認知症患者の治療に使用した限られた数の臨床試験の結果を論じる。
キーワード:光生物調節、アルツハイマー病、認知症、作用機序、動物モデル、臨床試験
1. はじめに
1.1. 光生物調節の紹介
フォトバイオモジュレーション(PBM)は、治癒を刺激し、痛みや炎症を和らげ、組織が死滅するのを防ぐために、赤色または近赤外光の治療的使用を説明している。PBMは以前は「低レベルレーザー(または光)療法」(LLLT)と呼ばれていたが、「低」という用語が不明確であること、レーザーは絶対に必要ではないこと、およびいくつかのプロセスの阻害が有益であるという事実を反映して名称が変更された[1、2]。
光生物調節療法(PBMT)は、様々な疾患または障害の治療法としてのPBMの使用を記述している。PBMは、50年以上前にハンガリーのEndre Mesterによって、マウスの発毛と創傷治癒を研究して発見された[3]。それ以来、PBMは徐々に医療従事者、理学療法士、一般の人々に受け入れられるようになっていた。このような受け入れの増加は、赤色および近赤外領域の波長を持つ発光ダイオード(LED)が利用可能になり、かなりのレベルの電力密度(かなり大きな面積で最大100mW/cm2)になったことが一因である。利用可能な証拠のほとんどは、LEDが同じような波長と出力密度のレーザーと比較して同等の性能を発揮することを示唆している[4]。しかし、LEDには、より安全性が高く、低コストで、家庭での使用に適しているという利点がある。
1.2. PBMのメカニズム
光生物学の第一法則として、光子が特定の分子発色団に吸収されないと生物学的効果が得られないとされている。PBMに有用とされている発色団は、電磁スペクトルの異なる波長領域(青、緑、赤、近赤外)で吸収され、図1に示すように、後述する。
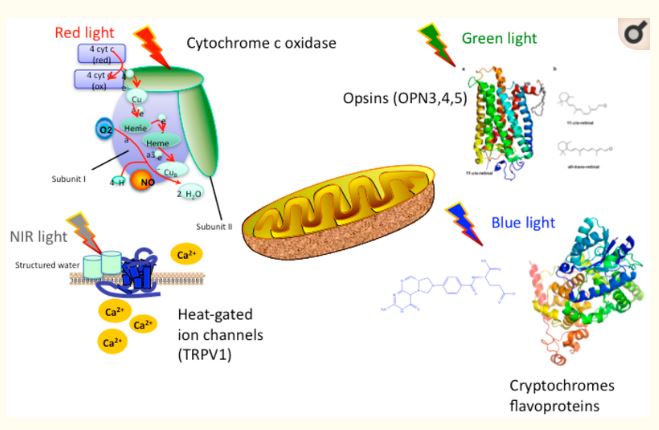
図1.
異なる波長の光を吸収するPBM用発色団の提案。これらの発色団の間にはかなりの重複があり、構造化された水が吸収する近赤外光は長波長(>950nm)である可能性が高いことに注意が必要である。
シトクロムC酸化酵素(CCO)は、ミトコンドリア膜の外側に位置する電子輸送鎖の末端酵素(ユニットIV)である。電子輸送鎖は、一連の酸化還元反応を介して、ミトコンドリアの内膜を横切る電子の移動を促進する。これらの電子移動の手順の正味の結果は、アルツハイマー病Pから高エネルギーのアデノシン三リン酸(ATP)を生成するATP合成酵素(時々ユニットVと呼ばれる)の活性を駆動するミトコンドリア膜を介してプロトンの勾配を生成することである。CCOは、チトクロムCから酸素分子への電子の移動を媒介する。CCO は、13 の異なるポリペプチドサブユニットで構成される複雑なタンパク質であり、また、2 つのヘムセンターと 2 つの銅センターが含まれている。これらのヘム中心と銅中心のそれぞれは、酸化または還元され、16の異なる酸化状態を与えることができる。これらの酸化状態はそれぞれ吸収スペクトルが微妙に異なるが、CCOは生体分子の中でも近赤外スペクトルに大きな吸収を持つという点ではほぼ特異な存在である。実際、Britton Chanceは、生体組織による近赤外光の吸収の50%以上が、発色団としてのこの単一酵素に起因すると推定している[5]。
多くの出版物において、CCOは、スペクトルの赤色および近赤外領域の光によって活性化された信号の生物学的光受容体および変換器であることが示されている[6、7]。具体的には、PBMで送達された光を吸収することで、CCOの触媒中心で酸素分子を還元するための電子の利用可能性が増加し、ミトコンドリア膜電位(MMP)が上昇し、ATP、環状アデノシン一リン酸(cAMP活性酸素種(ROS)のレベルが上昇し、これらはすべてミトコンドリア機能の増加を示しており、細胞内シグナル伝達経路の開始を引き起こす可能性があると考えられている[8]。しかし最近、CCO仮説が疑問視されるようになってきた。Limaら[9]は、任意の活性なCCOを発現しないように2つの異なる種類の細胞を遺伝子操作し、彼らは野生型細胞と比較して、660 nmの光にも同様によく応答したことを発見した。錯体I-IVやコハク酸脱水素酵素などの電子伝達鎖の他のユニットもPBMの結果として活性の増加を示しているが、CCOはまだ主要な光受容体の一つであると考えられている。この考え方は、PBM のような低レベルの光照射により酸素消費量が増加するという事実に裏付けられ、酸素消費量の大部分が錯体 IV で発生していること、さらに CCO 阻害剤であるアジ化ナトリウムの添加により PBM の効果が消失することからも裏付けられている[10、11]。さらに、機能的なミトコンドリアを欠いた rho-zero 細胞は、野生型と同様に PBM に反応しない[12]。
それにもかかわらず、CCOが赤色および近赤外光の主要な発色団であることを支持する多くの証拠にもかかわらず、これがすべてではないことを示唆する証拠が増えている。Limaら[9]は、CCOを欠いた2つの細胞株を調査した。1つはCox10をノックアウトしたマウス株(補酵素であるヘムを合成できなかったもう1つはtRNAリジンをコードするmtDNA遺伝子に変異があるヒト株(3つの重要なCCOサブユニットを欠いていた)である。PBM(660 nm)は、野生型とCCOノックアウト細胞の両方において、ATPとクエン酸合成酵素レベルの増加とともに、細胞増殖の増加を引き起こした。これらの結果は、機能的なCCOが代謝と細胞増殖を促進する能力を必要としないことを示している。
ドイツ、ウルムのSommerによる最近の論説[13]は、細胞内の界面水層(IWL)に対する赤色光および近赤外光(特に1Hzなどの低周波でパルス化された光)の効果が、代替的な説明である可能性を示唆している。もしこれらのIWLがミトコンドリアの内部にあるとすれば、エネルギー吸収の結果として粘度が下がることで、ATP合成酵素である分子ローターがより速く回転し、より多くのATPを産生することが可能になる可能性がある。一方、もしIWLが形質膜内に局在していれば、光の吸収によって栄養分の取り込みが増加し、増殖が促進される可能性がある。
実際の発色団に関係なく、PBMはミトコンドリアの逆行性シグナリングを引き起こすことができる[14]。これは、信号や通信がミトコンドリアから細胞の核に伝わることを意味し、その逆ではなく、細胞の核に伝わることを意味する。前述のミトコンドリアの変化は、ミトコンドリアの超構造を変化させ、ミトコンドリアの生合成を誘発する結果となる[15]。その結果、細胞膜の膜透過性とイオンフラックスが変化し、アクチベータープロテイン-1(AP1)とNFκBの活性が変化する[16]。
オプシン、フラビン、クリプトコームなどの他の一次発色団が、特に短波長(青と緑)での光の生物学的吸収を媒介する可能性があるという証拠が出てきている。オプシンは、全トランス異性体に光異性化される発色団としてシス-レチナルドアルデヒド分子を含み、これによりタンパク質のコンフォメーションに変化を生じさせ、シグナル伝達カスケードを開始する [17]。フラビンおよびフラボタンパク質は、リボフラビン、フラビンモノヌクレオチド、またはフラビンアデニンジヌクレオチドなどの発色団を含み、光で励起されると酸化還元反応を行うことができる[18]。クリプトクロムは、植物、動物、さらにはヒトにおいても青色光受容体として作用するフラボタンパク質の特別なサブクラスである[19]。
PBMの作用機序として光ゲートイオンチャネルが挙げられることを証明する証拠は、現時点ではまばらであるが、徐々に増えてきている。PBMは一過性受容体電位(TRP)チャネルに作用する可能性が高い。TRPチャネルは、昆虫の視覚を司るメカニズムとしてショウジョウバエの突然変異体で初めて発見されたが、現在では、他の様々な刺激に加えて、光にも敏感であることが知られている[20]。TRPチャネルはカルシウムチャネルであり、ホスホイノシチドによって調節される [21]。光ゲートイオンチャネルは、視能遺伝学の分野で非常に注目されている[22]。しかし、これらの研究の大部分は、細菌由来のチャネルロドプシンに類似したイオンチャネルを使用している[22]。PBMと光ゲートイオンチャネルに関連する研究の大部分は、TRP種のTRPV “Vanilloid “サブファミリーを試験することによって行われていた。様々なグループによって行われた研究からの証拠[23-26]は、TRPチャネルが緑色の光によって活性化される可能性が最も高いという一般的なコンセンサスにつながっている。しかし、緑色光は赤外光や近赤外光のような透過性に欠けているため、実用的な臨床応用には至っていない。しかし、Ryuらは、赤外線(2780 nm)波長の光への暴露がTRPV1の活性化を減衰させ、痛み刺激の発生を減少させることを発見した[24]。TRPV4を同じ波長の光に曝露した場合にも、同様の劇的な抗侵害受容性効果が観察された。TRPV4は1875 nmのパルス光にも反応することが示されたが、この領域では水が赤外線の主な吸収体であるため、結果は光刺激ではなく熱刺激によるものであるとは断定できないが[25]、この結果は光刺激によるものではない。
その分子吸収係数や細胞や組織の相対的な存在量を考えると、赤外波長(>900 nm)では水が最も重要な発色団であることは明らかである。それにもかかわらず、通常行われているようにPBMは、特に脳内の組織の過度の加熱を生成しない。実際、最も顕著な加熱効果(もしあれば)は頭皮の皮膚で感じられる。どのようにして我々は、PBMは1064 nmのような長い波長で脳に強力な効果を持つことができることを説明することができる[27、28]?一つの答えは、ポラック[29-31]によって精巧化された「ナノ構造水」または「界面水」の概念にあるかもしれない。この排除ゾーン(EZ)水(これは上で議論したIWL[13]と同じかもしれない)は、粘度やpHなどのパラメータに明確な物理的変化をもたらす光放射を吸収する。EZ水層は細胞内膜上に存在するため、これらの膜内に埋め込まれたイオンチャネル(例えばミトコンドリア)が、これらの物理的変化によって引き起こされる可能性があることを示唆するのが妥当である。バルク水はEZ水と同じ程度に赤外光を吸収しないので、赤外エネルギーがすべての水分子に吸収されている場合に予想されるように、組織の検出可能なバルク加熱がない一方で、生化学的変化が細胞内で起こることができる理由を説明することができるであろう。

2. アルツハイマー病と認知症
認知症は、認知機能や実行機能、記憶力に影響を与える広範な脳疾患を表す臨床用語である[32]。認知症の診断には、通常の加齢過程による予想以上に顕著な衰えを伴う精神機能の変化が必要である[33]。2015年には、全世界で4、680万人が認知症に罹患していると推定され、その58%が中低所得国に居住しており、この数は20年ごとに倍増すると予想されている[34]。
アルツハイマー病は認知症の中で最も一般的なタイプ(症例の60%~70%)であり、次いで血管性認知症(25%レビー小体型認知症(15%)と続いている[35]。アルツハイマー病は、1911年に報告書を発表したAlois Alzheimer(1864-1915)によって初めて記述された[36]。リスクの約70%はおそらく遺伝的なものであり、多くの遺伝子が関与していることが提唱されている[37]。他の危険因子としては、頭部外傷の既往、うつ病、高血圧などがある。アルツハイマー病は脳全体(特に大脳皮質)のびまん性萎縮を特徴とし、細胞外βアミロイド斑や高リン酸化タウタンパク質からなる脳内神経原線維のもつれを伴う[38]。アルツハイマー病の正確なメカニズムは依然として熱い議論の対象となっている[39]。他にも様々な治験薬が臨床試験で試験されているが、これまでのところあまり成功していない。
以下のセクションでは、いくつかの仮説を要約する。アミロイド仮説は何十年も前から優勢な説明である。アミロイドβペプチド(40または42アミノ酸)は、βおよびγセクレターゼによるアミロイド前駆体タンパク質(APP)の連続的な酵素切断によって形成される。アミロイドβ42のレベルの増加は、アミロイド線維形成をもたらし、最終的には老人性プラークに発展する。しかし、アミロイドペプチド(βおよびγセクレターゼ阻害剤)とアミロイドプラーク(モノクローナル抗体を用いた免疫療法アプローチ)を標的としたいくつかの薬物試験が失敗に終わったことから、アミロイドプラークは脳の劣化の原因というよりもむしろマーカーである可能性があるという考えに至っている[40]。
別の仮説では、タウに注目している[41]。タウは微小管の集合に関与する微小管関連タンパク質である。ヒト成人脳では主に神経細胞の軸索に発現する2つのアイソフォーム(4Rと3R)がある。アルツハイマー病脳では、3Rと4Rのタウは過リン酸化状態で蓄積され、細胞体では神経原線維のもつれ(NFT)を形成し、樹状突起や軸索で形成される場合は糸状になる。多くの異なる脳障害はタウ病理によって特徴づけられ、「タウ症」として知られている[42]。これらには、前頭側頭型認知症、皮質馬場変性症、リチャードソン症候群、パーキンソン病、慢性外傷性脳症、および加齢性タウアストログリオパチーが含まれる。
神経炎症および反応性グリア症はアルツハイマー病の特徴である[43]。蓄積された証拠は、M1表現型を持つミクログリアがアルツハイマー病において重要なプレーヤーであることを示唆している[44]。M1ミクログリアはプロ炎症性サイトカインをポンプアウトするだけでなく、これらの細胞はその貪食機能をダウンレギュレートするため、アミロイドプラークをクリアすることができない。ミクログリアの表現型をM1からM2に切り替えることができる任意の治療法(PBMなど)は、アルツハイマー病に役立つかもしれない。
高血圧と不規則な心拍に苦しむ患者におけるアルツハイマー病の発生率の増加は、”マイクロ脳卒中 “の仮説を生み出した[45]。線維性赤血球塞栓またはミクロンサイズのコレステロール結晶によって引き起こされるマイクロ脳卒中は、治癒反応としてアミロイドプラークの成長のための「播種点」として機能する可能性がある。関連する仮説として、血管機能障害と微小出血の影響が挙げられる[46]。血管機能障害は血管性痴呆の原因としてしばしば記述されるが、アルツハイマー病においても役割を果たしているという証拠が増えている[47]。これらの微小出血はプラーク形成と相関している[48]。脳血管におけるこれらの微小出血は、自然免疫系を活性化させる引き金として作用する可能性がある。また、認知機能障害の初期マーカーの1つと考えられている血液脳関門の破壊部位を示す可能性もある [49]。
酸化ストレスはアルツハイマー病の病因に関与している[50]。証拠には、フリーラジカルを生成することができる鉄、アルミニウム、水銀などのアルツハイマー病脳内の特定の金属のレベルの増加が含まれている。神経原線維のもつれやアミロイド斑における脂質過酸化、4-ヒドロキシノネナール、タンパク質やDNAへの酸化的損傷、高度な糖化最終生成物(AGEマロンジアルデヒド、カルボニル、ペルオキシナイトライト、ヘムオキシゲナーゼ-1およびSOD-1の増加。しかし、抗酸化物質を多く含む食事はある程度の保護を提供するが、抗酸化物質の補充はほとんどの場合、何らの利点を示すことができないであった[51]。
ミトコンドリア活性とグルコース代謝の低下は、アルツハイマー病で広く見られている[52]。チトクロームc酸化酵素の変化とミトコンドリアの形態学的変化が発見されている。統合ストレス応答と転写因子ATF4の活性化は、ミトコンドリアの機能不全によって引き起こされる可能性がある。
最後に、もう一つの仮説は、腸内マイクロバイオームの変化を示唆している[53]。細菌自体が細菌性アミロイドを分泌し、それがアミロイドプラークの交雑を誘発するか、あるいは細菌が自然免疫応答を過剰に刺激する可能性がある[54]。そのようなポルフィロモナスジンジバリスなどの細菌自体は、アルツハイマー病の脳で発見されている[55]。ウイルスやスピロヘータなどの他の病原体も脳に関与している可能性があり、アミロイドβペプチドは抗菌防御ペプチドとして機能している可能性がある[56]。
3. 脳内PBMのメカニズム
で見られるように、経頭蓋PBM(tPBM)の脳への利点を説明するために、さまざまなメカニズムの驚くべき配列が提案されている。これらは図2に模式的に示されている。
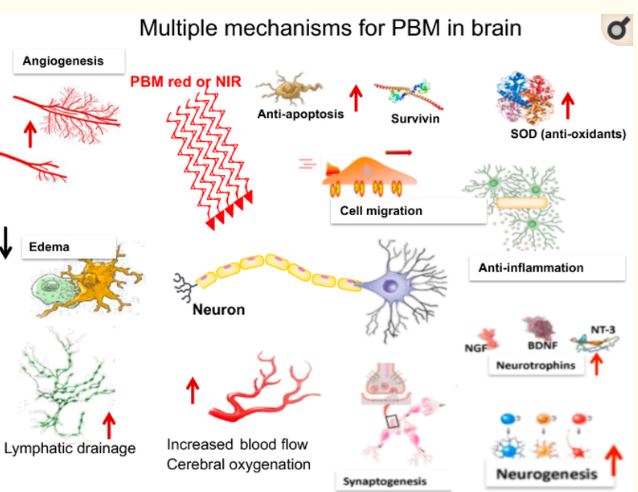
図2. 脳内のtPBMのメカニズムは数多く提案されている(後述)。
3.1. 代謝のメカニズム
代謝機能の改善は、PBMの最も容易に認識できる効果の一つであり、細胞内ATP産生の増加は、作用機序の最も強く支持された一つである[57]。さらに、いくつかの前臨床研究では、様々な脳障害のためにtPBMを受けた実験動物(マウスまたはラット)において、脳内ATP量が増加したことが示されている[58、59]。それは、ミトコンドリアの機能不全、ATPの不十分な供給、および酸化ストレスが脳疾患のほぼすべての形態の寄与因子であることが一般的な知見である[60]。これは、大うつ病性障害[61]、外傷性脳損傷[62]、パーキンソン病[63]、およびアルツハイマー病[64]などの神経学的状態について報告されている。
3.2. 血流
tPBM後の変化の中で最も測定しやすいのは、脳血流と酸素量の変化である。これは実験動物、特にヒトの被験者にも当てはまる。近赤外分光法は、1064nmのレーザーで治療したヒトボランティアの前腕に使用されている[65]。彼らは、tPBMが、レーザーエネルギー量が時間の経過とともに蓄積されると、治療部位におけるCCO濃度(Delta [CCO])および酸素化ヘモグロビン濃度(Delta [HbO])の有意な増加を誘導することを発見した。Schifferら[66]は、大うつ病および不安症のために額に適用された810nmのLEDを用いてtPBMを試験し、Somanetics(米国ミシガン州トロイ)のINVOS商用システムを使用して、装置の通常の酸素飽和出力に加えて、左右の前頭部およびRCBF(局所脳血流)の脳ヘモグロビン(cHb)を測定した。
PBMの結果としてのNOの放出が脳血流量の増加に関与していることが示唆されている[67]。NOは主要なニューロンシグナル伝達分子であり、他の機能の中でも血管拡張を誘発する能力を持っている。そのためには、まず、可溶性グアニル酸シクラーゼを刺激してcyclic-GMP(cGMP)を形成する。cGMPはその後、プロテインキナーゼGを活性化し、Ca2+の再取り込みとカルシウム活性化カリウムチャネルの開通につながる。その後のCa2+濃度の低下により、ミオシン軽鎖キナーゼがミオシン分子をリン酸化することが阻止され、血管やリンパ管の内膜の平滑筋細胞が弛緩するようになる[68]。この血管拡張はその後、循環の改善を促進し、その結果、パルス電磁場で観察されるのと同様の方法で脳酸素化の改善につながる[69]。
CBFの障害、神経血管機能障害、および低脳酸素化は、アルツハイマー病の重要な特徴として提案されている[70]。
3.3. 神経保護
様々な証拠は、PBMが神経保護のために利用され得ることを示唆している、本質的には、損傷から細胞を保護し、その生存と長寿を促進し、アポトーシスのシグナル伝達プロセスを逆転させる。PBMは、グリコーゲン合成酵素キナーゼ3β(GSK3β)の活性を阻害することで、この結果を達成することができる。これを行うために、それはプロテインキナーゼB(AKT)を活性化し、それはそのSer9残基のリン酸化レベルを増加させ、それによりGSK3βのN末端がそれ自身の結合部位と結合することを可能にする。その結果、β-カテニンが蓄積され、核内に移動することで、GSK3βの活性が阻害されると、リン酸化不足がなくなり、活性が高まる。一旦核内に蓄積されると、β-カテニンはTCF/LEF依存性の転写活性の増加に依存して細胞の生存を促進する [71]。このGSK3βの阻害は、生物の成長に伴って起こる正常な細胞死であるアポトーシスの防止にも役立つ。GSK3βは、AKTとBax(プロアポトーシス刺激の存在下で核にトランスロケーションされ、プロセスの開始を誘発するタンパク質)との間のメディエーターとして作用すると考えられている。しかし、GSK3βが阻害されると、AKTとBaxの間の伝達経路が遮断される。その結果、Baxの転座がシグナル化されず、したがって阻害される[72]。
PBMはまた、老化からの保護という形で神経保護的な資質を示している[73]。PBMは、細胞外シグナル関連キナーゼ(ERK)/フォークヘッドボックスプロテインM1(FOXM1)経路を活性化することが示されている。FOXM1タンパク質は細胞周期のG1期からS期への進行を制御しており、ERK/FOXM1経路の活性化を介して、PBMはERKの核へのより大きな移動と核内でのFOXM1のより大きな蓄積を導く。これにより、p21タンパク質の発現が低下し、G1期の有糸分裂が停止するため、細胞老化の進行が遅くなる。
PBMはまた、毒素の有害な影響から細胞を保護するのに有効であることが示されている[74]。Eellsらによる研究[75]では、670nmの光を照射することで、メタノールに曝露したげっ歯類モデルにおいて、網膜機能の回復および組織学的損傷の防止を引き起こすことに成功した。これは、メタノールがCCOの阻害剤である有毒代謝物ギ酸を生成し、PBMがCCOの刺激剤として知られていることに起因すると考えられる。Wong-Rileyによるテトロドトキシン曝露後のPBMの効果に関する研究では、同様の結果が得られており、特にモデルにCCOの吸収スペクトルのピークである670nmと830nmの光を照射した場合には、同様の結果が得られている[7]。このことは、PBMの抗毒素効果がCCOの刺激にトレースできることをさらに示している。また、PBMはシアン化カリウムに伴う有害作用の予防にも有効である。Liangら(2006)は、670nmの光で前処理した場合、シアン化物によって誘導されたBaxの神経細胞発現が低下し、その後のアポトーシスを防ぐことを発見した[76]。
さらに、PBMは、異なる健康状態の細胞に異なる方法で影響を与え、その生存を促進するために必要な方法で細胞を本質的に修飾するという、かなりユニークな特性を実証してきた。例えば、正常な細胞では、CCOによる光の吸収は、ベースラインを超えるMMPの増加と活性酸素産生の短いサージをもたらする。しかし、既存の酸化ストレス、興奮毒性、または電子輸送の阻害により MMP が低い細胞では、光の吸収は MMP を正常レベルに向けて増加させ、ROS 産生を減少させる [77]。同様に、健康な細胞におけるPBMに対する典型的な反応は、細胞内Ca2+の短時間の増加である[78]。しかし、すでに過剰なCa2+を含む細胞(興奮毒性と呼ばれる現象)では、PBMは逆の反応を引き起こす。天然物に基づく神経保護アプローチの範囲は、アルツハイマー病の治療のために研究されている[80]。
3.4. 酸化ストレス
酸化ストレスは、活性酸素種(ROS)の産生と、過剰になると有害になるその影響を抗酸化物質を介して打ち消す体の能力の間に不均衡が存在するときに発生する。多くの情報源は、酸化ストレスを大うつ病性障害[81]や外傷性脳損傷[82]などの様々な神経学的状態と結びつけており、心血管疾患[83]やアルツハイマー病[84]は言うまでもなく、そのような状態になっている。
しかし、これらの疾患に対する抗酸化療法の多くの臨床試験が失敗に終わっているため、状況は最初に見えるよりも複雑です[51、85]。明らかに、ある程度の酸化ストレスは人間の最適な機能に必要であり、抗酸化物質の補給ですべての酸化ストレスを除去することは逆効果である可能性がある[86]。重要な論文では、人間に抗酸化物質を投与すると、運動による健康増進効果が除去されることが示されている[87]。
Salehpourら[88]は、マウスの睡眠不足(SD)が海馬の酸化ストレスとそれに続く記憶障害を引き起こすことを示した。マウスは、バーンズ迷路とWhat-Wher-Wher-Which課題でより良いパフォーマンスを示し、抗酸化酵素の海馬レベルが上昇し、酸化ストレスバイオマーカーが減少した。外傷を受けた筋肉に対するPBMの効果の研究では、PBMは細胞によって産生されるサイトカイン誘導性一酸化窒素合成酵素(iNOS)の量を調節するのに有効であることが示されている。これは、過剰な量のiNOSがNOの過剰生産につながる可能性があるため、重要なことであり、それはその後、ペルオキシナイトライトと呼ばれる活性酸素/RNSの生産の増加を示唆し、酸化ストレスの増加につながるだろう。具体的には、PBMはペルオキシナイトライトを減少させることができる[89]一方で、PBMの血管拡張効果のために主に責任を負う種である内皮一酸化窒素合成酵素(eNOS)などのNO合成酵素の他のアイソフォームの正の効果を維持することができる[90-92]。
PBMはまた、血管新生の増加を刺激し、血流のさらなる改善につながることが示されている。Cury [93]によって実証されたように、780 nmおよび40 J/cm2でのPBMは、タンパク質HIF 1αおよび血管内皮増殖因子の発現の増加、およびマトリックスメタロプロテアーゼ2活性の低下を誘発し、これらのすべてが血管新生を誘導することが判明した。さらに、赤血球に対する赤/NIR光の効果を試験管内試験(in vitro)で調べたところ、NIR光は赤血球を酸化から保護するのに非常に効果的であることが明らかになった[94]。
広範囲に及ぶミトコンドリア機能不全、アルミニウムおよび重金属の増加したレベル、およびアルツハイマー病で発生する神経炎症は、有意なレベルの酸化ストレスを生じさせる。酸化ストレスは、アミロイドβの沈着、タウの高リン酸化、およびその後のシナプスおよびニューロンの喪失を引き起こす[96]。様々な抗酸化物質(および特にコエンザイムQ10)が、アルツハイマー病の治療のために試験されている[97]。
3.5. 抗炎症作用
炎症とは、細菌やウイルスなどの異物に対する自然免疫系の防御機能の一つである。細胞レベルでは、転写因子NF -κBが活性化されることで発生する。急性炎症は陽性であるのに対し、慢性炎症は非常に悪い影響を及ぼすことがある。神経変性疾患や気分障害を含む多くの疾患は、少なくとも一部は慢性炎症に起因している。
PBMが炎症を鎮めるのに役立つ一つの方法は、シクロオキシゲナーゼ2(COX-2)酵素の阻害である。Limらは、低出力の635nmの光照射が細胞内の活性酸素を減少させることでCOX-2の阻害を引き起こすことを発見した[98]。現在、医薬品によるCOX-2の阻害は広く支持されており、COX-2阻害剤は非ステロイド性抗炎症薬(NSAIDS [99])の市場のかなりの部分を占めている。PBMを使用すると、異なる刺激で、本質的に同じ結果を達成することができる。
PBM はまた、遊離 NF κB の細胞レベルを調節することができる。NF κB は、抑制タンパク質である IκB に結合した細胞質中に存在する。プロ炎症性刺激は、IκBの分解を引き起こす上流のシグナル伝達調節因子であるIκBキナーゼを活性化する能力を持っている。IκB が分解されると、NF κB は自由に核に移動し、そこでプロ炎症性遺伝子の発現を誘発する。PBM は、研究対象となる細胞の種類とその活性化状態に応じて、NF κB に逆の効果を与えることができるという証拠がある。Chen らは、正常な線維芽細胞において、PBM が刺激されたミトコンドリアからの低量の活性酸素の発生を介して NF κB を活性化することを発見した[100]。しかし、同じグループは、Toll like receptor agonistsによってM1表現型に活性化された樹状細胞(マクロファージ細胞のもう一つのタイプ)では、PBMが炎症性サイトカインを減少させることを発見した[101]。同様に、山浦らは、PBMを投与した活性化関節リウマチ由来滑膜細胞でNF-κBのレベルが低下することを発見した[102]。
さらに、PBMは、免疫系にとって重要なシグナル伝達分子として作用するタンパク質であるサイトカインのレベルを調節する能力を持っている。PBMは、プロおよび抗炎症性サイトカインの両方のレベルを調節することが示されているが、炎症を抑えるためには、腫瘍壊死因子(TNF)およびその他のプロ炎症性サイトカインのレベルを調節する能力が特に有用である。
脳内の炎症は、体の他の部分の炎症とは明らかに異なることに留意すべきである。実際、「神経炎症」という用語は、ミクログリアの活性化に一般的に適用される。ミクログリアは、中枢神経系の免疫防御システムとして機能する単球/マクロファージ系統の細胞である[103]。ミクログリアは、プラーク、損傷したニューロンやシナプス、感染因子を求めて常に中枢神経系を清掃している。ミクログリアは、中枢神経系における小さな病理学的変化にさえ非常に敏感である [104]。
マクロファージ系統の他の細胞と共通して、ミクログリアは多様な表現型をとることができ、組織の恒常性を維持するために機能をシフトさせる能力を保持している。ミクログリアは、プロ炎症性サイトカインを発現し、微生物細胞を殺すことができるM1表現型にLPSまたはIFN-γによって活性化することができる。一方、ミクログリアはIL-4/IL-13によって活性化され、破片のファゴサイトーシス、炎症の解決、組織修復のためのM2表現型になることができる。自然炎症反応の制御における代謝リプログラミングの役割を示唆する証拠が増えている[105]。研究では、M1表現型はしばしばエネルギー生産のための酸化的リン酸化から好気性解糖へのシフトを伴うことが実証されている[106]。このような条件下では、エネルギー需要は機能活動や細胞の生存に関連しており、したがって、様々な神経変性状態に対するミクログリアの活性化の寄与に影響を及ぼす可能性がある。
PBMがミトコンドリアの代謝を酸化的リン酸化に向けて活性化し、好気性解糖から離れた状態にすることができるというかなりの証拠があるので、これはPBMがミクログリアの表現型をM1からM2へと変化させる可能性があるもっともらしい理由です[107]。このシフトの結果は、代わりに、そのようなアルツハイマー病のβアミロイドプラークなどの物質を処理することができないM1ミクログリアの、したがって、活性酸素や炎症性サイトカインを生成し、PBM誘導M2ミクログリアは、プラークをクリアし、抗炎症および抗酸化作用を発揮し、組織治癒を奨励することになるだろう[108]。
3.6. 神経新生
長い間、成人の脳は新しい脳細胞を成長させることができないと考えられてた。胚や幼少動物、子供の脳は、神経幹細胞(NSC)や神経前駆細胞を媒介とした神経新生が可能でなければならないことがわかってたが、成人になるとそのプロセスは止まっていると考えられてた。私たちの認識の転換点は、成人の神経新生の発見と、試験管内試験(in vitro)と生体内試験(in vivo)の両方でNSCとして機能し、新しいニューロン、グリア細胞、またはその両方を生成することができる細胞の同定であった [109]。NSCの性質と出生後の脳の再生の可能性に関するパラダイムシフトは、新しい展望を持った新しい研究のための門戸を開いた[110]。現在、科学界は、成人脳の神経新生とNSCの機能を深く理解するだけでなく、新しい治療モダリティを用いてNSCをどのように促進するかにも取り組んでいる[111]。実験的にNSC/NPは、動物に感染した後、犠牲になる前の様々な時間に分裂細胞の核にブロモデオキシウリジン(BrdU)が取り込まれることによって検出され、その後、抗体によって測定することができる[112]。しかし、この神経新生が観察される脳内には、「神経原性ニッチ」として知られるいくつかの明確に定義された領域しか存在しないことが確立されている[113]。最もよく認められている神経原性ニッチは、海馬の歯状回の顆粒下層[114]、側脳室の脳室下帯(SVZ)である[115]。BrdU陽性細胞がグリアや他の細胞型ではなく、実際にニューロンであることを確認するために、通常、NeuN(成熟ニューロンのマーカー)またはTuj-1(βチューブリンクラスIII)に対する第二の抗体で染色するのが一般的である。
脳に送達されたtPBMによって神経新生が刺激されたという最初の報告は、ラットに脳卒中を誘発し、tPBMで処理した2006年のOronらの研究によるものである。PBMで脳卒中を誘発したラットにtPBMを投与したところ、新たに形成された神経細胞(BrdU-Tuj-1二重陽性)および遊走細胞(ダブルコルチン陽性)の数が、脳卒中誘発と同側の大脳半球の脳室下帯で有意に増加した[117]。同様の結果は、tPBMを用いてTBIを受けたマウスを治療したXuanらによって報告されている[118]。彼らは、TBI後1週間では歯状回とSVZで二重染色されたBrdU-NeuN(神経前駆細胞)が有意に増加していたが、TBI後4週間では増加していなかったことを発見した。ダブルコルチン(DCX)とTUJ-1の増加も認められた。最近の報告[119]は、アルツハイマー病を持つ被験者の海馬の神経新生に急激な低下があったことを示し、この減少は、疾患の進行とともに増加した。
3.7. シナプトジェネシス
これまでに発見されたtPBMの脳への効果の中で最も注目すべきものは、シナプス形成(神経可塑性とも呼ばれる)を促進する作用である。TBI、脳卒中、神経変性疾患、気分障害など、多くの脳疾患は、部分的または全体的に、脳の特定領域における神経細胞の接続不良や異常に起因していると考えられており、このプロセスは極めて重要である。tPBMが神経の組織化や再編成を促進することで、これらの影響に対抗する能力を持つとすれば、これらの脳疾患の新たな治療法として非常に有望であると考えられる。
tPBMが神経細胞の結合を促進する一つの方法として、BDNF(脳由来神経栄養因子)のアップレギュレーションが考えられる。BDNFは、神経成長因子(NGFNT3、NT4、およびGDNFを含む「ニューロトロフィン」の一種である[120]。BDNFは神経系に存在するタンパク質であり、既存のニューロンを維持し、新しいニューロンと新しいシナプスの成長を促すのに役立つ。具体的には、シナプス伝達の改善を促進するために樹状突起構造を調節すると考えられている[121]。PBMは、ERK/CREB経路を介してBDNFの減衰を遅らせることが示されており、従って、樹状突起の形態形成とニューロンの接続性の改善にポジティブな影響を与えることが示されている[122]。BDNFはまた、シナプシン-1というタンパク質のメディエーターでもあり、神経線維の発達を促進し、シナプス接触を維持することでシナプス形成を改善する[123]。Mengらによる研究[124]では、780 nm の光照射後の胚性ラットの神経組織において、より密な分岐と線維間の相互接続性の増加が観察されており、これらのタンパク質の活性が増加していることが示されている。また、BDNFは神経可塑性適応の改善にも関連しており、外傷性脳損傷や脳卒中の場合に特に重要である[125]。
tPBMがヒトおよびマウスの神経可塑性とシナプス形成を刺激することが決定的に示されれば、幅広い臨床応用への道が開かれることになる[126]。神経可塑性の障害や異常は、アルツハイマー病[127]、精神疾患[128]、脳卒中[129]、TBI[130]、中毒[131]などの幅広い脳疾患に関与している。
3.8. 幹細胞
どのような種類のPBM光が生きた動物に照射された場合でも、一部の幹細胞が光に曝されることは避けられないことを忘れてはならない。幹細胞は増殖と分化の点でPBMによく反応することが知られている[132、133]。幹細胞は、組織の下にある骨髄に存在する場合もあれば、照射された領域にある骨に存在する場合もある。Oronら[134]は、足の骨髄にPBMを適用すると、アルツハイマー病のマウスモデルで治療効果があったことを示した。この方法は、心臓発作モデルでの梗塞面積の減少[135、136]や虚血性腎障害の改善[137]に大きな治療効果があった。最近では間葉系幹細胞や神経幹細胞を用いたアルツハイマー病の臨床試験が行われているが、まだ有効性は認められていない[138]。
3.9. ガンマリズム
2016年、MITに勤務するIaccarinoらによる重要な研究では、40Hzのパルス状の青色光がアミロイド-β(アミロイドβ)1-40およびアミロイドβ1-42ペプチドの負荷を軽減し、アルツハイマー病のマウスモデルの脳の視覚野におけるアミロイドプラークの負担を軽減できることが報告された[139]。この効果は、もともと高速スパイクパルバルブミン陽性(FS-PV)間ニューロンを刺激するためのオプトジェネティック技術を使用して発見された。仮説は、脳内のミクログリアがガンマ同調によって “巻き込み状態 “に変換されたということであった。同じグループによるその後の研究では、40Hzのパルス光は神経保護効果があり、神経変性のタウP301SおよびCK-p25マウスモデルにおいて認知能力を改善することが示された[140]。研究グループは、シナプス機能の改善、神経保護因子の増強、神経細胞のDNA損傷の減少、ミクログリアの炎症反応の減少を見出した。このグループは、40Hzの青色光と40Hzの聴覚刺激を組み合わせて、「感覚刺激を用いたガンマ同調」(GENUS)[141]を作り出す実験を行った。この組み合わせのアプローチは、マウスの脳のはるかに広い領域でアミロイドプラークの減少をもたらし、認知機能の改善をもたらした。
4.動物モデルにおけるアルツハイマー病のためのtPBM
アルツハイマー病の動物モデルにおけるPBMの利点の最も説得力のある報告の一つは、デタボアーダらによって2011年に行われた[142]。彼らは、アミロイドβタンパク質前駆体(アミロイドβPP)トランスジェニックマウスの頭に810nmのレーザー(3×週6ヶ月間)を提供した。その結果、PBMを投与することにより、脳内のアミロイドβプラーク数が用量依存的に有意に減少した。PBM投与により、アミロイド負荷、可溶性アミロイドβPPα、脳内炎症マーカーが用量依存的に減少した。ATPレベル、ミトコンドリア機能、c-fosはすべて増加した。モリス水迷路で測定したような認知機能は、PBMによって改善された。
Purushothumanら[143]は、アルツハイマー病の2つの別々のマウスモデル、脳内の関連する病理学的変化を表示するように設計されたそれぞれでPBMの有益な効果を報告した。これらはK369Iタウトランスジェニックモデル(神経原線維性タングルを発生させるように設計された)とAPPswe/PSEN1dE9トランスジェニックモデル(アミロイド斑を発生させるように設計された)であった。マウスは670nmのLEDを5×/週で90秒間、4週間投与した。タウマウスでは、tPBMは大脳皮質と海馬において、高リン酸化タウ、神経原線維のもつれ、酸化ストレスマーカー(4-ヒドロキシノネナールと8-ヒドロキシ-2′-デオキシグアノシン)をコントロールレベルまで減少させ、生き残った神経細胞ではミトコンドリアのチトクロムc酸化酵素の発現を回復させた。アミロイドβマウスでは、PBMは大脳新皮質と海馬のアミロイドβプラークの大きさと数を減少させた。同じグループからの追跡報告では、これらの観察結果をマウスの脳の小脳領域にまで拡大している[144]。
Farfaraら[134]。134]は、異なるトランスジェニックマウスモデル、ヒトAPPの家族性アルツハイマー病(Fアルツハイマー病)変異型(スウェーデン変異、K670N/M671L;フロリダ変異、I716V;およびロンドン変異、V717I)およびPS1(M146L/L286V)トランス遺伝子を、神経細胞特異的マウスThy-1プロモーターの転写制御下で共発現させた5XFアルツハイマー病トランスジェニック雄性マウス(Tg6799)を使用した[145]。さらに、これらの研究者は、頭部ではなく、マウスの足の骨髄を治療した。光ファイバーケーブルに接続された810nmのレーザーは、1 J/cm2を提供するために皮膚に小さな切開を行った後、脛骨に接触して使用された。マウスは、4ヶ月齢からPBMを6回(10日間隔、2ヶ月間)投与した。治療したマウスは、物体認識テストと恐怖条件付けテストによって測定されるように改善された認知性能を示した。脳スライスの免疫組織化学的分析では、PBM投与マウスはアミロイドプラークの負担が68%減少していた。
いくつかの研究者は、直接海馬に異なる種類のアミロイドβペプチドを注入することによって、アルツハイマー病の齧歯類モデルを開発するために異なるアプローチを取っている。Luら[146]は、ラットにアミロイドβ1-42を注射し、808nmの光を2分間/日、5日間頭部に照射した。分子生物学的研究により、PBMは以下のことを示した。(1)ミトコンドリアダイナミクスの改善、(2)ミトコンドリア膜電位の上昇、(3)酸化されたミトコンドリアDNAとマイトファジーの減少、(4)Bcl-2関連Xタンパク質/B細胞リンパ腫2比で示されるアポトーシスの抑制、(5)ミトコンドリア抗酸化発現の増加、(6)チトクロームc酸化酵素活性とATPレベルの上昇、(7)アミロイドβ誘発反応性グリア症、炎症、タウ高リン酸化の抑制、などが示された。
da Luz Eltchechemら[147]はまた、ラットを用いたが、海馬にアミロイドβ25-35ペプチドを注射し、627 nmのレーザーで100秒、7 J/cm2で21日間毎日処理した。tPBMを使用することでアミロイドβプラークが有意に減少し、21日目に治療した動物の空間記憶と行動・運動能力が改善された。Blivetら[148]は、雄のスイスマウスを使用し、また、海馬にアミロイドβ25-35ペプチドを注入した。tPBMは、850 nmのレーザーとLEDと625 nmのLEDをすべて10 Hzでパルス状に発光し、200 mTの静磁場を作成するリング状の磁石で囲まれたRGn500デバイスを使用した。このデバイスは、10分間で8.4 J/cm2を提供し、1日1回、頭頂部または腹部の中心部のいずれか、または両方に7日間適用した。神経毒性からの保護は、PBMを頭部と腹部に一緒に適用した場合に見られたが、どちらか一方だけに適用した場合には見られなかった。マウスは記憶力の改善(Y迷路と受動的回避試験による)を示し、アミロイドβ1-42、pTau、酸化ストレス(脂質過酸化アポトーシス(Bax/Bcl2神経炎症はすべて減少した。
5. アルツハイマー病と認知症を対象としたPBMの臨床試験
最初に報告されたアルツハイマー病に対するtPBMのヒト臨床試験の一つは、軽度から中等度の重度の認知症(Mini-Mental State Exam、 MMSE、 10-24のスコア)と診断された5人の患者を治療したSaltmarcheら[149]によって報告されている。この研究では、デフォルトモードネットワークの皮質結節(両側中隔前頭前皮質、帯状体前皮質/後帯状体皮質、角回、海馬)を治療するために経頭蓋+経鼻PBMを組み合わせたVielight alpha(810nm、10Hzパルス、LED)が使用された。12週間の積極的な治療が行われ、週1回のオフィスでの経頭蓋/経鼻投与と毎日の自宅での経鼻投与が行われ、さらに4週間の無治療のフォローアップが行われた。12週間の時点で、認知機能は有意に上昇し(MMSEおよびアルツハイマー病AS-cog睡眠は改善し、怒りの暴発は減少し、不安感は減少し、徘徊はPBM後に報告された。副作用はなかった。4週間の無治療フォローアップ期間中に急激な低下が観察された。
最近Chaoは、認知症と診断された8人の患者(4人のtPBMと4人の通常ケア)を対象に、在宅PBMの認知・行動機能、脳灌流、安静時機能連結性への効果を検証した第2のパイロット試験[150]を発表した。PBM治療は、Vielight Neuro Gamma装置を用いて週3回自宅で行った。参加者は、ベースライン時と6週目と12週目にアルツハイマー病評価尺度(アルツハイマー病AS-cog)サブスケールと神経精神医学的インベントリ(NPI)で評価し、ベースライン時と12週目に動脈スピン標識灌流磁気共鳴画像法(MRI)と安静時機能MRIで評価した。12週後、tPBM群では、アルツハイマー病AS-cog(p=0.007)とNPI(p=0.03)の改善、脳灌流の増加(p<0.03デフォルトモードネットワーク内の後帯状皮質と側頭頂神経節間の接続性の増加が認められた。
Bermanら[151]は、認知症と診断された被験者(アクティブ6名、コントロール3名、ドロップアウト2名を含むn=11)を対象に、ヘルメットに埋め込まれた1060-1080nmのLEDを用いたNIR PBMの28回連続6分間の経頭蓋セッションの効果を評価するための小規模なパイロット二重盲検プラセボ対照試験を実施した。その結果、実行機能、時計描画、即時想起、プレーキシー記憶、視覚的注意、タスク切り替え(Trails A&B)の改善のほか、脳波振幅と結合性測定の改善傾向が示された。
Salehpourら[152]は、認知機能の低下と嗅覚機能障害と診断された1例の治療法を報告している。この患者は、3つの異なるウェアラブルLEDデバイスを使用して、1日2回のPBM療法を自宅で受けた。最初の1週間は、プロトタイプの経頭蓋光ヘルメットとボディパッドがCW 635 nmと810 nmのLEDの混合物を含む使用された。ボディパッドは腰の様々な領域に配置され、ヘルメットは座ったまま着用された。治療の最初の一週間後、10Hzの810nmの鼻腔内LEDデバイスを1日2回、左鼻孔内で開始した。3つのデバイスはすべて同時に適用され、1回あたりの照射時間は25分であった。患者は、モントリオール認知評価スコアが18から24に、ワーキングメモリ質問票スコアが53から10に、それぞれ有意な改善を示した。嗅覚機能障害は、アルバータ嗅覚テストとピーナッツバター臭検出テストで測定されるように逆転した。生活の質の尺度は改善し、介護者のストレスは減少した。
ロシアのモスクワで働いているIvan Maksimovichは、632nmの光(25mWのHeNeレーザー)を脳に照射するための血管内カテーテルアプローチを使用して、多くのアルツハイマー病患者を治療してきた[153]。局所麻酔下で、総大腿動脈をカテーテルで留置し、細くて柔軟な光ファイバー(25~100μm)を前大脳動脈と中大脳動脈の遠位部に進め、20~40分かけてPBMを行った[154]。TDR-0(前臨床段階)-10人、TDR-1(早期)-26人、TDR-2(中期)-40人、TDR-3(後期)-17人のアルツハイマー病重症度ステージを持つ34~80歳の93人(男性32人、女性61人)の患者を対象とし、このうち48人の患者には経カテーテル治療を行った。これらの患者のうち、48例には経カテーテル的脳内PBMが投与され、対照群の45例にはメマンチンとリバスチグミンによる保存的治療が行われた。PBM治療を受けた患者では、脳微小循環の改善、認知症の軽減、認知機能の回復がみられた。対照群では有意な変化は認められなかった。メカニズムとしては、毛細血管の血液供給量の増加、組織代謝の改善、神経新生の刺激、アミロイドβのクリアランスが関与していることが提案された。
6. 脳のtPBMのためのデバイスとパラメータ
人間のアルツハイマー病のためのPBMTのために使用されてきたデバイスとパラメータの広い範囲が存在する。レーザーとLEDの両方が歴史的に頭部に使用されていたが、時間が経つにつれて、LEDアレイは、頭部にPBMを送達するための最も一般的な方法になってきている。800~900nmのNIR波長が最も一般的であるが、1064nmや1080nmも使用されている。一部の研究者は、660nmのような赤色の波長をNIRと組み合わせている。頭部のLEDの正確な配置も様々である。おでこは光を遮る髪の毛がないため、tPBMに人気がある。ヘルメットやフードの中には、頭部全体を覆うように光が届くように設計されているものもある。図3は、tPBMに使用されてきた装置の一例を示している。
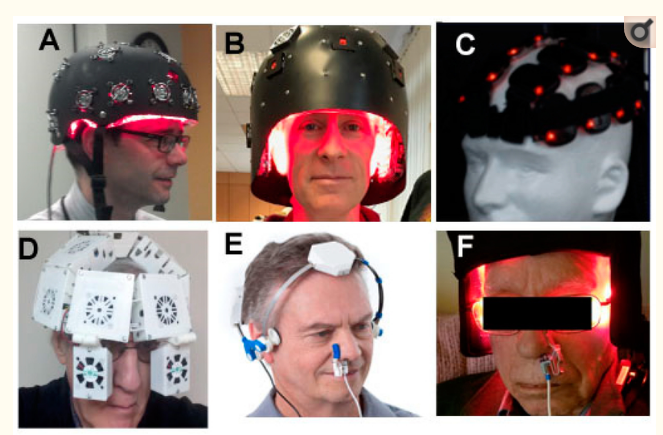
図3. アルツハイマー病や他の脳障害で臨床試験が行われたtPBMデバイスの選択
A)Photomedex Inc. フィラデルフィア、ペンシルバニア州、米国);(B)THOR Photomedicine(チェシャム、英国)からのヘルメット;(C)BioCare Systems(パーカー、CO、米国)からのLumiwave LEDクラスタ;(D)Cognitolite(ダブリン、アイルランド)からのヘルメット;(E)Vielight(トロント、オンタリオ州、カナダ)からのNeuroα LEDデバイス;(F)ProNeuroLIGHT LLC(フェニックス、アリゾナ州、米国)からのデバイス。
tPBMの線量測定は、J/cm2のエネルギー密度および全エネルギー(J)で測定される。エネルギー密度の値は10-60 J/cm2の範囲であるが、私の考えでは、最も有用な線量の測定値はジュール単位の総エネルギーであり、かなり大きなアレイを使用した場合には数千Jにもなる。例えば、頭部の500 cm2の領域が20 mW/cm2に10分間さらされた場合、6000 Jの総線量が配信される。全身光のベッドは、Jの数百、数千を提供するが、まだアルツハイマー病や脳疾患のためのPBMのこの方法についての研究はない。光のパルス化は、特にアルファリズムを刺激するために10 Hzで、またはガンマリズムを刺激するために40 Hzで、ますます注目されている。経鼻光送達は、しばしばそれ自体で、またはtPBMを高めるために使用されるが、ここでは、通常、単一の10mWのLEDが鼻孔にクリップされているので、用量ははるかに低くなっている。最後に、Maksimovichの血管内アプローチを覚えておく必要がある[153、154]。脛骨の骨髄中の自己幹細胞を刺激するためにPBMを適用することにより、マウスのアルツハイマー病モデルで良好な結果を得たOronからの予備報告[134]は、このアプローチは、ヒトで試してみる価値があるかもしれないことを示唆している。
まだのところ、アルツハイマー病のためのPBMを含む組み合わせ療法の研究はなかった。しかし、予備的な動物実験では、tPBMはコエンザイムQ10と組み合わせた場合にうまく機能することが示唆されている[155-157]。アルツハイマー病や他の神経変性疾患におけるコエンザイムQ10サプリメントの使用にはかなりの関心が寄せられている[158]。
7. 今後の展望
PBMTは脳に大きな範囲の有益な変化をもたらす可能性があり、大きな副作用がないという事実は、大規模な対照試験でアルツハイマー病や認知症のためにもっと広くテストされるべきであることを示唆している。直射日光よりも低いパワーレベルの光(ただし有害な紫外線を含まない)を頭部に照射することは、本質的に安全である。報告されている副作用は、軽度の頭痛、眠れない、頭皮の軽いかゆみなどの一過性のもので、まれに報告されている。PBM治療を中止した場合には退行が観察されているため、アルツハイマー病治療のtPBMは無期限に継続する必要があると思われる。さらに、尿路感染症や転倒などの無関係な健康問題は、tPBMで達成された利益の損失につながる可能性がある。家庭用tPBM装置は、一貫して自身の生活の質の改善を報告する介護者によって適用することができる。
