Contents
Pharma Regulations for Generic Drug Products in India and US: Case Studies and Future Prospectives
pdfs.semanticscholar.org/5ba0/5cd4e0d03226de8543c21a91a437634be137.pdf
Suryakanta Swain*、Ankita Dey、Chinam Niranjan Patra、Muddana Eswara Bhanoji Rao
インド、オディシャ州ベルハンプール、ローランド製薬科学研究所薬剤師学科
要旨
世界の発展途上国の中でも、インドは医薬品業界の多くの業種において、すでにニッチな地位を確立しており、現在ではジェネリック医薬品の「世界の薬局」として認知されている。インドのジェネリック医薬品市場は日々成長しており、インドの製薬会社は米国での略式新薬承認申請(ANDA)を求めている。ジェネリック医薬品は、特許権などの独占権が切れた時に処方される。後発医薬品の治療効果を確保するためには、先発医薬品との互換性や生物学的に同等であることが求められる。世界のジェネリック医薬品の成長に占めるインドの製薬業界の貢献度は非常に高く、約35%と言われている。インドのジェネリック医薬品メーカーは、先進国との競争を維持するために、市場戦略や必要な規制を迅速に計画する必要がある。本レビューでは、インドと米国におけるジェネリック医薬品製造のための有効な規制を紹介する。単に新しい規制を導入するだけではなく、州レベルでの医薬品セクターの実施と規制が急務となっている。今後は、健康への楽観的な影響に加えて、政府や顧客のコスト削減のためにも、医薬品の使用を重視していく必要がある。
キーワード
略式新薬承認、事例・事件、医薬品規制、最近の特許
序論
インドの製薬産業は、独立前には存在しなかったものから、現在の10年間で医薬品とヘルスケア製品の著名な提供者になるまでに長い道のりを歩んできた。現在のインドの製薬業界は、技術と医薬品製造の複雑な分野で広い範囲の能力を提供し、成長している医薬品製造会社のグローバルリーダーである。インドの製薬市場は、現在、市場価値[1]によると、ボリュームと14ランクの面で世界のすべてのインドの製薬業界の3番目のランクを提供し、急速なペースで成長している。現在成長しているインドの製薬セクターの主要な強みは、単純な鎮痛剤から複雑な抗生物質、同業者の品質と有効性と完全に先進国にそれらを輸出する心臓の化合物までの広い範囲を製造する能力である。業界の大部分の利益は、ジェネリック医薬品と原薬を主に米国、英国、ドイツ、ブラジルなどの先進国市場に輸出することに由来している。インド商務省は2013-14年までに250億ドルの輸出目標を掲げているが、これはジェネリック医薬品市場が大きく貢献しなければ達成できない[2]。インドのジェネリック医薬品市場は日々成長しており、インドの製薬会社は心血管、抗生物質などの主要な分野で米国での略式新薬承認申請(ANDA)を求めている。米国におけるジェネリック医薬品市場の発展の大きな原動力となったのは、1984年の医薬品価格競争及び特許回復法(Drug Price Competition and Patent Restoration Act of 1984)「ハッチ・ワックスマン法」として知られる公法98-417の制定であり、これによりジェネリック医薬品の開発及び販売の機会が創出された(180日間の略式新薬申請と呼ばれる方が良いであろう)。ANDAの下で製薬メーカーは、このように安全性と有効性と妊娠可能な価格で患者に同じ製品を提供し、以前に承認された革新的な薬の低価格のジェネリック版を開発し、販売することができる。ジェネリック医薬品またはバイオシミラー医薬品とは、剤形、強さ、投与経路、品質、性能特性、使用目的などにおいて、革新的な医薬品と同等のものを指す。イノベーターとジェネリックの両方で承認されたすべての製品は、FDAのオレンジブックに掲載されている。ジェネリック医薬品の申請は、一般的に前臨床試験(動物試験)と臨床試験(ヒト試験)のデータを添付して安全性と有効性を立証する必要がないため「abbreviated」(略式)と呼ばれているが、その代わりに、ジェネリック医薬品の申請者は、生物学的に同等であること(すなわち、イノベーター製品と同等の性能を有すること)を証明しなければならない。インドは世界のジェネリック医薬品市場において、先進国に低コストで医薬品を提供するという独自の地位を確立しているが、その背景には、厳格で柔軟な医薬品規制や特許法が随時更新されているため、インドのジェネリック医薬品市場は、主に米国への輸出で大きなシェアを占めており、インド経済の成長に大きな役割を果たしている。
インドと米国におけるジェネリック医薬品の医薬品規制
ジェネリック医薬品は、医療界ではよく知られており、競争のために通常はより手頃な価格で入手できるため、公衆衛生上重要な役割を果たしている。ジェネリック医薬品は、特許やその他の独占権が切れたときに処方される。ジェネリック医薬品の鍵は、先発医薬品との互換性にある。治療効果を確保するためには、先発医薬品との互換性(有効成分の含有量や剤形が同じであること)と生物学的に同等であることが求められる。生物学的同等性は、通常、先発品との比較生体内薬物動態試験を用いて確立される。この方法の詳細は、WHOの文書や各国の規制ガイドラインに記載されている。後発医薬品の規制当局は、ジェネリック医薬品が一定の規制基準を満たしていることを求めている[3,4]。ジェネリック医薬品の主な規制要件を表1に示する。米国での申請は、連邦法505(j)のいずれかのサブセクションに基づいて行われるが、インドのジェネリック医薬品メーカーにとって米国は主要な輸出先であるため、米国の規則や規制を遵守することが重要だ[5]。ジェネリック医薬品を開発する上で最も重要な審査プロセスは、FDAとCDERによる審査であり、同等性が承認された後、ジェネリック医薬品の後発品を販売するために、先発医薬品との生物学的同等性を比較するための審査が行われる(図1)。同等性の審査は、先発医薬品とのバイオアベイラビリティー、製品の微生物学的、化学的、表示などを考慮して行われており、これが現在のFDAによる後発品承認のための規制となっている。
インドと米国における今後のジェネリック医薬品
ジェネリック市場では上昇傾向にあると見られている。過去には1000億ドルに達しており、医薬品全体の成長率の3倍と推定されている。現在の傾向としては 2013年から 2015年の間に、大ヒット薬が特許権を失い、より安価なジェネリック医薬品への扉が開かれ、市場総額は数十億ドルに達する予定であることが示されている。米国市場におけるジェネリック医薬品の割合は14から 21に上昇すると予想されている。この成長はインドの輸出見通しを強化し、毎年2倍になるだろう。これは低コスト労働者の増加とイノベーションの度合いによるものである。最近のハイテク製造、試験、品質管理、研究、臨床試験、バイオテクノロジーの設計運営の実績もこの成長に貢献している。インドの製薬業界では、USFDA(米国食品医薬品局)との提携やANDA(略式新薬承認申請)の承認を受けている企業が恩恵を受けている。現在、インドのジェネリック市場における世界シェアは35%と定められており、これは非常に高い[6,7]。表3は 2015年に特許切れを迎える様々な医薬品のリストを示したものである。また、インド政府はこのような状況をより有利にするために、病院内の患者にジェネリック医薬品を提供する制度を導入しており、様々な支援センター(Jan-aushadhi Kendra)を設けている。このように、インドと米国におけるジェネリック医薬品の将来性は非常に高く、ヘルスケアのシナリオでは、ジェネリック医薬品は次の大きなものとなっている。先行研究と同様に 2011年から 2012年にかけてジェネリック医薬品に参入した医薬品のMEP(市場独占期間)は、ジェネリック参入前の年の売上高が1億ドル以上の新規分子事業体(NME)で12.6年、全ての新規分子事業体で12.9年となっている。さらなる調査により、分子タイプやその他の分類による定義の違いに関わらず、NMEのタイプによる違いが明らかになる可能性がある。過去10~15年の間にジェネリック医薬品の競争が激化しており、MEPは先発医薬品の経済性を示す重要な指標となっている。MEPは、メーカーが先発医薬品で利益を得て将来の研究開発活動のための資金を確保するために必要不可欠なものであり、先発医薬品のシェアは後発品参入後に急速に低下する。2012年に後発品参入した先発医薬品の80%以上が後発品メーカーからの第4項特許異議申立を1回以上受けており、1995年に後発品参入した医薬品では9%にとどまってたが 2012年には後発品メーカーからの第4項特許異議申立を1回以上受けている。これらの特許異議申立は、先発医薬品のライフサイクルの比較的早い時期に行われ、平均的には先発医薬品の上市から7年以内に行われている。ジェネリック医薬品業界にとっては、より多くの先発医薬品が特許切れになり、医療費の削減が求められる中での進展は心強いものとなっている。また、FDAの予算と人員の増加により、先発品とジェネリック医薬品の申請のバックログが削減され、今後数年でジェネリック医薬品が市場に出回るようになるため、FDAが国内外の施設を検査する能力が高まることが期待されている[8]。
グローバル市場におけるインドのジェネリック医薬品メーカーの今後の課題
インドのジェネリック医薬品会社は、幅広い技術力と多様な市場能力を持っている。特許の期限が切れることが多くなってきているため、医薬品市場におけるジェネリック部分の売上は今後も増加すると予想される。これらの企業のジェネリック医薬品を製造・供給するための科学的な能力は、他の企業よりも優位に立ち、国際的なジェネリック医薬品市場での主要なプレーヤーとなることであろう。幸いなことに、インドには外国人投資家を惹きつける最高の科目能力がある。基礎研究や創薬のシナリオもまた、このダイナミクスの変化を後押しするものとなるであろう。しかし、ジェネリック医薬品の将来の持続的な成長は、先進国の競争市場での持続性にかかっている。ジェネリック医薬品メーカーにとっての主な課題は、既存の規制制度を強化することであり、特にブランドジェネリックとジェネリックの間で医薬品や化学物質をより詳細かつ普遍的に分類できるようにすることである。また、高額な研究開発費や研究への投資も、この方向性を阻む大きな障害となっている[9]。
ジェネリック医薬品の医薬品規制の改正
1984年に制定されたハッチ・ワックスマン法は画期的な法律である。この法律は、ジェネリック医薬品が先発医薬品に必要な高額な臨床試験を繰り返さずに市場に参入できるようにするものである。この法律は、ジェネリック医薬品と先発医薬品業界のバランスをとるためのものである。この法律は、低価格のジェネリック医薬品へのアクセスを可能にする一方で、新薬の革新と開発を奨励している。それにもかかわらず、この法律は意図しない法的障壁を生み出し、重大な法律の抜け穴があるために後発医薬品の市場参入を遅らせている。ジェネリック医薬品会社は、特許や一定の独占権が切れた後に、その医薬品を販売することが認められている。このため、市場ではジェネリック医薬品が急増している。このように、抜け穴を埋め、規制を強化し、低コストの医薬品の販売を実現するためには、いくつかの変更が必要とされている。30ヶ月の滞在期間規定の濫用疑惑に関連した規則の変更は、後発品申請者が45日以内に後発品申請者に対して特許侵害訴訟を提起することができるように、先発特許権者に後発品申請に関する情報を通知することに注意を払う必要がある。この45日以内に侵害訴訟が提起された場合、FDAは自動的に後発品の承認を30ヶ月間延期することになる。このように、2年以上の追加販売期間を確保することができるため、革新的な企業にとっては非常に有利である。企業はこのルートを利用して利益を得て、ジェネリック医薬品の市場参入を遅らせている。また、特許を保有している多くの企業が30ヶ月間の使用期限の延長を行っているが、ジェネリック医薬品の市場参入をさらに遅らせることができるのが、FDAが承認した全ての製品の公式リストであるオレンジブックに複数の特許が掲載されていることである。また、後発医薬品メーカーがANDAを申請した後に、後発医薬品メーカーがオレンジブックに関連特許を掲載した例もある。このような「後発品登録」の影響で、後発品メーカーは、後発品登録された特許が無効であること、または侵害されていないことを再証明し、特許権者に再証明の通知をしなければならなくなる。このため、後発医薬品の上市までの時間が長くなってしまう[10](図2)。
インドと米国における後発品規制の最近の事例と事件
インドと米国における後発品規制の将来展望は、インド製薬産業の成長の方向性を左右する重要なものである。インドと米国で発生した後発品利用に関連した最近の事例や事件をもとに、新たな重要な役割を担っていくことになるだろう。以下に、インドと米国で発生したジェネリック医薬品に関連した最近の事例や事件のリストを詳しく紹介する(図3)。
カレン・L・バートレット事件
2004年12月、カレン・L・バートレットの医師は、カレン・L・バートレットの肩の痛みに対して、非ステロイド性抗炎症薬(NSAID)スルリンダックのブランド名版であるクリノリルを処方された。彼女の薬剤師は、請願人であるMutual Pharmaceutical社が製造したsulindacのジェネリック版を調剤した。Karen L. Bartlettはすぐに中毒性表皮壊死分解症の急性症例を発症した。彼女は重度の肢体不自由で、身体障害があり、ほぼ失明している。処方された当時、sulindacsのラベルは特に中毒性表皮壊死分解症について言及していなかった。しかし 2005 年までに FDA はすべての NSAID の表示を変更し、より明確な有毒性表皮壊死融解症の警告を記載することを推奨していた。被告はニューハンプシャー州裁判所にMutualinを提訴した。陪審員は、応答者の設計上の欠陥の主張について相互の責任を発見し、彼女に2100万ドル以上を授与した。第一巡回区は承認された。第一巡回区は、FDCAもFDAの規制も、被告の設計上の欠陥の主張を先取りするものではないと判断した。同裁判所は、後発医薬品メーカーに対する警告義務違反の請求は、FDCAの後発医薬品表示の変更禁止規定によって先取りされるとしたPLIVA, Inc. この訴訟は製薬会社や連邦規制当局などが注視しており、最高裁はバートレットさんの怪我について相互会社が責任を負うことができるかどうかを判断することになっている。この結果は、現在アメリカでは処方箋の80%を占めるジェネリック医薬品を服用している患者の法的救済手段をさらに明確にするものと思われる。もし裁判所がMutual社に同意し、ジェネリック医薬品の欠陥を理由にジェネリック医薬品会社を訴えてはならないとした場合、患者はジェネリック医薬品で怪我をした場合、ほとんど選択肢がなくなるだろうと裁判弁護士は警告しているが、ジェネリック医薬品メーカーや他の経済団体は、もし裁判所がバートレットさんに同意した場合、個々の陪審員の決定が食品医薬品局のような連邦政府機関の権限を覆し、製薬メーカーが貴重な医薬品を市場から排除する可能性があると指摘している。このように、この裁判は米国とインドのジェネリック医薬品市場の将来にとって重要な意味を持つことになるであろう[11,12]。
表1 ジェネリック医薬品は以下の条件を満たす必要がある
- イノベーター医薬品と同じ有効成分を含むこと
- 強度、投与形態、投与経路が同一であること
- 同じ使用法の表示を持っている
- 生物学的に同等であること(治療上の互換性の指標として)
- 同一性、強度、純度、品質のための同じバッチ要件を満たしている。
- イノベーター製品に要求されるGMPの厳格な基準に基づいて製造されている。
図1:ジェネリック医薬品開発のためのANDA審査プロセスの説明
図2:Hatch-Waxman法のメリットの概略図
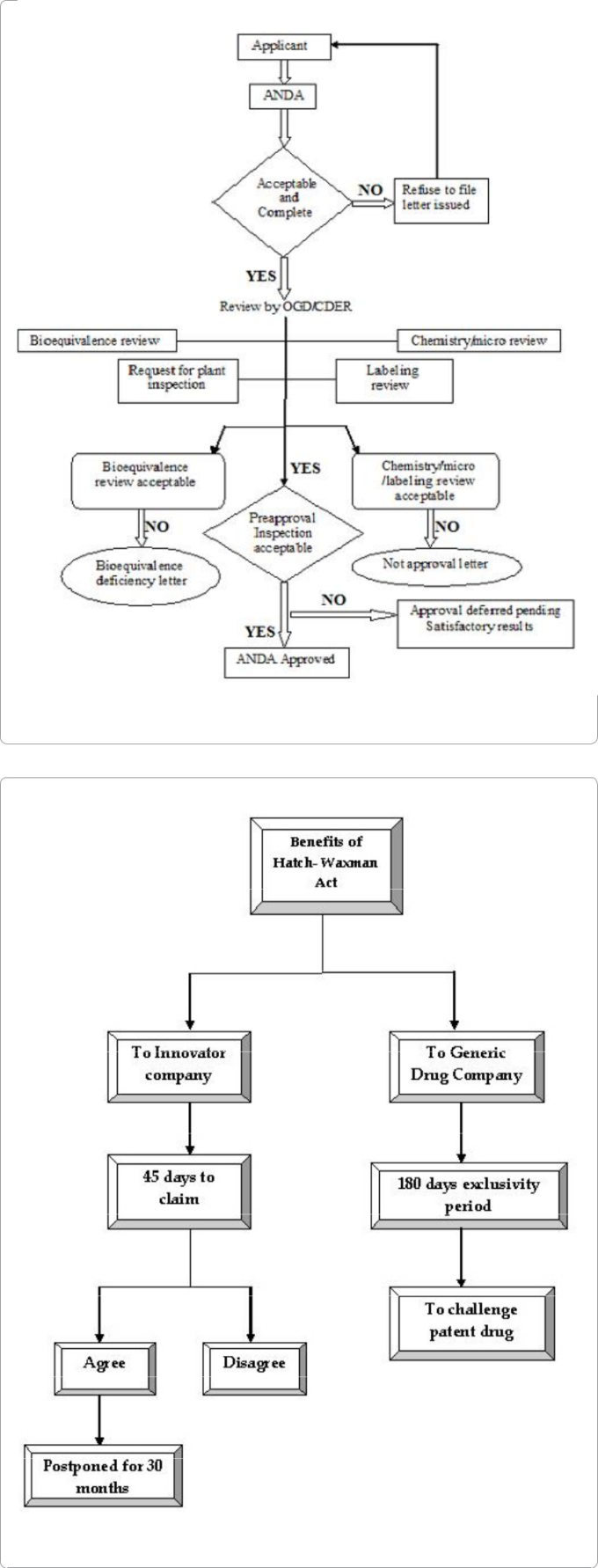
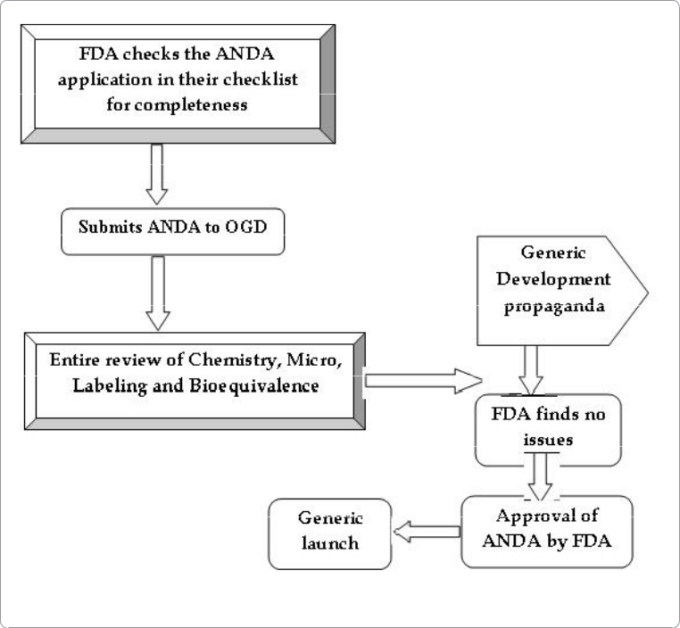
図3:ジェネリック医薬品の上市までの流れ
製薬会社のケースを遅延させるための支払い
先発医薬品のメーカーが別の医薬品メーカーにお金を払ってジェネリック版を市場に出さないようにすることができるかどうかという問題が 2013年3月25日に米国最高裁で審理された。裁判所は、ブランド薬のメーカーが市場からジェネリック版を維持するために別の会社に支払う “pay-to-delay “または逆和解の取り決めが合法であるかどうかを決定する、それはどのように多くの患者が薬のために支払うために決定されるので、事件の結果は非常に重要だ。連邦取引委員会は支払いに異議を唱える。それは共謀、市場での競争を停止するためのデザインとしてこれらの取り決めを見て、国家の独占禁止法違反のために意図されている。医薬品メーカーは、対照的に、それぞれの側がそれが欲しいものを得ることで、法的紛争を解決するための日常的な方法として和解 1984年のハッチ・ワックスマン法には、いくつかの抜け道がある。支払いは、この抜け穴を利用して可能になっている。ジェネリックメーカーが期限切れになる前にブランドメーカーが保有する特許に挑戦することを奨励するために、過去10年間で一定の改正が行われている。一般的には、後発医薬品メーカーが、特許保護下にある先発医薬品の後発品をFDAに販売承認を申請し、先発医薬品メーカーが後発医薬品メーカーを特許侵害で訴える。このようなケースでは、後発医薬品メーカーが先発医薬品メーカーからの支払いと引き換えに、後発医薬品の導入を延期することに同意する「ペイ・ツー・デイ」契約で終わるケースが増えている。このようなケースでは 2020年に特許が切れる予定のソルベイ製薬が製造しているアンドロゲン(テストステロンゲル)が挙げられる。アクタビス(旧ワトソン製薬)とソルベイ製薬の間で争点となっていたのは、アンドロゲン(テストステロンゲル)である。Actavisは2003年にAndro Gelのジェネリック版を販売するためにFDAの承認を申請し、Solvayは訴訟を起こした。2006,FDAはアクタビスのジェネリック版の販売を承認したが、訴訟は現状維持となった。その後2006年には、ソルベイ社がアクタビス社に年間2,000万ドルから3,000万ドルを支払うことで和解が成立し、マーケティング支援と2015年までアンドロゲルのジェネリック版の販売を停止することで合意した。FTC(連邦取引委員会)は、和解がなければ2006年にはジェネリック版が発売されていたため、製薬会社が結託してアンドロゲルの独占状態を維持していたと主張している。この事件では連邦地裁がFTCの主張を棄却したが、同様の事件では別の地裁が反対の判断を下したため、現在は最高裁の判断に委ねられており、判決が出ることが予想される。また、多くの経験豊富な連邦判事は、最高裁は法律を一般化すべきではなく、ケースバイケースで実施すべきであるとしており、この事件は製薬規制当局がインドや米国における今後のジェネリック医薬品規制のガイドラインを作成する上で非常に重要であり、患者がより安価な医薬品と高価な医薬品のどちらを選択するかを決める上で重要となるだろうとしている[13,14]。
ランバクシー事件
ランバクシーが行った米国FDAとの犯罪行為は、多くの人々を失望させたが、今回の事件はインドのジェネリック医薬品メーカーが直面するであろう、米国におけるインドのジェネリック医薬品市場とその規制の行方を左右する非常に重要な事件である。インドのランバクシー社は、米国で低品質のジェネリック医薬品を製造し、米国でのNDAやANDAの承認申請に必要なデータを操作して、様々な方法で相手を騙してジェネリック医薬品の製造競争の先頭に立っていた罪に問われている。ランバクシーは、詐欺の意図を持って粗悪品を販売したこと、自社の医薬品が仕様を満たしていないことを報告しなかったこと、政府に意図的に虚偽の陳述をしたことなど、7つの連邦刑事訴因で有罪を認めた。ランバクシーは、ジェネリック医薬品会社に対して課せられた罰金、没収、違約金としては過去最高の5億ドルを支払うことに合意した。ランバクシーは現在、日本の医薬品メーカーである第一三共が過半数を所有しており、世界150カ国以上で製品を販売し、14,600人の従業員を擁している。また、ランバクシーの科学者でさえも、生物学的同等性試験を操作するために、ジェネリック医薬品をブランド薬と混同していたことが明らかになった。
このように、インドのトップ製薬会社に対するこれらの重大な疑惑は、ジェネリックメーカーやインドの製薬規制当局にとって大きな後退となる可能性があり、今後、米国FDAがインドのジェネリックメーカーに対して厳しい規制を行う可能性があり、インドのジェネリック医薬品市場に影響を与えることになり、深刻な問題となる。このことが、今後のインドと米国のジェネリック医薬品規制の行方を左右する大きな要因となるであろう[15,16]。
その他の事例・事件
この研究では、スイスの製薬メーカーであるノバルティス社の抗弁が最高裁で覆された事例を取り上げている。これは、販売を促進するためにますますインドに焦点を当てている欧米の製薬会社に深刻な打撃を与え、それはまた、インドと米国のジェネリック市場に影響を与えるものであった。グリベック(イマチニブメシル酸塩の ß 多型)は、特定の血液がんや胃がんの治療に適応がある。最高裁判決は、Cipla、Ranbaxy、Natcoなどのインド企業が、ノバルティス社の製品の数分の一のコストでジェネリック版を販売し続ける可能性を示唆している。ノバルティス社のグリベックが月に100万円以上するのに対し、現地企業は月に1万円程度で販売している。最高裁の判決では、インドの法律では「発明性と特許性の両方のテスト」で失敗したとされている。一方、グリベックは数十年ぶりに最も重要な医学的発見の一つとして広く認知されているが、革新的な品質を理由に戦いに敗れた。この判決は、一方では研究とイノベーション、他方では公衆衛生と手頃な価格での戦いと解釈することができる。確かに、国内で救命救急薬の安価なジェネリック医薬品が生産される見通しが立ったことで、ジェネリック医薬品の販売が増加し、ジェネリック市場が活性化することは間違いないだろう。このように、本事例はインドにおけるジェネリック医薬品の将来が明るいことを示唆しており、本事例はそのためのベンチマークとなるだろう。インドの特許制度は、ノバルティス社の「Glivec」の件でよく知られているが、インドの規制当局は特許付与のための新しい規則を改革し、将来的にはより良いビジネスのために大規模な多国籍企業がインドに誘致されるようにすべきである[18-20]。
最近の特許
ブランド薬の特許切れに伴い、ジェネリック医薬品が申請されているが 2013年に承認された新薬のうち、いくつかを表4に簡単に示す[17]。
結論
医薬品の需要が供給を上回り、費用対効果の高い医薬品が必要最小限の支出で需要がある状況では、ジェネリック医薬品はこの需要を満たすための最良の選択肢となる。インドと米国のジェネリック医薬品の現在と将来の展望は、インド政府が国民により良い医療を提供するためのジェネリック医薬品に向けて探しているように非常に明るい。インドの製薬産業は世界中で急速に成長しており、米国は世界最大のジェネリック医薬品輸出国の一つである。そのため、インドと米国でジェネリック医薬品を製造するためには、適切な規制が必要であり、インドと米国の適切な共生関係が必要とされている。米国では、バラク・オバマ大統領の再選によりジェネリック医薬品市場が拡大していることから、ジェネリック医薬品の需要が増加しており、米国政府は3000万人以上のアメリカ人を対象に医療保険を拡大している。
