Contents
Perspective: The Potential Effects of ナリンゲニンingenin in COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7546806/
要旨
重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)によるコロナウイルス感染症2019(COVID-19)は 2020年3月に世界保健機関(WHO)によりパンデミック宣言された。重症COVID-19症例は重症急性呼吸器症候群を発症し、多臓器不全、敗血症、死に至る可能性がある。高リスク群には、高齢者や肥満、高血圧、糖尿病などの慢性疾患の既往がある人が含まれる。現在までのところ、COVID-19に対する特定の治療法やワクチンはない。多くの化合物の中で、柑橘類に含まれるフラボノイドであるナリンゲニン(NAR)は、ウイルスの複製やサイトカイン産生を抑制するなど、抗ウイルス作用や抗炎症作用が研究されていた。このような観点から、ナリンゲニンがCOVID-19関連の危険因子やSARS-CoV-2感染症において抗炎症作用を発揮する可能性があることを明らかにした。
キーワード:抗ウイルス性、抗炎症性、ナリンゲニン、SARS-CoV-2,COVID-19,TNF、ACE2
序論
コロナウイルス病2019(COVID-19)と名付けられた呼吸器疾患は、重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)の呼吸器感染によって発生する(1,2)。急速なウイルス感染のため、この病気は最初に診断された症例の数ヶ月後に世界保健機関によってパンデミックと宣言された(3, 4)。
以前の重症急性呼吸器症候群コロナウイルス1型(SARS-CoV-1)と同様の臨床症状を示すことに加えて、SARS-CoV-2感染は死亡率が非常に低い(5)。患者の約5%は重症のCOVID-19に進行し、主に重症急性呼吸器症候群を発症し、3%は補助呼吸器機械換気を必要とする。コロナウイルス症2019は敗血症性ショックや多臓器不全に進行する可能性があり(6)、約2%の死亡率を示する(7)。
SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)受容体および膜貫通型セリンプロテアーゼ2(TMPRSS2)を介した侵入によってヒト細胞に感染することができる(8)。このプロセスは野生的に受け入れられているが、抗体依存性増強(ADE)(7)やCD147(9)を介した感染経路など、他の可能性のある感染経路が探索されている。
アンジオテンシン変換酵素2の発現は、肺胞、気管支、気管支の上皮細胞、一部の気管支腺、肺胞マクロファージなどの呼吸器系で高発現していることから、高次気道感染症の主な説明の一つである(10)。しかし、ACE2はまた、胆道、腎臓、脂肪組織、心臓、脳、血管、胃、肝臓、口腔粘膜および鼻粘膜でも発現しており(11)、これはCOVID-19の全身性炎症プロファイルを裏付ける可能性がある。
ウイルスが侵入すると、ウイルスは宿主を誘導して炎症性サイトカインの産生と放出を増加させ、これが免疫活性化と組織損傷の増大につながる可能性がある(12)。仮定の話であるが、炎症の減少はCOVID-19患者を助ける可能性がある(13)。
いくつかの化合物は抗ウイルス性および抗炎症性と関連しており、ビタミンD(14)、ビタミンE(15)、ビタミンB12(16)、オメガ3(17)、フラボノイド(18)など、COVID-19の開発に影響を与える可能性がある。ナリンゲニン(NAR)は、グレープフルーツ(43.5 mg/100 mL)やオレンジ(2.13 mg/100 mL)などの柑橘類に存在する重要な天然フラボノイドであり(19)高い鎮痛作用、抗酸化作用、抗炎症作用、抗腫瘍作用、抗ウイルス作用を有する(20-23)(図1)。オレンジジュース8 mL/kgを摂取すると、摂取4時間後にナリンゲニンの血漿中濃度が0から300 μg/Lまで上昇することが明らかになった(24)。
図1 ナリンゲニンの免疫調節特性
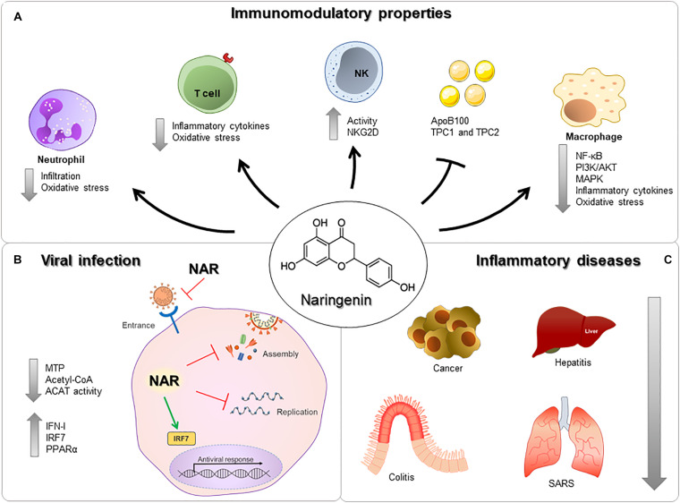
(A) ナリンゲニンは好中球、T細胞、NK細胞、マクロファージに作用し、タンパク質や受容体の発現を低下させる。
B)ナリンゲニンは、表面分子の調節、抗ウイルス成分の産生、炎症性分子、および/またはウイルス成分との直接的な相互作用を介して、ウイルスの侵入、集合、および複製を減少させる。
C)ナリンゲニンは、癌、肝炎、大腸炎、重症急性呼吸器症候群などの様々な器官において、多くの異なる疾患の発症および重症度に影響を与えることができる。
ナリンゲニンの抗ウイルス効果は、デング熱(25,26)C型肝炎(27)ジカ(28)チクングニア熱(29)セムリキ森林(30)単純ヘルペス1および2(31)黄熱病(32)ヒト免疫不全ウイルス(33)などのいくつかのウイルスで研究されている。いくつかの試験管内試験研究では、感染前と感染後のナリンゲニンの抗ウイルス効果が強調されている(28)。他の天然化合物と同様に、ナリンゲニンは試験管内試験で広範囲に研究されているが、ウイルス感染の生体内試験モデルでの結果は非常に限られている(34,35)(図1B)。それにもかかわらず、ナリンゲニンの試験管内試験および生体内試験での抗炎症能は、呼吸器症候群を含むいくつかの動物モデルで強調されている(35,36)。この観点から、我々は、ナリンゲニンがCOVID-19において重要な抗炎症的役割を示す可能性があるメカニズムを強調する。
ナリンゲニンの抗炎症特性
炎症は、常駐細胞や血液からリクルートされた白血球におけるプロおよび抗炎症性メディエーターの調節によって特徴づけられる(37)。広範囲のメカニズムのために炎症状態の下でのナリンゲニンの役割の強い証拠の断片がある。ナリンゲニンの免疫調節特性は、活性化B細胞の核因子κ-光鎖-エンハンサー(NF-κB)(38)PI3K/AKT(23)およびマイトジェン活性化プロテインキナーゼ(MAPK)(39)のような主要なシグナル伝達経路の調節と関連している(図1A)。
マクロファージは、病原体を感知して反応し、炎症性サイトカインおよびケモカインを産生することができるCOVID-19病理学において重要な細胞である(40)。マウスマクロファージでは、ナリンゲニンはLPSによって誘導される炎症性メディエーター産生を減少させることができ、マウスのエンドトキシン血症モデルでは、死亡率を60%から0%に減少させる(41)。グラム陰性菌(クラミジア・トラコマティス)に感染したマウスマクロファージでは、ナリンゲニンは用量依存的にIL-1β、IL1α、IL-6,TNF、IL-12p70,IL-10の産生を減少させた(42)。さらに、ナリンゲニンの抗炎症作用は、マクロファージとex vivoのヒト全血モデルで、IL-1β、IL-6,IL-8,TNFをLPS刺激時に非刺激に近いレベルまで減少させ、生体内試験で実証されている(41)(43)(図2)。
図2 COVID-19肺の病態生理におけるナリンゲニンの役割の概要
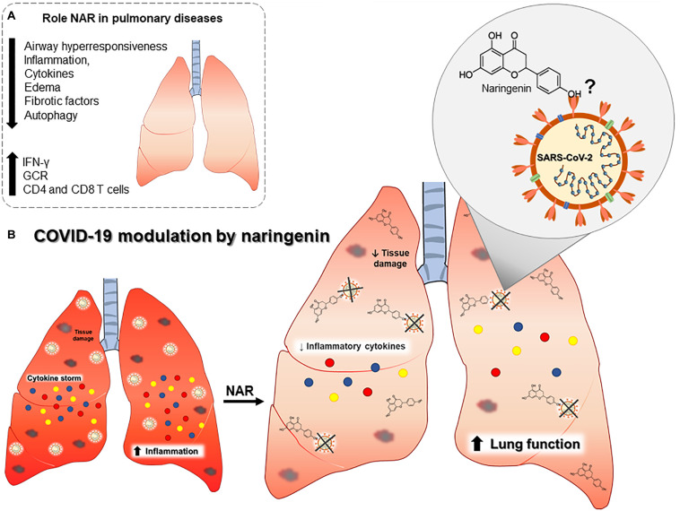
A)様々な肺疾患に対するナリンゲニンの効果が確立されている。B)ナリンゲニンは炎症性サイトカインや組織障害を減少させ、SARS-CoV-2に直接結合する可能性がある。略語。インターフェロンγ(IFN-γ)グルココルチコイド受容体発現(GCR)クラスター分化(CD)。
Barnesらは、重症COVID-19患者によって発現するサイトカインストームが好中球活性化の増悪に関連していることを報告している(44)。COVID-19患者における好中球および好中球対リンパ球比が疾患の重症度と関連していることから、COVID-19における好中球の中心的な役割は明らかである(45,46)。
肺生検はまた、好中球の浸潤(47)およびCOVID-19患者における好中球の細胞外トラップの形成を同定している(48)(図1A)。ネコ、フェレット、マウス、ハムスター、およびマカクのようないくつかの動物は、SARS-CoV-2に感染することができるが、COVID-19における動物モデルの使用は、現在のところ限られている(49)。
急性呼吸窮迫症候群(ARDS)の動物モデルでは、肺のIL-6,TNF、好中球の増加を伴う症候群であり、ナリンゲニンの補充は、好中球の浸潤と酸化ストレスを減少させ、気道炎症と肺損傷を大幅に減少させることができる(50)。酸化ストレスのナリンゲニンの減少は、部分的にアニオンのスーパーオキシド産生の抑制によって媒介される(51,52)(図2)。
ナリンゲニンは、転写機構と転写後機構の両方を介して炎症性分子の産生を抑制することができる(18)。マウスのLPS誘発炎症モデルでは、ナリンゲニンはtoll-like receptor (TLR)カスケードに干渉することなく、リソソーム依存性のメカニズムを介して細胞内サイトカイン分解を増加させることによって、マクロファージおよびTリンパ球によるTNFおよびIL-6産生を抑制した(23)。これらのデータは、気道炎症性侮辱に関連する炎症および酸化ストレスの制御における潜在的な役割を示している(図2A)。これらの抗炎症作用および抗酸化作用は、糖尿病(53,54)脂質異常症、高インスリン血症、および過体重(55)のような慢性的な併存疾患においても記述されており、これらはすべて重度のCOVID-19に関連する危険因子である(4,56,57)(図1C)(図1C)。
動物実験モデルにおいて、ナリンゲニンは、大腸炎(58)肝炎(59)肥満(60)癌(61)急性呼吸器症候群(36)のような異なる炎症症候群を、異なる部位で、変調することができた。これは、SARS-CoV-2感染が全身の炎症を誘発し、肺、心臓、肝臓、脳、腎臓、腸を含む多くの異なる臓器に感染する可能性があるため、COVID-19では特に重要である(62)。
さらに、ナリンゲニンは、重度のCOVID-19の間の全身性およびサイトカインストームを考慮すると、COVID-19において重要であるかもしれないリソソーム依存性のサイトカインタンパク質分解を促進することができる(63,64)。実際、ナリンゲニン誘導免疫調節は、気道炎症性疾患において実証されている。マウス喘息モデルでは、ナリンゲニンの治療は気道多動と気道炎症を減少させ、気管支肺胞液中のIL-4とIL-13のレベルと血清IgEレベルの低下と同様に肺機能アッセイの改善を示した(66-68)。全体的に、ナリンゲニンによる治療は肺好酸球症を非喘息群と同程度のレベルまで減少させた(66-68)。
肺炎マイコプラズマ感染によって誘発された肺線維症では、ナリンゲニンはオートファジーを介した気道炎症と肺線維症を減少させ(69,70)慢性閉塞性肺疾患(COPD)モデルでは、ナリンゲニンは肺の炎症を緩和し、TGF-βの発現を減少させ、グルココルチコイド受容体(GCR)の発現を増加させることができた(71)。ナリンゲニンの抗炎症作用は、放射線誘発肺損傷においても確認され、肺の炎症とIL-1βレベルを低下させた(72)。
したがって、ナリンゲニンの抗炎症効果は、2型または1/17型の免疫応答に直接媒介されるのではなく、免疫応答の調節である。研究では、アリール炭化水素受容体を媒介する経路を介したナリンゲニン摂取後のT調節細胞およびトランスフォーミング成長因子-βの増加が強調されている(73)。
それにもかかわらず、炎症反応の過剰な調節は、これまでナリンゲニン摂取では観察されていなかった抗ウイルス免疫応答を損なう可能性がある。ナリンゲニンはまた、インターフェロン刺激応答エレメントを活性化し、IRF7の発現増加を介してIFN-I産生を増強し(74)、NKG2Dリガンド発現の増強を介してNK細胞活性を増加させることができる(75)。抗ウイルス免疫応答におけるNK細胞とIFN-Iの重要な役割を考えると、ナリンゲニンはまた、ウイルス負荷の制御に寄与する可能性がある。全体的に、これらの先行研究は、生体内試験および試験管内試験で、ナリンゲニンが気道および全身の炎症を減少させるアジュバントとしての強力な候補であることを示した。
ナリンゲニンとコロナウイルス
最近のパンデミックの原因となっているのは、2種類のコロナウイルスである。2002,SARS-CoV-1のパンデミックは8,098人の症例を引き起こし、11カ国で774人が死亡した(76-78)。2012年には、中東で別のコロナウイルスも重症急性呼吸器症候群を引き起こし、MERS-CoVと名付けられた(79)。2020年までに、MERS-CoVは2,494例の症例を引き起こし、858人が死亡している(77)。
SARS-CoV-1とMERS-CoVの臨床症状は類似している。患者は、発熱、咳、体の痛み、頭痛などの臨床症状を報告し、より一般的には下痢や吐き気などの症状を報告する(80)。しかし、集中治療と機械的換気の必要性は、MERS-CoVではSARS-CoV-1よりも高い(81,82)。
MERS-CoVやSARS-CoV-1と同様に、SARS-CoV-2の感染は、くしゃみや咳の際に感染者から排出される呼吸器飛沫によって主に感染する(83,84)。重症急性呼吸器症候群 コロナウイルス-2表面の糖タンパク質スパイク(Sタンパク質)は、宿主の細胞表面のACE2に結合する。この侵入プロセスは、SARS-CoV-1が用いたものと同じである(85)。これに対し、MERS-CoVは、細胞への侵入に多機能表面タンパク質であるジペプチジルペプチダーゼ4(DPP4)を用いる(85)。ジペプチジルペプチダーゼ4は、主に腎臓、腸、肝臓、前立腺、活性化白血球に発現している。ジペプチジルペプチダーゼ4は、下気道、上気道粘膜下層に位置する腺、肺マクロファージ、肺胞上皮細胞で発現している(86)。
これらのコロナウイルス(MERS-CoV、SARS-CoV-1,およびSARS-CoV-2)が宿主の細胞に侵入した後、タンパク質分解処理によってポリペプチドがポリタンパク質から放出される。このタンパク質分解処理は、パパイン様プロテアーゼ(PLpro)と3-キモトリプシン様プロテアーゼ(3CLpro)によって媒介される。3CLproは、ウイルスの複製に不可欠な様々な非構造タンパク質を生成するためにポリプロテインを切断する(87,88)。コロナウイルスのウイルスサイクルにおける3CLの主な役割のために、3CLの阻害剤はCOVID-19で使用される可能性がある。
フラボノイドによる3CLプロテアーゼの阻害はMERS-CoV(89)やSARS(90)で報告されているが、ナリンゲニンはフラボノイドの中には含まれていなかった。しかし、ナリンゲニンはSARS-CoV-2の3CLproを阻害する可能性があることがin silico解析で明らかになった(91)。最近の研究では、SARS-CoV-1とSARS-CoV-2は3CLの遺伝的類似性が99.02%であり、12個のパンクチュアル変異を持つのみであることが確認されている(88)。
別の可能性のあるメカニズムは、2つの孔を持つイオンチャネル(TPC1とTPC2)の阻害である(92)。TPC1およびTPC2の阻害は、MERS-CoV感染性、細胞内トラフィック(93)およびウイルス複製を減少させる(93,94)。SARS-CoV-2ウイルスのゲノム配列はMERS-CoVやSARS-CoV-1と類似していることから(95)COVID-19ではTPC1およびTPC2チャネルの阻害メカニズムが類似している可能性があり、ウイルス複製の減少に寄与している可能性がある(96)。
また、ナリンゲニンは細胞質膜との親和性が高い親水性物質であり、細胞内にナリンゲニンを蓄積させている(98)。したがって、この親和性が細胞内シグナル伝達を促進し、TPC1とTPC2の調節を行っていると考えられる(27)。したがって、ナリンゲニンによるTPC1とTPC2の調節は、抗コロナウイルス介入の可能性があるとして、さらに研究が進められるべきである。
議論
抗SARS-CoV-2の可能性を有する天然化合物のいくつかの報告が現在研究されている。ACE2受容体と競合したり、ACE2発現を低下させる物質は、COVID-19の代替療法または補助療法を提示する可能性がある(99)。実際、ナリンゲニンの摂取はラットの腎臓におけるACE2発現の低下と関連しており(100)ACE2受容体に直接結合する可能性がある(101)。
しかし、SARS-CoV-2侵入受容体ACE2の調節を目的とした栄養介入は、ACE2のダウンレギュレーションもまた、より大きな炎症や肺障害につながる可能性があるため、慎重に評価する必要がある(102,103)。以前の報告では、ナリンゲニンの経口摂取がマウスモデルの急性肺損傷を減少させ(50)プロ炎症性サイトカインの産生を減少させることが実証されている(18)。これは、COVID-19肺損傷の一部がARDSに分類され得るので、非常に関連している(104)。
コロナウイルス疾患2019はまた、サイトカインストームを引き起こし、敗血症性ショックに進行し、死を引き起こす可能性がある(105,106)。したがって、サイトカインストームを調節することは、COVID-19を治療するための重要なプロセスである。ナリンゲニンは、COVID-19で増加し、重症例ではさらに増加するサイトカインであるIL-6およびTNF(23)の産生を調節するために実験モデルで使用されている(107,108)。また、敗血症性ショックの動物モデルでは、ナリンゲニンの摂取は抗酸化酵素の増加を介して腎臓の損傷を軽減することが実証されている(109)。
研究では、感染前(21)と感染後(30)に、ヒト細胞内のウイルス複製を減少させることでナリンゲニンの直接的な役割を検証した。SARS-CoV2では、in silico解析により、ナリンゲニンがSARS-CoV-2の3CLproを阻害し、その結果、ウイルスの複製を阻害する可能性があることが示されている(91)が、まだ実験的に検証する必要がある。
柑橘類(110)またはサプリメント(111)を介したナリンゲニンの摂取は、ナリンゲニンの循環レベルを急速に増加させ、ナリンゲニンの細胞内レベルを増加させることができる(98,111)。血漿サンプル中のナリンゲニンの濃度の増加は、経口摂取20分後に観察され、4時間後にピークを迎えることができる(112)。さらに、試験管内試験モデルでは、生体内試験での抗ウイルス活性の証拠はほとんどないが、ナリンゲニンの補充を中止した後でも、長期的な抗ウイルス効果が実証されている(21)。
ナリンゲニン を豊富に含むオレンジジュースを 500 mL/日、8 週間摂取した過去の臨床試験では、抗ウイルス療法のアジュバント効果が示されている(34)。また、グレープフルーツジュース340mL/日(ナリンゲニンを約210mg含む)の摂取は、閉経後の女性の心臓関連の測定値を改善した(113)。ナリンゲニンは天然に存在する最も重要なフラボノイドの一つであるが、ヒトでのこの生理活性化合物の使用を制限する可能性がある薬物動態学的側面、代謝運命、化学的安定性に関する臨床試験やデータが不足している(35)。
ナリンゲニンの注意点は経口摂取である。患者に広く受け入れられているが、重度のCOVID-19患者では障害となりうる。したがって、ナリンゲニン は、予防的介入として、または SARS-CoV-2 感染症の発症時に適用する方が良いかもしれない。また、ACE2受容体に対するナリンゲニンの影響についても調査が必要であり、ACE2の減少はより大きな炎症を引き起こす可能性がある(102, 103)。ナリンゲニンはほとんどが小腸で吸収され(114)微生物相の違いも重要な個人間の変数になるかもしれない(24,112)。
もう一つの注意点は、ナリンゲニンの水への溶解性とバイオアベイラビリティの低さである。現在、リポソーム、ナノ粒子、および他の製剤の使用は、溶液としてそれ自体を提示することがある(115-118)。
さらに、ナリンゲニンとチトクロームP450(CYP)系との相互作用を評価する必要がある。ナリンゲニンは、薬物代謝酵素やCOVID-19患者で常用されているか、または特異的に使用されているかもしれない重要な薬剤の薬物動態に影響を与える可能性があるためです(119-121)。
結論として、抗炎症性栄養介入としてのナリンゲニンの可能性は、SARS-CoV-1やMERS-CoVのような多くの異なる疾患で実証されている。ウイルス感染中のヒトにおけるナリンゲニン摂取の役割、特にSARS-CoV-2感染とCOVID-19における役割を理解するためには、さらなる調査と臨床試験が必要である。
