Contents
Persistence of SARS CoV-2 S1 Protein in CD16+ Monocytes in Post-Acute Sequelae of COVID-19 (PASC) up to 15 Months Post-Infection
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8784688/
オンラインで2022年1月10日に公開
Bruce K. Patterson,corresponding author 1 , * Edgar B. Francisco, 1 Ram Yogendra, 2 Emily Long, 1 Amruta Pise, 1 Hallison Rodrigues, 1 Eric Hall, 3 Monica Herrera, 3 Purvi Parikh, 4 Jose Guevara-Coto, 5 , 6 Timothy J. Triche, 7 Paul Scott, 7 Saboor Hekmati, 7 Dennis Maglinte, 7 Xaiolan Chang, 8 Rodrigo A. Mora-Rodríguez, 5 and Javier Mora 5
研究成果
近年のCOVID-19パンデミックは、急性感染の段階では治療が困難であるが、PASC(Post-acute sequelae SARS-CoV-2 infection/SARS-CoV-2感染による急性期後遺症)と呼ばれるCOVID-19の慢性症状が認められることで、全感染者の30%までが罹患する可能性があると言われている。しかし、初感染から3カ月以上経過すると、このような免疫学的に異なる症状が現れるが、そのメカニズムや原因は不明である。今回、我々は46人のSARS-CoV-2のS1タンパク質の存在を調べた。重症のCOVID-19患者とCOVID-19の急性後遺症(PASC)患者を対象に、T細胞、B細胞、単球サブセットを分析した。PASC患者では、中間型単球(CD14+、CD16+)と非中間型単球(CD14Lo、CD16+)の両方のレベルが、健康な対照者と比較して急性感染後15カ月まで有意に上昇していた(それぞれP=0.002、P=0.01)。重症患者(P=0.004)とPASC患者(P=0.02)の両方において、感染後15カ月までに統計的に有意な数の非古典的単球がSARS-CoV-2 S1タンパク質を含んでいた。PASC患者の非古典的単球をフローサイトメトリーで選別し、SARS-CoV-2 S1タンパク質が含まれていることを質量分析で確認した。重症のCOVID-19患者11人中4人、PASC患者26人中1人の細胞にはddPCR+末梢血単核細胞が含まれていたが、PASC患者では断片的なSARS-CoV-2 RNAしか検出されなかった。また、どの患者においても、完全長の配列は確認されず、観察されたS1タンパク質を説明できる配列も確認されなかった。非古典的単球がPASCの炎症の原因となっている可能性があり、今後の研究が必要である。
キーワード COVID-19、PASC、SARS CoV-2 S1タンパク質、非古典的単球、CCR5、フラクタルカイン
研究概要
SARS-CoV-2感染後の急性後遺症(PASC)は、SARS-CoV-2に感染した人の10%から30%に発症し、最近では感染者の30%に神経症状を引き起こすと提唱されている(1)、身体に障害を与え、時には衰弱させる疾患である。症状の数や程度は極めて不均一で、200種類以上の症状があるとする報告もある(2)。PASC症状の根本的な原因は謎に包まれているが、いくつかのデータは、潜在的なメカニズムとしてSARS-CoV-2の持続的な組織リザーバーを指摘している(3, 4)。我々は最近、機械学習の手法を用いて、PASC患者に特有の免疫学的シグネチャーを同定したことを報告した(5)。この報告では、サイトカイン/ケモカインプロファイルに伴う特徴的な免疫細胞サブセットの異常も明らかにした。主な免疫細胞の異常は、単球サブセットの増加であった(5)。単球サブセットは、3つの表現型と機能的に異なるタイプに分けられる。古典的な単球はCD14++, CD16-の表現型を示し、中間的な単球はCD14+, CD16+の表現型を示し、非古典的な単球はCD14lo, CD16+の表現型を示す(6, 7)。さらに、これらの単球は、以前に説明したように、非常に異なる細胞表面マーカーを発現している(8)。特に古典的単球は、SARS-CoV-2の受容体と考えられるACE-2受容体を高レベルで発現している(8)。中間型単球と非古典型単球は、ACE-2受容体をほとんど発現していない。同様に、古典的単球は、ケモカイン受容体であるCX3R1とCCR5の発現量が少ない。中間型単球はCCR5を多く発現し、非古典型単球はCX3R1を多く発現している。今回、重症患者とPASCにおける単球サブセットの割合の動態的な違いと、急性SARS-CoV-2感染から15カ月後までのPASC患者のCD14lo、CD16+単球におけるウイルスRNAを伴わないSARS-CoV-2タンパク質の存在について報告する。
材料・方法
対象患者
インフォームドコンセント後、全血を10 mLのEDTAチューブと10 mLの血漿調製管(PPT)に採取した。健常者 29 名、軽度・中等度の COVID-19 患者 26 名、重度の COVID-19 患者 25 名、慢性 COVID(Long Hauler-LH)患者 64 名の合計 144 名が本研究に登録された。Long Haulersの症状は既報(5)。研究対象者は、以下の基準で層別された。
軽度のもの
- 発熱、咳、喉の痛み、倦怠感、頭痛、筋肉痛、吐き気、下痢、味覚の低下、小
- 胸部画像(CXRまたは胸部CT)で肺炎の兆候がないこと
- 息切れや呼吸困難がないこと
中等度であること
- 肺炎の放射線学的所見 発熱と呼吸器系の症状
- 海面上の室内空気での酸素飽和度(SpO2)94%以上
重度のもの
- 酸素飽和度(SpO2)94%未満(海面上の室内空気)
- 動脈血中酸素分圧(PaO2)/吸入酸素分圧(FiO2)<300mmHG
- 24~48時間以内に50%以上の肺浸潤が認められた場合
- HR≧125bpm
- 呼吸数≧30回/分
クリティカル
- 呼吸不全で、人工呼吸、ECMO、高流量鼻カニューレによる酸素補給、非侵襲的陽圧換気(BiPAP、CPAP)を必要とする状態
- 敗血症性ショック- 収縮期血圧<90mmHgまたは拡張期血圧<60mmHg、または血管圧迫剤(レボフェド、バソプレシン、エピネフリン)を必要とする。
- 多臓器不全(心疾患、肝疾患、腎疾患、CNS、血栓性疾患)
急性期後のCOVID-19(ロングCOVID)
- 最初の症状が出てから3週間を超えて拡張するもの
慢性COVID-19
- 最初の症状が出てから12週間以上経過したもの
ハイパラメーター免疫プロファイリング/フローサイトメトリー
Lymphoprep density gradient (STEMCELL Technologies, Vancouver, Canada)を用いて、末梢血から単核細胞を分離した。90%ウシ胎児血清(HyClone, Logan, UT)と10%ジメチルスルホキシド(Sigma-Aldrich, St.Louis, MO)を含む培地で200,000個の細胞を凍結し、-70℃で1週間以内に保存して生存率を維持し、細胞内変動を避けるためにシングルバッチとして実行した。細胞を2%BSA溶液でRTで5分間ブロックした。以下の抗体および試薬を含むカクテルを加えた:Brilliant Stain Buffer(BD Biosciences,San Jose,CA),True-Stain Monocyte Blocker,抗CD19-PE-Dazzle594,抗CTLA-4 PE-Cy7,抗CD3-APC,抗CD16-Alexa Fluor 700(すべてBioLegend,San Diego,CA),および抗SARS-CoV-2 Spike S1 Subunit-Alexa Fluor 405(R&D Systems,Minneapolis,MN)。続いて、以下の抗体を加えた:抗CD8 BUV496、抗CD4-BUV661、抗CD45-BUV805、抗PD-1-BB700(すべてBD Biosciences, San Jose, CA)、抗CD56-BV711(BioLegend, San Diego, CA)、および抗CD14 BV786(BioLegend, San Diego, CA)。細胞をRTで30分間染色した後、2%BSAで2回洗浄した。細胞を1mLのincellMAX(IncellDx, San Carlos, CA)中でRTで1時間固定した後、抗FoxP3-PE抗体(BD Biosciences, San Jose, CA)と30分間インキュベートした。細胞を2%BSAで2回洗浄した後、5レーザーのCytoFLEX LXで取得した。
デジタルドロップレットPCR
QIAamp Viral Mini Kit (Qiagen, Germantown, MD)を用いて、製造元の指示に従い、300~400mLの血漿サンプルから核酸を抽出し、50mLのAVEバッファー(RNase-free water with 0.04% sodium azide)で溶出した。精製した核酸は,Bio-Rad SARS-CoV-2 ddPCR Kit(Bio-Rad, Hercules, CA, USA)を用いて直ちに検査した。このパネルは、2019-nCoVを特異的に検出するように設計されている(2つのプライマー/プローブセット)。また,対照試料および臨床試料中のヒトRNase P遺伝子を検出するために,追加のプライマー/プローブセットを使用した。血漿検体から分離・精製したRNA(5.5mL)を,2019-nCoVトリプレックスアッセイ1.1mL,逆転写酵素2.2mL,スーパーミックス5.5mL,ジチオスレイトール1.1mL,無核水6.6mLからなるマスターミックスに添加した。
この混合液を,QX200自動液滴生成装置(Bio-Rad, Hercules, CA)を用いて,最大20,000ナノリットルの油中水型エマルションに分画した。液滴を含む96ウェルのリアルタイムデジタル液滴ポリメラーゼ連鎖反応(RT-ddPCR)対応プレートを、プレートシーラーを用いてホイルで密封し、RNAを逆転写するためにサーモサイクラーを用いて、C1000 Touchサーモサイクラー(Bio-Rad, Hercules, CA, USA)でcDNAのPCR増幅を行う前に、サーモサイクラーを用いた。PCR後、プレートをQX200 Droplet Reader (Bio-Rad, Hercules, CA, USA)にセットし、各液滴の蛍光強度を2つのチャンネル(FAMとHEX)で測定した。その後、蛍光データをQuantaSoft 1.7およびQuantaSoft Analysis Pro 1.0 Software (Bio-Rad, Hercules, CA, USA)を用いて解析した。
フローサイトメトリーによるセルソーティング
凍結保存したPBMCを急速に融解し、遠心分離し、D-PBS中の2%BSA溶液で洗浄した。細胞を2%BSAで5分間ブロックした後、Alexa Fluor® 488 Anti-CD45抗体(IncellDx, 1/100希釈)、2.5ugのAlexa Fluor® 647 Anti-CD16抗体(BD, Cat. # 55710)、1ugのPerCP/Cy5.5 Anti-human CD14抗体(Biolegend, Cat. #325622)と共に室温で30分間インキュベートした。細胞を2% BSA/D-PBSで2回洗浄し、ろ過して、セルソートの間、氷上に置いた。ソニーSH800でデータを取得し、CD14+とCD16+の両方に陽性を示すCD45+細胞のみを100uLの2%BSA溶液で試験管にソートした。コントロールPBMCのソーティング純度は、同じテンプレートとゲーティングストラテジーを用いてソーティングしたPBMCを再分析することにより、99%以上であることが確認された。
単一細胞のタンパク質同定
表現型マーカーに基づいて患者の細胞を選別し、-80℃で凍結した。フローサイトメトリーのシグナルが陽性で、細胞数が十分な6つの患者サンプルを選び、LCMSで確認した。凍結した細胞を、メーカーのプロトコルに従って、キットのIP Lysis/Wash Bufferで溶解した。10ugの抗S1 mAbを用いて、各患者の細胞ライセートからS1 Spikeタンパク質を免疫沈降させた。4℃で一晩インキュベートした後、IP Lysis/Wash Bufferで3回洗浄し、結合したS1 Spikeタンパク質をキットの溶出バッファーで溶出した。
IP溶出画分をバキュームで乾燥させ、20 uLの水に再懸濁し、プールし、Discovery C8(3cm x 2.1 mm, 5 µm, Sigma-Aldrich, 室温)上のAgilent 1290 UPLC Infinity IIで、水またはアセトニトリルに0.1%のトリフルオロ酢酸(TFA)を溶解した移動相溶媒を用いて精製した。勾配は以下の通りである。5~75%のアセトニトリル(0.1%TFA)を4.5分(0.8mL/分)で、最初は5%のアセトニトリル(0.1%TFA)で0.5分(0.8mL/分)保持した。精製したタンパク質をバキュームで乾燥させ、50µLの100mM HEPES, pH8.0(20%アセトニトリル)に再懸濁した。1µLのTCEP(100mM)を加え、37℃で30分間インキュベートした。1µLのクロロアセトアミド(500mM)を加え、室温で30分間インキュベートした。1µLのrAspN(Promega 0.5µg/µL)と1µLのLysC(Pierce, 1µg/µL)を加え、37℃で16時間インキュベートした後、LCMS分析を行った。
液体クロマトグラフィー/質量分析計(LC-MS)分析
消化したリコンビナントSARS-CoV-2 Spike S1タンパク質を高精度質量分析計で分析し、保持時間と正確な質量を持つ検出可能なペプチドのリストを作成した。Agilent 1290 Infinity II高圧液体クロマトグラフィー(HPLC)システムとAdvanceBio Peptide Mappingカラム(2.1 × 150 mm, 2.7 μm)を用いて,質量分析の前にペプチドを分離した。ペプチド分離に使用した移動相は,溶媒A(0.1%ギ酸 in H2O)と溶媒B(0.1%ギ酸 in 90% CH3CN)で構成されている。グラジエントは以下の通りであった。溶出したペプチドは,Agilent 6550 iFunnel飛行時間型MSアナライザーと組み合わせたDual JetStream ESIソースを用いてエレクトロスプレーした。データは、50~1700ダルトンの質量/電荷範囲で2GHz(拡張ダイナミックレンジ)モードのMSメソッドと、オートMS/MSメソッドを用いて取得した。取得したデータは、Agilent Masshunter Workstation B09 Data acquisition Softwareを用いて、セントロイドモードとプロファイルモードの両方で保存した。ソートした患者細胞からの免疫沈降サンプルに対しても、ms/msを取得しないことを除いて、同じ分析方法を適用した。
PCRによるウイルスゲノムの検出と全ウイルスゲノムのシーケンス
TaqPath AssayによるCtの決定 上記のソートされた集団からの5つのRNAサンプルを、TaqPath COVID-19 Combo Kit Assay(Thermo Fisher Scientificカタログ番号A47814)に供し、閾値のサイクルを評価した。TaqPath COVID-19 Combo Kit Assayは、Applied BioSystems QuantStudio 7 Flex (Thermo Fisher Scientific Catalog no. 4485701)を用いて、EUAの推奨事項に従って実施した。
Ion AmpliSeqによるサンプルの全ゲノムシーケンス 5つのRNAサンプルを、Ion AmpliSeq Library Kit 2.0(Thermo Fisher Scientificカタログ番号4480441)とThermo Fisher Scientific Insightパネルを用いて、AmpliSeqライブラリの調製を行った。このパネルは、SARS-CoV-2に対する2つのプールデザインの238個のアンプリコンと、ヒトコントロールとしての7個のアンプリコンからなる。ライブラリーはメーカーの推奨する方法で作成した。最終的なライブラリは、5サイクルの増幅を行い、Kapa Pure Beads (Roche Catalog no l7983298001)を用いて、0.5倍の右サイドクリーンアップと1.2倍の左サイドクリーンアップでライブラリをクリーンアップした。最終的なライブラリは、Ion Library TaqMan Quantitation Kit (ThermoFisher Catalog no. 4468802)を用いて定量した。サンプルを等モルになるようにプールし、Ion Chef Instrument (ThermoFisher Catalog no. 4484177)にロードして510チップにテンプレートした。次に、準備したチップをGeneStudio S5 Prime (ThermoFisher Catalog no. A38196)にロードし、シークエンスを行った。
ゲノムアセンブリー、品質管理、シーケンス解析
シークエンスリードは、Thermo Fisher Scientific社のTMAPアライナーを用いて、SARS-CoV-2ゲノム(ビルドNC_045512.2)およびヒトトランスクリプトーム(ビルドGRCh37)とアラインメントした。パラメータは、-contextフラグを除き、デフォルトのものを使用した。
カバレッジ解析は、Thermo Fisher Scientific Torrent Suiteソフトウェアのカバレッジ解析プラグインで行った。品質管理のため、ヒトコントロールのリードを評価した。カスタムソフトウェアを用いて、塩基ごとのカバレッジ、平均カバレッジ、および様々な深さのしきい値におけるゲノムカバー率を評価した。さらに、リードの長さの分布とリードの品質(MAPQスコア)を評価した。SARS-CoV-2のバリアントコーリングは,variantCallerプラグインを用いて行った.呼び出し可能な領域は、MAPQ < 10 のリードをフィルタリングした後、リードの深さが >= 20 の領域として特定された。呼び出し可能な領域で対立遺伝子頻度(AF)が0.5未満の変異を除去することにより、バリアントの品質をフィルタリングした。PangoLEARN v1.2.13を用いて、フィルタリングされた変異を用いて系統を決定した。
結果
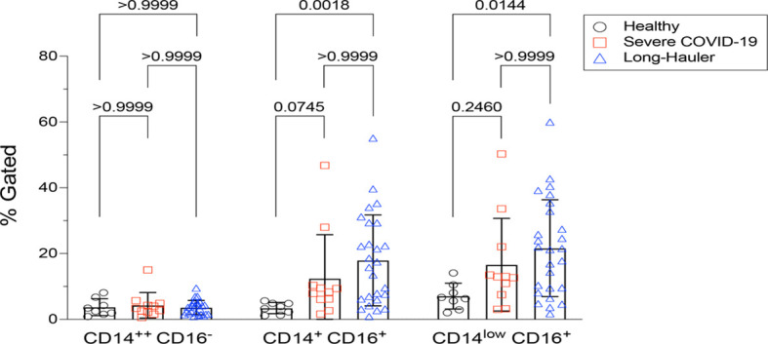
PASCでは、敗血症、エリテマトーデス、関節リウマチなどの他の炎症性・感染性疾患と同様に(9)、中間型のCD14+, CD16+単球が健常者と比較して統計的に有意に増加していることが確認された(P<0.002)。また、PASCでは、CD14lo, CD16+の非classical単球も有意に増加していた(P=0.01)。重度のCOVID-19では、中間型単球も非分類型単球も上昇していなかった(図1)。
図1 PASCにおける古典的単球、中間的単球、非古典的単球の定量化(LH)
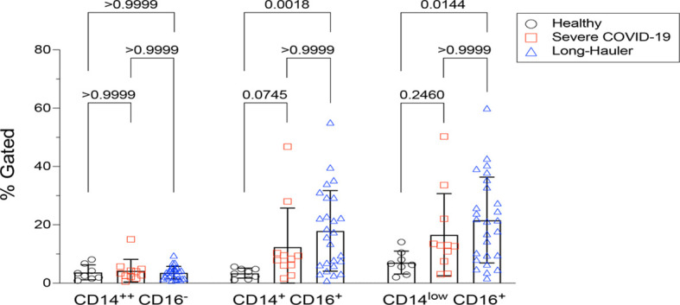
非古典的単球は、重症のCOVID-19とPASCで有意に上昇していた。各カテゴリーの値は、補足図1の親のゲーティングに基づいている。統計解析はKruskal-Wallis検定を用いて行った。P値<0.05を有意とした。
単球サブセットがHIV,HCV,ジカウイルス,デング熱ウイルスに感染する可能性があることが我々のグループなどの報告で明らかになっているので(10-12),対照として急性重症のCOVID-19と同様にPASCの人の末梢血単核細胞(PBMC)をスクリーニングし,SARS-CoV-2のRNAを調べた(表1)。高感度で定量的なデジタルドロップレットPCR(ddPCR)を用いて調べたところ、重症COVID-19患者のPBMCの36%(11人中4人)にSARS-CoV-2のRNAが含まれていたのに対し、PASC患者のPBMCでは4%(1/26)であった。なお、RNA陽性であったPASC患者1名は、感染後15カ月を経過していた。
表1 研究参加者の分子解析と感染後の期間
| COVID-19ステータス | Sars-CoV-2 RNA + | 感染後の月数 | |
|---|---|---|---|
| NS | PBMC | ||
| HC 1 | – | – | 該当なし |
| HC 2 | – | – | 該当なし |
| HC 3 | – | – | 該当なし |
| HC 4 | – | – | 該当なし |
| HC 5 | – | – | 該当なし |
| HC 6 | – | – | 該当なし |
| HC 7 | – | – | 該当なし |
| HC 8 | – | – | 該当なし |
| 無症候性 | + | + | 該当なし |
| 重度1 | + | – | 該当なし |
| 重度2 | + | + | 該当なし |
| 重度3 | + | – | 該当なし |
| 重度4 | + | – | 該当なし |
| 重度5 | + | – | 該当なし |
| 重度6 | + | – | 該当なし |
| 重度7 | + | + | 該当なし |
| 重度8 | + | – | 該当なし |
| 重度9 | + | – | 該当なし |
| 重度10 | + | + | 該当なし |
| 重度11 | + | + | 該当なし |
| LH 1 | + | – | 13 |
| LH 2 | + | – | 14 |
| LH 3 | + | – | 6 |
| LH 4 | + | – | 11 |
| LH 5 | + | + | 15 |
| LH 6 | + | – | 13 |
| LH 7 | + | – | 12 |
| LH 8 | + | – | 7 |
| LH 9 | + | – | 14 |
| LH 10 | + | – | 13 |
| LH 11 | + | – | 12 |
| LH 12 | + | – | 12 |
| LH 13 | + | – | 6 |
| LH 14 | + | – | 14 |
| LH 15 | + | – | 13 |
| LH 16 | + | – | 9 |
| LH 17 | + | – | 11 |
| LH 18 | + | – | 7 |
| LH 19 | + | – | 14 |
| LH 20 | + | – | 11 |
| LH 21 | + | – | 13 |
| LH 22 | + | – | 10 |
| LH 23 | + | – | 8 |
| LH 24 | + | – | 7 |
| LH 25 | + | – | 12 |
| LH 26 | + | – | 15 |
HC, 健康な対照群; LH-PASC; NS, 鼻腔スワブ。
ddPCRで検出された陽性シグナルに寄与する正確なリザーバーをさらに確立するために、B細胞、T細胞、単球サブセットを定義する抗体を用いたハイパラメータフローサイトメトリーを実施し、さらにこれらの細胞をSARS-CoV-2のS1タンパク質の抗体で同時に染色した。単球サブセットを特定するための親のゲーティングを補足図1に示す。図2に示すように、PASC患者の73%(26人中19人)、重症COVID-19患者の91%(11人中10人)で、CD14lo、CD16+の単球サブセットにSARS-CoV-2を含む細胞の異なるサブ集団が見られた。図3に示すように、SARS-CoV-2のS1を含む細胞の量は、重症患者(P=0.004)とPASC患者(P=0.02)の両方で統計的に有意であった。古典的な単球も中間的な単球もSARS-CoV-2 S1タンパク質を発現していなかった。
図2 単球サブセットにおけるSARS-CoV-2 S1タンパク質のハイパラメータフローサイトメトリーによる定量化
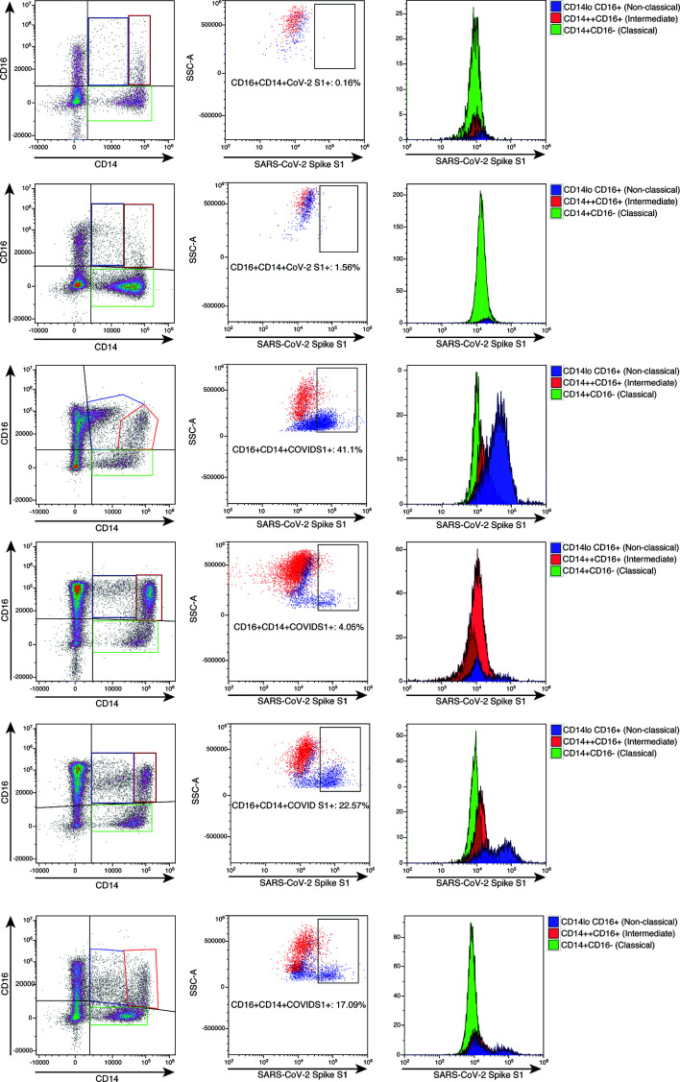
細胞は補足図1で示したようにゲートされた。各横列は個々の患者を表す。最上段には代表的な健康なコントロールが示されている。それ以降の行は、S1を含む単球のスペクトルを示している。古典的な単球は緑、中間的な単球は赤、非古典的な単球は青である。
図3 健康な63人の対照群(HC)、重症のCOVID-19(重症)、PASC患者(LH)から分離した単球サブセットにおけるSARS-CoV-2 S1タンパク質の定量化
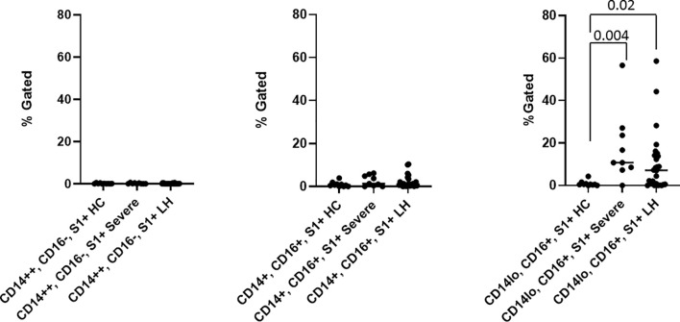
SARS-CoV-2 S1タンパク質は、重症者とPASC患者の両方において、非古典的な単球に発現していた。各カテゴリーの値(中央値-横線)は、補足図1の親のゲーティングに基づいている 。統計解析は、Kruskal-Wallis検定を用いて行った。P値<0.05を有意とした。
SARS-CoV-2 S1タンパク質の存在を確認するために、CD14lo、CD16+単球を選別し、超高速液体クロマトグラフィー(UHPLC)を行った。免疫沈降後、溶出画分をバキュームで乾燥させ、ddH2Oに再懸濁し、市販の免疫沈降バッファーに含まれる洗剤や、架橋されていないSARS-CoV-2 S1抗体を除去して精製した。消化されたペプチドは、Agilent 6550 IonFunnel QTOFおよび1290 UHPLCで分析され、患者のサンプルと市販のSARS-CoV-2 S1サブユニットで行われた同一の消化物を比較した。患者サンプルから得られたS1サブユニットのペプチドは、市販のS1サブユニット消化物を用いて作成されたペプチドデータベースにマッピングされた。ペプチドの同定は、正確な質量、同位体の分布、ペプチドの電荷状態、UHPLCの保持時間が一致するかどうかで行った。図4に示すように、市販のS1サブユニットを消化したものとサンプルLH1-6の代表的なペプチドNLREFVFKの保持時間が一致した。さらに、図4のマススペクトルでは、代表的なLH1サンプルと市販のS1サブユニットに含まれる代表的なペプチドNLREFVFKの質量、同位体分布、および電荷状態が一致している(LH2-6でも観察された、図示せず)。これらの指標を用いて、S1サブユニットのペプチドの最大44%がLH1〜LH6サンプルで同定され(補足表1)、フローサイトメトリーの実験で、これらの患者細胞にS1サブユニットタンパク質が存在することが証明されたことを補完する証拠となった。
図4 サンプルLH1-6におけるS1サブユニットの存在をLCMSで確認した
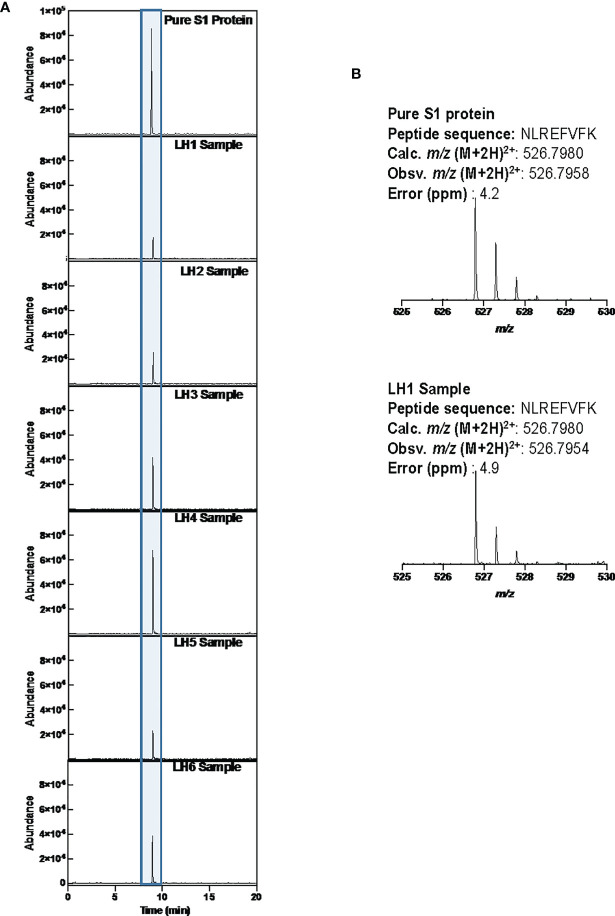
(A) NLREFVFKペプチドの抽出イオンクロマトグラム(EIC)。市販のS1スタンダードに含まれるNLREFVFKペプチドの保持時間と一致する。(B) 市販のS1標準品とLH1患者のNLREFVFKのマススペクトル。両者のスペクトルは同じ質量と同位体の分布を示している。
観察されたS1スパイクタンパクが持続的なウイルス感染の産物であるかどうかを判断するために、LC/MSを受けた患者のうち5人の患者の単球を用いて全ウイルスゲノム配列の解析を行った。ヒトコントロールアンプリコンのカバレッジ解析では、ヒトゲノムコンテンツを積極的に同定するのに十分なカバレッジが得られた。これは、ヒトの宿主からウイルスのゲノムコンテンツを抽出したことと一致する。ヒトのコントロールには、アメロゲニンの標的アンプリコン(AMELXおよびAMELY)も含まれていた。AMELXとAMELYのリードの比率は、各サンプルの性別がわかっていることと一致している。
この5つのサンプルのシーケンスカバレッジは、ウイルスの力価が低いサンプルやCt値が高いサンプルと一致していた。平均カバレッジは24.17~592.87倍で、10倍と20倍でカバーされた塩基の割合はそれぞれ10.81~19.18%と7.69~15.24%であった(表2)。これは、GenBankにコンセンサス配列を登録するために必要なNs>99のストレッチを排除するために予想される閾値をはるかに下回っており、また、正確な系統判定とGISAIDへの配列登録のために必要な10倍でのゲノムカバー率は90%を超えてた(www.gisaid.org)。読み取り値を評価したところ、100bp未満の短い読み取り値がほとんどであった。質の悪いリード、プライマーダイマー、複数の遺伝子座にマッピングされる可能性のあるリードに対処するため、MAPQ10未満のリードをフィルターにかけた結果、1サンプルあたり総リード数の3.63~18.99%が除去された。
表2 平均カバレッジと20倍でカバーした塩基の割合
| サンプル | 平均カバレッジ | 10倍でカバーされるパーセントベース | 20倍でカバーされるパーセントベース |
|---|---|---|---|
| 02-03_20210625 | 171.64 | 19.18 | 15.24 |
| ABA-2_20210625 | 59.67 | 14.04 | 10.42 |
| BGI-2_20210625 | 24.17 | 10.81 | 7.69 |
| CST-2_20210625 | 40.29 | 11.71 | 7.79 |
| RG_20210625 | 592.87 | 12.6743 | 10.16 |
カバーされる塩基の割合は患者によって異なるが、すべてが10倍で20%未満であり、20倍でカバー
カバーした塩基の割合は患者によって異なるが、10倍ではすべて20%以下、20倍ではそれ以下であった。また、完全な長さのウイルスゲノムRNAが検出された例はなく、複製能力のあるウイルスが感染していないことが示唆された。
呼び出し可能な領域の高品質な変異から得られた5つのサンプルの系統を決定すると、BとB.1の系統が得られたが、ゲノム全体のカバー率が不十分であったため、非特異的であった。サンプルLH5を除くすべてのサンプルで、ORF1abに変異が確認された。LH5は、N、S、ORF3bに変異があった(図5)。
図5 呼び出し可能な領域にある高品質の変異
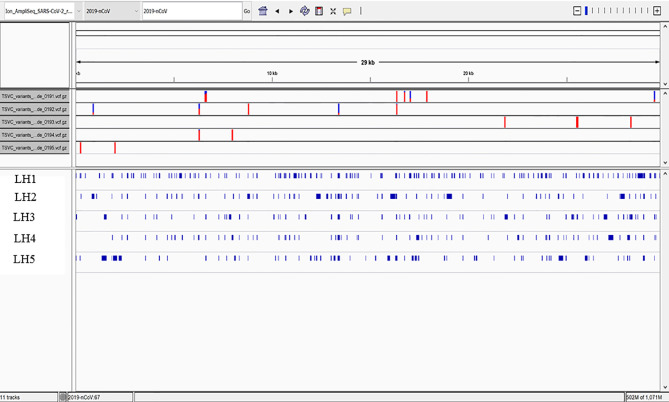
5人の患者からは断片化したウイルスRNAしか検出されなかったが、ウイルスゲノム全体に複数の変異が確認され、その大部分は各患者に固有のものであった。全体のカバー率は20%以下で、ウイルスゲノムのどの部分にも完全な配列は検出されず、これらの患者のタンパク質分析で同定されたS1サブユニットをコードするスパイク遺伝子も含まれていた。
考察
CD14lo, CD16+の単球にSARS-CoV-2タンパク質が15カ月にわたって持続的に検出された人がいることを報告し,PASCやCOVID-19の重症例の病態への影響を考察した。循環単球の3つのサブタイプ(古典型、中間型、非古典型)は、非常に異なる細胞表面分子を発現し、免疫系において非常に異なる機能を果たしている。一般的に、古典的な単球は、食細胞活性を示し、高いレベルの活性酸素を産生し、IL-6、IL-8、CCL2、CCL3、CCL5などの炎症性分子を分泌する。中間型単球は、最高レベルのCCR5を発現し、抗原提示能力に加え、TLR刺激によりTNF-α、IL-1β、IL-6、CCL3を分泌することが特徴である。CX3CR1を高レベルで発現している非古典的な単球は、補体やFcγを介した貪食や抗ウイルス反応に関与している(6)。
ヒトの単球は成熟した後、古典的単球として骨髄から血液中に放出される。現在、古典的な単球のプールから中間的な単球と非古典的な単球が順次生まれてくるという概念を裏付ける強力な証拠がある(13)。これは、CD16+単球がより成熟した表現型を持っていることを示すトランスクリプトーム解析によって裏付けられている(14)。ヒトでは、循環する単球の85%が古典的な単球であり、残りの15%は中間的な単球と非古典的な単球で構成されている(13)。古典的単球の寿命は約1日で、その後、組織に移動するか、死滅するか、あるいは中間型単球、さらに非古典的単球に変化する(6, 13)。
感染症や炎症などの病的な状況下では、単球のサブセットの割合は、それぞれのサブポピュレーションの機能に応じて変化する(6, 13, 15)。我々が以前に行った研究では、PASCグループでは、疾患の初期段階において、健常対照者と比較して、古典的単球の割合が減少し、中間型単球の割合が増加することが示された(5)。また、PASC群では感染後6-15カ月目に非古典型単球が増加し、重症患者では0日目に中間型単球と非古典型単球の割合が高くなっていることから、両群で古典型-中間型-非古典型単球の移行が亢進しているが、その速度は異なることが示唆された。
COVID-19患者における単球の活性化の臨床的意義と、PASCにおけるウイルスタンパク質の貯蔵庫としてのこれらの細胞の重要性は、非古典的単球内のS1タンパク質の存在を報告した我々のデータによって裏付けられた。ウイルス粒子やウイルスタンパク質は、それぞれ異なる方法で単球亜集団に侵入することができ、重篤な疾患やPASCを発症する個人では、この点が異なって制御されているようである。古典的単球は主に食細胞で、ACE-2受容体を多く発現している(8)。したがって、単球は、ウイルス粒子やアポトーシスを起こしたウイルス感染細胞を貪食するか、SARS-CoV-2感染の標的となる可能性がある。循環寿命が短いことを考慮すると、ウイルスタンパク質を含む古典的な単球は、中間的な単球や非古典的な単球に変化する。実際、病気の初期段階では、重症群では非古典的単球が増加しているが、PASCでは中間型単球と非古典的単球の両方が増加している(5)。さらに、CD14+CD16+単球は、中間レベルのACE-2受容体を発現しており、HIV-1やHCV11の感染標的であることが示されているように、SARS-CoV-2の感染標的になる可能性もある。非古典的単球は、内皮細胞の完全性をパトロールすることにより、血管系の管理者として機能することが提案されている(16)。非古典的な単球におけるS1タンパク質の説明としては、既存のCD14lo CD16+細胞が、ウイルスに感染したアポトーシス内皮細胞を貪食し、その後RNAを分解してS1タンパク質を提示するということが考えられる。さらに、非古典的単球は、FcRを介した食作用と関連しており(17、18)、これは急性感染時に抗体が産生された後、オプソニン化されたウイルス粒子を摂取することと関連しているのかもしれない。
これまでの報告では、COVID-19患者では、古典的な単球の数は減少するが、中間的な単球や非古典的な単球の数は増加することが示されている(19)。したがって、重症患者とPASC患者の非古典的単球におけるS1タンパク質の存在は、これらのグループの臨床的特徴や転帰と関連している可能性がある。以前、我々は、重症のCOVID-19患者は、IL-6、IL-10、VEGF、sCD40Lの全身レベルが高いことを発見した(5)。我々のデータと同様に、他の研究でも、非感染者によるIL-6、VEGF、IL-10の産生増加との関連が示されている。
VEGFおよびIL-10の産生増加と疾患の重症度との関連を示した研究もある(20-22)。
PASCの場合、上述したウイルスタンパク質の様々な内在化のメカニズムとは無関係に、S1を含む非古典的単球が感染後15カ月まで循環していたことから、この細胞集団を維持するための特定の条件が存在する可能性が示された。ヒトとマウスの両方で、非典型単球がアポトーシスを抑制し、生存を促進するためにフラクタルカイン(CX3CL1)とTNFを必要とすることが示されている(22)。我々の以前のデータでは、PASCの人ではIFN-γレベルが高く(5)、これがTNF-αの産生を誘導することがわかっている(23)。
さらに、TNF-αとIFN-γは、血管内皮細胞によるCX3CL1/フラクタルカインの産生を誘導し、非古典的単球の生存を促進する条件を作り出す(24)。さらに、IFN-γによる内皮細胞のCX3CL1/フラクタルカインの産生(23)は、CX3CR1を発現している非典型単球を保存する血管区画内の勾配を作っているのかもしれない。
非classical単球は通常、抗炎症細胞と呼ばれている(22)が、最近、このサブセットが炎症性表現型を獲得することが明らかになった(24)。非古典的単球は、細胞老化の特徴を獲得することがこれまでに示されており、これにより循環系におけるこれらの細胞の長期的な生存が促進される。さらに、このことは、NF-κB活性が高く、IL-1α、TNF-α、IL-8などの炎症性サイトカインが産生されることを特徴とする老化関連分泌表現型(SASP)の現れであると考えられる非古典的単球の炎症状態を誘導する(25)。
PASCの特徴は、様々な組織や臓器に生じる症状が不均一であることである。CD14lo、CD16+、S1タンパク質+の単球は、フラクタルカインを発現している解剖学的部位に優先的にリクルートされ、S1タンパク質を持たない非古典的な単球で以前に示されたように、この単球サブセットが拡大している病態下では、血管や組織の損傷に寄与する可能性がある。以前、CD16+単球は、CX3CL1(フラクタルカイン)とSDF-1を高レベルで発現しているAIDS患者の脳に移動し(26)、炎症性サイトカインと神経毒性因子の放出を介して、HIV関連の認知症における血液脳関門の損傷と神経細胞の損傷を媒介することが示された。興味深いことに、運動によってCD14lo、CD16+単球の動員が増加することを論じた論文がいくつかある(27)。これらのデータは、COVID以前の運動療法を再開した人でPASCの症状が悪化したという報告を説明するのに役立つだろう。
以上のことから、今回の報告で提案されたPASCのメカニズムは、CCL4レベルが低いために中間型単球が循環に留まり、分化するまでの時間が延びて、非古典的単球が蓄積されることを示唆している。さらに、CX3CR1/フラクタルカイン経路を阻害することで、S1を含む非classical単球の生存率を低下させ、それに伴う血管炎症を抑えることができるという治療ターゲットになりうることを示唆している(5)。
なお、これらの患者で検出されたS1タンパク質は、以前の感染やアポトーシスを起こした感染細胞のファゴサイトーシスによって保持されたものであり、持続的なウイルス複製の結果ではないことに留意する必要がある。ゲノム解析に提出された5例の完全長配列を調べたところ、プロテオミクス解析で検出されたスパイクタンパク質を説明できるスパイクタンパク質遺伝子やその他の遺伝子の完全長配列は確認できなかった。一方、5例すべてにおいて、断片化されたSARS-CoV-2の配列が確認された。ここ数カ月、PCR法によるCt値が高い、あるいは陰性で、全ウイルスゲノム配列解析により断片的なウイルス配列が確認されるというパターンが観察されており、これは2020年の大部分で確認されたCt値の低い完全長のウイルス配列からの大きな変化である。このシフトの理由は明らかではないが、これらの症例に見られるように、これらの患者が複製能力のあるウイルスゲノムを産生しているとは考えられず、したがって、感染を伝播する可能性は低いと考えられる。一方、今回報告されたデータは、持続性ウイルス抗原、特にスパイクタンパクのS1フラグメントに対する免疫反応が、以前に発表されたPASC免疫反応(5)を誘発し、IFN-γ、IL-6、IL-10、IL-2などの炎症マーカーの上昇によって特徴づけられるという仮説を支持するものである。
本研究で発表された論文の原文は、論文/補足資料に掲載されている。お問い合わせは、対応する著者にお願いする。
倫理規定
すべての患者がインフォームド・コンセントに署名し、本研究はChronic COVID Treatment Centerの倫理委員会で承認された。また、本研究は慢性COVID治療センターの倫理委員会で承認されている。患者/参加者は、本研究に参加することについて、書面によるインフォームド・コンセントを提供した。
著者の貢献
著者の貢献。RYとPPは、臨床研究を組織し、積極的に患者を募集した。BP, AP, HR, EL, TT, PS, SH, DMが実験を行い、データを解析した。JG-C, RM-R, JM, XCは統計およびバイオインフォマティクスを担当した。
利害の衝突
BP、AP、HR、EL、EFは、IncellDx社の従業員である。TT,PS,SH,DMはアブロク・ラボラトリーズ社の社員である。
その他の著者は,利益相反の可能性がある商業的・金銭的関係がない状態で研究を行ったことを表明している。