Contents
Peripheral Blood Brain-Derived Neurotrophic Factor as a Biomarker of Alzheimer’s Disease: Are There Methodological Biases?
要旨
脳由来神経栄養因子(BDNF)のレベルとシグナル伝達の変化がアルツハイマー病の病因に関与している可能性があることを示す証拠は、その血中濃度が疾患のバイオマーカーとして使用できることを示唆している。しかし、健康な対照群と比較して、高い、低い、または変化のない循環BDNFレベルはすべてアルツハイマー病患者で記載されている。
このような異なる所見の理由は不明であるが、方法論的な問題が関与している可能性が高い。参加者募集基準の不均一性や、認知症に関係なく循環BDNF値に影響を与える変数(抑うつ症状、投薬、生活習慣、血清と血漿の重なりのなさ、実験的側面)の管理ができていないことは、結果に偏りが生じ、研究の比較可能性を妨げている可能性が高い。
本研究では、これらの因子を厳密に管理することで、研究結果の不一致を減らすことができると考えられる幅広い因子をレビューし、その管理方法について実践的なアドバイスを提供している。これらの変数の重みを明らかにし、分析方法を標準化するための研究が急務である。
キーワード
脳由来神経栄養因子、アルツハイマー病、血液、バイオマーカー、交絡変数
序論
脳由来神経栄養因子(BDNF)は、末梢神経系と中枢神経系(中枢神経系)の両方で重要な生理機能を担っている神経栄養因子ファミリーの一種である(図1)[1-3]。脳内BDNFレベルの変化やBDNF-TrkBシグナル伝達経路の変化がアルツハイマー病の病因に関与している可能性が示唆されていることから、血中BDNFがアルツハイマー病の診断、予後、治療モニタリングのためのバイオマーカーとして利用できる可能性が示唆されている。
図1 脳由来神経栄養因子(BDNF)の機能の概略図
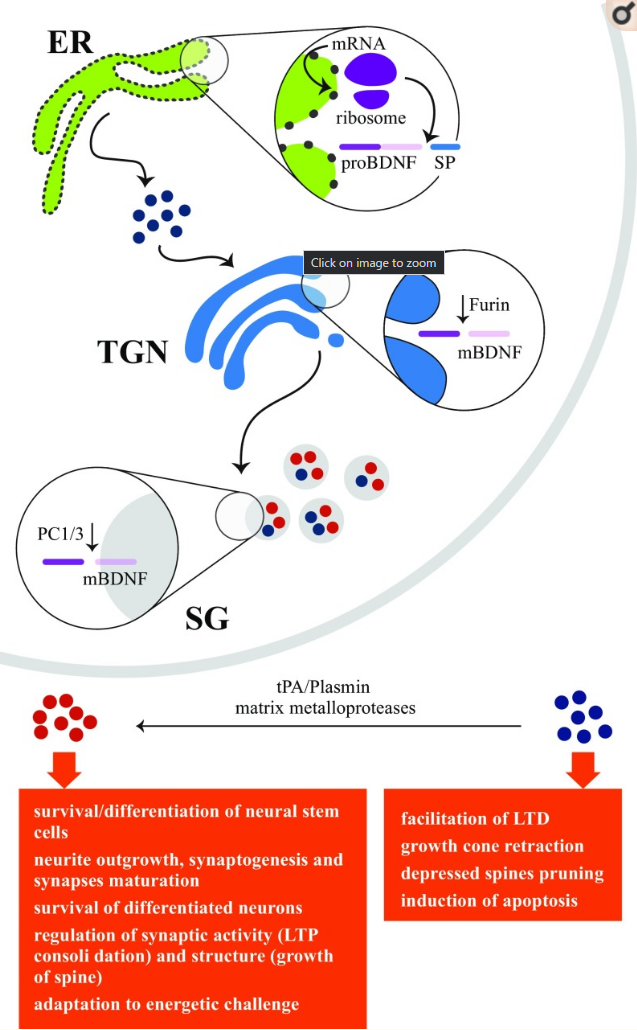
BDNF、神経成長因子、ニューロトロフィン-3,ニューロトロフィン-4/5は、密接な関係にあるタンパク質のニューロトロフィンファミリーに属している。BDNFはpre-proBDNFとして合成され、小胞体(ER)でシグナルペプチドが除去されることによりproBDNFに変換され、細胞内(トランスゴルジネットワーク(TGN)および分泌顆粒(SG)内)および細胞外での切断イベントにより成熟BDNF(mBDNF)に変換される。proBDNFはp75NTR/ソルチリン複合体を介して、mBDNFはその受容体TrkBを介して、それぞれ異なる重要な役割を果たす活性分子である。青丸はproBDNF、赤丸はmBDNF、LTDは長期うつ病、LTPは長期増強、tPAは組織プラスミノーゲンアクチベーター
BDNF の循環は末梢 [5-7] と大脳の両方に由来しており、血液脳関門はどちらの方向にも透過性があるため [8] 、BDNF の循環は末梢 [5-7] と大脳の両方に由来している。BDNF の循環と脳レベルおよび脳現象との相関性は、動物実験やヒト実験によって示唆されている[9-15]。しかし、アルツハイマー病のバイオマーカーとしてのBDNFの価値の調査は、健康な対照群と比較して、より高い[16, 17]、より低い[18-28]、または同程度のレベルの循環BDNF[29-33]がすべてアルツハイマー病患者で報告されているため、決定的な結果を与えていない。相反する報告の理由は不明であるが、最近のメタアナリシスでは、痴呆患者と健常対照者の非均質な採用基準が有意なバイアスを誘発する可能性があることが明らかにされている[34]。
本研究では、データの比較可能性を損なう循環BDNFに影響を与えうる因子の幅広いパネルをレビューすることでこの問題を掘り下げ、それらを最大限にコントロールする方法についていくつかの実用的なアドバイスを提供している。
アルツハイマー病ステージング
Laskeら[35]は、血清BDNFレベルがアルツハイマー病ステージに関連している可能性があること、すなわち、それらの初期の増加とその後の減少が疾患の進行に依存している可能性があるという仮説を立てた最初の研究者であった。BDNFの初期上昇は、βアミロイドの蓄積を打ち消すための代償的なメカニズム、神経細胞の損失を相殺するための栄養サポートの提供、および/またはTAUの脱リン酸化の促進[36-41]、あるいは神経変性の前段階を特徴づけるコリンアセチルトランスフェラーゼ活性の上昇の反映であると仮説が立てられている[42]。異なるBDNFレベルが異なるアルツハイマー病ステージで見られるという見解は、いくつかの研究者によって共有されている[43-45]と他の研究者によって拒否されている[16,17,30]。そのような異質な意見は、以下で議論されるいくつかの要因に依存する可能性が高い。しかし、評価ツールの不均一な使用も寄与しているかもしれない。
臨床的認知症評価(CDR)スケールとミニ精神状態検査(MMSE)は広く使われているツールであるが、CDRスケールはアルツハイマー病患者を段階的に評価するためのより信頼性の高いツールと考えられている[46]。14カ国語で検証されているこの尺度は、患者と情報提供者の両方に対して半構造化面接を用いて認知機能を評価する [47]。この尺度は、記憶、志向性、判断、問題解決、コミュニティ活動、家事、趣味、パーソナルケアを含む多数の領域を評価し、認知障害の個別のレベルに対応するグローバルなスコアを割り当てる [48]。CDRの厳密な適用は、研究間の比較可能性を高めるであろう。しかし、アルツハイマー病の進行とBDNFレベルとの関連を明らかにするためのアドホックな調査が必要であることは明らかである。注目すべきは、厳格な病期分類基準、すなわち軽度、中等度、重度のアルツハイマー病(CDR 1,2,3)または早期、中等度、後期のアルツハイマー病(MMSEスコアが20以上、20-10以上、10未満)に基づいて患者を登録することで、病期とBDNFレベルが類似した患者の登録が確実になり、より均質なコホートとより信頼性の高いデータを提供することになるだろう。
健康なコホートとアルツハイマー病コホートの人口統計学的特徴
健康な人と認知症の人の両方で、循環BDNFの加齢に伴う減少が報告されている[27, 45, 49-51]。また、女性と男性の間での違いも記述されている[33, 49, 51-54]が、アルツハイマー病の感受性に対するVal66Met多型の性的二型効果も同様である[55]。しかし、いくつかの研究では、健康な被験者と痴呆患者がこれらの違いを考慮せずにリクルートされており、コホートの同質性に対する年齢および/または性別の構成の影響の可能性は常に考慮されていない[16, 20, 27, 29]。統計解析において年齢と性別が共変量として用いられる場合、それらはBDNF比較の有意性に影響を与える可能性がある[43]。一般的なルールとして、交絡変数の存在、すなわち、研究デザインに関係なく関心のある結果に影響を与える可能性のある変数は、分析を行う前に必ず検証しなければならない [56] 、そして、例えば、それらの変数に対するモデル調整のような専用の統計的手法を採用しなければならない [57]。
抑うつ症状
いくつかの証拠から、大脳BDNFがうつ病のエフェクターであり、治療標的であることが示されている [58]。うつ病患者の海馬と前頭前野ではBDNFシグナル伝達が有意に減少しており[59]、抗うつ薬や電気けいれん性ショック療法による神経可塑性の誘発能力は、これらの回路におけるBDNFシグナル伝達刺激と密接に関連しているようである[60]。注目すべきことに、脳の報酬系におけるBDNFレベルの上昇は抑うつ症状を引き起こすため、脳内BDNFの役割は領域特異的である[61]。うつ病の末梢への影響に関しては、その機能的役割は不明であるが、血清および血漿中のBDNFの減少が繰り返し報告されている[62, 63]。循環BDNFの減少は、中枢神経系レベルでの変化を反映している可能性があり、および/または血小板の放出不良に依存している可能性がある [64]。アルツハイマー病患者の50%までがうつ病を患っており、このような患者では最も頻度の高い併存疾患の一つとなっている[65]ので、うつ病に関連したBDNFの変化と認知症に関連したBDNFの変化を識別することが重要である。
これには2つのステップがある。第一に、臨床的なうつ病に苦しむ患者をアルツハイマー病コホートから除外すること [16, 19, 20, 32, 33, 35, 43, 66]、またはBDNFレベルへの影響を評価することである [21, 45]。実際、Leeら[21]は重度のうつ病のあるアルツハイマー病患者とないアルツハイマー病患者の間で血清BDNFに差がないことを発見したのに対し、別の研究[33]では、不顕性うつ病を示唆する軽度の不定愁訴症状に関連した無気力が、アルツハイマー病患者とそうでないアルツハイマー病患者の血清BDNFの有意な減少を決定した。さらに、Platenikら[45]によって発見された、アルツハイマー病患者と健常者との間の血小板に富んだ血漿中のBDNF濃度の差は、うつ病患者では確認されているが、うつ病がない患者では確認されていない。ここでも、募集基準が重要な役割を果たしている。
第二のステップは、健常者とアルツハイマー病のコホートにおける抑うつ気分の評価であろう。この要素が交絡変数となる可能性があるにもかかわらず、異なる方法論的アプローチで得られているため、公表されているデータの数は少なく、結論を出すには十分ではない。ほとんどの研究では老年期うつ病尺度(GDS)[27, 31, 43, 45]を使用しているが、他の診断プロトコルも適用されている[16]。さらに、アルツハイマー病と健常者はほとんどが別々に保たれているのに対し [16, 43, 45]、いくつかの研究ではプールされている [27, 31]。ここでも、特に抑うつ気分評価のプロトコルが関係している場合には、統一性が不可欠である。いくつかのうつ病評価尺度が存在するにもかかわらず[67]、GDSにはいくつかの利点がある。実際、GDSは高齢者の気分状態を評価し、抑うつ症状を特定するために特別に設計されたものであり、さらに、医学的障害や加齢と重なる可能性のある症状を避け、心理的側面に焦点を当てている。当初は30項目に基づいていたが、その後15項目のバージョンが開発され [68] 、ほとんどの検証研究で使用されている。
薬物
アルツハイマー病患者に投与されるいくつかの精神活性薬は、循環BDNFに影響を及ぼす。アセチルコリンエステラーゼ阻害薬[20]と抗うつ薬[69]は末梢のBDNFを増加させるが、ベンゾジアゼピン系薬剤はBDNFを減少させる[24,70]。それらの重要性にもかかわらず、薬物の効果は多くの研究で無視されてきた [18, 19, 21-25, 27-30, 32, 35, 45]。これらを考慮した研究では、以下の2つのアプローチのいずれかを採用している。(i)ナイーブな被験者またはウォッシュアウト段階の患者の登録 [20, 33, 66] または (ii) 薬物使用の結果の評価 [16, 17, 24, 31, 43]。どちらのアプローチも有用なデータを提供するが、後者の方が母集団の平均的な状態をより明確に描出しているため、臨床現場で循環するBDNFのバイオマーカー機能を検査するのにはより有用であろう。精神薬以外にも、脂質低下薬 [51, 71] や抗糖尿病薬 [72] が高齢者に広く処方されており、BDNF のレベルに影響を与えている。したがって、非ステロイド性抗炎症薬、抗凝固薬、抗高血圧薬など、血小板活性に影響を及ぼすすべての薬剤を考慮に入れるべきである(セクション「血清と血漿中のBDNFの重なりの欠如」を参照)。精神活性薬と非精神活性薬を評価した研究は限られた数しかない [16, 20, 33, 43]。さらに、いくつかの研究では、認知的に健康な高齢者が高血圧、糖尿病、凝固障害、または脂質異常症の治療を受けていることが多いという事実を認識し、健康な高齢者と同様にアルツハイマー病における薬物使用を調査している[16, 17, 33, 43, 66]。明らかに、すべての潜在的な干渉性のある薬は、患者と対照群で同様に考慮されるべきであり、例えば、薬を服用している群と服用していない群のBDNFレベルを分離しておくか、または両方の群を組み合わせておく二分法分析によって。
ライフスタイル
運動、喫煙、飲酒、食事行動などの日常生活習慣は、循環する BDNF レベルに影響を与える可能性があるが、それらはほとんど解析されておらず、網羅的に解析されていない [16, 25, 32, 43, 45, 66]。
運動、特に有酸素運動は、主に脳内でのBDNF産生の刺激を介して循環BDNFを増加させることが知られているが[51, 73, 74]、おそらく末梢からの放出も刺激される[79, 80]。しかし、研究に登録された患者が日常的な身体活動(トレーニングプログラムではない)を行っている場合には、末梢性BDNFとの逆の関係が見出されている[81]。この不一致の理由は不明であるが、自発的に活動する人の心肺体力[82, 83]やエネルギー代謝[84]の向上が重要な役割を果たしている可能性がある。健康な高齢者はアルツハイマー病患者と比べて身体活動率が異なり[25, 85]、これが認知症とは無関係にBDNFレベルに影響を与えていると考えるのが妥当である。高齢者の日常的な身体活動を評価するための簡単で効果的なツールは、高齢者のための身体活動尺度(PASE)[86]である。この尺度は、65歳以上の高齢者の余暇時間、家事、仕事を評価するための疫学研究用に設計されたものである。したがって、健康なコホートとアルツハイマー病コホートのPASEスコアは常に比較され、可能性のある共変量として考慮されるべきである。
循環するBDNFに対する喫煙の影響に関する限られた利用可能な証拠は、血漿中および血清中のBDNF濃度に異なる影響があることを指摘しており、喫煙者では非喫煙者よりもそれぞれ低く [87, 88] 、高く [51, 89-91] なっている。1つの研究では反対の結果が得られているが、著者らはそれを説明することができなかった[92]。脳内BDNFに対するニコチンの直接的な影響が記述されている。ニコチンの慢性投与は、大脳皮質と海馬[93,94]、および後頭核、腹側索野、黒質を含むドーパミン作動性脳領域[95,96]でBDNFをアップレギュレートするが、線条体ではニューロトロフィンをダウンレギュレートする[97]。ニコチンの効果の違いは、短期投与では海馬のBDNFを減少させ、長期投与では海馬のBDNFを増加させる [98] ・ニコチンの摂取量と関連している。喫煙による末梢性BDNFの変調は大脳現象を反映しているかもしれないが、末梢性の影響も重要であるかもしれない。実際、試験管内試験解析では、喫煙者の血小板からの異常なBDNFのトラフィッキングが循環BDNFの変化に寄与することができることを示す、タバコの煙の抽出物は、BDNFの用量依存的な放出を誘導することが文書化されている[92]。喫煙と BDNF の機能的関係の詳細な分析は本稿の範囲を超えているが、上記のデータは、健康な人と アルツハイマー病 患者の両方を対象に、現在、元、非喫煙者として分類することの重要性を明確に示している。さらに、血清BDNF、喫煙年数[89]、喫煙強度[51, 100, 101]との間に有意な正の相関が認められていることを考えると、喫煙者はタバコを吸った本数と習慣を獲得した年齢についても評価されるべきである。特に、禁煙は血漿中の BDNF [87, 88] の有意な増加を誘導するので、元喫煙者を評価する際には、正常化を可能にする十分な休止期間を考慮する必要がある:これまでのところ、彼らは 12 週間でしか研究されておらず、BDNF は 4 週間後にはすでに減少し始めていたにもかかわらず、3 ヶ月間では定常状態に達していなかった [87]。禁薬期間を交絡因子として考慮することは、許容できる妥協点であると考えられる。
BDNFは依存症に関与していることが知られている[102]。したがって、脳内BDNFとアルコール使用との間に機能的な関係があるという報告は驚くべきものではない。中等度のアルコール摂取はBDNFをアップレギュレートさせ、それ以上のアルコール摂取を抑制することを目的としたホメオスタティックメカニズムを誘発するようであるが、慢性的なアルコール使用によるBDNFシグナル伝達の変化は乱用行動の一因となる可能性がある[103]。循環BDNFに対するアルコールの影響については、一貫性のないデータが得られている。健康な対照群と比較して、アルコール依存症の被験者では、血清BDNFの変化なし[104-106]または減少[107]、血漿BDNFの変化なし[107]、高値[108]または低値[109]であることが明らかになっている。断酒の効果についても、禁酒は血漿 [110,111] および血清 BDNF [105] に影響を及ぼさないこと、または血清レベルを上昇させることが報告されているため、相反する結果が報告されている。繰り返しになるが、これらの不一致を説明する要因としては、患者の臨床的特徴の不均一性[107]、広く過小評価されている依存性の家族的素因[109]、および離脱中の標準化された投薬スケジュールの欠如[105]などが挙げられる。注目すべきは、循環BDNFに対するアルコールの影響を検討した研究では、主に男性の個人と乱用行動を考慮しているが、女性と中程度の社交的飲酒に関する情報はほとんどないことである。それにもかかわらず、サンプルの評価で臨床家を導くためのいくつかの基本的なルールを簡単に識別し、適用することができる:健康な被験者とアルツハイマー病患者は、すべてのアルコール乱用と依存症のスクリーニングを行うべきであり、これらは除外基準として考慮されるべきである。
摂食行動の障害/制御への BDNF の寄与を支持するいくつかのエビデンスがある。BDNFとその受容体TrkBはエネルギー恒常性維持に関与する視床下部と後脳の核に局在している[112, 113]、BDNF多型(Val66Met、-270C/T、196G/A)と拒食症および神経過食症[114-116]との間に関連性が見出されており、BDNFの変化の動物モデルでは過食症および肥満が示されている[117, 118]。摂食障害は循環BDNFに影響を与えるが、拒食症および神経過食症の患者が一貫して低い血清BDNF [119-121]を示すのに対し、肥満の被験者からのデータは対照的であり、正常体重の被験者と比較して肥満の被験者では、より高い[119, 122-124]、低い[125]、または変化のない血清レベル[126]、および血漿BDNFの低い[127, 128]、または変化のないレベル[127, 129, 130]が報告されている。これらの結論の出ない所見は、肥満が慢性的な炎症性疾患であり、血小板貯蔵[122]および末梢血単核細胞によるBDNF産生[130]への影響を含む負の全身的影響を有し、その結果は疾患の重症度、併存疾患および薬剤に関連して変化する可能性があるという事実によって部分的に説明されているかもしれない。摂食障害は健康な高齢者対照者よりもアルツハイマー病患者の間でより頻繁であるというHeunらの報告[131]は、重度の低体重および過体重の被験者を登録すべきではないことを示唆している。もう一つの有用なオプションは、成人集団のために定義されたWHOのボディマス指数(BMI)クラス(すなわち、以下のように)に従って分割された健康な被験者とアルツハイマー病被験者の循環BDNFを評価することであろう。中等度/重度のやせ、BMI≦17kg/m2;低体重、17<BMI<18.5kg/m2;正常体重、18.5≦BMI<25.0kg/m2;過体重、25.0≦BMI<30.0kg/m2;肥満、BMI≧30.0kg/m2;肥満度クラス3,BMI>40.0kg/m2)[132]。興味深いことに、BMIと循環BDNF(血清では陽性、血漿では陰性)との間の相関は摂食障害および代謝障害の患者で発見されているが [49, 121, 123, 124, 127]、認知症の患者についてはほとんど、または全く情報がない。アルツハイマー病患者の血漿および血清BDNFに対するBMIの影響の可能性を評価した単一の研究では、効果は認められていない[45]。この問題は明らかにさらなる分析に値する。
血清と血漿中のBDNFレベルのオーバーラップの欠如
平均血清BDNFレベルは血漿の約200倍であり、この差は循環血小板に貯蔵され、凝固中に放出されるBDNFの量を反映している[5]。
血小板は、過活動化[133]、酸化状態の障害[134]、ミトコンドリアの欠損[135]、膜の流動性とコレステロールレベルの基底変化[136]、および非定型アミロイド前駆体タンパク質(APP)代謝[137]を含む、アルツハイマー病において広範な変化を受ける。被覆亜集団の割合の上昇[138]、APPアイソフォーム比の変化[139]、基底活性化の増加[140]など、いくつかの血小板機能不全は、アルツハイマー病の進行に関連している。血小板機能に影響を与えることにより、これらの現象は血清および血漿中BDNFに対して異なる、あるいは反対の効果を及ぼす可能性がある;結果として、2つのマトリックスから異なる結果が得られる可能性がある[141]。その潜在的な重要性にもかかわらず、アルツハイマー病における血小板の変化が血漿および血清BDNFに及ぼす影響を分析した研究は2件のみである。Platenikら[45]は、中等度および重度のアルツハイマー病患者の血小板の多い血漿中に見られるBDNFレベルの低下は、血小板数の減少によるものであり、血小板中のBDNFレベルの低下によるものではないことを示したのに対し、Laskeら[66]は、アルツハイマー病患者の血清BDNFレベルが血漿BDNFとは無関係な血小板活性化のマーカーである血漿β-トロンボグロブリンのレベルと有意に相関していることを報告している。
認知症以外にも、炎症性サイトカイン[142]や薬物[143-145]など、アルツハイマー病患者の血漿および血清BDNFに異なる影響を与える要因がある。結論を拡張する際の注意の重要性は、最近のメタアナリシス[146]で健常者と比較してアルツハイマー病患者の血漿BDNFが減少しているが、血漿は変化していないことが報告されたことで確認されている。この研究は有益であるとはいえ、しかしながら、認知症の病期分類やライフスタイルなどの重要な交絡因子を考慮しておらず、健康な対照者ではなく、患者のみを対象に薬物の影響の可能性を評価している。新たな実験データが得られるまでは、血漿と血清の同時評価が最も安全な方法であると思われる。血小板機能の影響を相殺できるだけでなく、血漿と血清では異なるタイプの情報が得られる可能性があるからである。実際、血漿中のBDNFが分子の「活性」形態、すなわち可飽和輸送系を介して血液脳関門を横断するために利用可能な画分であるのに対し、血小板量を反映する血清中のBDNFは、むしろ長期的なマーカーを提供する可能性がある[15, 54, 144]。
実験問題
分析を完成させるために、ここでは、上記で説明した様々な要因よりもコントロールが容易であるにもかかわらず、過小評価されているいくつかの方法論的特徴についていくつかの考察をする。
2つの事前分析条件が重要である。
- (i) BDNF はヒトでは概日リズムに従うことが示唆されており、ピーク値は午前中に達している [147, 148]。血漿中と血清中、および男女間での差異も報告されており、血清中の濃度は女性の方が一日中安定している[149]。すべての研究において、日中の変動を測定した被験者は若年者または成人であり、高齢者でこれらのデータを測定するためにはさらなる研究が必要であることが関係している。すべての場合において、採血の時間は一貫しており、慎重に実施されるべきである。
- (ii) Trajkovska ら [150] は、全血中の BDNF 濃度は-20℃で最大 5 年間安定しているが、血清中の BDNF 濃度は長期保存により負の影響を受けることを報告しているが、試料の保存期間についてはほとんど、あるいは全く報告されていない傾向がある。血清中の BDNF の低下と保存期間の長期化との間の有意な相関関係は Bus ら [89] によって確認されており、彼はまた、-85 ℃の温度ではこの現象が減衰することを実証している。即時アッセイは、可能性のあるバイアスを除去する可能性があるが、限られた均一な保存期間(すなわち、数ヶ月)を常に適用する必要がある。
バイオマーカーを検出するための材料や方法も重要である。循環BDNFは市販のELISAキットを用いて容易に測定でき、将来の臨床応用を考えると最良の方法と思われる。数多くのキットが販売されているが、Polacchini ら [151] は、5 種類のキットを比較して、それぞれの性能、特にアッセイ間のばらつきや成熟 BDNF ではなく全 BDNF に対する特異度に違いがあることを明らかにしている。この発見は、信頼性の適切な基準の定義と検証が非常に急務であることを強調している。残念ながら、既存のすべてのキットの完全なパネルの分析が不足しているため、現在のところ、最良の会社を提案することはできない。このギャップを埋めるための努力が優先的に行われるべきであり、様々な研究室が体系的なプログラムに参加することが必要である。
上述したように、統計解析が重要になるかもしれない。血液中の BDNF という変数の分布が適切に考慮されていない。非正規分布が広く報告されている[17, 43, 45, 50, 54, 105, 108, 119, 150]が、いくつかの例外はあるが[33, 52, 87]。この現象は小さなサンプルでは検出されないことがある。さらに、いくつかの研究では、変数分布の評価が明示的に記述されていないため、パラメトリック検定の使用に疑問が生じている。正規性は常に検証されなければならず、分布が正規でない場合は、ノンパラメトリック統計 [152] または変数変換 [153] を適用すべきである。
結論
図22は、アルツハイマー病の可能性のあるバイオマーカーとして血中BDNFを試験した研究において、それぞれの潜在的な交絡因子に及ぼされたコントロールの程度(非コントロール、部分的にコントロール、完全にコントロール)を模式的に示している。生活習慣は、4つの構成要素(運動と喫煙、飲酒と食習慣)すべてを考慮した研究はなく、また、どの構成要素も深く分析されていないため、圧倒的に最も過小評価されている領域である。半数以上の研究では患者のコホートが厳密に分類されておらず、残りの研究では均質な基準が採用されていないため、アルツハイマー病の病期分類も難問となっている。薬物の影響の評価は、非健常高齢者におけるポリファーマシーや、健常者とアルツハイマー病患者における非鎮痛性分子への限定的な注意を考慮すると、不十分である。一方で、うつ病の重大な重要性や、健常者とアルツハイマー病のコホートでは年齢と性別のバランスをとる必要性についての認識が高まっているように思われる。
図2 様々な因子に及ぼされる制御の程度を表したもの
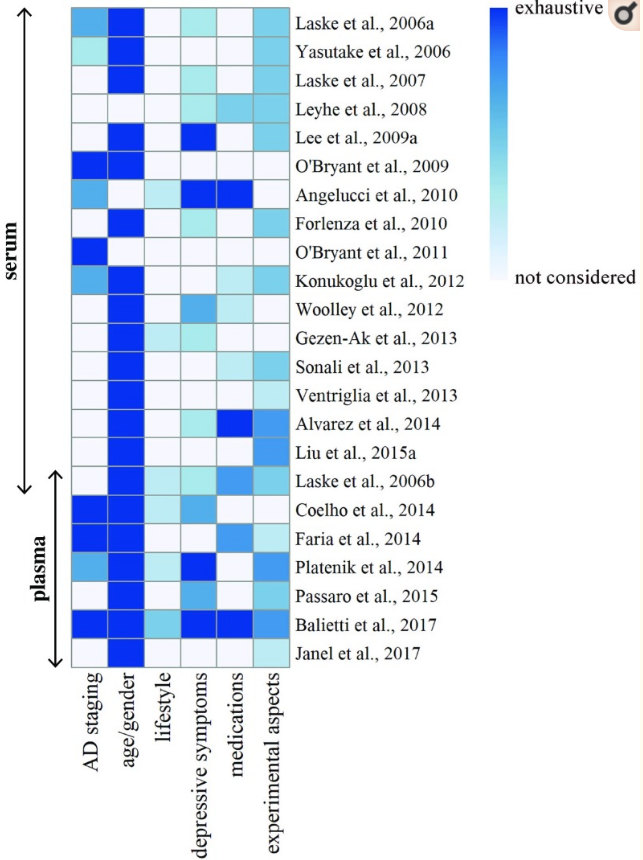
ヒートマップは、アルツハイマー病の可能性のあるバイオマーカーとして血液中のBDNFを検査した研究でバイアスを導入する可能性のある各因子に作用しているコントロールのレベル(色の値で示される)を概説している。色は、以下のカテゴリに基づいて、非制御(白)から完全に制御(紺色)までの範囲である。アルツハイマー病ステージング、(1)考慮されていない、(2)FAS(Functional Assessment Staging)スコアによって定義される、(3)MMSE(Mini Mental Stage Examination)スコアによって定義される、(4)CDR(Clinical Dementia Rating)スコアによって定義される、年齢/性別、(1)健常者コホートとアルツハイマー病コホートの差を調整していない、(2)健常者コホートとアルツハイマー病コホートの差がない、または健常者コホートとアルツハイマー病コホートの差を調整した。ライフスタイル、(1)評価なし、(2)1因子の評価、(3)2因子の評価、(4)3因子の評価、(5)4因子の評価、抑うつ症状、(1)評価なし、(2)うつ病の臨床診断を受けた患者の除外または体重の評価、(3)抑うつ症状の評価。うつ病症状、(4)うつ病の臨床診断を受けた患者又は体重の評価を受けた患者を除外し、抑うつ症状を評価する、薬物療法、(1)評価しない、(2)アルツハイマー病患者における精神活性薬の評価、(3)アルツハイマー病患者における精神活性薬及び非精神活性薬の評価、(4)アルツハイマー病患者及び健常者における精神活性薬の評価。(5) アルツハイマー病患者と健常者における精神活性薬及び非精神活性薬の評価、実験的側面、(1)評価しない、(2)データの正常性の評価、(3)採血時間の管理、(4)データの正常性の評価と採血時間の管理、(5)データの正常性の評価と採血時間の管理、保存期間に関する情報。
実験的な問題では、保存期間に関する情報が全くないことが最も驚くべき点であるが、これは必ずしも標準化の欠如を意味するものではない。最後に、1つの研究で血清と血漿を試験したという事実は、2つのマトリックスの異なる、あるいは補完的な性質を明らかにするために、同じコホートで2つのマトリックスを比較する必要性を強調している。
このレビューから導き出された主な結論は、認知症とは無関係に循環中のBDNFに影響を与える因子をコントロールできていないために、結果の比較可能性と拡張性が決定的に損なわれているということである。アルツハイマー病 のような複雑な病態のバイオマーカーとしての循環 BDNF の実際の価値と信頼性を明らかにするためには、各因子の重みの解明と方法論の標準化に向けた更なる研究が急務である。
