Contents
Pathogenic antibodies induced by spike proteins of COVID-19 and SARS-CoV
viruses
www.researchsquare.com/article/rs-612103/v1
キーワード COVID-19感染症、病原性抗体、抗スパイク抗体、新しい発症メカニズム
COVID-19ウイルスおよびSARS-CoVウイルスのスパイクタンパク質によって誘導される病原体抗体
Huiru Wang1*, Qiuchi Chen2, Yue Hu3, Xiancong Wu2, Lin Dai2, Yuekai Zhang3, Fang Li2, Jinfeng Lu3, Yuxing Chen2, and Xiaoling Liu2*.
1. Huirui Biopharma, Co., Ltd. 中国、杭州
2. 華安 McAb バイオテクノロジー有限公司 杭州、中国
3. Biolynx Technology (Hangzhou), Co., Ltd. 杭州、中国
概要
COVID-19やSARS-CoVなどの高病原性コロナウイルスのスパイク蛋白質に特異的な抗体の病原性について,ウイルスフリーマウスモデルを用いて検討した。その結果、これらの病原性抗体は、ADAA(Antibody Dependent Auto-Attack:抗体依存性自己攻撃)のメカニズムにより、損傷した肺上皮細胞などの宿主の脆弱な細胞や組織を標的として結合し、自己攻撃的な免疫反応を開始し、ARDS、サイトカインの放出、死亡などの重篤な病態を引き起こすことがわかった。また、この病原性抗体は、腎臓、脳、心臓などにも炎症や出血を引き起こす。さらに、病原性抗体は未成熟な胎児組織に結合し、妊娠マウスの流産、産褥、死産、新生児死亡の原因となる。これらの病原性抗体の宿主への結合を阻害することにより、COVID-19のパンデミックに対抗するための新しい臨床的介入策を開発することができる。さらに、本研究で検討されたADAAの新しい概念は、高病原性インフルエンザ感染症など、他の感染症にも適用できる可能性がある。なお、試験した7つのモノクローナル抗体のうち、有意な病原性を示したのは2つだけであり、抗スパイク抗体の大半は非病原性である。
コロナウイルス感染症2019(COVID-19)のパンデミックは、世界の人々の健康と経済にとって大きな脅威となっている1,2。COVID-19の感染発症から1週間後には、臨床症状が重篤化し、低酸素血症や呼吸困難が進行し、17%の患者が急性呼吸窮迫症候群(ARDS)に急速に発展し、そのうち65%の患者が多臓器不全により悪化して死亡することがある3,4,5。同様の臨床的特徴は、重症急性呼吸器症候群(SARS)ウイルス(SARS-CoV)6,中東呼吸器症候群(MERS)ウイルス(MERS-CoV)7,鳥インフルエンザウイルス(H1N5およびH7N9)など、他の高病原性呼吸器ウイルスに感染した患者でも観察されている8,9。また、重症化した時点でウイルス量が低かったり、検出されなかったりしたケースもあり10,ウイルスだけではない他の死因があったことが示唆されている。感染者の死には、過剰に反応する免疫反応とそれに伴うサイトカインストームが重要な役割を果たしていることが報告されているが11,12,13,何がサイトカインストームを引き起こしたのかは謎のままである。我々は、マウスモデルにおいて、妊娠中のマウスに抗インフルエンザ血清を注射すると、生まれた子マウスに肺炎が誘発されるという予想外の発見をした14。そこで我々は、高病原性ウイルスによって誘導されるある種の抗体は、宿主の細胞や組織を標的とすることで、それ自体が病原性を持つのではないかと考えた。この仮説を証明するために、本研究では、抗COVID-19ウイルス抗体を含む抗コロナウイルス抗体の病原性効果を調べた。
調査結果
省略~
以上のことから、COVID-19ウイルスやSARS-CoVウイルスのスパイクタンパク質に特異的なある種の抗体は、生体内ではヒト肺上皮細胞などの病気の細胞に結合することで、免疫系を誤作動させて宿主を攻撃する可能性があることが、試験管内試験のアッセイ結果から示された。我々は、この抗体の作用機序を「抗体依存性自己攻撃(ADAA)」と名付けた。REGN10987の抗体は、病気の細胞だけでなく、健康な細胞にも低い割合ではあるが結合するため、生体内の免疫反応を活性化することで、より高いADAAの可能性を持っていると考えられる。
省略~
以上のことから、COVID-19ウイルスやSARS-CoVウイルスなどのコロナウイルスのスパイクタンパク質に特異的なある種の抗体が、抗体依存性自己攻撃(ADAA)のメカニズムにより、生体内で胎児や新生児の著しい死亡や、肺などの全身性の炎症や傷害を誘発することが、ウイルスフリー動物モデルの生体内で証明された。この結果は、重症のCOVID-19患者の臨床観察結果と一致している5。したがって、抗COVID-19 S1,抗SARS-CoV S、B38,およびREGN10987の特定の抗体は病原性を有し、ADAAを誘発する。COVID-19の重症感染症の重篤な状態は、この病原性抗体とADAAが原因と考えられる。一方、抗COVID-19 N、抗SARS-CoV N、CR3022-b6の抗体は、生体内試験で有意な副作用を誘発しなかったことから、非病原性であると考えられる。
炎症性サイトカイン
抗スパイク抗体の病原性のさらなる証拠として、マウスの仔の血清中の単球走化性タンパク質1(MCP-1)腫瘍壊死因子-(TNF-)インターロイキン-4(IL-4)IL-6,およびIL-10のサイトカインレベルを、製造者の指示に従ってマルチプレックスLuminexアッセイキット(Millipore社)を用いて測定した。MCP-1の結果を図4にまとめた。
病原性の抗COVID-19 S1とREGN10987の両方が、有意に高いレベルのMCP-1を誘導した(図4)。組織学的変化の驚くべき結果と一致して、病原性の抗COVID-19 S1と非病原性の抗COVID-19 Nからなる混合抗体を用いた処理は、抗COVID-19 S1単独で誘導されたものと比較して、MCP-1のサイトカインレベルを有意に減少させた(P < 0.001)(図4)。さらに、病原体であるREGN10987と、CR3022-b6およびCC12.3の2つの非病原体抗体からなる混合抗体で処理した場合も、REGN10987単独で誘導された場合と比較して、MCP-1のレベルを有意に低下させた(P < 0.001)(図4)。他のサイトカインのレベルは有意に上昇しなかったが、これは生まれたばかりのマウスの仔の免疫力が未発達であったためと思われる。この結果は、病死率(表2)および組織学的変化(図3)の結果と一致した。これらのデータから、1)病原性抗体単独では、高濃度の炎症性サイトカインを誘導し、サイトカインストームやサイトカイン放出症候群(CRS)を引き起こす可能性があること、2)非病原性抗体の共存により、病原性抗体によって誘導される炎症性サイトカインの放出を抑え、病原性抗体によって引き起こされる可能性のあるサイトカインストームやCRSを防ぐことができることが示された。
In vivoでのマウス仔の多臓器への抗体結合
抗COVID-19スパイク抗体の病原性を示す証拠として、方法に記載されているように、免疫蛍光染色を用いてマウスの仔の組織への生体内試験抗体結合を検出した。
重症化したマウスの仔の心臓、肝臓、腸を採取した(図5)。これらのマウスの仔は、抗COVID-19 S1,抗SARS-CoV S、REGN10987,B38の病原体抗体を注射したデイムに引き渡された(図5)。非病原性抗体である抗COVID-19 N、抗SARS N、CR3022-b6を投与した子犬の組織では、ヒトIgGもウサギIgGも有意に検出されなかった(図5)。この結果は、特定の抗COVID-19スパイク抗体が胎盤を通過して胎児の組織に結合し、自己攻撃型の免疫反応を活性化し、肺、腎臓、心臓、脳などの複数の臓器に組織的な炎症と傷害をもたらしたことを示している。この結果は、組織学的変化と一致している(図3
病原性抗体の胎児や病変組織への結合
病原性抗COVID-19スパイク抗体のヒトにおける病原性をさらに評価するために、最も高い病原性を持つREGN10987を用いて、様々なヒト胎児組織、あるいは組織アレイスライド(US Biomax)から得た複数のヒト疾患組織に対する抗体結合を試験した。その結果を図6に示す。抗体REGN10987は、肺、心臓、腎臓、脳、膵臓、肝臓、胸腺、精巣などの複数のヒト胎児組織に結合したが、食道には結合しなかった(図6A)。さらに、REGN10987は、網膜とコロイド、強膜、眼球の胎児組織にも結合した(データは示していない)。このデータは、未成熟な胎児組織が、REGN10987のような病原性抗体に対して脆弱であることを示している。さらに、REGN10987は、ヒトの炎症組織や呼吸器系、循環器系、泌尿器系、消化器系のがん組織にも広く結合した(図6B〜6C)。炎症組織は、肺炎、気管支炎、気管支拡張症、弁膜症、リウマチ性弁膜症、心筋炎、食道炎、胃炎、胆嚢炎、虫垂炎、膵臓炎、肝炎などの患者のものであった。癌組織は、小細胞肺癌、腎明細胞癌、粘液腫の患者のものであった。この結果から、炎症組織や癌組織のように活発に増殖している細胞や組織の多くは、REGN10987のような病原性抗COVID-19 S1抗体に対して脆弱であることがわかった。
病原性抗体のヒト健常組織への結合性
病原性抗COVID-19 S1抗体の病原性を示すより多くの証拠として、REGN10987と、組織アレイスライド(US Biomax, FDA999w)からの複数の健康なヒト組織を使用した。この組織アレイスライドは、FDAの抗体交差反応性試験のガイドラインに沿って、ヒトのほとんどの組織を網羅する32種類の正常なヒトの臓器から構成されている。その結果、REGN10987は、ヒトの健常組織である肺、腎臓、膵臓、胃、腸、副腎、末梢神経、甲状腺、脾臓、下垂体、精巣、前立腺、骨髄、がんの隣接する正常組織である子宮頸部に有意に結合した(図7)。さらに、REGN10987は、副甲状腺、心膜中皮、眼の隣接する正常な強膜の組織にも結合した(データは示されていない)。これらのデータは、REGN10987のようなある種の抗COVID-19 S1抗体は、健康なヒトの組織に結合し、自己攻撃型免疫反応(ADAA)を活性化し、IN VIVOの重篤な有害反応を誘発する可能性が高いため、高い病原性を有することを示している。この結果に基づき、COVID-19感染時に病原性抗体を臨床的に検出することは、重篤な感染症を発症した患者の結末を予測するのに役立つと考えられる。
以上、本研究の試験管内試験および生体内試験のデータから、COVID-19スパイクタンパクに特異的な特定の病原性抗体が、重篤なCOVID-19感染症の原因となり、ADAAを介してCOVID-19感染症中に重篤な合併症を引き起こす可能性があることが明らかになった。さらに、病原性抗体は、成熟していない胎児の細胞または組織に結合し、妊娠中の女性の流産、産後の陣痛、死産、および新生児死亡を引き起こす可能性がある。
なお、本研究のモノクローナル抗体のデータによると、COVID-19ウイルスによって誘導される抗COVID-19スパイク抗体のうち、病原性抗体は全体の30%以下であるため、大部分(70%以上)は非病原性であることがわかっている。
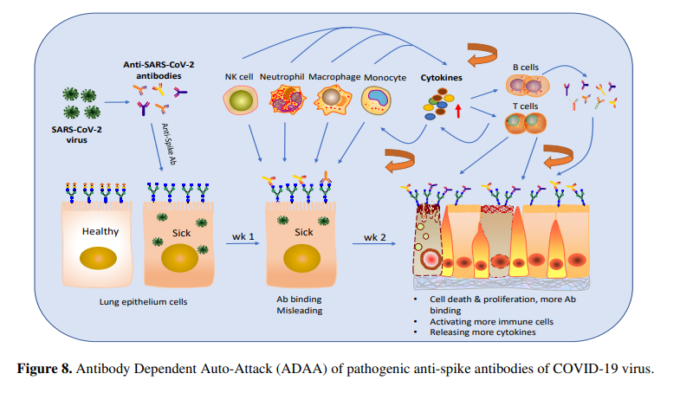
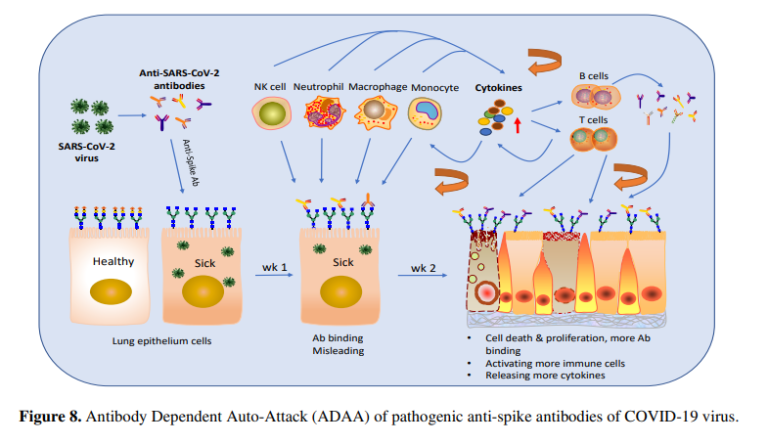
考察
本研究では、COVID-19ウイルスやSARS-CoVウイルスなどのコロナウイルスのスパイクタンパク質に特異的な特定の抗体の病原性の役割と新しい作用機序(ADA)を明らかにした(図8)。我々は、マウスモデルにおいて、抗インフルエンザ免疫血清を事前に投与すると、インフルエンザウイルスのみを感染させたマウスよりも重篤な感染症を引き起こすことを発見していた14。Wangらは、抗SARS-CoVスパイク抗血清がIN VITROにおいて抗体依存性増強(ADE)によりSARS感染を促進することを報告した22。Liuらは、SARS-CoVワクチンによって誘導された抗SARS-CoVスパイク免疫血清が、SARS-CoV感染マカクのモデルにおいて、MCP1およびIL-8の産生、単球またはマクロファージのリクルートおよび集積を促進することにより、急性肺傷害を引き起こすことを報告した23。これまでに報告されているこれらの抗スパイク抗体の作用機序(MOA)は、抗体がウイルスの感染力を増強するというADEベースのものである24。今回の研究では、病原性抗体が宿主の脆弱な細胞や組織に結合し、免疫反応を誤らせて宿主自身を攻撃するという、自己細胞を標的とした作用機序を初めて明らかにした(ADAA)。また、本研究では、高病原性ウイルス感染症の新たな病原性メカニズム(MOP)を解明した。このMOPは、COVID-19ウイルスやSARS-CoVウイルスなどの高病原性ウイルスが誘導する病原性抗体によって引き起こされる。さらに、この病原性抗体は、ADAAを介して、COVID-19長期不調組を含む感染症関連自己免疫疾患の原因に関係している可能性がある。
抗ウイルス抗体の二重の役割
従来の概念では、感染性病原体によって誘導された抗体は、病原体を中和して感染症を予防・治療することができるため、宿主を保護するものと考えられてた。しかし、このような抗体の役割は二面性を持っている。理論に縛られることなく、我々は、一部の抗体が宿主の細胞や組織と交差反応し、自己細胞や自己組織を攻撃する免疫反応を引き起こす可能性があることに気づいた(ADAA)。今回の研究では、COVID-19ウイルスやSARSウイルスの抗スパイク抗体が、そのような病原性を持つことが示された。
シアル酸は、細胞膜の外側にある粘膜の主要な構成要素であり、主に生物学的マスクや受容体として作用する25。シアル酸を持つ細胞や組織は「自分」として認識される25。シアル酸が失われると、細胞構造は「非自己」25となり、免疫反応を活性化させることができる。また、シアル酸は、コロナウイルスやインフルエンザウイルスなど、いくつかのウイルスの受容体の重要な付着分子でもある25,21。このようなウイルスに感染すると、肺上皮細胞などの感染細胞上のシアル酸は、COVID-19ウイルスなどのコロナウイルスの受容体破壊酵素(RDE)や、インフルエンザウイルスのシアリダーゼによって除去・破壊される可能性がある。細胞表面のシアル酸が欠損したダメージを受けた細胞は、ウイルスが誘導する病原性抗体に対して脆弱になる(図8)。例えば、今回の研究では、SARS-CoV-2スパイクとSARS-CoVスパイク糖タンパク質に特異的な抗体が、細胞表面のシアル酸が欠損した損傷した肺上皮A549細胞(図1)や腎臓胚HEK-293細胞に有意に結合することが示された。この抗体の結合は、自己を攻撃する免疫反応を活性化したり、誤解を招いたりして、生体内の複数の臓器の損傷を誘発する可能性がある。例えば、COVID-19のS1タンパク質やSARS-CoVのSタンパク質に特異的な抗体を妊娠中のマウスに注射すると、図1〜4および表2に示すように、胎児や新生児の死亡、ダミーで生まれたマウスの仔の複数の臓器の傷害が誘発された。一方、非病原性の抗体である抗COVID-19 Nおよび抗SARS Nは、生体内で大きな傷害を誘発しなかった。抗COVID-19 N抗体も抗SARS N抗体も、健康なA549細胞にも損傷を受けたA549細胞にも有意に結合しなかった(図1E)。胎児モデルを選択したのは、表面の糖タンパク質を含む多くの胎児組織が未成熟であり、病原性抗体に対して脆弱であるためである。
COVID-19のS1(S-RBD)タンパク質に特異的な7つの天然由来のヒトモノクローナル抗体15,16,17,18,19,20について、上述の試験管内試験アッセイを用いて、その病原性を分析した。その結果、1つ(85.7%)を除くすべての抗体が、健常なA549細胞に結合しなかった。しかし、B38とREGN10987の2つの抗体(28.6%)は、損傷したA549細胞に有意に結合した(図1C)ため、病原性の可能性のある抗体として選択し、生体内試験の動物モデルでさらに確認した。ウイルスフリー動物実験の結果、図1〜4および表2に示すように、この2つの抗体だけでも高い病原性を示し、ダミーマウスから生まれた仔マウスの胎児および新生児の著しい死亡や複数の臓器の損傷を誘発した。一方、7つのモノクローナル抗COVID-19 S1抗体のうち、もう1つの抗体であるCR3022-b6はコントロール抗体として機能し、生体内試験で有意な傷害を誘発しなかった(図1-4および表2)。これらのデータから、試験管内試験アッセイは潜在的な病原性抗体の迅速なスクリーニングに有用であり、ウイルスフリーの動物モデルはこれらの特定の抗体の病原性の確認に有用であることが示された。なお、マウス胎児に対する病原性抗体の影響は、抗体が母親の組織に結合した場合には軽減される可能性があることに留意すべきである。
病原性抗体は、COVID-19感染症のような高病原性感染症の際に誘発される可能性がある。病原性抗体とそのADAA機構の発見は、ウイルス感染症、特にCOVID-19感染症のような病原性の高いウイルス感染症の重篤な感染症、重篤な合併症、後遺症が発生する可能性のある病態形成機構(MOP)の謎を解明する可能性がある。このことは、サイトカインストームやサイトカイン放出症候群(CRS)の原因や、感染症関連の自己免疫疾患(COVID-19長期不調組26が罹患したものを含む)感染症関連の癌、その他病原性抗体によって誘発される可能性のある障害についても説明できるかもしれない。病原性抗体によって引き起こされる病気や状態には、さらに、感染症に関連した妊娠中の女性の流産、産後の陣痛、死産、新生児死亡などが含まれる。
ウイルス感染症の新しい発症メカニズム
今回の研究の試験管内試験および生体内試験のデータは、COVID-19ウイルスのような高病原性ウイルスの新しいMOPを裏付けるものである。
このMOPには COVID-19ウイルスのような高病原性呼吸器ウイルスは、通常、感染後1週間以内に、肺などの標的臓器に局所的な炎症やシアル酸が欠損した細胞損傷などの最初の一次傷害を引き起こす;
2)1週間目から病原性抗体を含む抗ウイルス抗体が上昇する。病原性抗体は、標的臓器(例えば肺)の損傷した細胞や炎症を起こしている細胞に結合する(図8)。肺など)に結合し(図8)また同様の損傷を受けた他の臓器(腎臓、脳、心臓など)にも結合する。
3) 抗体の結合は、自己の細胞や組織を攻撃するように免疫反応を活性化させ、誤った方向に導き(ADAA)さらなる損傷(二次的な損傷)を誘発する。
4) 二次的な損傷は、一次的な損傷にさらなる損傷を持続的に加え、雪だるま式に増えていき、1週目から2~3週目にかけて抗体がピークレベルに達すると、ARDS、サイトカインストーム、さらには死などの深刻な状態を引き起こす(図8)。
5)病原性抗体に惑わされた自己攻撃型免疫反応(ADAA)は持続性があり、ウイルスクリアランス後も抗体が存在し続ける限り蓄積し、自己免疫疾患を引き起こす可能性がある。
通常のインフルエンザ感染症で見られるように、一次感染は限定的で短く、ウイルスが除去されると減少する。つまり、ウイルス自体はARDS、サイトカインストーム、死亡などの重篤な状態を引き起こすのに十分ではないということである。一方、病原性抗体による二次災害は、ウイルスよりもはるかに長く持続し、肺以外の炎症組織や臓器にも非特異的に結合するため、より長く、より広く、より付加的なものとなる。そのため、病原性抗体によるADAA反応が重なると、ARDS、サイトカインストーム、死などの重篤な状態に陥る可能性がある。
COVID-19感染症や高病原性インフルエンザ感染症などの重篤な呼吸器ウイルス感染症の患者の大半が1週目以降に死亡し、特に感染経過の2〜3週目に死亡した理由は、抗体のピークレベルの時期と一致していることから、新MOPで説明することができる3,27。また、この新しいMOPは、1918年のインフルエンザパンデミックで重症または致死的な感染の大半が若年層に起こった理由を説明することができる27。これは、若年層が病原性抗体を含むより高いレベルの抗ウイルス抗体を誘導することができたからである。同様に、インフルエンザウイルスなどの他の感染性病原体によって誘導される特定の病原性抗体も、このMOPを介して重篤な副作用や自己免疫疾患を引き起こす可能性がある(研究継続中)。
病原性抗体の影響を受けやすい細胞や組織
図6に示すように、病原性の高いREGN10987抗体は、大多数のヒトの胎児組織や炎症組織、さらには特定のがん組織に結合した。癌組織を含むそれらの組織の共通の特徴は、活発に増殖する細胞で構成されていることである。そのため、それらの細胞や炎症組織は病原性抗体に対して脆弱であり、病原性抗体(ADA)との相互作用は、
1)重篤な感染症、特にCOVID-19感染症などの高病原性ウイルス感染症、
2)ARDS、サイトカインストーム、サイトカイン放出症候群(CRS)などの感染症の重篤な合併症、
3)肺炎や腎不全などの感染症関連の炎症などの原因
となる(図1-4)。さらに、成熟していない胎児の細胞や組織は、病原性抗体に対して脆弱である(図6A)。このように、ADAAを介した病原性抗体は、妊娠中の女性の流産、産褥、死産、新生児死亡の原因となることがある(図1B、1C)。
病原体抗体と自己免疫疾患
自己免疫疾患の多くはウイルス感染と関連している28が、その発症メカニズムはこれまで不明であった。今回の研究で、ほとんどの炎症組織が病原性抗体やADAAに対して脆弱であることが初めて明らかになった(図6B)。ほとんどの自己免疫疾患では、慢性的な炎症が見られる。感染症が発生すると、病原性抗体を含む抗体が誘導され、数ヶ月から半年程度持続する。病原性抗体は、自己免疫疾患の既存の脆弱な炎症組織に容易に結合し、免疫反応を誤らせて自分の組織を攻撃してしまう。このADAAのプロセスは、抗体が上昇して重大な反応を誘発するため、反復的かつ加算的になる。病原抗体とADAAによって引き起こされる自己免疫疾患の発生時間と発症経過は、脆弱な細胞や組織の量と病原抗体の量に応じて、短くも長くもなる。病原抗体は一般的に数ヶ月から半年程度持続するため、その間、特に抗体量がピークに達する時期に自己免疫疾患が発症することがある。
COVID-19の長期不調組が報告されているが、その原因は謎のままだ26。今回の研究では、COVID-19 long haulersの発症メカニズムの可能性が示された。回復したCOVID-19患者ではウイルスが除去されたにもかかわらず、抗ウイルス抗体が残り、数か月から半年以上も存在する可能性がある。ある種の病原性抗体は、COVID-19感染時に誘導された炎症細胞などの脆弱な細胞や組織に結合し、多臓器の慢性炎症などの持続的な有害反応を引き起こす可能性があった。このように、ADAAのメカニズムでは、病原性抗体もCOVID-19の感染による長期的な影響の原因となり得る。例えば、REGN10987のような病原性の高い抗スパイク抗体は、末梢神経に結合し、筋肉、視覚、味覚などの異常を引き起こす可能性がある。同様に、鳥インフルエンザウイルスなどの他の感染性病原体によって誘導される病原性抗体は、ギラン・バレー症候群(GBS)などの感染症による副作用や自己免疫疾患の原因となる可能性がある。また、HIVなどの慢性ウイルス感染症では、病原性抗体が長期間にわたって細胞増殖を繰り返し促し、細胞増殖がコントロールできなくなると、感染症に起因するがんが発生する可能性がある。
よりよいワクチン
病原性のある抗COVID-19 S1抗体に、同量の非病原性の抗COVID-19 N抗体を混合すると、抗COVID-19 S1抗体を単独で注射した場合に比べて、混合抗体による病気や死亡率が著しく低下することは驚くべきことであった(表2,図1C)。同様の結果は、高病原性のREGN10987でも、REGN10987とCR3022-b6およびCC12.3の2つの非病原性モノクローナル抗体を混合した抗体でも観察された(表2および図1C)。このデータから、非病原性の抗体を共存させることで、病原性の抗体のADAAを低減できることが示唆された。このように、多価の抗体を誘導できるワクチンは、少なくとも1種類の抗体が、より少ない副反応を誘導する非病原性の種類である方が安全であると考えられる。このようなワクチンの一例として、ウイルスの複数の抗原に特異的な多価抗体を誘導する従来の不活化ウイルスワクチン(例えば、不活化COVID-19ワクチン)が挙げられる。別の例として、SARS-CoV-2ウイルスのスパイクタンパクだけでなく、ヌクレオカプシドタンパクや非スパイクタンパクにも特異的な抗体を誘導することができる組換えまたはmRNAのCOVID-19ワクチンは、より安全性が高いと考えられる(特許出願中)。作用機序は不明だが、抗COVID-19 S1も抗COVID-19 Nも同じ抗原に結合しないことから、非病原性抗体が競合結合によって病原性抗体のADA作用に影響を与えたとは考えられないという。REGN10987も他の2つの非病原性抗体も、COVID-19ウイルスのS1タンパク質の同じエピトープに結合しない。非病原性抗体は、病原性抗体が脆弱な細胞や組織に付着するのを希釈したり、空間的に妨害したりすることで、病原性抗体のADAに影響を与えているのではないかと考えられる。
新しい発症メカニズムに基づく新しい臨床介入法
病原性抗体によって誘導される高病原性ウイルス感染症の新たなMOPに基づき、病原性抗体の宿主の脆弱な細胞、組織、臓器への結合を遮断することにより、COVID-19感染症の重篤な病態を治療・予防するための新規の臨床介入薬が開発される可能性がある。例えば、重篤なCOVID-19感染症の治療には、以下のような製品やアプローチが有効であると考えられる。
1) 重篤な状態にある患者に対しては、患者の血漿を感染していない健康なヒトの血漿と交換するなど、病原性抗体を除去することができる治療法が有効な場合があり、可能な限り早急に実施されるべきである。
2)回復した患者だけでなく、健康な人から採取した免疫グロブリン製剤、血清、血漿は、病原性抗体の結合を希釈・遮断することで症状の緩和に役立つ可能性がある。
3)ウイルス抗原や抗原断片、合成ペプチドなどの病原体由来の製品が有効な場合がある(病原性抗体の中和)(特許出願中)。
重篤なCOVID-19感染症の診断には、抗COVID-19スパイク抗体のレベルを決定することが重要であり、重篤な感染症の患者の状態を予測するのに役立つと考えられる。これは、ウイルスは1週間後には検出されなくなるが、ウイルスによって誘導される抗体は1週目から上昇し、2~3週目にピークレベルに達し、ARDS、サイトカインストーム、死亡などの重篤な状態の発生を伴うからである。抗COVID-19スパイク抗体の高値は、感染症の悪化を示していると考えられる。
要約
以上のように、今回の研究では、ウイルス感染症における「病原性抗体」の役割が明らかになった。これらの病原性抗体は、我々が「抗体依存性自己攻撃」(ADAA)と呼んでいる新しい作用機序で働く。特に、COVID-19などの高病原性呼吸器ウイルス感染症のADAAを調べた。病原性抗体は、感染時に誘導され、活発に増殖している細胞などの脆弱な細胞や組織に結合し、持続的な自己攻撃免疫反応を開始し、ARDS、サイトカインストーム、死などの重篤な症状を引き起こす。さらに、ADAAを介した病原性抗体は、COVID-19長期不調組が経験するような感染症関連の自己免疫疾患にも関与している可能性がある。病原性抗体のADAAに基づく改良型ワクチンを含む、診断と治療のための新しい臨床介入が開発される可能性がある。また、本研究で解明されたADAAの新しい概念やメカニズムは、高病原性インフルエンザ感染症など他の感染症にも応用できる可能性がある(研究継続中)。