Contents
The Fatty Acid Lipid Metabolism Nexus in COVID-19
www.mdpi.com/1999-4915/13/1/90/html
Jerome E. Tanner 1 andCaroline Alfieri 1,2,*著
1ウイルス病原体研究所、研究センター、CHU Sainte-Justine, 3175 Côte Sainte-Catherine Road, Montréal, QC H3T 1C5, Canada
2モントリオール大学微生物学・感染学・免疫学部門、2900 Boul. Édouard-Montpetit, Montréal, QC H3T 1J4, カナダ
公開:2021年1月11日
要旨
早期重症急性呼吸器症候群(SARS)-2003やCOVID-19に見られる腸症状は、腸、肝臓、膵臓でウイルスが複製されている証拠である。病的肥満者における脂質代謝異常は、COVID-19免疫応答に悪影響を与え、疾患の重症度を増加させる。このような観察は、COVID-19における脂質代謝の重要性と一致しており、腸は疾患の治療標的としてだけでなく、介入のための部位であることを示唆している。
複雑な脂質膜の形成およびコロナウイルスタンパク質のパルミトイル化は、ウイルスの複製および組み立ての際に不可欠である。脂肪酸合成酵素(FASN)の阻害およびAMP活性化プロテインキナーゼ(AMPK)の活性化による脂質異化作用の回復は、SARS-coronavirus-2(CoV-2)と密接な関係にあるコロナウイルスの複製を阻害する。
また、FASN阻害薬であるオルリスタットとAMPK活性化薬であるメトホルミンは、コロナウイルスの複製を阻害し、全身の炎症を抑えて免疫の恒常性を回復させる可能性があることが、試験管内試験での知見と臨床データから明らかになっている。このような観察結果は、これらの薬剤の既知の作用機序に加えて、脂肪酸脂質代謝を標的とすることでウイルスの複製を直接阻害し、COVID-19に対する患者の反応にポジティブな影響を与える可能性を示唆している。
キーワード
小胞体ストレス応答、アンフォールドタンパク応答、mTORC1,SREBP-1,非構造タンパク質、膜タンパク質、スパイクタンパク質、エンベロープタンパク質、複製オルガネラ、抗ウイルス剤
1. 序論
すべてのウイルスは、効率的な複製のためのエネルギーと高分子を生成するために、細胞の異化と同化を再目的としているが、SARS-coronavirus-2(CoV-2)の脂質代謝リプログラミングのメカニズムとその結果については、ほとんど研究されていない。本研究では、COVID-19を用いて脂肪酸脂質代謝を生物学的、細胞学的、高分子レベルで検討した。この理解に基づいて、我々は、ウイルスの脂質依存性を直接標的とするだけでなく、SARS-CoV-2感染に対する患者の応答を強化する2つの合理的な治療オプションを提案する。
2. COVID-19における消化器系の関与
哺乳類の細胞の増殖と、より大きな器官系の形成と維持には、エネルギーの十分な供給と、生体膜の主要な構成要素である脂肪酸リン脂質を含む細胞構築ブロックを必要とする[1]。膜リン脂質組成とアシル長の変化は、より大きな生物学的プロセスに影響を与える細胞膜の生物物理的特性を決定する。哺乳類の脂質の吸収、合成、および全身の恒常性を維持するための組成は、主に腸、肝臓、脂肪組織で制御されている[2]。C型肝炎ウイルス(HCV)に例示されるように、エンベロープされたRNAウイルスは、脂質の恒常性を変化させてウイルスの複製を促進し、感染性を高めることができる[3]。COVID-19患者に最近見られた初期の消化器症状は、SARS-2003患者によく見られたもので、下痢、吐き気、嘔吐、腹痛などが含まれている[4,5,6,7,8]。さらに、患者の便サンプルおよび下水から生菌ウイルスが検出され、これは地域社会への感染拡大に寄与する可能性がある [6,9,10,11,12]。血清アラニンアミノトランスフェラーゼ、アスパラギン酸トランスアミナーゼ、血糖値の上昇から明らかなように、SARS-CoV 患者は、病気の進行に伴って軽度から重度の肝機能障害または膵臓機能障害を発症する [13,14,15]。肝臓および腸の損傷の程度は、致死的なSARS-2003症例の生検で明らかになった [16]。肝臓および腸管組織では、肝細胞の脂肪変性、白濁した腫脹、アポトーシスおよび点状壊死が認められ、消化管壁組織および肝・膵管ではリンパ球浸潤を伴う局所出血および血管のうっ血が認められた。SARS-CoV感染でみられる一過性または恒久的な膵臓機能障害 [15] はβ細胞の損傷の結果であり、自己反応性T細胞およびマクロファージのβ細胞炎症活性化に起因している可能性が高く、広範囲に及ぶ場合には劇症的で恒久的な糖尿病 [17] につながる可能性がある。これらの異なるSARS-CoVの消化器疾患はすべて、腸、肝、膵臓細胞がアンジオテンシン変換酵素2(ACE2)ジペプチジルペプチダーゼ4(CD26)およびCD209Lというコロナウイルス受容体のうちの1つ以上を発現しているという事実に起因している [18,19,20]。SARS-2003およびCOVID-19で指摘された腸、肝臓および膵臓のβ細胞病変の共通性は、消化管が脂質代謝を変化させる可能性のある重要な疾患部位であることを示唆している。
3. SARS-CoV-2 に感染した肥満患者における全身および細胞性脂肪酸レベルの上昇の潜在的影響
入院を必要とするCOVID-19患者の数は、病的肥満(BMI>40)の患者では3倍になる[21]。2型糖尿病(2型糖尿病)との併存疾患として存在する場合、肥満は患者の死亡リスクを10倍に増加させる [14]。
肥満に起因する多数の代謝障害は、低悪性度炎症の慢性状態とウイルス感染に対する宿主応答の低下に寄与している[22,23]。血清トリアシルグリセロール(TAG)遊離脂肪酸(FFA)およびプロ炎症性アディポカインであるレプチンおよびレジスチンの上昇と、TNF-α、IL-6,IL-1β、IL-18,およびMCP-1の上昇が、抗炎症性アディポカインであるアディポネクチンの量を低下させると同時に、自然免疫系および適応免疫系を総称して弱める [24]。肥満個体の感染後、I型インターフェロンレベルが低下し、ナチュラルキラー細胞応答が減衰する。この減衰した応答は、適応免疫応答の低下とともに、IL-12,IL-18,IFNγ、およびIL-2応答の低下のサイクルを開始する [22,23]。長期的な肥満はまた、慢性的な炎症と腸粘膜の完全性の喪失を促進する [25,26]。肥満によって引き起こされる腸管の完全性の低下と相まって免疫機能が低下することで、SARS-CoVは一次腸内感染を確立する機会が増え、循環伝播へのアクセスが容易になると推測される。
細胞レベルでは、肥満に起因する過剰な脂肪酸の蓄積は、慢性的な小胞体(ER)ストレス応答とアンフォールドタンパク応答(UPR)経路の継続的な活性化を引き起こす [27,28]。正常な状態では、小胞体は、適切なタンパク質の折りたたみ、成熟、およびグリコシル化および分泌タンパク質の指示されたトラフィッキングに必要な細胞機械を提供している。また、小胞体はカルシウムの恒常性と複合脂質の代謝にも必要である。これらのERの要求の不均衡が生じると、進化的に保存されてきたUPR経路が活性化し、タンパク質生産を抑制し、誤って折り畳まれたタンパク質の除去を促進し、細胞脂質の合成を制御しようとする[29]。ERのタンパク質フォールディング能力が過剰になり、機能不全タンパク質が蓄積すると、UPR経路の活性化は、グローバルなタンパク質合成を一時的に減少させ、膜内再構築を介してER体積を増大させ、シャペロンとフォ ルダーゼのアップレギュレーションを介してERフォールディング能力を増大させ、ER関連分解(ERAD)成分とER特異的オートファジーのアップレギュレーションを介してタンパク質ターンオーバー能力を増大させることで、ERの恒常性を回復させようとする [30,31] 。ERの恒常性が達成できない場合、UPRは細胞死プログラムを開始し、生物の利益のために欠陥のある細胞を排除する[32]。細胞による「元に戻すか死ぬか」の決定は、イノシトール要求酵素1(IRE1)活性化転写因子6(ATF6)およびプロテインキナーゼRNA(PKR)様ERキナーゼ(PERK)によって制御され、指示される。重度のERストレスが発生し、ERの恒常性の回復に失敗すると、UPRネットワークは、ER関連分解(ERAD)オートファジー、あるいはアポトーシスによる細胞死を含む追加のSOSメカニズムに関与することを余儀なくされる。ERストレスが慢性的であり、UPR経路がすでに亢進している肥満患者では、SARS-CoV-2の複製によって引き起こされるER上の追加のストレスは、容易に恒常性の回復を超えてアポトーシスとより大きな組織破壊に向けてUPRシグナリングをシフトさせる可能性がある[33]。
4. SARS-CoV-2の複製とウイルスアセンブリ中の脂質の重要な役割
SARS-CoV-2の複製は、新たに合成されたリン脂質または再設計された宿主膜小胞に依存しており、ウイルス複製サイクルを完了させるために、ウイルスゲノムとタンパク質合成の対を調整する複製オルガネラとして機能する [34,35,36,37]。コロナウイルスの複製小器官は、ER-ゴルジ小胞輸送系に由来する200nm幅の二重膜小胞(DMV)で構成されている[38,39]。DMV構造は、新たに合成されたウイルスRNAゲノムと関連するウイルス構造タンパク質をより効率的に濃縮し、ウイルスの組み立てとパッケージングをよりよく可能にするという仮説が立てられている。DMVはまた、自然細胞防御システムによる認識および破壊からウイルスゲノムRNAを遮蔽する役割を果たす可能性がある[40,41]。宿主細胞のER因子および脂肪酸合成の増加[37]と協働して、SARS-CoV-2非構造タンパク質(nsp)3,4,6は複製オルガネラ構造を構築する[42,43]。Nsp3は、大きな多細胞小胞の形成を開始することが示されており、その後、Nsp4の助けを借りて、広範なDMVペアリングと迷路のようなボディに精製される。Nsp6は、細胞のオートファジーおよび膜脂質リサイクルを促進することにより、複製小器官の形成に寄与している[44]。複製オルガネラが完成すると、複製オルガネラはコロナウイルス膜タンパク質の足場として機能し、コロナウイルス膜タンパク質はウイルスRNA-ヌクレオカプシドの組み立てと、それに続くウイルススパイクとエンベロープタンパク質の脂質エンベロープを調整する。組み立てられたコロナウイルス粒子は、スパイクとエンベロープのグリコシル化のためのER-ゴルジ血管系に芽を出し、細胞の分泌経路と細胞外を介して、その後のウイルスの脱出[45]。
SARS-CoV-2の組み立てに安全な場所を提供するだけでなく、ウイルス誘発性オルガネラのリモデリング中に発生するERストレスおよびUPR経路の活性化は、ウイルスによって有利に利用され得る。ERのUPR活性化は、グローバルな脂質合成を刺激する。IRE1 シグナルの UPR 活性化は、適切な RNA スプライシングと X-box binding protein 1 (XBP1) mRNA の翻訳をもたらし、その結果、ステロール調節エレメント結合タンパク質-1 (SREBP-1) と脂肪酸合成酵素 (FASN)、アセチル-CoA カルボキシラーゼ (ACC)、ステアロイル-CoA デサチュラーゼ 1 (SCD1) を含む同化性脂質遺伝子の転写を刺激する [46]。このように、SARS-CoVによって引き起こされるUPRの活性化は、ウイルスおよび複製オルガネラの組み立ての間に必要とされる脂質ストックを提供することができる[46]。追加のウイルスの利点として、脂質ストックの増加は、DMVの腔内容積の拡大を可能にし、結果として、誤って折り畳まれたウイルスタンパク質の有効濃度を減少させ、UPR誘発アポトーシスの可能性を防ぐことができる[29]。
5. SARS-CoVタンパク質への脂質添加の重要な役割
SARS-CoVは、ウイルススパイクおよびエンベロープタンパク質の膜貫通部に隣接する保存されたシステイン残基に脂質鎖を付加することを必要とする(図1)[47,48,49]。脂質の付加は、システインパルミトイル化のプロセスを通じて行われる [50]。システインパルミトイル化は、パルミチン酸(C16:0)または一般的ではないステアリン酸(C18:0)またはアラキドン酸(C20:0)部位をシステイン残基に可逆的に付加し、細胞膜および隣接するタンパク質またはタンパク質ドメイン上の疎水性ポケットに対するタンパク質の親和性を動的に増加させる。膜テザーとして機能するだけでなく、タンパク質のパルミトイル化は、異なる膜コンパートメント間のタンパク質のシャトルリングを促進する[51]。パルミトイル化されたタンパク質は、脂質の付加部位によって分類されることが多く、パルミトイル化されたシステインがタンパク質の膜貫通配列の近く(20アミノ酸以下の距離)またはその中にあり、カルボキシル末端またはアミノ末端付近に位置し、MGCモチーフを発現しているものが含まれる[52]。
図1 コロナウイルス構造タンパク質中のパルミトイル化システイン残基の分布
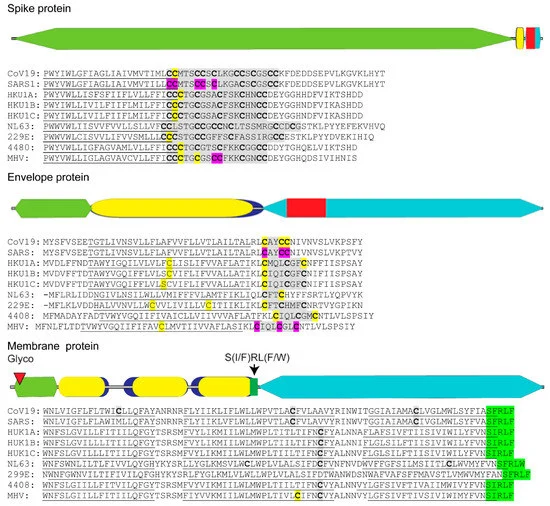
SARS-CoV-2スパイク、エンベロープおよび膜タンパク質の図。それらのエクトドメイン(オリーブグリーン)内部膜貫通配列(マスタード)を持つ疎水性ドメイン(ブルー)エンドドメイン(ティール)N-グリコシル化(マルーントライアングル)保存されたS(I/F)RL(F/W)モチーフ(明るいグリーン)およびパルミトイル化が証明されたシステインクラスター(レッド)の相対的なアミノ酸長さを示す。ヒトおよびマウスコロナウイルススパイク、エンベロープおよび膜タンパク質の予測された膜貫通ドメイン(下線部)内またはその近傍に見られる個々のシステイン残基(太字)を有するシステインクラスター(灰色のハイライト)の実際の配列が示されている。in silicoで予測された個々のシステイン(黄色)と生化学的に確認されたパルミトイル化部位(紫色)を示す。コロナウイルススパイク、エンベロープおよび膜タンパク質のアミノ酸配列は、SARS-CoV-2,NC_045512;SARS-CoV-1,AY291315;ヒトコロナウイルスHUK1遺伝子型A、AY597011のGenBankアクセッションIDから得た。HUK1遺伝子型B、AY884001;HUK1遺伝子型C、DQ415898;ヒトコロナウイルスNL63,NC_005831;299E、AF304460;ヒト腸管コロナウイルス株4408,FJ938067;および関連するマウス肝炎ウイルス株A59 MHV、MF618252。疎水性膜貫通位置でのコロナウイルスタンパク質のアラインメントは、それぞれClustal OmegaおよびTMHMM v. 2.0プログラムを用いて実施した。潜在的なパルミトイル化ターゲットの同定は、CSS-lm 4.0および高ストリンジェンシーに設定されたPalm-GPSアルゴリズムを用いて行った。
ウイルスエンベロープタンパク質のパルミトイル化は、通常、膜貫通ドメイン内またはその近傍に位置するシステイン残基で起こる[50]。システインパルミトイル化は、ERとゴルジ体に存在するDHHC(Asp-His-His-Cys)リッチドメインパルミトイルアシル転移酵素によって触媒される[53]。これらのインテグラル膜タンパク質は、DHHCモチーフに存在するパルミチン酸をアクセプタータンパク質内の還元されていないシステイン標的残基に転移させる。コロナウイルスウイルスの3つの膜タンパク質、すなわちスパイク、エンベロープ、膜のうち、スパイクとエンベロープのタンパク質だけがパルミトイル化されており、ウイルス複製に重要であることが示されている[54,55]。スパイクとエンベロープのパルミトイル化は、複製小器官へのタンパク質輸送を増加させ、ウイルスエンベロープの組み立てを助けることが示された。SARS-CoV-2スパイクタンパク質のエンドドメインを詳細に調べたところ、ウイルスエンベロープの近くに位置するシステインに富んだクラスターと、塩基性残基と酸性残基の両方を含むカルボキシ末端領域に分けられることが明らかになった(図1)。関連するSARS-CoV-1およびマウス肝炎ウイルス(MHV)のスパイクタンパク質のシステインクラスター内の特定のシステイン残基のパルミトイル化は、効率的なウイルスの組み立て、およびスパイクタンパク質と宿主細胞膜の融合イベントが発生する初期感染の間に不可欠であることが判明した(図1,紫)[49,55]。スパイクタンパク質のパルミトイル化は、スパイクタンパク質の膜貫通ドメインのねじれひずみを減少させることで、最適な宿主細胞融合とウイルスの侵入を可能にする、スパイクタンパク質の融合ドメインに追加のアンカー特性を追加するという仮説が立てられている[55]。
コロナウイルスエンベロープタンパク質もパルミトイル化されている(図1)[54,56]。感染細胞のERに豊富に発現しているが、エンベロープのごく一部がウイルス構造に組み込まれるだけである[57]。コロナウイルスエンベロープタンパク質と細胞膜および他のウイルスエンベロープタンパク質との密接な関連は、ER膜の湾曲を誘導し、ウイルスがER-ゴルジ血管に出芽する際にヌクレオカプシドのエンベロープ化を可能にする[58]。エンベロープタンパク質の第二の特性は、ホモ五量体カルシウムイオンチャネルの形成であり、カルシウムの恒常性の維持によりERストレスを緩和し、UPRによるアポトーシスを防止することが期待されている[59,60]。エンベロープタンパク質の膜貫通配列に近接してパルミトイル化が起こると、エンベロープタンパク質のDMVへの結合を強化する役割を果たす可能性がある。
脂質膜に密接に関与する他のSARS-CoV-2タンパク質、すなわちウイルス膜タンパク質やNSP3,4,6のシステインパルミトイル化に関しては、公表されている証拠が不足している。これらのタンパク質のシステインパルミトイル化が、ウイルスの脂質エンベロープやDMVへの結合を含む機能に必須であるならば、システイン残基は他のβ-コロナウイルスの間で保存されており、それらの膜貫通配列の近くまたはその中に位置しているであろうと仮定した。SARS-CoVを含むヒトコロナウイルスを、Clustal OmegaとTMHMM v. 2.0プログラムを用いて疎水性膜貫通領域に位置するシステインを検出し、CSS-lm 4.0とPalm-GPSアルゴリズム[61,62,63,64]を用いてパルミトイル化の可能性を同定するために、プロトタイプのMHV膜タンパク質またはNSP3,4,6とのin silico・アライメントを行った。その結果、コロナウイルス膜タンパク質と nsp のアミノ酸配列は、ヒトコロナウイルスと MHV の間で著しく異なるが、それらの相対的な位置と疎水性膜貫通配列の数は維持されていることが示された(図 1 および図 2)。
図2 コロナウイルス非構造タンパク質3,4および6における潜在的な膜関連パルミトイル化システイン残基の分布
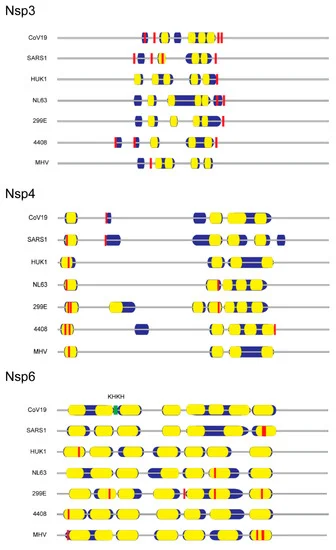
図は、予測される疎水性ドメイン(青)膜貫通配列(黄)およびシステインパルミトイル化のコンセンサス部位(赤)との相対的なアミノ酸長を示している。コロナウイルス非構造タンパク質の配列は、図1に記載のGenBank accession IDから取得した。
コロナウイルス膜タンパク質は、III型膜貫通型糖タンパク質であり、ウイルス粒子内に最も多く存在する糖タンパク質である[65]。膜タンパク質は、ヌクレオカプシド内での初期ゲノムパッケージング、およびその後のエンベロープおよびスパイクタンパク質とのウイルス膜への統合を調整することが示された[66]。コロナウイルス膜タンパク質は、伸長型とコンパクト型のどちらにも折りたためることができ、伸長型は脂質膜の湾曲やウイルスの出芽に重要な役割を果たしていると考えられている。SARS-CoV-2膜タンパク質のシステイン残基をin silicoで調べると、MHVのシステイン残基と同様の位置にあるシステイン残基のみがパルミトイル化されていることがわかった(図1)。また、in silico解析の結果、膜タンパク質の第3膜貫通配列と膜タンパク質のエンドドメインの接合部に位置する保存されたS(I/F)RL(F/W)モチーフも発見された(図1)。免疫グロブリン重鎖接合領域との相同性から、S(I/F)RL(F/W)モチーフはコロナウイルス膜タンパク質のコンフォメーションの柔軟性を提供している可能性がある。
nsp3のin silico試験により、保存されたシステインモチーフC(A)XCXKと、その疎水性ドメインの右端に位置するパルミトイル化ターゲットが、調査したヒトコロナウイルスについて明らかになった(図2)。SARS-CoV-2 ウイルスを除くすべてのコロナウイルスファミリーでは、最初の疎水性ドメインで nsp4 のパルミトイル化が起こった(図 2)。驚くべきことに、SARS-CoV-1または他のヒトコロナウイルスの第一膜貫通ドメインで検出されたシステインは芳香族残基で置換されていた。GenBankコロナウイルスTaxid(8-27-2020)をBLAST検索したところ、報告されているパンゴリン中間体ウイルス単離株MP789 [68]とは異なり、コウモリコロナウイルス単離株RaTG13のみがシステインを含まず、SARS-CoV-2 [69]と100%のcDNA配列同一性を有していた。Nsp6は、検査したすべてのコロナウイルスの第2および第3疎水性膜貫通ドメインの境界を画定する保存された-KHKH-接合配列を含んでいたが、感染中のその有用性はまだ明らかにされていない(図2)。nsp6の7つの疎水性領域ではパルミトイル化が予測されているが、保存されているパルミトイル化部位は見つかりなかった(図2)。これらの予測されたパルミトイル化部位の生化学的検証が必要であるが、保存されたパルミトイル化部位はすべて疎水性ドメイン内またはその近傍に位置しており、SARS-CoVのnsp3とnsp4の膜相互作用は、単純なテザリング、または多細胞小胞へのより広範なERの再形成とDMVペアリングのためにパルミトイル化を必要とするという議論を強化している。
6. 脂肪酸合成酵素(FASN)とAMP活性化プロテインキナーゼ(AMPK)。癌細胞の増殖を抑制するための抗ウイルスターゲットとしての可能性
SARS-CoV-2抗ウイルス薬の候補として脂質修飾薬の使用を検討する際、我々は抗ウイルス薬を特定のウイルスタンパク質を標的とするもの、またはウイルスのライフサイクルにおける重要なステップに干渉するものと定義した。スタチンのようなステロール変化薬は炎症を軽減することが証明されており、COVID-19患者のサイトカインストームを軽減するために現在研究されている(2020年3月1日、clinicaltrials.gov)が、COVID-19抗ウイルス薬としての使用はまだ論争の的となっている[70,71]。エビデンスは、スタチンが炎症を抑制し、ACE2受容体とのSARS-CoV-2相互作用を阻害しうることを示唆している。しかしながら、スタチンはまた、グルココルチコイド、デキサメタゾンを含む現在使用されているCOVID-19治療薬、またはプロテアーゼ阻害抗ウイルス薬と相互作用し、その効力を低下させる可能性がある [72]。さらに、スタチン系薬剤がCOVID-19肺炎を増悪させるかどうかは不明である[73]。スタチンは他のエンベロープされたRNAウイルス、すなわちC型肝炎ウイルスやインフルエンザウイルス[74,75,76,77]ではウイルスの複製を阻害しないため、我々は抗ウイルス薬としてスタチンを追求しないことを選択したが、スタチンがウイルスのタンパク質のパルミトイル化や複製小器官の組み立て中に必要な脂肪酸のレベルに影響を与えるとは考えていない[37]。
SARS-CoV-2は、密接に関連する中東呼吸器症候群β-コロナウイルス(MERS-CoV)とともにPI3K/AKT/mTOR/S6Kシグナル伝達活性を増加させ、これはFASNおよびアセチル-CoAカルボキシラーゼ(ACC1)を含む脂質同化酵素の産生を増加させると予想される(図3)[78,79]。FASNはパルミチン酸合成に関わる重要な細胞内酵素である[80]。FASNはアセチル-CoAとマロニル-CoAを基質としてパルミチン酸を形成し、パルミチン酸はタンパク質のパルミトイル化に利用されたり、さらに複雑な脂質に加工されてウイルスのエンベロープや複製器官の構築に利用されたりする。FASN阻害剤は、主にFASN β-ケトアシル還元酵素活性のアロステリック阻害を介して作用し、脂質膜合成およびタンパク質のパルミトイル化を変化させる [81]。アセチル-CoAカルボキシラーゼもまた、脂肪酸生合成における重要な代謝酵素である。ACC1はミトコンドリア由来のアセチル-CoAをマロニル-CoAに変換し、代謝中間体を脂肪酸合成に向けて誘導したり、マロニル-CoAを産生したりするという二重の目的と、カルニチンパルミトイルトランスフェラーゼ1のアロステリック阻害剤としての役割を果たしている[82]。この後者の酵素は、脂肪酸分解の律速段階として作用する[82]。ACC1またはFASNの酵素活性を阻害することで脂肪酸生合成を制御することで、ウイルスの産生を減衰させることが期待されている。
図3 脂質合成経路の概要
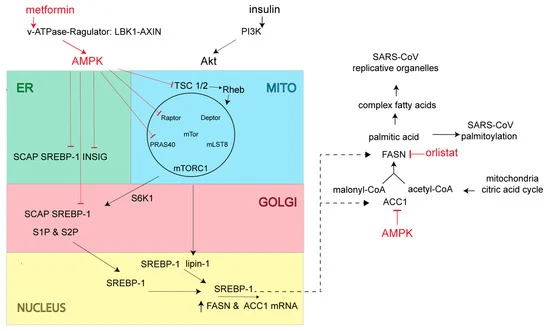
インスリンによるミトコンドリア(MITO)mTORC1の活性化は、S6K1とリピン-1のリン酸化につながる。活性化されたS6K1は、ゴルジ体へのSREBP-1の輸送、S1PとS2Pによるタンパク質分解成熟、最終的な核内への侵入と脂肪酸同化遺伝子FASNとACC1の転写活性化をもたらすERレジデントSREBP-1に作用する。AMPKは、ACC1酵素に直接作用することにより、あるいはmTORC1の不活性化を介して細胞内のFASNおよびACC1酵素を低下させることにより、あるいはゴルジ体へのER SREBP-1の輸送/成熟を阻害することにより、間接的に脂肪酸合成を阻害し、最終的に脂質遺伝子の転写を阻害する。
FASN と ACC1 酵素活性の直接的な阻害に加えて、細胞内の FASN と ACC1 のレベルは、転写時にステ ロール調節エレメント結合タンパク質(SREBP)-1 によって制御される(図 3)[83]。SREBP-1依存性のリポジェニック経路は通常、食物摂取によって刺激されるが、肥満にリンクしたインスリン抵抗性の設定では過剰に活性化される[84]。
低エネルギー需要および十分な脂肪酸貯蔵量の条件下では、SREBP-1は、SREBP切断活性化タンパク質(SCAP)およびインスリン誘導遺伝子タンパク質(INSIG)との安定した複合体として不活性な形態でERに存在する[85]。SREBP-1に結合したINSIGは、ERでSREBP-1を維持し、ゴルジ体でのSREBP-1の輸送およびタンパク質分解処理/成熟を防ぐ。不足した細胞性脂肪酸の時間の間に、INSIGは、ユビキチル化され、ゴルジ体複合体へのSREBP-1-SCAP輸送を可能にし、分解され、それによってSREBP-1は、サイト-1とサイト-2プロテアーゼ(S1P、S2P)によってタンパク質分解的に処理されている。タンパク質分解的に成熟すると、SREBP-1は、FASNとACC遺伝子の転写活性化のために核に移動される[86]。インスリンの慢性的な上昇が脂質合成の継続的な増加をもたらす2型糖尿病または肥満の場合には、細胞内INSIGレベルが減少していることが機序学的知見で示されている[87]。インスリンレベルの上昇に伴い、ホスファチジルイノシトール(3,4,5)-三リン酸(PIP3)のPI3K産生の増加、Akt(AKRマウス胸腺腫)キナーゼの活性化、哺乳類のラパマイシン標的(mTORC1)シグナル伝達複合体(図3)のAkt活性化を介した核内SREBP-1レベルの増加もある[88]。mTORC1は、mTORキナーゼ、mTORC1のアダプタータンパク質調節関連タンパク質(Raptor)哺乳類の致死性SEC13タンパク質8(MLST8,GβLとも呼ばれる)およびその阻害性サブユニット、プロリンリッチAkt基質1(PRAS1)およびAkt標的ドメイン相互作用タンパク質(DEP)TORから構成されている。mTORC1活性の調節に関与する最も重要なセンサーの一つは、結節性硬化症複合体(TSC)ヘテロダイマー(TSC1とTSC2)である。TSCはRas関連GTPaseであるRheb(脳内に富むRasホモログ)のGTPaseとして作用する。TSCはRheb特異的GTPaseとして、Rhebをその不活性なGDP結合状態に変換することで、mTORC1シグナルをネガティブに制御する。インスリン刺激とAktの直接リン酸化によりTSC GTPaseが不活性化され、GTP-Rhebの活性化が促進され、mTORC1シグナル伝達活性が増加する。また、Aktは通常はmTORC1のネガティブレギュレーターであるPRAS40(プロリンを豊富に含むAkt基質40 kD)をリン酸化することでmTORC1の活性を増加させる。通常は脱リン酸化されたリピン-1は核内に存在し、”自由形質 “のSREBP-1の核内レベルを制限する。リピン-1は、核内のSREBP-1をその脂質遺伝子応答性要素から遠ざけることによって作用する[89]。リピン-1がリン酸化されると、遊離したSREBP-1は脂質遺伝子応答性要素を標的とすることができるようになる。活性化されたS6-キナーゼは、ER SREBP-1複合体をリン酸化し、SREBP-1ゴルジ輸送およびタンパク質分解成熟を増強する[90]。慢性的なインスリン上昇が脂質合成の増加と脂質が豊富な環境をもたらす2型糖尿病や肥満の場合、SARS-CoVがより容易に複製小器官を形成し、ウイルス産生を増加させると予想される。
インスリンによる脂質合成の増加に対抗し、細胞の適切なATP/脂肪貯蔵比を維持するために[91]、細胞内AMPKは、律速酵素ACC1のリン酸化を介して直接的に、またmTORC1シグナル伝達とそれに続くSREBP-1処理の中断を介して間接的に脂質合成を停止する(図3)。AMPKは、TSC2をリン酸化し、Rhebを不活性なGDP結合状態に変換することでmTORC1シグナルを阻害し、mTORC1のAkt刺激をオフにする。AMPKはまた、14-3-3タンパク質の結合とmTORC1阻害をもたらすRaptorをリン酸化する[92]。AMPKはまた、SREBP-1とINSIGの両方をリン酸化することにより、SREBP-1シグナル伝達経路を直接ブロックする。INSIGのリン酸化は、ER内のSREBP-1の保持につながるINSIGのユビキチン化と分解をブロックする[93]。SREBP-1のAMPKリン酸化は、SREBP-1のタンパク質分解処理/成熟、最終的には脂質遺伝子の転写を防ぐ[94]。SREBP-1は、独自の転写を制御するように、INSIGの安定性やSREBP-1の成熟の防止のいずれかの増加は、さらに全体的なSREBP-1のレベルを低下させ、最終的には脂質酵素と脂質合成の減少を引き起こす負のフィードバック制御として機能するだろう[95]。
AMPK の作用による脂質生合成の低下は、コロナウイルス複製オルガネラの形成、ウイルスタンパク質のパルミトイル化およびウイルス産生を減衰させると期待されている(図 3)。さらに、AMPK の mTORC1 への作用は、細胞性および全身性の炎症反応や T 細胞活性化とともに細胞性 NFκB 活性を低下させ、重症 SARS-CoV-2 感染でしばしば見られる異常な炎症反応を軽減または緩和することが期待されている。
7. SARS-CoV-2 のタンパク質パルミトイル化とオルガネラアセンブリの制御におけるオルリスタットとメトホルミンの使用の可能性
FASN [81] または AMPK [98] を阻害し、抗 SARS-CoV 抗ウイルス薬としての可能性がある化合物が、臨床試験前にいくつかの実験的化合物として開発されている。しかし、FASN阻害薬であるオルリスタット、またはAMPK活性化薬であるメトホルミン(それぞれXenicalおよびGlucophageのブランド名で販売されている)のみが、広く臨床使用が承認されており、確立された安全性プロファイルを有している。オルリスタットは、肥満および肥満に関連した2型糖尿病の治療に処方される [99,100,101,102]。オルリスタットはStreptomyces toxytriciniから単離された内因性リプスタチンの飽和誘導体であり、FASNのチオエステラーゼドメインの活性部位に共有結合し、FASNの酵素活性を直接阻害する(図3)[103,104]。オルリスタットの推奨用量は、120mgカプセル1カプセルを1日3×3回、無脂肪の食事中に経口摂取することである[105]。オルリスタットの主な蓄積部位は腸内であるが、薬物の大部分(95~97%)は吸収されず、糞便中に排泄される;しかしながら、初期の臨床研究では、推奨される120mg以上の用量が処方された場合の血清中のオルリスタットの低レベルではあるが測定可能なレベルが検出されている[106]。メトホルミンはビグアナイド誘導体であり、2型糖尿病の治療に広く使用されている [107]。メトホルミンは、低血糖または体重増加をほとんど誘発せずに血糖値を低下させ、肝性ステアトーシスを逆転させ、インスリン感受性を改善し、動脈硬化および心血管機能障害を改善するという点で臨床的に優れていることが示された[107]。メトホルミンの作用機序は、かつてはミトコンドリアであり、AMPの増加とAMPKの活性化のための電子輸送鎖の複合体Iが関与していると考えられていた[107]。しかし、より最近の知見によると、メトホルミンは肝キナーゼB1(LKB1)および軸索阻害タンパク質1(AXIN1)と関連したv-ATPase/Ragulator複合体の形成を介してAMPKカスケードを活性化することが示されている。一旦形成されると、このより大きな複合体はAMPKの活性化とmTORC1のスイッチングオフにつながる(図3)[108]。AMPKおよびmTORC1に対するメトホルミンの作用は、SARS-CoV-2の複製に影響を与える可能性のあるグル経過およびタンパク質代謝、ミトコンドリアのバイオジェネシスおよびミトコンドリアのオートファジーの変化にもつながるが、我々は脂質代謝に対するメトホルミンの作用に焦点を当てた。AMPKを介したメトホルミンの作用は、脂質貯蔵量を減少させ、脂肪酸酸化を増加させ、解糖を阻害し、脂質代謝を阻害する。AMPKを介して作用するメトホルミンは、律速酵素ACC1のリン酸化を介して、パルミチン酸合成とウイルスタンパク質のパルミトイル化を直接断つことが期待されている。また、AMPKがmTORC1シグナル伝達とそれに続くSREBP-1処理を阻害することで、全体的な脂肪酸合成と複製オルガネラアセンブリを減少させると予想している(図3)。さらに、オルリスタットのFASN酵素活性の直接的な阻害は、パルミチン酸の産生と最終的にはウイルスタンパク質のパルミトイル化を損なうはずです(図3)。
7.1. COVID-19治療におけるオルリスタットとメトホルミンの使用に関する他の脂質依存性ウイルスからの洞察
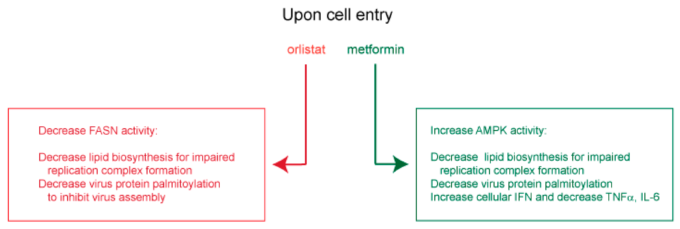
他のウイルス環境では、オルリスタットとメトホルミンは、いくつかのフラビウイルス[109,110,111,112]、およびB型肝炎ウイルスとHCV[113,114,115,116,117]、コクサッキーウイルスB3および水痘帯状疱疹ウイルス[118,119]の複製を阻害することが示されている。これらのウイルスでは、オルリスタットが脂質小胞の再構築、ウイルスゲノムの複製、ウイルスタンパク質のパルミトイル化[109,110,111,118]およびウイルスの侵入[113,114]を阻害することが示されている。メトホルミンは、脂質(パルミチン酸)合成 [119]、ウイルスRNA転写およびタンパク質合成 [115,116]、ならびにウイルス依存性解糖を減少させ、一方でIFN産生を増加させ、炎症性サイトカインをブロックすることが示された [112,117]。これらの観察された抗ウイルス機序から、オルリスタットとメトホルミンは、それぞれFASNを減少させ、AMPKを活性化させ、ウイルス複製オルガネラ形成を阻害し、スパイク、膜、エンベロープのパルミトイル化とそれに続くウイルスの組み立てをブロックすると予想される。また、オルリスタットとメトホルミンは、IFNの発現を促進し、劇症的なIL-6とTNF-αを抑制することで、自然細胞免疫を増強する可能性がある(図4)。
図4 オルリスタットとメトホルミンがSARS-CoV-2の複製を阻害するために使用する予測される作用機序
7.2. COVID-19 治療におけるオルリスタットとメトホルミンの潜在的な臨床的有用性
オルリスタットは、糖尿病患者においてIL-6およびTNF-αを減少させることが示されており[120]、また、急性膵炎マウスモデルにおける死亡率の低下およびTNF-α、MCP-1およびIL-6の血清レベルの低下によって測定されるように、肥満(ob/ob)マウスにおける全身性炎症および膵炎誘発死を減少させることが示されている[121]。オルリスタットは、糞便胞子および胞子感染率の減少によって見られるように、Enterocytozoon種によって引き起こされる腸管微小胞子症を減少させることが示された[122]。RNAウイルスの脂質依存性と同様に、オルリスタット処理したマウスは、胞子依存性リン脂質合成の阻害およびEnterocytozoon種の胞子発生時に必要とされる寄生胞子空胞の防止を通して、ミクロスポリジアの生存可能性の直接的な阻害を示した。
様々な疾患設定での臨床試験および動物実験により、メトホルミンはSARS-CoVの抗ウイルス薬として強く支持されている。メトホルミンはAMPKを活性化してIFNシグナル伝達を強化し、炎症性サイトカインを減少させ、免疫の恒常性を回復させることで、COVID-19病におけるサイトカインストームの重症度を低下させる可能性がある [123,124]。全身性免疫代謝薬としてのメトホルミンの臨床試験は現在進行中であるが [125]、メトホルミンの使用はすでに患者の炎症を減少させ、マウスのインスリン炎を減少させることが実証されている。メトホルミンは、自己反応性および抗炎症性細胞を抑制し、免疫恒常性を回復させることが示されている[126]だけでなく、多嚢胞性卵巣症候群の女性におけるIL-6,TNF-αおよび細胞内接着分子-1(ICAM-1)を減少させ[127]、糖尿病患者における喘息関連入院および喘息増悪を減少させることが示されている[128]。メトホルミンによる喘息イベントの低下は、AMPKを介して作用し、好酸球駆動性の炎症を減衰させると推定されている [129,130]。メトホルミンは、マウスモデルにおいて非アルコール性脂肪肝疾患および腸管炎症を減少させることが示されている [131,132]。
抗SARS-CoV抗ウイルス薬としてのメトホルミンの使用は、2型糖尿病 [133] および炎症性腸疾患 [134] における腸内マイクロバイオームの制御異常および慢性腸炎を減少させる能力に由来している。さらに、メトホルミンは、AMPKの活性化およびそれに続く活性化NFκBの減少を介して、病原性のあるTh17細胞の頻度を減少させ、有益な調節性T細胞の頻度を増加させる[134,135] [132]。メトホルミンは、AMPK依存性シグナル伝達の変化とサイトカイン遺伝子活性化のダウンストリーム抑制により、感染細胞におけるSARS-CoVの炎症性シグナルを減少させる可能性がある。
7.3. オルリスタットとメトホルミンの治療への応用
メトホルミンの推奨される1日の至適量は2000mgである。オルリスタットのように経口および食事中に服用した場合、蓄積の主な部位は腸内であり、排泄は尿および糞中である [107]。潜在的な薬物毒性のレビューでは、オルリスタットは忍容性が高いことが示されている;しかしながら、COVID-19患者では、オルリスタット誘発性肝障害がまれに発生するため、モニタリングが必要であるかもしれない[136,137]。まれな症例(4.3/10万人)では、メトホルミンは肝臓による乳酸取り込みを減少させ、それにより乳酸アシドーシスのリスクを増加させる可能性がある。重度の腎不全、アシドーシス、うっ血性心不全、肝疾患および低酸素血症の患者におけるメトホルミンの使用には注意が必要である[138]。
COVID-19治療中にメトホルミンを使用すると、細胞性ACE2のレベルが(約0.8倍)増強されることにより、SARS-CoVの感染性が増加する可能性が示唆されている [139,140]。この増加は、SARS-CoVによる肺の炎症および損傷[141,142]、または我々の見解では、メトホルミンによる脂質合成およびウイルス複製の阻害という利点を上回る可能性がある。COVID-19の治療にメトホルミンを使用することをさらに支持するために、我々は、SARS-CoV-1スパイクタンパク質がACE2を切断するためにメトシンプロテアーゼファミリーのメンバーであるTNF-α変換酵素(TACE)を使用しており、これによりウイルスの侵入が可能になることに注目している[143,144,145]。TACEプロテアーゼ活性の阻害は、SARS-CoV感染を減衰させる [144]。メトホルミンは他のメトジンシンファミリーメンバー、すなわちメタロプロテアーゼ(MMP)-2およびMMP-9を阻害することができることから、メトホルミンがTACEプロテアーゼに対して同様の阻害作用を示し、ACE2の切断およびウイルスの侵入を防止していると推察される。メトホルミン治療後に見られる細胞性ACE2の高レベルは、実際には切断されていない、機能不全のACE2 SARS-CoV受容体を反映している可能性がある。
現在提案されているCOVID-19治療モダリティとの潜在的な薬物相互作用は、単純な食事の変更、投与量の増加、または薬物投与時間のオフセットによって容易に回避することができる(すなわち、脂溶性ビタミン、シクロスポリンA、https://clinicaltrials.gov、検索用語「COVID-19」 2020年3月1日)。
8. 結論と今後の方向性
オルリスタットやメトホルミンなど、FASNやAMPKにそれぞれ作用し、ウイルスの複製や集合を阻害したり、消化管の完全性を促進したり、劇症的な全身性炎症を減少させたりすることが期待される承認薬は、抗COVID-19療法として臨床試験を真剣に検討する価値がある(図5)。
ウイルス 13 00090 g005 550図5 オルリスタットとメトホルミンによるCOVID-19の疾患および病態の抑制における予測される全身作用。
メトホルミンがCOVID-19の管理に有用であるかもしれないという我々の仮説を支持するために、(Zhu et al 2020)の研究では、2型糖尿病糖尿病をコントロールするために薬物を使用した人は、薬物を使用しなかった人と比較して入院成績が著しく良好であったことが示されている[147]。著者らのデータ(Zhuら、表2)をさらに検討したところ、メトホルミンを使用したCOVID-19患者は全体的に最も優れていた(27.3%)ことがわかった[147]。サンプルサイズが小さかったため、割合のZ検定を用いた統計的有意性は認められなかったが、データの傾向から、メトホルミンの使用は(>)抗2型糖尿病α-グルコシダーゼ阻害薬(26.7%)>チアゾリジン系薬剤(22.2%)>スルホニルウレア(20.1%)>メグリチニド(20.0%)>ジペプチジルペプチダーゼ-4阻害薬(20.0%)および>インスリン(12.1%)よりも入院成績を改善したことが示された。COVID-19感染症で入院した糖尿病患者におけるメトホルミンの使用を検討したその後の研究では、死亡リスクの低下との関連が示された [148,149]。
オルリスタットの使用とCOVID-19の転帰に関する臨床研究は、さらなる調査が待たれている。しかし、第4相臨床試験におけるHCVウイルス負荷低下に対するオルリスタットの有効性に関するまだ発表されていないレビュー(NCT00207311,clinical trials.gov)は、オルリスタットを用いてSARS-CoV-2感染症を効果的に治療するための明確な医学的指針と臨床的な道筋を示す可能性がある。
他の抗ウイルス剤や抗炎症剤と併用した場合、オルリスタットおよび/またはメトホルミンは、脂質合成を全体的に低下させて複製小器官を減少させ、ウイルスタンパク質のパルミトイル化を防止することにより、SARS-CoV-2の複製をさらに抑制することができ、それにより、高リスクの患者や感染した患者の免疫誘発性罹患率を低下させることができるかもしれない。本疾患の検査で陽性が確認された患者や、疾患進行の早い段階でオルリスタットやメトホルミンを用いた臨床予防が考えられる。他のCOVID-19抗ウイルス薬と慎重に併用すれば、両剤はこれらの抗ウイルス薬と相乗的に作用し、より侵襲的な集中治療が必要になる前に患者の回復を早めることができる。
