Contents
On the potential role of exosomes in the COVID-19 reinfection/reactivation opportunity
www.tandfonline.com/doi/full/10.1080/07391102.2020.1790426
要旨
我々は、COVID-19感染の再発のメカニズムの一つは、SARS-CoV-2負荷エキソソームや他の細胞外小胞の放出に関連した細胞輸送経路である可能性があることをここで提案する。
この「トロイの木馬」戦略は、退院後7-14日目に回復したCOVID-19患者におけるウイルスRNAの再発現を説明する可能性があり、この「沈黙」期間中にウイルス物質がエクソソームや細胞外小胞の中に隠され、その後再び広がり始めたことを示唆している。
キーワード SARS-CoV-2, COVID-19, 再感染, エクソソーム, 細胞外小胞
序論
私たちは、COVID-19、ひょっとしたら長い間、自分自身を適応させて生きていかなければならないという事実への準備はできているのだろうか。今、私たちは、SARS-CoV-2に感染したすべての人が感染しているわけではなく、すべての感染者が症状を示すわけではなく、症状を示すすべての人が重篤な呼吸器疾患を発症するわけではないことを知っている。
現在進行中のCOVID-19パンデミックの世界的な1日の症例死亡率(CFR)は減少しているが、CFRが増加している国も多く、新規感染率が依然として高いのが現状である。実際、5月の間だけでCOVID-19の新規感染者数はほぼ倍増(330万人から630万人に増加)したのに対し、6月は1日に記録されたCOVID-19の新規感染者数が過去最高(2020年6月26日には194,191人)を記録した。
COVID-19の特徴は、基礎再生産数(R0、これは各病人の感染者数である)が3.8から8.9までであることである(Sanche et al 2020)。これらはすべて、特にCOVID-19関連の検疫から出てきている、または出てくる予定の国にとっては、かなり不穏なニュースである。
SARS-CoV-2感染者の約80%は軽症で、ほとんどが上気道と導気道に限定されている。確定症例の平均では約15%が重症期に進行するが、65歳以上の患者では重症期に進行する確率が顕著に高くなる(Shi et al 2020)。SARS-CoV-2感染は大きく分けて3つのステージに分けられる(図1参照)。
I期はウイルスが検出されるか検出されないかの無症状潜伏期、II期はウイルスが存在する非重症症状期、III期はウイルス負荷が高い重症呼吸器症状期となる。50%以上の患者では、7日目までに血清転換が起こり、残りの患者では13~14日目までに起こる(Korber et al 2020; Mason, 2020; Shi et al 2020; Wölfel et al 2020)。
SARS-CoV2コロナウイルスは非常に攻撃性の高い新しい原因物質であり、新しいデータが毎時間ごとに発表されているため、疾患の進行には複数の分類があることを覚えておくべきである。しかし、ここで概説されている分類は、1000人以上の患者の臨床データに基づいて組み立てられた、最も臨床的に健全なものである(Korber et al 2020;Mason、2020;Shi et al 2020;Wölfel et al 2020)。
図1.COVID-19感染の段階および対応する患者の感染性の模式図。
ここで、血清転換は、免疫グロブリンM(IgM)抗体が産生される感染の初期(一次感染)段階から、IgMレベルが低下(および検出不能になる)し、免疫グロブリンG(IgG)レベルが上昇し、検出可能なままである段階への移行に対応する。C反応性蛋白(CRP)は、感染や炎症の部位で最大10000倍に上昇する急性炎症性蛋白である。
Dダイマーは、プラスミンの切断に起因する架橋フィブリンの分解産物である。ほとんどの健康な人の血液中には、D-ダイマーはごくわずかしか存在しないが、D-ダイマーの血中濃度の上昇は、深部静脈血栓症(DVT)または肺塞栓症(PE)として現れる可能性のある血管内凝固および静脈血栓塞栓症(VTE)を反映している。COVID-19患者におけるDダイマーレベルの上昇は、COVID-19感染の重症度と関連し、より高い死亡率と相関する。
急性呼吸窮迫症候群(ARDS)は、COVID-19関連死亡の主な原因であり、実際には、SARS-CoV-2、SARS-CoV、およびMERS-CoV感染症の一般的な免疫病理学的イベントを表している。ARDSの主なメカニズムの一つは、サイトカインストームであり、大量のプロ炎症性サイトカイン(IFN-α、IFN-γ、IL-1b、IL-6、IL-12、IL-18、IL-33、TNF-α、TGFβなど)およびケモカイン(CCL-α、TNF-α、TGFβなど)の放出から生じる致命的な制御不能な全身炎症反応である。 )およびケモカイン(CCL2、CCL3、CCL5、CXCL8、CXCL9、CXCL10など)を、免疫エフェクター細胞(Li,Geng,et al.2020). さらに、重症のCOVID-19の患者は、C3aの生成およびC3-フラグメントの沈着を特徴とする広範な補体活性化を示した(Risitano et al 2020)。
長期化したSARS-CoV-2 RNAシェディング、COVID-19再感染および再活性化
現在、COVID-19から回復した患者の数は、SARS-CoV-2感染の半数を超えている。このような前向きな動きにもかかわらず,回復・退院した患者の再感染や再活性化は潜在的なハードルとなっており,回復・退院した患者は通常,地域社会と混ざり合っているため,新たな感染源として隠れた存在となっている。
回復/退院した患者の中には、退院後10日から27日まで陽性のウイルスRNA負荷を示したものもあり(例:Korber et al 2020;Ye et al 2020年参照)、ウイルス排出期間の中央値は20日であったが、場合によっては37日も観察された(Zhou et al 2020)。
最近、COVID-19患者の一部では、SARS-CoV-2 RNAの脱落期間が30日をはるかに超える可能性があるため、状況はさらに悪化する可能性があることが実証された。実際、そのような患者の一部では、延長されたSARS-CoV-2 RNAシェディングが、中央値で53日、最大で83日で発生したことが報告されている(Li, Wang, et al 2020)。
このようなSARS-CoV-2の長期キャリーに加えて、COVID-19から回復した患者の中には、SARS-CoV-2の再発を示したものもあった(Xiao et al 2020;Ye et al 2020;Yuan et al 2020)。実際、ある研究では、退院したCOVID-19患者の9.1%もの患者がSARS-CoV-2の再活性化を呈していることが示された(Ye et al 2020)。
別の研究では、退院したCOVID-19患者の14.5%が(ポリメラーゼ連鎖反応)PCR陰性で、後にSARS-CoV-2の逆転写PCR(RT-PCR)検査が陽性であったことが示されており(Yuan et al 2020)、さらに別の研究では、このような再発患者の数が21.4%にもなる可能性があることが示されている(Xiao et al 2020)。
PCR法は感染性ウイルスと同一ウイルスの非感染性核酸を区別することはできないが、回復・退院した患者や非生存者であってもPCR陽性であることは、感染診断の重要な方法である。最近、非常に興味深い症例が報告されたが、鼻咽頭スワブ検体の3回連続PCR検査でSARS-CoV-2陰性が示された後、退院の準備をしていた78歳の女性が、容態が著しく改善し、CT検査で肺滲出液の吸収が認められたが、突然心停止に陥り死亡した(Yao et al. )
この症例は、彼女が何から死んだのかという根本的な疑問を提起した。それはウイルスからだったのか、それとも何か他の原因からだったのか?これらの疑問に答えるために、肺、肝臓、心臓、腸、皮膚からの組織切片にデジタルPCRを実施した(Yao et al 2020)。
この分析では、予想外に肺のみでSARS-CoV-2 RNAの陽性PCRが検出されたが、他の組織では検出されなかった。一貫して、電子顕微鏡分析は、肺生検でのコロナウイルス粒子の存在を明確に明らかにした(Yao et al. これらの重要な観察に基づき、著者らは、SARS-CoV-2核酸のPCR検出を気管支肺胞洗浄液で行うことを推奨した。また、著者らは、検疫期間の延長と、退院した患者、特に高齢の患者に対する適時のフォローアップ診察を提案した(Yao et al 2020)。
これらの再活性化患者について収集された臨床データは、一次感染患者のデータと類似していた。重要なことは、もともと無症状の患者が再活性化した患者の中に含まれていたことであり、無症状または症状の少ない患者の再活性化の可能性が顕著であることを示唆している(Korber et al 2020; Ye et al 2020)。
症状前の症例および無症状の症例におけるウイルス負荷は、症状のある症例と同様であり、潜伏期間中に感染が起こり得ることを示唆した(Arteaga-Livias et al 2020;Gatto et al 2020)。
潜在的な再活性化および/または再感染に対処するために、中国国家衛生委員会(国家衛生委員会)は、回復したと思われるものの退院のための4つの基準を発表している。(a) 少なくとも3日間発熱がないこと、(b) 呼吸器症状の著しい改善、(c) 胸部CT(コンピュータ断層撮影)またはX線検査での放射線異常の実質的な改善、(d) SARS-CoV-19核酸のRT-PCR結果が2回連続して陰性(少なくとも24時間以上の間隔をあけて)であること。
これは、臨床的に回復した患者で少なくとも24時間間隔で2回連続して陰性のPCR結果が得られた場合、COVID-19患者を退院させることができるというWHOの臨床管理に関するガイドラインにも合致している(https://www.ecdc.europa.eu/en/publications-data/COVID-19-guidance-discharge-and-ending-isolation)。
しかし、これらの基準をすべて満たしているにもかかわらず、退院後しばらくしてもRT-PCR検査で陽性を示す患者がいるが、これは不完全なウイルスクリアランス、不正確なサンプリング、偽陰性、および/または偽陽性のRT-PCR検査結果、ならびに再感染/再活性化が原因である可能性がある。これらの再発患者は、一次感染中に平均15.36±3.81日入院し、前回の退院からSARS-CoV-19の陽性検査までの平均期間は4~17日であった(Ye et al 2020;Yuan et al 2020)。
退院したCOVID-19患者が再感染/再活性化を発症する可能性が比較的高いということは、SARS-CoV-2に対するウイルス排除免疫応答が、少なくとも一部の患者では達成しにくい可能性があることも示している。14日間の追加隔離と退院後の医学的観察を必要とする厳格な検疫措置の下では、再感染は考えにくい。
RT-PCR 結果が再発陽性の患者を隔離し、再び退院基準を満たすまで治療を継続する必要がある。最近の研究では、RT-PCR結果が再発した患者が25例報告されており、最後に陰性になってから陽性になるまでの期間の中央値は6日であった。このようなことから、COVID-19患者の厳密な隔離とフォローアップが最重要視されている。
COVID-19の高リスク因子を有する患者は、注意深くモニターされ、包括的な治療を伴う完全な診断処置を受けるべきである(Dong, Cao, et al 2020; Lan et al 2020; Shi et al 2020; Xing et al 2020)。医師が、保護免疫を有する回復した患者と、保護免疫を有さない回復した患者とを区別または区別するのに役立つような、利用可能な方法論はない。明らかに、記憶CD8+ T細胞およびヘルパーCD4+ T細胞の形成を伴う、より強固な免疫応答を発達させた患者は、SARS-CoV-2に再曝露された場合、最も装備が整っているであろう。
再感染には3つの主要なメカニズムがあり、免疫応答は(i)効果がない、(ii)株特異的、(iii)短命である。さらに、SARS-CoV-2は「脱出変異体」を発症することが示された(Chaturvedi et al 2020)。
退院時にPCR結果が偽陰性であった持続感染に起因する再発例が実際にある可能性もあるが(Hoang et al 2020)、COVID-19で回復した患者が再感染または再活性化のリスクがあるのではないかという懸念が高まっている。これを機に、COVID-19から回復した一部の患者でSARS-CoV-2 RNAが再出現した理由は何か、そのような再感染・再活性化・再燃のメカニズムは何かなど、いくつかの重大な疑問が提起された(Kang et al 2020)。
これらの再感染・再活性化・再燃したCOVID-19患者は感染性があるのか?SARS-CoV-2で再検査で陽性となったこのような回復した患者はどのように管理すべきか?SARS-CoV-2感染によって誘発される中和抗体や保護反応はあるか?SARS-CoV-2ワクチンはこのような再感染、再発、再活性化したCOVID-19患者に効果があるのか?
再感染の可能性を生体内試験(in vivo)で試験するために、アカゲザルにおけるSARS-CoV-2に対する後天性免疫を調査した(Bao et al. 4匹のアカゲザルがSARS-CoV-2に感染し、2匹は回復が確認された後に再感染した。一次感染後、鼻、咽頭、肺、腸でウイルスの複製が検出され、組織学的に肺障害が認められた。
再感染前に回復したサルから採取した血清はSARS-CoV-2に対して中和活性を示した.再感染後、鼻咽頭や肛門の綿棒にはウイルスの複製は検出されず、再感染したサルにはCOVID-19病の再発の兆候は見られなかった。
このことは、SARS-CoV-2への一次感染後に獲得した免疫が再感染から保護するケースがあることを示唆しており(Bao et al 2020;太田、2020)、この免疫がウイルス複製を制御することで、回復した患者を重篤な合併症に移行しないように保護する役割を果たしている可能性があることを示唆している(Vardhana & Wolchok、2020)。
そこで、回復者における再感染の確率を評価するために、Susceptible-Exposed-Infectious-Removed-Undetectable-Susceptible(SEIRUS)モデルを用いた数値実験を行った(Victor Okhuese, 2020)。この研究では、根治的なワクチン接種がない場合、世界的に感染者の割合が増加し続けるのに対し、回復率は長期にわたってゆっくりと、しかし着実に増加し続け、死亡率は感染率と回復率の比で決まるという結論に達した(Victor Okhuese, 2020)。
また、このモデルは、回復した集団内の再感染率は、回復した集団のシステムからウイルスが臨床的にクリアされるにつれて、時間の経過とともにゼロにまで低下することを示唆している(Victor Okhuese, 2020)。しかし、この結論に反して、COVID-19の感染例が増加し続けているパンデミックの現段階では、SARS-CoV-2の再感染・再燃・再活性化の可能性がむしろ高いという明確な証拠がある。
COVID-19は、3つの隠れた感染源からの人と人との接触を介して感染する可能性があり、それは、無症候性の患者と無症候性の患者、またはCOVID-19の診断を受けていない人(おそらくあまり気分が良くなかったため)である。これらの患者はウイルスを広げる可能性があり、パンデミック予防において軽視されやすい集団を代表する可能性がある(Arons et al 2020;Lai et al 2020;Shi et al 2020;Wei et al 2020)。
第4の感染源は非潜伏であり、これは症状のあるCOVID-19患者である。同じSARS-CoV-2株で回復した人の再感染は、前述のすべての感染源に由来するか、または新しいウイルス株に起因する可能性があり、この場合、再感染者は複雑な症状を示すことがある。
多くの要因が組み合わされて、SARS-CoV-2の極めて攻撃的な性質が定義されており、この性質は高い感染性と高い死亡率を特徴としている。コロナウイルスとの共存は1930年代に始まった長い歴史があるが(Weiss, 2020)、SARS-CoV-2に対する集団免疫はまだないので、私たちはこの感染症にかかりやすくなっている。
また、このウイルスは効率的に水平感染するだけでなく、感染した母親から新生児へと垂直感染することも忘れてはならない(Dong, Tian, et al 2020; Ferrazzi et al. そして、もちろん再感染の可能性もある。
ウイルス感染、再感染、および再活性化の潜在的なメディエーターとしてのエクソソームおよび細胞外小胞
再感染患者(すなわち、再びSARS-CoV-2 RNA陽性となった退院回復患者)に関連して、重要な問題は、隠れたSARS-CoV-2 RNAがどこから(または何を引用して)来ているのかということである。多くのウイルスは、合成および宿主内拡散の間に、細胞外二重膜小胞(EDMV)またはエキソソームアベニューに侵入することが知られている(Badierah et al 2020)。
SARS-CoV-2についてのこのシナリオをカバーする文献はない。しかし、AT2細胞で培養したSARS-CoVを用いた試験管内試験(in vitro)試験では、二重膜小胞内にウイルス粒子が見られることが報告されている(Mason, 2020; Qian et al. コロナウイルスRNAは、感染細胞の細胞質内にあるウイルス誘発性二重膜小胞内で合成される。
ウイルスは、ER-ゴルジ間コンパートメントの膜から細胞内に芽生え、分泌小胞で細胞質を通って輸送され、細胞外に放出される(Qian et al 2013)。SARS-CoV-2が宿主細胞内の液胞または二重膜小胞(DMV)内に存在し得るという事実は、COVID-19を有する患者の腎サンプルの、光顕微鏡、電子顕微鏡検査、および免疫染色による慎重な死後病理組織学的分析によって証明された(Farkash et al 2020;Su et al 2020)。
実際、これらの分析は、腎尿細管上皮に特徴的なスパイクを有するコロナウイルス様粒子のクラスターの存在を明らかにした(Su et al 2020)。これらの細胞内ウイルスはアレイ状に組織化されており、細胞内で製造され、組み立てられたことを示していた。
さらに、ウイルス集合の可能性のあるDMVは、粗小胞体(RER)の近くで発見され、SARS-CoV-2ウイルス集合のメカニズムがSARS-CoVのそれと類似していることを示唆していた(Farkash et al 2020)。
これらの研究では、個々のウイルスのサイズは65〜91nm(平均76nm)であった。成熟して見えるウイルスは、主に細胞質内に存在し、小さなアレイに集中的に組織化されていた。ウイルス粒子は王冠状の形態をしており、電子密度が中程度のコアとその周囲を電子密度の高いスパイクで囲んだエンベロープで構成されていた。隣接する液胞には、粗い小胞体に関連した豊富な卵形の二重膜小胞が含まれており、ウイルスの集合体の可能性を表していた(Farkash et al 2020)。
これらの知見はまた、エクソソソーム細胞輸送を全身的なSARS-CoV-2ウイルス伝播のモードとして使用する可能性があり、COVID-19再活性化の潜在的な手段として役立つことを示唆した。
SARS-CoV-2感染の主な部位は肺であるように思われるが、これは腎臓や腸などの他の組織へのウイルス拡散源となる可能性があり、ここでは、ウイルスが便(Wang, Xu, et al. 経過中にウイルス感染が確立されるが、血中のウイルスRNAはまれにしか認められないが(Wang, Xu, et al. )
しかしながら、ウイルスは80〜100nmの大きさを有しており、ウイルス性SARS-CoV-2は、局所組織感染に先立って最初に血管に感染しなければならないことを示している(Monteil et al 2020)。
感染した肺胞単位は、末梢および硬膜下になる傾向がある。SARS-CoVはII型細胞内で伝播し、そこで大量のウイルス粒子が放出され、細胞はアポトーシスを受けて死滅する(Mason, 2020)。
SARS-CoVおよびSARS-CoV-2感染に伴う病理学的変化は、フィブリンに富んだヒアリン膜(第一の標的臓器として)を有するびまん性肺胞損傷(DAD)であり、感染した細胞から隣接する新しい細胞/組織に放出された遊離ウイルス粒子またはウイルス粒子を含む液胞化または二重膜小胞が拡大して全身を循環し、遠くの組織に到達するように播種される(Monkemuller et al 2020)。
このようにして、ウイルスは、血管系を含む多くの臓器に播種され得る(Monkemuller et al 2020;Varga et al 2020)。それは、内皮を攻撃して内皮炎を引き起こす可能性があり、それは、異なる器官にわたる微小循環機能の障害およびin-situ血栓形成を伴う頻繁に観察される血栓前血栓状態を説明する可能性がある(Puelles et al 2020;Su et al 2020;Varga et al 2020;Ye et al 2007、2020)。
脂質膜は、ミトコンドリア、小胞体(小胞体)、核、ゴルジ体などの多くの細胞小器官の境界を規定している。また、これらの細胞小器官は、細胞質からの物理的な分離と構造的な支持の両方を必要とし、生化学的な機能を果たすために必要不可欠なものである。
これまでに特徴づけられたすべての陽性鎖RNA(+RNA)ウイルスは、ゲノムの細胞質複製をサポートするために専用の膜構造の形成を誘導している(Knoops et al. コロナウイルスファミリーのメンバーは、平均直径300nmの典型的な二重膜小胞(DMV)と複雑な膜(CM)を誘導する(Knoops et al 2008、2012)。
通常、DMVクラスターは小胞体(ER)またはゴルジ体(ER-ゴルジ体)中間コンパートメントに由来し、新たに合成されたウイルスゲノム(電子密度の高い介在物として)、ウイルスRNA、ウイルスレプリカーゼタンパク質、およびウイルス粒子を含む。このようなDMVの多様性は、再感染者の分裂を説明している可能性があり、ある者はCOVID-19の症状を伴わないPCR陽性であり、他の者は急性から軽度の症状を有する。
コロナウイルス(例えば、SARS-CoV(Knoops et al 2008)、MERS-CoV(de Wilde et al 2013)、またはマウス肝炎ウイルス(MHV)(Ulasli et al 2010)など)に感染した細胞は、DMV(直径約250nm)で相互接続されたER由来の凸状膜の形で初期の膜再編成を表示する(Blanchard & Roingeard、2015;Knoops et al 2012)。
さらに、いくつかのCoV誘発DMVの外側膜の融合は、より大きなベシクルパケット(サイズが1〜5μm)の形成をもたらし得る(Knoops et al 2008)。細胞質細胞膜コンパートメントをハイジャックして、そのゲノムを増幅し、さらに発現させることができる「複製/転写複合体」を確立する能力は、研究されたすべての陽性鎖RNAウイルスの特徴的な特徴であり、この目的のために、しばしば、付属機能を調整することができるウイルス非構造タンパク質を利用する(Ahlquist, 2006; Mackenzie, 2005; Moriel-Carretero, 2020)。
SARS-CoV複製機構は、最大16個の非構造タンパク質(Nsp1〜Nsp16)で構成されており、Nsp3、Nsp4、およびNsp6はDMVの誘導に関与している(Angelini et al 2013)。Nsp4の変異は、膜のペアリングの明らかな欠陥を有する異常なDMVの形成にリンクされている。これは、ベロE6 9におけるSARS-CoVを含む、外膜内に囲まれた複数の単一膜小胞を有する単一膜小胞および二重膜小胞の出現を説明することができるかもしれない(Goldsmith et al 2004)。
一方、いくつかのコロナウイルス由来のNsp6の変異は、単膜小胞の形成を引き起こす(Al-Mulla et al 2014)。これらの観察は、膜再配列(ウイルスゲノム複製および転写機械の一部として使用するために宿主細胞膜をリダイレクトし、再配列すること)が、すべての既知のポジティブセンス一本鎖RNAウイルスによって使用される戦術を表していることを示している。
低温増殖条件下で通常の半分の量のDMVのみを産生しながら、正常に複製するNsp3およびNsp14の変異を有するマウスコロナウイルスを同定するために電子顕微鏡を用いた(Al-Mulla et al 2014)。Nsp5およびNsp16の変異を有するウイルスは、少量のDMVを産生したが、正常に複製した。定量的RT-PCRにより、これらの中で最も強く影響を受けたNsp3変異体は、野生型ウイルスよりも多くのウイルスRNAを産生することが確認された(Al-Mulla et al 2014)。
同じ系統で、それは実証された(Oudshoorn et al. 2017)MERS-CoVおよびSARS-CoVの両方について、Nsp3およびNsp4の共発現がDMVを誘導するために必要かつ十分であること、およびMERS-CoVのNsp3およびNsp4を個々のタンパク質としてまたは自己切断Nsp3-4前駆体としてのいずれかの共発現は、非常に類似したDMVの出現をもたらし、両方のセットアップにおいて、初期DMVに巻き込むように見えるジッパー状ERの増殖が観察されたことが示された(Oudshoorn et al 2017)。
ウイルス複製におけるNsp7-10の役割についての詳細な新しい知見が最近確立された(Gildenhuys, 2020)。Nsp7-10の切断の順序は、様々なウイルスプロセスを制御するために重要であり、タンパク質-タンパク質複合体の形成に関連性があるように思われる(Gildenhuys, 2020)。これらの重要な詳細は、効果的な介入の設計に用いることができる(Gildenhuys, 2020; Krichel et al 2020)。
DMVの形成、調節、および再形成、ならびに細胞内膜機械のリモデリングは、特にコロナウイルスに対して、創薬のための豊富な領域となった。ウイルス感染と戦う手段としてDMVを標的化するために使用され得る化合物のいくつかが最近レビューされた(Shahmohamadnejad et al 2020)。著者らは、まず、K22、オキシステロール結合タンパク質(OSBP)、OSW-1、T-00127-HEV-2、およびTTTP-8307のような、それらのNspタンパク質に作用して多くのポジティブセンスRNAウイルスと戦うために使用することができるいくつかの化合物を検討し、次いで、SARS-CoV-2に対するOSBPの使用を推奨した(Shahhmohamamadenjiad et al 2020)。
最近、ウイルス感染の初期に出現し、その一部がERに埋め込まれているように見える単膜小胞は、明らかに新生脂質滴(LD)に類似していることが指摘されている(Moriel-Carretero, 2020)が、これは、ER二重層の疎水性コア内でトリアシルグリセロールやステリルエステルなどの非極性脂質の核生成が進行して形成される膜封鎖小器官である。
実際、SARS-CoV感染時に誘導されたDMVの特異的な形態学的特徴として、内層は閉じた円を構成しているが、外層の脂質層は連続しており、他のDMVを巻き込んでいるという事実があり、全体の構造は、ホスファチジン酸の局所的な過剰の結果としてER内に捕捉されたもつれたLDに顕著に類似している(Moriel-Carretero, 2020)。
細胞外小胞(EV)は、ヒトの体内で天然キャリアのファミリーを代表し、細胞間通信において多くの重要な役割を果たしているが、最近、COVID-19を治療するためのプロテアーゼ阻害剤を送達するためのユニークな薬物キャリアとして使用されることが示唆された(Kumar et al 2020)。
一方で、ウイルスが、感染していない細胞に入るためにEV内細胞経路を使用し、感染した細胞から出るためにEV分泌経路をハイジャックすることができるという証拠があり、それにより、EVとウイルスが共通の細胞侵入および生体形成機構を共有していることを示す(Badiera et al 2020;Urburneli et al 2019)。
ウイルス感染一般およびHIV、HCV、およびSARSの感染性におけるEVの役割の解析に特化した多数の出版物が、最近レビューされている(Badierah et al 2020; Giannessi et al 2020)。HCVおよびHIV感染性におけるEVの役割は広範囲に文書化されていたが、EVの内細胞および分泌経路をハイジャックするSARSの能力は、ウイルス感染におけるEVの関与を分析する分野における新たな展開を表している(Giannessi et al 2020)。
全体的に、エクソソソームおよび他のEVの組成および生物学的活性は、様々な細菌、真菌およびウイルス感染の間に変化するので(Schorey et al 2015)、およびこれらのエクソソソーム/EVは、感染した細胞から標的にこのウイルス物質を運ぶために、ウイルスタンパク質および/またはウイルスRNAの断片を組み込むことができるので、それらは、ウイルス感染において重要な役割を果たすことが期待される(Raab-Traub & Dittmer、2017;Thery et al 2009;Urbanelli et al 2019)。
これらの重要な結論を支持するいくつかの証拠がある。例えば、最近、移植された肺に由来するエクソソームが、肺移植(LTx)後の慢性肺全移植片機能不全(CLAD)からの肺全移植片不全の免疫病因に寄与する可能性があることが報告された(Gunasekaran et al 2017)。実際、ドナーから移植された肺には、ライノウイルス、コロナウイルス(HKU1型、NL63型、229E型、OC43型)、呼吸器同期ウイルス(RSV)に由来する多数の病原性ウイルス抗原およびRNAが含まれていた。
一方、これらの患者から分離されたエクソソームは、特定のウイルス抗原、肺関連自己抗原(SAgs)、および不一致ドナーのヒト白血球抗原(HLA)およびSAgs(コラーゲンV(Col-V)およびKα-1チューブリン(Kα1T)など)を含んでいた。Gunasekaran et al 2020)。
この研究では、5人の肺移植レシピエント(LTxR)のうち3人にはウイルス抗原を含む循環エキソソームが一過性に存在していたのに対し、5人の呼吸器ウイルス感染症(RVI)を有するLTxRのうち2人には肺SAgsとウイルス抗原を含む循環エキソソームが持続的に存在していたことが明らかになった(Gunasekaran et al 2020)。
最近では、エクソソソームがアンジオテンシン変換酵素2(ACE2)をレシピエント細胞に移行させることができるというエビデンスが提示され(Wang, Chen, et al 2020)、それによりウイルスドッキングを受けやすくなり、SARS-CoV-2の内部化と感染に対するエクソソソームの支持機能が示唆された(Hassanpour et al.
さらに、以下で検討したいくつかの症例では、死後、生検、剖検、剖検、および内視鏡検査のサンプルの超微細構造を電子顕微鏡で分析したところ、ウイルスを含むDMVの存在が示唆された。EM組織学的解析(表1参照)では、剖検で得られた5つの小腸組織試料すべてにコロナウイルス(SARS-CoV)と一致するウイルス粒子が検出され、さらに大腸内視鏡検査で得られた終末回腸および大腸生検試料にもウイルス粒子が検出された。
ウイルス粒子は上皮細胞に限局しており、主に先端表面の腸球に存在し、まれに腺上皮細胞にも存在した。細胞内では、ウイルス粒子は拡張した小胞体と一致する拡張した細胞質小胞内に含まれていた。ウイルス粒子を含む小胞は、しばしば細胞質の先端に向かって見られた。
コロナウイルスのクラスターも表面の小絨毛から検出されたが,これは腸球の腔内表面からのウイルスの離脱を示唆していると考えられた.ウイルスの付着およびコロニー化にもかかわらず、絨毛の萎縮の証拠はなかった(Leung et al 2003)。
相似的に、表1は、遊離ウイルス粒子、単一または二重膜小胞内のウイルス粒子および/またはウイルス粒子、単一のDMV内の可変ビリオン径を有する複数のウイルス粒子が、SARS-CoV、MERS-CoV、およびSARS-CoV2に感染した患者に由来するサンプルにおいて一貫してファンドされたことを示している(Alsad et al 20018;Alsad et al 20018;Alsad et al 2002;Alsad et al 2002;Alsad et al 2003)。2018; Goldsmith & Miller, 2009; Kissling et al 2020; Larsen et al 2020; Martines et al 2020; Menter et al 2020; Qinfen et al 2004; Shieh et al 2005; Su et al 2020; Ye et al 2007; Zhu et al 2020)。)
表1. SARS-CoV、SARS-CoV-2、およびMERS-CoVウイルス粒子の超構造特徴を特徴づける電子顕微鏡。
原文参照
同様に、SARS-CoVに感染したベロE6細胞の電子顕微鏡分析は、典型的なDMVの早期形成および蓄積を明らかにし、これはおそらくウイルス複製複合体を運んでいた(Snijshder et al 2006)。さらに、感染細胞から分泌されたウイルス粒子の可視化は、明らかに見えるスパイクを含む、驚くほどよく保存された特徴を示した(Snijder et al 2006)。しかしながら、これらの著者らは、以前に提案された小胞の供給源としてのオートファジー経路の関与に反論した(Snijder et al 2006)。
以前に、SARS-CoVは、30分以内にVero E6培養細胞に付着し、宿主細胞に入り、ヌクレオカプシドのコーティングを解除することができることが発見された(Ng et al 2003a)。
多くの有益なEM画像が、侵入イベントの間に撮影された。感染後5分では、いくつかのウイルス粒子がベロ細胞の形質膜に並んでいた。侵入後(10分および15分)には、球状のコア粒子が大空胞(DMV)内の細胞質に移動した。そして、このような感染の初期段階(20分)でも、感染した細胞内で顕著なウイルス誘発性変化が明らかになった(コア粒子と同じ液胞内でミエリン様膜渦巻きの誘導が明らかになった)ことを発見した(Ng et al 2003a)。
しかし、感染後25〜30分で、球状のコア粒子は解離しているように見え、その場所では、ドーナツ型の電子密度の高い構造が観察された。これは、ウイルスゲノムがらせん状核カプシドの中に埋め込まれていることを表していると考えられる(Ng et al. 現在、これらの重要なウイルス誘発変化は、むしろよく知られている(Al-Mulla et al 2014;Angelini et al 2013;Knoops et al 2012;Oudshoorn et al 2017)。
その後の包括的な解析では、ベロE6細胞におけるSARS-CoV(患者から単離された株2003VA2774)の全複製サイクルを、感染後1時間から30時間(p.i.)まで追跡した(Ng et al 2003b)。この研究により、感染後1時間以内に観察された最も明白な超構造的変化は、ゴルジ複合体および関連する小胞の増殖であり、成熟の異なる段階でウイルス核カプシドを含むゴルジ嚢のいくつかのトランスゴルジ嚢の膨潤が観察された。
また、5時間後には細胞外ウイルス粒子を含む細胞が5%程度になり、この数は1時間後には30%程度にまで急速に増加した。膨潤したゴルジ嚢に見られることに加えて、ウイルス前駆体は大きな液胞にも観察され、複製周期のかなり早い時期に出現したため、複製複合体を表す膜渦巻きと密接に関連していた(Ng et al 2003b)。
前述のように、そのような膜状渦巻きの形成は、ウイルスゲノム複製および転写機械の一部として使用するために宿主細胞膜をリダイレクトおよび再編成するためのウイルス戦術の一部を表している(Al-Mulla et al 2014; Angelini et al 2013; Knoops et al 2012; Oudshoorn et al 2017)。後期の感染段階(12〜21時間後)では、感染した細胞の細胞質は、成熟したウイルスと球状コアの混合物を有する多数の大きくて滑らかな膜包埋液胞を含むことが示された(Ng et al 2003b)。
これらのウイルス含有液胞のいくつかは、成熟した子孫ウイルス粒子のエキソサイトーシスに基づく輸出のために準備された細胞周辺部に近接していた。最後に、最後の感染段階(24〜30時間後まで)では、細胞表面は細胞外ウイルス粒子の結晶性アレイを一般的に含んでいた(Ng et al 2003b)。
これらの研究は、SARS-CoVの侵入イベントが本当に速いことを示した。しかし、スパイクタンパク質がACE2に対する親和性がSARS-CoVよりも10〜20倍高いSARS-CoV-2(COVID-19)の侵入イベントの持続時間について何が言えるだろうか?
15の係数(前述の10-20倍の受容体に対する親和性の平均値)を用いて、SARS-CoVの侵入に必要な時間(30分)をこの値で割ると、SARS-CoV-2が宿主細胞に侵入するのに必要な時間はわずか2分であることがわかるだろう。
もちろん、これらの計算は実験的な検証が必要である。しかし、このような計算は重要である。なぜならば、COVID-19感染が他のヒトCoV感染よりも感染性が高く、攻撃的であるかを示すものであるからである。
また、鼻咽頭ルートを介したSARS-CoV-2感染は、ウイルスが特定の細胞受容体に迅速に結合し、迅速に宿主細胞内に入り、20〜30分以内に上皮組織細胞内で精力的かつ積極的に複製されると推測することもできる。12~24時間以内に、成熟したウイルス粒子は、感染した細胞から放出され、近くの細胞に拡散したり、下気道や人によっては消化器系に侵入したりする。このようなシナリオは、SARS-CoVによるベロE6感染でも模倣される可能性があるのであろうか?
一般的にSARS-CoV-2はSARS-CoVと強い類似性を示しており、特に超音波病理組織学的に類似していることが明らかになっている。培養細胞のSARS-CoV感染は、以前に特徴づけられたコロナウイルスと類似した特徴を示している。SARS特有の特徴は、大きな顆粒状の細胞質領域、ヌクレオカプシド包接体の存在、および典型的なDMVを含む。
いくつかのSARSの剖検では、EM検査により、肺組織の肺細胞、神経系および腸組織の細胞内に細胞質のウイルス粒子が存在することが明らかになった(表1)。これらのウイルス粒子の大部分は、膜結合小胞内に存在していた。ウイルス粒子は、肺組織のマクロファージ内でも観察されている。さらに、感染細胞内の包接体の存在は、いくつかの研究で報告されており、そのような包接体のウイルス起源は、免疫金標識によって確認されている(Gu & Korteweg, 2007; Zeng et al 2020)。
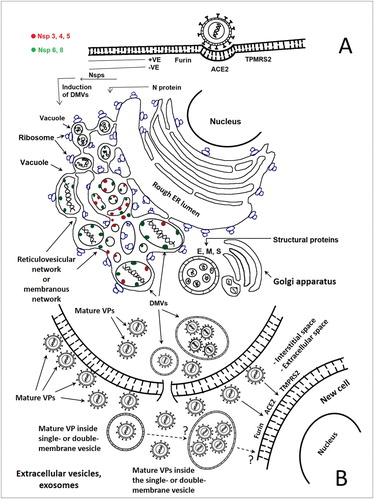
この論文で検討されたデータは、他の多くのウイルスと同様に、SARS-CoV-2が、生殖および全身的なウイルス拡散のモードとして、エクソソソームおよび細胞外小胞細胞輸送経路を利用していることを示している(図2を参照)。
SARS-CoV-2を搭載したエクソソームやEDMVの放出というこの「トロイの木馬」戦略は、回収されたCOVID-19患者の7-14日後の退院後のウイルスRNAの出現のための合理的な説明を表しているのであろうか?
そのような隠されたエクソソーム/EDMVの中には何があるのか、また、もし存在するとすれば、「沈黙」の期間、すなわち、回復した患者が退院した後、COVID-19の再感染/再活性化を反映してウイルスRNAが再び出現し始める前に、どこに隠れているのか?これらは重要な疑問であり、その答えが待たれている。
図2. A. ヒト宿主細胞(生体内試験(in vivo))および/またはベロE6細胞(試験管内試験(in vitro))におけるSARS-CoVおよびSARS-CoV-2の仮説的ライフサイクル。
感染細胞の細胞質に存在するウイルス誘導性二重膜小胞は、コロナウイルスの複製、集合、輸送、押し出し、および成熟したウイルス粒子(遊離小胞および/または小胞内)の脱落のためのプラットフォームである。ウイルスに感染した細胞は、ウイルスが複製する部位を表す単一/複数の二重膜小胞を含む、改変された膜の網状ネットワークの形成を実証した。すべては、荒い小胞体と連続している。ウイルス+RNAは、細胞質中に放出され、主にNspをコードするウイルスポリタンパク質に翻訳され、これは、DMVを刺激/誘導して、小胞内のウイルス粒子を生成するためにゴルジスタックと関連してウイルスのライフサイクルを進行させ、完了させるが、これは、最終的には、漿膜と融合する。DMVは、成熟または未熟なウイルス粒子、または非集合ウイルス装置を含むことができる。Nsp3〜8はCMV上に存在するが、Nsp8の一部はDMV内にも検出される。SARS-CoV-2感染者のサンプルの外観の組織学的および超構造解析は、成熟したウイルス粒子のほか、DMV内部の未熟なウイルス粒子または非集合型ウイルス装置の存在を示した。図示は、(Alsaad et al 2018; Angelini et al 2013; Bulfamante et al 2020; Goldsmith & Miller、2009; Knoops et al 2008; Menter et al 2020; Oudshoorn et al 2017; Perlman & Netland、2009; Qinfen et al 2004; Shieh et al 2005; Sims et al 2008; Su et al 2020)からのデータに依存する。B. 成熟および未熟なウイルス粒子は、SARS-CoV-2のテキストに記載されているように、新たに隣接する細胞に拡散/放出されるが、細胞外小胞(エクソソソーム)がSARS-CoV-2ウイルス粒子を細胞内に導入することについては、まだ文書化する必要がある。