Contents
Old friends meet a new foe
A potential role for immune-priming parasites in mitigating COVID-19 morbidity and mortality
www.ncbi.nlm.nih.gov/pmc/articles/PMC7665448/
オンラインで公開2020年10月20日
COVID-19の罹患率と死亡率を軽減するための免疫プライミング寄生虫の役割の可能性
要旨
新規ウイルス、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)および関連するコロナウイルス病2019(COVID-19)は、ヒトが進化した免疫応答を制限されていない病原体を表している。最も重篤な症状は、過活動性の炎症性免疫応答と関連しており、バランスが取れていないとサイトカインストーム、組織の損傷、および死に至る。Hygiene/Old Friends仮説を含む進化医学内の仮説は、この過活動性免疫応答を理解し、おそらく制御するための重要なレンズを提供する。この記事では、土壌伝染性蠕虫(STHs;すなわち腸内寄生虫)との感染がSARS-CoV-2の症状を緩和し、最悪のCOVID-19の転帰を緩和する上で果たす可能性がある役割を探る。具体的には、STHsは免疫系の免疫抑制性および調節性Tヘルパー2(TH2)分枝を刺激し、ACE2受容体(すなわち、SARS-CoV-2が宿主細胞に感染するために使用する受容体)の発現を減少させ、SARS-CoV-2感染によって引き起こされる免疫系の炎症性TH1/TH17分枝のバランスをとり、抗炎症性/調節性サイトカインの放出を介して炎症を抑制する。STHは一般的であり、社会的弱者や社会から疎外された人々に影響を与えるため、これらの寄生虫がCOVID-19の転帰にどのような影響を与えるかを検討することは特に重要である。STH感染が蔓延している地域では、しばしば予防インフラや医療が不足していることが特徴であり、これがSARS-CoV-2感染やCOVID-19発症のリスクをさらに悪化させている可能性がある。このため、我々はまた、SARS-CoV-2感染症とSTH感染症の両方の疾患転帰に寄与する生物文化的要因を探求する。COVID-19に関する生物文化的・進化医学的視点は、この病気のグローバルな影響を理解する上で極めて重要である。
要約:
COVID-19の世界的な影響と様々な症状を理解するためには、進化学的な視点が必要である。我々は、土壌伝染性蠕虫(ヒトと共進化した一般的な寄生虫)との共感染が、炎症性免疫活動を抑制し、それによってCOVID-19病の重症度を低下させる可能性があるかどうかを検討している。また、感染パターンを形成する構造的・生活様式的要因についても検討した。
キーワード
COVID-19,衛生仮説、オールドフレンズ仮説、土壌伝染性蠕虫、生物文化的視点、ミスマッチパラダイム
はじめに
新型ウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)および関連するコロナウイルス病2019(COVID-19)は、世界の人口の間で急速に広がった。2020年9月6日までに、推定26,962,795人が感染陽性と判定され、880,955人が死亡している[1]。しかし、現在のエビデンスは、COVID-19による罹患率および死亡率のリスクが個人および集団によって異なり、特定の人口統計学的グループ(高齢者や慢性疾患の持病を持つ人など)および国(米国、ブラジル、インド、ロシアなど)では、より高い感染率および/またはより悪い疾患転帰を示していることを示唆している[1]。これまでのCOVID-19の研究のほとんどは、近縁疾患の決定因子と危険因子に焦点を当ててきた [2-4];しかしながら、SARS-CoV-2/COVID-19を進化のレンズを通して検討することも重要であると我々は考える。
この理論に基づいたレビューでは、COVID-19の病原性の近因と最終的な原因の両方を検討し、進化医学の枠組みを用いて、我々の進化した生物学と現在の生活様式との間のミスマッチがCOVID-19の疾患転帰をどのように形成するかを検討すべきであると主張している。COVID-19は高炎症性の免疫応答と関連しているため、我々はこの論文では、人間と長い共進化の歴史を共有しており[5-7]、COVID-19で観察されるような有害な炎症応答[8]を抑制することが知られている特定の寄生種、いわゆる「古い友人」の免疫調節効果に焦点を当てている。
特に、我々は、ライフコースを通して、また集団間での寄生虫疾患曝露の変化が免疫系の調節にどのように影響を与え、SARS-CoV-2に対する免疫反応性に影響を与え、COVID-19の重症度を変化させる可能性があるのかを明らかにするために、進化論的な視点の必要性を強調している。我々はミスマッチパラダイムを用いて、寄生虫への曝露とそれに続く免疫の発達を変化させる進化的に新しい環境が、より強固な炎症性免疫反応をもたらし、COVID-19の重症化リスクを増加させる可能性があることを検討している。このアプローチにより、寄生虫とSARS-CoV-2の感染パターン、およびCOVID-19の疾患転帰の両方に影響を与える共通の社会生態学的要因を特定するために、生物文化的視点を適用することが可能となる。最後に、寄生虫感染とCOVID-19病変転帰との関係を明らかにするために必要な今後の研究についての議論を行う。
マクロパラサイト感染とSARS-CoV-2に対する免疫応答との間の相互作用の可能性を探ることは、時宜を得た非常に重要なことである。寄生虫とCOVID-19との感染は世界中の多くの場所で発生しており、特に医療介入へのアクセスが限られている地域では、COVID-19との継続的な戦いによって基本的な医療サービスや抗ヘルミン公衆衛生キャンペーンに必要な政府のリソースが枯渇しているため、感染の有病率は増加する可能性が高いと考えられる。この情報は、医療従事者や研究者がSARS-CoV-2感染の様々な可能性のある転帰をよりよく理解し、追跡するのに役立つかもしれない。
既知のCOVID-19リスクファクター
COVID-19は複数の臓器系に影響を与え、大きな呼吸窮迫を引き起こし、血管、消化管、中枢神経系に影響を与える可能性がある [9-11]。現在のエビデンスによると、感染者の最大81%がほとんど症状を経験しないことが示唆されているが [12-14]、最も感染した20カ国の死亡率は国によって大きく異なる(例:フィリピンと南アフリカの2%、ブラジルと米国の3%、スペインの6%、メキシコの11%)[15]。疾患転帰の幅と変動は、COVID-19の予後を形成する個人レベルおよび集団レベルの因子が存在することを示唆しており、既存の健康状態を含む。
最近のエビデンスでは、肥満、心血管疾患、自己免疫疾患、およびその他の慢性疾患とCOVID-19の症状がより重症化し、入院や感染症による死亡のリスクが高まることが明らかになっている[2, 4, 16]。重要なことに、COVID-19症状に関連するほとんどの併存疾患は、炎症性免疫活性と関連しており、過剰反応性の炎症反応が疾患の重症化の主要な推進因子である可能性を示唆している[17, 18]。さらに、既往症にかかわらず、健康状態が最悪のCOVID-19患者は、典型的にサイトカインストームと呼ばれる過剰反応性の炎症反応を示しており、これはサイトカインが短期間にあまりにも多く放出されることによって引き起こされる重篤な免疫反応であり、宿主組織の損傷を広範囲に引き起こし、高凝固を引き起こす [17, 18]。
COVID-19病変の転帰には年齢も重要な役割を果たしているようであり、死亡率は高齢者で最も高い [2]。これは、幼少期によくみられる繰り返しのウイルス曝露による免疫プライミングに起因する可能性がある[3]。稀ではあるが、最近の証拠は、COVID-19に関連した高炎症反応の有害な影響から子供たちが完全に保護されているわけではないことを示唆しており、一部の以前に感染した子供たちは、後に致死的な多系統炎症性症候群を発症する可能性がある [22]。それでも、重度のCOVID-19の年齢プロファイルは、個人の免疫系のばらつき、特に調節性および炎症過程に関する重要性を示唆している。
疾患パターンにおける人口レベルの違いもまた明らかである。政治的・文化的要因がパンデミック対策の有効性を形成することは確かであるが、地域レベルでの根本的な差異(例えば、人口密度、衛生・衛生、疾病回避に関する教育、他の疾患の有病率)およびそれに続く免疫系の発達の初期段階でのばらつきもまた、慢性炎症リスクおよびSARS-CoV-2に対する免疫反応を形成する上で重要な役割を果たしている可能性がある。その結果、特定の個体や集団が重度のCOVID-19の転帰を経験するリスクが高い理由を明らかにするためには、進化論的な視点が必要とされる。
COVID-19のアウトカムを理解するための進化的仮説
進化的ミスマッチ:衛生と旧友仮説
進化医学の分野は、COVID-19パターンを研究するための重要なレンズを提供している。進化医学(またはダーウィン医学)は、自然淘汰がどのようにして人体を形成し、有益な形質、トレードオフ、そして一見最適ではないように見える物理的なデザインにつながってきたのかを扱う[23-25]。言い換えれば、進化医学は、人間の体がどのように機能し、何が病気を引き起こすのかについての近縁的な質問をすることを超えて、自然淘汰と他の進化的な力がどのように怪我や病気に個人を素因づける脆弱性をもたらしたかについての究極の説明を検討するために移動する[24-27]。進化医学の中の一つのパラダイムは、先祖代々の環境(人間の進化を形成した)と現在の環境条件の間の「環境のミスマッチ」がどのように病気のリスクを増加させるかを探求している。ミスマッチのパラダイム内の一つの例は、衛生仮説は、多くの高所得地域の衛生の高レベルは、主要な発達期間中に減少した病原体への曝露につながることを主張し、進化的に関連する病原体による免疫刺激のこの欠如は、慢性炎症、アレルギー、自己免疫[28-33]の免疫異常と関連する増加につながると考えられている。
衛生仮説に対抗するものとして、オールドフレンズ仮説があるが、これは、人間が特定の常在菌やマクロパラサイト種と共有する共進化的な関係に焦点を当てており、マクロパラサイト感染に反応して特別に進化した免疫系の特定の枝(すなわち、タイプ2[TH2]免疫)に焦点を当てている[5-7]。この仮説によると、比較的最近の医療、衛生、衛生の進歩により、これらの「古い友人」にさらされることが制限され、結果として、炎症性の経路を好む免疫調節異常が生じ、無害な刺激や自己生成の刺激に対して体が過剰反応するようになる。この調節異常は最終的に、高所得地域で見られる慢性炎症性疾患(アレルギー、自己免疫疾患、心血管疾患など)の高率化に寄与している [5, 29, 34]。
免疫抑制を促進するヘルミンスと共進化のメカニズム
ヒトに感染するマクロ寄生虫には多くの種類がある。ここでは、世界的な有病率と共進化した免疫調節作用のために、土壌伝染性蠕虫(STH)と呼ばれる寄生性腸内虫のグループに焦点を当てる。STHsは、世界的に最も普及している無視された熱帯病(すなわち、極貧の地域に見られる細菌性、ウイルス性および寄生虫性疾患のグループ)である[35]。注目すべきことに、STHは世界の人口の4分の1以上を感染させており、数百万人の個体がいくつかの主要な種に感染している:アスカロイド(世界で約8億件)鞭毛虫(世界で約4億件)鉤虫(世界で約4億件) [36]。多くの場合、無症状または軽度であるが、重度のSTH感染は栄養不足、精神・発達の遅れ、臓器不全、死亡に至る可能性がある[37]。STHは広く普及しており、医療へのアクセスが限られている脆弱な低所得者層に多く影響を与えるため、COVID-19の転帰と併せて考慮すべき重要な感染症群である。
他の寄生虫と同様に、STHはバランスのとれた寄生によって宿主の中で生き延びる。このような大型病原体に対する過剰反応的な免疫応答は、宿主の免疫病理学が蔓延することになるため、このバランスのとれた寄生は、宿主にとって有害な症状のリスクを低減させる。例えば、宿主が脳内のタニアソリウム(サナダムシの一種であるが、STHではない)の嚢胞に反応して炎症をダウンレギュレートすることに失敗すると(すなわち、嚢胞症)感染は発作および死をもたらす;しかしながら、免疫活性の低下は免疫病理学を低下させるが、宿主の耐性の増加は嚢胞の増殖を可能にする [8, 39, 40]。このように、寄生虫と宿主の両方が生き延びることができるバランスのとれた免疫応答は、信じられないほど複雑で微妙な共進化の例を示している。研究者たちは、STHが宿主の免疫システムを乗っ取る複雑な方法を研究し続けている。一次感染時には、寄生虫から直接分泌されるSTH抗原とその派生産物がTH2応答の引き金となる [37, 41, 42]。TH2応答が寄生虫によって引き金となると、免疫細胞プロファイルはより抗炎症性になる。一方、細胞内の微生物やウイルス感染は、炎症性のTH1およびTH17応答を誘発する。
より具体的には、蠕虫抗原は、インターロイキン(IL)-12の産生を抑制し、TH1経路の誘導をブロックすることにより、積極的に炎症を抑制することができる[8]。この蠕虫の免疫調節は最終的に、IL-4,IL-10,IL-13,IL-33,およびトランスフォーミング成長因子β(TGF-β)を含む免疫調節性または抗炎症性サイトカインの産生を有利にする無症状の感染をもたらす[8, 43]。全体として、STH感染は一般的にCD4+ T細胞、Treg細胞およびBreg細胞の産生を増加させ、TH1免疫細胞型の死をもたらす[43, 44]。インターロイキン-10,IL-4およびIL-13は、IL-10が抗炎症性であるのに対し、IL-4およびIL-13は、皮膚(鉤虫)および肺(鉤虫およびアスカロイド)を介したSTHの移動によって引き起こされる組織損傷の修復、ならびにSTHが直接摂食する際の腸の損傷(鉤虫および鞭虫)の修復に関与しているため、蠕虫感染の宿主耐性にとって特に重要である(表1)[8]。
表1 3 種類のパンデミック性 STH の種特異的宿主関係とサイトカインの関連性
| 感染タイプ | 体内の場所/関係 | サイトカイン関連 | 参考文献 |
|---|---|---|---|
|
カイチュウ (例:Ascaris lumbricoides) |
肝臓と肺を通って移動します 成熟して受動的に小腸を養う |
増加:
|
[ 37、45-48 ] |
|
鞭虫 (例:Trichuris trichiura) |
成熟しており、大腸に直接付着/摂食します |
増加:
|
[ 37、47、49、50 ] |
|
鉤虫 (例:Ancylostoma duodenale、Necator americanus) |
皮膚から入る 肺を通って移動します 成熟しており、上部小腸に直接付着/摂食します |
増加:
|
[ 37、51-53 ] |
aこの表は一般化された概要を示しているが、これらの関係は複雑であることに注意することが重要である。例えば、STHに対する免疫応答は、STH感染の持続期間や強度と同様に、年齢によって異なるようである。さまざまなSTHは体のさまざまな部位に影響を及ぼすため、サイトカインのレベルや影響も、サンプリングの場所やサンプリング技術によって異なる場合がある。
b下線を引いたサイトカインは免疫抑制活性および/または抗炎症活性と関連し、斜体を引いたサイトカインは免疫活性の亢進および/または抗炎症活性と関連している。これは、各サイトカインの最も一般的に議論されている効果を表しているが、いくつかのサイトカインは、その活性(例えば、抗炎症性対抗炎症性)が文脈によって異なることに注意することが重要である。
土壌伝染性の蠕虫類は、同じ器官系の多くに影響を与えるため、COVID-19と併せて検討することが重要である。例えば、多くのSTH種は肺に影響を与え、幼虫期に肺組織を介して移動するものもある [37, 38]。さらに、STHは腸および全体的な免疫系にも影響を与える[37]。累積的に、慢性的なSTH感染は、炎症を抑制しながら、免疫不耐性、免疫調節、組織治癒を促進する。
STHのない世界:免疫異常と過敏症
多くの一般的な慢性炎症性疾患(例:自己免疫疾患、心血管疾患、肥満、加齢に伴う慢性炎症)は、高所得国でパンデミックしているミスマッチ疾患と考えられている。このパターンは、身体活動レベルの低下、不健康な食生活、STHsのような重要な免疫プライミング病原体への暴露の減少など、複数のライフスタイル要因(図1)に起因している可能性が高い[8, 54]。STHが免疫不耐性を誘発し、炎症を抑えるために使用するプロセスは、無害な環境抗原(アレルゲン)や常在菌に対する耐性だけでなく、自己耐性を促進する恒常性プロセスと非常によく似ている[8]。したがって、STH感染による免疫プライミングの喪失は、アレルギー性および自己免疫応答をもたらすと考えられている。例えば、TH2/Tregプロファイルを促進するために蠕虫類がいないと、常在菌や特定の食物タイプに対する耐性が失われ、炎症性腸疾患やクローン病のような状態が発生する可能性がある[8]。Trichuris trichiura (Whipworm) とその近縁種である Trichuris suis (pig whipworm) は、局所的な TH2/Treg 応答を誘発する排泄物による腸内炎症を減少させることが示されている [42, 53, 55, 56]。
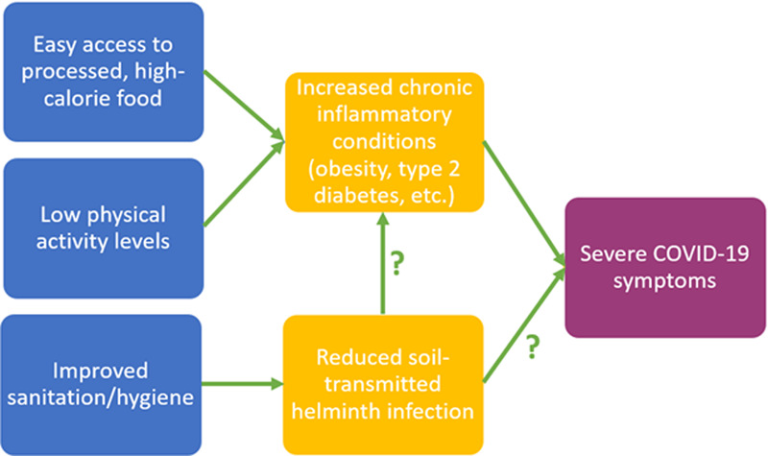
図1 慢性炎症状態の上昇率およびSTH感染率の低下と関連する生活習慣因子
STH感染率低下の生理的効果は、慢性炎症の増加と重度のCOVID-19症状のリスクの両方に寄与しているという仮説が立てられているが、慢性炎症状態はCOVID-19疾患転帰の悪化のリスク因子として同定されている。
重要なことは、STH関連の免疫活性がアレルギーリスクと関連していることを示唆するエビデンスである。過剰に活性化されたTH2免疫経路はアレルギー感受性の増加と関連しており、マクロパラサイトに反応して最初に進化した免疫経路が、非寄生性抗原によって引き金を引かれると、調節不全となり病原性を持つようになることを示唆している[38]。アレルギーの場合には、蠕虫も引き金となる免疫抑制性および抗炎症性の細胞を介さずに、TH2応答が活性化されるようである。例えば、蠕虫が樹状細胞に結合してTH2応答を誘発すると、最終的に肺の炎症を抑えるIL-10とTregの産生によってバランスが取られる[38]。調節細胞とのこのバランスはアレルギー反応では明らかではなく、無害な抗原に対する過剰反応につながる。
局所的な抗炎症作用だけでなく、乳児期や幼児期の免疫系の発達段階でのSTH感染による免疫プライミングは、将来の免疫応答を適応的なTH2優勢免疫へとシフトさせ、TH1免疫と自然炎症反応の両方のバランスをとることで、全身の炎症からの保護を提供する可能性がある[57]。したがって、重要な発育期にSTH感染にさらされると、生涯にわたって炎症が減少する可能性がある。しかしながら、STH感染が後の免疫機能を形成する上で最も大きな役割を果たす年齢を明らかにするためには、様々な病原体負荷を経験している集団を対象に、さらに縦断的な研究を行う必要がある。さらに、成人期に初めてSTH感染に曝露された場合にも、全身的な炎症の低下が起こる可能性があるが、この遅い年齢での曝露の程度や効果は不明である[29]。それでも、暫定的で予備的ではあるが、蠕虫感染に関連した全身炎症の減少は、多発性硬化症や関節リウマチなどのいくつかの炎症性自己免疫疾患の予防や症状の軽減にリンクしている[58, 59]。
STHに関連した免疫応答が慢性炎症性疾患の発症リスクを形成する可能性は、COVID-19に対抗する上で重要であることが証明されるかもしれない。STHは「古い友人」であり、長い進化の歴史の中でヒトと共存してきたが、最近のヒトの歴史の中では、新規でより毒性の強い病原体が出現している。ヒトは、これらの新たな健康問題に対する特異的な進化した免疫反応を持たないため、SARS-CoV-2で明らかなように、個人に容易に感染し、群衆の間で急速に拡散することが可能である[60, 61]。ウイルスに対する免疫応答は、結果的に効果がないか、あるいは過剰な炎症による宿主組織への付随的な損傷を引き起こす可能性があるが、STHとの感染によってバランスが保たれる可能性がある。
土壌伝染性蠕虫およびCOVID-19の予後
マクロパラサイトの感染とは異なり、ウイルスはTH1免疫応答を誘発するが、これは炎症性サイトカイン(例:IL-6,CRP、TNF-α、IL-1β)によって支配されている[62]。健康な免疫系では、TH1とTH2の両方の応答が重要であり、お互いのバランスをとるように作用し、仮に免疫調節障害を防ぐことができる[63]。これらの関係は、COVID-19の疾患転帰を理解する上で進化医学の視点が必要であることを示している。炎症性サイトカインIL-6,IL-8,TNF-αのレベルの上昇は、患者の生存を予測するようである。異なる免疫経路間の複雑な相互作用がCOVID-19の疾患進行をどのように促進するかを明らかにすることは、効果的な介入の設計において重要である。実際、TH2応答が高炎症性のTH17応答に対抗する能力を持つことから、TH2応答を誘発する刺激がCOVID-19ワクチン開発の標的とされている[65]。
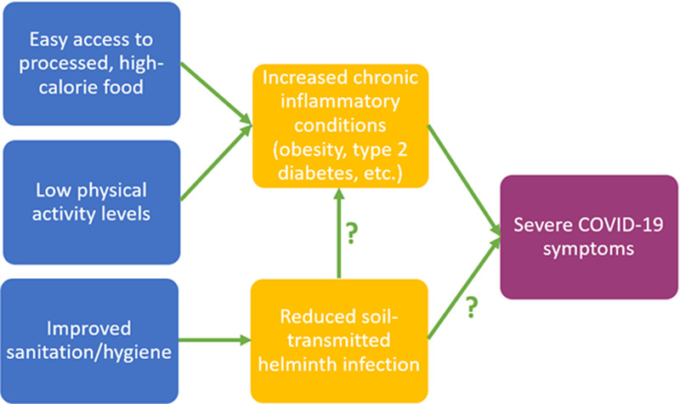
図2Aは、COVID-19による急性呼吸窮迫症候群に関連する免疫応答および疾患転帰を示す。この重度の炎症性反応は、TH1およびTH17経路によって駆動される「サイトカインストーム」の発生をもたらし[16]、その結果、炎症性および破壊性サイトカインの制御不能な増殖をもたらす[16,17]。調節性および免疫抑制性サイトカイン(すなわち、IL-4,IL-10,IL-13,IL-33,TGFβ)およびTreg細胞の放出を介して、炎症性TH1およびTH17応答のバランスをとり、調節する免疫抑制性TH2応答を誘発する能力のために、STHSに感染した個体は、より穏やかなCOVID-19の症状を経験し、サイトカインストームを経験しないことがある[66](図2B)。
図2
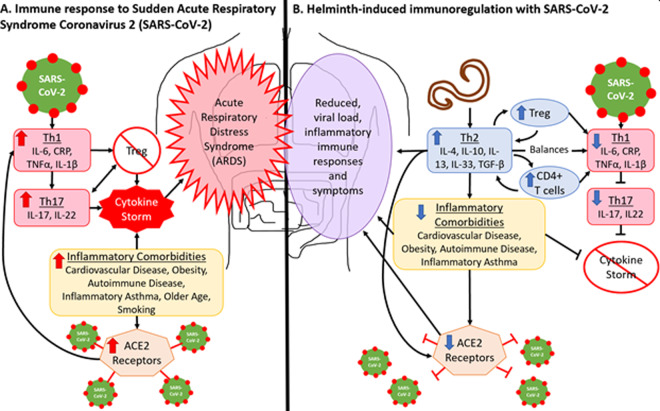
A)SARS-CoV-2は、炎症状態で上昇するアンジオテンシン変換酵素(ACE)2受容体を介して宿主に感染する。感染は、炎症性サイトカインを産生するTH1応答を誘発する。過剰に産生されると、TH1サイトカインは高炎症性のTH17応答を引き起こす [17, 18]。これらの応答は、炎症性サイトカインを抑制するために必要なTreg細胞の分化を阻害する。炎症性サイトカインが制御不能に増殖すると、サイトカインストームが起こる。B)STHsに対するTH2応答は、抗炎症性サイトカインおよび調節性サイトカインの産生を介して炎症を抑制するとともに、CD4+ T細胞およびTreg細胞の産生を介してTH1経路のバランスをとることで炎症を抑制する[8, 43, 44]。TH17応答が誘発されにくくなり、サイトカインストームは起こらないはずである[66]。STHは炎症性合併症の減少と関連しており[8,34]、サイトカインストームの可能性とACE2受容体の存在の可能性をさらに低下させる[69-71]。また、TH2応答はACE2受容体の存在を直接的に減少させる可能性がある[10,72]。
さらに、サイトカインストームを引き起こすプロ炎症性サイトカインの増産は、パターン認識受容体の活性化によって引き起こされるという証拠が示されている[67]。これらの同じ受容体は、慢性STH感染を促進する免疫調節戦略の一部として、蠕虫によって標的とされている[43, 68]。したがって、抗炎症性免疫細胞の産生を増加させることに加えて、STH感染はまた、プロ炎症性免疫応答の上流の調節因子に作用する可能性があり、これにより、蠕虫類がサイトカインストームを含むCOVID-19症状のリスクを減少させる別の経路を提供する。
一般的に炎症の亢進は、宿主ACE2-受容体の増加と関連しているようであるが、これはSARS-CoV-2が細胞に感染するために使用するものである[21]。これらの受容体の高レベルは、心血管疾患、糖尿病、喫煙、炎症性喘息などの炎症状態で明らかである[69-71]。TH2応答は、ACE2受容体の存在を減少させるように見える[72]。一例を挙げると、TH2経路によって誘発されるアレルギー性喘息(非アレルギー性喘息とは対照的)は、ACE2発現の低下と関連している[72]。これらの知見により、一部の研究者は、アレルギー性喘息が重度のCOVID-19 [72]から何らかの保護を提供する可能性があることを示唆しているが、この関連性についてはまだ議論されている[69]。我々の知る限りでは、STHとACE2発現との関係を直接検証した研究はない。いくつかのSTHsは、宿主寄生虫耐性を促進するために肺のTH2応答を刺激する [38] ことから、STHsは肺でアレルギープロセスと同じ効果を持ち、同時に抗炎症性および調節性の免疫応答を誘発することを示唆している。この理由から、STHの存在は呼吸器細胞上のACE2受容体も減少させ、それによってSARS-CoV-2ウイルスの宿主への感染能力を阻害し、ウイルス負荷を減少させる可能性が高いと考えられるが、この考えにはさらなる試験が必要である。
STH感染の他の側面もまた、ウイルス負荷を減少させる可能性がある。STHへの感染はIL-5産生の増加(表1)をもたらし、これは好酸球症(すなわち、好酸球と呼ばれる白血球の一種のレベルの上昇)と関連している[73,74]。好酸球は肺のSTH幼虫を標的とし、免疫調節および抗ウイルス効果を引き出す [73,75]。COVID-19に関する初期の研究では、COVID-19で入院した患者では好酸球減少症(すなわち、全血球数で好酸球が少ないか全くない)が一般的であり、死亡率の上昇と関連していることが明らかになった[76]。抗ウイルス効果のため、SARS-CoV-2曝露前のSTH感染によって引き起こされた好酸球減少は、感染の初期段階でウイルスと戦い、ウイルス負荷を減少させるように働く可能性があった[75]。SARS-CoV-2ウイルス負荷の減少は、疾患転帰を強く形作る可能性がある。現在のエビデンスは、高ウイルス負荷がCOVID-19の重症度と正の相関があることを示している;具体的には、呼吸器サンプルから測定されたウイルス負荷は、軽症の場合に比べて重症のCOVID-19症状を持つ患者で有意に高かった [77-79]。高いウイルス負荷はまた、プロ炎症性サイトカイン(例:IL-6)の上昇と相関していた [77-79]。したがって、ウイルス負荷およびプロ炎症性免疫活性のSTH関連の低下は、最も重篤な疾患転帰を予防する可能性がある。
ウイルス負荷の減少およびCOVID-19関連の高炎症の緩和に加えて、STH感染はまた、COVID-19の罹患率および死亡率の危険因子であることが知られている既存の慢性炎症性疾患の有病率を減少させる可能性がある[5-7, 28-34]。これらの危険因子は、発育期にTH2プライミングが行われず、ベースラインの炎症活性が変化しているために、高炎症反応(すなわちTH1,TH17)を起こしやすい免疫系を反映しているため、COVID-19の転帰が悪化することと関連している可能性がある。STHへの曝露とTH2のプライミングがなければ、これらの炎症反応のバランスをとることができず、過活動性のTH1とTH17の反応は、SARS-CoV-2に感染した人をサイトカインストームに陥れる可能性がある。もしそうであれば、STH感染が蔓延している(慢性疾患の既往が少ない)集団では、致死的なサイトカインストームの発生が少なくなるなど、COVID-19病変の転帰が良好であることを示唆している。
COVID-19病変転帰と共存寄生虫感染との関連性を検証した研究は非常に少ないが、初期の限られたエビデンスは、意味のある関連性がある可能性を示唆している。例えば、まだ査読されていないが、ある予備研究では、世界中のCOVID-19の有病率に関するWHOのデータと、様々な寄生虫感染症の有病率に関するデータを比較した。研究者らは、症候性COVID-19の発生率とSTHの有病率との間に逆相関があることを文書化した[80]。また、STH感染症が蔓延している国では、全国的にCOVID-19レベルが高いと報告するオッズが有意に低いことも示している [80]。これらの知見は、STHがCOVID-19の健康アウトカムを改善する可能性があるという我々の仮説を暫定的に支持するものであるが、この初期の研究では、寄生虫感染がCOVID-19の症状を悪化させる可能性のある経路を検討しておらず、また、この関係を推進する他の生物文化的要因を検討していない。
例えば、STHを含む寄生虫が世界的に大きな健康問題であることを認識することが重要である。我々は、STH感染の免疫抑制効果がCOVID-19の転帰を緩和する可能性があるという仮説を立てているが、STH関連免疫調節が(ACE2受容体のTH2関連減少という仮説にもかかわらず)SARS-CoV-2感受性およびCOVID-19に関連した肺損傷を増加させる可能性がある。蠕虫に関連した免疫抑制は、蠕虫と結核菌マイコバクテリウム(Mycobacterium tuberculosis)との間の感染症の場合と同様に、感染を迅速に撃退する可能性を低下させることが示されている[8, 81]。また、寄生虫に関連した免疫抑制がワクチンの有効性を低下させるという証拠も示されており[82]、STH感染は長期的なSARS-CoV-2免疫の発現を阻害する可能性があることを示唆するものもある[83]。このように、STH感染の多くの側面がSARS-CoV-2ウイルス負荷を低下させる可能性があるが(上記で議論したように)STHに関連した免疫抑制が予備的な免疫活性を阻害し、ウイルス負荷を増加させ、場合によっては感染期間を延長させる可能性もある。これらの複雑な関連性を調べるためには、さらなる研究が必要である。
それでも、免疫活性の抑制は、感染リスクの増大の可能性があるにもかかわらず、COVID-19の致命的な側面を防ぐことができるかもしれない。COVID-19に関連する免疫活性を中等度であっても低下させることで、個々の患者の転帰が大幅に改善される可能性がある。例えば、最近の研究では、無症状のSARS-CoV-2感染者では免疫反応が弱く、サイトカインレベルは健常対照と同程度であることが明らかになった[84]。このように、無症状と致命的な結果の違いは、免疫系がどのように反応するかに完全に依存している可能性がある。その結果、STHに関連した免疫調節がSARS-CoV-2感染の初期リスクを増加させる一方で、STHと他の死に至る病原体との共感染の例で明らかなように、症状が軽快し、死亡率が低下する可能性がある。例えば、マラリアとSTHとの感染は、STHが重度のCOVID-19リスクにどのように影響を与えうるかを理解するための平行線を提供する可能性がある。具体的には、蠕虫の感染はマラリアに対する感受性を高める一方で、重症マラリアに関連する高炎症性免疫応答およびサイトカインストームのリスクを低下させる [8, 85, 86]。STH感染がSARS-CoV-2感染およびCOVID-19の疾患転帰にも同様の影響を及ぼす可能性があるが、これはまだ直接検証されていない。
もう一つの懸念は、STH感染に対する免疫反応が特定のCOVID-19の転帰を悪化させる可能性があることである。例えば、STH感染によって引き起こされた好酸球レベルの上昇は宿主組織に炎症性の影響を与え、肺組織の損傷の増加につながる可能性がある。前述したように、好酸球レベルの低さはCOVID-19の転帰の悪化と関連しているようであることを考えると、これもまた可能性が低いように思われる[76]。さらに、COVID-19患者におけるいくつかのTH2免疫細胞の高レベル(例:IL-4およびIL-10)[9, 87]が報告されているが、これらはSARS-CoV-2の組織損傷に対する正常な免疫反応であり、炎症を調節し、組織を修復することを目的としていることが示唆されている[88]。重要なことは、寄生虫の感染が常在する集団では、感染開始時にTH2反応がより強固になり、好酸球レベルが高くなるため、組織損傷が比較的少なく、ウイルス負荷が低くなることである。しかし、我々の知る限りでは、STH感染とCOVID-19の転帰との関係を直接検証した研究はない。明らかに、寄生虫感染がCOVID-19の疾患転帰にどのように影響するか、特に生物学的および文化的に多様な集団にまたがって理解するためには、さらなる研究が必要である[87,88]。
感染と健康のアウトカムを理解するための生物文化的視点
我々は、STHsとSARS-CoV-2との共感染が重度の炎症性COVID-19のリスクを低下させる可能性があるという仮説を立てているが、疾患転帰にも影響を及ぼす可能性のある両感染タイプに関連する他の因子を考慮することが重要である。例えば、STHは、医療または感染から保護するインフラへのアクセスが限られているために、すでに高い感染症負荷を経験している低所得国で最も多く見られる傾向がある。このように、疾患曝露とその後の免疫活性のばらつきは、個人の免疫系の発達(上述したように)だけでなく、地域の状況(図3;人口密度、医療アクセス、衛生レベルなど)など、さまざまな要因が混在していることが原因であると考えられる [83, 89-93]。これらの織り交ぜた影響を切り離すことは困難であり、一緒に考えるべきである。例えば、人口密度が高いと感染症の蔓延が促進される可能性がある一方で、追加的な要因がこのリスクを軽減する可能性がある(例えば、地域の高い衛生水準、予防行動を促進する文化的規範、迅速な疾病スクリーニングと治療を行うための十分な資金が提供された医療インフラなど)。したがって、生物学的、文化的、社会経済的要因がどのように相互作用して STH と SARS-CoV-2 への曝露とその後の健康影響を形成するかを検討する必要がある。
図 3. STH と SARS-CoV-2 感染の両方のリスク増加に関連する構造的、集団レベルの要因
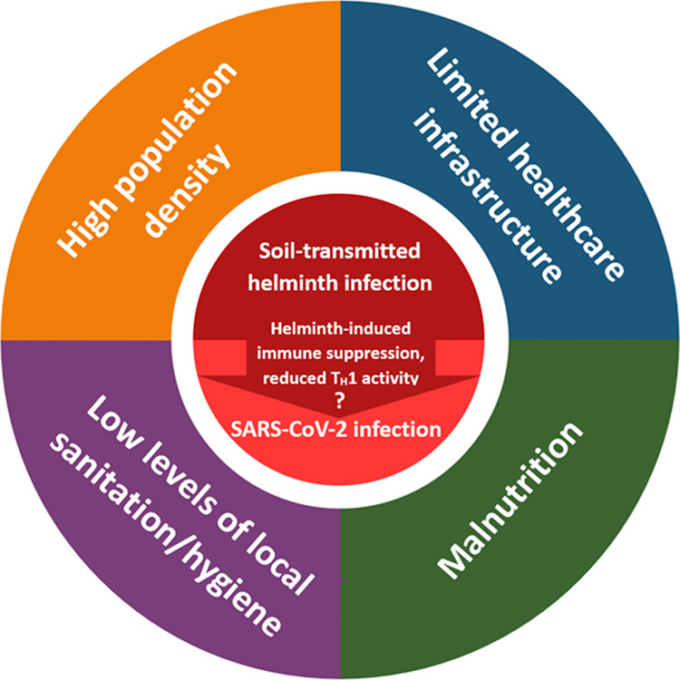
これらの構造的要因は相互に影響し合い、互いに強化し合い、急速な感染拡大、感染率の上昇、治療法の選択肢の少なさ、一般的な健康状態の悪さに寄与している。STH と SARS-CoV-2 感染リスクはともにこれらの社会・生態学的要因の影響を受けていると考えられる。また、これら2つの感染型は相互に作用し、STH感染による免疫抑制効果がSARS-CoV-2感染の初期リスクを高め、感染を撃退することをより困難にするという仮説も立てられている。
地域インフラ
いくつかの生物文化的要因が、さまざまな病状の感染リスクと疾患予後を形成している。例えば、衛生インフラの欠如、個人の衛生状態の悪さ、医療へのアクセスの制限は、多くの寄生虫感染症と関連している [94-96]。一例を挙げると、アマゾン・エクアドルの先住民シュアル族を対象とした研究では、生活様式や地域の衛生レベルと結びついた家庭の構造(水源や床材など)が、一般的なSTH種の感染リスクや感染強度と有意に関連していることが示されている[94, 96]。同様に、高感染性疾患(大規模な集団を介して急速に拡散する細菌やウイルス)は、人混みや人と人との接触率の高い環境下で増殖する[60, 61]。これはSARS-CoV-2にも当てはまり、初期のデータではCOVID-19のリスクと疾患転帰は用量依存性があり、最前線の医療従事者は定期的な曝露によるウイルス負荷の上昇によりリスクが高くなることが示されている[97]。このことは、衛生/衛生インフラの劣る限られた空間での感染者への長時間の曝露がウイルス負荷を増加させ、より悪い健康転帰につながる可能性を示唆している。
さらに、地域の医療インフラの欠如は、STH感染リスクとSARS-CoV-2の伝播の両方を悪化させると予想される。例えば、感染診断のための検査資源の不足、不十分な診断用品や保護具、医療提供者へのアクセスの制限などが、特にCOVID-19の需要の増加により地域の医療資源が枯渇しているため、SARS-CoV-2およびSTH感染の予防、特定、封じ込めを阻害する可能性がある[89-93]。疾病の拡大を防ぐ対策に影響を与えるだけでなく、不十分な医療インフラは、感染者の治療能力も低下させる。必要とされる医療機器、病院のスペース、訓練を受けた医療提供者、および薬剤へのアクセスが不十分であることは、STHおよびSARS-CoV-2感染症の両方の健康状態の悪化と関連している [89-93]。
栄養状態
地域のインフラや医療アクセスの違いだけでなく、栄養状態の違いも STH および SARS-CoV-2 感染リスクに影響を与える可能性がある。慢性的な栄養不良は、病原体に対する免疫応答のエネルギーコストが高いため、免疫機能とその他の重要な生理機能との間のトレードオフと関連している [83, 98]。例えば、免疫活性の上昇と関連した成長のトレードオフが研究で示されており、栄養ストレスを受けた集団では免疫応答のエネルギーコストが高いことが実証されている[57, 99]。研究では、ウイルスや細菌に対する免疫応答、特に急性炎症を引き起こす免疫応答は、エネルギー的に非常に高価であることが示唆されている。したがって、ポジティブなエネルギーバランス(すなわち、健康的なレベルの体脂肪)は、特に子供の間では、このようなエネルギー要求を緩衝する上で非常に重要である [99]。しかし、高レベルの不健康な体脂肪は、SARS-CoV-2 [16]を含む特定の感染症タイプの主要な危険因子として作用する可能性があることに注意することが重要である。生涯のトレードオフ(例えば、免疫機能と成長の間のトレードオフ)につながることに加えて、栄養不良自体もまた、エネルギー的に高価な免疫応答を維持するために必要な資源が不足しているために、免疫抑制作用を持つ可能性がある[100, 101]。
ヘルミント感染症はまた、宿主の栄養素を抽出することで宿主の栄養状態を直接損なうことも示されている[37, 95]。さらに、STH感染は、自然免疫の必要な構成要素である赤血球中のヘモグロビンの破壊/消費による貧血の発生率の増加と関連している[36, 102, 103]。宿主の栄養状態における寄生虫誘発性の低下は、他の病原体との感染をクリアするための効果的な免疫応答を宿主が実行する能力をさらに低下させる。同様に、栄養不良は重度のCOVID-19症状の危険因子である可能性がある [83]。これは、1918年およびH1N1インフルエンザパンデミックの両方で栄養不良が死亡リスクに寄与しているように見えるという事実と一致している [83, 104, 105]。
腸内マイクロバイオーム
インフラや食生活の変化はヒトの腸内細菌叢の変動と関連しており、その結果、(他の要因の中でも)衛生状態の悪化や加工食品の消費が多様性の低下をもたらすようである[106, 107]。健康で多様性のあるマイクロバイオータは、適切な免疫系の発達と機能にとって重要である[108]。興味深いことに、STHはまた、ラクトバシラス科の細菌のように、慢性的なSTH感染に有利な免疫調節細菌種の豊富さを増加させることによって、腸内マイクロバイオータを修飾する[109]。さらに、STHとマイクロバイオータ間の相互作用は、マイクロバイオータ依存性の抗炎症性サイトカインの産生を促進することにより、他のウイルス感染による肺障害を軽減することが示されている[110]。微生物相の構成および健康転帰に対するその影響は、この論文の範囲を超えた多数の生物文化的要因に基づいて異なるため、今後の研究では、STH感染症と関連したCOVID-19転帰におけるその役割を検討すべきである。
いくつかの交差する生物文化的要因が感染症リスクに影響を与える(STH感染症とSARS-CoV-2の両方を含む)。これらの複雑な相互作用については、現在のところ、感染症や寄生虫による病気の蔓延に対して最も脆弱な低所得国や地域では十分に研究されていない。さらに、COVID-19の予後および症状は、STH感染の免疫調節効果のために、高所得国の患者に典型的に見られる症状とは異なる可能性がある。医療従事者および研究者は、結果として、地域の状況が多様な集団におけるSARS-CoV-2の伝播およびCOVID-19の症状にどのように影響を与えうるかを検討すべきである。COVID-19の様々な可能性のある症状を明らかにすることは、特に高所得国では一般的に見られない併存疾患(寄生虫感染症など)を持つ患者を正しく特定し、症例を封じ込めるために極めて重要である。
未回答の質問
STH感染が宿主の免疫機能に及ぼす影響が知られていることを考えると、STH感染の既往がSARS-CoV-2感染リスクやCOVID-19の重症度に影響を及ぼす可能性があると考えられる。それでも、重篤なSTH感染に関連した健康への悪影響(例えば、栄養不足、発育不全、身体的および認知機能の障害、臓器不全)[36,37]を考えると、我々は、重篤なCOVID-19症状を予防するための実行可能な戦略としてのSTHの使用を提唱しているわけではない(例えば、ナイーブな宿主をSTH感染に意図的に曝露することによって)。さらに、STH感染とCOVID-19の転帰との間の仮説的関係については、まだ十分な検証がなされていない。これらの関係をさらに検証することは、多様な病原体負荷に直面している集団におけるSARS-CoV-2感染のすべての可能な症状を明らかにするために必要である。ここでは、今後の研究で取り組むべき複雑な問題のいくつかを概説する。
SARS-CoV-2感染者におけるSTH感染の免疫調節効果には測定可能な効果があるか?
STH感染者のCOVID-19症状の重症度が、STH感染を併発していない人と比較して、STH感染者のCOVID-19症状の重症度が有意に低下しているかどうかを理解するための研究が必要である(すなわち、STH感染が蔓延している地域とそうでない地域の間でCOVID-19症状が診断された症例の割合を比較することによって)。さらに、STH感染が蔓延している集団においては、現在のSTH感染と重度のCOVID-19症状の可能性との関連性を、駆虫プログラムとの関連で考慮すべきであり、駆虫プログラムに登録している人と最近駆虫治療を受けていない人との間の転帰をテストし、モニターするための研究を計画することができる。STH感染がCOVID-19の重症度を緩和するようであれば、STH感染者と非感染者のCOVID-19患者におけるACE2受容体の減少やサイトカインプロファイルの変化などの仮説を含めて、この違いを説明する免疫機構を調査すべきである。また、STH感染による免疫調節効果が、免疫状態に関連する可能性のある他の共存疾患(例:肥満、栄養不良、貧血など)を有する患者間で異なるかどうかについても研究する必要がある。
特定の種またはタイプの STH は、SARS-CoV-2 の感受性および COVID-19 の転帰に異なる影響を与えるか?
STHの分類には、消化管の異なる部分を占有し、異なる方法で宿主と相互作用し、種特異的なサイトカインプロファイルと関連している可能性のある複数の種が含まれている(表1)。これは、COVID-19の疾患転帰に対するSTHの影響が、感染の時期、期間、および強度と同様に、種によって異なる可能性があることを意味する。例えば、ホタル虫と鉤虫の両方の感染は、IL-6とTNF-α [45-48, 51-53]を減少させるようであり、これらのレベルの上昇はCOVID-19の重症度の増加と関連している [64]。一方、鞭毛虫感染はTNF-αの増加と関連しているようであるが [49, 50]、この関係は年齢および重症度に依存しているようである。したがって、研究では種特異的な転帰に関連した以下の疑問に取り組む必要がある。STH の種が病気の感受性にどのように影響を与えるかには違いがあるのか?もしあるとすれば、どの特定の STH 種が COVID-19 の病原性の最大の低下と関連しているのか?また、特定の感染タイプのタイミングや強度はCOVID-19の結果をどのように変化させるのであろうか?
STH感染のタイミングはCOVID-19病変の転帰にどのように影響するのか?
寄生虫が宿主の免疫機能および免疫反応を調節するメカニズムは、個体が感染した時期によって異なるようである [8]。STHがCOVID-19の重症度を緩和するとしたら、それは免疫系の発達期にSTHに感染した個体にのみ起こるのか、それとも後に感染した成人にも恩恵があるのか?さらに、感染の強さは、結果としてSTHに関連した免疫調節に影響を与えるのだろうか?言い換えれば、STHの感染が重度であれば、炎症性亢進性の免疫活性を抑える必要があるのか、それとも軽度の感染でも同様の免疫効果が得られるのか?
同様に、COVID-19に反応するSTH感染の抗炎症効果は、現在蠕虫に感染している人だけに見られるのであろうか、それともSTH感染の既往歴のある人(たとえ現在感染していなくても)にも同じ免疫調節効果が見られるのであろうか?抗炎症性免疫調節作用を示すためには、どのくらいの期間にSTHに感染している必要があるのだろうか?過去のSTH曝露による免疫効果を調べるために、今後の研究では、STH疾患が蔓延している地域からSTH感染のない地域へと様々な年齢で移行した個人のグループ(移民コミュニティなど)におけるCOVID-19の症状の重症度を調べることができる。
STHとSARS-CoV-2感染症の間に有害な相互作用はあるか?
エビデンスは、STH感染症が免疫抑制作用を持つことを示唆している。STH感染による免疫抑制効果は、SARS-CoV-2感染に対する宿主の感受性を高めるのであろうか?もしそうであるならば、上述した抗炎症作用は、この免疫抑制作用が引き起こす可能性のある負の結果を十分に上回るものなのだろうか?STH感染はCOVID-19ワクチンの有効性を低下させるのであろうか?さらに、重度のCOVID-19に関連した過剰な免疫活性は、寄生虫を含む他の病原体への感染を引き起こす可能性があるという議論もある[111]。したがって、STH感染はSARS-CoV-2感染リスクを増加させ、SARS-CoV-2はSTH感染感受性を増加させるという双方向の関係が見られるのだろうか?SARS-CoV-2とSTH感染の相互作用の方向性を解明するためには、縦断的なデータ収集が必要である。最後に、医療インフラが限られており、STH感染が蔓延している地域では、COVID-19パンデミックの間に介入プログラムが中断された結果、STH感染の制御が遅れているのではないかという議論もある[112, 113]。したがって、資源配分のシフトがSTHの予防と治療にどのように悪影響を及ぼし、2つの感染タイプ間の有害な相互作用を悪化させる可能性があるかを検討する必要がある。
STHの免疫効果には集団レベルでのばらつきがあるか?
STHとSARS-CoV-2感染との間に関係があるとすれば、その関係は異なる集団間でどのように変化するのか?どのようなライフスタイルの違い(例:国の医療制度、典型的な食生活、投薬、人口密度と人口統計、喫煙率など)がこの変動を説明しているのであろうか?どのような基礎となる生物学的要因(例えば、血液型、腸内細菌叢の多様性、他の病原体への過去の暴露など)が、これらの相互作用に影響を与えているのであろうか?STHと腸内細菌叢との相互作用はCOVID-19の転帰にどのように影響するのか?そして最後に、STH感染とマイクロバイオームの両方に関連する代謝コストおよび栄養コストは、栄養状態および疾患予後にどのように影響するのか?
結論
結論として、ヒトにおけるウイルスの新規性を考慮しても、COVID-19の転帰と共存する寄生虫感染との関連性を検証した研究はほとんどない。非常に予備的な研究では、パンデミック性のSTH感染と局所的なSARS-CoV-2リスク/悪性度との間に意味のある関係が示唆されているが、COVID-19パターンに対する寄生虫感染の影響は、寄生虫の種類によって、また宿主の特徴(例えば、他の合併症、免疫系の能力、栄養状態など)に基づいて異なる可能性が高い [66,80,83]。STHは典型的に脆弱な、疎外された、無視された集団に感染するため、SARS-CoV-2の世界的な影響を徹底的に理解したいのであれば、これらの寄生虫がCOVID-19の転帰に及ぼす影響を理解することが極めて重要である。