Contents
Obstructive Sleep Apnea and Its Treatment in Aging: Effects on Alzheimer’s disease Biomarkers, Cognition, Brain Structure and Neurophysiology
pubmed.ncbi.nlm.nih.gov/32860945/
2020年8月27日
概要
閉塞性睡眠時無呼吸症候群(OSA)がアルツハイマー病の病因、神経解剖、認知、神経生理学のバイオマーカーに与える影響を検証し、持続的気道陽圧(CPAP)療法の効果を検討した研究を紹介する。
OSAは、脳脊髄液(脳脊髄液)ポジトロン・エミッション・トモグラフィー(PET)血清中のアルツハイマー病マーカーであるアミロイドβおよびタウの増加と関連している。CPAP療法が脳脊髄液中のアルツハイマー病バイオマーカーを正常化することを示唆するいくつかの証拠があるが、ヒトにおけるアミロイドβおよびタウの産生/消失のメカニズムは完全には解明されていないため、これらの知見はまだ予備的なものである。
OSA患者では、注意力、警戒心、記憶、実行機能といった認知領域の障害が観察され、その障害の大きさは、高齢者の地域社会サンプルよりも臨床現場の若年者でより強く現れている。
認知機能は、CPAP使用後に程度の差こそあれ改善され、OSAと眠気が重度の中年層では注意力に最大の効果が見られたという。
OSAの有無にかかわらず、情報の符号化と検索を睡眠期間に分けて行うパラダイムはほとんど行われていないが、おそらく日中の単独テストよりもOSAの認知機能への影響を理解するのに適しているだろう。
認知機能が正常な人では、睡眠中の脳波微細構造の変化、特に低速振動と紡錘体の変化が、アルツハイマー病のバイオマーカーや認知・記憶の指標と関連している。アルツハイマー病とOSAでは、覚醒時とレム睡眠時の「EEGスローイング」や、NREM EEG微細構造の劣化など、EEG活性の同様の変化が報告されている。CPAP療法がこれらの変化を部分的に回復させるという証拠があるが、これを証明する大規模な縦断的研究は不足している。
Apnea Hypopnea Index(AHI)のみに依存するOSAの診断定義では、OSAに関連する日中の障害やCPAP療法への反応に高度な個人差があることを理解する助けにはならない。
最後に、アルツハイマー病予防のためのOSA治療の臨床試験を行う上での概念的な課題として、年齢、OSAの重症度、関連する症状などの組み入れ基準、長期にわたる試験の必要性、関連する主要アウトカムの定義、治療アドヒアランスを最適化するためにどの治療法を対象とすべきか、などについて述べている。
1. はじめに
閉塞性睡眠時無呼吸症候群(OSA)は、睡眠呼吸障害(睡眠呼吸障害)の一種であり(ICSD-3, 2014)上気道の完全または部分的な閉鎖と、それに続く血中酸素濃度の低下および/または睡眠からの覚醒が繰り返されることを特徴とする。このような呼吸イベントが繰り返されると、睡眠が妨げられ、慢性的な夜間の間欠的な低酸素症、再酸素化、過呼吸または低カプニアが引き起こされる。OSAの診断は、睡眠中の鼻腔内気流、呼吸努力、パルスオキシメーターからの生理的信号の評価を用いて行われる。脳波を含む睡眠ポリグラフ(睡眠ポリグラフ検査)は、睡眠呼吸障害が疑われる場合の調査のゴールドスタンダードとされているが、診断には気流やパルスオキシメーターのみの記録が一般的に用いられている(Woods et al 2014)。OSAの重症度は、主に睡眠1時間あたりの呼吸イベント(無呼吸と低呼吸)の回数として定義される無呼吸低呼吸指数(AHI)を参照して分類される。重要なのは、「低呼吸」の定義が複数あるため、AHIの値も複数になり、OSAとその健康への影響を調査する臨床研究では、AHIの定義が一貫して使用されていないことである。
1993年から 2013年の間に世界中で行われた11件の人口ベースの疫学研究のレビューによると、少なくとも軽度のOSAの平均有病率は男性で22%、女性で17%、日中の過剰な眠気を伴うOSAとしても知られるOSA症候群(OSAS)は男性で6%、女性で4%でした(Franklin and Lindberg, 2015)。地域住民を対象とした最近の大規模研究の1つであるHypnoLaus研究では、AASM 2012年の低呼吸の定義である≥30%の気流低下が少なくとも10秒間続き、覚醒または≥3%の酸素脱飽和度(AHI3A)のいずれかを伴うものを使用した。本研究では、被験者を年齢別(40~60歳、60~85歳)に二分したところ、AHI3A≧15/時間の被験者の割合は、若年層で26.8%(男性39.6%、女性13.9%)高齢層で48.7%(男性64.7%、女性35.2%)となり、高齢者におけるOSAの異常な有病率が浮き彫りになった(Heinzer er al 2015)。OSAの治療法には、気道陽圧装置、口腔内装置、行動・生活習慣の改善、手術、および/またはこれらを組み合わせたアプローチがある。睡眠時OSAと診断された人にとって最も効果的な治療法を決定するには、疾患の重症度、症状、原因によって異なる。CPAP(Continuous Positive Airway Pressure)は、最も一般的に処方される治療法であり、鼻(および/または口)に装着したマスクを介して正圧を供給することで、睡眠中に上気道を開くように機能する(Sullivan et al 1981)。
ここ数年、睡眠障害とアルツハイマー病の病因マーカー、認知機能障害や認知症の発症との関連性に関する文献が増えている。最近のメタアナリシスでは、睡眠呼吸障害が全原因の認知症、アルツハイマー病、血管性認知症のリスク因子であることが示されたが(Shi er al 2018)多くの研究ではOSAの自己申告による測定が用いられており、縦断的な研究はほとんど含まれていなかった。高齢女性では、睡眠ポリグラフ検査でOSAと診断された人は、5年間の追跡調査で軽度認知障害(MCI)または認知症を発症するリスクが高かった(Yaffe er al)。 アジア人集団では、OSA/睡眠呼吸障害が認知症およびアルツハイマー病の発症リスクの増加と関連することを見出した2つの大規模な縦断的コミュニティベース研究がある(Chang et al 2013,Lee et al 2019a、Lee et al 2019b)。Alzheimer’s Disease Neuroimaging Initiative(ADNI)コホートの分析では、OSAの存在が認知機能低下の早期化と関連しており、CPAP治療が認知機能障害の進行を遅らせる可能性が示唆されている(Osorio er al 2015)。ここでは、睡眠と睡眠呼吸障害が、アミロイドβやタウ、神経解剖学、認知、神経生理学の測定を通じて、神経変性のリスクを高めるマーカーにどのような影響を与えるかを調査した文献のナラティブレビューを紹介する。最後に、CPAP治療によるこれらの様々なマーカーの修正に関するエビデンスをレビューする。対象とした文献は,SCOPUSを用いて,「OSA」と「アルツハイマー病」,「neuroimaging」,「cognition」,「EEG」で検索し,それぞれの検索語に「CPAP」を追加した。また,睡眠とアルツハイマー病に焦点を当てたメタアナリシスやシステマティックレビューについては,関連する引用文献の書誌情報とともにレビューした。
2. アルツハイマー病のリスク増加に関連するOSAのマーカーへの影響
2.1. アミロイド/タウバイオマーカー
具体的には、脳脊髄液(脳脊髄液)ポジトロン・エミッション・トモグラフィー(PET)血清中のアミロイドβおよびタウを測定する。睡眠ポリグラフ検査を用いてOSAを診断したいくつかの研究では、OSAのない年齢をマッチさせた対照群と比較して脳脊髄液のアミロイドβレベルの低下が実証されている(Ju et al 2016,Liguori et al 2017,Liguori et al 2019)。ApoE対立遺伝子の状態でグループを層別化すると、OSAの重症度は、ApoE3キャリアではアミロイドβ42,リン酸化タウ(P-tau)総タウ(T-tau)と正の相関があり、ApoE2のキャリアではアミロイドβ42レベルと負の相関があった(Osorio et al 2014)。認知的に正常な高齢者のクロスセクションにおける脳脊髄液アミロイド-βのみに基づいてアルツハイマー病リスクを解釈することは容易ではない。脳脊髄液アミロイドβは、年齢をマッチさせた対照群と比較して、正真正銘のアルツハイマー病認知症患者では低いというコンセンサスがある一方で、アルツハイマー病の遺伝的リスクを有する個人では、脳脊髄液アミロイドβが上昇し、その後の低下が急であるという証拠がある(Bateman et al 2012;Fagan et al 2014)。さらに、幅広い年齢層における脳脊髄液アミロイドβとタウの相互関係を分析したところ、45歳から70歳までは脳脊髄液アミロイドβとタウの間に全体的な正の相関があるのに対し、71歳から90歳までは脳脊髄液アミロイドβとタウの間に全体的な負の相関があることが示された(de Leon et al 2018)。
PETアミロイドトレーサーの取り込みレベルは、アミロイド負荷だけでなく、将来のアルツハイマー病発症の強固な予測因子である(Waragai er al 2009)。OSA重症度の増加に伴いアミロイド沈着が大きくなることを示した最初のPET研究は、5人のMCI患者を対象とした小規模なパイロット研究であった(Spira er al 2014)。しかし、認知機能が正常な8人の参加者では、アミロイドとOSAの関連性は認められなかった。認知機能が正常なOSAS患者14人を対象としたより最近の解析でも、睡眠呼吸障害とアミロイド取り込みの関連性は認められなかった(Handa er al 2019)。一方、睡眠呼吸障害の参加者19人を対象としたケースコントロール研究では、コントロールと比較して、右後帯状回と右側頭葉皮質に高いアミロイド沈着が認められた(Yun er al 2017)。また、認知機能が正常なオーストラリアの退役軍人117名(睡眠ポリグラフ検査でOSAと診断された42名)を対象としたクロスセクション研究では、18F-florbetaben(アミロイド凝集体に結合するリガンド)の皮質への取り込みが、OSAの症状がない人に比べてOSA群で高かった。この研究では、回帰分析により、アミロイド沈着とOSAの関係は、年齢や血管危険因子に依存せず、BMIやApoE4の状態にも依存せず、OSAの人ではApoE4アミロイド負担の存在がより大きくなることが明らかになった(Elias er al 2018)。別の横断的分析では、127人の地域居住者で認知機能が正常な人のうち96人のOSA患者が、後帯状皮質と楔前部でPETによるアミロイド負荷が大きく、灰白質体積、灌流、グルコース代謝の増加と重なってた(Andre er al 2020)。
タウについては、OSAとの関連ではあまり研究されていない。OSAのある人は、OSAのない人と比較して、T-タウ(Motamedi et al 2018)およびP-タウ(Bu et al 2015)の血漿濃度が上昇することが示されている。血清タウ濃度と脳脊髄液タウ濃度の相関性は低いが、それにもかかわらず、血清タウは認知症の予測マーカーとして有用である可能性がある(Pase et al 2019)。関連して、OSAを有する個人は、OSAを有しない個人またはPAP治療を受けたOSAを有する個人のいずれかと比較して、脳脊髄液中のT-tau/アミロイドβ42の濃度が上昇していることが示されたが(Liguori et al 2017年)別の横断的研究では、脳脊髄液中の個人のT-tauまたはP-tauに差は認められなかった(Ju et al 2016)。タウPET画像は、292人の認知障害のない成人を対象とした横断的分析に採用されたが、ベッドパートナーが「無呼吸を目撃した」と肯定的に報告した場合、内嗅皮質と下側頭皮質のタウPETレベルがより上昇していた(Carvalho er al 2020)。
そのため、縦断的な研究は、クロスセクションでの矛盾点を明らかにするのに有効である。我々のグループは、OSAにおけるアルツハイマー病の脳脊髄液およびPET画像マーカーの両方を用いた2つの縦断的研究を報告している。(Sharma et al 2018)では、ベースラインでのOSAの重症度は、脳脊髄液アミロイド-β42の縦方向の減少およびPET画像による皮質アミロイド沈着の縦方向の増加と関連していた。(Bubu et al 2019)では、認知的に正常な人とMCIの人における自己申告のOSAは、脳脊髄液とPETの両方の測定によるアミロイド負荷の増加、および2.5年にわたるT-tauとP-tauの脳脊髄液濃度の増加と関連していた。
2.2. CPAP治療による疾患マーカーの変化
CPAP治療がアルツハイマー病のアミロイドおよびタウのバイオマーカーに及ぼす影響を示した文献は少ない。ラボでの睡眠ポリグラフ検査、脳脊髄液サンプリング、神経認知検査を取り入れたCPAP治療効果を検証した唯一の研究である(Liguori et al 2017)は、CPAP治療を受けたOSA陽性患者10名(コンプライアンスが良好な1年未満)未治療のOSA患者25名、対照者15名を比較した。未治療のOSA患者は、CPAP治療を受けた人と対照者の両方に比べて、脳脊髄液アミロイドβ42濃度が低く、T-tau/アミロイドβ42比が高かった。さらに、脳脊髄液アミロイドβ42濃度の低下は、OSA患者の平均夜間酸素飽和度や認知機能の低下と相関していた。一方、(Elias et al 2018)による観察研究では、24/42人の退役軍人のOSA患者における自己申告によるCPAP使用は、アミロイド沈着や認知に有意な影響を及ぼさないことがわかった。参加者内デザインを用いた別の研究では、(Ju et al 2019)が、18人のアドヒアランスCPAPユーザーを対象に、1~4カ月間のCPAP療法の前後で脳脊髄液バイオマーカーを測定したところ、CPAP療法の結果としてOSAがより改善すること(AHIと覚醒の減少)は、アルツハイマー病の病理を減少させる方向にアミロイドとタウのレベルがより大きく変化することと正の相関があることがわかった。一方、グループレベルでは脳脊髄液バイオマーカーに有意な変化は見られず、より中等度から重度のOSA患者に焦点を当てる必要があることが示唆された。
2.3. まとめ
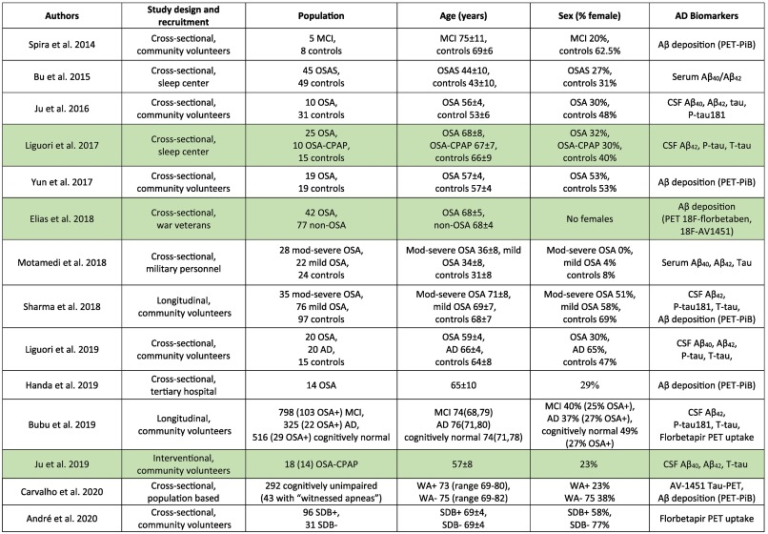
認知的に正常な高齢者において、OSAは、クロスセクションでのアルツハイマー病病理の脳脊髄液測定値の増加と関連しているようだが、その不均一性はOSAの重症度の除外基準の違いに起因している可能性がある。CPAPは、OSAの重症度が増すにつれて、これらのマーカーをより深く減少させると思われるが、その証拠は乏しい。OSAが脳脊髄液のアミロイドβやタウ濃度に影響を与えるメカニズムをよりよく理解するためには、治療用CPAPの離脱を用いたパラダイムにおいて、個人内の睡眠の断片化と低酸素の独立した寄与を評価することが必要である。大規模な横断的・縦断的研究では、OSAがPET画像で測定されるアルツハイマー病バイオマーカーの負荷を増加させることが示されているが、CPAPによる治療が長期的にこれらの影響を逆転できるかどうかはまだ明らかになっていない。表1は、このセクションで言及されているOSAとアルツハイマー病のバイオマーカー研究をまとめたものである。
表1 OSAとアルツハイマー病のバイオマーカーに関連してレビューされた研究。
3. 認知機能
OSA患者では、日中のテストにおいて、注意力、警戒心、記憶、実行機能などの認知領域の障害が観察される(Bucks et al 2013,Leng et al 2017)。しかし、縦断的研究から得られた証拠は、OSAと認知機能の低下を関連付けるものもあれば(Yaffe et al 2011,Spira et al 2014,Osorio et al 2015,Blackwell et al 2015)この点に関して弱い、あるいは無効な所見を示すものもある(Boland et al 2002,Martin et al 2015,Lutsey et al 2016)など、異なる結果が得られている。全体として、臨床現場の若年・中年のOSA患者の方が、高齢の健康な地域サンプルよりも、障害の大きさが大きく現れている(Cross er al 2017)。
中高年のOSA患者を調査した横断的研究では、実行機能における認知障害が実証されている(Bawden et al 2011,Mathieu et al 2008,Quan et al 2006; Hrubos-Strom et al 2012; Blackwell et al 2011; Nikodemova et al 2013; Salorio et al 2002; Spira et al 2008; Yesavage et al 1985; Sharma et al 2010)注意(Bawden et al 2011; Mathieu et al 2008; Naegele et al 2010)。2008; Naegele et al 1995; Quan et al 2006; Yesavage et al 1985)反応時間と精神運動警戒テスト(PVT)(Sharma et al 2010; Kim et al, 2008)および記憶(Bawden et al 2011,Kloepfer et al 2009,Naëgelé et al 2006,Nikodemova et al 2013,Salorio et al 2002,Sharma et al 2010,Ju et al 2012,Yesavage et al 1985年、Berry et al 1990)。一方、他のグループでは、OSAと実行機能、注意、記憶の測定値との間に有意な関連はないとしている(Hayward et al 1992年、Phillips et al 1992年、Foley et al 2003,Sforza et al 2010)。
OSAと認知機能障害に関する知見の説明メカニズムとしては、睡眠の断片化による日中の眠気や、間欠的な低酸素の結果としての神経血管障害などが提案されているが、それぞれの寄与は十分に確立されていない(Cedernaes et al 2017)。実際、前述のいくつかの研究では、疾患の重症度が認知障害の程度に対応していることがわかっているが、それは必ず、調査する尺度だけでなく、OSAと認知の両方の測定方法に依存する(Gagnon et al 2019,Gosselin et al 2019)。初期の研究では、睡眠の断片化の程度が注意力と記憶力の障害をもたらすことを示唆するものがあり(Naegele et al 1995;Roehrs et al 1989)一方で低酸素血症の重症度は運動機能、警戒心、実行機能に影響を与えることがわかっている(Bliwise、1993;Bedard et al 1991)。Kainulainen et al 2020)は、臨床的な 睡眠ポリグラフ検査 検査を受け、AHI≧5 で睡眠前 PVT 評価を行った 743 人を対象とした大規模な研究において、低酸素血症の新たな指標(末梢酸素飽和度(SpO2)ディップおよび脱飽和領域の中央値)が夕方の PVT パフォーマンス低下のリスク増加と有意に関連することを示したが、OSA の重症度および睡眠の断片化に関する他のすべての指標は関連しなかった。しかし、このような記憶や実行機能の違いを裏付けるような、最近の十分な規模の研究はない。
OSA患者の認知機能を評価する上で複雑な要因となるのが、認知機能を悪化させるとされる眠気の問題である(Gagnon et al 2014,Steiropoulos et al 2019 Mathieu et al 2008)は、若年(50歳未満)のOSA患者においてのみ、眠気が認知パフォーマンスの低下に寄与していることを明らかにした。文献のレビュー(Zhou et al 2016)では、EDSはOSAのより大きな神経認知機能障害に寄与すると結論づけているが、眠気のないOSAの神経認知機能障害を十分に検討する必要性が強調されている。
3.1. 夜間記憶
OSAの認知機能を調査するほとんどの研究では、エンコードと想起を睡眠期間で区切って行う睡眠関連の記憶処理ではなく、日中の神経心理学テストバッテリーや神経行動学的警戒で一般的な認知能力を評価している(Ahuja er al)。 OSA患者の夜間記憶評価を取り入れた少数の研究では、健常対照者と比較して、宣言的記憶および手続き的記憶課題の処理に障害があることが実証されているが(Kloepfer et al 2009,Landry et al 2014年)記憶エンコーディングおよび暗黙的運動記憶形成は無傷であるように見える(Cellini 2017)。中等度重症OSAにおける一晩の運動シーケンス課題学習の障害を示す一連の研究では、課題パフォーマンスと睡眠ポリグラフ(睡眠ポリグラフ検査)の覚醒指数との間に負の関係が観察され(Djonlagic et al 2015,Djonlagic et al 2014年)後の研究では年齢の上昇が一晩の改善が少ないことと関連していることが示されている。
CPAP離脱は、OSAの一晩の記憶タスクに対する劇薬効果を観察する方法である。私たちのグループによる研究では、レム睡眠中に選択的なCPAP離脱によってOSAが誘発されると、空間ナビゲーション課題の改善に対する一晩の睡眠のメリットが減衰することがわかった(Varga er al 2014)。
3.2. CPAP治療による認知機能の変化
CPAP治療により、認知に様々な変化が生じ(Kielb et al 2012)、最大の効果は、より重度の睡眠呼吸障害と眠気を有する若年・中年の成人の注意力(Kylstra et al 2013; Pan et al 2015)に見られる(Zhou et al 2016)。
これまでに行われた最大の無作為化対照試験(RCT)では、6カ月間のCPAP治療は、注意力と実行機能の一過性の改善(2カ月のみ)と関連し、ベースラインの日中の眠気が高い(ESS>10)人では、6カ月後の持続的なワーキングメモリ課題でより大きな効果が見られた(Kushida er al 2012)。既存のRCTを要約すると、短期および長期のCPAP治療は、中年成人のOSAに関連する障害の一部を改善することを示している(Canessa et al 2011,Castronovo et al 2014,Ferini-Strambi et al 2003)。あるいは、(Saunamaki et al 2010)は、男性17人のグループで長期のCPAP治療を行っても、実行機能や視空間機能の改善は観察されなかった。高齢者では、大規模な多施設試験(Martinez-Garcia et al 2015,McMillan et al 2014)でCPAPの認知に対する効果は最小または無効であることが示されており、同様の観察がなされている。しかし、治療関連のアウトカムの欠如は、少なくとも(McMillan et al 2014)の研究では、CPAPのアドヒアランスレベルが低いことで説明できる。小規模な単一センター試験では、特にCPAP使用率が高い人で、注意力、精神運動速度、記憶、実行機能の改善が観察されている(Aloia et al 2003,Dalmases et al 2015)。
(Antic et al 2011)は、中重度のOSAを対象とした観察研究において、Epworth Sleepiness Scale(ESS)スコアに関して、CPAPの治療用量反応効果を見出した。さらに、毎晩のCPAPの継続時間が長いほど、眠気と神経行動機能の正常化を示す患者が多い一方で、そうでない患者もかなりいた。大規模な横断研究で、軽度~中等度のOSA患者を対象としたJackson et al 2018)は、CPAPを十分に使用していても、CPAP療法3カ月後の神経認知障害の逆転を観察しなかった。Bhat et al 2018)は、少なくとも1カ月のCPAP療法後の主観的な眠気(ESSによる)および客観的な警戒心(PVTによる)の変化を評価し、OSAの重症度にかかわらず眠気が有意に少ないことが報告されたものの、PVTを用いて測定した警戒心の改善は、治療前に重症のOSAがあった場合にのみ観察されたことを明らかにした。
OSA治療と夜間の記憶統合を調査した研究では、CPAP療法の一晩ではなく、長期的な使用がオフラインの睡眠を介した運動記憶統合を増強することがわかっている(Djonlagic et al 2015,Landry et al 2016)。
Alzheimer’s Disease Neuroimaging Initiativeにおいて、自己申告のOSAと治療のためのCPAP使用を有する被験者のMCI発症年齢を調べたところ、自己申告の未治療のOSAを有する認知的に正常な高齢者は、OSAを有しない被験者よりもMCIの平均発症年齢が11年早かった(72年 vs 83)のに対し、自己申告のCPAP治療を受けた被験者は、OSAを全く有しない被験者と同程度のMCIの平均発症年齢(82)であることが観察された(Osorio et al, 2015).
3.3. OSAを伴うMCI/アルツハイマー病における治療
すでに認知障害を患っている人にCPAP治療を行うことで、症状が改善されたり、さらなる認知機能の低下を遅らせることができるというエビデンスがある。(Chong et al 2006年:著者)は、軽度から中等度のアルツハイマー病患者をCPAP療法に無作為に割り付けたところ、3週間と6週間の治療後に眠気が減少したが、偽装装置を使用した場合は減少しなかった。中等度のアルツハイマー病と重度のOSAを有する患者の認知機能低下率を調査したパイロット研究では、CPAP治療を受けた患者は、未治療の患者に比べて、3年間の認知機能低下(Mini Mental State Exam(MMSE)スコアの変化)が有意に遅かった(Troussiere et al 2014)。MCIとOSAを調査した最近の準実験的研究では、1年後のCPAPアドヒアランス患者において、非アドヒアランス対照群と比較して精神運動/認知処理速度の有意な改善が認められた(Richards et al 2019)。また、記憶、眠気、日常機能の改善も認められ、CPAPが認知症の進行を遅らせる可能性が示唆された。
3.4. まとめ
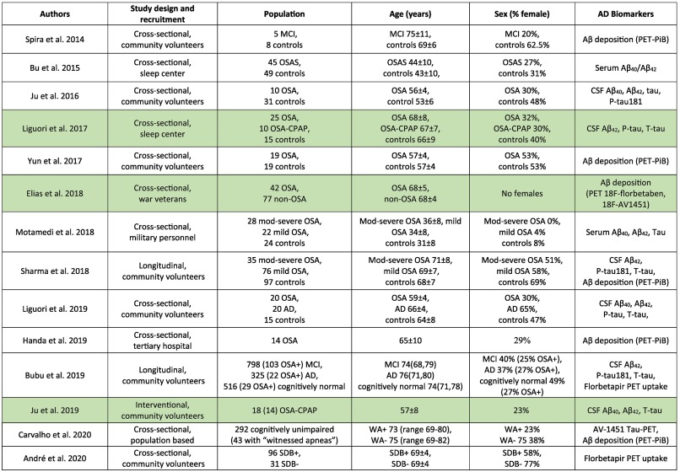
全体的に見て、認知機能障害のより一貫した所見は、高齢者の地域住民コホートよりもむしろ若年および中年のOSA患者で見られ、その所見は治療を求める人々によってもたらされている可能性が高い(Bubu er al 2020)。CPAPは、特に眠気があり、治療をしっかりと受けている場合には、認知機能の改善に有効であると考えられる。また、CPAP治療は、MCIやアルツハイマー病の人の認知機能の低下を遅らせることができると期待されているが、OSAに関連した個人の認知機能の低下を理解するためには、エンコーディングとリコールを睡眠時間で区切って行う、より多くの認知機能の評価が必要である。表2は、このセクションで言及されているOSAと認知に関する研究をまとめたものである。
表2 OSAと認知に関連して検討された研究
アルツハイマー病: アルツハイマー病、CPAP: continuous positive airway pressure、OSA: obstructive sleep apnea、OSAS: obstructive sleep apnea syndrome、RCT: randomized controlled trial、SHHS: sleep heart health study。中央値(SEM)中央値[IQR]。年齢とパーセンテージの値は出典の原稿を丸めたもの。CPAPを含む研究は緑色でハイライトされている。
4. OSAにおける神経解剖学的変化
OSAは、断続的な低酸素状態と慢性的な睡眠不足を臨床的に特徴としており、その両方が正常な脳の形態を変化させると提唱されている。OSAによる低酸素症は、交感神経系の血管収縮の増大と血管保護機構の低下に関連し、血管の構造と機能に変化をもたらすと考えられている(Zimmerman and Aloia, 2006)。さらに、OSAに関連した睡眠の断片化が脳の構造と機能に及ぼす影響は、慢性および急性の睡眠不足に関する研究から推測することができる。睡眠不足は、独立して、あるいはOSAや他の神経疾患などの併存疾患の一部として、前頭葉、側頭葉、頭頂葉領域の萎縮の増加と関連していることが示唆されている(Sexton er al)。 OSAに見られる神経解剖学的変化に対する断続的な低酸素と睡眠の断片化の相対的な寄与を明らかにすることは困難であるが、神経画像診断ツールは、OSA患者の異常な脳構造の全体像を示すことができる。
神経画像診断ツールを用いた研究では、OSAに共存する神経解剖学的な異常が明らかになってきている。ボクセルベースモルフォメトリー(VBM)を用いたいくつかの研究では、OSA患者の前頭葉、頭頂葉、側頭葉、海馬領域における灰白質(GM)密度の低下が確認されている(Macey et al 2002,Canessa et al 2011,Morrell et al 2003,Gale and Hopkins 2004,Yaouhi et al 2009)。これらの研究では、海馬と前頭葉皮質がOSAにおけるGMの減少に最も敏感であることが指摘されている(Canessa et al 2011)。しかし、T1強調MR測定に基づいて観察された灰白質体積の変化を解釈する際には、注意が必要である。神経変性ではなく、ミエリンや鉄の含有量がGMの変化をもたらす可能性があることが観察されている(Lambert et al 2013)。そのため、これらのGMの変化は、神経細胞の損失ではなく、組織の物理的特性によって説明される部分があると考えられる。T1強調画像を超える撮影方法か、T1強調画像モダリティを補完する解析方法のいずれかが、OSAにおける灰白質の変化をよりよく評価するのに役立つだろう。
GMに加えて、白質(WM)の異常もOSA患者に見られる。(Cross et al 2018)らは、ボクセルベースではなくサーフェスベースの手法で評価した両側の側頭葉における皮質の厚さの減少が、OSA患者の酸素脱飽和度と関連することを観察した。Diffusion Tensor Imaging(DTI)研究では、OSAにおけるWMの病変は、皮質、辺縁系、海馬、小脳路でより顕著であることが明らかになった(Macey et al 2008)。DTI研究では、分数異方性(FA)の測定が日常的に行われている。FA値は、脳組織における水の動きの方向性を測定し、脳組織の完全性を推測するために使用することができる。この手法を用いて、最近の研究では、大部分が軽度・中等度のOSA集団において、WMの完全性と構造的連結性が失われていることが明らかになった(Lee er al 2019a; Lee er al 2019b)。注目すべきは、少なくともいくつかの研究が、OSAは萎縮ではなく灰白質の肥大と関連している可能性を示唆していることであり(Rosenzweig et al 2013,Baril et al 2017,Andre et al 2020)この現象は、萎縮性変化が起こる前のOSAの発症初期に、基礎的な炎症/浮腫を表している可能性がある。
MRIとDTIの研究に加えて、他の神経画像のモダリティも、OSAに見られる神経解剖学的変化の研究に使用されている。磁気共鳴分光法(MRS)は、脳内の生化学的変化を非侵襲的に調べるために広く用いられている。OSAのMRS研究では、海馬(Bartlett et al 2004)および前帯状回(Duffy et al 2016)における代謝物プロファイルが、疾患の重症度および神経認知障害に関連していることが示唆されている。他にも、海馬、視床、被殻、中脳を含む辺縁系領域において、神経細胞の損傷のマーカーであるN-アセチルアスパラギン酸(NAA)のレベルが有意に低下し、興奮性神経伝達物質であるグルタミン酸のレベルが上昇していることが確認されている(Macey et al 2017)。
4.1. CPAP治療による脳構造の変化
中等度から重度のOSAにおいて、(Rosenzweig et al 2016)は、CPAP治療1カ月後の眠気の改善が、神経可塑的な脳の変化と相関していることを発見した。これらの変化は、「待機リスト」対照条件(OSAの重症度、年齢、教育レベルで層別された患者を無作為にグループに割り振った)と比較して、注意力調整および作業記憶能力の改善に対応していた。
CPAPによるOSAの治療は、間欠的な低酸素状態と睡眠の断片化を改善することが知られている。そのため、CPAP治療によって神経解剖学的な変化が生じ、それが非OSA被験者に見られるレベルに達するのではないかという仮説を立てることは妥当であろう。Rosenzweig et al 2015)は、1カ月間のCPAPと生活習慣の改善および心理教育により、両側の視床に肥大性変化が誘発されることを明らかにした。(Canessa et al 2011)は、3カ月間のCPAP治療が海馬と前頭構造内のGM体積の増加と関連していることを示した。一方、(O’Donoghue et al 2005)は、6ヵ月間のCPAP治療後に、GMの密度や領域の体積に変化は見られなかった。また、治療前のベースラインにおいても、健常対照者と比較して、GMの密度や体積に変化は認められなかった。その後の解説によると、(O’Donoghue et al 2005)の研究結果と他のグループの研究結果との間の不一致の原因は、方法論の違いとサンプルサイズの小ささにあるかもしれない(Zimmerman and Aloia, 2006)。しかし、毎晩の平均的なCPAP使用が、これらの研究結果の不一致の原因である可能性も同様に高い。
CPAP治療で見られるGMボリュームの変化に加えて、OSAで見られるWMの変化の正常化も報告されている。(Castronovo et al 2014)は、治療を受けたOSA被験者17人のグループを、ベースライン時と治療後の3カ月および12カ月のフォローアップで評価した。彼らは、12カ月後にDTIに基づくFA測定を用いてWMの繊維統合性が正常化し、3カ月後のフォローアップでは限定的な変化しか見られなかったと報告した。この研究や他の研究は、治療効果を調べるOSA研究でしばしば観察されるもう1つの重要な側面を浮き彫りにしている。すなわち、3ヵ月間のCPAP治療では、OSAの推定される悪影響を回復するのに十分ではない可能性がある。(Maresky et al 2019)は、動的帯磁率コントラスト画像(DTIのサブタイプ)を用いて、全脳のFA、平均拡散率、脳灌流の変化を観察した。FAと平均拡散率の変化は、脳の微細構造の完全性の改善を意味する。さらに、CPAP治療は、脳血流と脳血液量の定量化によって測定される脳灌流を改善することが観察された。
4.2. まとめ
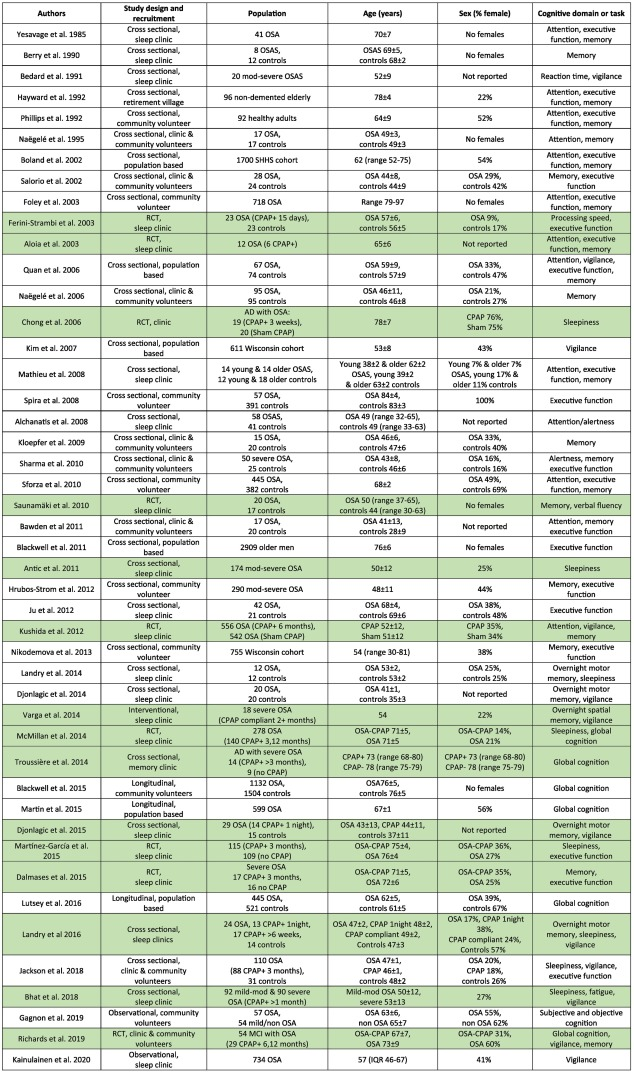
神経画像診断の進歩により、OSA患者における神経解剖学的な著しい変化を観察することができるようになった。注目すべきは、これらの変化が健康な加齢で見られる変化と平行していることである(Veasey, 2012)。健康な高齢者におけるこれらの神経解剖学的変化の進行が、OSAや他の神経疾患が併存している場合に加速されるかどうかは、まだ検証されていない。CPAP治療は、治療を受けていないOSA患者の神経解剖学的変化を誘発することが示されており、CPAPの長期使用による累積的な効果が期待されている。しかし、結果に影響を及ぼす可能性のあるさまざまな変動要因、すなわち方法論、疾患の重症度と慢性度、および夜間のCPAP装着率があることを考えると、いくつかの疑問が残る。表3は、このセクションで参照したOSAと神経解剖学の研究をまとめたものである。
表3 OSAと神経解剖学に関連して検討された研究
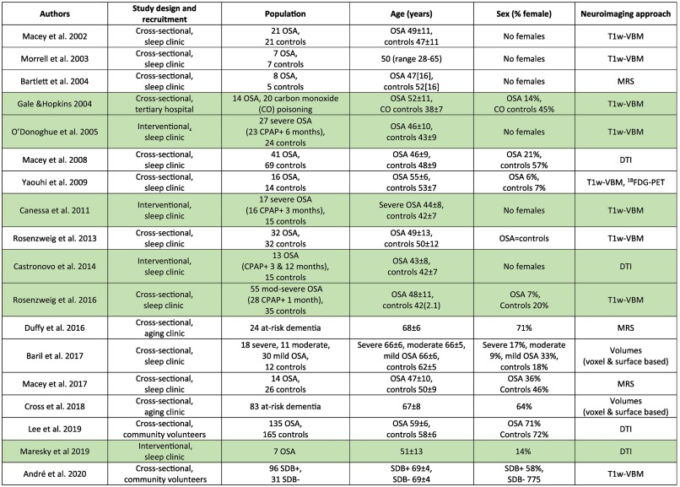
CO-一酸化炭素、CPAP-持続的気道陽圧、脳脊髄液-脳脊髄液、DTI-拡散テンソル画像、FA-分数異方性、OSA-閉塞性睡眠時無呼吸症候群、T1w-VBM-ボクセルベースモルフォメトリー、18FDG-PET-フルオロデオキシグルコース陽電子放出断層撮影法。平均値±標準偏差。中央値(SEM)中央値[IQR]。年齢とパーセンテージの値は出典の原稿を丸めたもの。CPAPを含む研究は緑色でハイライトされている。
5. 睡眠障害とアルツハイマー病のマーカー
睡眠障害は、質の悪い睡眠、短時間の睡眠、断片的な睡眠など様々な形で表現される。質問票による主観的な報告(Sprecher et al 2015)や、動きがないことで睡眠が推測されるActigraphyによる客観的な評価など、様々な睡眠測定のアプローチが、アルツハイマー病の脳脊髄液マーカーと関連することが示されている(Ju et al 2013,Lim et al 2013,Musiek et al 2018)。
脳波は、指紋のような形質特性を示すため(De Gennaro et al 2008)睡眠・覚醒生物学および行動における個体内の安定性および個体間の変動を調査するための強力なツールである(Buckelmuller et al 2006)。頭皮脳波は、低コストで非侵襲的な脳活動の測定法であり、時間分解能が高く、睡眠/覚醒状態の判定、病気の診断、治療に対する反応の評価など、さまざまな場面で広く利用されている(Jobert et al 2012)。
5.1. アルツハイマー病の相関関係としての脳波測定
アルツハイマー病の覚醒時の定量的脳波測定では、年齢をマッチさせた対照群と比較して、後頭部の支配的なリズムが遅くなることが示されており(Petit et al 2004,Dauwels et al 2010年)EEGマーカーの組み合わせがMCIからアルツハイマー病への転換を予測することが示されている(Poil et al 2013)。具体的には、覚醒時の脳波シータ活動は、脳脊髄液のT-tau、P-tauおよび認知機能低下と正の相関を示すことが観察されている(Stomrud et al 2010)。認知症の進行を示す脳波の鈍化を検出するには、睡眠中、特にレム睡眠中の脳波測定が、覚醒時の測定よりも感度が高いと指摘する研究者もいる(Petit et al 1993年、Brayet et al 2016)。1つの説明として、アルツハイマー病の早期に変性することが知られている前脳基底部のコリン作動性ニューロンが、覚醒時よりもレム睡眠時に活発になることが挙げられている(Petit et al 2017)。
睡眠ポリグラフ検査分析中、EEG成分を視覚的に検査し、睡眠マクロ構造、すなわちノンレムステージN1,N2,N3(徐波睡眠)急速眼球運動(REM)睡眠および覚醒の持続時間という観点から、睡眠構造の指標を決定する。睡眠脳波の微細構造とは、脳波信号を構成する背景リズムや一過性のイベントのことである。徐波(SW)K複合体(KC)睡眠紡錘体は、NREM睡眠の3つの段階を定義し、区別するための視覚的睡眠採点で使用される重要なEEG微細構造イベントである。EEG微細構造振動は、スペクトルおよび/またはイベントベースの分析技術を用いて自動的に定量化することができ、睡眠神経生理学をより詳細に理解することができる(Younes, 2017)。SWおよび徐波活動(SWA)は、~0.3~4Hzの周波数範囲にあり、1Hz未満の徐波振動(SO)と~1~4Hzのデルタバンド活動の両方を内包している(Achermann and Borbely, 1997; Rasch and Born, 2013)。徐波振動とデルタ帯活動は、記憶(げっ歯類)(Kim et al 2019)と大脳皮質アミロイド沈着(Mander et al 2015)の両方に異なる影響を与えることが示されているため、徐波振動を機能的に区別することが重要かもしれない。NREM睡眠中の徐波睡眠(
およびSWAは、睡眠のホメオスタシスの推定マーカーであり(Borbely, 1982; Borbely et al 1981)加齢とともに減衰することが観察されている(Carrier et al 2001; Ohayon et al 2004)が、女性ではあまりそうではない(Carrier et al 2011)。
徐波振動の時空間的動態を調べる高密度脳波および神経画像研究では、各波が特定の部位(主に前頭前野)で発生し、頭皮の前後方向に移動し、デフォルトモードネットワーク(DMN)の神経解剖学的構造と重なることがわかっている(Dang-Vu et al 2008,Murphy et al 2009)。低速振動、およびそれに関連する皮質ニューロン活動は、脱分極(激しい発火の活動状態)と過分極(静寂状態)の間を循環し、デルタ波や紡錘形などの他のNREM振動をグループ化または調整していると考えられている(Steriade, 2006; Molle et al 2002; Staresina et al 2015; Mak-McCully et al 2017)。
認知的に正常な人では、睡眠中の脳波微細構造の変化は、アルツハイマー病のバイオマーカーや認知・記憶の指標と関連している。NREM SWAは、脳脊髄液アミロイドβレベル(Varga et al 2016a;Varga et al 2016b;Ju et al 2017)内側前頭前野(mPFC)内のアミロイドβ負担(Mander et al 2015)および前頭前野皮質の萎縮(Mander et al 2013;Varga et al 2016a;Varga et al 2016b)と負の相関を示すことが示されている。最近、Lucey et al 2019)は、SWA、特に2Hz未満のスペクトル周波数領域が、PET画像と脳脊髄液の両方の測定によると、アルツハイマー病の病理と負の関連があることを発見した。さらに、宣言的記憶(Mander et al 2013,Mander et al 2015)および空間的記憶変換の障害(Varga et al 2016a、Varga et al 2016b)は、高齢者のSWAと負の相関があることが示されている。
睡眠紡錘体は、約0.5~3秒持続するシグマ周波数(~11~16Hz)の活動の盈虚振動と定義され(De Gennaro and Ferrara, 2003)知能(Fogel and Smith, 2011)学習(Gais et al 2002; Kam et al 2019a; Kam et al 2019b)記憶(Schabus et al 2004)および睡眠安定性(Dang-Vu et al 2010)における役割が提案されている。また、SOやK複合体とともに、外部環境と中枢神経系内の両方からの覚醒刺激(Halasz er al 2014)に関連する皮質活動にも関与している。Andrillon et al 2011)は、ヒトのてんかん病巣の術前定位において、頭蓋内脳波と単一ユニット神経細胞の記録を用いて、頭皮上に異なる地形分布を持つ遅発性紡錘体(9~12Hz)と速発性紡錘体(12~15Hz)の2つの異なる紡錘体の存在を記録した。高速紡錘体は頭頂部に、低速紡錘体は前頭部に分布していた。また、神経画像、薬理学、記憶に関する研究でも、2つの紡錘体が地形的にも機能的にも異なることが示唆されている(Ayoub et al 2013; Schabus et al 2007; Barakat et al 2011; Molle et al 2011)。さらに、紡錘体周波数活動(SFA)は、若年層に比べて中高年層で低下する(Dijk et al 1989年、Landolt et al 1996年、De Gennaro and Ferrara 2003)。このSFAの加齢による減少は、睡眠紡錘体の発生数(単位時間当たりの密度)や、振幅や持続時間などの形態的特徴の障害と関連している。紡錘体密度は加齢に伴い前頭部で顕著に減少し(De Gennaro and Ferrara, 2003)紡錘体の持続時間は頭頂部で最も顕著に短くなる(Martin er al)。 紡錘体活動における性的二型の証拠は広く報告されており、女性は男性と比較して高い睡眠紡錘体密度を示している(Gaillard and Blois, 1981; Huupponen et al 2002; Purcell et al 2017)。
頭皮脳波から、高速紡錘体は脱分極するSO上昇状態に、低速紡錘体は下降状態への移行に同期しているという証拠がある(Molle and Born, 2011; Klinzing er al)。 最近の研究では、低速振動とスピンドルの結合が少ないことは、側頭葉のタウ負担が大きいことと関連するが、アミロイドβ負担とは関連せず、1Hz未満のSWAと独立して関連することが示されている(Winer et al 2019)。これは、高速スピンドル密度と持続時間がT-tauレベルと逆相関することを示す我々のグループの最近の研究の文脈で興味深い。この研究では、中心的なEEG派生からの紡錘体活動は、脳脊髄液のアミロイドβとタウの両方の測定値、および認知と負の相関があった(Kam et al 2019a、Kam et al 2019b)。
脳の健康との関連で睡眠時のEEG変化を解釈するために、定量的EEG分析方法の発明的な応用が行われている。例えば、Latreille et al 2019)は、REMおよびNREM中のEEGデルタパワーの加齢に伴う減少は、内側前頭皮質および前帯状皮質の菲薄化によって媒介されることを実証している。Sun et al 2019)は、睡眠時のEEGには、機械学習によって識別可能な抽出可能な特徴があり、脳年齢を合理的に予測できることを実証している。
ノンレム睡眠に特徴的な脳波の特徴は、MCI/アルツハイマー病の進行に伴い、通常の加齢の場合よりも低下することが見られる。自発的なK-コンプレックス(De Gennaro et al 2017)や高速睡眠紡錘体は、MCIおよびアルツハイマー病で徐々に密度が低下することが分かっている(Rauchs et al 2008; Gorgoni et al 2016)。さらに、睡眠中の聴覚誘発Kコンプレックスを用いた研究では、アルツハイマー病で密度と振幅が低下し、一方で認知症の重症度が高いほどKコンプレックスを誘発する確率が低いことが示された(Crowley et al 2005)。最近の研究では、加齢に伴う認知障害が、対照群(N=29)と比較して、自覚的な認知症状を訴える患者やMCI患者(N=29)のNREM睡眠中のデルタ、シータ、シグマのパワーの低下と関連していることが示された。これらの患者の1年間の追跡調査では、スピンドル特性(振幅、持続時間、密度または周波数)の変化が認知機能の低下と最も強く関連することが示された(Taillard er al)。 一方、高齢女性を対象とした大規模な解析では、5年後に軽度認知障害または認知症を発症した人(N=85)は、悪化しなかった女性(N=85)と比較して、ベースラインのレム睡眠とノンレム睡眠の両方でシータとシグマの脳波パワー密度が増加していた(Djonlagic et al 2019)。この2つの研究でシータ周波数とシグマ周波数に関連する知見の方向性が異なる理由として考えられるのは、Djonlagic et al 2019)の分析で研究されたバランスのとれたグループの薬の使用状況と高齢の専業女性と比較して、Taillard et al 2019)の研究では薬の使用状況に関するグループ間の違いと、男性と女性を含めることが挙げられる。Taillard et al 2019)の研究では、参加者の約3分の2がOSAの診断基準を満たしており、これがで議論するようにEEG測定に影響を与える可能性があることは注目に値する。
Cyclic alternating pattern(CAP)分析は、EEGの覚醒や睡眠の不安定現象を定量化するのに有効な方法である。この解析では、皮質の活性化(A相)と非活性化(B相)が交互に繰り返されることを確認する。A相サブタイプA1-A3事象は、高電圧の徐波(EEG同期)または低振幅の高速リズム(EEG非同期)のいずれかが支配する事象持続時間の割合に応じて記述され、特徴的な睡眠EEG振動および一過性の事象を含む(Tarzano et al 1996;ParrinoおよびTarzano 2017)。CAP相サブタイプA1はSW、K-コンプレックス、紡錘体を含むことが多く、サブタイプA2とA3はAASMで定義された微小覚醒イベントに似ている(Parrino er al)。 CAP分析を用いて、(Carnicelli et al 2019)は、アルツハイマー病に転換したMCIの人のNREM 2睡眠中のA1(SWとK-complexes)とA2イベント(SWで始まり、覚醒で終わる)の減少を観察した。
5.2. OSAの脳波、アルツハイマー病マーカーとの相関?
脳波活動の変化は、OSAでは覚醒状態と睡眠状態の両方で報告されており、D’Rozario et al 2017)で包括的にレビューされている。認知機能が低下した人で報告された知見と同様に、OSAでは対照群と比較して覚醒時のEEGスローイングが観察される(Morisson et al 1998年、Morisson et al 2001,Mathieu et al 2007,Gennaro et al 2008,Xiromeritis et al 2011)。さらに、EEGスローイングの増加は、眠気などの日中の症状の悪化(Lee et al 2012年)注意時の事象関連電位(ERP)の異常(Baril et al 2013年)PVTやドライビングシミュレータのパフォーマンスの低下(D’Rozario et al 2013,Wang et al 2015)と関連している。覚醒時のEEGの低下がOSAの重症度の悪化(覚醒指数、AHIまたは低酸素症の増加)と関連することを発見した研究もあるが(Mathieu et al 2007,Greneche et al 2008a、Greneche et al 2008b)EEGの低下の大きさが現在の診断手段を用いたOSAの重症度と一致することを観察していない研究もある(Sforza et al 2002)。
OSAのqEEG分析を用いた初期の研究でも、レム睡眠中のEEGの低下が対照群に比べて増加していることがわかったが(Morisson et al 1998年、Morisson et al 2001年)これらは少数の人を対象としており、EEGの短いセグメントのみを対象としていた。しかし、これらのオリジナルの知見はその後、664人の男性(40歳以上)の外来qEEG測定を調査した大規模な研究で再現され、OSAの重症度と、レム睡眠中のすべての周波数帯におけるEEGスローイング比およびEEGパワーの両方との間に正の関連があることが示された(Appleton et al 2019)。重要なのは、同じ著者による以前の研究で、様々なOSA重症度を持つ76人において、レム睡眠中のEEGスローイング(デルタパワー)が大きいと、模擬運転パフォーマンスの悪化を予測することが分かったことである(Vakulin et al 2016)。中程度の重症OSAの男性8人を対象に、長時間の覚醒プロトコルを行った小規模な研究では、ベースライン時のレム睡眠中のEEGスローイングが大きいほど、24時間覚醒後のPVT反応時間が遅くなり、PVT周回数が多くなり、AusEdクラッシュが多くなることと関連していた。同じ期間に、NREM睡眠中の紡錘体密度の低下も、PVT反応時間の遅さと関連していた(Mullins et al 2020)。
OSA患者のNREM睡眠中の脳波微細構造を定量化した研究の多くは、コントロールと比較してSWAが減少していること(Guilleminault et al 2001,Saunamaki et al 2009,Jones et al 2014,Ju et al 2016年)または睡眠期間中のSWAの消失が遅いこと(Ondze et al 2003,Himanen et al 2004)を示している。健康な若年者(Jurado et al 1989)と高齢者(Anderson and Horne 2003)の両方で、徐波睡眠/SWAの増加が翌日のパフォーマンスの向上と関連していることを考えると、NREM睡眠中の徐波睡眠持続時間とデルタパワーがOSAのドライビングシミュレータのパフォーマンスの低下を予測することも驚くことではない(Vakulin et al 2016)。注目すべきは、OSAにおけるSWAと脳脊髄液アミロイドβの関係を検討した小規模な研究が1つだけあることである(Ju er al 2016)。この研究では、NREM SWAは、対照群では脳脊髄液アミロイド-βレベルと負の相関があったが、OSAの人ではなかった。
睡眠呼吸障害のある人のCAP分析を用いた研究では、CAPサブタイプA2およびA3の割合と持続時間が、コントロールと比較して高いことがわかっている。OSA(Tarzano et al 1996年)上気道抵抗症候群(Guilleminault et al 2007年)日中の過度の眠気(EDS)を伴うOSAでは、眠気のない人に比べて、CAPサブタイプA2およびA3の速度および持続時間がコントロールに比べて高いことが分かっている(Korkmaz et al 2018)。呼吸に関連したEEG微細構造イベントの変化がNREM時のスペクトルパワーの測定にどの程度影響するかは、アルツハイマー病病変を有する人のEEG変化を報告する研究ではあまり認められていない。これは、徐波振動とK-コンプレックスの間の部分的なスペクトル周波数の重なりを考えると適切であり(De Gennaro er al)。 睡眠呼吸障害のある呼吸不全患者では、二酸化炭素分圧(PCO2)と徐波睡眠の割合との間に正の関連が観察され、夜間の血液ガス交換の異常が徐波の出現に影響を与えているようである(Wang et al 2011)。さらに、OSAは、睡眠サイクル全体におけるSWAとK-コンプレックスの振幅の正常な恒常的な減少の両方を損なうという証拠があり(Parapatics et al 2015年)K-コンプレックスは睡眠中の呼吸イベントによって頻繁に誘発されるが(Nguyen et al 2016,Parekh et al 2019年)呼吸誘発K-コンプレックスはOSAでは自発的なK-コンプレックスと比べて形態的に異なる(Sun et al 2019)。Chervin et al 2005)によるいくつかの研究では、呼吸周期に関連した脳波の変化、特にシグマパワーの変化は、睡眠呼吸障害の人の眠気を予測するものであり、おそらく吸気時のシグマ(覚醒活動)の増加を反映していることが示されている。
所見には一貫性がないが、睡眠障害における紡錘体振動のシステマティックレビュー(Weiner and Dang-Vu, 2016)によると、OSA患者は全体的に、OSAではない人に比べて紡錘体の活動が少なく(スペクトル、視覚、自動イベント分析法を使用)紡錘体の周波数が遅いことが示されている(Schonwald et al, 2012)。さらに、OSAでは、コントロールと比較して、夜間睡眠期間中の異なる紡錘体ダイナミクスが観察される(Ondze et al 2003,Huupponen et al 2008,Carvalho et al 2014)。興味深いことに、OSASの過体重青年の紡錘体を定量化した研究では、年齢とBMIを一致させた対照群と比較して、紡錘体の活動(数と密度)が増加していることがわかり(Madaeva et al 2017年)若年成人におけるOSAへの適応的な皮質反応の潜在的な影響が強調されている。薬を服用していない若年者(~24歳)と高齢者(~59歳)のOSAS患者のEEGスペクトルパワーの違いを調べたところ、NREM時の低速(13Hz未満)と高速(13Hz以上)のシグマ活動の両方が高齢者グループで高く、低速/高速シグマ活動の比は若年者のみでOSA重症度指標と正の相関があることがわかった(Lee er al)。
紡錘体活動と認知機能との関連性がよく知られているにもかかわらず(De Gennaro and Ferrara, 2003; Schabus et al 2004; Schabus et al 2006)OSAにおける睡眠紡錘体活動と認知機能との関係を調査した例はほとんどない。紡錘体と夜間のタスク改善との間には、中程度の正の相関(統計的には有意ではない)がOSA参加者では観察されているが、対照者では観察されていない(Landry et al 2014)。さらに、OSA患者における学習後の紡錘体の増強は、健康な若年成人に見られるように、(Barner et al 2016)によって観察されなかった(Gais et al 2002)。しかし、参加者の年齢が高いことが、効果が見られなかったことの説明になるかもしれない(Gais et al 2002)の24歳に対し、Barner et al 2016)の平均年齢は52歳)。現在までに、OSAが低速振動-スピンドル結合に及ぼす影響を調査した研究は発表されていない。
5.3. EEGに対するCPAP治療の効果
十分なCPAP治療を受けると、睡眠のマクロ構造がOSAのない人と同じように回復する。特に、徐波睡眠とREMの持続時間が長くなり、これらの段階への睡眠潜時が短くなる(Parrino et al 2000,McArdleとDouglas 2001,Brillante et al 2012)。このような睡眠のマクロ構造の変化や呼吸関連の覚醒の減少(Fietze et al 1997)に加えて、CPAP治療後の覚醒時および睡眠時の脳波記録における脳波のミクロ構造の変化を調べた文献はわずかしかない。
初期の研究では、少数(N~10)の主に男性患者(~80%)を対象に、CAP(Parrino et al 2000,Thomas 2002,Parrino et al 2005)やスペクトルパワー計算(Morisson et al 2001,Heinzer et al 2001)などの特徴に関する包括的なEEG分析を行い、CPAP治療の前、間、および様々な長さの後に、対照とOSA患者を比較した。(Parrino et al 2000)は、CPAPを開始した最初の夜に、覚醒度とCAPの測定値が対照群よりも有意に減少したことを指摘し、そのうちCAP率の減少は眠気の改善と有意な相関を示した。その後、同じグループは、CPAPを1カ月間続けた結果、CAPが徐々に正常化し、30日間の連続治療終了時には、A1サブタイプのイベント数が対照患者のレベルを下回っていることを確認した(Parrino et al 2005)。この研究では、Multiple Sleep Latency Test(MSLT)スコアが覚醒およびCAP率と負の相関があることもわかったが、これは以前の研究では当てはまらなかった。CPAP治療の前後でスペクトルパワー分析を用いた初期の研究では、覚醒時とレム睡眠時の脳波の低下が是正されたが、眠気が完全に解消されたわけではなかった(Morisson et al 2001)。さらに、同じ研究グループは、同様の患者グループにおいて、CPAPを9ヶ月間使用した後、未治療のベースライン睡眠時と比較して、夜間の最初の部分でSWAの増加を観察した(Heinzer et al 2001)。その後の多くの研究でも、数か月間のCPAP治療により、覚醒時の脳波異常(EEGスローイング)が部分的に回復し、日中の機能が一部改善することが示されている(Greneche et al 2011,Xiromeritis et al 2011,Lee et al 2012,Wang et al 2014年)詳細なレビューは(D’Rozario et al 2017)を参照。
睡眠スピンドル特性に対するCPAP治療の効果を調査した研究では、診断用の夜間睡眠ポリグラフ検査と比較して、CPAP滴定中にスピンドル密度が増加することが示されている(Chokroverty et al 2015,Yetkin and Aydogan 2018)。紡錘体の特徴に関する研究では、CPAP治療により、健常対照者に見られるものに向けてグループの紡錘体の特徴が部分的に正常化することが分かっている(Saunamaki et al 2017)。
K-コンプレックスもCPAP治療の結果として変化するという証拠がある。Parapatics et al 2015)は、KC密度と恒常性振幅散逸が、CPAP治療の3~6カ月後に正常対照者のレベルに戻ることを発見した。我々のグループの研究では、CPAP治療によってKC密度が減少し、SWAおよびK複合体を取り巻く徐波活動(ΔSWAK)が増加することが示されている(Parekh et al 2019)。さらに今回の解析では、ΔSWAKは警戒心(PVT lapses)の有意な予測因子であり、KCによって誘発される徐波活動が少ないほど、パフォーマンスの障害が大きくなることと関連していた。このような睡眠脳波と日中のパフォーマンスの関係は、慢性および急性OSAの両状態において横断的に観察されただけでなく、CPAP治療に伴って縦断的にも観察された。
5.4. まとめ
加齢や認知症に伴う覚醒時と睡眠時の脳波の変化は、男性と女性で異なることがよく知られている。予備的な知見では、OSAでは睡眠が障害され、脳波の微細構造が加齢や認知症時と同様に変化することが示されているが、大規模な研究はほとんど行われていない(図1)。さらに、睡眠呼吸障害やCPAP治療に対する神経生理学的反応には個人差が大きいことから、睡眠の断片化の重症度や慢性度と間欠的な低酸素状態との間には複雑な関係があり、その関係を切り離すことは困難である。表4は、このセクションで参照したOSAとEEGの研究をまとめたものである。
図1.認知症、老化、アルツハイマー病バイオマーカー、睡眠呼吸障害、CPAP治療で見られる脳波の特徴をまとめた図
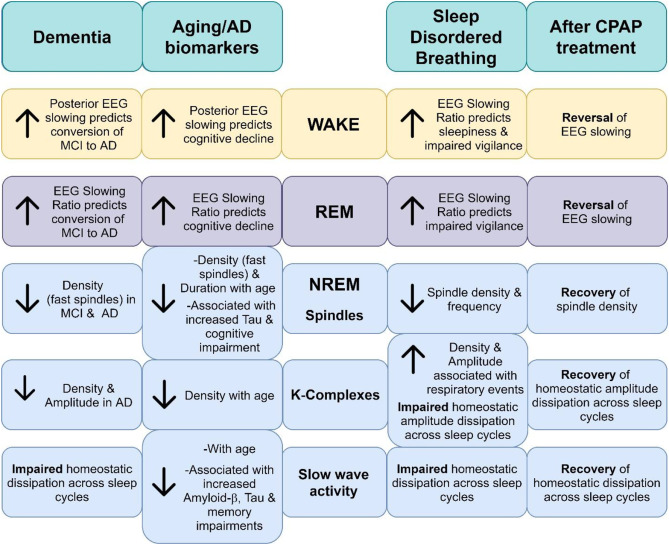
表4 OSAと脳波の定量的測定に関連してレビューされた研究
CAP: cyclic alternating pattern, CPAP: continuous positive airway pressure, DFA: detrended fluctuation analysis, ERP: event related potential, ES: excessive sleepiness, OSA: obstructive sleep apnea, OSAS: obstructive sleep apnea syndrome, OSHS: obstructive sleep hypopnea syndrome, 睡眠呼吸障害: sleep-disordered breathing, SW: slow wave, SWA: slow wave activity, UARS: upper airway resistance. 中央値(SEM)中央値[IQR]。年齢とパーセンテージの値は出典の原稿を丸めたもの。CPAPを含む研究は緑色でハイライトされている。
6. アミロイドとタウ以外の要因
6.1. OSAとApoE
ApoE遺伝子には3つの共通対立遺伝子があり、ApoE4を1つ以上持つことが遅発性アルツハイマー病の最大の遺伝的危険因子として知られている(Corder et al 1993)。脳内では、ApoEタンパク質がアストロサイトで産生され、コレステロールを神経細胞に輸送する。このプロセスは、神経細胞膜の機能や神経細胞の完全性(特に神経突起の伸長など)に不可欠である(Mahley and Rall Jr, 2000)。初期の研究では、ApoE4対立遺伝子を1つ持っていると、中等度から重度のOSAになる確率が高くなることが示唆されていたが(Gottlieb et al 2004,Kadotani et al 2001年)その後のいくつかの研究では、ApoE遺伝子型とOSAの間には関係がないことが示唆されている(Saarelainen et al 1998年、Thakre et al 2009,Xu et al 2015,Lu et al 2016)。私たちのグループは、ApoE遺伝子型がOSA重症度と脳脊髄液アミロイドβ42またはタウとの関係に影響を与えることを発見した。ApoE3キャリアではOSA重症度と脳脊髄液アミロイドβ42またはタウの両方に正の関連が認められたが、ApoE4キャリアでは関連がない(タウ)か負の関連(アミロイドβ42)が認められた(Osorio et al 2014)。しかし、ApoE4キャリアの数はApoE3キャリアに比べて非常に少ないため、この関係に対するApoE遺伝子型の影響を確かめるには追加の研究が必要である。ApoE e4対立遺伝子を保有するOSA参加者では、PET画像による皮質アミロイド負荷が高いことが横断研究で観察されたことから、アミロイド負荷に対するApoE遺伝子型の影響は一般的にOSA患者にも及ぶようである(Elias er al)。 認知的に正常な中年成人のApoE4キャリアは、OSAを併発している被験者に限って、空間作業記憶が非キャリアに比べて損なわれており、通常の呼吸をしている対照者には見られなかったことから、OSAとApoE4キャリアの状態の負の影響は相乗的である可能性がある(Cosentino er al 2008)。これらの研究は、OSAの重症度とApoEの複雑な相互作用を浮き彫りにし、未治療の無呼吸がバイオマーカーやアルツハイマー病の臨床症状に10年先行する微妙な認知障害に影響を与えることを示唆している。
6.2. OSAと免疫因子
アルツハイマー病と睡眠分野の研究では、脳と免疫系の間に重要なクロストークがあることが明らかになっている。ミクログリアは、脳の主要な免疫細胞であり、神経発達、感染反応、神経シナプスの恒常性維持など、さまざまな機能を持っている。この常駐免疫細胞は、脳内のもう一つのグリア細胞であるアストロサイトによっても活性化される。OSAがこのクロストークにどのような影響を与えるかは、免疫系を測定する方法が限られているため、正確にはほとんどわかっていない。ミクログリアは脳内の病原体に反応してサイトカインを分泌するが、OSA分野の研究成果の多くは、血液中の全身性免疫源を測定したものである。例えば、中等度から重度のOSAでは、血中由来のIL-6とタウがOSAのないコントロールよりも大きかった(Motamedi er al)。 CRP、IL-1Ra、IL-8,TNF-αなどの他の循環因子は、OSAと急性心血管イベントを有する患者で上昇を示している(Testelmans er al)。 それにもかかわらず、この分野では、生体内試験での脳からのミクログリア活性化のバイオマーカーが広く採用されていない。YKL-40は、ミクログリアを活性化するアストログリアの分泌タンパク質であり、脳脊髄液から測定するとMCIの早期認知機能低下に追随することが示されている(Craig-Schapiro er al)。 睡眠時無呼吸症候群では、血清由来のYKL-40がより侵襲性の低いバイオマーカーとなるが、全身性免疫由来であるという代償を払うことになる。例えば、血清YKL-40の上昇は、OSAと冠動脈疾患(Sui and Gao, 2013)OSAと糖尿病(Sun et al 2015)および横断的に測定したOSAと高血圧の患者で見られた(Jafari and Mohsenin, 2016)。脳脊髄液から測定すると、主観的に定義された睡眠不足の認知的に正常な高齢者は、検出可能なほど高いYKL-40レベルを示する(Sprecher et al 2017)。YKL-40を含む複数の脳脊髄液由来のタンパク質に対する徐波睡眠崩壊の役割を解明するために、Ju et al 2017)は、一晩の徐波睡眠崩壊パラダイムを実施し、脳脊髄液のYKL-40は偽薬と比較してデルタパワーの変化と相関しなかった。これらの結果は、ミクログリアの活性化には、OSAに見られる間欠的な低酸素を伴う慢性的な睡眠の分断が必要である可能性が高いことを示している(Ju et al 2017)。可溶性脳脊髄液 TREM2は、アルツハイマー病の遺伝的危険因子のミクログリアタンパク質製品であり(Jonsson et al 2013,Guerreiro et al 2013年)認知的に正常な高齢者と比較してアルツハイマー病では高いことがわかっている(Heslegrave et al 2016,Ewers et al 2019)。生体内および特定の脳領域におけるミクログリアの活性化をモニターするPETトレーサーの開発は、アルツハイマー病において積極的に研究されており、OSAにおいても将来的に検討する必要がある(Edison er al)。 間欠的な低酸素を伴わない睡眠制限の動物モデルでは、ミクログリアとアストロサイトの両方がシナプスを貪食することが形態学的に証明されており、脳がシナプスのホメオスタシスを維持するために長時間の覚醒に反応する1つの方法が示唆されている(Bellesi et al 2017)。しかし、OSAにおけるミクログリアとアストロサイトの間の病理学的クロストークを解剖するには、生体内試験で同時かつ縦断的にアッセイできる特定のバイオマーカーが必要である。
6.3. OSAと血液-脳関門/リンパ系
血液脳関門(BBB)は、脳と循環血液を機能的に分離している。OSAがBBBの伝染性をどのように乱すかについては仮説が立てられてきたが(Lim and Pack, 2014)最近になってようやく、ヒトの生体内でBBBの伝染性を測定するイメージング法が開発された(Raja et al, 2018)。疑似連続動脈スピンラベリングMRIは、OSA患者が非OSA対照者と比較してBBBを介した水の拡散が低下していることを示している(Palomares et al 2015)。BBBが破壊されると、循環している細胞が脳内に浸潤する可能性がある。灌流画像を用いて、OSA群では対照群と比較して、局所脳血流の低下と、主に顆粒球の白血球アポトーシスの増加が認められた(Chen et al 2017)。特に高齢の重症OSA患者では、局所的な脳血流低下が認められたこと(Baril et al 2015)と合わせて考えると、OSAは領域特異的なBBB破壊に寄与していると考えられる。しかし、この同じ研究で、海馬、扁桃体、尾状体などの他の脳領域では、逆説的に過灌流が見られ、AHIと正の相関を示したことから、頻繁な無呼吸や低呼吸の結果、領域特異的な過活動が起こっていることが示唆された(Baril er al 2015)。
動物を用いた研究では、アミロイドβやその他の脳内代謝物を間質空間から脳脊髄液に排出するリンパ系が同定されている(Xie er al 2013)。しかし、溶質の間質液(脳間質液)クリアランスに関するエビデンスがないため、この分野は論争の的となっている(Abbott et al 2018)。ヒトの生体内で脳間質液から脳脊髄液への溶質の交換を直接測定する方法は不足しているが、ある方法では超高速磁気共鳴脳波を用いて、脳内の心臓、呼吸、超低周波パルス媒介流を特定している(Kiviniemi et al 2016)。睡眠段階と脳脊髄液フローの時間的な関係は、眠っている人間の脳の謎のままであった。脳波と超高速MRIを同時に用いることで、徐波睡眠中のBOLDと脳脊髄液のリズムにデルタ波が先行することがわかった(Fultz er al 2019)。著者らは、第4脳室からの脳脊髄液流入が、徐波睡眠中に脳脊髄液と脳間質液が混合する新たな経路であることを提案している(Fultz er al)。 理想的には、これらの高度なイメージング手法を将来の研究に適用し、OSAがどのように潜在的にグリンパティッククリアランスに影響を与えるかを理解することである。OSAによる徐波睡眠の乱れと、無呼吸と回復呼吸の間の大きな胸腔内圧の変化は、周期的な脳脊髄液脈動に影響を与え、潜在的にグリムファティッククリアランスを調節するために相反して作用している可能性がある。
6.4. OSAとニューロン因子
オレキシン(別名ヒポクレチン)は、覚醒維持、覚醒、摂食に関与する神経ペプチドであり、主に視床下部の外側で産生される。アミロイド過剰産生モデルマウスでは、脳内に投与されたオレキシンが脳間質液アミロイドβを増加させる一方、デュアルオレキシン受容体アンタゴニストが脳間質液アミロイドβを減少させ、24時間にわたる覚醒持続時間を減少させた(Kang er al)。 OSAを持たないヒトでは、実験的に5日間の睡眠制限を行うと、アミロイドβ、タウ、神経細胞由来のタンパク質(ニューロフィラメントライト、神経細胞特異的エノラーゼ、脂肪酸結合タンパク質)の増加を伴わない脳脊髄液オレキシンの増加が認められた(Olsson et al 2018)。認知的に正常な高齢者のコホートでは、脳脊髄液のオレキシンは脳脊髄液のアルツハイマー病バイオマーカーであるアミロイドβ、P-tau、T-tauと正の相関があり、これはAHIによって駆動されなかった(Osorio et al 2016)。しかし、閉塞性睡眠時無呼吸症候群患者のオレキシン測定値は、ある研究ではOSA患者とそうでない被験者の間で脳脊髄液オレキシンに変化がないことが示され(Kanbayashi et al 2003年)別の研究では、未治療のOSA被験者では、治療を受けたOSA被験者と通常の呼吸をしている被験者の両方と比較して脳脊髄液オレキシンレベルが上昇することが示されている(Liguori et al 2019)。さらに、OSAの血漿オレキシンレベルは、OSAの眠い被験者(ESS≧13 vs ESS≦9)で高いレベルを示し、眠気と関連しているようである(Sanchez-de-la-Torre et al 2011)。その他の有望な神経由来のバイオマーカーとしては、脳脊髄液 VILIP-1とニューログラニンがあり、いずれも軽度のOSAと比較して中等度重度のOSA群で低いことが示されている(Ju er al 2016)。神経細胞由来のバイオマーカーに関するこれらの不均質な所見は、神経細胞の完全性のマーカーに対するOSAの影響についてのより大規模な研究を保証するものである。
6.5. まとめ
特に免疫系は、アルツハイマー病の発症と進行に重要な役割を果たしていることが注目されている。OSAは、サイトカインや免疫細胞に直接的な影響を与えている可能性が高く、また、血液脳関門への影響を介して免疫細胞が脳にアクセスしている可能性もあるが、これらの影響がアルツハイマー病のリスクや進行にどの程度影響するかについては、まだ理解されていない。表5は、このセクションで言及したOSAバイオマーカー研究をまとめたものである。
表5 アミロイドやタウ以外のOSAとバイオマーカーに関連する研究をまとめた
ApoE: ApoE: Apolipoprotein E, BBB: blood brain barrier, CV: cardiovascular event, EDS: excessive daytime sleepiness, HT: hypertension, OSA: obstructive sleep apnea, SHHS: sleep heart health study, YKL-40: 40 kDaのヘパリン・キチン結合糖タンパク質。中央値(SEM)中央値[IQR]。年齢とパーセンテージの値は出典の原稿を四捨五入している。CPAPを含む研究は緑色でハイライトされている。
7. 課題と今後の方向性
7.1. アルツハイマー病および認知症のバイオマーカーに対するCPAP治療の効果を調査する決定的な試験の難しさ-今後の方向性
アルツハイマー病と睡眠呼吸障害の交差する研究分野における基本的な課題の一つは、睡眠時無呼吸症候群の重症度の定義と適切な治療反応の両方に関連した測定の問題であると思われる。
The AASM manual for the scoring of sleep and related events(睡眠とそれに関連する事象の採点に関するAASMマニュアル)によれば、ルール、用語、技術仕様が示されている。AASM manual for scoring of sleep and associated events: Rules, Terminology and Technical Specifications (Iber et al 2007)によると、AHIスコアに寄与する呼吸イベントは、閉塞性、中枢性、混合性無呼吸イベント(気流の完全な停止)と低呼吸イベント(気流の減少)の4種類である。低呼吸は統一された定義がなく、事象の後遺症(典型的には脳波の微小覚醒および/または酸素欠乏の事象だが、研究では心拍数の変化に伴う事象などが用いられている)によって分類されている。このような異質性は、純粋にイベントの頻度に依存する場合と同様に、OSAの悪影響を理解する上でいくつかの根本的な障害となる。例えば、1回の事象が120秒続き、70度台の著しい酸素飽和度を伴うAHI10/時間の人は、1回の事象が10秒続き、純粋に覚醒を伴うだけで酸素の変化がないAHI30/時間の人と比べて、良いのか悪いのか、ということだ。睡眠の断片化(覚醒による)と低酸素血症(酸素脱離による)を1つのAHI測定で切り離すことは不可能である。さらに、ある定義で大規模な疫学試験や臨床試験が行われた場合、別の定義を用いた研究を既存の知識に統合することは困難である。おそらく、OSAの負の転帰に対するフラグメンテーションと低酸素の寄与を理解するためには、この分野ではOSA診断のためのAHIを超える必要があるだろう。
そのためには、睡眠ポリグラフ検査における既存の睡眠生理学的測定法を新たに分析して、診断時と治療時におけるOSAの睡眠生理学をより詳細に特徴づけることが必要であろう。睡眠ポリグラフ検査中に複数の器官系から収集した豊富な振動活動を新たに定量化することで、睡眠障害の悪影響に対する脆弱性の個人差を説明できる可能性がある。しかし、この可能性は、自宅で睡眠検査を完了させることが強く求められていることによって妨げられている。自宅での睡眠検査では、AHIを算出するのに十分な信号を収集することがますます重要になっている。人間の生理機能には高度な個人差があり、これが、OSAが個人の中でどのように健康に悪影響を及ぼすかについての理解を狭めている原因となっていると考えられる(Davies and Harrington, 2016)。OSAの最も効果的で頻繁に推奨される治療法であるにもかかわらず、CPAPの受容率と遵守率は様々であり、OSAによる眠気やその他の症状がない人では特に劣る可能性がある(McArdle et al 1999年、Weaver and Grunstein 2008)。さらに、臨床や研究の場では、CPAPを適切に使用するための基準として、少なくとも70%の夜間に4時間以上の使用が推奨されているが、この推奨値は事実上無作為に選ばれたものであり(Weaver et al 2007,Sawyer et al 2011年)個人の習慣的な睡眠時間、未処理の睡眠の割合、未処理の睡眠中の無呼吸の重症度は無視されている。CPAPを部分的に使用している人の場合、未処理の睡眠部分は、通常、レム睡眠が多い後半部分であり、レム筋の緊張低下によりOSAが最悪の状態になることが多い睡眠段階である。レム睡眠に関連するOSAの有害な結果を強調する研究は、アルツハイマー病と睡眠に関する研究課題に役立つ可能性がある(Varga and Mokhlesi, 2019)。Sleep Heart Health Studyの二次解析において、(Pase et al 2017)は、REM睡眠時間の減少とREMへの潜伏時間の増加が、アルツハイマー病認知症の発症と関連することを観察した。さらに、MCIではレム睡眠が減少することが報告されている(Maestri et al 2015,Liguori et al 2016)。レム睡眠に関連したOSAに焦点を当てた興味深い研究では、Baril et al 2020)が、レム睡眠中の睡眠呼吸障害の増加が、前頭部における日中の局所脳血流の減少と関連していることを明らかにした。
OSAには個人間のばらつきがある一方で、共通のグループ分けを可能にする個人のサブセットに共通する特徴があるかもしれない(すなわち、上気道の高い崩壊性と低い覚醒閾値によって引き起こされるOSA)(Seely and Macklem, 2004; Buckelmuller er al)。 OSAの研究で歴史的に軽視されてきた分野の一つに、性的二型がある。OSAの表現型に関して男性と女性の間に有意差があることを示す新たな証拠(Won et al 2020)や、CPAP療法が健康アウトカムに与える影響(Gagnadoux et al 2017)から、事後分析ではなく研究デザインで性別を考慮する必要がある。眠気、覚醒、認知に関する治療への反応について、集団ではなく個人の変化を理解することで、個人の日中の機能の改善を達成するための治療方法や必要な使用量について、より良い指標が得られる可能性が高い。
AHIを診断や疾患の重症度の判定に用いる際のもう一つの難点は、疾患の慢性化に鈍感なことである。OSAが健康に及ぼす影響を理解する上で重要なのは、システムへのストレス要因に対する適応プロセスの傾向であり、これは回復力としても理解される。睡眠EEGの高い遺伝性(Ambrosius et al 2008年)個人内の安定性(Lewandowski et al 2013,Poon et al 2019)に加え、EEGパターンや睡眠・覚醒調節に対する遺伝子の影響(Shi et al 2017)が知られていることから、睡眠障害の異質性とリスクの理解に活用できる可能性がある。睡眠呼吸障害時の睡眠への摂動に直面する回復力のある脳という概念は、睡眠EEG微細構造を用いて神経変性のバイオマーカーを特定したり(Melpignano et al 2019年)個人の健康的な睡眠を実現するための戦略(Parrino and Vaudano 2018)を構築するための枠組みを提供する。同様に、生物学的複雑性(Goldberger, 2006)やフラクタル特性(Franca et al 2018)を評価する信号分析の非線形手法(Ma er al)。 例えば、Zhang et al 2009)は、CPAP治療で安定する睡眠EEGのフラクタル次元シーケンス分析を用いて、OSAの重症度を評価できることを示した(Zhang et al 2015)。おそらく、このような方法を睡眠脳波に適用すれば、「健康な」恒常性徐波と「有害な」病的徐波や脳波の低下を定量的に区別することができるだろう(Petit er al)。 睡眠の新しい測定法は、睡眠障害の否定的な結果に対する個人の脆弱性をよりよく特徴づける可能性があるにもかかわらず、睡眠、OSA、アルツハイマー病の関連性を調査する際に現在テストされている多数の睡眠の特徴に追加される。この目的のために、文献には、多くの尺度が検証され、有意な関連だけが報告され、多重比較の補正が十分に行われていないため、かなりの出版バイアスがかかっている可能性がある。
入手可能な証拠に基づいて、多くの人が、アルツハイマー病予防のためのOSA治療の臨床試験が必要であると主張するだろう。しかし、このような臨床試験の構想には、いくつかの基本的な問題があり、その多くは、アルツハイマー病の進行を遅らせたり予防したりするための介入に本質的なものである。アルツハイマー病の分野では、認知機能の変化が明らかになる前に、シナプスの機能障害やアミロイド・タウの蓄積などの脳の変化が起こる、数年から数十年に及ぶ長い前臨床段階があることを認識している。したがって、アルツハイマー病予防のための理想的な臨床試験では、比較的若く、そのような前臨床的な脳の変化が起こり始めたばかりの被験者を採用することになるであろう。しかし、アルツハイマー病発症への影響を判断するためには、そのような臨床試験をどのくらいの期間続ける必要があるのかという疑問が生じるのも当然である。その答えは、10年から 20年という長い年月になると思われ、このような提案の実現性(および資金調達力)に悪影響を与える。率直な認知症の発症を主要評価項目とする代わりに、中間的な代替評価項目(例えば、PET画像による脳のアミロイドやタウの負荷)を評価することもできるが、そのような評価項目が最終的に認知症の発症に影響を与えるか否かについて、この分野ではまだコンセンサスが得られていない。募集年齢、追跡期間、主要評価項目の設定は、アルツハイマー病治療の臨床試験を計画する上での問題点であるが、OSAにはさらに特有の問題がある。理想的な試験では、特に、すべての原因の眠気が高齢の被験者における脳アミロイドの長期的な蓄積と関連することが示されたという観察結果を考慮して、治療から最も利益を得ることができる個人、すなわち重度のOSAおよび日中の眠気を有する個人をリクルートしたいと思うだろう(Carvalho et al 2018)。しかし、重度のOSAと日中の眠気を有する個人を、治療を欠いた対照群に無作為に割り当てることは、特に何年もかけて行う必要がある場合、倫理的に正当化できないだろう。そこで、日中の症状がない重度のOSAが偶然確認された地域の人々に焦点を当てることが考えられる。しかし、そのような人たちでは、心血管エンドポイントに対するCPAPの最近の臨床試験(McEvoy et al 2016)で観察されたように、治療群のCPAPへのアドヒアランスはかなり低くなると思われる。この試験では、平均追跡期間3.7年の間、平均CPAP使用時間は一晩あたりわずか3.3時間であった。アドヒアランスの問題は、治療群を「AHIをある閾値以下に下げるあらゆる介入」に自由化することで最小限に抑えることができる。これは、私たちの同僚であるDavid Rapoport博士が提唱した概念で、下顎前進装置の使用、鼻腔内EPAP、体位療法、その他の介入などが考えられる。魅力的ではあるが、試験で複数の介入を行うことの実現可能性や、CPAPでは簡単にできるアドヒアランスの追跡は、まだ解決していない要素である。