Nutraceutical Targeting of Inflammation-Modulating microRNAs in Severe Forms of COVID-19: A Novel Approach to Prevent the Cytokine Storm
www.ncbi.nlm.nih.gov/pmc/articles/PMC7759543/
Michel Desjarlais, 1 , 2 ,* Maëlle Wirth, 1 , 2 Isabelle Lahaie, 1 Pakiza Ruknudin, 1 Pierre Hardy, 2 Alain Rivard, 3 , 3 † and Sylvain Chemtob
要旨
コロナウイルス感染症2019(COVID-19)のパンデミックは、世界的な健康問題の第1位となっている。2020年8月現在、1,800万人以上のヒトに感染し、全世界で70万人以上の死者を出している。
COVID-19は、重度の急性呼吸器症候群を引き起こす可能性のある感染症である。特定の状況下では、ウイルス感染は過剰で制御不能な炎症反応を引き起こし、これは肺胞構造における炎症性サイトカインの大量放出と関連している。この現象は「サイトカインストーム」と呼ばれ、肺障害、急性呼吸器症候群、死亡率と密接に関連している。残念ながら、現在のところ、この感染症を予防するためのワクチンはなく、また、この重症化に伴う死亡率を低下させるための有効な治療法もない。
COVID-19に関連するサイトカインストームは、敗血症、急性呼吸窮迫症候群、急性肺損傷、および重症例のインフルエンザを含む他のウイルス感染症などの他の病態で観察されるものとの類似性を示す。しかしながら、異なる条件におけるサイトカインストームを引き起こし、調節する特定のメカニズムは、まだ決定されていない。
マイクロRNAは、IL1β、IL-6,およびTNF-αのような肺への免疫細胞の大規模なリクルートに関与する主要な炎症性サイトカインを含む、遺伝子発現の重要な調節因子である。近年、栄養補助食品は、様々な炎症性疾患におけるサイトカインの調節に関与するmiRの発現を調節し得ることが示されている。
ここでは、COVID-19に関連したサイトカインストームにおける炎症性調節性miRsの潜在的な役割を検討し、この状態における調節異常miRsを調節するための栄養補助的な治療アプローチが、重度の呼吸器疾患に利益をもたらす可能性を提案する。
キーワード
COVID-19,マイクロRNA、炎症、サイトカインストーム、栄養補助食品
はじめに COVID-19パンデミックと新規治療アプローチの必要性
2019年12月に中国の武漢で、ウイルス性肺炎の臨床症状を示す症例が続出したことから始まりました。この症状を呈し、その起源に言及していることから、この病気は当初、報道機関によって「武漢肺炎」と呼ばれてた。ゲノムの塩基配列を調べた結果、研究者らは新規コロナウイルスを発見し、世界保健機関(WHO)から 2019年の新規コロナウイルス(2019-nCoV)と一時的に命名された。これは、ヒトに感染するコロナウイルスファミリーの7番目のメンバーである。この新規感染症は 2020年2月12日に正式にコロナウイルス病2019(COVID-19)と命名された(Liu er al)。 COVID-19は急速に世界中に広がり 2020年3月11日、WHOは正式にパンデミックと認定した(WHO, COVID-19 reports/20200311-rep-51)。2020年8月5日現在、COVID-19の18,318,928例が確認されており、その中にはWHOに報告された695,043例の死亡例も含まれている。
重症例では、COVID-19による死亡は急性呼吸器疾患症候群(ARDS)に関連していることが判明している。そのため、国際ウイルス分類学委員会は、COVID-19をSevere Acute Respiratory Syndrome coronavirus 2(SARS-CoV-2)と呼んでいる。COVID-19に伴うARDSは、免疫エフェクター細胞による大量のプロ炎症性サイトカインおよびケモカインの全身放出に起因する、制御不能なサイトカインストームを伴う。免疫系は宿主を激しく攻撃し、死に至る可能性のある多臓器不全を引き起こす(Li et al 2020)。
これまでのところ、SARS-CoV-2感染症を治療するための特異的な治療法や抗ウイルスワクチンは存在しない。この病気の治療法を開発するために、世界中の研究者が集中的に動員され、このウイルス感染症の発症メカニズムを解明している。一方、罹患率や死亡率へのこのウイルスの影響を軽減するために、1つの可能性のある手段は、サイトカインストームを防ぐために炎症反応を軽減することである。1つの可能性は、栄養補助食品を使用することであろう。実際、栄養補助食品は、免疫系を増強し、コロナウイルスなどのカプセル化されたRNAを持つウイルスと戦うことが示されている(McCartyおよびDiNicolantonio 2020)。いくつかの栄養補助食品は、特定のマイクロRNA(miR)(Quintanilha et al 2017)の調節に作用して炎症性経路を抑制するのに有効である(Quintanilha et al 2017)mRNAを分解することによって、またはタンパク質へのRNA翻訳を阻害することによって遺伝子発現を調節することができる小さなノンコーディングRNAである。いくつかの研究により、miR発現の調節障害が炎症などの様々な生物学的プロセスを変化させることが示されている(He and Hannon, 2004; Lee and Dutta, 2009; Sonkoly and Pivarcsi, 2009; Quintanilha et al 2017)。さらに、miRsの制御異常は、敗血症、ARDS、急性肺感染症(ALI)および重症ウイルス性肺炎を含むサイトカインストームに関連し得る様々な疾患の発症および転帰に関与することが知られるようになった(Quintanilha et al 2017; Szilágyi et al 2019; McCartyおよびDiNicolantonio 2020)。しかしながら、COVID-19の重篤な形態の発症におけるmiRの役割、および炎症性miRを調節するための治療薬としての栄養補助食品の潜在的な使用については、まだ探索されていない。この記事では、COVID-19の重度の形態におけるサイトカインストームに関与する炎症性因子の変調におけるmiRの役割をレビューし、この文脈での代替治療アプローチとしてのニュートラシューティカルズの潜在的な効果を探る。
COVID-19の病態生理学的側面
サイトカインストームに関与するコロナウイルスと古典的プレーヤーの特徴
形態学的には、コロナウイルス(CoV)は、球状または多面体の粒子形状を持つ一本鎖RNAウイルスである。CoVは、その表面にスパイクタンパク質を含み、宿主細胞に付着して感染するのに必要なタンパク質である。CoVsは、同定された最大のRNAウイルスであり、そのゲノムは、約13,000〜16,000塩基のペアエンドを含む(Belouzard et al 2012; FehrおよびPerlman 2015)。メカニズム的には、陽性ウイルスRNA鎖はmRNAとして機能し、それ自身の複製転写酵素複合体およびその構造タンパク質の産生を可能にする。スパイク(S)エンベロープ(E)メンブレン(M)およびヌクレオカプシド(N)と呼ばれる4つの主要なウイルス構造タンパク質がCoVに見られる(McBride et al 2014)。CoVsの分類には、追加のウイルス付属タンパク質も重要である。つの主要なタイプ(α型またはβ型)に分けられた7つのCoVsメンバーは、感染効率、特異的な臨床症状、および疾患の重症度の点でバリエーションを持ってヒトに感染することができる(McBride et al 2014)。軽度の上気道感染症の重症度に関連するCoVsメンバーには、α-HCoV-229E、α-HCoV-NL63,α-HCoV-OC43,およびβ-HCoV-HKU1が含まれる。より重要なことに、下気道を標的とし、致命的な急性肺損傷(ALI)につながる可能性のある重篤な病原性急性呼吸窮迫症候群(ARDS)に関連するメンバーには、β-SARS-CoV、β-MERS-CoV、そして最後にCOVID-19としても知られるβ-2019-nCoVが含まれる(vand der Hoek et al 2004;Macbride et al 2014;Jan et al 2020;Wiersinga et al 2020)。
過去数年にわたり、サイトカインストームは、重症急性肺症候群に見られる共通のイベントの一つとして同定されてきたが、β-SARS-CoVおよびβ-MERS-CoV感染に続くARDS/ALIに関連する病原性および死亡率の重要な要素としても同定されてきた(Gao et al 2020; Tang er al)。 さらに最近では、このサイトカインストームは、重症型のCOVID-19感染症においても報告されている。CoV感染では、サイトカインストームは、感染の後期に観察され、感染した肺組織によるいくつかの炎症性プロサイトカインおよびケモカインの迅速かつ制御不能な放出によって特徴づけられ、制御緩和された過剰な免疫応答、臨界炎症性自己増幅環、肺損傷、およびより重症の場合には死亡に至る(Gao et al 2020;Tang et al 2020)。古典的には、β-SARS-CoVおよびβ-MERS-CoVで観察されるサイトカインストームには、いくつかの炎症性因子が一般的に関与している。これまでの研究は、感染の後期において、抗ウイルス因子インターフェロン(INF)の発現レベルが、末梢血、肺上皮細胞、樹状細胞、および常駐マクロファージにおいて低下することを示してきた(Vabret et al 2020)。これは、主要なプロ炎症性サイトカインIL-1β、IL-6およびTNF-α、ならびにケモカインCCL-2,-3および-5の産生の不均衡な増加と関連している(Mehta et al 2020; Vabret et al 2020; Ye et al 2020)。これらの因子は、感染した肺において、より多くの単球、マクロファージ、および好中球のリクルートを促進することにより、炎症性サークルの増幅をもたらし、これらの因子は、次に同じサイトカインおよびケモカインを産生することができ、過剰かつ持続的な炎症性組織損傷をもたらす。両側性肺炎およびARDSを有するCOVID-19患者の血清において、最近の研究では、IL-1β、IL-6,INF-y、IP-10,gm-脳脊髄液、TNF-α、およびMCP-1のより高い発現レベルが同定されている(JohnsonおよびLaloraya 2020;Mehta et al 2020;Ye et al 2020)。重要なことに、IL-6は、COVID-19サイトカインストームに関与する重要な主要因子として世界中の研究者によって同定されており、また、ARDSの病原性進行と高い相関性を有する(Grifoni et al 2020;Magro 2020;Zhang et al 2020)。さらに、他の研究では、血清サイトカインレベル、ALIの程度、および死亡率との間の相関関係が確立されている。これらの観察を合わせると、COVID-19の重症型で観察される肺外臓器不全は、末梢血中で再循環し、組織損傷を誘発するために遠くの臓器に到達することができるサイトカインのこれらの過剰レベルに少なくとも部分的に関連している可能性があることを示唆している。我々は次に、サイトカインストームを駆動するために最近同定された特定の重要な炎症性因子と免疫細胞を識別するために、COVID-19重症型の患者の異なる分析をコンパイルすることに焦点を当てました。
COVID-19重症患者で確認された最も一般的なサイトカイン
SARSおよびMERSなどの重篤な形態のCoVs感染症に関連するサイトカインストームは、肺組織における免疫細胞の大規模なリクルートおよび浸潤に起因する重篤な肺合併症を伴う複雑な病態を表す(Gao et al 2020;Yee et al 2020)。これは、上皮細胞および内皮細胞の死につながり、それにより、血管漏出およびALIを引き起こす。COVID-19感染の場合、特定のバイオマーカーおよびメカニズムが最近同定されている。例えば、軽度の形態の患者と比較して、重度の形態のCOVID-19を呈する患者において、プロ炎症性サイトカインTNF-α、IL-1β、およびIL-6の強いアップレギュレーションが見出された(Gao et al 2020;Tang et al 2020;Vabret et al 2020)。この観察は、これらの3つのサイトカインが、肺における免疫細胞浸潤の増加の鍵となるメディエーターとして作用することを示唆している。これらのサイトカインは、BおよびTリンパ球、単球およびマクロファージ、樹状細胞、ならびに線維芽細胞および内皮細胞などの非免疫細胞を含む様々な細胞型によって産生され得る(SokolおよびLuster 2015)。興味深いことに、IL-6産生はまた、主要な活性化剤として作用するTNF-αおよびIL-1によって誘導される(Confalone et al 2010)。Toll様受容体(TLR)プロスタグランジン、活性酸素および他のサイトカインを含む他のシグナル伝達経路もまた、IL-6の産生を誘発し得る(Turner et al 2014)。IL-2,IL-7,MCP-1,GM-脳脊髄液およびMIP-1aなどの他の炎症性因子は、重篤な形態のCOVID-19患者の末梢血中で増加していることが報告された(Lineswaran et al 2020)。これはまた、疾患の重症度と相関していた。これらの因子のすべては、肺における急性および持続的な炎症状態を増幅させることができる免疫細胞のリクルートと関連している。興味深いことに、他の研究では、COVID-19の重症型を有する患者において、CD4+およびCD8+細胞の劇的な減少を特徴とする重要なリンパ減少が観察されている(Tavakolpour et al 2020)。これは、リンパ球のリクルートを刺激することにより抗ウイルス性を有することが知られているIFN-γの循環レベルの低下としばしば関連していた。対照的に、高白血球数およびサイトカイン産生の増加もまた、COVID-19の重篤な形態の患者において文書化されている(Lineswaran et al 2020;Mehta et al 2020)。しかしながら、COVID-19の最も重篤な形態で死亡した患者では、肺浸潤において単球およびマクロファージが優勢な免疫細胞型であることが示されている(MeradおよびMartin 2020)。
microRNAである。遺伝子発現に大きな影響を与える小型RNA
マイクロRNA(miRまたはmiRNA)は、20〜22ヌクレオチドの小さなノンコーディング一本鎖RNAであり、60%以上の遺伝子の発現をネガティブに調節する(Cataranotto et al 2016)。それらは、標的mRNAを分解するか、またはその翻訳を阻害することによって作用する(Almeida et al 2011)。
それらの調節機能のために、それらは、発生、成長、代謝、生存、アポトーシス、組織修復、血管新生、および特に免疫応答および炎症プロセスを含む生物学的プロセスの大部分に関与している(Lee and Dutta, 2009; Sonkoly and Pivarcsi, 2009; Almeida et al 2011; Caporali and Emanueli, 2012)。
過去10年の間に、ゲノミクスとバイオインフォマティクス技術の進歩は、miRの作用機序の理解に革命をもたらした。特に、遺伝子発現の調節因子としてのそれらの役割は、多くの研究の対象となっている(Giza et al 2014)。歴史的には、最初のmiRは、1993年にAmbrosグループによって発見され、彼は、線虫のモデルにおいてmiR lin-4を同定した(Lee et al 1993; Almeida et al 2011)。
しかし、特定のmiRの生理的・病理学的な発現プロファイルや機能が調べられたのは、それから 10年後のことであった。2010年には、哺乳類では約2,200のmiRが、ヒトでは1,000以上のmiRが同定された(Ardekani and Naeini, 2010)。しかし 2015年以降、新しいmiRの同定は常に進化しているようで、現在までにヒトでは約2,500個のmiRが同定されている(Friedländer et al 2014)。重要なことは、miR発現のエピジェネティックな調節が、ウイルス感染後の免疫応答を含む複数の病理学的プロセスにおいて重要な役割を果たしていることが、現在では受け入れられていることである。
miRの生合成と作用機序
miRは、そのゲノム上の位置により、一般的に遺伝子間またはイントロニックと呼ばれている(図1)。遺伝子間miRは独立した転写ユニット(TU)によって転写される。イントロニックmiRの場合は、一般的にタンパク質をコードする宿主遺伝子と同時に転写される(Ramalingam er al)。 miRは単独でも、近くにある他のmiRと同時に転写されることもある。カノニカル経路によるmiRの自律的な生合成は、RNAポリメラーゼ2によって媒介された可変サイズでステムループ構造を持つ長い一次転写産物(pri-miR)の転写から始まる。pri-miRはその後、rnase複合体(Drosha/DGCR8)によって核内で切断され、70ヌクレオチドの長さの前駆体miR(pre-miR)が生成される。この前駆体miRは、exportin-5によって核内から細胞質に輸出され、酵素的なプロセスを経て細胞質に運ばれる。この第二の切断は酵素ダイサーによって媒介され、ステムループを除去し、22ヌクレオチドの成熟したmiR二重鎖(二重鎖)を生成することを可能にする。5′ストランドはガイドストランドと呼ばれ、3′ストランドはパッセンジャーストランドと呼ばれている。その後、2本の鎖のうちの1本は、Argonautファミリーからのタンパク質(Ago2)の助けを借りて、RISKエフェクター複合体(RNA-induced silencing complex)に取り込まれる。Ago2はまた、miRの標的mRNAへの結合を促進し、その後の抑制につながる。 miRは、「シード配列」と呼ばれるmiRの5′-UTR領域上に位置する8塩基の特定の配列を用いて、3′UTR領域上の標的mRNAを認識して結合する(図1)。標的mRNAの抑制のメカニズムは完全には定義されていない。一般に、miR/RNAのペアリングが完全に相補的であれば、標的mRNAは分解されると考えられている。不完全なペアリングの場合には、様々なメカニズムによって翻訳が阻害される。いずれの場合も、標的遺伝子の発現はダウンレギュレートされる。 miRは一般に約100個の標的(mRNA)を有する(Friedman et al 2009; Friedländer et al 2014; Giza et al 2014; Ramalingam et al 2014)。成熟したmiRおよびプレmiRは、細胞内に局在するか、またはそれによって循環中に遊離形態で分泌されるか、またはマイクロベシクル(エキソソソーム、アポトーシス体、マイクロパーティクル)中に隔離され得る。
図1 miRNAの生合成の模式図、染色体局在名とmiRNA/ターゲット種子の配列
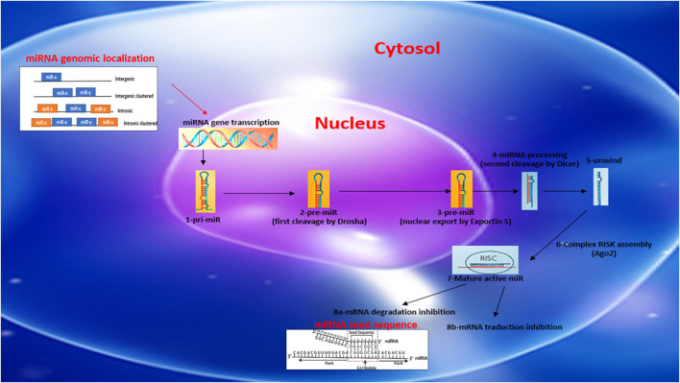
炎症性疾患とCOVID-19サイトカインストームに関連するmiRの潜在的な役割
感染または傷害に応答して、炎症は、自然免疫系および適応免疫系の両方に関与する生物学的および病態生理学的カスケードの結果である。このプロセスの変化は、異常な、過剰な、持続的な炎症をもたらし、それは組織傷害をもたらし、最も重篤な場合には組織破壊をもたらす(Chen et al 2018)。分子レベルおよび炎症プロセスの初期段階では、免疫細胞のリクルートは、サイトカインおよびケモカインのようなプロおよび抗炎症因子のよく知られた複雑なネットワークによって細かく制御される(Cicchese er al)。 しかしながら、炎症性組織への免疫細胞のリクルートに関連するサイトカインおよびケモカインの発現レベルの調節に関与する転写後機構は、ほとんど知られていない。注目すべきことに、COVID-19サイトカインストームにおけるmiRの役割は、まだ探索されていない。前述のように、個々のmiRは何百もの異なる標的に同時に作用することができる。したがって、1つのmiRは、同時にいくつかの炎症性シグナル伝達経路の調節を微調整し得る(SonkoryおよびPivarchi 2009)。これまでの出版物では、組織、流体および細胞型における炎症中のmiRの発現プロファイルの変化が報告されている(Mi et al 2013)。しかしながら、これまでのところ、COVID-19の重篤な形態を呈する患者におけるmiRのプロファイリングを報告した研究はない。したがって、以下の段落では、敗血症、ARDS、ALI、およびインフルエンザウイルスによって誘導される重症肺炎のような強い炎症反応の間のmiR調節の例を記載した臨床または前臨床研究に焦点を当てる。
表1に示すように、ヒトおよび急性炎症・感染症の動物モデルにおいて、様々な疾患や炎症状態において発現が有意に変化することが報告されているmiRをまとめた(表1)。例えば、重症敗血症患者の血清中では、4つの臨床研究の結果を合わせると、5つのmiRが強くアップレギュレーションされているのに対し(miR-486,-182,-15b、-223,-483)miR-146を含む12のmiRがダウンレギュレーションされていることが示されている(Vasilescu er al 2009;Wang et al 2010;Wang et al 2012;Tudor et al 2014)は、IL1,TNF-α、IRAK1,TRAF6およびNF-κBなどのいくつかのプロ炎症性メディエーターの発現および活性を低下させることがよく知られている抗炎症性miR-146である(Saba et al 2014)。さらに、いくつかのmiRは、ARDSおよびALIの動物モデルにおける重度の肺炎症の2つの前臨床研究において、変調されていることが見出されている(10個のアップレギュレートおよび7個のダウンレギュレート)この2つの条件は、重度の形態のCOVID-19を有する患者において見出された肺病理に類似している(Huang er al)。
興味深いことに、miR-127は、これらの条件において有意に増加していることが見出された。miR-127は、IL-6,TNF-α、IL-1βの誘導を介してマクロファージM1表現型を誘導し、抗炎症性サイトカインIL-10を減少させることによってマクロファージM1表現型を誘導するよく知られたプロ炎症性miRNAである(Ying et al 2015)。興味深いことに、サイトカインストームを媒介するCOVID-19のような状況であるインフルエンザウイルス誘発肺炎症の研究において、いくつかのmiRの細胞内発現が、インフルエンザに感染した肺細胞A549において変調され、組織内のmiRの局所発現の変化が、その後の局所炎症応答にも影響を与え得ることを示唆している(Li et al 2010; Huang et al 2014)。
炎症状態で増加するmiRのうち、炎症促進/血管新生促進の二重の機能を持つことで知られるLet-7ファミリーの2つのメンバー(Let-7fおよびLet-7a)は、インフルエンザウイルスによって誘導されることが報告されている(Wang and Olson, 2009; Teng er al)。 興味深いことに、miR発現の変化はまた、呼吸器同期ウイルス感染症(CRSVI)を有する小児(Inchley et al 2015)および重度の両側性肺炎を有する患者(Huang et al 2019)において文書化されており、これは、機械的換気を行うCOVID-19患者の死亡率に直接関連している(表1を参照)。
表1 炎症性疾患におけるmiRNA発現のモジュレーション(臨床研究および前臨床研究を含む)
| 炎症性疾患 | 人間またはモデル | アップレギュレートされたmiRNA | ダウンレギュレートされたmiRNA | 参考文献 |
|---|---|---|---|---|
| 敗血症(4つの臨床試験を含む) | 敗血症の人間の患者 | miR-486,miR-182,miR-15b、miR-223,miR-483-5p | miR-150,miR-342-5p、miR-223,miR-146b、miR-223,miR-146a、miR-122,miR-193b、miR-499-5p、miR-23a、miR-26a、miR- 342 | Vasilescu etal。(2009) ; 王ら。(2010) ; 王ら。(2012) ; チューダー等。(2014) |
| 急性呼吸窮迫症候群(ARDS)および急性肺損傷(ALI)(2匹の動物実験) | ARDSおよびALIのラットモデル | miR-181,miR-92a、miR-424miR-344,miR-346,miR-99a、miR-127,miR-128b、miR-135b、およびmiR-30a / b | miR-24,miR-26a、miR-126,およびLet-7a、b、c、f | 王ら。(2010) ; Zhu etal。(2017) |
| インフルエンザウイルスに関連する肺の炎症 | インフルエンザに感染したマウスの肺とヒトのA549肺細胞 | let7a、let7f、miR-145,miR-21,miR-223,miR-101,miR-193,miR-23b、miR-30e | miR-29,miR-200,miR-193,miR-27,miR-29,miR-30 | Li etal。(2010) ; 黄ら。(2014) |
| 小児呼吸器合胞体ウイルス感染症(CRSVI) | CRSVIのヒト患者 | miR-155,miR-31,miR-203a、miR-16およびlet-7days | miR-34b、miR-34c、miR-125b、miR-29c、mir125a、miR-429,miR-27b | Inchley etal。(2015) |
| 重度の肺炎 | 重度の肺炎の人間の患者 | miR-450a-5p-miR-103a-3pおよびmiR-103b-5p-miR-98-5p | 該当なし | 黄ら。(2019) |
炎症の調節におけるmiRの重要性を説明するために、主要な炎症性メディエーターの発現に影響を与えることが知られている機能を持つmiRをまとめた。例えば、miR-125は、Meg-01およびK562細胞における骨髄異形成症候群に関連するTLR/NF-κB活性を減少させることにより抗炎症性を有することが知られているが、クローン病患者の血漿中のCRP、IL-17およびTNF-αレベルにも負の相関がある(Gañán-Gómez er al 2014; Sun er al 2017)miR-125aはTLR刺激時にNF-κB阻害剤として作用する可能性があり、したがって、その効果はTLR経路の状態に依存する可能性がある。また、敗血症で強く減少するmiR-146は、NF-κB活性をネガティブに調節し、IRAK-1およびTRAF6を直接標的とすることで抗炎症性を示すことがよく知られている(Taganov et al 2006)。 miR-146は、喘息時のヒト気管支上皮細胞においても抗炎症機能を果たしている(Lambert et al 2018)。
これらの知見をまとめると、miR-146bがIRAK-1およびTRAF6シグナル伝達を抑制し、炎症を制限するためのフィードバック機構として特定の炎症状態で誘導され得ることが示唆される。ARDS中の肺胞マクロファージにおいて、miR-199は、TNF-α、IL1βおよびIL-6などの主要な炎症性サイトカインの誘導および放出に寄与するそのプロ炎症作用で知られている(Li et al 2018)。前述のように、IL-6は、COVID-19の重篤な形態と正に相関する重要な因子として同定されている。antagomir199によるmiR-199aの発現の減少は、TNF-α、IL1βおよびIL-6の発現の減少を介して、ARDS中のマウス肺胞マクロファージにおいて保護的役割を果たすことが以前に示されている。さらに、miR-124およびmiR-223のような他のmiRは、LPSで刺激されたマクロファージにおいて抗炎症特性を有しており、miR-124はSTAT3およびTACE経路を介してTNF-αおよびIL-6を減少させ(Sun et al 2013)一方、miR-223はTLR阻害を介してIL-6およびIL1βを減少させる(Chen et al 2012)。
要約すると、本節では、プロおよび抗炎症特性を有するいくつかのmiRが、炎症状態において、全身(血漿/血清)および肺組織および細胞の局所的な両方で変化することを実証する。では、栄養補助食品を使用して炎症性miRを調節することの潜在的な治療上の影響を文書化する。
表2 サイトカイン/ケモカイン産生および免疫細胞のリクルートに関連する炎症過程を制御するmiRNAの例
| miRNAs ID | 関与する炎症過程 | モデル/疾患および組織または細胞株 | miR変調の全体的な潜在的影響 | 参考文献 |
|---|---|---|---|---|
| miR-125 | TLR /NF-κB活性を低下させることによる抗炎症特性は、CRPおよびCDAI、IL-17,TNF-α産生と負の相関がある | 骨髄異形成症候群/ Meg-01およびK562クローン病/ヒト血漿 | miR-125aは、TLR刺激時にNF-κB阻害剤として作用する可能性がある。これらの結果は、miR-125aがNF-κB活性の微調整に関与しており、その効果がTLR経路の状態に依存している可能性があることを示している。miR-125の発現低下はCRP et CDAI、IL-17のアップレギュレーションにつながる可能性がある。 、TNF-a産生 | Gañán-Gómezetal。(2014) ; Sun et al。、(2017) |
| miR-146a | IRAK-1およびTRAF6の肺の抗炎症効果を直接標的とすることによりNF-kB活性を負に調節することによる抗炎症特性 | ヒト急性単球性白血病細胞株THP-1喘息/ヒト気管支上皮細胞 | miR-146aはIRAK-1およびTRAF6シグナル伝達を抑制する。miR-146aは、炎症を制限するフィードバックメカニズムとして炎症状態で誘発される可能性がある | タガノフ他 (2006) ; ランバート等。(2018) |
| miR-142,-101,-29a、-29c、および-141-3p | 炎症誘発性効果; これらのmiRは敗血症でアップレギュレートされ、血中のIL-6およびTNF-αレベルと正の相関がある | 敗血症/血清によるまだ病気 | IL-6およびTNF-αインデューサーの負の調節因子を標的とすることにより潜在的に作用する可能性がある | Hu etal。(2018) |
| miR-127 | マクロファージM1対M2の極性化を調節する炎症誘発性効果(miR-127発現はM1表現型を活性化する) | LPSによって誘発されたマウス肺炎症損傷モデル | miR-127は、IL-6,TNF-α、IL-1βの発現を誘導し、抗炎症性サイトカインIL-10を減少させることにより、M1表現型を活性化する。 | Ying etal。(2015) |
| miR-124 miR-223 | 抗炎症作用 | LPSで刺激されたマウスマクロファージ | miR-124はSTAT3et TACE経路を介してTNF-αとIL-6を減少させるmiR-223はTLR阻害を介してIL-6とIL1βを減少させる | Chen etal。(2012) ; Sun etal。(2013) |
| miR-199 | 炎症誘発性作用 | ARDS /マウス肺胞マクロファージ | antagomir199によるmiR-199aの発現低下は、TNF-α、IL1β、IL-6の発現低下を通じて、マウス肺胞マクロファージARDSにおいて保護的な役割を果たす。 | Liu etal。(2018) |
炎症を調節するmiRの発現を調節する栄養補助食品
“栄養補助食品 “は、食品源、ハーブ製品または栄養補助食品に由来する任意の天然化合物を説明するために使用される広義の用語である。この用語は、「栄養剤」(食品成分)と「医薬品」(医療用医薬品)という言葉を組み合わせたもので、1989年にスティーブン・デフェリーチェ博士によって考案された(Kalra, 2003)。基本的な栄養価に加えて、栄養補助剤は、生理的利益を発揮したり、様々な疾患に対する健康保護を提供したりすることが示されている。実際、最近、特定の栄養補助剤が免疫系を増強し、インフルエンザおよびコロナウイルスのようなカプセル化されたRNAを有するウイルスとの戦いを助ける可能性があることが報告された(McCartyおよびDiNicolantonio 2020)。いくつかの前臨床研究および臨床研究により、栄養補助食品が炎症性経路の抑制に特に有効であることが示されている(Moss and Ramji, 2016; Gupta et al 2018)。これらの天然化合物の作用機序として考えられるものの中には、多数のマイクロRNAの発現および活性を調節する能力がある。本項では、miRNA、特にCOVID-19関連サイトカインストームに関連する主要な炎症性因子を調節するものに対する特定の栄養補助剤の潜在的な効果を実証した研究を要約する(Quintanilha et al 2017;Sabino et al 2019)。
COVID-19-関連サイトカインストームの調節に関与するmiRのニュートラシューティカルターゲティング
レスベラトロール
レスベラトロール(trans-3,5,4′-トリヒドロキシスチルベン)(RSV)は、ポリフェノール化合物で、赤ブドウ、ベリー類、ピーナッツ、竹に含まれている。それは、ブドウの皮に最も豊富であり、主にブドウ由来の赤ワインの形で消費されている。いくつかの研究により、RSVは、抗炎症作用、抗酸化作用、抗発がん性、抗老化特性、および生体内試験および試験管内試験における心臓保護効果を有することが示されている(Bao et al 2012;McCubrey et al 2017;Alharris et al 2018)。
しかしながら、研究では、ヒトにおける有益な抗炎症効果に関連する正確な有効量を確立することは困難であり、それは、用量の大きな範囲(1日あたり150mg〜2.5g)を使用しているからである。食事からこの濃度を得ることの難しさを克服するために、レスベラトロールの濃縮抽出物が使用されてきた(Ramírez-Garza et al 2018)。例えば、150mlの赤ワイン1杯に含まれるレスベラトロールの量は0.015~2.15mgであるが、ブルーベリー、ラズベリー、クランベリーなどの小さな果物には0.6~2.4mgが含まれている(Chachay et al 2011)。食事中のRSVの推奨量は約12.5mg/kg体重である。これらの濃度は、動物実験からの大まかな外挿によって得られたものであり、そのほとんどは、特定の生物学的効果に到達するために5〜100mg/kg体重の1日投与量を必要としていた。
いくつかの専門家は、1日1gのレスベラトロールの投与量が、ヒトにおける多様な障害の治療に有効であると主張している。それは、従来の食品を消費することによってレスベラトロール/日の1グラムまで摂取することはできない。多くの企業によって提供されている代替品には、正確に定義されたレスベラトロール含有量を有する様々な(時には法外に高価な)栄養補助食品が含まれている(WeiskirchenおよびWeiskirchen 2016)。
RSVはまた、様々なウイルス性病原体に対して抗ウイルス特性を示すことが示されている。特に、125〜250μMの濃度のRSVは、試験管内試験でベロE6細胞における中東呼吸器症候群コロナウイルス(MERS-CoV)の複製を抑制することが示された(Lin et al 2017; Marinella 2020)。RSVは、高用量を動物に長期間投与した場合でも、生体内試験では副作用が観察されなかったため、有望な分子である可能性がある。RSVは、110を超える臨床試験で試験されたか、または現在試験されている(Latruffe et al 2015;McCubrey et al 2017;Marinella 2020)。
RSVのプリーオトロピック活性に関連する分子機構はまだほとんど不明であるが、いくつかの研究では、レスベラトロール媒介の抗炎症作用におけるmiRNAの潜在的な役割が調査されている(Alharris et al 2018)。リポ多糖類(LPS)刺激ヒトTHP-1マクロファージにおいて、以前の研究では、25〜200μMの濃度で使用されたRSVが(25μMに最大のピーク効果を持つ)miR-Let-7Aの発現を著しく増加させ(Song, et al 2016)プロ炎症性サイトカインTNF-αおよびIL-6の発現を減衰させることが明らかになった(表3を参照)。また、PC-12神経芽細胞におけるLPS誘発性炎症性傷害において、10~25μMの濃度のRSVはmiR-132のアップレギュレーションを介してIL1β、IL-6,TNF-αの発現を減少させることが報告されている。RSVのこの効果は、炎症反応を抑制することで細胞の生存性を改善し、アポトーシスを減少させる(Zhang et al 2019)。
miR-132とmiR-Let-7Aの両方が、炎症反応の変調、および細胞の生存/アポトーシスに重要であることが示されている。RSVは、変形性関節症の治療のための有望な経口サプリメントであることが報告された(Gu er al)。 ATDC5細胞のLPS誘発性炎症傷害において、IL-1β、IL-6およびTNF-αのレベルは、RSV(30μM)の処置によって有意に減少した。したがって、RSVはmiR-146bをアップレギュレーションすることによって作用すると考えられる(Jin er al)。 同様に、RSVは、miR-146a-5pのアップレギュレーションを介して、BV2マウスミクログリア細胞におけるTNF-α、IL1βおよびIL-6のLPS誘発性生成を有意に阻害した(Ge et al 2019)。細胞を、6時間のLPS処理の24時間前にRSV(3,10,および30μM)で処理した。 3μMの濃度でのRSVでの前処理は、LPSによって誘発されたサイトカインのアップレギュレーションには効果を示さなかった。しかし、RSV(10μMおよび30μM)の前処理は、LPSによるTNF-aのmRNAの増加をそれぞれ54.6および77.9%、IL-1bを38.9および65.9%、IL-6を21.7および43.6%、有意に減少させた。LPS曝露の24時間前に10μMおよび30μMのRSVで前処理すると、LPSで処理した細胞では抗炎症性のmiR-146a-5pのレベルが有意に増加した(10μMでは5.21倍、30μMでは8.41倍)。miR-146bとmiR-146a-5pは自然免疫応答の重要な制御因子である。異なるmiRNAの調節を通して、試験管内試験研究では、RSV(25-250μM)は、重度のCOVID-19に一般的に関与する3つの主要なサイトカインを標的とすることで抗炎症効果を媒介することが示唆されている。
表3 炎症性細胞のリクルートを減衰させる可能性のあるmiRのニュートラシューティカルズ関連のターゲティング
| 栄養補助食品 | miR変調 | 発現の調節 | 細胞/サンプル/組織 | 病理学/疾患/モデル | サイトカインストロームによって媒介される急性肺損傷に対する予測される潜在的影響 | 参考文献 |
|---|---|---|---|---|---|---|
| レスベラトロール | miR-let7a | アップレギュレート | THP-1細胞 | LPS刺激マクロファージ | TNF-αおよびIL-6の発現低下 | Song etal。(2016) |
| miR-132 | アップレギュレート | PC-12細胞 | PC-12神経芽細胞のLPS誘発性炎症性損傷 | IL-1β、IL-6,およびTNF-αの発現低下 | 張ら。(2019) | |
| miR-146b | アップレギュレート | マウス軟骨形成細胞株ATDC5 | ATDC5細胞のLPS誘発性炎症性損傷 | IL-1β、IL-6,およびTNF-αの発現低下 | ジンら (2018) | |
| miR-146a-5p | アップレギュレート | BV2マウスミクログリア細胞 | BV2細胞のLPS誘発性炎症性損傷 | TNF-α、IL-1β、およびIL-6のmRNAレベルの低下 | (Ge、Zhong et al。 2019) | |
| ケルセチン | miR-221 | ダウンレギュレートされた | WI-38肺線維芽細胞 | LPSによるWI-38肺線維芽細胞の炎症性損傷 | mRNAレベルの低下とTNF-αおよびIL-6の発現 | (Wang et al。 2019) |
| miR-369-3p | アップレギュレート | 骨髄由来樹状細胞(BMDC) | LPSで刺激されたBMDC | mRNAレベルの低下とTNF-αおよびIL-6の発現 | (Galleggiante et al。 2019) | |
| miR-124 | アップレギュレート | ヒト腎臓-2細胞 | HK-2細胞のLPS誘発性炎症性損傷 | TNF-αおよびIL-6の発現低下 | Guo etal。(2020) | |
| ビタミンD | miR-125b | ダウンレギュレートされた | THP-1細胞および固有層単核細胞(LPMC) | LPS刺激マクロファージおよびDSS誘発大腸炎マウス | TNF-αおよびIL-6の発現低下 | Zhu etal。(2019) |
| miR-155 | ダウンレギュレートされた | Raw264.7細胞と血清 | WTおよびmiR155KOマウスにおけるLPS処理マクロファージおよびLPS誘発敗血症マウス | TNF-αおよびIL-6の発現低下 | Chen etal。(2013) | |
| クルクミン | miR-155 | ダウンレギュレートされた | Raw264.7およびTHP-1セル; 肝臓と腎臓の組織 | LPS処理マクロファージマウスにおけるLPS誘発敗血症 | TNF-αおよびIL-6の発現低下 | Ma etal。(2017) |
| miR-199b-5p | アップレギュレート | BV2ミクログリア細胞 | LPS誘導BV2細胞 | TNF-αおよびIL-1βの発現低下 | Gao etal。(2019) | |
| 人参 | miR-132 | アップレギュレート | 肺線維芽細胞MRC-5細胞 | LPS誘発性のMRC-5細胞傷害 | IL-1β、IL-6,およびTNF-αの発現低下 | Cong etal。(2019) |
| miR-181a | アップレギュレート | WI-38肺線維芽細胞 | LPSによるWI-38肺線維芽細胞の炎症性損傷 | mRNAレベルの低下とIL-1β、TNF-α、IL-6の発現 | Qian etal。(2019) | |
| miR-26a | アップレギュレート | ヒト腎近位尿細管上皮細胞およびヒト腎臓-2細胞 | LPSで処理されたヒトRPTECおよびHK-2細胞 | mRNAレベルの低下とIL-1β、TNF-α、IL-6の発現 | Liu etal。(2019) | |
| 緑茶ポリフェノール | miR-9 | アップレギュレート | マウス軟骨細胞ATDC5細胞 | ATDC5細胞におけるLPS誘発性変形性関節症 | TNF-α、IL-6およびMCP-1の発現低下 | 張ら。(2019) |
ケルセチン
ケルセチン(3, 3′, 4′, 5, 7-ペンタヒドロキシフルバノン)はフラボノイド科に属する。リンゴ、ブドウ、タマネギ、アーティチョーク/フェンネル/セロリ、豆、アプリコット、プラム、スモモ、カブ、ピーマン、イチゴ、トマト、ブロッコリーを含む多くの果物や野菜におけるその高い豊富さ(4-79 mg/100 g)のために、ケルセチンは、食事を介して50-800 mgと推定される1日平均吸収量で、かなりの量を消費することができる(Boesch-Saadatmandi et al 2012; Li et al 2016; Kocic et al 2012; Li et al 2016; Kocic et al 2016,2012; Li et al 2016; Kocic et al 2019)
他の研究では、決定された食品において、最高濃度はケイパー(生)の可食部分234mg/100gであり、最低濃度は紅茶または緑茶(Camellia sinensis)の可食部分2mg/100gであり、推定吸収率は100mgのケルセチンを受ける健康な個体において3%から 17%であることが判明した。ケルセチンのバイオアベイラビリティが比較的低いのは、その吸収が低く、広範囲の代謝および/または迅速な排泄に起因すると考えられる(Li et al 2016)。
その薬理学的性質のうち、ケルセチンは、抗炎症作用、腫瘍細胞に対する抗増殖作用、および酸化ストレスに対する細胞保護作用を有する。レスベラトロールについては上述したように、ケルセチンのサプリメントの有効量は、動物試験およびヒト試験で大きく変動する。例えば、ラットの関節炎モデルでは、1日80mg/kgの用量で急性および慢性炎症相の両方を抑制した(Guardia et al 2001)。
ヒトでは、12 週間の臨床試験において、ケルセチンを 1,000 mg/日の用量で摂取すると、中高年の被験者の上気道感染率が低下することを特徴とする抗炎症作用を示した(Heinz er al)。 また、ケルセチン500mgの摂取は、心血管疾患の危険因子である2型糖尿病の女性において、TNF-αやIL-6などの炎症性マーカーを有意に減少させた(Zahedi et al 2013)。
試験管内試験では、IL-1およびTNFa発現を阻害するためのケルセチンの有効な抗炎症濃度は、N9ミクログリア細胞において10~100μMである(Bureau et al 2008)。それは、潜在的に自然免疫を増強し、多くの慢性疾患の予防に貢献することができる(Galleggiante et al 2019)。
いくつかの研究では、炎症の文脈でのケルセチンによるmiRNAの変調を調査している。別の研究グループ(Wang et al 2019)は、LPS誘発炎症性損傷の設定でのケルセチンによるmiRNA-221のダウンレギュレーションが、WI-38肺線維芽細胞におけるIL-6およびTNF-αのmRNAおよびタンパク質発現レベルの低下をもたらすことを示した。
miR-221は、NF-κBおよびc-Jun N末端キナーゼ(JNK)などの炎症に関連する因子を活性化することが知られている(Zhao et al 2016; Qian et al 2017)。別の研究では、LPS刺激骨髄由来樹状細胞(BMDC)をケルセチンで処理すると、miR-369-3p発現レベルが有意に上昇することが明らかになった。
miR-369-3pのこのアップレギュレーションは、TNF-αおよびIL-6のmRNAおよびタンパク質レベルの低下をもたらす(Galleggiante et al 2019)。
最近の研究はまた、ヒト腎臓-2細胞(HK-2細胞)のLPS誘発性炎症性傷害においてmiR-124をアップレギュレーションすることにより、ケルセチンがIL-6およびTNF-αの生成を減少させ得ることを示した(Guo er al)。
ビタミンD
脂溶性ビタミンであるビタミンDは、2つの形態で存在している。植物由来のD2と、コレステロールの前駆体である7-デヒドロキシコレステロールが紫外線を浴びると皮膚で主に合成されるD3である。ビタミンDの食事源としては、タラ肝油(210μg/100g)やサケ(5-13μg/100g)などの油っこい魚、キノコ類(13-30μg/100g)乳製品などのビタミンD強化食品が挙げられる(O’Mahony et al 2011)。ビタミンD欠乏症の判定にどの程度のカットオフ値を用いるべきかについては、文献では多くの議論がある。しかし、最近の研究では、欠乏を示すこのレベル以下の値で、適切なレベルとして75 nmol/L以上の血清濃度を示唆している(O’Mahony et al 2011)。ビタミンD3または経口ビタミンDは、最初に肝臓で25(OH)Dに変換され、その後、腎臓や場合によっては他の臓器や免疫系の細胞で活性型の1,25-ジヒドロキシビタミンD(1,25(OH)2D3)(カルシトリオール)に変換される。実際、これらの細胞において、1,25(OH)2D3は、炎症性応答の制御において重要な役割を果たす(Carvalho et al 2017; Grant et al 2020; Zabetakis et al 2020)。
ヒトにおいて抗炎症効果を発揮するビタミンD補充の正確な用量は、まだ決定されていなかった。以前の研究では、1日あたり500~5,000IUのビタミンD3の摂取は、患者の歯肉炎に対して用量に依存した抗炎症効果を発揮することが示されている(Hiremath et al 2013)。7つの臨床研究を組み合わせたメタアナリシスでは、患者におけるビタミンDの補給は、対照群と比較してTNFaの形質濃度の低下をもたらすと結論づけられた(n = 380; p = 0.04)。しかし、C反応性蛋白質、IL-10またはIL-6のレベルには影響は認められなかった。これらの知見は、ビタミンD補給が炎症性マーカーに対して特異的ではあるが控えめな効果を有する可能性を示唆している(Rodriguez et al 2018)。最近の動物および試験管内試験研究では、miRNA上での変調を介したビタミンDの抗炎症効果が調査されている。
Zhu Xらは、LPS刺激されたTHP-1細胞、およびDSS誘発大腸炎マウスから分離されたlamina propria mononuclear cells (LPMCs)において、1,25(OH)2D3によるmiR-125b発現のダウンレギュレーションが、M1マクロファージのM2抗炎症サブタイプへの分極を誘導することを観察した。その結果、TNF-αおよびIL-6発現が減少する(Curtale et al 2019)。
別の研究では、1,25(OH)2D3補充(200 ng/kg/日、1週間)が、LPSで処理したマウスマクロファージRAW264.7においてmiR-155,TNF-αおよびIL-6をダウンレギュレートすることが生体内試験で示され(Chen et al 2013)、その効果の特異性は、腹腔内LPSチャレンジ後の野生型マウスとmiR-155ヌル(KO)マウスとを比較することによって検証された。呼吸器感染症はプロ炎症性サイトカインやケモカインの産生を増加させるため、1,25(OH)2D3はCOVID-19のような急性(重症)ウイルス性呼吸窮迫症候群への感受性を減衰させるのに関与している可能性がある。
クルクミン
クルクミン[1,7-ビス(4-ヒドロキシ-3-メトキシフェニル)-1,6-ヘプタジエン-3,5-ジオン]は、植物Curcuma longaの根茎から抽出された天然のポリフェノールである。ウコンの生理活性成分であり、生姜など他の植物にも含まれている。クルクミンは一般的にスパイスとして使用され、カレーの黄色の色素沈着のために責任がある(バオ et al 2012; Hewlingsとカルマン 2017; McCubrey et al 2017)。この生理活性食餌性化合物は、ウイルス感染および癌を含む様々な疾患、特に炎症および相互に関連する酸化ストレス(Quintanilha et al 2017; Zahedipour et al 2020)に対する有益な潜在的な保護効果を発揮する。動物実験では、クルクミンは急速に代謝され、肝臓で共役化され、糞便中に排泄されるため、有益な抗炎症効果に到達するためには高用量が必要であることを示唆する限られた全身的なバイオアベイラビリティを有することが示されている。例えば、40mg/kgのクルクミンをラットに静脈内投与した場合、1時間後に血漿中のクリアランスが完全に得られた。500 mg/kgをラットに経口投与した場合、血漿中のピーク濃度はわずか1.8 ng/mlであり、主な代謝物はクルクミン硫酸塩とクルクミングルクロニドであることが確認された。ヒトでの臨床研究(主に癌患者を対象とした)で使用される用量は、1日0.5~10gを経口投与することで変化する(Jurenka, 2009)。ここでは、炎症反応に対するクルクミンの調節効果とmiRNAとの間の関連を記述した研究をレビューする。
Maらは、クルクミンがmiR-155を介して用量依存性(5-15μM)の抗炎症効果を発揮し、LPS刺激マウスマクロファージRAW264.7およびヒト単球THP-1マクロファージ細胞においてTNF-αおよびIL-6の分泌を減少させることを試験管内試験で示した。これらの著者らは、生体内でのLPS誘発敗血症のマウスモデルにおいて、LPS腹腔内注射の3日前に20mg/kgのクルクミンを投与すると、miR-155を標的としてサイトカインであるTNFaおよびIL-6を阻害することにより、肝臓および腎臓の炎症反応が抑制されることを見出した(Ma et al 2017)。 miR-155は、免疫機能の重要な調節因子であり、炎症関連疾患の発症に関与する因子として浮上している(Testa et al 2017)。
試験管内試験では、クルクミン(2〜8μM)は、miR-199b-5pのレベルを増加させることにより、LPSで処理したBV2ミクログリア細胞におけるTNF-αおよびIL1βの発現を減少させることが最近発見された(Gao et al 2019)。miR-199b-5pは、よく知られた腫瘍抑制因子であるが、最近、敗血症および敗血症性ショックの潜在的なバイオマーカーとしても提案された(Reithmair et al 2017)。したがって、クルクミンは、いくつかのプロ炎症性サイトカイン、特にサイトカインストームに関与するサイトカインを強力に阻害することが示されているので、その抗ウイルス活性を考慮すると、この栄養補助化合物は、重度のコロナウイルス感染症の管理のための有望な候補である可能性がある。
高麗人参
高麗人参は、古くから健康補助食品や伝統的な漢方薬として利用されていた。東アジアや北米で栽培されているウコギ科パナックス属の多年草13種のうちの一つであるパナックス高麗人参の根から抽出される。高麗人参の薬理・薬効に関する研究では、高麗人参の主な生理活性化合物であるジンセノサイドに注目している。ジンセノサイドはステロイド様サポニンであり、多数の種類のジンセノサイドが、癌、糖尿病、神経疾患、心血管疾患、炎症性疾患などの多くのヒトの疾患に生理的効果を有することが報告されている(Paik et al 2019;Yu et al 2019)。現在までに、150以上のジンセノサイドが高麗人参から単離されており、そのうちの40のジンセノサイドは、非常に低い量および可変量でパナックス高麗人参から発見されており、したがって、効果的な投与量に到達するためには、治療研究において濃縮される必要がある(Liu et al 2019)。
ラット、イヌまたはヒト血漿中の選択されたジンセノサイドの薬物動態学的研究では、10-300 mg/kgの用量で異なるジンセノサイドを補充すると、化合物およびモデルによって異なる生理活性(1-64%)が得られることが示されており、これらの結果をヒトに外挿することの複雑さが強調されている(Lü et al 2009)。朝鮮紅参(KRG)が雄性Wistarラットにおける慢性非細菌性前立腺炎(CNP)の発症を抑制する役割を果たすかどうかを調査する研究では,0.25および0.5mg/kgの用量で皮下注射したKRGは、IL-6,IL-1,TNF-αおよびCOX2などの主要な炎症性サイトカインの発現を有意に減少させた(Tabolacci et al 2019)。試験管内試験での研究では、BV2ミクログリア細胞および腹側中脳一次ミクログリア培養におけるLPS誘発ミクログリア活性化に対するジンセノサイドRg1の抗炎症効果を評価し、10μMの濃度のRg1は、TNFa、IL-1b、iNOS、COX-2 mRNAおよびタンパク質レベルのLPS誘発アップレギュレーションを減衰させることができると結論づけた(Gao et al 2019)。
最近、様々なジンセノサイドがmiRNAを直接修飾し得ることが報告されており、高麗人参がその抗炎症機能を発揮し得る代替経路を提供している(Dong et al 2019)。2019)。 miRNA-132は、LPSで処理した肺線維芽細胞MRC-5を含む細胞傷害のモデルにおいて、Panax notoginseng(Burk.)の根から抽出された主要な活性成分であるノトギンセノサイドR1(NGR1)によってアップレギュレートされる(Cong et al 2019)。 miRNA-132のアップレギュレートは、炎症性サイトカインIL1β、IL-6およびTNF-αの発現の減少をもたらす(Salvi et al 2019)。
同様に、NGR1はまた、LPS誘発性炎症性損傷WI-38肺線維芽細胞においてmiR-181aをアップレギュレートし、IL1β、IL-6およびTNF-αのmRNAおよびタンパク質発現の減少を導くことが見出された(Qian et al 2019)。プロ炎症性調節性miR26aはまた、LPSで処理したヒト腎臓-2細胞(HK-2細胞)およびヒト腎臓近位管上皮細胞(RPTECs)におけるNGR1への応答で増大することが見出された;これは、IL1β、IL-6およびTNF-αの放出の減少をもたらした(Liu et al 2019)。
緑茶ポリフェノール及びその他の化合物
緑茶は、葉と植物椿 sinensis の芽から抽出される。その多くの健康上の利点のため、緑茶は、世界的に最も広く消費される飲料の一つである。緑茶ポリフェノール(GTP)は、緑茶の活性化合物であり、彼らはまた、一般的にカテキンとして知られている。主なものは、エピガロカテキンガレート(EGCG)エピカテキンガレート、エピカテキンおよびフラバノールであり、抗酸化作用、抗炎症作用、抗血管新生作用、抗糖尿病作用および抗がん作用を含む緑茶の生物学的活性の多くを担っている(Otton et al 2018;Torres et al 2019;Yan et al 2020)。
淹れた緑茶の250mlのカップは、約25〜60mgのEGCGを提供する(カテキンの約50〜60%はEGCG)。試験管内試験では、LPSで処理したヒト歯肉上皮ケラチノサイト(HGEK)における研究は、緑茶抽出物(2.5,5,および10mg/ml)がIL-β1,IL-6,およびTNF-α遺伝子発現を10倍以上減少させることを示した(Hagiu et al 2020)。酢酸誘発性大腸炎を有するラットにおける別の研究では、EGCG(50mg/kg/日、7日間)が、TNFa、IFN-γおよびNF-κBp65の産生を阻害することによって抗炎症活性を発揮することが実証された(Ran et al 2008)。重要なことに、Zhang Qらは、GTPが炎症の制御に関与するmiRNAの発現を直接調節できることを示している。彼らは、マウス軟骨細胞ATDC5細胞におけるLPS誘発性炎症のモデルにおいて、GTPがmiRNA-9を増加させ、プロ炎症性サイトカインおよびケモカインを抑制することを観察した(Zhang et al 2019)。したがって、重度のCOVID-19感染症におけるGTPの有効性を推測したくなるであろう。
ラクトフェリン
他のいくつかの栄養補助化合物もまた、COVID-19の文脈で炎症を調節するのに役立つ可能性がある。例えば、COVID-19の原因となる新型の重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と密接に関連している重症急性呼吸器症候群コロナウイルス(SARS-CoV-2)を含むいくつかのウイルスにおいて、ラクトフェリン(非毒性の多糖タンパク質)の潜在的な治療効果が研究されている。実際、ラクトフェリンは、感染症に対する宿主応答を積極的に修飾しうる、いくつかの興味深い免疫調節性および抗炎症性の特性を示す。しかしながら、特に重度の炎症性疾患の文脈において、miRの発現に対するラクトフェリンの調節効果を特異的に定義するために、追加の研究が必要である(Chang et al 2020)。
結論
ARDSは、MERS、SARS-CoV-1,SARS-CoV-2(COVID-19)などの重症コロナウイルス感染症に伴う死亡の主な原因であり、現在までに薬理学的治療法はない。ARDSの管理は、さまざまな人工呼吸法を用いた大部分の支持療法が残っている。呼吸不全の急速に進行する性質は、気管支肺胞液中に検出されるIL1β、IL-6,IL8,TNF-αを含むサイトカインストームに対応する(Butt et al 2016; Felsenstein et al 2020; Schett et al 2020)。同調して、IL-6プロモーター変異体は、ARDSの重症度の低下と関連している(Martin-Loeches et al 2012)同様に、IL-1受容体アンタゴニストヌルマウスは、ARDSにおける肺炎症の解決が遅延している(Hudock et al 2012)。
承認された抗IL-1およびIL-6を用いた患者の治療の試みは、現在利用可能な抗IL-1および抗IL-6(それぞれ、キネレおよびトシリズマブ(Felsenstein et al 2020;Zhang et al 2020))を用いた免疫抑制の結果としてのリスクが懸念されているにもかかわらず、ARDSにおいてある程度成功している(Shakoory et al 2016;Toniati et al 2020)。多数の(潜在的に有害な)プロ炎症性サイトカインの同時ダウンレギュレーションは、COVID-19のARDSを治療するためのより良い解決策にそれ自体を貸す。
したがって、miRsの安全なモジュレーターは、この目的のために十分に適しているであろう。この文脈では、本レビューで紹介したもの(RSV、ケルセチン、ビタミンD、クルクミン、高麗人参、GTP)のような栄養補助食品(個別にまたは組み合わせて投与)は、主要なmiRに影響を与えることで抗炎症特性を発揮し、COVID-19などに関連するARDSの重症度を効果的に減衰させ、転帰を改善するための単一標的治療薬の最も適切な代替品であるかもしれない。
