Contents
Novel Therapeutics for Epstein–Barr Virus
www.ncbi.nlm.nih.gov/pmc/articles/PMC6429425/
要旨
エプスタインバーウイルス(EBV)は、成人人口の95%まで感染するヒトγヘルペスウイルスである。EBVの初感染は通常小児期に起こり、一般的には無症状であるが、その後に感染すると35~50%の症例で感染性単核球症を引き起こす可能性がある。
EBVは主にB細胞と上皮細胞に感染し、安静時記憶B細胞で潜伏を確立し、場合によっては上皮細胞でも潜伏を確立する。EBVは発がん性ウイルスとして認識されているが、免疫不全宿主では、免疫応答によってEBVの再活性化が制御され、生体内での形質転換が阻止される。
免疫抑制下では、原因にかかわらず、免疫系はEBV複製の制御を失う可能性があり、その結果、新生物が出現する可能性がある。EBVに関連する主要な悪性腫瘍は、B細胞リンパ腫および鼻咽頭癌であり、これは生体内でのウイルス感染の主要な細胞標的を反映している。
多くの抗ウイルス薬が試験管内試験でEBVの複製を阻害することが証明されているが、臨床での成功は限られており、現在までにEBV感染症の治療薬として承認されている抗ウイルス薬はない。
本稿では、EBV感染症の治療薬として臨床で評価されている抗ウイルス薬をレビューし、現在研究中の抗EBV活性を有する新規分子やEBV関連疾患の新たな治療戦略について考察する。
キーワード
エプスタインバーウイルス、抗ウイルス薬、ヌクレオシドアナログ、ヌクレオチドアナログ、細胞標的
1. はじめに
ヒトγ-ヘルペスウイルス・エプスタイン-バーウイルス(EBVまたはヒトヘルペスウイルス4,HHV-4)は、最も一般的に感染するヘルペスウイルスの一つであり、成人のヒト人口の95%まで感染している。EBVの一次感染は一般に小児期に起こり、通常は無症状である。しかし、思春期や成人初期にEBVに感染すると、35~50%の症例で感染性単核球症を発症することがある。感染性単核症の症状(疲労、発熱、喉の炎症、首のリンパ節の腫脹、脾臓の肥大、肝臓の腫脹、発疹)は典型的には1~2ヶ月で治まるが、感染性単核症が消失した後の青年期の慢性疲労症状の発生率は、6ヶ月、12ヶ月、24ヶ月でそれぞれ13%、7%、4%である[1]。
EBVは他のヘルペスウイルスと同様に、一次感染後に生涯潜伏を確立する。EBVの感染は免疫系によって制御されているため、生涯にわたってEBVを保有している人のほとんどはウイルス感染に悩まされることはない。しかし、EBVはまた、免疫抑制下(先天的なもの、HIV感染症の文脈でのもの、または移植や自己免疫疾患での免疫調節薬の使用に関連したもの)で、重篤な急性疾患やリンパ系および上皮細胞由来の様々な生命を脅かす悪性腫瘍を引き起こす可能性がある。EBVは、バーキットリンパ腫やその他の非ホジキンリンパ腫、ホジキンリンパ腫、中枢神経系リンパ腫、移植後リンパ増殖性障害(PTLD)エイズ関連リンパ腫、ナチュラルキラー(NK)リンパ腫、T細胞リンパ腫などのB細胞悪性腫瘍の発生と関連している[2,3](表1)。また、角化していない上咽頭がんの100%に見られ、散発的に消化管がんと関連している [4,5]。
表1 免疫不全宿主および免疫不全宿主におけるエプスタインバー(EBV)関連リンパ腫
| 免疫担当ホスト | 免疫不全の宿主 | ||||
|---|---|---|---|---|---|
| リンパ腫 | EBV協会 | レイテンシープログラム | リンパ腫 | EBV協会 | レイテンシープログラム |
| BL(風土病) | 100% | IまたはWp-制限付き | PTLD、B細胞 | > 90% | III |
| BL(散発的) | 15〜85% | 私 | BL(HIV) | 25〜35% | 私 |
| クラシックHL | 40% | II | HL(HIV) | > 80% | II |
| 慢性炎症に関連するDLBCL | 〜70% | II | PEL(原発性滲出液リンパ腫) | > 80% | 私 |
| 高齢者のEBV陽性DLBCL | 100% | II | 形質芽細胞リンパ腫 | 〜70% | IまたはII |
| リンパ腫様肉芽腫症 | 100% | II | 形質芽細胞リンパ腫、口腔型(HIV) | 100% | 私 |
| 血管免疫芽球性T細胞リンパ腫* | > 90% | II | 原発性CNSリンパ腫(HIV) | 100% | III |
| 節外性NK / T細胞リンパ腫、鼻型* | 100% | II | 原発性免疫障害のあるNHL | > 90% | III |
| アグレッシブNK細胞白血病* | > 90% | II | 医原性免疫不全リンパ腫 | 40〜50% | III |
| PTLD、NK / T細胞* | > 70% | III | |||
EBVのライフサイクルには、溶解期と潜伏期の2つの異なる段階がある(図1)。EBV は CD21 受容体を介して B 細胞に優先的に感染するが、上皮細胞や T または NK 細胞にも感染する。ウイルスは上皮細胞で溶解性複製を受け、循環するメモリーBリンパ球で生涯潜伏を確立し、潜伏から周期的に再活性化する[4,6]。弛緩感染の間、ウイルス遺伝子発現のフルレパートリーが起こり、子孫ウイルスが産生される。EBVの2つの主要な即時-初期のライチン化遺伝子(すなわち、BZLF1およびBRLF1)は、ウイルスおよび特定の細胞プロモーターを活性化するトランザクテーターをコードしており、ウイルス遺伝子発現の秩序あるカスケード(初期遺伝子発現およびゲノム複製に続く後期遺伝子発現)を導く。寛容な上皮細胞での溶血複製中に産生されたウイルスは、宿主内および宿主間でのウイルス粒子の拡散を可能にする。
図1 EBVのライフサイクル
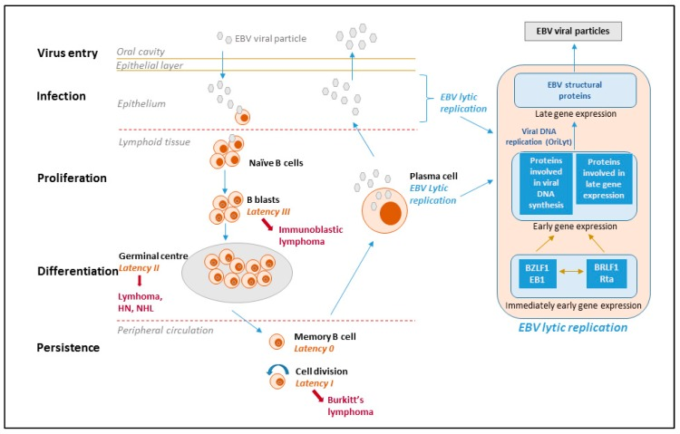
潜伏期と派生リンパ腫 ウイルスのライフサイクルには、少なくとも5つの異なるステージ(ウイルスの侵入、感染、増殖、分化、持続)があり、そのうちの4つがEBV疾患と関連している。ウイルスは唾液を介して感染し、口腔咽頭粘膜のナイーブB細胞に感染する。一次感染時、EBV感染したナイーブB細胞は、全潜伏遺伝子複合体(10個のタンパク質。EBV核抗原(EBNAs)潜伏膜タンパク質(LMPs)EBVコードされた小RNA(EBERs)マイクロRNAなど10種類のタンパク質)を発現している。これはIII型潜伏と呼ばれ、この潜伏形態は休息中のB細胞を活性化し、増殖と形質転換に駆り立てる。しかし、これらの細胞は免疫原性が高く、EBV特異的T細胞によって急速に排除される。ウイルスは免疫原性タンパク質をダウンレギュレーションするため、B細胞で生き残ることができる。EBVは抗原駆動型B細胞応答を模倣し、抗原刺激芽球と同様に、EBVに感染したB細胞は毛包に入り、拡大し、生殖中枢を形成し、そこで3つのウイルス性タンパク質のみを発現する(II型潜伏)。最後に、1つのウイルス性タンパク質(EBNA1,ウイルスゲノムが細胞ゲノムと確実に分裂するようにする)のみを発現してリンパ節を出る(I型潜伏)。EBV感染細胞の末梢血への侵入は、タンパク質をコードするすべてのウイルス遺伝子の停止をもたらする;これは、ウイルスタンパク質が発現しない潜伏0または潜伏プログラムと呼ばれている。ウイルスが静止している安静時記憶細胞は、宿主免疫系による攻撃を受けず、長期的な持続性を持つ部位である可能性が高い。記憶B細胞は、安定した細胞数を維持するために時折分裂し、ウイルスを運んでいる細胞が分裂すると、ウイルスEBNA1タンパク質が発現し、ウイルスゲノムが細胞と一緒に複製されるようにする。また、記憶B細胞は、末期分化を経て形質細胞になり、抗体を分泌することもある。そのような細胞がウイルスを含んでいる場合、EBVの溶血プログラムが活性化され、血漿細胞から放出された感染性ウイルスが上皮細胞に感染し、そこでウイルスが複製され、多量に流され、その後、他の宿主に感染することができる。潜伏型0を除いて、各潜伏状態は、EBV関連悪性腫瘍の特定の型に見られる。
潜伏状態では、ウイルスはウイルスゲノム(核内エピソームとして)の維持と宿主免疫系の回避に必要な限られた数の遺伝子のみを発現する。潜伏遺伝子の発現に基づいて、EBVの潜伏は異なるタイプに分類される(図2A)[7]。潜伏0,I、II、IIIの命名法は、遺伝子発現のスナップショットを表していることは注目に値する。EBVの潜伏は、潜伏0(健康な人の循環メモリーB細胞で観察されるようなEBV抗原の発現なし)から潜伏III(PTLDで見られるような、すべての核タンパク質(EBNA -1,-2, -3A, -3B, -3C, および -LP)および2つの膜タンパク質(LMP1およびLMP2)が2つの小さなRNA(EBER)とともに発現している)までの範囲である。腫瘍の中には、これらの潜伏パターンのいずれかに当てはまらないものもあり、さらに、免疫組織化学は、単一の生検内での発現の不均一性を示すことがある。さらに、細胞遺伝学的変化および/または共感染は、EBV関連悪性腫瘍で起こる(図2B)。EBV駆動型腫瘍では潜伏プログラムが優勢であるが、溶連性ウイルス複製もまた病原性の重要な要素である[8,9]。
図2 (a) EBV潜伏期の遺伝子発現パターン
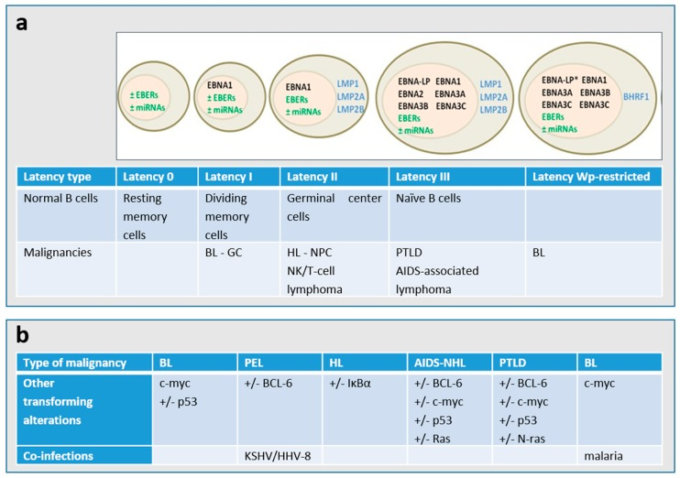
蔓延性BLの大部分は潜伏I型を呈し、野生型転換適合型EBVゲノムを持ち、EBNA1特異的潜伏プロモーターQpからのエプスタインバー核抗原1(EBNA1)ノンコーディングEBER(エプスタインバーウイルスがコードする小RNA)およびいくつかのマイクロRNA(miRNA)のみを発現している。いわゆるWp制限BLと呼ばれるBL常在性腫瘍の約15%は、EBNA2遺伝子を欠失したゲノムを持ち、Wp潜伏プロモーターからEBNA1,-3A、-3B、および-3C、ならびにウイルスBcl2ホモログであるBHRF1を発現している[2,6]。* EBNA-LP遺伝子は、Wp制限潜伏型では部分的に欠失している。EBV関連悪性腫瘍における主要な潜伏型は、潜伏膜タンパク質LMP1,LMP2A、LMP2BがLatency I遺伝子に加えて発現するLatency IIである。また、いくつかのEBNAタンパク質、LMP1,LMP2A、LMP2B、EBER、miRNAからなるEBV潜伏遺伝子複合体全体が発現しているIII型潜伏では、潜伏膜タンパク質LMP1,LMP2A、LMP2B、EBER、miRNAが発現している。b)細胞遺伝学的変化および/または共感染は、異なるタイプのEBV関連悪性腫瘍で起こることが知られている。PEL:原発性滲出液リンパ腫、HL:ホジキンリンパ腫、BL:バーキットリンパ腫、NHL:非ホジキンリンパ腫、PTLD:移植後リンパ増殖性障害、NPC:上咽頭癌、GC:胃癌。
2. EBV感染症の治療薬がないのはなぜですか?
ヌクレオシド系(アシクロビル(ACV)ペンシクロビル(PCV)ガンシクロビル(GCV)およびその経口製剤であるバラシクロビル(VACV)ファムシクロビル(FAM)バルガンシクロビル(VGCV))ヌクレオチド系(シドフォビル(CDV))ピロリン酸系(ピロリン酸系)の抗ウイルス剤がある。フォスカビル(フォスカネットナトリウム、PFA)類似体は、単純ヘルペスウイルス1(HSV-1)および2(HSV-2)水痘帯状疱疹ウイルス(VZV)および/またはヒトサイトメガロウイルス(HCMV)の治療薬として承認されている[10,11]。ヨーロッパのいくつかの国では、ブリブジン(BVDU)がHSV-1およびVZV関連疾患の治療薬として承認されている。これらの抗ウイルス剤の中には、試験管内試験でEBV複製の有効な阻害剤であることが証明され、実験的に使用されたものもあるが[11,12,13]、EBV感染症の治療薬としてFDA(食品医薬品局)またはEMA(欧州医薬品庁)の承認を受けたものはなかった。
2005,GershburgとPaganoは、抗EBV薬がないことの3つの主な説明を提案した[14]。第一に、感染性単核球症の診断が困難であることが、EBV感染症治療薬の開発が成功しなかった原因の少なくとも一部である可能性がある。EBVは30歳でほとんどの人に感染するが、感染性単核症を発症する人はごく少数である(通常、20歳代で感染を獲得した人)。感染性単核症の症状は発症が微妙で、潜伏期間が長く(4~6週間)診断が遅れる。
第二に、抗ウイルス剤は、EBVが高力価で放出される口腔咽頭において高濃度を達成すべきである。アシクロビルを静脈内および経口投与した場合、口腔咽頭でのEBVの脱落を有意に減少させることが示されたが、ウイルスの放出は治療を中止してから3週間以内に初期のレベルに戻った[15,16]。感染性単核症治療のための抗ウイルス剤が失敗した最も重要な理由は、この病気の症状や徴候がウイルスの複製の結果ではなく、血液中を循環して様々な臓器の組織に浸潤するEBV感染B細胞に対する免疫学的反応であるという事実に起因しているのかもしれない。感染性単核球症は、ウイルスに感染したBリンパ球に対する大量の細胞介在性免疫応答に起因する非定型リンパ球症を特徴とする。そのため、抗ウイルス薬と免疫調節薬(コルチコステロイドなど、感染性単核症の治療に医師が経験的に使用する薬)の併用が有効である可能性がある。しかし、多施設、二重盲検、プラセボ対照試験では、感染性単核症の治療のためにアシクロビルと一緒に投与されたプレドニゾロンは、臨床症状の持続期間やEBV特異的細胞免疫の発現に影響を与えることなく、口咽頭EBV複製を抑制した[16]。
3. 溶解複製を標的とした抗EBV治療薬の医学的必要性
EBVの一次感染は通常無症状であるが、一部の患者は感染性単核症を発症し、軽度の症状(発熱、咽頭痛、リンパ節腫脹など)を伴う場合もあれば、免疫不全宿主では致命的な症状となる場合もある。さらに、感染性単核球症の有無にかかわらず、EBVの一次感染は、主にウイルスに対する免疫病理学的反応の結果である合併症(自己免疫性溶血、扁桃腺肥大による気道閉塞、脾臓破裂、脳炎、重度の肝炎および心筋炎など)を引き起こす可能性がある。その他のまれではあるが重篤な合併症(無顆粒球症や再生不良性貧血など)は、健康な患者でも時折発生することがある。感染性単核球症に関連した合併症の治療の主力はコルチコステロイドである。重度の感染性単核球症合併症の管理における抗ウイルス剤の役割は、症例シリーズに基づいて議論の余地があるが、医師はEBV感染症の重度の顕在化における抗ウイルス剤の使用を検討してもよい。感染性単核球症の病態は主に免疫媒介であるにもかかわらず、EBV関連肝炎の重症度は高ウイルス負担と関連していることが示されている[17,18]。したがって、特定の抗ウイルス剤の使用は、感染性単核症に見られるEBV関連の合併症の症状を緩和することが期待されている。
EBVの溶血性複製は、感染性単核症に直接関連するだけでなく、慢性活動性EBV感染症(CAEBV)や口腔毛状白板症にも関連している。CAEBVはアメリカやヨーロッパではまれであるが、アジアや南米ではより頻繁に発生している。CAEBVは、EBV特異的抗体の著しく上昇したレベルと高いウイルス負荷を有するリンパ増殖性疾患である。多くの場合、慢性または再発性の感染性単核球症様症状が長期間持続し、抗EBV抗体の異常なパターンによって特徴づけられる致死的な疾患である。生命を脅かすCAEBVの合併症には、ウイルス関連血球貪食症候群、白血病およびT/NK細胞系統のリンパ腫がある[19]。直前の遺伝子の発現をアップレギュレーションすることにより、リンパサイクルを再活性化する遺伝子内EBV欠失は、ウイルス産生を回避し、リンパ腫形成を促進することと関連していた[20]。免疫調節剤(インターフェロン-αやインターロイキン-2など)抗ウイルス剤(アシクロビル、ガンシクロビル、ビダラビンなど)化学療法剤、EBV特異的細胞傷害性Tリンパ球を用いた細胞療法、造血幹細胞移植などがCAEBVの治療に用いられてきたが、成功は限られていた[21]。
移植後リンパ増殖性障害(PTLD)は、固形臓器移植後の重篤な合併症であり、しばしば致命的な合併症である。PTLDはまた、同種造血幹細胞移植(造血幹細胞移植)後の生命を脅かす疾患でもあり、薬剤による免疫モニタリング機能の低下が原因でリンパ球の制御不能な増殖を引き起こす。移植活動の増加、ドナーおよびレシピエントの年齢の上昇、新規で強力な免疫抑制剤の使用、ハプロ同一性造血幹細胞移植の導入、障害に対する認識の向上、診断ツールの改善などのいくつかの理由により、過去20年間でPTLDの発生率が大幅に増加している[24]。高ウイルス負荷の持続的な持続性とウイルス負荷の上昇は、PTLDのリスク上昇と関連している[25,26]。PTLDではウイルスが潜伏しているため、抗ウイルス療法は有用とは考えられていない。しかし、抗ウイルス薬の予防的投与により、PTLDの発症率は低下した[27,28,29]。固形臓器移植患者の血液中のEBV DNAの高値はPTLDを予測することが示されており、抗ウイルス剤はPTLDを予防する役割を果たしている可能性がある。早期発症PTLD(移植後1年以内に発症)のほとんどの症例は、最近のEBV感染と関連している。移植後1年目以降に発症した遅発型リンパ腫は、EBVと関連する可能性は低い。
EBVリチン化感染はリンパ増殖性疾患に寄与することが示されているので、リチン化タンパク質の発現を抑制することを目的とした治療戦略は、EBV関連悪性腫瘍の初期段階の制御に役立つはずである[8,30]。EBV IE 蛋白質 BZLF1 と BRLF1 は、リンパ性感染細胞における IL-6 の分泌に寄与し、初期のリンパ増殖性疾患を促進している [31]。IL-6は、免疫機能の維持、造血細胞の分化刺激、炎症の持続に重要な役割を果たすことが知られているサイトカインであるが、様々な血液学的および上皮性悪性腫瘍において重要な因子である。IL-6は、細胞の生存を促進するためにパラクリン機構およびオートクリン機構を介して作用し、転写3のシグナル変換器およびアクチベーター(STAT3)を誘導する。したがって、上皮細胞とリンパ球の両方に感染することが可能なウイルス(EBVなど)には、IL-6発現を誘導する機構があることは驚くべきことではない。また、リンパ球感染した細胞は、細胞やウイルスのIL-10の発現を誘導し[32]、B細胞をより効率的に増殖させ、B細胞悪性腫瘍と上皮悪性腫瘍の両方で血管新生に寄与するVEGFの発現を誘導している[33]。
4. クリニックで評価されているEBVに対する抗ウイルス剤
4.1. ヌクレオシド類似体(アシクロビル、バラシクロビル、ガンシクロビル、バルガンシクロビル
アシクロビルとガンシクロビルは試験管内試験でEBVを阻害することから[11,34,35],これらの薬剤とその経口プロドラッグは免疫抑制時のEBV再活性化抑制効果が評価された。肺および心肺移植EBVセロネガティブレシピエントにおけるPTLDの発生率は、アシクロビル、バラシクロビルまたはガンシクロビルによる抗ウイルス予防により減少した[28]。このリンパ増殖性障害の発生率を 1996 年以前(歴史的群)と 1996 年から 2000 年の間(抗ウイルス予防を受けた群)に解析し、EBV セロネガティブ受給者における長期の抗ウイルス予防が PTLD 発症に及ぼす影響を比較した。継続的な抗ウイルス予防を受けたEBV血清陰性者ではPTLDの発症は認められなかったが,既往群では4.2%の患者でPTLDが発症していた。
EBV陽性ドナー(D+)から移植片を受け取ったEBV非感染の小児腎移植患者(R-)を対象に、ガンシクロビルとバルガンシクロビルの予防薬がEBVウイルス負荷に及ぼす影響が評価された。移植後1年間、ガンシクロビルまたはバルガンシクロビルによる抗ウイルス予防は、EBV一次感染の発生率を有意に減少させた:予防群では9/20(45%)がEBV一次感染を発症したのに対し、予防群では8/8(100%)がEBV一次感染を発症していた。抗ウイルス薬の予防はEBVウイルス負荷を有意に低下させたが、免疫抑制療法の種類や強度はEBV一次感染の発生率やウイルス負荷のレベル/持続性に影響を与えなかった。
HCMV疾患を予防するために使用された抗ウイルス薬の影響は 2000年1月から 2016年1月までの間に移植された成人の腎臓または腎臓膵臓EBV血清陰性者73人の単心レトロスペクティブコホートで調査された[36]。37 例(50.7%、予防群)はバラシクロビルまたはバルガンシクロビルを 3~6 ヵ月間投与され、36 例(49.3%、予防なし群)は抗ウイルス薬を投与されず、平均追跡期間は 69 ヵ月(予防群)と 91 ヵ月(予防なし群)であった。予防は、EBV ウイルス負荷のモニタリングによって決定された初発感染を 100 日で遅らせた(43%対 84%)。初期のPTLDの発生率は群間で差はなかったが、EBV関連新生物の発生率は治療を受けた患者(症例は観察されなかった)の方が無予防群よりも有意に低かった(6例の新生物の報告があった)。弱いレベルのエビデンスにもかかわらず、抗ウイルス予防は遅発性PTLDを予防する可能性がある。
小児肝移植患者のコホートでは、ガンシクロビルを静脈内投与しても、EBVウイルス感染が検出されてから8週間後と1年後にEBV負荷が減少した患者の割合に変化はなかった[37]。2002年から 2015年までノルウェーで行われたこのレトロスペクティブ研究には、EBVウイルス症患者38人が含まれており、そのうち32人は中央値22日(21~38日)の期間、ガンシクロビルを静脈内投与された。移植からウイルス感染までの期間が短いこと、移植時の年齢が若いこと、移植前にEBVの血清転換がなかったことが慢性EBVウイルス感染症の有意な予測因子であった。
HCMVとEBVの再活性化の素因となるアレムツズマブ(すべてのBおよびTリンパ球に発現するCD52に対するヒト化モノクローナル抗体)による免疫抑制下にある29人の患者群において、バルガンシクロビルはEBVの再活性化を抑制した[38]。29人の患者(258検体、中央値は患者1人あたり7検体)で血漿中EBV DNA負荷を定量した。そのうち24人の患者では、定量可能なEBV DNAは検出されなかったが、5人の患者(17%)ではEBV再活性化が認められたが、4人の患者では自然に低下した。また、以前に別の強力なT細胞抑制薬(フルダラビン)を投与されていた患者1人がEBV陽性のホジキンリンパ腫を発症した。
血液中に持続的な EBV DNA が認められた肝移植を受けた小児グループにおいて、免疫抑制の低下を伴わないバルガンシクロビルの有効性と安全性が評価された[29]。長期抗ウイルス療法(中央値8カ月)を受けた患者の20/42(47.6%)に検出不能なウイルス負荷が観察され、そのうち60%は治療効果を維持した。しかし、本試験の結果は対照群がないため、慎重に解釈されるべきである。
経口EBV排出に対するバルガンシクロビルの効果は、無作為化二重盲検プラセボ対照試験[39]で評価された。26人の男性が含まれ、参加者全員が男性と性交渉をする男性と自認し、16人の参加者(62%)がHIV-1感染者であった。参加者はバルガンシクロビルの経口投与または毎日のプラセボ投与を8週間受け、その後2週間の「ウォッシュアウト期間」を経て8週間の代替治療を受けた。バルガンシクロビルの投与により,EBVが検出された日数の割合は61.3%から17.8%に,検出されたウイルス量は0.77ログに有意に減少した。
4.2. ヌクレオチド類似体
ヌクレオチドアナログのシドフォビル(CDV)は、幅広いスペクトルの抗DNAウイルス薬である。この化合物は、AIDS患者の網膜炎の治療に承認されているが、DNAウイルスによって引き起こされるいくつかの感染症の治療には適応外で使用されている[40]。認識されている抗ウイルス特性に加えて、この薬剤は、その抗増殖効果でも知られている[41]。
抗ウイルス剤シドフォビルを用いた局所再発EBV関連鼻咽頭癌の治療が2人の患者で成功したことが報告されている[42]。また、ヌードマウスのEBV陽性上咽頭癌異種移植片の腫瘍組織にシドフォビルを注入すると、腫瘍の増殖が抑制された[43]。リボヌクレオチド還元酵素阻害剤であるヒドロキシウレアおよびディドックス(3,4-ジヒドロキシベンゾヒドロキサム酸)との併用により、シドフォビルによるEBV形質転換上皮細胞およびEBV陽性上咽頭癌異種移植片のアポトーシスが増強された[44]。シドフォビルはEBVオンコプロテインを減少させ、EBV関連悪性腫瘍(バーキットリンパ腫および上咽頭癌)の放射線感受性を高めた[45]。
4.3. ピロリン酸アナログ
無機ピロリン酸アナログであるフォスカルネットは、ヘルペスウイルスDNAポリメラーゼの直接阻害剤である。ピロリン酸結合部位をブロックし、デオキシヌクレオシド三リン酸からのピロリン酸の開裂を防ぐ。ウイルスDNAポリメラーゼの非競合的阻害剤であるフォスカルネットは、成長しているウイルスDNAに組み込まれず、細胞酵素よりもウイルスに対して~100倍以上の活性を持つ。EBVを含むすべてのヒトヘルペスウイルスに対して活性を有するが、ホスカルネットは、エイズ患者におけるHCMV網膜炎の治療や、免疫不全患者におけるアシクロビル耐性HSV感染症の治療に承認されている。また、UL97プロテインキナーゼ(PK)の変異によるガンシクロビル耐性HCMV感染症の治療にも使用されている。他のヘルペスウイルス感染症の治療に対する安全性と有効性はまだ確立されていない[10]。持続性のあるEBV感染症の治療にフォスカルネットを使用した成功例が報告されることがある。肺移植患者の持続性EBV感染症の管理には、免疫グロブリンとの併用でフォスカルネットが成功し、免疫抑制の強度が低下した後、PTLDの臨床的改善が認められた[46]。この患者では、細胞性免疫の回復によりPTLDは改善したが、EBV感染の抑制には効果がなかったため、抗ウイルス薬と免疫グロブリンによる治療が必要であった。フォスカルネットによる治療中の2人のAIDS患者におけるEBV関連リンパ増殖障害の退縮も記載されている[47]。
5. 研究中の抗EBV化合物
5.1. EBVプロテインキナーゼBGLF4の阻害剤
マリバビル(MBV)は、HCMVとEBVの両方に対して有意な活性を持つ経口ベンズイミダゾールL-リボシドであるが、他のヒトヘルペスウイルスに対しては活性がない [48,49]。マリバビルは副作用が少なく、ウイルスDNAポリメラーゼを標的とする抗HCMV薬と比較して特異性が高い。ヌクレオシドおよびヌクレオチド類似体とは異なり、マリバビルの阻害効果は、主にHCMVおよびEBVのPKの阻害を通じて産生される[50]。本化合物は、HCMVのUL97 PKを選択的に阻害し(キナーゼ活性の直接阻害によって決定される)UL97遺伝子の一点変異はHCMVにおけるマリバビル耐性を付与する [51]。UL97は、HCMVの退院において重要な役割を果たすセリン/スレオニン特異的PKである。UL97は、HCMV感染細胞におけるいくつかのウイルス性および細胞性タンパク質のリン酸化に必要である[50,52]。ガンシクロビルとマリバビルの下で選択されたUL97変異は、試験管内試験および生体内試験では異なる変異であり、交差抵抗性は認められなかった[53,54]。しかし、Chouら[56]は、ガンシクロビルを投与した被験者で、またはシクロプロパビルの下で増殖した後にUL97キナーゼ変異が検出され、3つの薬剤すべてに対して中等度から高レベルの耐性を有することを報告している。マリバビルに対する低レベルの耐性(2~3倍)もまた、HCMV UL27遺伝子の変異によって生じる可能性がある。UL27の機能は不明であるが、マリバビルの直接的な標的とは考えられていない。
同種幹細胞移植のレシピエントにおけるHCMV疾患予防のためのマリバビル予防の有効性は、第3相:二重盲検プラセボ対照無作為化試験で評価された [57,58]。HCMV感染症の管理を目的としたマリバビルの臨床開発は、同種幹細胞移植患者における主要評価項目(HCMV疾患の予防)を達成できなかったため、現在は保留されている。
マリバビルはEBVに対しても顕著な活性を示しており、EBVに対してユニークな二重の効果がある:ウイルスDNA複製とウイルス転写の阻害 [14,60]。HCMVとは対照的に、EBVに対するマリバビルの活性は、EBVのPKであるBGLF4の直接的な阻害には結びつきないでした。実際、マリバビル治療は、EBVのDNAポリメラーゼプロセシング因子BMRF1のリン酸化を阻害することが示された[49]。EBV RNAにほとんど影響を及ぼさないアシクロビルとは異なり、マリバビルは複数のRNAの発現を阻害する。さらに、マリバビルの転写物の阻害プロファイルは、PKの発現および活性がノックアウトされたEBV変異体によって産生されたものと類似しているように思われた[61]ことから、マリバビルはEBVのPKには直接影響しないが、BGLF4の阻害を通してEBVの転写物レベルに大きく影響することが示唆された[62]。EBVのBGLF4は少なくとも20のウイルス標的を持っていることを考えると、マリバビルは下流の標的にも間接的に影響を与える可能性がある。
5.2. EBV DNAポリメラーゼの阻害剤
新規なl-ジオキソランチミジンアナログである1-[(2S,4S-2-(ヒドロキシメチル)-1,3-ジオキソラン-4-イル]5-ビニルピリミジン-2,4(1H,3H)-ジオン(HDVD)は、HSV-1, KSHV, EBV, マウスヘルペスウイルス68(MHV-68)に対して活性を示した [35]。この化合物はHSV-2,VZVおよびサイミリヘルペスウイルス(HVS)の複製を弱く阻害し,HCMVおよびアカゲザルヘルペスウイルス(RRV)に対しては抗ウイルス活性は認められなかった。このことから,HSV-1やVZVに対して強力な活性を示す関連化合物であるブリブジンとは抗ウイルス活性スペクトルが異なっていた。しかし,ブリブジンと同様に,HDVD耐性ウイルスの特性を調べたところ,HSV-1,MHV-68,HVSのウイルス性チミジンキナーゼ(TK)が本化合物の活性化に必要であることが示された。BALB/cマウスのMHV-68感染モデルを用いて,HDVDとブリブジンの経口投与を評価した。HDVD治療はブリブジン治療とは対照的に、未治療のコントロールと比較して、肺での急性ウイルス複製時のウイルスDNA負荷とウイルス遺伝子発現の低下をもたらした。HDVDのバリルエステルプロドラッグ(USS-02-71-44)は、HDVDよりも脾臓の潜伏感染予防に有効であった[35]。様々なヌクレオシド誘導体の耐性機構の研究から、ピリミジンヌクレオシド誘導体はγ-ヘルペスウイルスTKによってリン酸化され、プリンヌクレオシドはγ-ヘルペスウイルスPKによって優先的に活性化されることが示唆されている[13]。
2つのチオヌクレオシド誘導体、KAY-2-41およびKAH-39-149は、生体内試験(MHV-68マウスモデル)で有効な抗ウイルス効果を示し、試験管内試験では強力かつ選択的な抗EBV活性を示した[34]。また、これらの化合物はHSVおよびVZVに対しても活性を示した。KAY-2-41-およびKAH-39-149耐性のHSVおよびMHV-68はウイルスのTKに変異を有していたが,これらの変異は他のTK依存性の薬剤と比較して,KAY-2-41およびKAH-39-149には低いレベルの耐性しか付与しなかった。HeLa TK欠損細胞を用いた抗ウイルスアッセイでは、HSV TK欠損変異体に対するKAY-2-41およびKAH-39-149活性の欠如が示された。さらに,酵素アッセイでは,HSV-1およびVZV TK,細胞性TK1およびTK2がKAY-2-41およびKAH-39-149を認識し,リン酸化することが示された。KAH-39-149は、マウスのγ-ヘルペスウイルス感染モデルにおいて、KAY-2-41よりも優れていることが示され、EBVに対する抗ウイルス治療薬としての可能性を強調した。
様々なメチレンシクロプロパンヌクレオシド(MCPN)類似体は、細胞培養や動物モデルにおいて、いくつかのヘルペスウイルスに対して活性があることが証明されている[64,65,66,67,68]。MCPN類似体の最初のシリーズは、デオキシリボヌルセオシドの5′水酸基を模倣したシクロプロパン環上の単一のヒドロキシメチル基を有していた。このシリーズからの化合物は、アシクロビルと同様に、3′ヒドロキシ基のカウンターパートの欠如のために、一旦DNAに組み込まれると、さらなる鎖伸長をブロックする。第二世代のMCPN類似体は、ジヒドロキシメチル誘導体であり、ガンシクロビルと同様に、さらなる鎖伸長を可能にするDNAポリメラーゼによって認識され得る第二のヒドロキシ基を有する。このクラスの最も活性の高い化合物であるシクロプロパビルは、HCMV、マウスCMV、EBV、HHV-6およびHHV-8に対して良好な抗ウイルス活性を示し、そのプロドラッグである6-デオキシシクロプロパビルは、経口投与した場合に良好な活性を示している[69]。CMVに対するシクロプロパビルの作用機序は、DNA合成の阻害とUL97のPKの両方が関与する複雑なものである[70]。(S)-シンガノールのような単一のヒドロキシメチル基を有する最初のシリーズの類似体は、B型肝炎およびHIVを含むより広範な抗ウイルス活性を示している。最近では、6-エーテルおよび-チオエーテル部位を有するモノヒドロキシメチルおよびジヒドロキシメチル類似体もまた、EBVを含むいくつかのヘルペスウイルスに対して活性であることが報告されている。これらの類似体の中には,シクロプロパビルよりも広い範囲の活性を示すものもあり,HSV-1,HSV-2およびVZVに対しても阻害作用を示した[66]。これらの化合物の活性はHCMV UL97 PKに依存していたが,HSV TK活性とは比較的独立していた。これらのデータは,これらの類似体の作用機序がシクロプロパビルとは異なることを示唆しており,最終的には広範な抗ヘルペスウイルス薬として使用できることを示唆している.
コンフォメーションロックされたヌクレオシドアナログであるN-メタノカルバチオミジンは、α-ヘルペスウイルス、γ-ヘルペスウイルスおよびオルソポキソウイルスに対して活性があることが証明された[71]。この化合物の抗ウイルス活性は、ウイルスTKによる活性化に依存する。本剤は、ウイルスTKsによって活性化されると、ウイルスのDNA合成を阻害する。この化合物は、オルソポキソウイルスおよびHSV感染の動物モデルにおいても有効であることが証明されており[72,73]、現在、健康なボランティアを対象とした安全性を評価するための第I相試験が進行中である[10]。
シドフォビル誘導体を含むいくつかの非環状ヌクレオシドホスホン酸塩(ANP)は、EBV および他のγ-ヘルペスウイルスの複製を高い効力と選択性で阻害した [12] 特筆すべきは、ANP の環状プロドラッグは EBV 株 P3HR-1 に対しては活性が低下したが、EBV 株 Akata に対しては活性が低下しなかったことである。シドフォビルとその環状形態(cyclic-cidofovir)を用いた代謝研究により、これらの違いは、EBV再活性化後のP3HR-1細胞における薬物代謝の変化、すなわち、cyclic CMPホスホジエステラーゼによるcyclic-cidofovirの加水分解の減少に起因することが明らかになった[12]。P3HR-1 細胞における環状 AMP レベルの変化は、この環状ヌクレオチドによるホスホジエステラーゼの競合的阻害を示唆していた。シドフォビルとその5-アザ誘導体(HPMP-5azaC)は、マウスモデルにおいて、マウスのγ-ヘルペスウイルスの複製および伝播を非常に効果的に阻害する薬剤として登場した [12]。
ブリンシドフォビル(CMX-001)はシドフォビルの経口生物学的利用可能な形態である。このシドフォビルのアルコキシアルキルエステルプロドラッグは、試験管内試験ではシドフォビルと同じ広範な抗ウイルス活性を有しているが、シドフォビル二リン酸の細胞内レベルが高いため、シドフォビルと比較して最大1000倍の活性を有する[74]。ブリンシドフォビルはシドフォビルとは対照的に、近位腎尿細管に位置するヒト有機アニオントランスポーター1酵素の基質ではないため、抗ウイルス活性が向上していることに加え、腎毒性がない。ブリンシドフォビルの前臨床試験では有望なデータが報告されているが、血清陽性の全血球造血幹細胞移植患者におけるHCMV疾患の予防を目的とした第III相試験では、残念な結果が得られたため、市場への移行は遅れることになった。SUPPRESSと名付けられたこの試験では、ブリンシドフォビル投与群でプラセボ投与群と比較してHCMV疾患の増加が報告されたが、これはおそらくブリンシドフォビル胃腸病を移植片対宿主病と誤診したことに関連していると考えられる。これらの知見を受けて、HCMVの試験は中止されたが、アデノウイルスの試験は継続中であり、静脈内投与製剤も開発中である。EBV関連疾患を対象とした本剤の評価試験は予定されていない[10]。
5.3. EBV核抗原1(EBNA1)の阻害剤
EBV-エンコード核抗原1(EBNA1)は、EBVゲノムの維持、複製、分離に機能する汎用性の高いタンパク質であり、EBV関連悪性腫瘍を治療するための魅力的な治療標的となっている。このタンパク質は、潜伏期0を除くすべてのEBV潜伏型で発現しており、潜伏感染細胞におけるEBVエピソームゲノムの複製と持続は、主にEBVエンコード核抗原1(EBNA1)とEBVオリプエレメントとの結合に依存している。
近年、EBNA-1の発現を低下させたり、機能を阻害する阻害剤の設計や同定に多大な努力が払われていた。EBNA-1の顕著な特徴、その機能ドメイン、およびEBNA-1阻害剤の開発における進歩は、最近詳細にレビューされている[76]。例えば、Leeら[77]は、EBNA1低分子阻害剤(H20,H31)およびその基礎となる阻害機構を特徴付けた。H20は、in silico・ドッキング解析によって予測されたように、EBNA1のDNA結合ドメイン(DBD)のポケットに収まるが、H20はEBNA1のコグナート配列への結合に有意な影響を与えなかった。H20の限定的な構造相関研究により、疎水性化合物であるH31がEBNA1阻害剤として同定された。H31はEBNA1依存性のoriP配列特異的DNA結合活性を阻害したが、配列非特異的染色体結合には影響を与えなかった。H31はEBNA1依存性の転写、複製、およびEBV oriPプラスミドの永続性を抑制し、EBNA1結合活性の阻害と一致した。重要なことに、H31はEBVエピソームの漸進的な喪失をもたらし、EBV感染リンパ芽球細胞株またはバーキットリンパ腫細胞の増殖を選択的に遅延させた。このように、H31によるEBNA1依存性DNA結合の阻害は、EBV感染細胞におけるEBNA1依存性転写およびEBVエピソームの持続を減少させた。また、スクリーニングアプローチにより、EBNA1-DNA結合、EBNA1-oriPトランザクティベーション、EBNA1連結領域を阻害する分子が同定された。また、EBNA1の二量体界面からの切断ペプチドをベースとした阻害剤が報告され、EBNA1のEBV関連癌の治療に対する「薬効性」が確認された[78]。
リガンド分子を収容する可能性のあるEBNA1結合ポケットの計算上の同定および構造的特徴付けは、以前に試験管内試験でEBNA1阻害のために試験された化合物(PubChem AID-2381)のセットとドッキングすることによって検証された(79)[79]。ポケット内の薬物取り込み性の評価は、薬物取り込み可能な結合部位に属する多数のヒットに対して、分子力学一般化ボルン表面積計算による結合親和性予測と対になった誘導フィットドッキングおよび分子動力学シミュレーションによって行われた。これらの研究により、EBNA1を創薬ターゲットとして確立し、AID-2381の活性なヒットが個々の部位で相互作用してEBNA1:DNA結合を破壊するという計算上の証拠を提供した。Cullinan Oncology社は、Wistar Instituteが発見した新規EBNA1阻害剤VK-2019(EBNA1に結合し、EBNA1のDNA結合活性を阻害する)を開発している。現在、VK-2019の安全性と忍容性、薬物動態、薬力学、予備的有効性を評価するための第1-2a相臨床試験(https://clinicaltrials.gov/ct2/show/NCT03682055)オープンラベル、用量増量・拡張、ヒト初の臨床試験が行われている。
6. 細胞標的
ウイルスの複製サイクルのステップを標的とするように設計された直接作用型抗ウイルス剤に代わる戦略として、ウイルスの複製に不可欠な細胞タンパク質は、ウイルスの複製を特異的に阻害するための新規な標的として機能する可能性がある。従来の抗ウイルス剤は、少数のウイルスに対して活性があり、抵抗性の開発はその特異性の特徴と考えられている。対照的に、ウイルスの複製に不可欠な細胞タンパク質を標的とする抗ウイルス剤は、関連性のない様々なウイルスの複製には同じ細胞タンパク質が関与している可能性があるため、より広範囲のウイルスに対して活性を発揮することが期待される。さらに、細胞イベントを標的とした抗ウイルス剤は、ウイルスタンパク質に作用する抗ウイルス剤に比べて、薬剤耐性ウイルスの突然変異体を選択しにくくなることが期待される。さらに、従来の抗ウイルス剤に耐性のあるウイルス変異体に対しても、抗ウイルス剤は活性を維持しなければならない。しかし、細胞タンパク質を標的とした場合の大きな欠点として、細胞毒性や副作用の増加が考えられる。
細胞性トポイソメラーゼIおよびII(トポIおよびII)は、γ-ヘルペスウイルスのリンパ性DNA複製に不可欠であるため[80,81]、ある種のトポIおよびII阻害剤は、EBV感染に対する抗ウイルス剤の可能性があると考えられている[82]。トポII阻害剤は2つのカテゴリーに分類される。トポイソメラーゼ-DNA中間体を標的とするトポII毒物と、酵素のターンオーバーを阻害するトポII触媒阻害剤である[83]。トポイソメラーゼII毒物には、抗腫瘍薬として使用されているエトポシドやドキソルビシンなどがあり、これらはKSHVの複製やウイルス産生を阻害することが示されているが、予想通り、かなりの毒性を示していた[83]。対照的に、ノボビオシン、メルバロン、ルタマリンを含むトポII触媒阻害剤は、ヒトγ-ヘルペスウイルスに対して最小限の毒性で抗ウイルス活性を示した[83]。特に、(+)ルタマリンは、試験したトポII阻害剤の中で最も高い選択性(SI > 63)を示し、EBVのDNA複製とウイルス産生を阻害し、細胞増殖への悪影響をほとんど及ぼさなかった [82]。したがって、ルタマリンは、EBV感染に伴うヒト疾患の治療薬として、安全性の高い薬剤と考えられる。
Verdinexorは、SINE(Selective Inhibitors of Nuclear Export)化合物として知られる新しいクラスの低分子に属する。これらの化合物は、核輸出タンパク質であるXPO1と共有結合してブロックし、XPO1依存性タンパク質を細胞核内に封じ込める。Verdinexorは、免疫不全患者に影響を及ぼす日和見ウイルスに対して様々なレベルの有効性を示した [84]。ベルディネキソールは、50%有効濃度(EC50)が50nM、選択性指数が7で、赤田細胞におけるEBVの複製を阻害するのに有効であった。 ベルディネキソールの有効性は、ウイルスタンパク質SM(溶解複製中のEBV mRNAの核細胞質的輸出に関与するアダプタータンパク質)が、XPO1を媒介とする核輸出に依存していることで説明できた。バーディネキソールは、核輸出を阻害することで、翻訳のためにEBV mRNAの細胞質へのシャトリングを阻害する。
宿主細胞のプロテインキナーゼおよびそれらが制御する下流経路がヘルペスウイルス感染において重要な役割を果たしているという豊富な証拠があるため、いくつかの細胞性プロテインキナーゼ阻害剤が抗ヘルペスウイルス効果のために試験されていた[85]。移植患者におけるHCMV疾患の軽減における哺乳類標的ラパマイシン(mTOR)阻害剤の成功は、ヘルペスウイルス関連疾患の治療における細胞性プロテインキナーゼ阻害剤の可能性についてのさらなる研究を奨励するかもしれない[86,87,88]。最近では、エベロリムスがDNA合成の遅延と抑制、感染の広がり、サイトメガロウイルス感染の緩和を示すことが示されている[89]。
7. 薬用植物
薬用植物から単離された多くの化合物が、EBVのリチン化複製を阻害することが知られている。その中でも、細菌感染、炎症、高血圧を含む様々な病気の治療に一般的に使用されるアンドログラフィス・パニキュラータは、EBV IE遺伝子の転写およびEBVビリオンの産生を阻害することが示されている[90]。A. paniculataに含まれるジテルペノイドのアンドログラフォリドは、抗炎症、抗血栓、抗癌、抗免疫刺激活性のために重要である。さらに、アンドログラフォライドはEBVだけでなく、HIV [91,92]、インフルエンザウイルス、SARS [93]、HSV-1 [92,94]などの他のウイルスに対しても抗ウイルス活性を示した。アンドログラフォリドがEBVのBRLF1およびBZLF1遺伝子の転写をどのように阻害するかは現在のところ不明であるが、アンドログラフォリドがEBVのIE遺伝子の転写を活性化するシグナル伝達経路を阻害している可能性がある[90]。
Polygonum cuspidatum(イタドリ)の根から得られた酢酸エチルサブフラクションF3とその主成分(エモジン)は、EBVのリチン化サイクルを阻害することが示されている[95]。P. cuspidatumは漢方薬であり,動脈硬化の治療に用いられるほか,癌,喘息,高血圧,咳嗽などの治療にも用いられている。F3とエモジンは、EBV IEタンパク質であるRta(Rトランザクティベータ、BZLF1遺伝子の産物)Zta(Z EB複製活性化因子、BZLF1の産物)EA-D(早期拡散タンパク質)の発現を用量依存的に減少させ、EBV複製サイクルの初期段階を阻害することを示唆している[95]。F3とエモジンはBRLF1とBZLF1のmRNA発現も阻害し、その結果、ウイルスのリチン化タンパク質の発現とEBVのDNA複製に影響を与えた。エモジンはp38, MAPK, ERK, JNKのシグナル伝達を阻害し、AP-1やATF1によって活性化されるプロモーターの活性化に影響を与えることが先行研究で示されている[96,97,98]ことから、シグナル伝達経路の活性化に対するエモジンの阻害が、EBVのリチン化サイクルに対するF3やエモジンの阻害に関与している可能性が示唆された[95]。
緑茶の主要なカテキンである(-)-エピガロカテキン-3-ガレート(EGCG)によるEBVの自然感染の阻害は、MEK/ERK1/2およびPI3-K/Aktシグナル伝達の活性化の抑制にも関与しているようである[99]。(-)-緑茶は、フラバノールまたはカテキンとして知られているポリフェノール化合物の多量の存在によって特徴付けられ、EGCGは、EBVの溶解サイクルの阻害を含む緑茶の生物学的効果を担当する主な活性成分であるように見える[100]。
最近、Saururus chinensis(ドクダミ科ハンゲショウ)の根から分離されたリグナンの抗EBVリチン化複製活性が報告された[101]。リグナンはS. chinensisの主要な活性成分であり,NF-kB[102]やHIVプロテアーゼ[103]の阻害活性や心血管系への影響[104]など,幅広い生物学的活性を示すことが知られている。S. chinensis のエタノール抽出物を分画して得られた 19 種類の新規リグナンおよび既知のリグナンのうち,マナサンチン B は EC50 1.72 µM,低毒性(CC50 > 200 µM),SI > 116 で最も有望な阻害作用を示した。
モロン酸はトリテルペノイドのケト酸であり,Rhus chinensis(ヌルデ)やBrazilian propolis(ブラジリアンプロポリス)に含まれている。モロン酸は、試験管内試験ではHIV [105]およびEBV [106]に対して、マウスではHSV-1 [107]に対して活性があることが実証されている。Changらは、モロン酸がRta、ZtaおよびEA-Dの発現を阻害することを報告した[106]。さらに、モロン酸は、Rta応答エレメントを含むプロモーターを活性化するRtaの能力を阻害しており、モロン酸がRtaの機能を阻害していることが示唆された。一方、モロン酸はZtaのトランザクティベーション機能に影響を与えることがわかった。したがって、モロン酸処理後のZtaおよびEA-Dの発現の欠如は、Rtaのトランザクティベーション機能の阻害に起因するものと考えられ、その結果、リチン化サイクル中に産生されるEBV粒子の数が大幅に減少することになる。対照的に、Thelypteris torresianaに含まれるフラボノイドであるプロトアピゲノンは、Ztaのトランザクティベーション機能を阻害してウイルスのリチン化サイクルを阻止し、Rtaプロモーターの機能には影響を与えないことが報告されている[108]。
様々な天然物から分離された116種の化合物の実験室コレクションをスクリーニングした結果、アンジェリシンはMHV-68および2つのヒトγ-ヘルペスウイルスEBVとKSHVに対して抗ウイルス活性を示した[109]。アンゲリシンは、Psoralea corylifolia(オランダビユ)の種子やAngelica archangelica(セイヨウトウキ)の根に含まれるフロコマリンであり、psoralens(長波長紫外線照射とともに様々な皮膚疾患の治療に使用される光合成剤)の一種である。アンゲリシンのγ-ヘルペスウイルスに対する作用機序の詳細な分子機構は不明であるが,アンゲリシンはRTAプロモーターの自己活性化を阻害し,その結果,複製溶解サイクルの初期段階を阻害することが明らかにされている[109]。フロンコウマリンは、インフルエンザウイルス[110]やレトロウイルス[111]に対しても活性があることが証明されている。
8. 溶解誘導療法における抗ウイルス薬の使用
潜伏感染した腫瘍細胞におけるウイルスの溶解複製を再活性化する戦略の開発(溶解誘導療法)は、溶解複製が腫瘍細胞の死を促進することから、関心が高まっている。さらに、ウイルスを担持している腫瘍細胞はまた、溶解サイクルの間に発現するウイルスキナーゼによって活性化される抗ウイルス剤(例えば、ガンシクロビル)によっても死滅することがある。抗ウイルス剤と溶解サイクルの誘導剤との組み合わせは、EBVおよびKSHV駆動の腫瘍を治療するための有望な戦略として検討されている[112,113,114,115]。一部の細胞株は外部刺激によるリチン化活性化に特に抵抗性であり、リチン化誘導刺激に応答性のある細胞株でも、亜集団の細胞はリチン化活性化に応答しないままであるため、リチン化サイクルへの誘導効率を向上させるためのさらなる研究が必要である[112,116]。
9. 結論と展望
抗EBV療法は、特に免疫系に障害のある患者にとって、依然として大きなアンメットメディカルニーズとなっている。EBV関連疾患に対して評価されてきた他のヘルペスウイルスに対して承認された抗EBV薬は、期待はずれの結果となっている。いくつかの抗EBV薬候補があるが、その有効性を示すにはまだ多くの研究が必要である。EBV関連疾患の治療法を開発するためには、さらなる研究が必要であり、また、EBV疾患に関連した合併症を回避するために免疫抑制患者の予防に使用できる分子を開発する必要がある。EBVワクチンは、一次感染による大きな負担を軽減し、特定のヒト悪性腫瘍の発生率を低下させるために高い利益をもたらすはずであるが、EBVワクチンの開発は非常に遅れている。
生産性の高いEBV感染と潜在的なEBV感染の両方に対処するために使用できる可能性のある新しい戦略は、CRISPR/Cas9ゲノム編集技術を用いて、ウイルスの適合性に必要なウイルス遺伝要素を標的化することである。Lebbink氏のグループは、複数のガイド付きRNA(gRNA)を用いてEBVゲノムを同時に標的化することで、潜伏感染したEBV形質転換細胞からウイルスをほぼ完全に除去できることを実証した。このことは、新たなゲノム工学技術を用いて病原性ヒトヘルペスウイルスを管理するための治療アプローチの開発に新たな道を開くことになる[117]。
