Contents
Nicotinamide Riboside—The Current State of Research and Therapeutic Uses
www.ncbi.nlm.nih.gov/pmc/articles/PMC7352172/
要旨
ニコチンアミドリボシド(NR)は、体内のNAD+含有量の上昇を介して媒介されるその多くの潜在的な健康上の利点のために、最近、最も研究されているニコチンアミドアデニンジヌクレオチド(NAD+)前駆体の一つとなっている。NAD+は、様々な代謝経路で重要な役割を果たしている必須の補酵素であり、その全体的な含有量を増加させることは、病態生理学的条件の多種多様な治療のための貴重な戦略として確認されている。NR の健康上の利点に関する証拠の蓄積は、心血管系、神経変性疾患、および代謝性疾患の数多くの治療のための多数の動物およびヒトの研究にわたってその効率を検証している。現代社会では、これらの条件の有病率と罹患率が増加しているため、大きな必要性は、治療用にNRの迅速な翻訳と栄養補助食品としての利用可能性のさらなる確立のために生じている。ここでは、我々は、特定の病態生理学的条件のための治療法としてのアプリケーションに至るまで、代謝、およびいくつかの神経変性疾患や心血管疾患に対するNRの効果に関する現在利用可能なデータを要約している。さらに、SARS-CoV-2 を含むいくつかの病原体の感染症に対する潜在的な治療法としての NR の応用に関する新たに発表された研究をレビューした。さらに、NRの治療薬への迅速な翻訳をサポートするために、他のNAD+前駆体に対するNRの利点とともに、そのバイオアベイラビリティと安全性に関連した課題に取り組んでいる。
キーワード
ニコチンアミドリボシド、ニコチンアミドアデニンジヌクレオチド、サプリメント、安全性、バイオアベイラビリティー、代謝障害、加齢性疾患、COVID-19
1. はじめに
近年、NAD+の生物学への関心が高まっており、多くの生理学的プロセスにおけNAD+の役割についての重要な洞察が明らかになり、その前駆体を補給することによる有益な効果が強調されている。さらに、蓄積された証拠は、NAD+レベルの低下が加齢に関連した病態生理の発達に寄与していることを示している[1,2,3]。全身のNAD+の減少は、生合成率の低下とNAD+の使用量の増加の両方によって引き起こされる。NAD+の膨大な需要は、解糖、脂肪酸β酸化、トリカルボン酸サイクル、脂肪酸合成、コレステロール、ステロイドなどの異化・同化反応の大部分を含む細胞の酸化還元反応において重要であることに起因している[4,5,6]。[4,5,6]. さらに、サーチュイン、ポリ-ADP-リボースポリメラーゼ(PARPcADP-リボース合成酵素(CD38/157エクト酵素)[7,8,9]およびモノ-ADP-リボース転移酵素(ART)などのNAD+消費酵素が、NAD+の全体的な枯渇に寄与している。
生合成は、トリプトファン(Trp)からのde novo合成を介して、または他の4つの前駆体、ニコチンアミド(NAMニコチン酸(NAニコチンアミドリボシド、およびニコチンアミドモノヌクレオチド(NMN)からのサルベージ経路でNAD+の枯渇レベルをある程度補償することができる。
Trpからのde novo合成が8段階の経路で行われるのに対し、サルベージ可能な前駆体であるNAとNAMは、それぞれ3段階(Preiss-Handler経路)と2段階である(図1)。ニコチンアミドリボシド(NR)は、NAD+を形成するための2段階の経路[10]または3段階の経路[11]を持つ追加のサルベージ可能なNAD+前駆体である(図1)。哺乳類では、最も一般的な前駆体はNAMであり、これはさらに律速酵素であるホスホリボシルトランスフェラーゼ(NAMPT)によってNMNを形成するために使用することができる[12]。最終段階では、NMNはNMN/NaMNアデニル転移酵素(NMNATs)によってNAD+に変換される [13,14]。
老化過程および/または栄養過多の機能として、NAD+含量およびNAMPT発現は、複数の組織において減少することが見出されている[3,15,16,17]一方で、NAD+レベルの維持は、異なる組織における多様な生合成経路および前駆体に依存している[18,19]。それにもかかわらず、NAMPT酵素の発現低下は、加齢によるNAD+低下の主要な原因の一つである[15,20]。この酵素の必要性は、2つのニコチンアミドリボースキナーゼ、NMRK1およびNMRK2(NRK1およびNRK2としても知られている)によるNRのNMNへの直接変換によって回避することができる[10]。これはまた、エネルギー的にコストのかかるPRPP(ホスホリボシルピロリン酸。 図2)およびNAD+によるフィードバック阻害の要件を回避する[21]。あるいは、NRは、プリンヌクレオシドホスホリラーゼ(NP)によってNAMに変換することができ、このNAMは、その後、NMNATによってNMNを介してNAD+に変換される(図1)。したがって、NRの利用は、Nrk経路かNPとNampt経路の組み合わせのいずれかの発現に依存する。
図1 NAD+合成経路
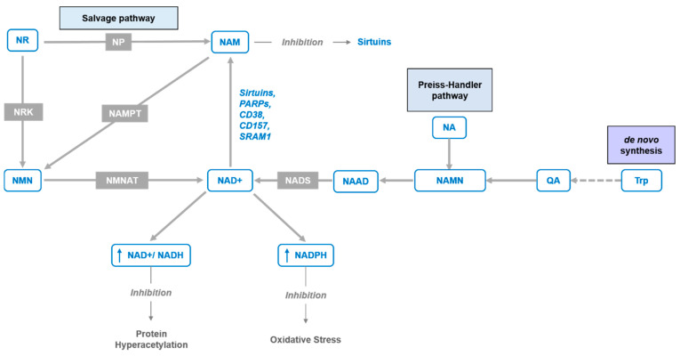
トリプトファン(Trp)からキノリン酸(QA)を経由したNAD+ de novo経路、ニコチン酸アデニンジヌクレオチド(NAAD)を経由したニコチン酸(NA)からニコチン酸合成酵素(NADS)を経由したPreiss-Handler経路を描いた図である。およびニコチンアミドリボシド(NR)およびニコチンアミドモノヌクレオチド(NMN)から、それぞれプリンヌクレオシドホスホリラーゼ(NP)およびニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)酵素またはニコチンアミドリボースキナーゼ(NRK)およびNMN/NaMNアデニルトランスフェラーゼ(NMNAT)を介して「サルベージ経路」を得ることができる。
図2 NMRK2経路の活性化
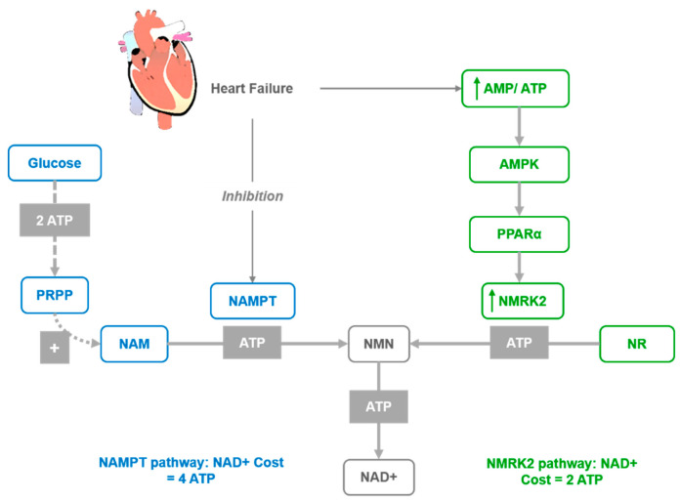
NMRK2経路の活性化は、NAD+レベルが低い不全期の心不全における共通の適応機構である。NMRK2経路を介したNRからのNAD+合成は、NMRK酵素によるNRからのNMN合成は1つのATP分子しか必要としないが、NAMPTによるNAMからの合成は少なくとも3つのATP相当量を必要とするため、NMRK2経路を介したNRからのNAD+合成が有利である可能性がある。
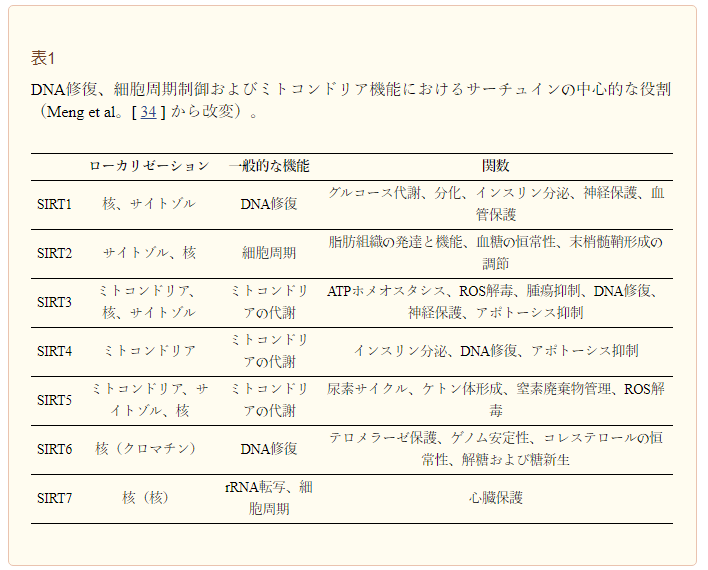
NAD+の重要性は、老化のメディエーターであるNAD+欠乏酵素の活性を通して反映されており、この酵素はDNA損傷、酸化ストレス、炎症などのストレス因子によって誘発されることがほとんどである。主な下流のメディエーターは、サーチュイン、NAD+依存性脱アセチラーゼ/デアシラーゼである。サーチュインは、多様な生物における老化と長寿の保存的調節因子であり、代謝、DNA修復、ストレス応答、クロマチンリモデリング、概日リズムにおける多数の調節機能により、代謝のマスタースイッチと考えられている[22]。表1)[2,23]。
サーチュインとともに、PARPはNAD+を利用してADP-リボース(ADPR)分子の連鎖を生成する。PARP1とPARP2は核内のDNA切断に反応し、DNA修復のプロセスを促進する[23]。DNA損傷が時間の経過とともに蓄積されると、PARPの活性化が増加し、その結果、基質競合およびSirt1のプロモーターに結合し、その発現を抑制するPARP2の能力の両方のために、SIRT1の活性を低下させる[24]。さらに、哺乳類の一次NADaseである
CD38の含有量は、加齢とともに増加する。この酵素は、NAD+を利用してCa2+固定化第二メッセンジャーであるcADP-リボースを産生し、加水分解する[25,26,27]。CD38はまた、NAD+の中間体であるNRおよびNMNを分解することができる[28,29]が、これはNAD+の含有量をさらに減少させる[30]。NAD+含量に対するCD38の効果は、NAD+レベルが高いままのCD38欠損マウスで実証された。これにより、加齢に伴うミトコンドリア呼吸や代謝機能が維持される[31]。さらに、CD38を阻害することでNAD+量が増加し、グルコース代謝や脂質代謝を改善することができる[32]。エクト酵素CD38およびCD157とは別に、SARM1(sterile alpha and Toll/interleukin-1 receptor motif-containing 1)は、傷害後の軸索変性を促進するためにNAD+を利用し、それによって全体の含有量を減少させる追加のNAD+枯渇酵素である[33]。
表1 DNA修復、細胞周期制御、ミトコンドリア機能におけるサーチュインの中心的な役割(Mengら[34]より引用)。
これらのすべてのプロセスにおけるNAD+の巨大な関与は、NAD+前駆体の補充による様々な病態生理学的状態の治療のための有意な可能性を示唆している。しかし、補充のための複数のオプションが存在し、最適な前駆体および用量は、特定の状態に関してはまだ不明である。
NAD+合成のベースライン要件については、食事性トリプトファンまたは毎日20mg未満のナイアシン(NA、NAM)で十分である。しかしながら、NAD+合成の実質的に高いレートでは、多くの有益な、あるいは治療効果さえも示すことを示す証拠が増えてきており、これらはその中間体の補充によって達成され得る。これらの中間体は、肉、卵、乳製品、特定の野菜、全小麦を含む多種多様な食品に含まれている[35,36]。具体的には、NRは、牛乳中に自然に存在し、栄養補助食品として既に入手可能である第3の発見されたNAD+前駆体である。
NRの経口サプリメントは、SIRT活性の増加[10,11]、ミトコンドリア機能の改善[37]、幹細胞の再生能力[38]とともに、複数の組織におけるNAD+レベルを増加させることが示されている。さらに、NRは、他のNAD+前駆体とは対照的に、重篤な副作用またはフラッシングを有することが示唆されていないので、現在、好ましい前駆体とみなされている[14,39]。NR塩化物はGRASステータス(一般的に安全とみなされている)を与えられており、これは薬物のような治療法としての迅速な導入をさらに支持している。しかし、NR技術を治療用に適応させるためには、経口での利用可能性、治療用投与量、および異なる組織での利用を決定する必要がある。さらに、ヒトの消化器官やマイクロバイオーム[40]は、NRの代謝において重要な役割を果たしているが、その詳細な特徴はまだ明らかにされていない。この点に関して、我々は、代謝、神経変性、および心血管障害に対するNRの効果に関するヒトおよび動物研究から得られた利用可能なデータを、他の利用可能なNAD+前駆体に対するNRの利点とともにまとめた。また、最近のデータでは、最近のコロナウイルスパンデミックを引き起こしたSARS-CoV-2による感染症を含め、NRが感染症の治療をサポートできることが示されているため、本レビューでは免疫調節効果についても検討した。バイオアベイラビリティ、安全性、酸化ストレスおよび長寿への影響を含むNRの研究の現状については、本論文で説明する。
2. 検索戦略と論文の選定
オープンアクセスの査読付きジャーナルに掲載された論文を中心にPubMedデータベースを検索した。また、ResearchGate上で公開されている論文の要旨
や論文全体をオープンアクセスではなく、利用可能なものを利用した。論文の選定には公開日を優先したが、査読された論文の多くは過去 10 年から 15 年以内に公開されたものである。より古い論文は、基礎的な発見があると判断した。その他のデータベースについても、ニコチンアミドリボシド(NR)のバイオアベイラビリティ、NRの安全性、NRサプリメント、NRの代謝やインスリンへの影響、神経変性疾患へのNRの影響、長寿へのNRの影響、肝臓の健康へのNRの影響、および類似のキーワードを用いてGoogleで検索した。
3. NRの代謝と加齢に伴う病態生理への影響
3.1. インスリン感受性、肝機能、その他の代謝機能への影響
NAD+はその中間体とともに代謝に不可欠な役割を果たしており、NAD+レベルの上昇は2型糖尿病(2型糖尿病メタボリックシンドローム、非アルコール性脂肪性肝疾患(NAFLD)などの代謝性障害の改善効果を示すことが示唆されている[14,41,42]。さらに、NRは肝NADP+やNADPHと同様にNADHの前駆体としても機能するNAD+中間体の一つである[14]。肝NAD+メタボロームは、糖尿病前(PD)および2型糖尿病マウスモデルの機能と考えられているため、NADP+およびNADPHは、疾患の進行を評価するために使用することができる。すなわち、NADP+とNADPHの両方が酸化ストレスに対する抵抗性に重要であり、NADPHはインスリン抵抗性の主要な寄与者であると考えられている[42]。PDおよび2型糖尿病マウスにおける肝NADP+およびNADPHの有意に減少したレベルは、NRの補充により回復する[41]。マウスモデルでは、NRはNAD+代謝を増加させ、それによって耐糖能を改善し、体重増加を減少させ、糖尿病性神経障害および肝ステアトーシスに対して神経保護効果を示すことができる[41]。同様に、高脂肪誘発性肥満モデルのマウスでは、400mg/kg/日という少量の食事性NRがインスリン感受性を改善し、マウスを体重増加から保護することが示されている[37]。しかし、これらの結果はヒトではまだ再現されておらず、2000mg/日の用量のNRを12週間補充しても、インスリン抵抗性の肥満男性においてインスリン感受性および他の代謝パラメータを改善することはできなかった[43]。インスリン感受性に対するNRの長期的な効果を決定するためには、追加の研究が必要である[43]。一方、マウスモデルでのNR投与により、2型糖尿病の予防やインスリン感受性の維持に重要な因子であるSIRT1の活性が上昇するというエビデンスがある[37,44]。さらに、SIRT1は2型糖尿病マウスの酸化ストレスの影響を抑制し[45]、膵β細胞からのグルコース刺激インスリン分泌を促進し[46,47]、末梢組織のインスリン抵抗性から保護する[48]一方、SIRT1の過剰発現は脂肪酸の酸化を促進し、脂質生成を抑制し、肝臓をステアトーシスから保護する。さらに、サーチュインはNAFLD患者ではダウンレギュレーションされており、これは肝臓のステアトーシスによって特徴づけられる状態である[49]。NAFLDは、2型糖尿病、肥満、インスリン抵抗性と関連していることが判明しているため、メタボリックシンドロームの肝疾患として広く考えられている[50]。SIRT1およびコレステロールのホメオスタシスに関連する追加の因子の活性化を介して、NRは潜在的にコレステロールレベルを低下させ、肝臓の健康を改善する可能性がある [51,52,53,54]。脂肪蓄積もまた、ミトコンドリアのアンフォールドタンパク応答の誘導に関与するメカニズムを介して減少する可能性がある [44]。再生肝臓では、NRは、脂質蓄積を減少させ、肝細胞の複製を促進し、マウスでの肝臓重量の迅速な回復につながる肝ATP含有量を増加させる[55]。さらに、肝細胞癌のマウスモデルでは、生合成障害に起因するNAD+レベルを回復させ、それによってDNA損傷と腫瘍形成の両方を防ぐことができた[56]。以上のことから、NR補給によるNAD+含量の増加は、2型糖尿病やNAFLDを含む代謝機能障害に対する有望な治療戦略と考えられることを示す十分なエビデンスがある。
3.2. 心血管疾患への影響
ミトコンドリア機能不全によるNAD+ホメオスタシスの障害は、心肥大と心不全(HF)の発症の中心であり、圧力過負荷、心筋梗塞、アンジオテンシンII注入を含むいくつかのHFモデルで報告されている[57,58,59,60,61,62]。さらに、HFの発症では、脂肪酸酸化および酸化的リン酸化から他の形態の基質代謝(解糖およびケトン酸化)へのシフトがしばしば起こり[63,64]、一方でNAD+/NADH比も低下する[64]。酸化還元能の変化は、ストレスに対する心臓の感受性をさらに高める。肥大のマウスモデルでも、虚血性HFまたは拡張型心筋症(DCM)のヒト患者でも、NAD+依存性の脱アセチル化が減少することにより、タンパク質のハイパーアセチル化のレベルも上昇する。NR補給は心筋のNAD+/NADH比を正常化し、有害な心臓リモデリングにおいて保護効果を示す一方、長期補給はクエン酸塩およびアセチル-CoA代謝および抗酸化遺伝子発現を刺激することにより、核細胞質タンパク質のアセチル化を増加させる [66]。NAD+ホメオスタシスを改善し、NMRK2を活性化することにより、NRは心機能の低下と有害リモデリングをさらに防ぐことができ、これらのイベントは、HFに至るDCMのマウスモデルでは早期および持続的なイベントである。
心臓損傷のいくつかのモデルでは、NAMPT酵素は抑制されているが[62]、NMRK2の発現は強固にアップレギュレーションされている[66]。ヒトの心筋症モデルでは、同様のシフトが観察されている[66]。このことから、NMRK2経路の活性化は失調心における共通の適応メカニズムであり、一方、NMRK2遺伝子はNAMPT阻害に応答して活性化される可能性があることが提案された。さらに、NAD+合成のためのNAMPTからNMRK2へのシフトは、NMRK酵素によるNRからのNMN合成は1個のATPを必要とするが、NAMPTによるNAMからの合成は3個以上のATP当量を必要とするため、好ましいエネルギー節約メカニズムである可能性がある(図2)。HFマウスではNMRK2経路が活性化されているが、心筋のNAD+レベルは低下しており、これはNAD+前駆体の循環および組織レベルが、通常のげっ歯類の食事で心臓のNAD+合成を維持するには不十分であることを示唆している。このことは、この状態を改善するためのNR補給への関心を支持する。さらに、心臓機能が維持され、心臓リモデリングが制限され、心臓内のNAD+レベルが維持されることと関連しているHFのマウスモデルにおいて、NRの強力な有益な効果が発見された。このことから、DCMにおける心機能の維持とリモデリングの抑制には、NRの経口投与が有効であることが示唆された。
NAD+前駆体の補給はまた、SIRT(表2)を活性化し、Ca2+ホメオスタシスを維持するという追加のメカニズムによって、心臓のリモデリングを防御する可能性を持っている[67]。すなわち、SIRT1の生体内試験での活性化は、心臓肥大のマウスモデルにおいて、心臓肥大、代謝異常、および心臓の炎症から保護し、心臓機能障害の他のモデルにおいても保護効果を示す[68,69,70,71]。さらに、SIRT2とSIRT6は著名な心保護SIRTとして浮上してきており[72,73]、SIRT2の欠損は高齢マウスやアンジオテンシンIIでストレスを受けたマウスの心肥大を増強させ[73]、一方でSIRT6の欠損は心肥大とHFの発症をもたらした[74]。ミトコンドリアSIRTの活性は、心機能の維持に必要とされると考えられるSIRT3を含め、心臓のリモデリングとHFの発症に関与している[75]。データはさらに、NRがミトコンドリアで好ましいNAD+前駆体であることを示唆している[76]が、生体内試験でのNRの効果はミトコンドリアのサーチュイン活性に依存していると解釈されている[37,77]。しかし、核細胞質標的の重要性を排除すべきではない[1,78]。心血管機能および健康の2つの臨床的に重要なリスク指標である収縮期血圧(SBP)および大動脈硬化のNR誘発性低下[39]は、核内および細胞質のSIRT1活性化により生じる可能性がある(表1)。すなわち、NAD+は脱アセチル化酵素SIRT1の義務的基質であり、健康な血管機能の維持に関与している[81,82,83]。数多くの生理学的反応におけるNAD+の関与はまだ完全には理解されていないが、マウスモデルにおける健康上の利点が文書化されていることから、心血管疾患、特にHFおよび心肥大に対するNRの治療への応用への関心が高まっていることが証明されている。
表2 ノックアウトマウスおよびトランスジェニックマウスの実験から得られた心不全発生におけるサーチュインの役割(Pillai er al)

3.3. 神経変性疾患への影響
神経変性疾患は、加齢とともに蓄積するDNA損傷と酸化ストレスと関連しており[85]、ミトコンドリア機能の低下につながる[86]。また、NAD+の枯渇は、ヒトを含む複数の動物で加齢に伴って観察され、アルツハイマー病の主要な危険因子と考えられている[87]。
ADマウスモデルに投与すると、NRはNAD+レベルを増加させることにより、酸化ストレスとDNA修復の両方に有益な効果を示する[88]。さらに、NRは、pTau、アミロイドβ、神経新生、神経炎症、海馬のシナプス可塑性、および認知を含むアルツハイマー病神経病理学の他の側面を改善することができる[89,90]。具体的には、NR治療は、アミロイドβレベルといくつかの炎症マーカー(NLRP3,CASP1,IL-1,TNF-α、およびIL-6)を減少させることにより、高脂肪食(高脂肪食)を摂取したマウスの全脳における神経炎症とアミロイド新生を減少させる[91]。
脳の炎症は認知障害と密接に関連しているため[92,93,94]、認知機能と認識記憶はNR治療によってわずか6週間で減衰する可能性がある[91]。さらに、アルツハイマー病のもう一つの特徴であるPARylation(ポリADPリボシル化)の増加は、NRの補充によりADマウスで減少させることができた[90]。PARylationの増加は、コッケイン症候群、色素性乾皮症、失調性斜角結節症など、DNA修復障害を伴う他のいくつかの神経変性疾患でも検出されている。それにもかかわらず、PARPを介したNAD+枯渇がこれらの疾患の発症に大きな役割を果たしていることが最近確認された。根底にあるDNA修復欠損にもかかわらず、NRはマウスモデルではこれらの病態のそれぞれの表現型を劇的に改善し、失調マウスでは生存期間を3倍以上延長させることができた [95,96]。
急性脳損傷やアルツハイマー病やパーキンソン病などの慢性神経変性疾患で起こるもう一つの初期イベントは、軸索変性である[97,98,99,100]。このような場合、軸索変性は、中枢神経系に影響を及ぼすほとんどの神経変性疾患に関与するもう一つの特徴である興奮毒性によって引き起こされる。興味深いことに、神経細胞におけるNAD+の強力な枯渇は、興奮毒性の間に明らかにされている[101,102,103,104]が、NRを注射したマウスは興奮毒性誘発性の軸索変性から保護されていた[105]。NAD+を含む3つの試験済みNAD+前駆体(NA、NAM、NR)のうち、軸索内の局所的なNR代謝を変化させることで軸索変性を防ぐことができたのはNRのみであった [105,106]。すなわち、NRはNMRk2-KOマウスの神経細胞において、NMRk1を誘導することで核凝縮と軸索変性を抑制した[105]。この神経保護効果は、ミトコンドリアと軸索の両方のNAD+量に依存している[78]。
現在のところ、神経保護の2つの可能なメカニズムが提案されている:
- SIRT3をサポートするためにミトコンドリアのNAD+を増加させること[77]
- 損傷誘発性SARM1活性化を供給するために軸索のNAD+を維持すること[107]。
SIRT3活性化を介して、NRによるNAD+レベルの増加は、さらなる有益な治療効果をもたらす可能性がある。具体的には、NRは、SIRT3依存性のメカニズムを介して、内耳の毛髪細胞からのノイズ誘発性難聴および神経細胞の退縮を防ぐことが示されている[77]。さらに、SIRT3 と 5 は共に網膜光受容体の健康に重要である [108]。SIRT3活性は、加齢に伴う機能障害、糖尿病性網膜症、マウスの光誘発性変性など、網膜変性を伴う複数の障害で検出されているNAD+含有量の減少に敏感である[108]。このことは、光受容体の変性を含む様々な障害に対するNRによる治療の可能性を示唆している。
さらに、NAD+レベルの一般的な減少は、多くの場合、進行性の骨格筋の脱力および変性につながる遺伝的変異によって引き起こされる神経筋疾患で観察されている[38]。NRによるNAD+含有量の増加は、エネルギー産生を刺激し、ミトコンドリア機能を改善することができる。NRの補給は、根本的な遺伝的欠陥を修正することはできなかったが、それは2つの異なるミトコンドリアミオパチー[109,110]におけるミトコンドリアの豊富さと機能を改善することができた。さらに、NRは、Namptを欠損したマウスの骨格筋の進行性消耗症候群を、わずか1週間の治療で持久力を回復させながら逆転させることができた [111]。したがって、NRは、高脂肪食を与えられたマウスで増加した持久力と改善された耐寒性を与えることが判明した。しかし、NRが除脂肪した健康な筋肉に有意な効果があるかどうかは、通常の給餌マウスでは有意ではないが持久力の増加傾向が観察されたので、あまり明らかではない[37]。
興味深いことに、NAD+レベルとNampt発現の低下は、組織学的にも転写学的にも進行性消耗性症候群と類似した状態であるデュシェンヌ型筋ジストロフィー(DMD)でも観察された [112,113]。DMDはまた、PARP活性の亢進、線維化、および筋変性によって特徴づけられる。NRは、DMDのmdxマウスモデルにおいて、筋機能と心臓病理を改善し、PARylation、炎症、および線維化を減少させることが明らかになった[112]。さらに、NR治療は、幹細胞機能を改善し、それにより、DMDモデルマウスの筋消耗表現型を改善することが示されており、ヒトの状態にNRを使用することを支持している[38,112]。幹細胞機能の改善はNR治療中の一般的な現象であり、マウスの寿命がわずかではあるが有意に延長することが示唆されている [38]。以上のことから、筋力の改善、老化した筋幹細胞の若返り、炎症や線維化のレベルの低下によって、NRは筋ジストロフィーや変性症の進行を管理するのに有効であることが示唆されている。
3.4. 長寿への効果
カロリー制限(CR)は、Sir2とNAD+の調節を介した野生型酵母細胞の寿命延長が最初に報告されて以来、真核生物の寿命延長に最も効果的なアプローチと考えられている[114]。CRの延命効果は部分的にはサーチュイン機能の増加を介して媒介されている可能性があり、一方、サーチュイン活性のためのNAD+の必要性は、老化と代謝との間に関連がある可能性を示唆している。しかし、Sir2活性を増加させ、長寿を促進するための栄養学的アプローチは、酵母における遺伝子の過剰発現を操作することによって達成されている[115]が、NAは寿命の延長に失敗し、NAMは寿命を短縮させた[116,117]。一方、NRはCRと同様にNAD+レベルとSir2機能を増加させることができ、外因性NRはSir2依存性の組換え抑制を促進し、遺伝子サイレンシングを改善し、カロリー制限なしで寿命を延ばすことができる[11]。さらに、NRの作用機序は、Nrk1とUrh1/Pnp1/4経路を介した純NAD+合成の増加に完全に依存している。後者はNrk1に依存せず、新たに発見されたNRサルベージ経路を代表するものである[11]。さらに、マウスモデルを用いた研究では、1日の断食が肝臓でNAD+を増加させるのに対し、CRは脳でNAD+を上昇させ、NAMを減少させることが報告されている[118]。このことは、NAD+のレベルの上昇がCRのいくつかの有益な効果を媒介しているように見え、NR補給の延命効果を支持していることを示唆している。これらの効果は、代謝の改善と老化の特徴である慢性炎症の減少を介して媒介されている[35]。前臨床研究では、NRは損傷を受けた筋肉におけるマクロファージの浸潤を減少させ[38,112]、脂肪肝疾患のモデルにおいて血漿中TNF-αを減衰させることが報告されている[44]。それにもかかわらず、最近の臨床研究では、高齢のヒト被験者の筋肉組織におけるNRの利用可能性とその抗炎症効果が確認されている[120]。すなわち、21日間のNRの補給により、多数の循環炎症性サイトカイン [120] が減少したことから、NRが潜在的に老化過程を調節し、それによって延命効果を示すことができるさらなるメカニズムが示唆された。NRがこれらの効果を発揮する正確なメカニズムは不明のままであるが、記載されている明らかな健康上の利点は、長寿に対するNRの肯定的な効果を示している。
4. 感染症治療と免疫調節効果
NAD+中間体は、いくつかの病原体に感染している間、その有益な健康効果が認められている。結核菌(Mycobacterium tuberculosis)に感染した患者においてNAMの抗菌効果が確認されており[121,122]、黄色ブドウ球菌(Staphylococcus aureus, MRSAを含む)や肺炎球菌(Klebsiella pneumoniae緑膿菌(Pseudomonas aeruginosa)などの他の主要なヒト病原体においても免疫介在性除菌効果が報告されている[123]。さらに、NAMおよびその類似体は、HIV患者[121]およびB型肝炎患者[124]において抗ウイルス効果を示した。現在、効率的な治療薬または予防薬を欠いており、公衆衛生のための世界的な懸念を表しているCOVID-19感染症と闘うために、NAD+中間体を用いた潜在的な治療法が最近認識されている。
SARS-CoV-2感染は不適応免疫応答を誘発する。特に肺組織における「サイトカインストーム」につながる過剰な炎症性反応、およびCD4+およびCD8+ T細胞の大幅な減少を伴うリンパ球減少症 [125]。分子レベルでは、感染と戦うために自然免疫応答が活性化すると、PARPsの活性化は、標的SARS-CoV-2タンパク質の広範なDNA損傷およびIFN誘発MARylation(モノ-ADP-リボシル化)のために増加する[126,127]。PARPs応答は、ウイルス複製の阻害に必要である[128]が、この抗ウイルス効果は、ウイルス非構造タンパク質のADP-リボシルヒドロラーゼマクロドメイン、nsp3によって反転され、その活性はウイルス性に必要である[126,127,129]。さらに、SARS-CoVのnsp10は、ミトコンドリア電子輸送鎖の複合体IのNADH部位で電子輸送を阻害することが明らかになった[130]ことから、ウイルス感染に対する自然免疫応答の鍵となるイベントが感染細胞のNAD+メタボローム内で起こっていることが示唆された[131]。最近の研究では、コロナウイルス感染によるPARPsの発現とNAD+メタボロームの異常を調べた。フェレットのSARS-CoV-2感染細胞株と死亡した患者の肺を調べたところ、NAD+の合成と利用に関するNAD+代謝と遺伝子発現が障害されていた[131]。さらに、NMRK1経路の発現は、濃縮型ヌクレオシドトランスポーターCNT3の発現とともにアップレギュレーションされており、感染中にNRのNAD+およびNADP+への変換能力が高くなることが示唆された[10]。NMRK遺伝子のアップレギュレーションは、以前にNRの治療効果と関連していた [66,105]。また、NAMメチル化の低下によりNNMT(ニコチンアミドN-メチルトランスフェラーゼ)の発現が低下しており[131]、NAMサルベージ経路の促進[132]と、NAD+を補充するためのNR治療の効率の向上を示唆している[131]。これらのデータは、NAMおよびNRキナーゼ経路を介したNAD+含量のブーストが、SARS-CoV-2に対する自然免疫をサポートするための抗ウイルスPARPs機能を回復させる可能性を示唆している[131]。
適応免疫応答が活性化されると、CD4+およびCD8+リンパ球におけるCD38の過剰発現は、NAD+枯渇をさらに増大させ[133,134]、炎症性サイトカイン、活性酸素種、およびマクロファージ浸潤の産生および放出の増加につながる[135,136]。さらに、NAD+の急激な枯渇は、細胞死と生存率の調節因子であるサーチュインの機能を損なう [133]。具体的には、SIRT1は、腫瘍抑制因子、サイトカイン、原腫瘍遺伝子などの遺伝子の発現を調節し、最終的には炎症、細胞生存、およびアポトーシスのメカニズムを調節する [137]。サーチュイン機能の損失は、酸化的損傷の増加と全体的なエネルギーの減少とともに最終的に細胞死に至る。NAD+体含有量の補充は、エネルギーレベルと障害されたサーチュイン機能を回復させ、おそらくSARS-CoV-2感染に対する不適応な免疫応答のバランスを取り戻す可能性がある。すなわち、SARS-CoVおよびSARS-CoV-2はともに不適応性の高炎症を誘発し、肺への白血球浸潤が増加し、その結果、広範な組織損傷およびそれに続く肺活量の低下を伴う臓器不全を引き起こす [138,139,140]。新たな証拠は、NAD+が炎症の初期段階で放出され、生体内で免疫調節的な役割を果たすことを実証している[141,142]。さらに、ナイアシンは、ある前臨床研究において、IL-1,IL-6,およびTNF-αを含む前炎症性サイトカインを減少させる強力な薬剤として、抗炎症療法として以前に示唆された[143]。NRは同様にIL-2,IL-5,IL-6,およびTNF-αを減少させることができる [120]。IL-6を標的とすることは、最近、特に重度のCOVID-19患者において、炎症性ストームをブロックする有望な治療法として提案されている[132]。さらに、ナイアシンは好中球浸潤を減少させ、人工呼吸器誘発性肺損傷時には長期の抗炎症効果を示す可能性がある。しかし、ナイアシンは好中球浸潤の低下にかかわらず低酸素血症を悪化させることから、好中球の低下とは別の低酸素血症の原因が示唆された[144,145]が、今後の検討が必要である。さらに、ビタミンB3(ナイアシンまたはニコチンアミド)の肺組織障害予防効果の高さは、ブレオマイシンやLPSによる肺障害のモデル動物において確認されている[146,147,148]。ビタミンB3の強力な肺保護効果を考慮すると、COVID-19に対する早期治療支援剤として提案されている[146]。このことは、NRが高炎症を減少させ、損傷を受けた肺組織を再生するための潜在的な治療または支援剤として考慮されるべきであることを示唆している。
5. バイオアベイラビリティおよび安全性
NR のバイオアベイラビリティは、標的組織の細胞または血液中の NAD+ レベルまたはニコチン酸アデニンジヌクレオチド(NAAD)などの他の関連するバイオマーカーを測定することによってテストすることができる。肝臓、骨格筋、および褐色脂肪組織を含む多種多様な哺乳類細胞株における多数の観察を通して、NRはNAD+レベルを増強することが文書化された[37]。逆に、脳や白色脂肪組織ではNAD+レベルは有意に上昇しなかった[37]。観察された違いは、特定の組織におけるNMRKの発現の違いに起因していることが示唆された。Nmrk1がユビキタスに発現しているのに対し、Nmrk2は主に心筋と骨格筋で発現しているが、肝臓と褐色脂肪組織でも検出可能であり、これらの組織がNRに反応する能力が高いことを説明しているのかもしれない。一方、NRは血中では非常に不安定であり、測定や検出が困難である。このような不安定性にもかかわらず、信頼性の高い採取・処理・測定法が開発されたことにより、経口投与されたNRの薬物動態プロファイルを決定することが可能となった。健康なヒトボランティアとマウスの両方で実施された研究では、1000mgを1日2回(合計で2000mg)のNR投与により、NAD+の定常状態の全血中濃度が有意に上昇し(1回の投与で最大2.7倍)[149]、NAD+代謝を効果的に刺激できることが報告されている[39,149,150]。この研究はまた、NAD+レベルに対する測定可能な生物学的効果が、重篤な副作用なしに慢性的な経口NR補給によって達成できることを確認した[39,150]。具体的には、潮紅、そう痒症、高血糖、高尿酸血症、または肝臓または筋肉の酵素活性の上昇などの重篤な副作用は報告されていない[149,150,151,152]。しかし、血中NAD+反応はNRの吸収パターンと相関しているようには見えず、NAD+増加のピークは9日後に達していた[150]。さらに、いくつかの被験者で観察されたNRの排泄半減期が比較的短いことから、NRの体内濃度の大きな変動を防ぐためには反復投与が必要であることが示唆されたが、NAD+の血中濃度が継続的であることから、所望の臨床的転帰を達成するためには、NRを1日2回または1日1回の投与で十分である可能性が示唆された[150]。
一方、1000mgのNRの見かけの経口バイオアベイラビリティーは個人間で非常にばらつきがあった [150]。いくつかの研究[150,153]で観察された血液サンプル中のNRの不安定性は、観察された変動性を完全に説明することはできないが、1つの要因である可能性がある。もう一つ提案されている説明は、NRがヒトの腸管粘膜で低い受動的透過性を示すと予想されるため、NRの親水性[15]であった。さらに、腸管系におけるNRの輸送機構の個人差は、NRの経口吸収にも影響を及ぼす可能性がある。さらに、NR は腸内で NAM に分解されることが提案されているが、別の研究では、NR は肝臓で NAM に代謝されることが示されており、他の組織でのバイオアベイラビリティの低さを説明している可能性がある[154]。その後、NAMは吸収されてNMNに変換され、さらにNAD+に代謝されるか、またはNRに脱リン酸化される。この場合、腸内でのNRのNAMへの分解は、おそらく哺乳類および細菌細胞におけるプリンヌクレオシドホスホリラーゼが関与していると考えられ、NRの経口摂取に関与する可変ステップである可能性がある[155]。さらに、NRのNAD+への変換のための複数の経路が、雄性ヒト被験者およびC57Bl6/Jマウスを用いた研究で同定された[149]。興味深いことに、NRへの反応として、NAADの顕著な増加(45倍)が報告された[149]。これらの研究は、NRの代謝と輸送のさらなる調査により、経口バイオアベイラビリティの変動の原因が明らかになる可能性があることを示唆している。
6. 他のNAD+前駆体と比較した利点
現在、NRは他の前駆体に比べてバイオアベイラビリティー、安全性、およびNAD+含量を上昇させる強力な能力のため、有力な候補として浮上している[149]。多様なNAD+前駆体の中で、NMNとNRはより優れた薬物動態学的および薬理学的特性を示した[156]。NAD+前駆体(NMN、NR、NAM、NA)間のバイオアベイラビリティは、前臨床研究で細胞内NAD+を上昇させる能力として評価された。NRはマウスの肝臓でNAD+レベルを上昇させることができ、NAMよりも高い経口バイオアベイラビリティーを示し、その結果、NAよりも経口バイオアベイラビリティーが高かった[149]。さらに、動物実験では、等モル経口投与されたNRは、肝臓のNAD+含量を上昇させる点でNAおよびNAMよりも優れていることが報告されている[149]。同様に、筋肉中のNAD+含量は、NRとNAでは有意に増加したが、NMNでは増加しなかった[149]。
3つの前駆体(NA、NMN、およびNR)は、ADPRの蓄積、サーチュイン活性の測定値、および他のNAD+消費活性を促進する程度が異なっていた[149]。すなわち、NRはNAMよりも3倍以上ADPRを増加させることが明らかになり、これはNRが肝臓でNAD+およびNAD+消費活性を増加させるための好ましいNAD+前駆体として支持されていることを示している[149]。さらに、NRによるNAD+レベルの上昇後、サーチュインの活性が刺激された[37]。SIRT1とSIRT3の両方の活性が試験管内試験と生体内試験で増加した[37]ことから、NRは少なくともミトコンドリアと核のコンパートメントでNAD+レベルを増加させることができるという仮説を支持するものである。異なる細胞内コンパートメントでNAD+を増加させるNRの能力は、細胞内NAD+レベルを増加させる他のアプローチと比較して決定的な違いを表している。3つの前駆体、NA、NAM、およびNRはすべてNAD+およびNADP+レベルの両方を上昇させることができるが [14,149,157]、それらはすべて異なる生理学的応答を示す。例えば、NAは血中脂質レベルを低下させる効果を示し、脂質異常症の治療に使用される[151]。しかし、NAMは50mg/日を超える用量ではフラッシングに関与している[151]。これに対して、NAMは脂質血中濃度には影響しないが、より高い用量でサーチュイン阻害作用を示すことがある[116,149]。前述の3つの前駆体のうち、NRのみが生存期間を延長し、放射線照射したマウスを用いた研究で文書化されているように、造血幹細胞の再生を誘導することができた[158]。さらに、NRの経口投与は、化学療法による神経障害に対する抵抗性を改善し、神経障害を逆転させることが明らかになった[159]。このことは、化学療法または放射線療法を受けている癌患者への潜在的な使用のためのNR前駆体の利点を示唆している。NAD+前駆体のバイオアベイラビリティは、NAADレベルを測定することによって評価することができる。すなわち、NAADは、補充前には血中で検出されず、NAD+前駆体を経口投与した後、そのレベルの増加が肝臓で観察されているので、効果的なNAD+補充の最も感度の高いバイオマーカーを表している。NRはベースラインと比較してNAADを少なくとも45倍に増加させることが判明した[149]。さらに、NRは、定常状態のNAD+の増加がない場合にNAD+の増加が起こるNAAD心臓含量を有意に上昇させることができた[149]。驚くべきことに、NAAD中間体を介してNAD+に変換されると予想される唯一の前駆体であるNAは、最も少ないNAADを産生したが、NAMとNRは両方とも肝内NAADのピークを産生した[149]。
NRの高可用性は、通常のヒトの食事で観察されている。NRは細胞内に入るために変換を必要としないため、高レベルの利用可能性を部分的に説明することができる。逆に、NAD+とその前駆体は、細胞に入る前にNRまたはNAMに変換されなければならない[153]。NAD+およびNMNはCD73[28]によって細胞外でNRに変換されているが、それらの細胞内変換はNMRK経路に依存する[153,160]。しかし、Slc12a8遺伝子によってコードされる腸内のNMN特異的なトランスポーターが最近Grozioらによって同定された[161]。したがって、NRおよび細胞外NAD+の利用は、NMRK経路の活性によって制限される[153]。逆に、最近、NMRKに依存しない経路を介してNAD+レベルを増加させることができる別の候補が出現した。すなわち、ある研究では、NR 還元型(NRH)がマウスで生物学的に利用可能であることが報告され、治療への応用の可能性を示唆している[162]。NRは、部分的にNAMに分解されることにより血中循環が不安定であるため[153]、経口投与後に末梢組織に到達する能力が損なわれている[162]。NRHはNRよりも安定で、血漿中で直接分解されないようであるため、この制限はNRHの投与によって克服される可能性がある[162]。NRHは経口摂取または腹腔内注射後の循環中で検出可能であり、培養細胞(ベースラインの5~10倍)[162,163]とマウスの両方において、NRよりも強力かつ迅速な方法でNAD+を増加させることが明らかになった。これは、アデノシンキナーゼ(アルツハイマー病K)がNRHキナーゼとして作用するNMNH中間体を介したNRHからのNAD+の新規生合成経路の最近の発見と一致している[164]。この研究はまた、マウスモデルの肝臓に内因性のNRHが存在することを確認し、NRHがNAD+の有効な天然前駆体であることを立証した。
一方、副作用に関しては、NRの方がより適切なNAD+前駆体である可能性がある。NAとNAMはNAD+サルベージ経路に入ることができるが、いくつかの前臨床研究では、NAとNAMの両方が治療用量で痛みを伴う潮紅感覚やその他の毒性作用を引き起こすことが確認されている[14,165,166]。NMNは前臨床研究において有意な有益な薬理学的活性を示しているが、十分な臨床データおよび毒性学的データはまだ不足している。最近、健康な男性10名を対象とした臨床試験では、100~500mgの単回経口投与で安全かつ有効であり、有意な副作用はないことが確認されているが、現在のところ、NMNの安全性とヒトへの経口投与可能性については、利用可能な試験はない[167]。一方、NRは多くの研究で1日2gまでの忍容性が確認されており、潮紅や重篤な副作用との関連は認められていない[39]。具体的には、NRの投与は、ニコチン酸誘発性フラッシングを媒介するGPR109Aを活性化することなく、哺乳類の細胞および組織におけるNAD+レベルを上昇させることができる[168]。
7. NRの誘導体とサプリメント
生理的平衡状態の間、生合成経路はトリプトファン(Trp)の食事源に依存し、NAD+前駆体ビタミンはNAD+枯渇の期間中に補っている。しかし、食事性前駆体は、病理学的状態でNAD+レベルを維持するために不十分になる可能性がある[14,41,169]、それによってNAD+前駆体の補充の必要性を強調している。よく知られたビタミンB3サプリメント(NAおよびNAM)のほかに、NRおよびそのリン酸化形態(NMN)は、NAD+の前駆体として最近になって経口的に利用できるようになったばかりである[11,150,170,171]。一方で、NRの合成と操作は、特にその比較的脆弱なグリコシド結合とNR塩の不安定性に関して、依然として困難なままである[172]。しかし、分子のバックボーン上に様々な化学基を導入することで、新規薬物の開発や既存薬物の構造的アナログの開発に大きな可能性がある[172]。一般に、ニコチンアミドリボシド塩(NR+X-)の合成経路には2つのカテゴリーが報告されている。NR+のβ形のみが生化学的および医学的関連性を有するので、NR+合成の貴重な方法は、高レベルのβ立体選択性を提供する必要がある。NR の 2 つの主要な合成経路のうち、合成効率、立体選択性、および全体的な収率の点から、1 つだけが優勢に利用され、開発されている [172]。この方法は、NAMまたはその類似体または誘導体とペラシル化された(ハロ)-d-リボフラノ ースとの反応を具体化したもので、アシル化された中間体が得られ、その後、所望のNR+X-に変換される [173,174]。合成グリコシル化条件は、糖成分の性質に依存する[172]。完全にアシル化されたリボフラノースは、グリコシル化試薬として活性化する必要があるフリーデル-クラフツ触媒の使用を必要とするので、これらの条件は、1-ハロ-2,3,5-トリ-O-アシル-または1,2,3,5-テトラ-O-アシル-d-リボフラノースが使用されるかどうかによって異なる[172]。
さらに、NR塩のX線構造はすでに決定されている。NR誘導体であるニコチンアミド-β-d-リボシドクロライド、ニコチンアミド-β-d-リボシドブロミド、チオニコチンアミド-β-d-リボシドブロミド、ニコチンアミド-β-d-リボシドトリアセテートブロミド、チオニコチンアミド-β-d-リボシドトリアセテートブロミドは、蒸気拡散法により結晶化に成功した[175]。さらに、ニコチンアミド-β-d-リボースクロリドの結晶形態は、より良い精製の可能性を考慮すると、非晶質形態に比べて有利な性質を持つことがわかった[176]。しかし、ニコチノイル部位上のリボシル化形態の化学的汎用性と反応性のより良い理解に沿って、NRの化学合成のさらなる発展は、NR+X-塩のより信頼性の高い、よりスケーラブルで、より再現性の高い調製を提供するであろう[172]。さらに、5′-ヒドロキシ位置でのNR+のリボシド残基の効果的な修飾は、より高い収率、より良い回収、および改善された精製戦略を確実にすることができるであろう[172]。これは、同位体標識されたNR+アナログおよび誘導体の原子効率の良い合成に加えて、新しい薬剤学的に許容される形態および潜在的に治療上有用なNR+の形態の改善された調製を可能にするであろう[172]。
研究やサプリメントでのNRの使用に対する高い需要については、過去数年の間に、NR製造のための新しく信頼性の高い合成方法が開発されてきた[177]ため、細胞ベースの研究や動物の摂食実験でより多くの量を利用できるようになった[37,88]。NRは、2013年7月に結晶性塩化物塩の形でサプリメントとして利用できるようになり、ブランド名はNIAGEN(クロマデックス社、アーバイン、カリフォルニア州、米国)である。90日間の毒性ラット試験では、NR塩化物の結晶形態が試験され、最も低い観察有害影響レベル(LOAEL)は1000mg/kg/日であったのに対し、観察されなかった有害影響レベル(NOAEL)は300mg/kg/日であった[178]。NRは6つの臨床試験 [39,43,149,150,179,180]でも試験されており、短期(8日間)[150]および長期(6週間)[39,179]使用の安全性が確認され、経口での使用が可能であることが確認されている[149]。さらに、過体重および健康な成人を対象に試験されたNRの3つの異なる用量(最大1g)を用いた8週間の無作為化プラセボ対照試験では、NR塩化物は安全で経口的に入手可能であることが報告されている[178]。
8. 結論
前臨床研究におけるNRの多数の有益な健康効果に関する驚くべき発見は、最終的に画期的なものとなり、多数の代謝性疾患や神経変性疾患の治療を可能にする可能性がある。現在、NRの効果は、多様な心血管疾患、神経および認知機能、代謝障害、筋肉および腎臓の損傷、老化、化学療法などの研究を含む、かなりの数の臨床試験[181]で研究されている。さらに、NRの輸送および代謝経路に関する基礎研究は、有効な治療的使用への迅速な転換をさらにサポートする。
安全性と効率性を含む代替NAD+前駆体よりもNRを使用する利点は、近い将来、一般的なサプリメントとしてナイアシンに取って代わられる可能性を示唆している。しかしながら、栄養補助食品としてのNRの使用は、低収率、高価または危険な試薬の使用、および他の手段によって毒性または生物学的に耐えられない可能性のある製薬学的に許容できない種を含む、その製造方法に関してまだ一定の制限を有している。特許数の増加に伴い、これらの制限は、NRおよびその誘導体の化学合成のための新規または改良された方法の開発によって克服されつつある。これにより、より高い純度と立体選択性を有する堅牢で費用対効果の高い製造が可能になる。また、NRに関する広範な研究は、現在効率的な治療法を欠いている病態生理学的状態のために最も重要な、サプリメントの使用と新しい治療戦略におけるNRの世界的な利用可能性につながる可能性がある。
